一种多糖纳米剂型的制备方法和应用
1.本发明属于食品与医药领域,具体涉及一种多糖纳米剂型的制备方法和应用。
技术背景
2.多糖作为构成生命体的基本物质之一,广泛存在于各种生物中,其具有经济、安全、副作用少、生物活性广泛等优点,目前被广泛应用于医药及功能食品领域。红乳牛肝菌作为一种食用真菌,具有良好的抗氧化、抗炎活性。红乳牛肝菌多糖(sbp)表现出良好的抗炎、辐射防护活性。红菇是一种药食同源真菌,红菇多糖(rvp)具有抗氧化、抗炎、降血糖等活性。黑松露作为一种名贵的药食同源型真菌,具有多种广泛的药理活性。黑松露多糖(tp)作为黑松露子实体富含的主要活性物质之一,表现出优异的抗氧化、抗炎、免疫调节等生物活性。相比于一些中草药来源的生物多糖,tp还具有毒副作用小、生物安全性好等优点。但是以上多糖分子量庞大,可达数万甚至百万da。巨大的分子量、松散的分子结构导致其难以透过细胞屏障被机体吸收利用,使其生物利用度较低,阻碍其在生物与医药领域的高效应用。
技术实现要素:
3.本发明为了解决tp、sbp、rvp的生物利用度低、体内生物活性差的问题,提供一种多糖纳米剂型的制备方法和应用。
4.为实现上述目的,本发明采取的技术方案如下:
5.一种多糖纳米剂型的制备方法,包括以下步骤:
6.步骤一、将多糖溶于去离子水中得到溶液a;
7.步骤二、在搅拌的条件下将无水乙醇逐滴加到溶液a中,继续搅拌,得到悬浮液b;
8.步骤三、将悬浮液b离心分离,沉淀物即为多糖纳米剂型;所述多糖为黑松露多糖、红乳牛肝菌多糖或红菇多糖。
9.进一步的,步骤一中,多糖与去离子水的质量体积比为10-20mg/ml。
10.进一步的,步骤二中,溶液a与无水乙醇的体积比为1:5-1:20。
11.进一步的,步骤三中,沉淀物使用无水乙醇洗涤。
12.进一步的,步骤一中,多糖的制备方法包括以下步骤:
13.步骤1、以脱脂的黑松露粉末、红乳牛肝菌粉末或红菇粉末为原料,超纯水为溶剂,混合均匀后进行水浴提取,提取温度为90℃,提取时间为2h,得到提取液c;
14.步骤2、将提取液c经过离心分离得到上清液,上清液经过抽滤、浓缩得到浓缩液d;
15.步骤3、向浓缩液d中加入体积分数为95%的乙醇,于4℃环境下静置12h醇沉,随后离心分离,获得沉淀物,沉淀物加水复溶后经过7000da透析袋透析36h,将透析后的溶液真空冷冻干燥,相应的获得黑松露多糖、红乳牛肝菌多糖或红菇多糖。
16.进一步的,步骤1中,原料与溶剂的料液比为1:30g/ml。
17.进一步的,步骤3中,浓缩液d与体积分数为95%的乙醇的体积比为1:4。
18.进一步的,步骤1中,脱脂的步骤为:将粉碎的黑松露粉末、红乳牛肝菌粉末或红菇粉末用体积分数为95%的乙醇浸泡,抽滤后舍弃滤液,将滤渣烘干,相应的得到脱脂后的黑松露粉末、红乳牛肝菌粉末或红菇粉末,其中,粉碎的黑松露粉末、红乳牛肝菌粉末或红菇粉末与体积分数为95%的乙醇的料液比为1:30g/ml。
19.一种所述的多糖纳米剂型的应用,所述多糖纳米剂型应用在辐射防护食品中。相比于现有技术,本发明具有如下优点:
20.有益效果:本发明与现有技术相比具有如下优势:
21.1、本发明制备的tp纳米剂型tp-nps、sbp纳米剂型sbp-nps、rvp纳米剂型rvp-nps主要依靠分子间氢键等非共价作用力结合,不涉及化学改建,产物可控、绿色、安全。
22.2、本发明制备的tp纳米剂型tp-nps、sbp纳米剂型sbp-nps、rvp纳米剂型rvp-nps具有较小的尺寸、均匀的球状形貌,同时其具有较强的ph稳定性、温度稳定性及离子强度稳定性。
23.3、本发明制备的tp纳米剂型tp-nps、sbp纳米剂型sbp-nps、rvp纳米剂型rvp-nps可以显著提升其对正常肝细胞aml-12的辐射防护能力以及对巨噬细胞raw 264.7的促增殖能力。
附图说明
24.图1中,a、b、c、d分别为tp及不同条件下制备的tp-nps(np-1、np-2、np-3)的sem微观形貌图;
25.图2中,a为tp及tp-nps(np-1、np-2、np-3)的ft-ir图谱;b为tp及tp-nps(np-1、np-2、np-3)的xrd图谱;
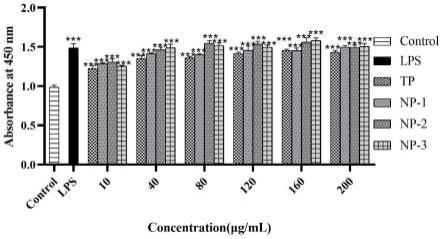
26.图3为tp及tp-nps(np-1、np-2、np-3)对raw 264.7细胞增殖能力的影响效果图,其中脂多糖(lps)作为阳性对照;
27.图4中,a、b分别为tp及tp-nps(np-1、np-2、np-3)对aml-12细胞的安全性和辐射防护能力效果图,nc代表空白对照组,ir代表辐照模型组;
28.图5为tp及tp纳米颗粒np-3对蛋白质的吸附能力效果图;
29.图6中,a、b、c分别为np-3的ph、温度、离子强度稳定性效果图。
具体实施方式
30.下面结合实施例对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。下述实施例中所使用的实验方法若无特殊说明,均为常规方法。
31.具体实施方式一
32.本发明提供一种多糖纳米剂型的制备方法,用以解决黑松露多糖(tp)、红乳牛肝菌多糖(sbp)、红菇多糖(rvp)的生物利用度低、体内生物活性差的问题,该方法制备的多糖纳米剂型主要依靠tp、sbp、rvp中各自的分子间氢键结合,依靠非共价作用力组装而成。该方法制备的纳米剂型具有尺寸小、稳定性强、生物利用度高等优点,可以有效解决生物与医药领域中,多糖类生物大分子因分子量过大导致的生物利用度低、体内活性差等问题。
33.具体方案如下:
34.一种多糖纳米剂型的制备方法,包括以下步骤:
35.步骤一、将多糖溶于去离子水中得到溶液a,其中多糖与去离子水的质量体积比为10-20mg/ml;
36.步骤二、在磁力搅拌的条件下将无水乙醇逐滴加到溶液a中,继续磁力搅拌2h,得到悬浮液b;溶液a与无水乙醇的体积比为1:5-1:20;优选的,所述溶液a与无水乙醇的体积比为1:5、1:10、1:20,该比例下制备的tp-nps(分别记为np-1、np-2、np-3)具有促进raw 264.7细胞增殖、对aml-12细胞辐射防护活性。所述溶液a与无水乙醇的体积比为1:4时,所得tp-nps(np-3)具有优异的蛋白吸附能力和ph、温度、离子强度稳定性。
37.步骤三、将悬浮液b在10000rmp条件下离心15min,用无水乙醇洗涤沉淀物3次,即得多糖纳米剂型;所述多糖为黑松露多糖、红乳牛肝菌多糖或红菇多糖。
38.进一步的,步骤一中,多糖的制备方法包括以下步骤:
39.步骤1、将粉碎的黑松露粉末、红乳牛肝菌粉末或红菇粉末过40目筛,然后按照1:30(g/ml)的料液比用体积分数为95%的乙醇浸泡12h,抽滤后舍弃滤液,将滤渣烘干,相应的得到脱脂后的黑松露粉末、红乳牛肝菌粉末或红菇粉末;以脱脂的黑松露粉末、红乳牛肝菌粉末或红菇粉末为原料,超纯水为溶剂,按照料液比为1:30g/ml的比例混合均匀后进行水浴提取,提取温度为90℃,提取时间为2h,得到提取液c;
40.步骤2、将提取液c经过4000rpm离心15min,分离得到上清液,上清液经过抽滤、旋转蒸发浓缩得到浓缩液d;
41.步骤3、向浓缩液d中加入4倍体积的体积分数为95%的乙醇,于4℃环境下静置12h醇沉,随后3500rmp离心15min,获得沉淀物,沉淀物加水复溶后经过7000da透析袋透析36h,将透析后的溶液真空冷冻干燥,相应的获得黑松露多糖、红乳牛肝菌多糖或红菇多糖。
42.具体实施方式二
43.具体实施方式一所述的多糖纳米剂型应用在辐射防护食品中。
44.实施例1
45.一种多糖纳米剂型的制备方法,包括以下步骤:
46.步骤1、将粉碎的黑松露粉末经过40目过筛,然后按照1:30(g/ml)的料液比用95%(v/v)的乙醇浸泡12h,抽滤后舍弃滤液,将滤渣烘干得脱脂后的黑松露粉末;以脱脂后的黑松露粉末为原料,超纯水为溶剂,按照料液比1:30(g/ml)的比例混合均匀,然后进行水浴提取,提取温度为90℃,提取时间为2h,得到提取液c。
47.步骤2、提取液c经过4000rpm离心15min得上清液,上清液经过抽滤、旋转蒸发浓缩得浓缩液d。
48.步骤3、向浓缩液d加入4倍体积的95%(v/v)乙醇,于4℃冰箱中静置12h醇沉,随后3500rmp离心15min,获得沉淀物;沉淀物加水复溶后经过7000da透析袋透析36h,将透析后的溶液通过真空冷冻干燥机冷冻干燥后获得黑松露多糖(tp)。
49.步骤一、将tp溶于去离子水中得到溶液a,其中tp与去离子水的质量体积比为20mg/ml。
50.步骤二、在磁力搅拌条件下,将无水乙醇逐滴加入到溶液a中,继续磁力搅拌2h,得到悬浮液b。
51.步骤三、悬浮液b在10000rmp条件下离心15min,并用无水乙醇洗涤沉淀3次,得到
tp纳米剂型tp-nps。可将洗涤后的tp-nps悬浮于适量去离子水中,冷冻干燥后保存,用于后续检测。
52.按照上述方法,步骤二中分别控制溶液a与无水乙醇的体积比为1:5、1:10、1:20,其余步骤均相同,制备tp-nps,分别命名为np-1、np-2、np-3。
53.按照上述方法,步骤1中将黑松露换为红乳牛杆菌和红菇,其他步骤相同,分别制备红乳牛肝菌多糖纳米颗粒sbp-nps、红菇多糖纳米颗粒rvp-nps。
54.由表1所示,tp、sbp、rvp均可以通过本发明方法制备为纳米剂型。后续检测中以tp-nps为检测对象进行分析。
55.表1为不同多糖溶液与无水乙醇体积比条件下制备的tp-nps、sbp-nps、rvp-nps的粒径及pdi
[0056][0057]
1.1 tp和tp-nps的显微形貌
[0058]
将tp、np-1、np-2、np-3冻干粉分别均匀黏附在导电胶上,用洗耳球吹去未黏附粉末,在粉末表面喷涂一层薄金,增强导电性。通过扫描电子显微镜(sem,zeiss gemini 300)观察它们的微观形貌。
[0059]
由图1所示,a、b、c、d分别为tp、np-1、np-2、np-3的sem微观形貌图。tp为片状结构,整体尺寸较大。np-1、np-2呈现出多孔构型,但是表面颗粒的球状形貌不明显,颗粒度不足。np-3呈现明显的纳米球相互聚集的外观形貌。本发明创新的利用反溶剂沉淀法,通过加入反溶剂来诱导饱和溶液为溶质的沉淀提供驱动力,在临界溶质浓度下,多糖分子相互碰撞聚集,团聚形成纳米颗粒。反溶剂比例较大的情况下,溶液过饱和度增加,所形成纳米颗粒的粒径较小。相比于tp,np-1、np-2、np-3均由较小尺寸的颗粒聚集而成,在机体内它们可以分散为较小的颗粒单元,更易透过细胞屏障被机体吸收利用。
[0060]
1.2傅里叶红外光谱(ft-ir)及x-射线衍射(xrd)分析
[0061]
1.2.1 ft-ir分析
[0062]
用tensor ii傅里叶红外光谱仪(bruker,ettilingen,germany)测定tp和tp-nps(np-1、np-2、np-3)的红外图谱。将研钵、杵和压片装置用无水乙醇擦拭干净,再分别取tp和np-1、np-2、np-3冻干粉与溴化钾粉末按照1:100的比例放入研钵中,用杵仔细按同一方向缓慢研磨,直至研磨均匀,将粉末放入压片装置中,压片3min,可见压片透明均一,无裂片,放入红外检测装置中,进行检测并应用红外分析软件omnic 8.0进行分析。
[0063]
由图2a所示,相比于tp,np-1、np-2、np-3在3400cm-1
处的吸收峰增大,此吸收峰为-oh的伸缩振动特征吸收峰。并且其余吸收峰未产生明显变化,证明未有新的化学键生成。-oh可以作为氢键的供体与受体,证明氢键主要参与np-1、np-2、np-3的形成。无未知副产物产生,产物更加安全。同时氢键作为一种较强的分子间非共价键,将多糖分布松散的基团相互连接,形成结构紧致,粒径较小的纳米颗粒。这种较强的分子间作用力赋予纳米颗粒良好的稳定性,使其在多变的外部环境中保持良好的纳米结构。稳定性实验检测结果也表明了
这一点。
[0064]
1.2.2 xrd分析
[0065]
用x-射线衍射仪(rigaku smartlab 9kw,japan)测定tp和tp-nps(np-1、np-2、np-3)的晶体结构。检测条件:电压45kv,电流200ma,2θ(
°
)范围为5-90
°
,速度5
°
/min。
[0066]
由图2b所示,tp、np-1、np-2均未显示出晶体结构的特征吸收峰,属于非晶体结构。np-3出现特征吸收峰,表现出部分晶体结构特征,该晶体结构可以使np-3更易被细胞摄取,表现出更优的生物利用度和生物活性。
[0067]
1.3 tp和tp-nps对raw 264.7细胞的促增殖能力检测
[0068]
收集生长状态良好的raw 264.7细胞,血球计数板计数并调整细胞浓度,以1
×
104/ml的细胞浓度接种于96孔板中,37℃、5%co2培养箱中培养12h使其充分贴壁。12h后分别加入不同浓度的tp溶液和tp-nps(np-1、np-2、np-3)悬浮液10μl于对应的孔,pbs组和lps(1μg/ml)组分别作为阴性对照和阳性对照,每个实验组做5个重复孔,于37℃、5%co2培养箱中继续培养24h。24h之后,取出96孔板,小心吸走96孔板中的细胞培养液,并避光配置含10%胎牛血清和10%cck-8溶液的dmem培养基,每孔避光加入110μl混合培养基,于37℃,5%co2的细胞培养箱中孵育1-2h。然后使用酶标仪测定450nm处吸光度。
[0069]
由图3所示,相比于control组,tp、np-1、np-2、np-3组均能显著提升raw 264.7细胞的细胞活力,且该效果呈剂量依赖性,证明tp、np-1、np-2、np-3均能促进raw 264.7巨噬细胞增殖。相比于tp组,np-1、np-2、np-3组的促增殖效果更明显,且np-3组最佳。证明tp可以促进raw 264.7巨噬细胞增殖,具有一定的免疫调节功能。本发明制备的tp-nps可以在一定程度上提升该效果,表现出更好的免疫调节功效。
[0070]
1.4 tp和tp-nps对aml-12细胞的辐射防护能力检测
[0071]
1.4.1 tp和tp-nps对aml-12细胞的剂量安全性检测
[0072]
使用传代次数为3-6代的aml-12细胞,待细胞生长至最佳时期时,消化细胞重悬后稀释计数,将细胞悬液加入96孔板中,每孔体积为90μl,约5000个细胞/孔。于37℃、5%co2培养箱中培养12h使细胞贴壁,12h后分别加入不同浓度的tp溶液和tp-nps(np-1、np-2、np-3)悬浮液10μl于对应的孔,pbs组作空白对照,每个实验组做5个重复孔,于37℃、5%co2培养箱中继续培养24h。24h之后,取出96孔板,小心吸走96孔板中的细胞培养液,并避光配置含10%胎牛血清和10%cck-8溶液的培养基,每孔避光加入110μl混合培养基,于37℃,5%co2的细胞培养箱中孵育1-2h。然后使用酶标仪测定450nm处吸光度,并计算细胞活力。
[0073]
由图4a所示,不同浓度的tp及tp-nps(np-1、np-2、np-3)处理后,aml-12细胞的细胞活力均未下降,且有一定程度的提升,其中np-3效果最佳。证明在100-400μg/ml的浓度下tp及tp-nps(np-1、np-2、np-3)对aml-12细胞无毒,且具有一定程度的促增殖作用,其中np-3效果最佳。
[0074]
1.4.2 tp和tp-nps对aml-12细胞辐射防护能力检测
[0075]
使用传代次数为3-6代的aml-12细胞,待细胞生长至最佳时期时,消化细胞重悬后稀释计数,将细胞悬液加入96孔板中,每孔体积为90μl,约5000个细胞/孔。于37℃、5%co2培养箱中培养12h使细胞贴壁,12h后分别加入不同浓度的tp溶液和tp-nps(np-1、np-2、np-3)悬浮液10μl于对应的孔,每个实验组做5个重复孔,于37℃、5%co2培养箱中继续培养12h后,除nc组外,其余组均进行
60
co-γ射线辐照,辐照总剂量为6gy,辐照剂量率2gy/min。24h
之后,取出96孔板,小心吸走96孔板中的细胞培养液,并避光配置含10%胎牛血清和10%cck-8溶液的培养基,每孔避光加入110μl混合培养基,于37℃,5%co2的细胞培养箱中孵育1-2h。然后使用酶标仪测定450nm处吸光度,并计算细胞活力。
[0076]
由图4b所示,辐照之后,ir组细胞活力显著降低,tp-nps(np-1、np-2、np-3)处理后,细胞活力有一定程度的恢复,且np-3恢复效果最佳。以上结果表明本发明制备的tp-nps(np-1、np-2、np-3)对辐照导致的aml-12细胞活力降低具有一定的防护作用。
[0077]
1.5 tp和np-3对蛋白质的吸附能力检测
[0078]
以牛血清白蛋白(bsa)为模型研究tp和np-3对蛋白质吸附情况。将15mg的tp、15mg的np-3分别与25mg的bsa共同溶解于100ml pbs(ph 7.4)溶液中。每隔一段时间,从混合溶液中吸取1ml液体,10000rpm离心20min,使用bca蛋白定量试剂盒检测上清中未被吸附的蛋白质。25mg bsa溶解于100ml的去离子水中混合溶液作为空白对照。计算不同时间后tp及np-3对蛋白质的吸附能力。
[0079]
由图5所示,tp对蛋白质具有一定的吸附能力,但是其吸附效率较低。本发明方法制备的np-3在同样时间段对蛋白质的吸附能力显著高于tp。证明本发明方法制备的tp-nps可以有效提升蛋白质吸附能力,更易与细胞膜表面蛋白结合,从而提升细胞对其摄取能力,进一步提升生物利用度与体内生物活性。
[0080]
1.6 np-3的稳定性检测
[0081]
1.6.1 np-3的ph稳定性检测
[0082]
取适量np-3加入去离子水中制备为悬浮液,将悬浮液分为4组。各组分别取2ml与2mlph为2、5、7、9的去离子水(用0.5m的hcl和naoh调节ph)混合。室温下孵育2h,随后检测其粒径和pdi。
[0083]
如图6a所示,在不同ph条件下孵育2h之后,np-3的粒径和pdi未显著增加,证明本发明方法制备的tp-nps具有良好的ph稳定性,可以满足一般功能性食品的生产及储备要求。
[0084]
1.6.2 np-3的温度稳定性检测
[0085]
取适量np-3加入去离子水中制备为悬浮液,将悬浮液分为4组,分别在4、25、37、60℃条件下孵育2h,然后恢复至室温,随后检测其粒径和pdi。
[0086]
如图6b所示,在不同温度条件下孵育2h之后,np-3的粒径和pdi未显著增加,证明本发明方法制备的tp-nps具有良好的温度稳定性,可以满足一般功能性食品的生产及储备要求。
[0087]
1.6.3 np-3的离子强度稳定性检测
[0088]
取适量np-3加入去离子水中制备为悬浮液,将悬浮液分为5组,各组分别取2ml与2ml 200、400、600、800、1000mm的nacl溶液混匀(nacl的终浓度分别为100、200、300、400、500mm),室温下孵育2h,随后检测其粒径和pdi。
[0089]
如图6c所示,在不同离子强度条件下孵育2h之后,np-3的粒径和pdi未显著增加,证明本发明方法制备的tp-nps具有良好的离子强度稳定性,可以满足一般功能性食品的生产及储备要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1