挤压预处理大豆蛋白制备含有槲皮素的乳液凝胶的方法
1.本发明属于大豆蛋白加工技术领域,具体涉及挤压预处理大豆蛋白制备含有槲皮素的乳液凝胶的方法。
背景技术:
2.目前,运载槲皮素的载体较多,有乳液、颗粒、纤维、胶束、凝胶和脂质体等。这些载体运载槲皮素后,都在一定程度上解决了槲皮素水溶性低、化学稳定性差、生物利用率低等问题。但是,当这些载体运载槲皮素后,对槲皮素的抗氧化活性保护作用的效果并不相同。考虑到食品安全性的问题,这些载体都选用了食品基质的生物大分子作为原料进行制备。然而,天然的食品生物大分子自身性质有一些不足,为了制备的载体性能更优越,往往会对这些蛋白质进行改性。目前,制备蛋白质乳液凝胶时,多采用单一的改性方法,如只用物理改性(单独使用挤压、单独使用超声等),只用化学改性(单独使用碱法多酚共价结合法、单独使用磷酸化法、单独使用琥珀酰化法等)。并未发现利用多种改性方法结合的方式改性蛋白质并用于制备乳液凝胶进而提升槲皮素抗氧化活性的方法。
技术实现要素:
3.为了运载槲皮素并提升槲皮素的抗氧化活性,本发明提供了挤压预处理大豆蛋白制备含有槲皮素的乳液凝胶的方法,包括以下步骤:
4.(1)碱法多酚共价结合改性大豆蛋白:将大豆蛋白冻干粉溶于磷酸盐缓冲溶液中,并在室温下搅拌2h,制得浓度为2g/100ml的大豆蛋白溶液,于4℃水化过夜;将大豆蛋白溶液的ph调节至9.0,加入阿魏酸,使阿魏酸在大豆蛋白溶液中的浓度为150μmol/g蛋白,于室温下磁力搅拌12h;将混合液ph调节至7.0,然后装入透析袋中,用磷酸盐缓冲溶液透析24h,经冷冻干燥获得改性大豆蛋白;
5.(2)挤压处理进一步改性大豆蛋白:向步骤(1)获得的改性大豆蛋白中加入蒸馏水,将改性大豆蛋白的含水量调节至30%-70%,静置24h平衡水分,进行挤压处理,挤压处理后的样品于干燥箱中45℃烘干至恒重,研磨成粉,制备得到挤压-碱法多酚共价结合复合改性大豆蛋白;
6.(3)将步骤(2)获得的复合改性大豆蛋白溶于磷酸盐缓冲溶液中,于室温下搅拌2h,置于4℃水化过夜,获得复合改性大豆蛋白溶液;将20mg槲皮素溶解于65℃的3ml体积分数为25%的乙醇溶液中,加入10ml大豆油,于65℃加热30min,除去乙醇,获得含有槲皮素的大豆油;取10ml复合改性大豆蛋白溶液,加入1.76ml含有槲皮素的大豆油,经避光搅拌和均质获得粗乳液;将粗乳液置于超声波细胞粉碎机中,于400w,25℃水浴的条件下处理15min,经低速离心去除气泡后加入葡糖糖酸内酯调节ph为4.5,磁力搅拌后置于4℃冷藏12h即得乳液凝胶。
7.进一步地限定,步骤(1)所述大豆蛋白冻干粉的制备方法为将脱脂大豆粉与超纯水按照1g:10ml的料液比混合,ph调节至8.5,水浴搅拌2h,离心取上清液,调节ph至4.5,静
置2h,离心取沉淀,利用超纯水溶解,调节ph至7.0得到大豆蛋白,经冻干获得大豆冻干粉。
8.进一步地限定,步骤(1)和步骤(3)所述的磷酸盐缓冲溶液的浓度为0.02mol/l,ph为7.0。
9.进一步地限定,步骤(1)中利用2mol/l的naoh溶液和2mol/l的hcl溶液调节ph。
10.进一步地限定,步骤(1)所述透析袋的截留分子量为8000-14000da。
11.进一步地限定,步骤(1)所述透析每6h换一次磷酸盐缓冲溶液,以确保去除游离的酚类物质。
12.进一步地限定,步骤(2)是将改性大豆蛋白的含水量调节至40%。
13.进一步地限定,步骤(2)所述挤压处理的条件为主机螺杆转速300r/min,喂料区螺杆转速200r/min,挤压温度从第一区到第五区分别为175℃,140℃,120℃,100℃,60℃。
14.进一步地限定,步骤(3)所述复合改性大豆蛋白与磷酸缓冲溶液的料液比为1g:10ml。
15.进一步地限定,步骤(3)所述避光搅拌为避光磁力搅拌2h。
16.进一步地限定,步骤(3)所述均质的条件为10000rpm,2.5min。
17.进一步地限定,步骤(3)所述低速离心的条件为1000rpm,搅拌1min。
18.进一步地限定,步骤(3)所述葡萄糖酸内酯的终浓度15mg/ml。
19.进一步地限定,步骤(3)所述磁力搅拌时间为30s,磁力搅拌后于40℃反应2h。
20.本发明还提供了上述制备方法获得的保护槲皮素抗氧化活性的乳液凝胶。
21.本发明的有益效果:
22.本发明以天然大豆蛋白、超声波改性大豆蛋白、挤压处理改性大豆蛋白、自由基法多酚共价结合改性大豆蛋白、碱法多酚共价结合改性大豆蛋白和挤压-碱法多酚共价结合复合改性大豆蛋白为凝胶基质制备运载槲皮素的大豆蛋白乳液凝胶。通过研究天然大豆蛋白和改性大豆蛋白槲皮素乳液和乳液凝胶的基本性质,考察不同改性方法对槲皮素乳液凝胶体外消化规律的影响,探讨大豆蛋白乳液凝胶运载体系对槲皮素抗氧化活性的保护作用,确定了最佳的大豆蛋白改性方法,进而得到了改性大豆蛋白制备含有槲皮素的乳液凝胶的方法。本发明具体是以脱脂后的天然大豆蛋白为原料,利用挤压-碱法多酚共价结合复合改性天然大豆蛋白,采用复合改性后的大豆蛋白制成含有槲皮素的乳液凝胶。
23.本发明为疏水性营养素物质槲皮素提供了优良的载体,同时也能为运载其他疏水性物质提供理论依据,具有广泛的借鉴意义。与现有技术相比,本发明提供的方法选用大豆蛋白为主要原料,消除了使用传统合成型凝胶基质所带来的安全隐患;同时采用物理改性、多酚改性和物理-多酚复合改性多种方式进一步提高了大豆蛋白乳化性能和凝胶性能,使其制备的乳液凝胶运载性能更加优良,并且成本较低,适合应用于工业生产。与天然大豆蛋白制备的大豆蛋白乳液凝胶相比,采用改性后的大豆蛋白制备的大豆蛋白乳液凝胶(特别是复合改性后的大豆蛋白制备的大豆蛋白乳液凝胶),运载槲皮素的包封效果更好、生物利用率更高、对槲皮素的抗氧化活性保护作用的效果更强。
附图说明
24.图1为大豆蛋白冻干粉的制备流程图。
具体实施方式
25.为了使本发明的目的、技术方案及优点更加清楚明白,下面结合具体的实施方式及说明书附图对本发明进行进一步的详细说明。下述实施例中所使用的实验方法如无特殊说明均为常规方法,所用材料、试剂、方法和仪器,未经特殊说明,均为本领域常规材料、试剂、方法和仪器,本领域技术人员均可通过商业渠道获得。
26.天然大豆蛋白的制备:
27.本发明所用的大豆蛋白冻干粉为天然大豆蛋白,其制备流程图见图1,大豆蛋白冻干粉以脱脂大豆粉(将脱脂豆粕磨粉后过50目筛)为原料进行制备,具体制备方法如下:
28.将脱脂大豆粉与超纯水按照1g:10ml的料液比混合,ph调节至8.5,水浴搅拌2h,离心取上清液,调节ph至4.5,静置2h,离心取沉淀,利用超纯水溶解,调节ph至7.0得到大豆蛋白,经冻干获得大豆冻干粉。
29.本发明采用不同的蛋白改性方法获得改性大豆蛋白,然后分别利用天然大豆蛋白和不同改性方法获得的改性大豆蛋白制备含有槲皮素的乳液凝胶,最终通过对乳液凝胶的性质进行测定确定最佳的改性大豆蛋白的方法。
30.本发明涉及的大豆蛋白改性方法如下:
31.1、超声波处理对天然大豆蛋白进行改性
32.将大豆蛋白冻干粉溶于超纯水(10%,w/v),室温条件下磁力搅拌2h后,放入4℃冰箱中水化过夜。将大豆蛋白分散液置于平底锥形烧瓶中,使用jy92-2d超声波细胞粉碎机进行超声波处理,制备获得超声波改性大豆蛋白。
33.对超声条件进行优化:将超声波的温度设定为55℃,时间设定为30min,功率分别设定为100w、200w、300w、400w、500w,选择出最佳超声功率;将超声波功率设定为400w,温度设定为55℃,时间分别设定为10min、20min、30min、40min、50min,选择出最佳超声波时间;将超声波功率设定为400w,时间设定为30min,温度分别设定为40℃、45℃、50℃、55℃、60℃,选择出最佳的超声波温度。
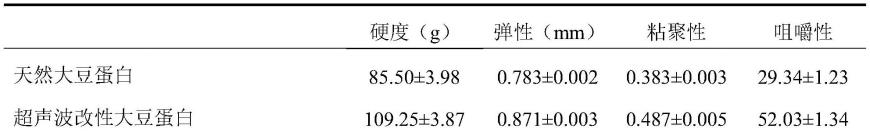
34.通过制备得到的乳液凝胶的质构特性和持水性,确定最佳的超声波处理条件是:将30ml大豆蛋白溶液(10%,w/v,ph 7.0)倒入50ml的三口烧瓶中,在超声功率400w,超声温度55℃,超声时间30min条件下,制备超声波改性大豆蛋白。
35.2、挤压处理对天然大豆蛋白进行改性
36.称取一定质量的大豆蛋白冻干粉,加蒸馏水调节含水量分别为30%,40%,50%,60%,70%(质量分数,以蛋白质干基计),放置24h平衡水分,设置挤压条件,主机螺杆转速300r/min,喂料区螺杆转速200r/min,挤压温度从第一区到第五区分别为175℃,140℃,120℃,100℃,60℃。挤压处理后的样品于干燥箱中45℃烘干至恒重,研磨成粉,制备得到挤压改性大豆蛋白。
37.对大豆蛋白冻干粉加蒸馏水后的含水量进行优化,通过制备得到的乳液凝胶的质构特性和持水性,确定最佳的挤压处理条件是:大豆蛋白加蒸馏水调节含水量分别为40%(质量分数,以蛋白质干基计),放置24h平衡水分,设置挤压条件,主机螺杆转速300r/min,喂料区螺杆转速200r/min,挤压温度从第一区到第五区分别为175,140,120,100,60℃。挤压处理后的样品于干燥箱中45℃烘干至恒重,研磨成粉,制备得到挤压改性大豆蛋白。
38.本发明利用上述超声和挤压改性方法的最优参数分别获得了超声改性大豆蛋白
和挤压改性大豆蛋白,并根据下述含有槲皮素的乳液凝胶的制备方法分别制备乳液凝胶,然后对获得的不同乳液凝胶的质构特性和持水性进行比较。
39.比较结果显示超声改性大豆蛋白槲皮素乳液凝胶的质构特性为硬度109.25
±
3.87g、弹性0.871
±
0.003mm、粘聚性0.487
±
0.005、咀嚼性52.03
±
1.34,持水性为84.20
±
0.44%;挤压改性大豆蛋白槲皮素乳液凝胶的质构特性为硬度112.88
±
3.25g、弹性0.865
±
0.011mm、粘聚性0.492
±
0.009、咀嚼性54.31
±
1.49,持水性为84.90
±
0.25%。由上述比较结果可知挤压改性方法制备获得的改性大豆蛋白制成的含有槲皮素的乳液凝胶的质构特性和持水性表现更好,因此,将挤压改性确定为最佳的物理改性方法。
40.3、多酚自由基法共价结合对天然大豆蛋白进行改性
41.将大豆蛋白冻干粉溶于磷酸缓冲溶液(pbs溶液,0.02mol/l,ph 7.0),大豆蛋白浓度为2%(w/v),室温下磁力搅拌2h后,置于4℃冰箱中过夜水化;取0.1%(v/v)自由基系统(5mmol/lh2o2,0.1mol/l抗坏血酸,0.1mol/lfecl3)加入到上述大豆蛋白溶液中,室温下搅拌2h使大豆蛋白氧化;加入阿魏酸,使大豆蛋白的最终浓度为2%(w/v),室温下搅拌24h;反应结束后加入6-羟基-2,5,7,8-四甲基色烷-2-羧酸(trolox,1mmol/l)终止氧化反应,将反应后的溶液置于10kda透析袋中,使用磷酸缓冲溶液(0.02mol/l,ph 7.0)透析24h(每6h换磷酸缓冲溶液),经冷冻干燥(-80℃冷冻干燥24h)制得自由基法多酚共价结合改性大豆蛋白。
42.对阿魏酸的添加量进行优化,改变阿魏酸的添加量,使阿魏酸的最终浓度分别为10μmol/g蛋白、50μmol/g蛋白、150μmol/g蛋白、250μmol/g蛋白、500μmol/g蛋白,经优化,通过制备得到的乳液凝胶的质构特性和持水性,确定最佳的阿魏酸添加量为150μmol/g蛋白。
43.4、多酚碱法共价结合对天然大豆蛋白进行改性
44.将大豆蛋白冻干粉溶于磷酸缓冲溶液(pbs溶液,0.02mol/l,ph 7.0),大豆蛋白浓度为2%(w/v),室温下磁力搅拌2h后,置于4℃冰箱中过夜水化;用2mol/lnaoh溶液将大豆蛋白溶液调至ph 9.0,加入阿魏酸,使大豆蛋白的最终浓度为2%(w/v),混合物在室温下搅拌12h,确保fa与spi充分反应,在此期间,用naoh溶液维持ph 9.0;反应结束后用2mol/l hcl溶液调ph至7.0,将反应后的溶液置于10kda的透析袋中,使用磷酸缓冲溶液(0.02mol/l,ph 7.0)透析24h(每6h换磷酸缓冲溶液),经冷冻干燥(-80℃冷冻干燥24h)制得碱法多酚共价结合改性大豆蛋白。
45.对阿魏酸的添加量进行优化,改变阿魏酸的添加量,使阿魏酸的最终浓度分别为10μmol/g蛋白、50μmol/g蛋白、150μmol/g蛋白、250μmol/g蛋白、500μmol/g蛋白,经优化,通过制备得到的乳液凝胶的质构特性和持水性,确定最佳的阿魏酸添加量为150μmol/g蛋白。
46.本发明利用上述多酚自由基共价结合和多酚碱法共价结合的最优参数分别获得了自由基法多酚共价结合改性大豆蛋白和碱法多酚共价结合改性大豆蛋白,并根据下述含有槲皮素的乳液凝胶的制备方法分别制备乳液凝胶,然后对获得的不同乳液凝胶的质构特性和持水性进行比较,结果显示自由基法多酚共价结合改性大豆蛋白槲皮素乳液凝胶的质构特性为硬度155.98
±
4.83g、弹性0.904
±
0.009mm、粘聚性0.532
±
0.013、咀嚼性83.18
±
3.84,持水性为86.13
±
0.45%;碱法多酚共价结合改性大豆蛋白槲皮素乳液凝胶的质构特性为硬度214.99
±
4.98g、弹性0.913
±
0.013mm、粘聚性0.543
±
0.002、咀嚼性118.28
±
4.37,持水性为90.26
±
0.25%。由上述对比结果发现多酚碱法共价结合改性方法制备获得
的碱法多酚共价结合改性大豆蛋白制成的含有槲皮素的乳液凝胶的质构特性和持水性表现更好,因此,将多酚碱法共价结合改性方法确定为最佳的化学改性方法。
47.5、挤压-碱法多酚共价结合复合改性法对天然大豆蛋白进行改性
48.本发明将上述获得的最佳物理改性方法和最佳化学改性方法结合,获得了挤压-碱法多酚共价结合复合改性法,具体如下:
49.将大豆蛋白冻干粉溶于磷酸盐缓冲溶液(0.02mol/l,ph 7.0)中,并在室温下搅拌2h,制备得到浓度为2%(w/v)的大豆蛋白溶液,放入4℃冰箱水化过夜;用2mol/l的naoh溶液将上述大豆蛋白溶液调至ph 9.0后,加入阿魏酸,使阿魏酸在大豆蛋白溶液中浓度为150μmol/g蛋白,将混合物在室温下磁力搅拌12h,确保fa与spi充分反应,在此期间,溶液的ph要一直维持在9.0;反应结束后,再用2mol/l的hcl将混合液ph调至7.0,然后,将反应后的溶液装入透析袋中(分子量10000da),室温下用磷酸盐缓冲溶液(0.02mol/l,ph 7.0)透析24h(每6h换水),以确保去除游离的酚类物质;最后,混合物经-80℃冷冻干燥24h,制得碱法多酚共价结合改性大豆蛋白。
50.将碱法多酚共价结合改性大豆蛋白加蒸馏水调节含水量,放置24h平衡水分,设置挤压条件。挤压处理后的样品于干燥箱中45℃烘干至恒重,研磨成粉,制备得到挤压-碱法共价结合复合改性大豆蛋白。
51.对挤压条件进行优化:将含水量分别设定为30%,40%,50%,60%,70%(质量分数,以蛋白质干基计),放置24h平衡水分,设置挤压条件为:主机螺杆转速300r/min,喂料区螺杆转速200r/min,挤压温度从第一区到第五区分别为175℃,140℃,120℃,100℃,60℃。选择出最佳的含水量。
52.碱法多酚共价结合改性大豆蛋白的挤压处理,通过制备得到的乳液凝胶的质构特性和持水性,确定最佳条件是:将碱法多酚共价结合改性大豆蛋白加蒸馏水调节含水量分别为40%(质量分数,以蛋白质干基计),放置24h平衡水分,设置挤压条件,主机螺杆转速300r/min,喂料区螺杆转速200r/min,挤压温度从第一区到第五区分别为175,140,120,100,60℃。挤压处理后的样品于干燥箱中45℃烘干至恒重,研磨成粉,制备得到挤压-碱法共价结合复合改性大豆蛋白。
53.本发明所述含有槲皮素的乳液凝胶的制备方法如下:
54.将天然大豆蛋白或上述不同方法获得的改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)分别溶于磷酸盐缓冲溶液(0.01mol/l,ph 7.0)中,于室温下磁力搅拌2h,置于4℃冰箱中水化过夜,获得大豆蛋白/改性大豆蛋白溶液;将20mg槲皮素溶解于65℃的3ml体积分数为25%的乙醇溶液中(6.6mg/ml),再将10ml大豆油加入含有槲皮素的乙醇溶液中,于65℃加热30min,蒸发除去乙醇,获得含有槲皮素的大豆油;取10ml大豆蛋白/改性大豆蛋白溶液,加入1.76ml含有槲皮素的大豆油,室温下避光磁力搅拌2h,然后使用高速均质机均质(10000r/min,2.5min)得到粗乳液;将粗乳液置于超声波细胞粉碎机中,使用0.636cm直径的钛探头进行超声波处理(400w,15min),通过冰水浴使超声温度维持在25℃左右,制得负载槲皮素的o/w型大豆蛋白/改性大豆蛋白乳液;将负载槲皮素的乳液进行低速离心(1000r/min,1min),去除乳液中的气泡。向乳液中加入一定量的葡萄糖酸内脂(glucono-δ-lactone,gdl)粉末,终浓度为15mg/ml,使乳液的ph值逐渐下降并最终稳定在4.5(大豆蛋白
等电点);将加入gdl的槲皮素乳液在室温下磁力搅拌30s,在40℃条件下反应2h;然后,将样品置于4℃条件下冷藏12h,制得负载槲皮素的大豆蛋白/改性大豆蛋白乳液凝胶。
55.对利用不同改性方法获得的改性大豆蛋白制备而成的含有槲皮素的乳液凝胶的性质进行测定:
56.(1)质构分析
57.根据hu等(hu h,wu j,eunice c y,et al.effects ofultrasound on structural andphysical properties of soy protein isolate(spi)dispersions[j].food hydrocolloids,2013,30(2):647
–
655.)研究方法略作修改,对槲皮素乳液凝胶进行质构分析。使用ta-xt plus质构仪,测试槲皮素乳液凝胶的硬度、粘度、弹性、粘聚性等。实验条件为:p/0.5探头,测试前速度为1mm/s,测试速度为5mm/s,测试后速度为5mm/s,触发力为5.0g。将样品压缩至原始厚度的30%,两次压缩时间间隔为5s。质构分析结果见表1。
[0058]
表1天然/改性大豆蛋白槲皮素乳液凝胶的质构特性
[0059][0060][0061]
利用ta-xtplus质构仪对天然大豆蛋白槲皮素乳液凝胶和改性大豆蛋白槲皮素乳液凝胶的质构特性进行测定,试验结果如表1所示。由表1可知,相比于天然大豆蛋白槲皮素乳液凝胶,改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)槲皮素乳液凝胶的硬度、弹性、粘聚性和咀嚼性都得到了明显提升。两种物理改性(超声波改性、挤压改性)中,挤压改性的效果最佳;两种化学改性(自由基法多酚共价结合改性、碱法多酚共价结合改性)中,碱法多酚共价结合改性最佳。但是,使用单一的物理改性或者单一的化学改性都没有挤压-碱法多酚共价结合复合改性效果好。
[0062]
(2)持水性的测定
[0063]
根据wu等(wu m,xiongy l,chen j,et al.rheological and microstructural properties ofporcine myofibrillar protein-lipid emulsion composite gels[j].journal offood science,2009,74(4):77-87.)研究方法略作修改,对槲皮素乳液凝胶进行持水性(whc)测定。将装有5ml槲皮素乳液凝胶样品的pe离心管在4℃条件下,10000r/min离心15min。离心后把离心管倒置排干水分,用干燥的滤纸小心地除去残留水分。按照公式(1)计算槲皮素乳液凝胶的持水性:
[0064][0065]
其中:w
t
是离心前槲皮素乳液凝胶重量,单位为g;wr是离心后除去水分的槲皮素乳
液凝胶重量,单位为g;wo是pe离心管重量,单位为g。
[0066]
乳液凝胶的持水能力是凝胶稳定的关键因素,能够体现凝胶网络与水分子之间的相互作用。以天然大豆蛋白和改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)为凝胶基质制备的槲皮素乳液凝胶持水性分别为:82.50
±
0.36%,84.20
±
0.44%,84.90
±
0.25%,86.13
±
0.45%,90.26
±
0.25%和93.17
±
0.38%,因此,挤压-碱法多酚共价结合复合改性法获得的槲皮素乳液凝胶持水性最好。
[0067]
(3)槲皮素乳液凝胶包封率的测定
[0068]
称量槲皮素乳液冻干粉末50mg,将其溶解在体积分数为25%的乙醇和体积分数为0.5%的吐温80等体积混合的5ml混合溶液中。在4℃下,14000r/min离心30min,取离心管底部溶液(含有未包封的槲皮素),用体积分数为70%的乙醇溶液稀释合适倍数后,在374nm处测量吸光度。利用槲皮素-乙醇标准曲线计算槲皮素含量,按照式(2)计算槲皮素乳液凝胶的包封率:
[0069][0070]
其中:a
total
是加入油相中槲皮素的初始含量;a
outer
是外水相中存在的未包封的槲皮素含量。
[0071]
槲皮素乳液凝胶的包封率代表着槲皮素被乳液凝胶包封的程度,是衡量乳液凝胶运载体系运载效率的重要指标。以天然大豆蛋白和改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)为凝胶基质制备的槲皮素乳液凝胶包封率分别为73.70
±
1.23%,80.17
±
0.97%,82.57
±
0.97%,87.69
±
0.87%,88.57
±
0.86%和91.13
±
0.96%。结果表明,天然大豆蛋白和改性大豆蛋白槲皮素乳液凝胶均表现出良好包封能力,改性大豆蛋白槲皮素乳液凝胶的包封效果更好,复合改性大豆蛋白槲皮素乳液凝胶的包封效果最好。
[0072]
(4)槲皮素乳液凝胶脂肪分解率的测定
[0073]
采用ph-stat法,在模拟小肠消化阶段时,不断滴加0.25mol/l的naoh溶液,以中和脂质消化释放的游离脂肪酸。滴定过程中,维持消化体系中的ph恒等于7.0,温度恒等于37℃,记录槲皮素乳液凝胶在体外消化开始后1min,3min,5min,10min,20min,60min,90min,120min,150min,180min,210min和240min滴加naoh的消耗量,按照式(3)计算槲皮素乳液凝胶的脂肪分解率:
[0074][0075]
式中:v
naoh
是滴加naoh的体积;m
naoh
是滴加naoh的摩尔浓度;m
oil
是大豆油的平均分子量,w
oil
是反应开始时消化系统中油的重量。
[0076]
在体外模拟小肠消化条件下,采用ph-stat法研究槲皮素乳液凝胶脂质消化情况。消化刚开始时,脂肪分解率快速增长,游离脂肪酸的释放速率迅速增加;随着消化时间的延长,游离脂肪酸的释放速率逐渐趋于平缓。经过240min小肠消化后,天然大豆蛋白和改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)槲皮素乳液凝胶的脂肪分解率分别为:71.20
±
1.24%、81.26
±
1.44%、83.28
±
1.53%、89.57
±
1.44%、92.45
±
1.65%、93.98
±
1.22%。通过槲
皮素乳液凝胶脂肪分解率的试验结果可知,对大豆蛋白进行改性处理能够有效提高油脂的消化速率,挤压-碱法多酚共价结合复合改性槲皮素乳液凝胶的脂肪分解率最高。
[0077]
(5)槲皮素乳液凝胶生物可给率的测定
[0078]
在模拟小肠消化阶段后,立即把消化物放入冰水浴中进行冷却。然后,在4℃下离心(15000r/min,40min);离心后,吸取中间胶束层,并使用0.22mm过滤器过滤,用体积分数为70%的乙醇溶液稀释至合适倍数后,在374nm处测量吸光度。利用槲皮素-乙醇标准曲线计算槲皮素含量,槲皮素乳液凝胶的生物可给率按式(4)计算:
[0079][0080]
式中:w是混合胶束中槲皮素的含量;w1是原始乳液凝胶样品中槲皮素的含量。
[0081]
天然大豆蛋白和改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)槲皮素乳液凝胶的生物可给率分别为:33.40
±
0.93%、36.90
±
0.74%、37.69
±
0.51%、44.19
±
0.47%、47.47
±
0.46%、49.47
±
0.87%。试验结果表明,大豆蛋白槲皮素乳液凝胶的生物可给率与游离脂肪酸(ffa)的释放速率是呈正相关的,乳液凝胶中生物活性物质的生物可给率高度依赖于脂质的消化,脂肪分解程度越高,生物可给率更高。因此,挤压-碱法多酚共价结合复合改性槲皮素乳液凝胶的生物可给率最高。
[0082]
(6)槲皮素乳液凝胶抗氧化活性的测定
[0083]
为了研究乳液凝胶对槲皮素生物活性的保护作用,分别测定消化前后的纯槲皮素溶液以及消化后的槲皮素乳液凝胶提取物的抗氧化活性。分别将7.5ml未经消化的纯槲皮素溶液、消化后的纯槲皮素溶液和槲皮素乳液凝胶装入透析袋中,用12ml乙醇和甲醇(1:1,v/v)混合溶液进行透析,收集透析袋外的提取物。按照下述方法测定提取物的抗氧化活性。
[0084]
dpph自由基清除活性的测定
[0085]
根据medina等(medina-perez g,estefes-duarte j a,afanador-barajas l n,et al.encapsulation preserves antioxidant andantidiabetic activities ofcactus acid fruit bioactive compounds under simulated digestion conditions[j].molecules,2020,25(23):5736.)研究方法略作修改,测定提取物dpph自由基清除活性。配置0.1mmol/l的dpph乙醇溶液,室温下避光保存2h。然后,取1ml样品与4mldpph乙醇溶液,室温下避光反应30min后,在517nm处测量吸光度。dpph自由基清除率由式(5)计算:
[0086][0087]
式中:a是样品与dpph乙醇混合溶液的吸光度;ai是样品与乙醇溶液的吸光度;aj是单独dpph乙醇溶液的吸光度。
[0088]
abts自由基清除活性的测定
[0089]
根据medina等(medina-perez g,estefes-duarte ja,afanador-barajas ln,et al.encapsulation preserves antioxidant andantidiabetic activities ofcactus acid fruit bioactive compounds under simulated digestion conditions[j].molecules,2020,25(23):5736.)研究方法略作修改,测定提取物abts自由基清除活性。用磷酸盐缓冲溶液(0.1mol/l,ph7.4)配制浓度为7mmol/l的abts原液(含有2.45mmol/l过硫酸钾),在室温下避光保存16h。用磷酸盐缓冲溶液(0.1mol/l,ph7.4)将abts原液稀释至合
适倍数,调整其吸光度为0.7
±
0.1,将稀释后abts溶液用于后面的测定反应。将20μl样品加入到2mlabts溶液(吸光度为0.7
±
0.1)中,室温下避光反应5min,在734nm处测量吸光度。abts自由基清除率由式(6)计算:
[0090][0091]
式中:a0是abts溶液的吸光度;a是样品与abts溶液混合后吸光度。
[0092]
槲皮素作为一种天然黄酮类化合物,具有抗氧化、抗菌、抗炎等生理功能和药用价值。由于槲皮素口服吸收利用率较低,研究运载体系对槲皮素的生理活性保护作用具有一定意义。通过对未经消化的纯槲皮素溶液(qct)、消化后的纯槲皮素溶液(qct-ed)和槲皮素乳液凝胶提取物的抗氧化活性进行测定,分析乳液凝胶运载体系对槲皮素抗氧化活性的保护作用。
[0093]
在完整体外消化模型里,qct、qct-ed和天然大豆蛋白和改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)槲皮素乳液凝胶消化后提取物的dpph自由基清除率分别为92.51
±
2.53%、28.40
±
1.97%、32.85
±
1.53%、54.35
±
0.97%、56.17
±
1.32%、63.86
±
0.77%、65.42
±
0.76%、70.09
±
1.02%。
[0094]
在完整体外消化模型里,qct、qct-ed和天然大豆蛋白和改性大豆蛋白(超声波改性、挤压改性、自由基法多酚共价结合改性、碱法多酚共价结合改性、挤压-碱法多酚共价结合复合改性)槲皮素乳液凝胶消化后提取物的abts自由基清除率分别为98.72
±
1.35%、34.62
±
2.65%、44.40
±
2.33%、78.49
±
0.97%、79.66
±
1.16%、83.19
±
0.77%、87.89
±
0.76%和88.93
±
0.27%。
[0095]
综合槲皮素乳液凝胶体外消化后提取物dpph和abts自由基清除率的试验结果,与不进行包埋的槲皮素相比,利用大豆蛋白乳液凝胶对槲皮素进行包封,经过完整体外消化后槲皮素的自由基清除率提高。结果表明,大豆蛋白乳液凝胶具有优良的运载性能,能够保护运载物质的抗氧化活性。
[0096]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明精神和范围内,都可以做各种的改动与修饰,因此,本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1