抗癌剂所致的末梢神经障碍性疼痛的预防和/或治疗剂的制作方法与工艺
本发明涉及对抗癌剂所致的末梢神经障碍性疼痛具有预防和/或治疗效果的药物。
背景技术:
在癌症(恶性肿瘤)的治疗中,适于分别单独或组合使用外科手术、放射线治疗、化学疗法。其中,癌化学疗法中使用的抗癌剂(抗恶性肿瘤剂)本来就具有细胞毒性、细胞损伤性,不仅会伤害癌(恶性肿瘤)细胞,而且还会伤害正常细胞,从而会产生副作用。作为抗癌剂所致的副作用,可以举出血液障碍、消化器官障碍、神经障碍,近年来,特别是急性或慢性神经障碍的问题增大。据考虑,其原因在于,显示出显著抗癌效果的新型抗癌剂所带来的主要副作用多数情况下为神经障碍;FOLFOX疗法等多剂合用疗法所带来的影响、血液障碍或消化器官障碍的副作用倾向于得到改善。在目前的情况下,为了应对该抗癌剂所致的神经障碍,不得不减少抗癌剂的量或中断癌化学疗法。抗癌剂所致的神经障碍除了在中枢神经系统、自主神经系统、末梢神经系统中观察到以外,还在味觉等感觉器官中观察到。其中高频表现出剧痛或灼痛等疼痛、四肢末端麻木、低温刺激所致的过敏等知觉异常、感觉消失或感觉麻痹等感觉异常、知觉性运动失调、肌力降低等末梢神经障碍,特别是冷性异常疼痛或机械性异常疼痛会产生作为代表性症状的问题。作为容易导致这些末梢神经障碍的抗癌剂,可以举出紫杉烷类药剂(紫杉醇、多烯紫杉醇)、长春花生物碱类药剂(长春新碱、长春碱、长春地辛、长春瑞滨)、铂制剂(奥沙利铂、顺铂)。目前,对于抗癌剂所致的末梢神经障碍、特别是异常疼痛(異痛症),尚未确立有效的预防法和治疗法。对于奥沙利铂的末梢神经障碍,有人报道了钙/镁静脉内给药及谷胱甘肽的有用性,但出于癌化学疗法的复杂化及需要大量给药等原因,它们几乎未进行使用。另外,在实际的临床现场中,不得不通过理疗、按摩、针刺等补充疗法以及类固醇、抗抑郁药、抗癫痫药、鸦片类物质等药物疗法的组合来应对抗癌剂所致的末梢神经障碍,但这些治疗法的有效性尚未得到证实,这些治疗本身多数也具有副作用(非专利文献1、非专利文献2)。另一方面,已知血栓调节蛋白是如下的物质:其与凝血酶特异性地结合,具有抑制凝血酶的凝血活性同时显著促进凝血酶的蛋白C活化能力的作用,已知其具有强大的凝血抑制作用。以往,血栓调节蛋白作为在以人为首的各种动物种的血管内皮细胞上表达的糖蛋白而被发现获得,其结构从蛋白质的N末端一侧起由N末端区域(第1-226位)、具有6个EGF样结构的区域(第227-462位)、O型糖链附加区域(第463-497位)、跨膜区域(第498-521位)、以及细胞质内区域(第522-557位)这5个区域构成(非专利文献3)。全长的血栓调节蛋白若不在表面活性剂的存在下则难以溶解,作为制剂必须添加表面活性剂,与此相对,存在一种即使不在表面活性剂的存在下也可以顺利地溶解的可溶性血栓调节蛋白。可溶性血栓调节蛋白制备成至少不含有跨膜区域的一部分或全部即可,例如,确认到仅由N末端区域与具有6个EGF样结构的区域及O型糖链附加区域这3个区域形成(即,由序列编号9的第19~516位氨基酸序列形成)的可溶性血栓调节蛋白可通过应用重组技术来获得,并且该重组体可溶性血栓调节蛋白具有天然的血栓调节蛋白的活性(专利文献1)。此外还可示例出人尿来源的可溶性血栓调节蛋白等(专利文献2)。顺带说一下,在基因中,如在很多情况下所确认,通过自然变异或获得时的变异,在人类中也发现了多样性的变异,目前已经确认到由上述575个残基的氨基酸序列形成的人血栓调节蛋白前体的第473位氨基酸为Val的序列和为Ala的序列。在编码该氨基酸的碱基序列中,第1418位分别变异为相当于T和C(非专利文献3)。但是,它们在活性和物性方面完全没有差异,可认为两者实质上是相同的。以往,作为血栓调节蛋白的用途,可期待其用于例如心肌梗塞、血栓症(例如急性期或慢性期的脑血栓症、动脉或静脉的急性或慢性的末梢血栓症等)、栓塞症(例如急性期或慢性期的脑栓塞症、动脉或静脉的急性或慢性的末梢栓塞症等)、末梢血管闭塞症(例如伯格氏病、雷诺氏病等)、闭塞性动脉硬化症、心脏手术的继发性功能性障碍、脏器移植的并发症、血管内凝血综合症(DIC)、心绞痛、短暂性脑缺血发作、妊娠中毒症、深静脉血栓症(Deepvenousthrombosis:DVT)等疾病的治疗和预防。此外,作为在血栓症或DIC等伴有凝固亢进的疾病以外的疾病中的应用,可以举出肝脏障碍(专利文献4)、吸收性骨疾病(专利文献5)、创伤治愈(专利文献6)等。进而,作为将血栓调节蛋白与其它有效成分合用的用途,公开了创伤治愈(专利文献7)和脑组织的保护(专利文献8)等。另外还记载了血栓调节蛋白在与造血细胞移植相伴的疼痛的治疗和预防中的用途(专利文献9)。现有技术文献专利文献专利文献1:日本特开昭64-6219号公报专利文献2:日本特开平3-86900号公报专利文献3:WO92/00325号公报专利文献4:日本特开平8-3065号公报专利文献5:日本特开平8-301783号公报专利文献6:日本特开平9-20677号公报专利文献7:美国专利第5,976,523号说明书专利文献8:美国专利第5,827,832号说明书专利文献9:日本特开2012-001543号公报非专利文献非专利文献1:NCICancerBulletin,2010,Feb.23,7(4)非专利文献2:日薬理誌(日本药理志),2010,136:275-279非专利文献3:EMBOJournal,1987,6:1891-1897
技术实现要素:
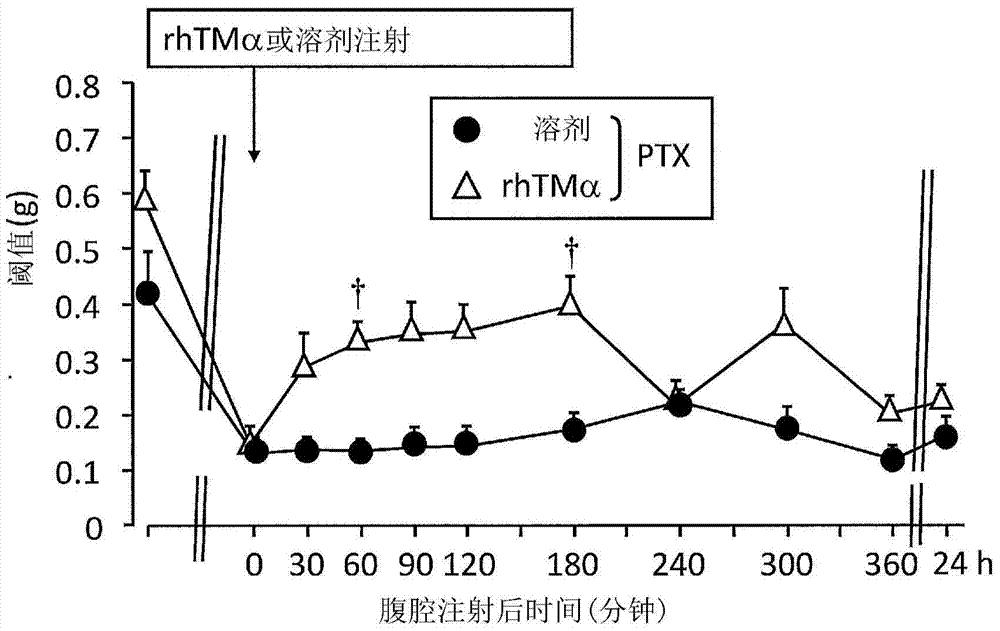
发明所要解决的课题本发明所要解决的课题在于提供一种能够有效地预防和/或治疗由利用抗癌剂的治疗所致的末梢神经障碍性疼痛的药物。解决课题的手段现状中,为了应对抗癌剂所致的神经障碍不得不减少抗癌剂的用量或中断抗癌剂给药,尚未确立对于抗癌剂所致的神经障碍有效的预防法和治疗法,本发明人强烈认识到这些现状中的问题,并认为提供用于有效地预防和/或治疗由抗癌剂所致的神经障碍、尤其是抗癌剂所致的末梢神经障碍性疼痛的药物是重要的课题。这是由于,发明人认为,抗癌剂所致的末梢神经障碍性疼痛使日常生活难以进行、为癌症治疗中止的最大原因之一,因而抗癌剂所致的异常疼痛问题的解决不仅从提高患者的生活质量方面、而且从癌症治疗的持续方面来说在癌症治疗中也是重要的。本发明人为了解决上述课题进行了深入研究,结果令人惊讶地发现,血栓调节蛋白对于抗癌剂所致的末梢神经障碍性疼痛、具体地说对于异常疼痛显示出了优异的预防和/或治疗效果,从而完成了本发明。截止目前,尚无关于血栓调节蛋白预防和/或治疗由抗癌剂所致的神经障碍、进而预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的报告或暗示。另外,在专利文献9中公开了其对于与造血细胞移植的前处理所带来的浮肿或腹水贮留等所致的体重增加相伴的疼痛是有效的。但是,其中对于抗癌剂所致的末梢神经障碍性疼痛却没有任何公开或暗示。即,作为本发明,可以举出下述方案。[1]一种药物,其是用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的药物,其中,该药物含有血栓调节蛋白作为有效成分。[2]如上述[1]所述的药物,其中,血栓调节蛋白为可溶性血栓调节蛋白。[3]如上述[1]所述的药物,其中,血栓调节蛋白为人血栓调节蛋白。[4]如上述[1]~[3]的任一项所述的药物,其中,末梢神经障碍性疼痛选自由四肢麻木、四肢疼痛、深部肌腱反射降低、肌力降低、异常疼痛、痛觉过敏和运动功能障碍组成的组中的一种以上。[5]如上述[1]~[4]的任一项所述的药物,其中,末梢神经障碍性疼痛为异常疼痛。[6]如上述[5]所述的药物,其中,异常疼痛为机械性异常疼痛。[6-2]如上述[5]所述的药物,其中,异常疼痛为冷性异常疼痛。[7]如上述[1]~[6-2]的任一项所述的药物,其中,抗癌剂选自由紫杉烷类药剂和铂制剂组成的组中的一种以上。[7-2]如上述[7]所述的药物,其中,紫杉烷类药剂选自由紫杉醇和多烯紫杉醇组成的组中的一种以上。[7-3]如上述[7]所述的药物,其中,铂制剂选自由奥沙利铂、顺铂、卡铂以及奈达铂组成的组中的一种以上。[8]如上述[1]~[6-2]的任一项所述的药物,其中,抗癌剂为紫杉醇。[8-2]如上述[1]~[6-2]的任一项所述的药物,其中,抗癌剂为奥沙利铂。[9]如上述[1]~[6-2]的任一项所述的药物,其中,抗癌剂经FOLFOX疗法或FOLFIRI疗法进行给药。[10]如上述[1]~[9]的任一项所述的药物,其中,血栓调节蛋白以间歇给药的方式给药。需要说明的是,如上述[1]~[9]那样引用的项编号以范围表示,该范围内配置[7-2]等具有分支编号的项的情况下,意味着还引用了[7-2]等具有分支编号的项。下文中也相同。[10-2]如上述[10]所述的药物,其中,间歇给药为一周一次的给药。[10-3]如上述[10]所述的药物,其中,间歇给药为每日给药。[10-4]如上述[1]~[9]的任一项所述的药物,其中,血栓调节蛋白一周给药一次。[10-5]如上述[1]~[9]的任一项所述的药物,其中,血栓调节蛋白每日给药。[11]如上述[1]~[10-5]的任一项所述的药物,其中,该药物针对患有选自由卵巢癌、非小细胞癌、乳腺癌、胃癌、子宫体癌、头颈部癌、食道癌、白血病、恶性淋巴瘤、小儿肿瘤、多发性骨髓瘤、恶性星形细胞瘤、神经胶质瘤、绒毛膜疾病、胚细胞瘤、肺癌、睾丸瘤、膀胱癌、肾盂肿瘤、尿道肿瘤、前列腺癌、子宫颈癌、神经母细胞瘤、小细胞肺癌、骨肉瘤、恶性胸膜间皮瘤、恶性骨瘤以及大肠癌组成的组中的1种以上的癌的癌症患者进行给药。[12]一种药物,其为用于与抗癌剂组合给药从而预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的药物,其中,该药物含有血栓调节蛋白作为有效成分。[12-2]如上述[12]所述的药物,其中,抗癌剂为紫杉烷类药剂或铂制剂。[12-3]如上述[12]所述的药物,其中,抗癌剂为紫杉醇。[12-4]如上述[12]所述的药物,其中,抗癌剂为奥沙利铂。[13]如上述[1]~[12-4]的任一项所述的药物,其中,血栓调节蛋白为由转化细胞获得的肽,该肽为具有血栓调节蛋白活性的肽,所述转化细胞是将编码下述(i-1)或(i-2)的任意氨基酸序列的DNA转染到宿主细胞中而制备的。(i-1)序列编号9或序列编号11的任一项所述的氨基酸序列;或者(i-2)上述(i-1)的氨基酸序列中有1个或2个以上的氨基酸发生取代、缺失或添加而成的氨基酸序列。[13-2]如上述[1]~[12-4]的任一项所述的药物,其中,血栓调节蛋白为由转化细胞获得的肽,该肽为具有血栓调节蛋白活性的肽,所述转化细胞是将编码下述(i-1)的氨基酸序列的DNA转染到宿主细胞中而制备的。(i-1)序列编号9或序列编号11的任一项所述的氨基酸序列。[14]如上述[1]~[12-4]的任一项所述的药物,其中,血栓调节蛋白为含有下述(i-1)或(i-2)的任意氨基酸序列的肽,该肽为具有血栓调节蛋白活性的肽;(i-1)序列编号9或序列编号11的任一项所述的氨基酸序列中的第19~516位氨基酸序列;或者(i-2)上述(i-1)的氨基酸序列中有1个或2个以上的氨基酸发生取代、缺失或添加而成的氨基酸序列。[14-2]如上述[1]~[12-4]的任一项所述的药物,其中,血栓调节蛋白为含有下述(i-1)的氨基酸序列的肽,该肽为具有血栓调节蛋白活性的肽;(i-1)序列编号9或序列编号11的任一项所述的氨基酸序列中的第19~516位氨基酸序列。[14-3]如上述[1]~[12-4]的任一项所述的药物,其中,血栓调节蛋白为:(i)含有序列编号9或序列编号11的任一项所述的氨基酸序列中的第367~480位氨基酸序列、且含有下述(ii-1)或(ii-2)的任意氨基酸序列的肽,该肽为具有血栓调节蛋白活性的肽;(ii-1)序列编号9或序列编号11的任一项所述的氨基酸序列中的第19~244位氨基酸序列;或者(ii-2)上述(ii-1)的氨基酸序列中有1个或2个以上的氨基酸发生取代、缺失或添加而成的氨基酸序列。[14-4]如上述[1]~[12-4]的任一项所述的药物,其中,血栓调节蛋白为:(i)含有序列编号9或序列编号11的任一项所述的氨基酸序列中的第367~480位氨基酸序列、且含有下述(ii-1)的氨基酸序列的肽,该肽为具有血栓调节蛋白活性的肽;(ii-1)序列编号9或序列编号11的任一项所述的氨基酸序列中的第19~244位氨基酸序列。[15]一种用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的方法,其中,该方法包括将血栓调节蛋白对哺乳动物进行给药的工序。[15-2]如上述[15]所述的方法,其具有上述[1]~[14-4]中所述的特征。[16]血栓调节蛋白在用于制造下述药物中的应用,该药物用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛。[16-2]如上述[16]所述的应用,其具有上述[1]~[14-4]中所述的特征。[17]一种用于对给予了抗癌剂的哺乳类动物进行该抗癌剂所致的末梢神经障碍性疼痛的预防和/或治疗的方法,其中,该方法包括将血栓调节蛋白对该哺乳动物进行给药的工序。[17-2]如上述[17]所述的方法,其具有上述[1]~[14-4]中所述的特征。[17-3]如上述[17]所述的方法,其中,该方法包括与该抗癌剂同时或者改变时间对该该哺乳动物给予血栓调节蛋白的工序。发明的效果利用本发明,能够有效地预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛。在此之前,为了应对抗癌剂所致的末梢神经障碍性疼痛,不得不减少抗癌剂的量或中断癌化学疗法,而利用本发明,能够继续适当的癌化学疗法,能够对患者生活质量的提高做出贡献。附图说明图1为利用冯弗雷试验对血栓调节蛋白针对由于紫杉醇给药而产生的机械性异常疼痛的预防效果进行研究的结果。白色下箭头:紫杉醇4mg/kg给药、黑色下箭头:TMD123给药、○:溶剂给药组、●:PTX给药组、△:PTX+0.1mg/kg-TMD123给药组、灰色△:PTX+1mg/kg-TMD123给药组、▲:PTX+10mg/kg-TMD123给药组、*:p<0.05、**:p<0.01(与溶剂组的比较)、p<0.05、p<0.001(与PTX给药组的比较)图2为与图1同样地利用冯弗雷试验对血栓调节蛋白针对由于紫杉醇给药而产生的机械性异常疼痛的治疗效果进行研究的结果。●:PTX给药组、△:PTX+10mg/kg-TMD123给药组、p<0.05(与PTX给药组的比较)、rhTMα:TMD123。图3为与图1同样地利用Randall-Selitto试验使用大鼠对血栓调节蛋白针对由于紫杉醇给药而产生的机械性异常疼痛的治疗效果进行研究的结果。白色下箭头:紫杉醇2mg/kg给药、黑色下箭头:TMD123给药、○:溶剂给药组、■:PTX给药组、△:PTX+10mg/kg-TMD123给药组、*:p<0.05、**:p<0.01(与溶剂组的比较)、p<0.05、p<0.01(与PTX给药组的比较)具体实施方式下面对本发明的几个优选方式(用于实施本发明的优选方式,以下在本说明书中有时简称为“实施方式”)进行具体说明,但本发明的范围并不限定于下述说明的特定方式。对于本实施方式的作为抗癌剂所致的末梢神经障碍性疼痛的预防剂和/或治疗剂的有效成分有用的血栓调节蛋白,可以举出可溶性血栓调节蛋白。本实施方式中的血栓调节蛋白已知具有(1)与凝血酶选择性地结合、(2)促进基于凝血酶的蛋白C的活化的作用。另外,优选通常可确认到:(3)延长基于凝血酶的凝血时间的作用、(4)抑制基于凝血酶的血小板聚集的作用、和/或(5)抗炎作用。有时将这些血栓调节蛋白所具有的作用成为血栓调节蛋白活性。作为血栓调节蛋白活性,具有上述(1)和(2)的作用,优选进一步具有上述(1)~(4)的作用。另外,作为血栓调节蛋白活性,更优选具备全部(1)~(5)的作用。血栓调节蛋白与凝血酶的结合作用例如可通过以ThrombosisandHaemostasis199370(3):418-422或TheJournalofBiologicalChemistry1989264(9):4872-4876为代表的各种公知文献中所记载的试验方法来进行确认。对于促进基于凝血酶的蛋白C的活化的作用,例如可以通过以日本特开昭64-6219号公报为代表的各种公知文献中明确记载的试验方法来容易地确认促进蛋白C的活化的作用的活性量或其有无。此外,对于延长基于凝血酶的凝血时间的作用和/或抑制基于凝血酶的血小板凝集的作用也同样可以容易地进行确认。进一步地,关于抗炎作用,例如可以通过以Blood2008112:3361-3670、TheJournalofClinicalInvestigation2005115(5):1267-1274为代表的各种公知文献中记载的试验方法来进行确认。作为本实施方式中的血栓调节蛋白,只要具有血栓调节蛋白活性即可,没有特别限定,优选在不存在表面活性剂的情况下可溶于水的可溶性血栓调节蛋白。作为可溶性血栓调节蛋白的溶解性的优选示例,可以举出在水、例如注射用蒸馏水(在不存在TritonX-100或聚多卡醇等表面活性剂的情况下,通常在中性附近)中为1mg/mL以上、或10mg/mL以上,优选为15mg/mL以上、或17mg/mL以上,进一步优选可示例出20mg/mL以上、25mg/mL以上、或30mg/mL以上,特别优选可以举出60mg/mL以上,根据情况可以分别举出80mg/mL以上、或100mg/mL以上。判断可溶性血栓调节蛋白是否能够溶解时,溶解后,在例如白色光源的正下方、约1000lux亮度的位置进行肉眼观察,将此时澄清、不含有可清楚确认的程度的不溶性物质的情况理解为明显的指标。此外,也可以过滤确认有无残渣。如上所示,血栓调节蛋白只要具有血栓调节蛋白活性则对其分子量即没有限定,作为分子量的上限,优选为100,000以下、更优选为90,000以下、进一步优选为80,000以下、特别优选为70,000以下,作为分子量的下限,进一步优选为50,000以上、特别优选为60,000以上。可溶性血栓调节蛋白的分子量可以利用测定蛋白质的分子量的常规方法容易地测定,优选利用质量分析法测定,更优选MALDI-TOF-MS法。为了获得目的范围分子量的可溶性血栓调节蛋白,如后所述,可以如下获得:利用载体将编码可溶性血栓调节蛋白的DNA转染到宿主细胞来制备转化细胞,对该转化细胞进行培养,从而获得可溶性血栓调节蛋白,利用柱色谱法等对该可溶性血栓调节蛋白进行分级,由此获得上述目的范围分子量的可溶性血栓调节蛋白。作为本实施方式中的血栓调节蛋白,优选包含人类血栓调节蛋白中作为血栓调节蛋白活性的中心部位已知的序列编号1的第19~132位氨基酸序列,只要包含序列编号1的第19~132位氨基酸序列就没有特别限定。该序列编号1的第19~132位氨基酸序列只要具有促进基于凝血酶的蛋白C的活化的作用、即血栓调节蛋白活性,则也可以发生自然或人工变异,即可以在序列编号1的第19~132位氨基酸序列中有1个或2个以上的氨基酸发生取代、缺失、添加。所容许的变异程度没有特别限定,只要具有血栓调节蛋白活性即可,例如作为氨基酸序列,可以示例出50%以上的同源性,优选为70%以上的同源性、更优选为80%以上的同源性、进一步优选为90%以上的同源性、特别优选为95%以上的同源性、最优选为98%以上的同源性。像这样在氨基酸序列中有1个或2个以上的氨基酸发生取代、缺失、添加而成的氨基酸序列被称为相同变异序列。对于这些变异,如后所述,只要使用通常的基因操作技术就能够容易地获得。对于血栓调节蛋白,只要具有上述序列、至少作为血栓调节蛋白整体具有与凝血酶选择性地结合来促进基于凝血酶的蛋白C的活化的作用即可,没有特别限定,但优选同时具有抗炎作用。序列编号3的序列为序列编号1的第125位氨基酸Val变异为Ala所得到的序列,作为本实施方式中的血栓调节蛋白,也优选包含序列编号3的第19~132位氨基酸序列。如此地,作为本实施方式中的血栓调节蛋白,只要包含序列编号1或序列编号3的第19~132位的序列、或者至少具有上述序列的相同变异序列且至少具有血栓调节蛋白活性的肽序列即可,没有特别限定,作为优选的实例,可以举出由序列编号1或序列编号3中的第19~132位或第17~132位的序列形成的肽、或由上述序列的相同变异序列形成的至少具有血栓调节蛋白活性的肽,更优选由序列编号1或序列编号3的第19~132位的序列形成的肽。此外,也存在更优选由序列编号1或序列编号3中的第19~132位或第17~132位的相同变异序列形成的至少具有血栓调节蛋白活性的肽的其它方式。此外,作为本实施方式中的血栓调节蛋白的其它方式,优选包含序列编号5的第19~480位氨基酸序列,只要包含序列编号5的第19~480位氨基酸序列,则没有特别限定。该序列编号5的第19~480位氨基酸序列也可以为其相同变异序列,只要具有促进基于凝血酶的蛋白C的活化的作用、即血栓调节蛋白活性即可。序列编号7的序列为序列编号5的第473位氨基酸Val变异为Ala所得到的序列,作为本实施方式中的血栓调节蛋白,也优选包含序列编号7的第19~480位氨基酸序列。如此地,作为本实施方式中的血栓调节蛋白,只要包含序列编号5或序列编号7的第19~480位的序列、或至少具有上述序列的相同变异序列且至少具有血栓调节蛋白活性的肽序列即可,没有特别限定,作为优选的实例,可以举出由序列编号5或序列编号7中的第19~480位或第17~480位的序列形成的肽、或由上述序列的相同变异序列形成的至少具有血栓调节蛋白活性的肽,更优选由序列编号5或序列编号7的第19~480位的序列形成的肽。此外,也存在更优选由序列编号5或序列编号7中的第19~480位或第17~480位的相同变异序列形成的至少具有血栓调节蛋白活性的肽的其它方式。此外,作为本实施方式中的血栓调节蛋白的其它方式,优选包含序列编号9的第19~515位氨基酸序列,只要包含序列编号9的第19~515位氨基酸序列,就没有特别限定。该序列编号9的第19~515位氨基酸序列也可以为其相同变异序列,只要具有促进基于凝血酶的蛋白C的活化的作用、即血栓调节蛋白活性即可。序列编号11的序列为序列编号9的第473位氨基酸Val变异为Ala所得到的序列,作为本实施方式中的血栓调节蛋白,还优选包含序列编号11的第19~515位氨基酸序列。如此地,作为本实施方式中的血栓调节蛋白,只要包含序列编号9或序列编号11的第19~515位的序列、或至少具有上述序列的相同变异序列且至少具有血栓调节蛋白活性的肽序列,就没有特别限定,作为优选的实例,可以举出由序列编号9或序列编号11中的第19~516位、第19~515位、第17~516位、或第17~515位的序列形成的肽、或由上述序列的相同变异序列形成的至少具有血栓调节蛋白活性的肽,特别优选由序列编号9中的第19~516位、第19~515位、第17~516位、或第17~515位的序列形成的肽。还可以举出它们的混合物作为优选的实例。此外,也存在特别优选由序列编号11中的第19~516位、第19~515位、第17~516位、或第17~515位的序列形成的肽的其它方式。还可以举出它们的混合物作为优选的实例。进一步地,还可以举出由上述序列的相同变异序列形成的至少具有血栓调节蛋白活性的肽作为优选的实例。血栓调节蛋白优选同时具有抗炎作用。如上所述,具有相同变异序列的肽是指作为对象的肽的氨基酸序列中可以有1个以上、即1个或2个以上的氨基酸、进一步优选有多个(例如1至20个、优选1至10个、更优选1至5个、特别优选1至3个)氨基酸发生取代、缺失、添加所得到的肽。对所容许的变异程度没有特别限定,只要具有血栓调节蛋白活性即可,例如作为氨基酸序列,可示例出50%以上的同源性、优选70%以上的同源性、更优选80%以上的同源性、进一步优选90%以上的同源性、特别优选95%以上的同源性、最优选98%以上的同源性。进一步地,作为本实施方式中的血栓调节蛋白,还可以举出日本特开昭64-6219中的由序列编号14(462个氨基酸残基)形成的肽、由序列编号8(272个氨基酸残基)形成的肽、或由序列编号6(236个氨基酸残基)形成的肽作为优选的实例。作为本实施方式中的血栓调节蛋白没有特别限定,只要为至少具有序列编号1或序列编号3的第19~132位氨基酸序列的肽即可,其中优选至少具有序列编号5或序列编号7的第19~480位氨基酸序列的肽,更优选至少具有序列编号9或序列编号11的第19~515位氨基酸序列的肽。作为至少具有序列编号9或序列编号11的第19~515位氨基酸序列的肽,可以举出由序列编号9或序列编号11各自中的第19~516位、第19~515位、第19~514位、第17~516位、第17~515位、或第17~514位的序列形成的肽作为更优选的实例。此外,还可以举出由序列编号9或序列编号11各自中的第19~516位、第19~515位、第19~514位、第17~516位、第17~515位、或第17~514位的序列形成的肽的针对序列编号9或序列编号11各自的混合物作为更优选的实例。在上述混合物的情况下,作为由序列编号9或序列编号11各自中的从第17位开始的肽与从第19位开始的肽的混合比例,可以示例出(30:70)~(50:50),可以举出(35:65)~(45:55)作为优选的实例。此外,作为序列编号9或序列编号11各自中的在第514位、第515位以及第516位终止的肽的混合比例,可示例出(0:0:100)~(0:90:10),根据情况可示例出(0:70:30)~(10:90:0)、(10:0:90)~(20:10:70)。这些肽的混合比例可以通过常规方法求得。需要说明的是,序列编号1的第19~132位的序列相当于序列编号9的第367~480位的序列,序列编号5的第19~480位的序列相当于序列编号9的第19~480位的序列。此外,序列编号3的第19~132位的序列相当于序列编号11的第367~480位的序列,序列编号7的第19~480位的序列相当于序列编号11的第19~480位的序列。进而,序列编号1、3、5、7、9、和11各自中的第1~18位的序列全部为相同的序列。如后所述,这些本实施方式中的血栓调节蛋白可由转化细胞获得,该转化细胞是通过将编码这些肽的DNA(具体地说,为序列编号2、序列编号4、序列编号6、序列编号8、序列编号10、或序列编号12等碱基序列)利用载体转染到宿主细胞中而制备的。进一步地,这些肽具有上述氨基酸序列即可,可以带有糖链或不带糖链,对于这一点没有特别限定。另外,在基因操作中,根据所使用的宿主细胞种类的不同,糖链的种类、附加位置或附加的程度也会不同,可以任意使用。对于糖链的结合位置和种类,已知有日本特开平11-341990号公报中记载的内容,对于本实施中的血栓调节蛋白有时也可以在相同的位置附加相同的糖链。本实施方式的血栓调节蛋白结合岩藻糖基化双触角型与岩藻糖基化三触角型这两种N结合型糖链,其比例可示例出(100:0)~(60:40),优选为(95:5)~(60:40),可以举出(90:10)~(70:30)作为更优选的实例。这些糖链的比例可以通过《生物化学実験法23糖蛋白質糖鎖研究法(生物化学实验法23糖蛋白糖链研究法)》、学会出版中心(1990年)等中记载的二维糖链图谱进行测定。进一步地,在研究本实施方式的血栓调节蛋白的糖组成时,检测出中性糖、氨基糖和唾液酸,相对于蛋白质含量,各自独立地以重量比计示例出1%~30%的比例,优选为2%~20%、更优选为5%~10%。这些糖含量可以通过《新生化学実験講座3糖質I糖タンパク質(上)(新生物化学实验讲座3糖质I糖蛋白(上))》、东京化学同人(1990年)中记载的方法(中性糖:苯酚-硫酸法、氨基糖:Elson-Morgan法、唾液酸:高碘酸-间苯二酚法)进行测定。如后所述,血栓调节蛋白的获得并不限于通过基因操作来获得,但在通过基因操作来获得的情况下,作为可以在表达时使用的信号序列,可以利用编码序列编号9的第1~18位氨基酸序列的碱基序列、编码序列编号9的第1~16位氨基酸序列的碱基序列、其它公知的信号序列,该其它公知的信号序列例如为人组织型纤溶酶原激活剂的信号序列(国际公开88/9811号公报)。在将编码血栓调节蛋白的DNA序列导入到宿主细胞中的情况下,优选将编码血栓调节蛋白的DNA序列插入到载体、特别优选插入到可在动物细胞中表达的表达载体中来进行导入的方法。表达载体指的是由启动子序列、对mRNA赋予核糖体结合部位的序列、编码要表达的蛋白的DNA序列、剪接信号、转录结束的终止子序列、复制起始序列等构成的DNA分子,作为优选的动物细胞表达载体的示例,可以举出MulliganRC等人[ProcNatlAcadSciUSA1981,78:2072-2076]所报告的pSV2-X、或HowleyPM等人[MethodsinEmzymology1983,101:387-402、AcademicPress]所报告的pBP69T(69-6)等。此外,也存在导入到能够在微生物中表达的表达载体中的其它优选方式。作为可以在制备这些肽时使用的宿主细胞,可以举出动物细胞。作为动物细胞,可以举出中国仓鼠卵巢(CHO)细胞、COS-1细胞、COS-7细胞、VERO(ATCCCCL-81)细胞、BHK细胞、犬肾来源的MDCK细胞、仓鼠AV-12-664细胞等,此外,作为人源细胞,可以举出HeLa细胞、WI38细胞、人293细胞、PER.C6细胞。通常非常优选CHO细胞,在CHO细胞中,进一步优选二氢叶酸还原酶(DHFR)缺陷CHO细胞。此外,在基因操作的过程或肽的制造过程中,还大多使用大肠杆菌等微生物,优选使用适合各自的宿主-载体系统,在上述的宿主细胞中也可以选择适宜的载体系统。在基因重组技术中使用的血栓调节蛋白的基因已经过克隆化,并且血栓调节蛋白的利用基因重组技术的制造例已被公开,此外用于得到其精制品的精制方法也是已知的[日本特开昭64-6219号公报、日本特开平2-255699号公报、日本特开平5-213998号公报、日本特开平5-310787号公报、日本特开平7-155176号公报、JBiolChem1989,264:10351-10353]。因此,本实施方式中使用的血栓调节蛋白可以通过使用上述报告中记载的方法或按照这些报告中记载的方法进行制造。例如在日本特开昭64-6219号公报中公开了含有包含编码全长血栓调节蛋白的DNA的质粒pSV2TMJ2的EscherichiacoliK-12strainDH5(ATCC保藏编号67283号)。此外,还可以使用将该菌株在生命研(现独立行政法人产业技术综合研究所专利生物保藏中心)保藏的菌株(EscherichiacoliDH5/pSV2TMJ2)(FERMBP-5570)。可以将编码该全长血栓调节蛋白的DNA作为原料,通过公知的基因操作技术来制备本实施方式的血栓调节蛋白。本实施方式中的血栓调节蛋白利用现有公知的方法或或按照现有公知的方法来制备即可,例如可参照上述山本等人的方法[日本特开昭64-6219号公报]、或日本特开平5-213998号公报。即,通过基因操作技术将人源的血栓调节蛋白基因制成例如编码序列编号9的氨基酸序列的DNA,进而也可以根据需要进行改变。作为该改变,例如为了制成编码序列编号11的氨基酸序列的DNA(具体地说由序列编号12的碱基序列构成),根据ZollerMJ等人[MethodsinEnzymology1983,100:468-500、AcademicPress]的方法,对编码序列编号9的第473位氨基酸的密码子(特别是序列编号10的第1418位的碱基)进行定点突变。例如,可以使用具有序列编号13所示的碱基序列的变异用合成DNA来制成序列编号10的第1418位的碱基T转换成碱基C的DNA。可以将如此制备的DNA插入到例如中国仓鼠卵巢(CHO)细胞中来制成转化细胞,进行适宜选择,对该细胞进行培养,利用公知的方法从所得到的培养液中制备精制的血栓调节蛋白。如上所述,优选将编码序列编号9的氨基酸序列的DNA(序列编号10)转染到上述宿主细胞中。本实施方式中的血栓调节蛋白的生产方法并不限于上述的方法,例如也可以从尿、血液、其它体液等中进行提取精制,此外还可从生产血栓调节蛋白的组织或这些组织培养液等中进行提取精制,并且可根据需要进一步利用蛋白分解酶进行切断处理。在培养上述的转化细胞时,可以使用在通常的细胞培养中使用的培养基,优选事先利用各种培养基培养该该转化细胞,选择最佳的培养基。例如,将MEM培养基、DMEM培养基、199培养基等公知的培养基作为基本培养基,进一步添加改良物或各种培养基用的补充物,使用所得到的培养基即可。作为培养方法,可以举出在添加了血清的培养基中进行培养的血清培养、或在未添加血清的培养基中进行培养的无血清培养。对培养方法没有特别限定,优选无血清培养。在血清培养中,向培养基中添加血清的情况下,优选牛血清。牛血清有胎牛血清、新生小牛血清、小牛血清、成牛血清等,只要是适于细胞培养的牛血清,任何一种均可使用。另一方面,在无血清培养中,所使用的无血清培养基可以使用市售的培养基。适于各种细胞的无血清培养基是有市售的,例如对于CHO细胞,有Invitrogen社所售的CD-CHO、CHO-S-SFMII、CHO-III-PFM,有IrvineScientific社所售的ISCHO、ISCHO-CD培养基等。这些培养基可以直接使用,也可以添加改良物或补充物进行使用。进而,作为无血清培养基,可以示例出分别以5mg/L的方式添加胰岛素、转铁蛋白以及亚硒酸而得到的DMEM培养基。如此,只要是能干产生本实施方式的血栓调节蛋白的培养基就没有特别限定。培养方法没有特别限定,可以为分批培养、反复分批培养、补料分批培养、灌注培养等任意培养法。通过上述细胞培养方法制造本实施方式中的血栓调节蛋白的情况下,有时通过蛋白质的翻译后修饰会在N末端氨基酸中确认到多样性。例如,序列编号9中的第17位、18位、19位、或22位氨基酸有时为N末端。此外,例如像第22位的谷氨酸转换为焦谷氨酸那样,有时N末端氨基酸会被修饰。优选第17位或19位氨基酸形成N末端、更优选第19位氨基酸形成N末端。此外,还存在优选第17位氨基酸形成N末端的其它方式。关于上述修饰或多样性等,在序列编号11中也可以举出同样示例。进一步地,使用具有序列编号10的碱基序列的DNA制造可溶性血栓调节蛋白的情况下,有时确认到C末端氨基酸的多样性,有时会制造出少1个氨基酸残基的肽。即,如第515位氨基酸形成C末端、并且该第515位被酰胺化的情况那样,有时C末端氨基酸被修饰。此外,有时还会制造出少2个氨基酸残基的肽。即,有时第514位氨基酸形成C末端。从而,有可能制造出N末端氨基酸和C末端氨基酸富于多样性的肽或它们的混合物。优选第515位氨基酸或第516位氨基酸形成C末端、更优选第516位氨基酸形成C末端。此外还存在优选第514位氨基酸形成C末端的其它方式。关于上述修饰或多样性等,在具有序列编号12的碱基序列的DNA中也是同样的。通过上述方法得到的血栓调节蛋白有时为在N末端和C末端确认到多样性的肽的混合物。具体地说,可以举出由序列编号9中的第19~516位、第19~515位、第19~514位、第17~516位、第17~515位、或者第17~514位的序列形成的肽的混合物。接下来,关于从通过上述获得的培养上清或培养物中分离精制血栓调节蛋白的方法,可以根据公知的方法[堀尾武一编集、蛋白質·酵素の基礎実験法(蛋白质·酶的基础实验法)、1981]来进行。例如还优选使用固定了具有与血栓调节蛋白相反电荷的官能团的色谱载体以及利用了血栓调节蛋白间的相互作用的离子交换色谱或吸附色谱。此外,还可以举出利用了与血栓调节蛋白的特异性亲和性的亲和色谱作为优选的实例。作为吸附体的优选实例,可以举出利用血栓调节蛋白的配体即凝血酶或血栓调节蛋白的抗体的示例。作为该抗体,可以利用具有适宜性质、或识别出适宜表位的血栓调节蛋白的抗体,例如可以举出日本特公平5-42920号公报、日本特开昭64-45398号公报、日本特开平6-205692号公报等中记载的示例。此外,还可以举出利用血栓调节蛋白的分子量大小的凝胶过滤色谱或超滤。并且还可以举出固定了疏水性基团的色谱载体、以及利用了血栓调节蛋白所具有的的疏水性部位间的疏水键合的疏水性色谱。此外,作为吸附色谱还可以使用羟基磷灰石作为载体,例如可以举出日本特开平9-110900号公报中记载的示例。这些方法可以适宜组合。精制的程度可以根据使用目的等进行选择,优选进行纯化直至例如以单一带的形式得到电泳(优选SDS-PAGE)的结果、或者分离精制品的凝胶过滤HPLC或反相HPLC的结果形成单一的峰。当然,在使用两种以上的血栓调节蛋白的情况下,优选实质上形成仅为血栓调节蛋白的带,不要求形成单一带。若具体地示例出本实施方式中的精制法,则可以举出以血栓调节蛋白活性为指标进行精制的方法,例如可以举出下述精制方法:利用离子交换柱的Q-琼脂糖凝胶FastFlow对培养上清或培养物进行粗精制,回收具有血栓调节蛋白活性的级分,接着利用亲和柱的DIP-凝血酶-琼脂糖(diisopropylphosphorylthrombinagarose)柱进行主精制,回收血栓调节蛋白活性强的级分,将回收级分浓缩,进行凝胶过滤,以纯品的形式获得血栓调节蛋白活性级分[GomiKetal、Blood1990;75:1396-1399]。关于作为指标的血栓调节蛋白活性,可以举出例如基于凝血酶的蛋白C活化的促进活性。此外,如下示例出优选的精制法。选择与血栓调节蛋白具有良好的吸附条件的适当的离子交换树脂,进行离子交换色谱精制。作为特别优选的实例,为使用经含有0.18mol/LNaCl的0.02mol/L三羟甲基氨基甲烷盐酸盐缓冲液(pH7.4)进行了平衡的Q-琼脂糖凝胶FastFlow的方法。在适宜清洗后,例如可以利用含有0.3mol/LNaCl的0.02mol/L三羟甲基氨基甲烷盐酸盐缓冲液(pH7.4)进行洗脱,得到粗精制品的血栓调节蛋白。接着,例如可以将与血栓调节蛋白具有特异性亲和性的物质固定于树脂,进行亲和色谱精制。作为优选的实例,可以举出DIP-凝血酶-琼脂糖柱的示例以及抗血栓调节蛋白单克隆的抗体柱的示例。DIP-凝血酶-琼脂糖柱预先利用例如含有100mmol/LNaCl和0.5mmol/L氯化钙的20mmol/L三羟甲基氨基甲烷盐酸盐缓冲液(pH7.4)进行平衡,填充上述粗精制品,进行适宜清洗,利用例如含有1.0mol/LNaCl和0.5mmol/L氯化钙的20mmol/L三羟甲基氨基甲烷盐酸盐缓冲液(pH7.4)进行洗脱,从而可以获得精制品的血栓调节蛋白。此外,在抗血栓调节蛋白单克隆的抗体柱中,可示例出下述方法:使溶解有抗血栓调节蛋白单克隆抗体的含有0.5mol/LNaCl的0.1mol/LNaHCO3缓冲液(pH8.3)与预先利用CNBr进行了活化的琼脂糖凝胶4FF(GEHealthcareBio-Sciences社)接触,将填充有琼脂糖凝胶4FF与抗血栓调节蛋白单克隆抗体偶联得到的树脂的柱预先利用例如含有0.3mol/LNaCl的20mmol/L磷酸盐缓冲液(pH7.3)进行平衡,适宜清洗后,用例如含有0.3mol/LNaCl的100mmol/L甘氨酸盐酸缓冲液(pH3.0)进行洗脱。洗脱液用适当的缓冲液中和,也可获得精制品。接着将所得到的精制品调整至pH3.5,之后填充到用含有0.3mol/LNaCl的100mmol/L甘氨酸盐酸缓冲液(pH3.5)平衡后的阳离子交换体、优选强阳离子交换体SP-琼脂糖凝胶FF(GEHealthcareBio-Sciences社)中,用相同缓冲液进行清洗,得到非吸附级分。所得到的级分利用适当的缓冲液中和,可获得高纯度精制品。它们优选通过超滤进行浓缩。进一步地,还优选通过凝胶过滤进行缓冲液交换。例如,可以向用含有50mmol/LNaCl的20mmol/L磷酸盐缓冲液(pH7.3)平衡后的SephacrylS-300柱或者S-200柱中填充通过超滤进行了浓缩的高纯度精制品,利用含有50mmol/LNaCl的20mmol/L磷酸盐缓冲液(pH7.3)展开分级,对基于凝血酶的蛋白C活化的促进活性进行确认,回收活性级分,可以得到经缓冲液交换的高纯度精制品。对于如此得到的高纯度精制品,为了提高安全性,优选使用适当的病毒去除膜、例如Planova15N(旭化成医疗株式会社)进行过滤,其后可通过超滤浓缩至目的浓度。优选最后利用无菌过滤膜进行过滤。本实施方式中的“癌化学疗法”是指使用抗癌剂对癌进行治疗的方法。作为本实施方式中的“抗癌剂”,只要是具有抗癌作用、且通过给药而呈现出末梢神经障碍性疼痛的症状作为副作用的药剂就没有特别限定,例如可以举出抑制核酸代谢的抗癌剂(铂制剂等)、抑制微管聚合的抗癌剂(长春花生物碱类药剂)、抑制微管去聚合的抗癌剂(紫杉烷类药剂)、具有激素拮抗作用的抗癌剂(抗雌激素剂等)、抑制细胞内信号传递的抗癌剂(蛋白酶体抑制剂等)、分子靶向特异性作用于恶性肿瘤的抗癌剂(酪氨酸激酶抑制剂、抗体制剂等)、或者具有非特异性免疫活化作用的抗癌剂(溶血性链球菌制剂等),优选抑制核酸代谢的抗癌剂或者抑制微管聚合或去聚合的抗癌剂。例如,作为抗癌剂,可以举出选自由紫杉烷类药剂和铂制剂组成的组中的一种以上的抗癌剂,优选紫杉烷类药剂或铂制剂、更优选紫杉烷类药剂。此外还有优选铂制剂作为其它方式的情况。作为紫杉烷类制剂,可以举出紫杉醇、多烯紫杉醇、或者他莫昔芬等,优选为选自由紫杉醇和多烯紫杉醇组成的组中的一种以上,更优选紫杉醇。作为铂制剂,可以举出奥沙利铂、顺铂、卡铂、或者奈达铂等,优选为选自由奥沙利铂、顺铂、卡铂以及奈达铂组成的组中的一种以上,优选奥沙利铂。关于作为本实施方式药物的预防和/或治疗的对象的抗癌剂所致的末梢神经障碍性疼痛,不消说包括使用一种抗癌剂的单剂疗法所致的末梢神经障碍性疼痛,还包括组合给予作用机制不同的2种以上的药剂的多剂合用疗法所致的末梢神经障碍性疼痛。作为多剂合用疗法,例如可以举出FOLFOX疗法或FOLFIRI疗法等,但并不限定于这些疗法。作为本实施方式药物的适用对象,例如优选FOLFOX疗法。此外,还有优选FOLFIRI疗法作为其它方式的情况。FOLFOX疗法为组合奥沙利铂、氟尿嘧啶和左亚叶酸盐来进行的癌化学疗法之一。FOLFOX疗法根据给药方法例如可分类为FOLFOX2、FOLFOX3、FOLFOX4、FOLFOX6、mFOLFOX6、FOLFOX7、mFOLFOX7等。FOLFIRI疗法为组合伊立替康、氟尿嘧啶、左亚叶酸盐或者甲酰四氢叶酸来进行的癌化学疗法之一。作为抑制核酸代谢的抗癌剂,例如可以举出烷基化剂(例如环磷酰胺、尼莫司汀)、抗肿瘤性抗生素(例如多柔比星、丝裂霉素C、博来霉素)、拓扑异构酶抑制剂(例如伊立替康、依托泊苷)、铂制剂(例如顺铂、卡铂、奥沙利铂)、嘧啶代谢抑制剂(例如巯基嘌呤、氟达拉宾)、或者叶酸合成抑制剂(例如甲氨蝶呤)。其中优选铂制剂,从奥沙利铂为最容易引起末梢神经障碍性疼痛的抗癌剂、强烈希望治疗该末梢神经障碍性疼痛的方法的方面考虑,更优选奥沙利铂。作为抑制微管聚合或去聚合的抗癌剂,可以举出长春花生物碱类药剂(例如长春新碱、长春碱)、紫杉烷类药剂(例如紫杉醇、多烯紫杉醇、他莫昔芬)、或者抗雄激素剂(例如氟他胺)。其中优选紫杉烷类药剂、更优选紫杉醇。作为具有激素拮抗作用的抗癌剂,可以举出例如抗雌激素剂(例如他莫昔芬)或抗雄激素剂(例如氟他胺)。作为抑制细胞内信号传递的抗癌剂,可以举出例如蛋白酶体抑制剂(例如硼替佐米)。作为分子靶向特异性作用于恶性肿瘤的抗癌剂,可以举出例如BCR/ABL酪氨酸激酶抑制剂(例如伊马替尼)、EGFR酪氨酸激酶抑制剂(例如吉非替尼)、抗体制剂(例如利妥昔单抗、曲妥珠单抗、托珠单抗)、或者砷制剂。作为具有非特异性免疫活化作用的抗癌剂,例如可以举出溶血性链球菌制剂或云芝多糖体制剂可以举出。本实施方式中的“抗癌剂所致的末梢神经障碍性疼痛”是指由于给予如上述示例出的抗癌剂而产生的末梢神经障碍性疼痛。也将其称为“化学疗法所致的末梢神经障碍性疼痛”。作为末梢神经障碍性疼痛,可以举出四肢麻木、四肢疼痛、深部肌腱反射降低、肌力降低、异常疼痛、痛觉过敏和运动功能障碍。此外,作为末梢神经障碍性疼痛,还可示例出刺痛或灼痛等疼痛、四肢末端的麻木、灼热感等知觉异常、冷感刺激所致的过敏等的觉过敏、感觉消失·感觉麻痹或不适感等感觉异常、知觉性运动失调、肌力降低。异常疼痛(allodynia)通常是指将不会引起疼痛的刺激(例如轻接触或压迫、轻度低温刺激)感知为疼痛的症状。在抗癌剂所致的异常疼痛中,有抗癌剂刚给药后所出现的急性异常疼痛以及随着持续进行抗癌剂治疗而迟发性表现出的慢性异常疼痛,这些异常疼痛也包含在本实施方式中的抗癌剂所致的末梢神经障碍性疼痛中。急性异常疼痛在奥沙利铂中为特征性的。作为抗癌剂所致的异常疼痛的诊断基准,使用DEB-NTC(Debiopharm社:神经症状-感觉性毒性基准)或CTCAE(通用不良事件术语标准)等。在本实施方式中,作为末梢神经障碍性疼痛中的异常疼痛,只要为将通常不会引起疼痛的刺激感知为疼痛的症状,就没有特别限定,例如可以举出机械性异常疼痛或冷性异常疼痛,优选机械性异常疼痛。此外,作为其它方式,也有优选冷性异常疼痛的情况。作为机械性异常疼痛,可以举出将通常不会引起疼痛的触觉刺激感知为疼痛的症状。例如可以举出难以进行扣上衬衫的扣子、取出钱包中的硬币、歩行等日常动作等的症状。作为冷性异常疼痛,可以举出将通常不会引起疼痛的低温刺激感知为疼痛的症状。例如可以举出难以进行使用水的烹调或洗涤、拿住装有水的杯子、冬季外出等日常动作等的症状。在本实施方式中,血栓调节蛋白可以在给予抗癌剂之前进行给药(预防性给药),并且也可以在给予抗癌剂之后进行给药(治疗性给药)。优选在给予抗癌剂之后进行给药。此外,作为其它方式,有时也优选在给予抗癌剂之前进行给药。进而也可将血栓调节蛋白与抗癌剂同时给药。如下述试验例1所示,在即将给予抗癌剂之前或与给予抗癌剂同时给予血栓调节蛋白为优选的预防性给药方式之一。此外,在预防性给药或治疗性给药的任一方式中,均可在给予抗癌剂的过程中给予血栓调节蛋白。从效果持续性的方面出发,优选预防性给药。换言之,作为本实施方式中的药物,优选用于预防抗癌剂所致的末梢神经障碍性疼痛的药物。在给予抗癌剂之前给予血栓调节蛋白的情况下,关于在抗癌剂给药之前的何时给予血栓调节蛋白没有特别限定,只要可发挥出预防末梢神经障碍性疼痛的效果即可,优选在抗癌剂给药前的9天之内、更优选7天之内、进一步优选5天之内、特别优选3天之内、最优选1天之内。作为其它方式,尤其优选12小时之内。例如,可以在抗癌剂给药前与用于预防过敏性休克的类固醇剂同时、或者分别给予血栓调节蛋白。此外,通常在经静脉内点滴给药给予抗癌剂时,也可以与即将给予抗癌剂时所给予的止吐剂、抗过敏剂和/或抗炎剂等一起、或者在它们之前、或者在其(它们)给药之后、且在抗癌剂给药之前给予血栓调节蛋白。在抗癌剂给药之后给予血栓调节蛋白的情况下,关于在抗癌剂给药之后的何时给予血栓调节蛋白没有特别限定,只要可发挥出治疗末梢神经障碍性疼痛的效果即可,优选在抗癌剂给药后的8天之内、更优选6天之内、进一步优选4天之内、特别优选2天之内、最优选6小时之内。作为其它方式,尤其优选1小时之内。本实施方式中的药物可以含有载体。作为可在本发明中使用的载体,优选水溶性的载体,例如,可以加入蔗糖、甘油等以及其它无机盐的pH调节剂等作为添加剂来进行制备。进而,根据需要,可以如日本特开平1-6219号公报和日本特开平6-321805号公报中所公开的那样添加氨基酸、盐类、糖质、表面活性剂、白蛋白、明胶等,此外还优选添加防腐剂,例如可以举出对苯甲酸酯类作为优选的实例,可以举出对苯甲酸甲酯作为特别优选的实例。防腐剂的添加量通常可示例出0.01%~1.0%(表示重量%、以下相同),优选可以举出0.1%~0.3%。它们的添加方法没有特别限定,可以举出下述方法:在为冷冻干燥的情况下,如通常所进行的那样,例如在将含有抗癌剂的溶液与含有血栓调节蛋白的溶液混合后,添加混合添加物的方法;或者预先将添加物混合到溶解于水、注射用蒸馏水或者适当的缓冲液中的抗癌剂中,之后添加混合含有血栓调节蛋白的溶液,利用该方法制备溶液,进行冷冻干燥的方法。本实施方式中的药物为将各药剂成分组合而成的药剂的情况下,各药剂优选通过适宜的制造方法添加载体来进行制造。作为本实施方式中的药物,可以以注射液的形态提供,或者也可以以在使用时溶解冷冻干燥制剂来进行使用的形态来提供。在制剂化工序中,可以示例出下述方法:向安瓿或小瓶中填充例如0.5mL~10mL的在水、注射用蒸馏水或者适当的缓冲液中含有0.05mg/mL~15mg/mL(适宜为0.1mg/mL~5mg/mL)的血栓调节蛋白、以及上述添加物的溶液,之后进行冷冻,在减压下进行干燥。或者可直接制备为水溶液注射用制剂的形式。本实施方式中的药物优选通过非口服给药法、例如静脉内给药、肌肉内给药、皮下给药等来进行给药。此外,还可进行口服给药、直肠内给药、鼻内给药、舌下给药等。本实施方式中的药物为将各药剂成分组合而成的药剂的情况下,各药剂成分优选通过适宜的给药方法进行给药。在静脉内给药的情况下,可以举出一次性给予所期望的量的方法或滴注静脉内给药。从给药时间短的方面考虑,优选一次性给予所期望的量的方法(静脉推注)。在一次性给药的情况下,用注射器给药所需要的时间通常有波动,作为给药所需要的时间,根据给药的液量不同而不同,可以示例出5分钟以下、优选3分钟以下、更优选2分钟以下、进一步优选1分钟以下、特别优选30秒以下。此外,作为下限没有特别限定,优选1秒以上、更优选5秒以上、进一步优选10秒以上。给药量没有特别限定,只要为上述的优选给药量即可。此外,从容易将血栓调节蛋白的血中浓度保持恒定的方面考虑,优选滴注静脉内给药。本发明中,药剂的1天给药量根据患者的年龄、体重、疾病程度、给药途径等的不同而不同,通常以血栓调节蛋白的量计,作为上限优选为20mg/kg以下、更优选为10mg/kg以下、进一步优选为5mg/kg以下、特别优选为2mg/kg以下、最优选为1mg/kg以下,作为下限优选为0.001mg/kg以上、更优选为0.005mg/kg以上、进一步优选为0.01mg/kg以上、特别优选为0.02mg/kg以上、最优选为0.05mg/kg以上。在静脉推注的情况下,只要为上述的优选给药量就没有特别限定,作为1天给药量的上限,优选为1mg/kg以下、更优选为0.5mg/kg以下、进一步优选为0.1mg/kg以下、特别优选为0.08mg/kg以下、最优选为0.06mg/kg以下,作为下限,优选为0.005mg/kg以上、更优选为0.01mg/kg以上、进一步优选为0.02mg/kg以上、特别优选为0.04mg/kg以上。对体重超过100kg的患者给药时,血液量与体重不成比例,从相对于体重的血液量相对降低的方面考虑,有时优选以6mg的固定用量进行给药。在滴注静脉内给药的情况下,只要为上述的优选给药量就没有特别限定,作为1天给药量的上限,优选为1mg/kg以下、更优选为0.5mg/kg以下、进一步优选为0.1mg/kg以下、特别优选为0.08mg/kg以下、最优选为0.06mg/kg以下,作为下限,优选为0.005mg/kg以上、更优选为0.01mg/kg以上、进一步优选为0.02mg/kg以上、特别优选为0.04mg/kg以上。本实施方式中的药物没有特别限定,只要在血栓调节蛋白给药后确认到预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的效果即可,该效果可示例出在血栓调节蛋白给药后24小时以内得到确认,优选在12小时以内确认到效果,更优选在6小时以内确认到效果,进一步优选在3小时以内确认到效果,特别优选在1小时以内确认到效果的情况,最优选在30分钟以内确认到效果的情况。如此,本实施方式中的药物有时具有在早期确认到预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的效果的特征。此外,本实施方式中的药物可以以间歇给药制剂或持续给药制剂的形式进行处方,优选以间歇给药制剂的形式进行处方。间歇给药是指,在一定时间内以不连续的方式进行1次以上、优选多次将药剂给予到体内或释放到体内的方式。例如,作为间歇给药,可以为1天1~2次的给药,优选1天1次的给药。此外,作为间歇给药,可以为每天给药、每周给药1~3天、或者每周给药1~5天,优选每周给药1天。此外,作为其它方式,有时也优选每周给药5天。进而,作为其它方式,有时优选每天给药。进而,作为间歇给药,可以为每天一次、每周一次、每周三次、每周五次、或二周一次给药,优选每周一次。此外,作为其它方式,有时优选每周五次。进而,作为其它方式,有时优选每天给药。并且,根据情况,还优选两周一次的给药。持续给药是指在一定时间以上、例如至少5分钟以上将药剂连续释放到体内的给药方法,只要为全身性给药或者向末梢组织的局部给药即可,给药途径并无限制,例如可以举出使用灌输泵或输液泵等仪器的给药或手动给药、将在生物体内发生分解的高分子用作载体的缓释制剂等。关于给予本实施方式中的药物的患者没有特别限定,只要为给予抗癌剂的患者即可,具体地说,可示例出癌症患者。作为癌症患者,例如可示例出患有选自由卵巢癌、非小细胞癌、乳腺癌、胃癌、子宫体癌、头颈部癌、食道癌、白血病、恶性淋巴瘤、小儿肿瘤、多发性骨髓瘤、恶性星形细胞瘤、神经胶质瘤、绒毛膜疾病、胚细胞瘤、肺癌、睾丸瘤、膀胱癌、肾盂肿瘤、尿道肿瘤、前列腺癌、子宫颈癌、神经母细胞瘤、小细胞肺癌、骨肉瘤、恶性胸膜间皮瘤、恶性骨瘤以及大肠癌组成的组中的1种以上的癌的癌症患者。本实施方式中的药物可以选择下述药剂进行合用或制备为合剂的形式进行给药,所述药剂为被用作抗癌剂所致的末梢神经障碍的应对法的其它药剂,例如为类固醇、抗抑郁药、抗癫痫药、鸦片类物质等中的一种或2种以上的药剂。此外,血栓调节蛋白还可以与理疗、按摩或针刺等补充疗法等组合给药。此外,根据本发明,可提供一种用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的药物,该药物与抗癌剂组合给药,含有血栓调节蛋白作为有效成分。作为本实施方式中的血栓调节蛋白,可以举出上述作为可溶性血栓调节蛋白的优选实例。此外,作为本实施方式中的抗癌剂,可以举出上述作为抗癌剂的优选实例。进而,作为本实施方式中的末梢神经障碍性疼痛,可以举出上述作为末梢神经障碍性疼痛的优选实例。此外,根据本发明,提供一种用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的药物,其中,该药物含有血栓调节蛋白以及抗癌剂作为有效成分。进一步地,用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛的方法也包含在本发明的范围中,其中,该方法包括将血栓调节蛋白对哺乳动物进行给药的工序。进而,血栓调节蛋白在用于制造下述药物中的应用也包含在本发明的范围中,该药物用于预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛。实施例下面举出本发明的试验例以及实施例进行详细说明,但本发明并不受这些示例的任何限定。[序列表的说明]序列编号1:用于生产TME456的基因所编码的氨基酸序列序列编号2:编码序列编号1的氨基酸序列的碱基序列序列编号3:用于生产TME456M的基因所编码的氨基酸序列序列编号4:编码序列编号3的氨基酸序列的碱基序列序列编号5:用于生产TMD12的基因所编码的氨基酸序列序列编号6:编码序列编号5的氨基酸序列的碱基序列序列编号7:用于生产TMD12M的基因所编码的氨基酸序列序列编号8:编码序列编号7的氨基酸序列的碱基序列序列编号9:用于生产TMD123的基因所编码的氨基酸序列序列编号10:编码序列编号9的氨基酸序列的碱基序列序列编号11:用于生产TMD123M的基因所编码的氨基酸序列序列编号12:编码序列编号11的氨基酸序列的碱基序列序列编号13:进行定点突变使用的变异用合成DNA试验例中使用的本发明的血栓调节蛋白是根据上述山本等人的方法(日本特开昭64-6219号中记载的方法)制造的。下面示出其制造例。需要说明的是,本次的制造例中所得到的血栓调节蛋白通过使用了大鼠和猴的单次和反复静脉内给药试验、小鼠生殖试验、局部刺激性试验、安全性药理试验、病毒灭活试验等确认了其安全性。[制造例1]<血栓调节蛋白的获得>通过上述方法获得血栓调节蛋白,即,将编码序列编号9的氨基酸序列的DNA(具体地说,由序列号10的碱基序列构成)转染到中国仓鼠卵巢(CHO)细胞中,通过上述常规方法的精制法利用含有50mmol/LNaCl的20mmol/L磷酸盐缓冲液(pH7.3)从该转化细胞的培养液中回收活性级分,获得高纯度精制品。进一步进行超滤,获得浓度为11.2mg/mL的血栓调节蛋白(下文中有时简称为TMD123)溶液。<添加剂溶液制备>在10L的不锈钢制容器中量入盐酸精氨酸(味之素社制造)480g,加入注射用水5L进行溶解。添加1mol/L氢氧化钠溶液,将pH调整为7.3。<试剂制备·填充>将上述添加剂溶液总量装入到20L的不锈钢制容器中,加入上述得到的TMD123溶液2398mL(以可溶性血栓调节蛋白的蛋白质量计相当于26.88g。其中过量投入12%)进行混合搅拌。进一步加入注射用水,使总量为12L,进行混合搅拌。将该试剂利用孔径为0.22μm的过滤器(Millipore制MCGL10S)进行过滤灭菌。将过滤液以每瓶1mL填充到小瓶中,利用橡胶栓半盖合。<冷冻干燥>按照冷冻干燥→氮填充→橡胶栓全盖合→旋盖封盖的顺序在下述条件下进行冷冻干燥工序,得到在1个容器中含有可溶性血栓调节蛋白2mg、盐酸精氨酸40mg的含有TMD123的制剂。<冷冻干燥条件>预冷却(利用15分钟时间从室温冷却至15℃)→主冷却(利用2小时时间从15℃冷却至-45℃)→保持(2小时-45℃)→真空开始(18小时-45℃)→升温(利用20小时从-45℃升温至25℃)→保持(15小时25℃)→升温(利用1小时从25℃升温至45℃)→保持(5小时45℃)→室温(利用2小时从45℃至25℃)→复压氮填充(至-100mmHg为止)→全盖合→旋盖封盖[制造例2]将编码序列编号11的氨基酸序列的DNA(具体地说,由序列编号12的碱基序列构成)转染至中国仓鼠卵巢(CHO)细胞中,利用上述常规方法的精制法从该转化细胞的培养液中获得经精制的血栓调节蛋白(下文中有时简称为TMD123M)溶液,通过与上述相同的方法获得TMD123M的冷冻干燥制剂。[制造例3]将编码序列编号1的氨基酸序列的DNA(具体地说,由序列编号2的碱基序列构成)转染至中国仓鼠卵巢(CHO)细胞,利用上述常规方法的精制法从该转化细胞的培养液中获得经精制的血栓调节蛋白(下文中有时简称为TME456),通过与上述相同的方法获得TME456的冷冻干燥制剂。[制造例4]将编码序列编号3的氨基酸序列的DNA(具体地说,由序列编号4的碱基序列构成)转染至中国仓鼠卵巢(CHO)细胞,利用上述常规方法的精制法从该转化细胞的培养液中获得经精制的血栓调节蛋白(下文中有时简称为TME456M),通过与上述相同的方法获得TME456M的冷冻干燥制剂。[制造例5]将编码序列编号5的氨基酸序列的DNA(具体地说,由序列编号6的碱基序列构成)转染至中国仓鼠卵巢(CHO)细胞,利用上述常规方法的精制法从该转化细胞的培养液中获得经精制的血栓调节蛋白(下文中有时简称为TMD12),通过与上述相同的方法获得TMD12的冷冻干燥制剂。[制造例6]将编码序列编号7的氨基酸序列的DNA(具体地说,由序列编号8的碱基序列构成)转染至中国仓鼠卵巢(CHO)细胞,利用上述常规方法的精制法从该转化细胞的培养液中获得经精制的血栓调节蛋白(下文中有时简称为TMD12M),通过与上述相同的方法获得TMD12M的冷冻干燥制剂。[试验例1]对于紫杉醇所致的小鼠异常疼痛的作用为了确认血栓调节蛋白对于抗癌剂所致的异常疼痛的效果,针对血栓调节蛋白对于在对小鼠给予抗癌剂紫杉醇时所产生的基于机械刺激的异常疼痛的作用进行研究。将TMD123作为待测药对小鼠进行腹腔内给药,进行下述试验。(1)紫杉醇给药诱发异常疼痛模型小鼠的制作作为实验动物使用4-5周龄的ddY系雄性小鼠(20~30g),对小鼠腹腔内给药紫杉醇(下文中有时简称为PTX)4mg/kg。给药隔日进行,计实施4次(day0、2、4、6)。对照组同样地给予PTX的溶剂,该PTX的溶剂即为利用生理盐水将0.5mL的按1比1混合蓖麻油聚氧乙烯醚(CremophorEL)与乙醇得到的溶液稀释至1.5mL所得到的溶剂。紫杉醇使用紫杉醇(100mg:LKTLaboratories,Inc.)。(2)待测药的给药在评价预防效果的实验中,使实验动物为对照组、PTX给药组、PTX和血栓调节蛋白0.1mg/kg给药组、PTX和血栓调节蛋白1mg/kg给药组或PTX和血栓调节蛋白10mg/kg给药组(PTX+TM给药组)这5组构成。在评价治疗效果的实验中,使其为PTX给药组、PTX和血栓调节蛋白10mg/kg给药组(PTX+TM给药组)这2组构成。在预防实验中,对于PTX+TM给药组,从开始进行PTX给药那天起,每天腹腔内给药1次、计7天给予血栓调节蛋白TMD123。此外,在治疗实验中,在PTX最终开始8-9天后进行TMD123的单次腹腔内给药。对于对照组和PTX给药组,同样地进行TMD123的溶剂的给药。(3)统计处理在结果的统计学处理中,对于2组间的比较使用Wilcoxon检验进行处理,对于3组以上的组间的比较使用Kruskal-Wallis的H检验和LSD(最小显著差)型检验进行处理,将临界比率为5%以下作为有显著差异。(图中的*、**、***:对照组与PTX给药组的测定值相比,p<0.05、p<0.01、p<0.001;图中的与PTX给药组与PTX和待测药给药组的测定值相比,p<0.05及p<0.001)。(4)冯弗雷试验(vonFreytest)对于上述小鼠,通过使用冯弗雷细丝的上下法来测定痛觉阈值。即,使用0.008g、0.02g、0.04g、0.07g、0.16g、0.4g、0.6g、1.0g强度的冯弗雷细丝,对小鼠后肢足底持续刺激6秒,观察刺激后的足部的抬起、摇摆、舔舐等反应。刺激从强度弱的情况开始,在没有反应的情况下,利用强1级的强度进行再次刺激,在发现有反应的情况下,隔着30秒以上的间隔利用弱1级的强度进行刺激。从开始这些刺激并发生反应时开始反复进行5次刺激,将发生50%反应的细丝的强度作为疼痛容许阈值。在PTX给药前测定基线阈值,其后在PTX给药日和给药开始第8天或第9天测定痛觉阈值,进行经过观察。在治疗实验中,在第8天以后确认到痛觉阈值充分降低后,实施测定试验。对于上述试验结果(使用冯弗雷细丝的上下法),将TMD123的预防性给药结果示于图1、将TMD123的治疗性给药结果示于图2。在PTX给药组中,与对照组相比,痛觉阈值(Threshold)显著降低,与此相对,在PTX+TM预防性给药组,显著抑制了在PTX给药组中确认到的阈值的降低。此外,在PTX+TM治疗性给药组中,在PTX给药中确认到的阈值的降低从给药30分钟后开始显著上升,在给药后持续3小时以上。由上述结果确认到,血栓调节蛋白对于PTX所致的机械性异常疼痛具有速效性和持续性优异的预防和/或治疗效果。[试验例2]低温刺激试验1(冷板试验)按下述所示的方法观察低温刺激所致的异常疼痛,从而可确认到本发明对抗癌剂所致的末梢神经障碍性疼痛的效果。(1)紫杉醇给药诱发异常疼痛模型大鼠的制作作为实验动物使用5周龄的SD系雄性大鼠(150~200g),对大鼠腹腔内给药PTX4mg/kg。给药隔日进行,计实施4次(day0、2、4、6)。对照组同样地给予PTX的溶剂,该PTX的溶剂即为利用生理盐水将0.5mL的按1比1混合蓖麻油聚氧乙烯醚与乙醇得到的溶液稀释至1.5mL所得到的溶剂。(2)待测药的给药使实验动物为对照组、PTX给药组、PTX和血栓调节蛋白给药组(PTX+TM给药组)这3组的组构成。在PTX+TM给药组中,作为预防性给药,从开始进行PTX给药那天起,每天腹腔内给药(10mg/kg)1次、计7天给予血栓调节蛋白TMD123。此外,作为治疗性给药,在PTX最终给药翌日单次腹腔内给药(10mg/kg)。对于对照组和PTX给药组,同样地进行TMD123的溶剂的给药。(3)冷板试验对于上述5组大鼠,使用冷感知阈值分析器件的调节为8℃的冷刺激部的前端,计量对于左右后肢背面交互给予各5次刺激时的回避行动的潜伏时间,观察低温刺激所致的异常疼痛,从而可确认本发明对于抗癌剂所致的末梢神经障碍性疼痛的效果。例如截止时间为15秒。可以在下述时间实施测定试验:PTX给药5小时前;PTX给药1小时后;PTX给药2、3、5、7、9、11天后;PTX给药15天后且在待测药给药前;PTX给药15天后且在待测药给药6小时后;PTX给药17和19天后且在待测药给药前;PTX给药22天后且在停药3天后;PTX给药26天后且在停药7天后;PTX给药29天后且在停药10天后。需要说明的是,实验条件可适宜变更。[试验例3]低温刺激试验2使用通过与试验例2相同的方法进行了PTX给药的大鼠,利用如下所示的方法观察低温刺激所致的异常疼痛,由此可确认本发明对抗癌剂所致的末梢神经障碍性疼痛的效果。将大鼠装入底部为金属丝网的笼中,进行1小时驯化后,使用MicroSprayer(PENN-Century社制造)利用5秒的时间对后足进行丙酮0.05mL的喷雾,利用丙酮气化时的冷却作用给予冷刺激。在自喷雾开始起40秒内观察大鼠的回避反应,记录直至发生反应为止的时间(潜伏时间)。试验对于左右各进行3次,计算出平均值。可以在下述时间进行测定:PTX给药5小时前;PTX给药1小时后;PTX给药2、3、5、7、9、11天后;PTX给药15天后且在待测药给药前;PTX给药15天后且在待测药给药6小时后;PTX给药17和19天后且在待测药给药前;PTX给药22天后且在待测药停药3天后;PTX给药26天后且在待测药停药7天后;PTX给药29天后且在待测药停药10天后。需要说明的是,实验条件可以适宜变更。[试验例4]对奥沙利铂所致的大鼠异常疼痛的作用与试验例1~3同样地使用大鼠对基于奥沙利铂给药的冯弗雷试验和低温刺激试验进行研究。由这些试验例可以确认本发明对抗癌剂所致的末梢神经障碍性疼痛的效果。[试验例5]invitro神经细胞变性通过下述方法可确认本发明对末梢神经障碍的缓解作用的效果。为了研究对于通过紫杉醇处理所引起的神经细胞变性的作用,使用作为神经分化·突起延伸的模型细胞株的大鼠肾上腺嗜铬细胞株(Pheochromocytoma12:PC12)和脊髓背根神经节(Dorsalrootganglia:DRG)细胞。(1)细胞的培养使用含有5%胎牛血清、10%马血清、100单位/mL青霉素-链霉素(GibcoBRL社制造)的RPMI1640培养基(MPBiomedicals社制造),在37℃、5%CO2培养箱中对PC12细胞进行培养。此外,DRG细胞从SD系雄性大鼠中取出并进行初代培养后,利用I型胶原酶(Funakoshi社制造)和分散酶I(三光纯药社制造)对L4-5的DRG的5节进行处理,播种至24孔微板中进行培养。需要说明的是,培养使用含有10%胎牛血清、100Unit/mL青霉素-链霉素的杜尔伯科改良伊格尔培养基(DMEM培养基、MPBiomedical社制造),在37℃、5%CO2培养箱中进行培养。(2)药物处理和神经突起长度的测定将PC12细胞以10,000细胞/孔播种至24孔微板,3小时后利用低聚果糖胆碱(FOS-choline)0.01mmol/L进行处理,使突起延伸,24小时后进行待测液的处理。此外,对于DRG细胞,在进行1周培养确认细胞的粘接和突起的延伸后,进行待测液的处理。另外,在待测液中,仅添加紫杉醇10ng/mL、或者添加紫杉醇10ng/mL与待测药(10ng/mL至0.1mg/mL)。在进行待测液处理24和96小时后,置换成含有待测药的新培养基,在168小时后利用锥虫蓝染色液对死细胞进行染色,利用光学显微镜拍摄照片(倍率200倍、3视野/孔)。拍摄后,利用分析软件ImageJ测定活细胞中的突起的长度。需要说明的是,实验条件可适宜变更。[试验例6]对于紫杉醇所致的大鼠异常疼痛的作用与试验例1同样地利用如下所示的方法进行血栓调节蛋白对于在对大鼠给予抗癌剂紫杉醇时所产生的基于机械刺激的异常疼痛的作用的研究。将TMD123作为待测药对大鼠进行腹腔内给药,进行下述试验。(1)紫杉醇给药诱发异常疼痛模型大鼠的制作作为实验动物使用5-6周龄的Wistar系雄性大鼠(200~250g),对大鼠腹腔内给药PTX2mg/kg。给药隔日进行,计实施4次(day0、2、4、6)。对照组同样地给予PTX的溶剂,该PTX的溶剂即为利用生理盐水将0.5mL的按1比1混合蓖麻油聚氧乙烯醚(CremophorEL)与乙醇得到的溶液稀释至1.5mL所得到的溶剂。(2)待测药的给药在使用大鼠进行预防效果的评价的实验中,使实验动物为对照组、PTX给药组、PTX和血栓调节蛋白10mg/kg给药组(PTX+TM给药组)这3组构成。作为预防性给药,从开始进行PTX给药那天起,每天腹腔内给药(10mg/kg)1次、计7天给予血栓调节蛋白TMD123。(3)统计处理结果的统计学处理使用Kruskal-Wallis的H检验和LSD(最小显著差)型检验来进行,将临界比率为5%以下作为有显著差异。(图中的*、**:对照组与PTX给药组的测定值相比,p<0.05、p<0.01;图中的与PTX给药组与PTX和待测药给药组的测定值相比,p<0.05和p<0.01)。(4)Randall-Selitto试验按照RandallLO.等,Arch.Int.Pharmacodyn.Ther.1957.111,409-419中所述的足部压痛法(Randall-Selitto试验)对上述大鼠进行测定。即,将右后肢足部利用压力刺激镇痛效果装置渐次加压,将表现出嘶叫反应或逃避反应时的压力作为疼痛阈值。使用大鼠的TMD123预防性给药的结果见图3。在PTX给药组中,与对照组相比,痛觉阈值(Threshold)显著降低,与此相对,在PTX+TM给药组中,在PTX给药组中确认到的阈值的降低得到显著抑制。此外,在使用大鼠的试验中,在PTX+TM给药组中,PTX给药中确认到的阈值的降低在28天内得到了显著抑制。由上述结果也确认到,血栓调节蛋白对于PTX所致的机械性异常疼痛具有速效性和持续性优异的预防效果。[试验例7]在抗癌剂所致的末梢神经障碍性疼痛的人类中的预防效果例如,对于以大肠癌为代表的癌症患者等具有恶性肿瘤的患者,利用FOLFOX6或mFOLFOX6等进行1轮为2周、计12轮的化学疗法,此时,在各轮抗癌剂即将给药之前、给药中以及刚给药后给予TMD123(例如Recomodulin(注册商标)(旭化成制药制造))。在化学疗法终止后,对于化学疗法的退出率、末梢神经障碍性疼痛的发病率、QOL、凝聚学的检査值的变化、或者对肿瘤的效果等进行研究,从而确认到本发明在抗癌剂所致的末梢神经障碍性疼痛的人类中的预防效果。需要说明的是,抗癌剂的种类、抗癌剂及TMD123的给药量、给药时机、1轮的时间、或者轮数等可按照技术常识进行适宜变更。工业实用性本发明的药物在预防和/或治疗由抗癌剂所致的末梢神经障碍性疼痛中是极为有效的,抗癌剂治疗所致的末梢神经障碍性疼痛会使患者的生活质量大幅降低,本发明可使其得到显著改善,因而在医药产业领域中是有用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1