免疫原性组合物的制作方法
本发明涉及改良的免疫原性组合物和疫苗,及其在医学中的用途。特别地,本发明涉及包含26-46μg肺炎球菌溶血素和/或PhtD/人剂量的免疫原性组合物。
背景
肺炎链球菌(Streptococcus pneumoniae)(肺炎链球菌(S. pneumoniae))也称为肺炎球菌,是革兰氏阳性细菌。肺炎链球菌是遍及全世界的重大公共卫生问题,并且负责相当大的发病率和死亡率,尤其是在婴儿、老年人和无免疫应答的人中。肺炎链球菌引起广泛范围的重要人体病理学,包括社区获得性肺炎、急性鼻窦炎、中耳炎、脑膜炎、菌血症、败血病、骨髓炎、脓毒性关节炎、心内膜炎、腹膜炎、心包炎、蜂窝织炎和脑脓肿。每年仅在美国肺炎链球菌据估计为3,000例脑膜炎、50,000例菌血症、500,000例肺炎和7,000,000例中耳炎中的致病因子(Reichler,M. R.等人,1992,J. Infect. Dis. 166: 1346;Stool,S. E.和Field,M. J.,1989 Pediatr. Infect. Dis J. 8: S11)。在来自发达国家和发展中国家的小于5岁的儿童中,由于肺炎球菌疾病的死亡率尤其高。老年人、无免疫应答的人和患有其他潜在状况(糖尿病、哮喘)的患者也对疾病特别敏感。
由肺炎链球菌引起的主要临床综合征在所有标准医学教科书中是广泛公认且讨论的(Fedson D S,Muscher D M. In: Plotkin S A,Orenstein W A,编辑Vaccines. 第4版Philadelphia WB Saunders Co,2004a: 529-588)。例如,将侵袭性肺炎球菌疾病(IPD)定义为其中从血液或另一个通常无菌部位中分离到肺炎链球菌的任何感染(Musher D M. Streptococcus pneumoniae. In Mandell G L,Bennett J E,Dolin R(编辑). Principles and Practice of Infectious diseases(第5版). New York,Churchill Livingstone,2001,第2128-2147页)。
慢性阻塞性肺疾病(COPD)是肺的慢性炎性疾病,并且是全世界的发病率和死亡率的主因。美国在2005年大约20例死亡有一例具有COPD作为潜在原因。(Drugs and Aging 26:985-999(2009))。估计在2020年COPD将上升至伤残调整生命年(disability adjusted life year)、慢性无效性疾病(chronic invalidating diseases)的第五大主因,以及死亡率的第三位最重要的原因(Lancet 349:1498-1504(1997))。
尽管抗微生物药物的进展已降低来自肺炎球菌疾病的总体死亡率,但肺炎链球菌的抗生素抗性菌株的出现是严重且迅速增加的问题。因此,重要的是开发针对肺炎链球菌的有效疫苗。有效的肺炎球菌疫苗可以对与肺炎链球菌疾病相关的发病率和死亡率具有重大影响。
本发明涉及包含26-45μg肺炎球菌溶血素或PhtD(聚三联组氨酸蛋白D)/人剂量的免疫原性组合物。本发明人已惊讶地发现:当肺炎球菌溶血素和/或PhtD与来源于该菌株的肺炎链球菌糖组合共施用时,肺炎球菌溶血素和PhtD可以增强抗体介导的针对肺炎链球菌菌株的调理活性,即共施用肺炎链球菌糖与更高水平的肺炎链球菌蛋白导致抗体介导的针对糖由其衍生的菌株的调理活性中的增加。本发明人也已发现:与施用包含更低剂量的肺炎球菌溶血素和/或PhtD的组合物时相比较,当施用包含26-45μg肺炎球菌溶血素和/或PhtD的组合物时,该效应更高。此外,本发明人已发现该更高剂量的肺炎球菌溶血素和/或PhtD与统计上显著增加的反应性无关,当施用更高剂量的抗原时,可以预期这点。
尽管先前已证实在肺炎球菌糖和蛋白之间的阳性相互作用(例如WO02/22167),但WO02/22167涉及通过同时刺激免疫系统的细胞介导分支和免疫系统的体液分支而获得的结果。WO02/22167中的效应将不增强抗体介导的针对肺炎链球菌菌株的调理活性,并且将不反映在使用调理吞噬(OPA)测定测量的增强的抗体介导的调理活性中。这是因为使用OPA测定测量的调理活性(例如实施例2中所述的那种)在不存在细胞介导的免疫系统组分的情况下进行测量。
概述
本发明人已惊讶地发现:与具有更低剂量的肺炎球菌溶血素和/或PhtD的组合物相比较,包含26-45μg肺炎球菌溶血素和/或PhtD(聚三联组氨酸蛋白D)的免疫原性组合物并非显著更多反应原性,并且当肺炎球菌溶血素和/或PhtD与来自该菌株的肺炎链球菌糖组合共施用时,更高的(26-45μg)剂量可以增强抗体介导的针对肺炎链球菌菌株的调理活性。
相应地,在第一个方面,提供了包含26μg-45μg(例如26μg-40μg、28μg-35μg或约30μg)的脱毒肺炎球菌溶血素(dPly)/人剂量的免疫原性组合物。
在第二个方面,提供了包含26μg-45μg(例如26μg-40μg、28μg-35μg或约30μg)PhtD /人剂量的免疫原性组合物。
在第三个方面,提供了包含本发明的免疫原性组合物和药学上可接受的赋形剂的疫苗。
在第四个方面,提供了针对由肺炎链球菌感染引起的疾病免疫人宿主的方法,其包括给宿主施用免疫保护剂量的本发明的免疫原性组合物或疫苗。
在第五个方面,提供了用于治疗或预防由肺炎链球菌感染引起的疾病的本发明的免疫原性组合物或疫苗。
在第六个方面,提供了本发明的免疫原性组合物或疫苗在制造用于治疗或预防由肺炎链球菌感染引起的疾病的药物中的用途。
附图简述
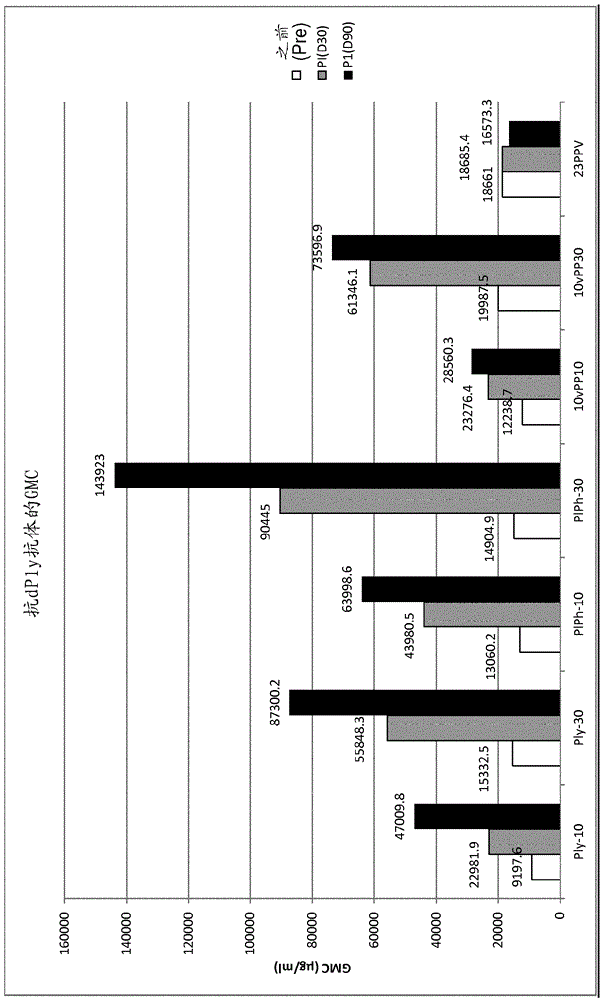
图1:根据ELISA测定,在用10μg脱毒肺炎球菌溶血素(Ply-10)、30μg脱毒肺炎球菌溶血素(Ply-30)、10μg脱毒肺炎球菌溶血素和10μg PhtD(PlPh-10)、30μg脱毒肺炎球菌溶血素和30μg PhtD(PlPh-3)、包含与10μg脱毒肺炎球菌溶血素和10μg PhtD组合的10种肺炎球菌缀合物的疫苗(10vPP10)、包含与30μg脱毒肺炎球菌溶血素和30μg PhtD组合的10种肺炎球菌缀合物的疫苗(10vPP30)、以及包含23种未缀合的肺炎球菌糖的疫苗免疫后,显示在人成人中的抗dPly抗体滴度的条形图。白色条表示在免疫前的免疫原性,灰色条表示在1个疫苗剂量后的免疫原性,并且黑色条表示在2个疫苗剂量后的免疫原性。
图2:与图2相似的条形图,但描述抗PhtD滴度而不是抗Ply滴度。
图3:根据调理吞噬测定,在用10μg脱毒肺炎球菌溶血素(Ply-10)、30μg脱毒肺炎球菌溶血素(Ply-30)、10μg脱毒肺炎球菌溶血素和10μg PhtD(PlPh-10)、30μg脱毒肺炎球菌溶血素和30μg PhtD(PlPh-3)、包含与10μg脱毒肺炎球菌溶血素和10μg PhtD组合的10种肺炎球菌缀合物的疫苗(10vPP10)、包含与30μg脱毒肺炎球菌溶血素和30μg PhtD组合的10种肺炎球菌缀合物的疫苗(10vPP30)、以及包含23种未缀合的肺炎球菌糖的疫苗免疫后,显示在人成人中的抗PS1调理抗体滴度的条形图。白色条表示在免疫前的免疫原性,灰色条表示在1个疫苗剂量后的免疫原性,并且黑色条表示在2个疫苗剂量后的免疫原性。
图4:与图3相似的条形图,但描述抗PS4滴度而不是抗PS1滴度。
图5:与图3相似的条形图,但描述抗PS5滴度而不是抗PS1滴度。
图6:与图3相似的条形图,但描述抗PS6B滴度而不是抗PS1滴度。
图7:与图3相似的条形图,但描述抗PS7F滴度而不是抗PS1滴度。
图8:与图3相似的条形图,但描述抗PS9V滴度而不是抗PS1滴度。
图9:与图3相似的条形图,但描述抗PS14滴度而不是抗PS1滴度。
图10:与图3相似的条形图,但描述抗PS18C滴度而不是抗PS1滴度。
图11:与图3相似的条形图,但描述抗PS19F滴度而不是抗PS1滴度。
图12:与图3相似的条形图,但描述抗PS23F滴度而不是抗PS1滴度。
图13:序列表。
图14:如使用抗糖ELISA测定在小鼠注射后测量的,比较包含12种糖缀合物、PhtD、dPly和PE-PilA 的组合物(12V + prot)与包含12种糖缀合物的组合物(12V)和包含10种糖缀合物的组合物(10V)的免疫原性的图表。GMC=几何平均浓度。IC =置信区间。
图15:如使用调理吞噬测定在小鼠注射后测量的,比较包含12种糖缀合物、PhtD、dPly和PE-PilA 的组合物(12V + prot)与包含12种糖缀合物的组合物(12V)和包含10种糖缀合物的组合物(10V)的免疫原性的图表。GMT=几何平均滴度。
图16:如使用抗蛋白ELISA测定在小鼠注射后测量的,比较包含12种糖缀合物、PhtD、dPly和PE-PilA 的组合物(12V + prot)与包含单独的PhtD、dPly和PE-PilA的组合物(prot)的免疫原性的图表。GMC=几何平均浓度。IC =置信区间。
图17:如使用调理吞噬测定在豚鼠注射后测量的,比较包含12种糖缀合物、PhtD、dPly和PE-PilA 的组合物(12V + prot)与包含12种糖缀合物的组合物(12V)和包含10种糖缀合物的组合物(10V)的免疫原性的图表。GMT=几何平均滴度。
图18:如使用抗糖ELISA在豚鼠注射后测量的,比较包含12种糖缀合物、PhtD、dPly和PE-PilA 的组合物(12V + prot)与包含12种糖缀合物的组合物(12V)和包含10种糖缀合物的组合物(10V)的免疫原性的图表。GMC=几何平均浓度。IC =置信区间。
图19:如使用抗蛋白ELISA在豚鼠注射后测量的,比较包含12种糖缀合物、PhtD、dPly和PE-PilA 的组合物(12V + prot)与包含单独的PhtD、dPly和PE-PilA的组合物(prot)的免疫原性的图表。GMC=几何平均浓度。ic =置信区间。
详述
在第一个方面,本发明涉及包含26μg-45μg(例如26μg-40μg、27μg-39μg、27μg-37μg、28μg-35μg、29μg-33μg或约30μg)的肺炎球菌溶血素/人剂量的免疫原性组合物。在一个实施方案中,肺炎球菌溶血素已进行化学脱毒。在进一步的实施方案中,肺炎球菌溶血素已进行遗传脱毒。在一个实施方案中,该组合物进一步包含PhtD(聚三联组氨酸蛋白D)。在进一步的实施方案中,该组合物包含26μg-45μg(例如26μg-40μg、27μg-39μg、27μg-37μg、28μg-35μg、29μg-33μg或约30μg)的脱毒PhtD/人剂量。
在第二个方面,本发明涉及包含26μg-45μg(26μg-40μg、27μg-39μg、27μg-37μg、28μg-35μg、29μg-33μg或约30μg)PhtD/人剂量的免疫原性组合物。在一个实施方案中,PhtD包含与WO00/37105(通过引用并入本文)(WO00/37105的SEQ ID NO:4的氨基酸21-838具有本申请的图13中的SEQ ID NO:1的序列)的SEQ ID NO:4的氨基酸21-838处的序列至少85%、90%、95%、98%、99%或100%相同的氨基酸序列。在进一步的实施方案中,该组合物进一步包含脱毒肺炎球菌溶血素(dPly)。在进一步的实施方案中,该组合物包含26μg-45μg(26μg-40μg、27μg-39μg、27μg-37μg、28μg-35μg、29μg-33μg或约30μg)的脱毒肺炎球菌溶血素(dPly)/人剂量。
肺炎球菌溶血素
肺炎球菌溶血素或“Ply”意指:来自肺炎球菌的天然或野生型肺炎球菌溶血素,重组肺炎球菌溶血素及其片段和/或变体。在一个实施方案中,肺炎球菌溶血素是来自肺炎球菌的天然或野生型肺炎球菌溶血素或者重组肺炎球菌溶血素。
Ply是53 kDa成孔毒素,并且像这样对许多哺乳动物细胞类型具有溶解作用,并且在亚裂解浓度时,Ply具有众多其他效应,包括在不存在抗肺炎球菌溶血素抗体的情况下的补体活化和促炎介质的诱导(Hirst等人,2000;Mitchell & Andrew,1997;Paton等人,1984;Zysk等人,2001)。补体活化不依赖于毒素的溶血活性(Berry等人,1995)。肺炎球菌溶血素目前已知与Toll样受体4(TLR-4)直接相互作用,并且经由髓系分化标记物88信号传递,以诱导肿瘤坏死因子α和白细胞介素6的产生(Malley等人,2003;Trzcinski等人,2008)。肺炎球菌溶血素通过所有已知的肺炎链球菌的临床分离物产生,与血清型和基因型无关。野生型或天然肺炎球菌溶血素的表达和克隆是本领域已知的。参见例如Walker等人(Infect Immun,55:1184-1189(1987)),Mitchell等人(Biochim Biophys Acta,1007:67-72(1989)和Mitchell等人(NAR,18:4010(1990))。WO2010/071986(通过引用并入本文)描述了野生型Ply,例如SEQ ID 2-42(例如SEQ ID 34、35、36、37、41)。在一个方面,肺炎球菌溶血素是WO2010/071986的Seq ID NO:34。在另一个方面,肺炎球菌溶血素是WO2010/071986的Seq ID NO:35。在另一个方面,肺炎球菌溶血素是WO2010/071986的Seq ID NO:36。在另一个方面,肺炎球菌溶血素是WO2010/071986的Seq ID NO:37。在另一个方面,肺炎球菌溶血素是WO2010/071986的Seq ID NO:41。此外,EP1601689B1描述了在去污剂和高盐的存在下,通过层析用于纯化细菌溶细胞素例如肺炎球菌肺炎球菌溶血素的方法。
在一个实施方案中,术语‘肺炎球菌溶血素’包括与野生型序列相比较,在核酸或氨基酸序列中具有差异的肺炎球菌溶血素的片段和/或变体。当使用肺炎球菌溶血素的片段时,这些片段长度为至少约15、至少约20、至少约40或至少约60个邻接氨基酸残基。在本发明的一个实施方案中,肺炎球菌溶血素的免疫原性片段包含全长序列的至少约15、至少约20、至少约40或至少约60个邻接氨基酸残基,其中所述多肽能够引发对于所述氨基酸序列特异性的免疫应答。肺炎球菌溶血素已知由四个主要结构结构域组成(Rossjohn等人Cell. 1997 May 30;89(5):685-92)。这些结构域可以通过去除和/或修饰这些结构域中的一个或多个进行修饰。在一个实施方案中,该片段或每个片段含有确切地或至少1、2或3个结构域。在另一个实施方案中,该片段或每个片段含有确切地或至少2或3个结构域。在另一个实施方案中,该片段或每个片段含有至少3个结构域。该片段或每个片段可以与野生型肺炎球菌溶血素序列多于50、60、70、80、90、95、98、99或100%相同。
根据本发明,肺炎球菌溶血素的变体包括这样的序列,其中与野生型序列相比较,一个或多个氨基酸被取代和/或缺失和/或插入。氨基酸取代可以是保守或非保守的。在一个方面,氨基酸取代是保守的。取代、缺失、插入或其任何组合可以在单一变体中组合,只要该变体是免疫原性多肽。肺炎球菌溶血素的变体通常包括任何肺炎球菌溶血素或肺炎球菌溶血素的任何片段,其与野生型肺炎球菌溶血素序列,例如来自WO2010/071986的SEQ ID 2-42(例如SEQ ID 34、35、36、37、41),共享至少80、90、94、95、98或99%氨基酸序列同一性。在一个实施方案中,肺炎球菌溶血素的变体通常包括任何肺炎球菌溶血素或肺炎球菌溶血素的任何片段,其与来自WO2010/071986的SEQ ID 36共享至少80、90、94、95、98或99%氨基酸序列同一性。在一个实施方案中,本发明包括片段和/或变体,其中几个、5 - 10、1 - 5、1 - 3、1 - 2、1、最高达10、最高达20、最高达30或最高达50个氨基酸以任何组合被取代、缺失或添加。在另一个实施方案中,本发明包括片段和/或变体,其包含B细胞或T细胞表位。此类表位可以使用2D结构预测的组合进行预测,例如使用PSIPRED程序(来自David Jones,Brunel Bioinformatics Group,Dept. Biological Sciences,Brunel University,Uxbridge UB8 3PH,UK)和基于由Jameson和Wolf(CABIOS 4:181-186 [1988])描述的方法计算的抗原指数。肺炎球菌溶血素的变体例如在WO04/43376、WO05/108580、WO05/076696、WO10/071986、WO10/109325(所述专利全部通过引用并入本文)(SEQ ID 44、45和46)和WO10/140119(通过引用并入本文)(SEQ ID 50和51)中得到描述。在一个实施方案中,本发明的免疫原性组合物包含肺炎球菌溶血素的变体,例如WO05/108580、WO05/076696、WO10/071986中描述的那些。
如本说明书使用的,术语“片段”是能够在宿主动物中引发体液和/或细胞免疫应答的部分。使用本领域已知的技术,例如重组、通过蛋白酶解消化或通过化学合成,可以产生蛋白的片段。通过从编码多肽的核酸的一端(对于末端片段)或两端(对于内部片段)去除一个或多个核苷酸,可以生成多肽的内部或末端片段。通常,片段包含全长序列的至少10、20、30、40或50个邻接氨基酸。通过从N和C末端中任一或两者添加或去除1、2、3、4、5、6、7、8、9、10、20、30、40或50个氨基酸,可以容易地修饰片段。
如本说明书使用的,术语“保守氨基酸取代”涉及天然氨基酸残基由非天然残基的取代,从而使得对在该位置处的氨基酸残基的大小、极性、电荷、疏水性或亲水性具有很少作用或无作用,并且不导致免疫原性减少。例如,这些可以是在下述组内的取代:缬氨酸,甘氨酸;甘氨酸,丙氨酸;缬氨酸,异亮氨酸,亮氨酸;天冬氨酸,谷氨酸;天冬酰胺,谷氨酰胺;丝氨酸,苏氨酸;赖氨酸,精氨酸;和苯丙氨酸,酪氨酸。对多肽序列的保守氨基酸修饰(和对编码核苷酸的相应修饰)可以产生具有与亲本多肽的那些相似的功能和化学特征的多肽。
如本说明书使用的,术语“缺失”是从蛋白序列中去除一个或多个氨基酸残基。通常,在蛋白分子内的任何一个位点处缺失不多于约1 - 6个残基(例如1 - 4个残基)。
如本说明书使用的,术语“插入”是在蛋白序列中添加一个或多个非天然氨基酸残基。通常,在蛋白分子内的任何一个位点处插入不多于约1 - 6个残基(例如1 - 4个残基)。
在本发明的一个实施方案中,肺炎球菌溶血素及其片段和/或变体,具有与肺炎球菌溶血素的野生型序列,例如来自WO2010/071986的SEQ ID 34、35、36、37、41,共享至少80、85、90、95、98、99或100%同一性的氨基酸序列。在本发明的另一个实施方案中,肺炎球菌溶血素及其片段和/或变体,包含肺炎球菌溶血素的野生型序列的至少约15、至少约20、至少约40或至少约60个邻接氨基酸残基。
肺炎球菌溶血素在脱毒(即当以适合于保护的剂量提供时,致使对人无毒)后施用。如本文使用的,应当理解术语“dPly”指适合于医学用途的脱毒肺炎球菌溶血素(即无毒的)。肺炎球菌溶血素可以进行化学和/或遗传脱毒。肺炎球菌溶血素的脱毒可以通过化学方法进行,例如使用交联剂例如甲醛、戊二醛,以及含有N-羟基琥珀酰亚胺酯和/或马来酰亚胺基团(例如GMBS)或这些的组合的交联试剂。在一个实施方案中,肺炎球菌溶血素通过暴露于甲醛进行脱毒。此类方法是本领域对于多种毒素众所周知的;参见例如EP1601689B1、WO04/081515、WO2006/032499。在化学脱毒中使用的肺炎球菌溶血素可以是天然或重组蛋白,或已遗传改造以降低其毒性的蛋白(参见下文)。肺炎球菌溶血素的融合蛋白或肺炎球菌溶血素的片段和/或变体还可以通过化学方法进行脱毒。因此,在一个实施方案中,本发明的免疫原性组合物可以包含肺炎球菌溶血素,其已例如通过甲醛处理进行化学脱毒。
肺炎球菌溶血素还可以进行遗传脱毒。因此,本发明涵盖肺炎球菌蛋白,其可以为例如突变蛋白。术语“突变的”在本文中用于意指例如通过使用众所周知的定点诱变技术或任何其他常规方法,已经历一个或多个氨基酸(例如1、2、3、4、5、6、7、8、9、10、11或12个氨基酸)的缺失、添加或取代的分子。在一个实施方案中,该分子已经历1-15、适当的10-15个氨基酸的缺失或取代。突变的序列可以去除不希望的活性,例如针对人红细胞及其他细胞的膜渗透、细胞裂解和细胞裂解活性,以便降低毒性,同时在施用于人后保留诱导抗肺炎球菌溶血素保护和/或中和抗体的能力。肺炎球菌溶血素的融合蛋白或肺炎球菌溶血素的片段和/或变体还可以通过遗传方法进行脱毒。任何这些修饰均可使用标准分子生物学和生物化学技术而引入。例如,如上所述,突变体肺炎球菌溶血素蛋白可以这样改变,使得它是生物学失活的,同时仍维持其免疫原性表位,参见例如WO90/06951、Berry等人(Infect Immun,67:981-985(1999))和WO99/03884。例如,肺炎球菌溶血素蛋白可以通过三个氨基酸取代进行脱毒,所述三个氨基酸取代包含T65至C、G293至C和C248至A。可以用于本发明的遗传脱毒的肺炎球菌溶血素的另一个实例是来自WO2011/075823(通过引用并入本文)的SEQ ID 9。因此,在进一步的实施方案中,本发明的免疫原性组合物可以包含已进行遗传脱毒的肺炎球菌溶血素。
技术组合可以用于使肺炎球菌溶血素脱毒。例如,本发明的免疫原性组合物可以包含已进行化学和遗传脱毒的肺炎球菌溶血素。
PhtD
如本文使用的,术语“PhtD”(聚三联组氨酸D)包括具有信号序列附着的全长蛋白或具有信号肽(例如在N末端处的20个氨基酸)去除的成熟的全长蛋白,及其片段、变体和/或融合蛋白,例如WO00/37105的SEQ ID NO: 4。PhtD也称为“Sp036D”。在一个方面,PhtD是具有信号序列附着的全长蛋白,例如WO00/37105的SEQ ID NO: 4。在另一个方面,PhtD是包含具有信号肽(例如在N末端处的20个氨基酸)去除的成熟的全长蛋白的序列,例如WO00/37105的SEQ ID NO: 4的氨基酸21-838(或本申请的SEQ ID NO:1)。适当地,PhtD序列包含N末端甲硫氨酸。本发明还包括其为PhtD的免疫原性片段、PhtD变体和/或PhtD的融合蛋白的PhtD多肽。例如,如WO00/37105、WO00/39299、US6699703和WO09/12588中所述。
当使用PhtD蛋白的片段(分开地或作为融合蛋白的部分)时,这些片段长度为例如来自WO00/37105或WO00/39299中的PhtD氨基酸序列,例如WO00/37105的SEQ ID NO: 4的至少约15、至少约20、至少约40或至少约60个邻接氨基酸残基。在本发明的一个实施方案中,PhtD蛋白的免疫原性片段包含WO00/37105的SEQ ID NO: 4中所示的序列的至少约15、至少约20、至少约40或至少约60个邻接氨基酸残基,其中所述多肽能够引发对于所述氨基酸序列特异性的免疫应答。在一个实施方案中,本发明的免疫原性组合物包含例如WO09/12601、WO01/98334和WO09/12588中所述的PhtD的片段。当使用PhtD蛋白的片段(分开地或作为融合蛋白的部分)时,每个片段任选含有此类多肽的一个或多个三联组氨酸基序。三联组氨酸基序是具有序列HxxHxH(SEQ ID NO:2)的多肽的一部分,其中H是组氨酸,并且x是除组氨酸外的氨基酸。在本发明的一个实施方案中,该片段或每个片段含有确切地或至少2、3、4或5个三联组氨酸基序(任选地,在2个或更多个三联体之间具有天然PhtD序列,或三联体内序列),其中所述片段与天然肺炎球菌三联体内PhtD序列(例如WO00/37105的SEQ ID NO: 4中所示的三联体内序列)多于50、60、70、80、85、90、95、98、99或100%相同。PhtD蛋白的片段任选含有此类多肽的一个或多个卷曲螺旋区。卷曲螺旋区是通过“Coils”算法Lupus,A等人(1991)Science 252;1162-1164预测的区域。在本发明的一个实施方案中,该片段或每个片段含有确切地或至少2、3或4个卷曲螺旋区。在本发明的一个实施方案中,该片段或每个片段含有确切地或至少2、3或4个卷曲螺旋区,其中所述片段与天然肺炎球菌PhtD序列(例如WO00/37105的SEQ ID NO: 4中所示的序列)多于50、60、70、80、90、95、96、98、99或100%相同。在本发明的另一个实施方案中,该片段或每个片段包括一个或多个三联组氨酸基序以及至少1、2、3或4个卷曲螺旋区。
在其中PhtD多肽是变体的情况下,变化一般在除三联组氨酸残基和卷曲螺旋区外的其一部分中,尽管可以制备在这些区域中的一个或多个中的变化。根据本发明,多肽变体包括这样的序列,其中与野生型序列相比较,一个或多个氨基酸被取代和/或缺失和/或插入。氨基酸取代可以是保守或非保守的。在一个方面,氨基酸取代是保守的。取代、缺失、插入或其任何组合可以在单一变体中组合,只要该变体是免疫原性多肽。PhtD的变体通常包括PhtD的任何片段或变体,其与野生型PhtD序列,例如来自WO00/37105的SEQ ID NO: 4,共享至少80、90、95、96、98或99%氨基酸序列同一性。在一个实施方案中,本发明包括片段和/或变体,其中几个、5 - 10、1 - 5、1 - 3、1 - 2、1、最高达10、最高达20、最高达30或最高达50个氨基酸以任何组合被取代、缺失或添加。在另一个实施方案中,本发明包括片段和/或变体,其包含B细胞或T细胞表位。此类表位可以使用2D结构预测的组合进行预测,例如使用PSIPRED程序(来自David Jones,Brunel Bioinformatics Group,Dept. Biological Sciences,Brunel University,Uxbridge UB8 3PH,UK)和基于由Jameson和Wolf(CABIOS 4:181-186 [1988])描述的方法计算的抗原指数。变体可以通过常规分子生物学技术产生。如本文使用的变体还可以包括来自替代链球菌属(Streptococcus)菌株的天然存在的PhtD等位基因,其在同源PhtD基因内的一个或多个位点处显示出多态性。
在本发明的一个实施方案中,PhtD及其片段、变体和/或融合蛋白包含与WO00/37105的SEQ ID NO:4的氨基酸序列21 - 838共享至少80、85、90、95、96、97、98、99或100%同一性的氨基酸序列。在本发明的另一个实施方案中,PhtD及其片段、变体和/或融合蛋白具有与WO00/37105的SEQ ID NO:4的氨基酸序列21 - 838共享至少80、85、90、95、96、97、98、99或100%同一性的氨基酸序列。适当地,PhtD及其片段、变体和/或融合蛋白包含具有N末端甲硫氨酸的氨基酸序列。在本发明的另一个实施方案中,PhtD及其片段、变体和/或融合蛋白包含WO00/37105的SEQ ID NO:4中所示序列的至少约15、至少约20、至少约40、或至少约60或至少约100、或至少约200、或至少约400或至少约800个邻接氨基酸残基。
在本发明的一个实施方案中,PhtD及其片段、变体和/或融合蛋白包含与WO00/39299(通过引用并入本文)的氨基酸序列SEQ ID NO:73共享至少80、85、90、95、96、97、98、99或100%同一性的氨基酸序列。在本发明的另一个实施方案中,PhtD及其片段、变体和/或融合蛋白具有与WO00/39299的氨基酸序列SEQ ID NO:73共享至少80、85、90、95、96、97、98、99或100%同一性的氨基酸序列。在本发明的另一个实施方案中,PhtD及其片段、变体和/或融合蛋白包含WO00/39299的SEQ ID NO:73中所示序列的至少约15、至少约20、至少约40、或至少约60或至少约100、或至少约200、或至少约400或至少约800个邻接氨基酸残基。在本发明的另一个实施方案中,PhtD序列是来自WO2011/075823的SEQ ID NO. 1或5。
本发明还包括以不涉及氨基酸序列的方式不同于天然存在的肺炎链球菌多肽的PhtD蛋白。非序列修饰包括乙酰化、甲基化、磷酸化、羧化或糖基化中的变化。还在本发明内的是具有增加肽稳定性的修饰的那些;此类类似物可以含有例如肽序列中的一个或多个非肽键(其替换肽键)。还在本发明内的是包括除天然存在的L-氨基酸外的残基的类似物,所述残基例如D-氨基酸或者非天然存在的或合成氨基酸,例如β或γ氨基酸和环状类似物。
剂量
如本文使用的,术语“人剂量”意指采取适合于人使用的体积的剂量。一般地,施用于人患者的最终剂量体积(疫苗组合物体积)可以是0.25 - 1.5 ml、0.2 - 1.0 ml或0.4 - 0.6 ml。在一个实施方案中,人剂量是0.5 ml。在进一步的实施方案中,人剂量高于0.5 ml,例如0.6、0.7、0.8、0.9或1 ml。在进一步的实施方案中,人剂量是1 ml - 1.5 ml。在另一个实施方案中,特别当免疫原性组合物用于儿科群体时,人剂量可以小于0.5 ml例如0.25 - 0.5 ml。
进一步的未缀合或缀合的肺炎链球菌蛋白
本发明的免疫原性组合物可以包含至少一种进一步的未缀合或缀合的肺炎链球菌蛋白。为了本申请的目的,术语肺炎链球菌(S.pneumoniae)和肺炎链球菌(Streptococcus pneumoniae)视为彼此可互换且等价的。在一个实施方案中,至少一种进一步的未缀合或缀合的肺炎链球菌蛋白选自聚三联组氨酸家族(PhtX)、胆碱结合蛋白家族(CbpX)、CbpX截短物、LytX(自溶酶)家族、LytX截短物、CbpX截短物-LytX截短物嵌合蛋白、PcpA(肺炎球菌胆碱结合蛋白A)、PspA(肺炎球菌表面蛋白A)、PsaA(肺炎球菌表面粘附蛋白A、Sp128(肺炎链球菌128)、Sp101(肺炎链球菌101)、Sp130(肺炎链球菌130)、SP125(肺炎链球菌125)和SP133(肺炎链球菌133)。在进一步的实施方案中,至少一种进一步的未缀合或缀合的肺炎链球菌蛋白选自胆碱结合蛋白家族(CbpX)、CbpX截短物、LytX家族、LytX截短物、CbpX截短物-LytX截短物嵌合蛋白、PcpA、PspA、PsaA、Sp128、Sp101、Sp130、SP125和SP133。
Pht(聚三联组氨酸)家族包含蛋白PhtA(聚三联组氨酸家族A)、PhtB(聚三联组氨酸家族B)、PhtD(聚三联组氨酸家族B)、和PhtE(聚三联组氨酸家族E)。聚三联组氨酸家族还称为肺炎球菌三联组氨酸家族,并且因此术语‘聚三联组氨酸’和‘肺炎球菌三联组氨酸’视为彼此可互换且等价的。该家族的特征在于脂质化序列;由富含脯氨酸区和几个三联组氨酸分隔开的两个结构域,可能涉及金属或核苷的结合或酶促活性;(3-5)个卷曲螺旋区;保守的N末端和异源的C末端。它存在于已测试的所有肺炎球菌菌株中。同源蛋白也已在其他链球菌和奈瑟氏球菌属(Neisseria)中发现。在本发明的一个实施方案中,本发明的Pht蛋白为PhtD。然而,应当理解术语Pht A、B、D和E指具有在以下引用文献中公开的序列的蛋白,以及其天然存在的(和人工制备的)变体,所述变体与参考蛋白具有至少90%相同的序列同源性。任选地,它是至少95%相同或至少97%相同。
对于PhtX蛋白而言,PhtA在WO 98/18930中公开,并且也称为Sp36。如上所述,它是来自聚三联组氨酸家族的蛋白,并且具有LXXC的II型信号基序(SEQ ID NO:3)。PhtD在WO 00/37105中公开,并且也称为Sp036D。如上所述,它也是来自聚三联组氨酸家族的蛋白,并且具有II型LXXC信号基序。PhtB在WO 00/37105中公开,并且也称为Sp036B。PhtB家族的另一成员是如WO 00/17370中公开的C3-降解多肽。该蛋白也来自聚三联组氨酸家族,并且具有II型LXXC信号基序。例如,免疫功能等价物为在WO 98/18930中公开的蛋白Sp42。PhtB截短物(约79 kD)在WO 99/15675中公开,其也被认为是PhtX家族的成员。PhtE在WO 00/39299中公开,并且被称为BVH-3。当本文提到任何Pht蛋白时,意指可以使用Pht蛋白的免疫原性片段或其融合体。例如,提及PhtX包括来自任何Pht蛋白的免疫原性片段或其融合体。提及PhtD或PhtB也是提及如例如WO 0198334中可见的PhtDE或PhtBE融合体。
关于胆碱结合蛋白家族(CbpX),该家族的成员最初被鉴定为能用胆碱亲和层析纯化的肺炎球菌蛋白。所有胆碱结合蛋白都非共价结合于细胞壁磷壁酸和膜结合脂磷壁酸的磷酸胆碱部分。虽然该蛋白的确切性质(氨基酸序列、长度等)可以不同,但整个家族具有数个在结构上共同的区域。一般而言,胆碱结合蛋白包含N末端区(N)、保守重复区(R1和/或R2)、富含脯氨酸区(P)和保守的胆碱结合区(C),该胆碱结合区由多个重复序列组成,约占该蛋白的一半。如本申请中使用的,术语“胆碱结合蛋白家族(CbpX)”选自如WO97/41151中所鉴定的胆碱结合蛋白、PbcA、SpsA、PspC、CbpA、CbpD和CbpG。CbpA公开于WO97/41151。CbpD和CbpG公开于WO00/29434。PspC公开于WO97/09994。PbcA公开于WO98/21337。SpsA为WO 98/39450中公开的胆碱结合蛋白。任选地,该胆碱结合蛋白选自CbpA、PbcA、SpsA和PspC。
本发明的一个实施方案包含CbpX截短物,其中“CbpX”在上文定义,并且“截短物”指缺乏50%或更多的胆碱结合区(C)的CbpX蛋白。任选地,此类蛋白缺乏整个胆碱结合区。任选地,此类蛋白截短物缺乏(i)胆碱结合区和(ii)该蛋白的N末端一半的一部分,但保留至少一个重复区(R1或R2)。任选地,该截短物具有2个重复区(R1和R2)。此类实施方案的实例是如WO99/51266或WO99/51188中举例说明的NR1xR2和R1xR2,但是,其他缺乏相似的胆碱结合区的胆碱结合蛋白也包含在本发明的范围内。
LytX家族是与细胞裂解有关的膜结合蛋白。N末端结构域包含胆碱结合结构域,然而,LytX家族并不具有在上述CbpA家族中发现的所有特征,因此,对于本发明而言,LytX家族被认为不同于CbpX家族。与CbpX家族相比,C末端结构域含有LytX蛋白家族的催化结构域。该家族包含LytA、B和C。对于LytX家族而言,LytA公开于Ronda等,Eur J Biochem,164:621-624(1987)。LytB公开于WO 98/18930,并且也被称为Sp46。LytC也公开于WO 98/18930,并且也被称为Sp91。本发明的实施方案包含LytC。
另一个实施方案包含LytX截短物,其中“LytX”在上文定义,并且“截短物”指缺乏50%或更多胆碱结合区的LytX蛋白。任选地,此类蛋白缺乏整个胆碱结合区。本发明的又一个实施方案包含CbpX截短物-LytX截短物嵌合蛋白(或融合体)。任选地,这包含CbpX的NR1xR2(或R1xR2)和LytX的C末端部分(Cterm,即缺乏胆碱结合结构域)(例如LytCCterm或Sp91Cterm)。任选地,CbpX选自CbpA、PbcA、SpsA和PspC。任选地,其为CbpA。任选地,Lytx为LytC(也被称为Sp91)。本发明的另一个实施方案为PspA或PsaA截短物,其缺乏胆碱结合结构域(C),并且与LytX一起表达为融合蛋白。任选地,LytX为LytC。
PsaA和PspA这二者在本领域都是已知的。例如,Berry和Paton,Infect Immun 1996年12月;64(12):5255-62已描述了PsaA及其跨膜缺失变体。例如US5804193、WO 92/14488和WO 99/53940已公开了PspA及其跨膜缺失变体。
对于PcpA而言,该蛋白是本领域已知的,例如PcpA已在WO2011/075823中得到描述。术语‘PcpA’指包含与来自WO2011/075823(通过引用并入本文)的SEQ ID NO:2或7至少80%、85%、90%、95%、98%、99%或100%相同的蛋白,或者来自WO2011/075823的SEQ ID NO:2或7的至少100、150、200、250个或更多个邻接氨基酸的片段。
Sp128和Sp130公开于WO00/76540。Sp125是带有细胞壁锚定基序LPXTG(SEQ ID NO:4)(其中X为任何氨基酸)的肺炎球菌表面蛋白的实例。具有此基序的这类肺炎球菌表面蛋白内的任何蛋白在本发明的背景下都已被发现是有用的,因此将其视为本发明的另一种蛋白。Sp125本身公开于WO 98/18930,并且也称为ZmpB-锌金属蛋白酶。Sp101公开于WO 98/06734(在其中它具有参考# y85993)。它的特征在于I型信号序列。Sp133公开于WO 98/06734(在其中它具有参考# y85992)。它的特征也在于I型信号序列。
任何这些进一步的肺炎链球菌蛋白均可以未缀合或缀合的形式存在。一种或多种肺炎链球菌蛋白任选缀合至肺炎链球菌糖(在下文名称为肺炎链球菌糖缀合物的部分中描述)。任选地,一种或多种肺炎链球菌蛋白缀合至来自不同细菌的糖。
在该上下文中,术语‘缀合至’意指该蛋白与糖共价键合,在这种情况下,该蛋白充当载体蛋白。
在一个实施方案中,至少一种进一步的未缀合或缀合的肺炎链球菌蛋白包含选自PhtB、PhtE、PhtA和PhtBD或PhtDE融合蛋白的聚组氨酸家族(PhtX)蛋白。
在一个实施方案中,该组合物包含1μg-100μg、1μg-75μg、1μg-50μg、1μg-25μg、1μg-20μg、5μg-15μg、25μg-40μg、28μg-35μg、约10μg或约30μg的至少一种进一步的未缀合或缀合的肺炎链球菌蛋白/人剂量/蛋白。
肺炎链球菌荚膜糖缀合物
在一个实施方案中,本发明的免疫原性组合物进一步包含一种或多种(例如7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23种)肺炎链球菌荚膜糖缀合物。术语荚膜糖包括荚膜多糖和可来源于荚膜多糖的寡糖。寡糖含有至少4个糖残基。术语缀合物和缀合的涉及与载体蛋白共价键合的荚膜糖。
任选地,糖血清型的总数目小于或等于23,任选地,免疫原性组合物包含10-23个血清型、10-16个血清型、10-15个血清型、10-14个血清型、10-13个血清型或10-12个血清型。
在一个实施方案中,本发明的一种或多种肺炎链球菌荚膜糖缀合物包含来源于选自下述血清型的血清型的糖:1、2、3、4、5、6A、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F,尽管应当理解取决于接受免疫原性组合物的接受者的年龄和在其中将施用疫苗的地理位置,可以取代一个或两个其他血清型。例如,7价免疫原性组合物可以包含来自血清型4、6B、9V、14、18C、19F和23F的糖。10价免疫原性组合物可以包含来源于相同7个血清型的糖,并且进一步包含来自血清型1、5和7F的糖。12价免疫原性组合物可以包含来源于相同10个血清型的糖,并且进一步包含来源于血清型6A和19A的糖。13价免疫原性组合物可以包含相同12个血清型,并且进一步包含血清型3。15价免疫原性组合物可以包含来源于相同13个血清型的糖,并且进一步包含来源于血清型22F和33F的糖。
进一步的糖抗原例如23价(例如血清型1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F)也由本发明包含。
术语“载体蛋白”意欲涵盖小肽和大多肽(>10 kDa)两者。载体蛋白可以是任何肽或蛋白。它可以包含一个或多个T辅助表位。载体蛋白可以是破伤风类毒素(TT)、破伤风类毒素片段C、破伤风毒素的无毒突变体[注:为了本发明的目的,所有此类TT变体均视为相同类型的载体蛋白]、包含破伤风毒素T细胞表位例如N19的多肽(WO2006/067632)、白喉类毒素(DT)、CRM197(交叉反应物质197)、白喉毒素的其他无毒突变体[例如CRM176、CRM 197、CRM228、CRM 45(Uchida等人J. Biol. Chem. 218;3838-3844,1973);CRM 9、CRM 45、CRM102、CRM 103和CRM107(其中CRM代表交叉反应物质)及其他由Nicholls和Youle在Genetically Engineered Toxins,Ed: Frankel,Maecel Dekker Inc,1992中描述的突变;Glu-148至Asp、Gln或Ser和/或Ala 158至Gly的缺失或突变及其他公开于US 4709017或US 4950740中的突变;至少一个或多个残基Lys 516、Lys 526、Phe 530和/或Lys 534的突变及其他公开于US 5917017或US 6455673中的突变;或公开于US 5843711中的片段](注:为了本发明的目的,所有此类DT变体均视为相同类型的载体蛋白)、肺炎球菌肺炎球菌溶血素(Kuo等人(1995)Infect Immun 63;2706-13)、OMPC(外膜蛋白C)(脑膜炎球菌外膜蛋白 - 通常取自脑膜炎奈瑟氏球菌(N. meningitidis)血清群B – EP0372501)、合成肽(EP0378881、EP0427347)、热休克蛋白(WO 93/17712、WO 94/03208)、百日咳蛋白(WO 98/58668、EP0471177)、细胞因子、淋巴因子、生长因子或激素(WO 91/01146)、包含来自多种病原体衍生抗原的多重人CD4+ T细胞表位的人工蛋白(Falugi等人(2001)Eur J Immunol 31;3816-3824),例如N19蛋白(Baraldoi等人(2004)Infect Immun 72;4884-7)、肺炎球菌表面蛋白PspA(肺炎球菌表面蛋白A)(WO 02/091998)、铁摄取蛋白(WO 01/72337)、艰难梭菌(C. difficile)的毒素A或B(WO 00/61761)、流感嗜血杆菌(H. influenzae)蛋白D(EP594610和WO 00/56360)、肺炎球菌PhtA(聚三联组氨酸蛋白A)(WO 98/18930,也称为Sp36)、肺炎球菌PhtD(聚三联组氨酸蛋白D)(如上文PhtD部分中所述)、肺炎球菌PhtB(聚三联组氨酸蛋白B)(公开于WO 00/37105中,并且也称为Sp036B)、或PhtE(聚三联组氨酸蛋白E)(公开于WO00/30299中,并且也称为BVH-3)。
在一个实施方案中,一种或多种肺炎链球菌荚膜糖缀合物缀合至独立地选自下述的载体蛋白:破伤风类毒素(TT)、TT的片段C、白喉类毒素、CRM197(交叉反应物质197)、脱毒的肺炎球菌溶血素、蛋白D(来自流感嗜血杆菌)、PhtD、PhtDE和N19。在进一步的实施方案中,一种或多种肺炎链球菌荚膜糖缀合物均独立地缀合至CRM197。
在一个实施方案中,免疫原性组合物包含至少一种缀合至蛋白D的肺炎链球菌荚膜糖。在一个实施方案中,缀合的肺炎链球菌糖中的少数缀合至蛋白D。在进一步的实施方案中,免疫原性组合物包含1-20、1-18、1-16、1-14、1-12、1-10、1-9、1-8、1-7、1-6、1-5、1-4或1-2种缀合至蛋白D的肺炎链球菌荚膜糖。在一个实施方案中,免疫原性组合物包含至少一种缀合至白喉类毒素的肺炎链球菌荚膜糖。在进一步的实施方案中,免疫原性组合物包含19F糖缀合物,其中19F糖缀合至白喉类毒素。在一个实施方案中,免疫原性组合物包含至少一种缀合至破伤风类毒素的肺炎链球菌荚膜糖。在进一步的实施方案中,免疫原性组合物包含18C糖缀合物,其中18C糖缀合至破伤风类毒素。
在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型1糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型4糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型5糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型6B糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型7F糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型9V糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的血清型14糖。在一个实施方案中,免疫原性组合物包含缀合至破伤风类毒素或CRM197的血清型18C糖。在一个实施方案中,免疫原性组合物包含缀合至白喉类毒素或CRM197的19F糖。在一个实施方案中,免疫原性组合物包含缀合至蛋白D或CRM197的23F糖。在一个实施方案中,免疫原性组合物包含缀合至CRM197的19A糖。在一个实施方案中,免疫原性组合物包含缀合至CRM197的6A糖。
在一个实施方案中,一种或多种肺炎链球菌缀合物包含缀合至蛋白D的血清型1糖、缀合至蛋白D的血清型4糖、缀合至蛋白D的血清型5糖、缀合至蛋白D的血清型6B糖、缀合至蛋白D的血清型7F 糖、缀合至蛋白D的血清型9V糖、缀合至蛋白D的血清型14糖、缀合至蛋白D的血清型23F糖、缀合至破伤风类毒素的血清型18C糖和缀合至白喉类毒素的19F糖。
任选地,载体蛋白与肺炎链球菌糖的比为1:5 - 5:1; 1:2 - 2.5:1; 1:1 - 2:1(w/w)。在一个实施方案中,缀合物中的大多数,例如缀合物中的6、7、8、9种或更多种具有大于1:1,例如1.1:1、1.2:1、1.3:1、1.4:1、1.5:1或1.6:1的载体蛋白与糖的比。
在本说明书自始至终,术语“糖”可以指示多糖或寡糖并且包括两者。多糖分离自细菌,并且可以通过已知方法(参见例如EP497524和EP497525)且任选通过微流化,将尺寸设定为一定程度。多糖可以具有一定的尺寸,以便降低多糖样品中的粘度和/或改善缀合产物的可过滤性。寡糖具有低数目的重复单位(通常为5-30个重复单位),并且通常为水解的多糖。
肺炎链球菌的荚膜多糖包含可以含有最高达8个糖残基的重复寡糖单位。关于关键肺炎链球菌血清型的寡糖单位的综述,参见JONES,Christopher. Vaccines based on the cell surface carbohydrates of pathogenic bacteria. An. Acad. Bras. Ciênc.,June 2005,第77卷,no.2,第293-324页,ISSN 0001-3765。在一个实施方案中,荚膜糖抗原可以是全长多糖,然而,在其他实施方案中,它可以是一个寡糖单位,或短于重复寡糖单位的天然长度糖链。在一个实施方案中,疫苗中存在的所有糖均为多糖。全长多糖可以“具有一定大小”,即它们的大小可以通过多种方法降低,所述方法例如酸水解处理、过氧化氢处理、通过emulsiflex®筛分随后为过氧化氢处理以生成寡糖片段或微流化。
缀合
使用任何缀合技术,可以将本发明的免疫原性组合物中存在的糖缀合物缀合至载体蛋白。
在一个实施方案中,肺炎链球菌糖经由接头例如双功能接头缀合至载体蛋白。接头任选是异双功能的或同双功能的,具有例如反应性氨基和反应性羧酸基团、2个反应性氨基或两个反应性羧酸基团。接头具有例如4 - 20、4 - 12、5 - 10个碳原子。可能的接头是ADH。其他接头包括B-丙酰胺基(WO 00/10599)、硝基苯基-乙胺(Gever等人(1979)Med. Microbiol. Immunol. 165;171-288)、卤代烷基卤化物(US4057685)、糖苷键(US4673574、US4808700)、己二胺和6-氨基己酸(US4459286)。在一个实施方案中,ADH用作接头用于缀合来自血清型18C的糖。
本发明的免疫原性组合物中存在的糖缀合物可以通过任何已知的偶联技术进行制备。缀合方法可以依赖糖由1-氰基-4-二甲基氨基吡啶鎓四氟硼酸盐(CDAP)的活化,以形成氰酸酯。活化的糖因此可以与载体蛋白上的氨基直接偶联或经由间隔物(接头)基团偶联。例如,间隔物可以是胱胺或半胱胺,以获得硫醇化多糖,其可以经由硫醚键偶联至载体,所述硫醚键在与马来酰亚胺活化的载体蛋白(例如使用GMBS)或卤代乙酰化载体蛋白(例如使用碘乙酰胺[例如乙基碘乙酰胺HCl]或N-琥珀酰亚胺溴乙酸酯或SIAB或SIA或SBAP)反应后获得。任选地,氰酸酯(任选通过CDAP化学作用制备)由己二胺或ADH偶联,并且经由在蛋白载体上的羧基,使用碳二亚胺(例如EDAC或EDC)化学作用,使氨基衍生的糖缀合至载体蛋白。此类缀合物在PCT公开申请WO 93/15760 Uniformed Services University以及WO 95/08348和WO 96/29094中描述。
其他合适的技术使用碳二亚胺、carbiinides、酰肼、活性酯、降冰片烷(norborane)、对-硝基苯甲酸、N-羟基琥珀酰亚胺、S-NHS、EDC、TSTU。许多在WO 98/42721中描述。缀合可以涉及羰基接头,其可以通过糖的游离羟基与CDI的反应形成(Bethell等人J. Biol. Chem. 1979,254;2572-4,Hearn等人J. Chromatogr. 1981. 218;509-18),随后为与蛋白的反应,以形成氨基甲酸酯连接。这可以涉及异头末端还原至伯羟基,伯羟基与CDI的伯羟基反应的任选保护/脱保护,以形成CDI氨基甲酸酯中间产物,并且使CDI氨基甲酸酯中间产物与蛋白上的氨基偶联。
缀合物还可以通过直接还原胺化方法进行制备,如US 4365170(Jennings)和US 4673574(Anderson)中描述的。其他方法在EP-0-161-188、EP-208375和EP-0-477508中描述。
进一步方法涉及通过碳二亚胺缩合(Chu C.等人Infect. Immunity,1983 245 256),例如使用EDAC(1-乙基-2-(3-二甲基氨基丙基)碳二亚胺),由己二酸二酰肼(ADH)衍生的溴化氰(或CDAP)活化的糖与蛋白载体的偶联。
在一个实施方案中,在糖上的羟基(任选活化羟基例如活化为制备氰酸酯的羟基[例如使用CDAP])直接或间接(通过接头)连接至蛋白上的氨基或羧基。当存在接头时,例如通过使用CDAP缀合,糖上的羟基任选连接至接头上的氨基。例如通过使用碳二亚胺化学作用,例如通过使用EDAC,接头例如ADH)中的进一步氨基可以缀合至蛋白上的羧酸基团。在一个实施方案中,在接头缀合至载体蛋白之前,一种或多种肺炎球菌荚膜糖首先缀合至接头。可替代地,接头可以在缀合至糖之前缀合至载体。
还可以使用技术的组合,其中一些糖-蛋白缀合物通过CDAP制备,并且一些通过还原胺化制备。
一般而言,在蛋白载体上的下述类型的化学基团可以用于偶联/缀合:
A)羧基(例如经由天冬氨酸或谷氨酸)。在一个实施方案中,该基团直接连接至糖上的氨基或用碳二亚胺化学作用例如EDAC连接至接头上的氨基。
B)氨基(例如经由赖氨酸)。在一个实施方案中,该基团直接连接至糖上的羧基或用碳二亚胺化学作用例如EDAC连接至接头上的羧基。在另一个实施方案中,该基团直接连接至糖上由CDAP或CNBr活化的羟基或者连接至接头上的此类基团;连接至具有醛基的糖或接头;连接至具有琥珀酰亚胺酯基团的糖或接头。
C)巯基(例如经由半胱氨酸)。在一个实施方案中,该基团连接至溴或氯乙酰化的糖或者具有马来酰亚胺化学作用的接头。在一个实施方案中,该基团由双重氮联苯胺活化/修饰。
D)羟基(例如经由酪氨酸)。在一个实施方案中,该基团由用双重氮联苯胺活化/修饰。
E)咪唑基(例如经由组氨酸)。在一个实施方案中,该基团由双重氮联苯胺活化/修饰。
F)胍基(例如经由精氨酸)。
G)吲哚基(例如经由色氨酸)。
在糖上,一般地,下述基团能够用于偶联:OH、COOH或NH2。醛基能够在本领域已知的不同处理后生成,所述处理例如:高碘酸盐、酸水解、过氧化氢等。
直接偶联方法:
糖-OH + CNBr或CDAP -----> 氰酸酯 + NH2-Prot ----> 缀合物
糖-醛 + NH2-Prot ----> 希夫碱+ NaCNBH3 ----> 缀合物
糖-COOH + NH2-Prot + EDAC ----> 缀合物
糖-NH2 + COOH-Prot + EDAC ----> 缀合物
经由间隔物(接头)的间接偶联方法:
糖-OH + CNBr或CDAP --->氰酸酯 + NH2----NH2 ---->糖----NH2 + COOH-Prot + EDAC -----> 缀合物
糖-OH + CNBr或CDAP ---->氰酸酯 + NH2-----SH ----->糖----SH + SH-Prot(具有暴露的半胱氨酸的天然蛋白,或通过例如SPDP修饰蛋白的氨基后获得)----->糖-S-S-Prot
糖-OH + CNBr或CDAP --->氰酸酯 + NH2----SH ------->糖----SH + 马来酰亚胺-Prot(氨基的修饰)----> 缀合物
糖-OH + CNBr或CDAP --->氰酸酯 + NH2-----SH --->糖-SH + 卤代乙酰化-Prot ----> 缀合物
糖-COOH + EDAC + NH2-----NH2 --->糖------NH2 + EDAC + COOH-Prot ----> 缀合物
糖-COOH + EDAC+ NH2----SH ----->糖----SH + SH-Prot(具有暴露的半胱氨酸的天然蛋白,或通过例如SPDP修饰蛋白的氨基后获得)----->糖-S-S-Prot
糖-COOH + EDAC+ NH2----SH ----->糖----SH +马来酰亚胺-Prot(氨基的修饰)----> 缀合物
糖-COOH + EDAC + NH2----SH --->糖-SH +卤代乙酰化-Prot ----> 缀合物
糖-醛 + NH2-----NH2 ---->糖---NH2 + EDAC + COOH-Prot ----> 缀合物
注:除上述EDAC之外,还可以使用任何合适的碳二亚胺。
总之,一般可以用于与糖偶联的蛋白载体化学基团的类型是氨基(例如在赖氨酸残基上)、COOH基团(例如在天冬氨酸和谷氨酸残基上)和SH基团(如果可接近的话)(例如在半胱氨酸残基上)。
在一个实施方案中,至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23种肺炎链球菌糖通过还原胺化缀合至载体蛋白。在一个实施方案中,小于23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1种肺炎链球菌糖通过还原胺化缀合至载体蛋白。在一个实施方案中,1 - 23、2 - 22、3 - 21、4 - 20、5 - 19、6 - 18、7 - 17、8 - 16、9 - 15、10 - 14、11 - 13、1 - 23、- 22、1 - 21、1 - 20、1 - 19、1 - 18、1 - 17、1 - 16、1 - 15、1 - 14、1 - 13、1 - 12、1 - 11、1 - 10、1 - 9、1 - 8、1 - 7、1 - 6、1 - 5、1 - 4、1 - 3或1 - 2种肺炎链球菌糖通过还原胺化缀合至载体蛋白。在进一步的实施方案中,所有肺炎链球菌荚膜糖通过还原胺化缀合至载体蛋白。
在一个实施方案中,至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23种肺炎链球菌糖通过CDAP化学作用缀合至载体蛋白。在一个实施方案中,小于23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1种肺炎链球菌糖通过CDAP化学作用缀合至载体蛋白。在一个实施方案中,1 - 23、2 - 22、3 - 21、4 - 20、5 - 19、6 - 18、7 - 17、8 - 16、9 - 15、10 - 14、11 - 13、1 - 23、- 22、1 - 21、10 - 23、10 - 22、10 - 21、10 - 20、10 - 19、10 - 18、10 - 17、10 - 16、10 - 15、10 - 14、10 - 13、10 - 12、10 - 11、1 - 20、1 - 19、1 - 18、1 - 17、1 - 16、1 - 15、1 - 14、1 - 13、1 - 12、1 - 11、1 - 10、1 - 9、1 - 8、1 - 7、1 - 6、1 - 5、1 - 4、1 - 3或1 - 2种肺炎链球菌糖通过CDAP化学作用缀合至载体蛋白。在进一步的实施方案中,所有肺炎链球菌荚膜糖通过CDAP化学作用缀合至载体蛋白。
在一个实施方案中,本发明的免疫原性组合物包含通过还原胺化缀合至载体蛋白的至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21或22种糖,并且包含通过除还原胺化外的化学作用例如CDAP化学作用缀合至载体蛋白的至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21或22种糖。
在一个实施方案中,来自选自血清型1、3、19A和19F的至少一种血清型的荚膜糖通过除还原胺化外的化学作用缀合,并且选自血清型4、5、6A、6B、6C、7F、9V、14、18C和23F的至少一种血清型通过还原胺化缀合。在一个实施方案中,本发明的免疫原性组合物包含通过除还原胺化外的化学作用缀合至蛋白载体的来自下述血清型的一种或多种肺炎链球菌荚膜糖:1或3或19A或19F;1和3;1和19A;1和19F;3和19A;3和19F;19A和19F;1、3和19A;1、3和19F,1、19A和19F;3、19A和19F或1、3、19A和19F。在一个实施方案中,19F通过除还原胺化外的化学作用缀合至载体蛋白。在一个实施方案中,本发明的免疫原性组合物包含通过氰化化学作用例如CDAP化学作用缀合至蛋白载体的来自下述血清型的肺炎链球菌荚膜糖:1或3或19A或19F;1和3;1和19A;1和19F;3和19A;3和19F;19A和19F;1、3和19A;1、3和19F,1、19A和19F;3、19A和19F或1、3、19A和19F。在一个实施方案中,19F通过CDAP化学作用缀合至载体蛋白。在本发明的一个实施方案中,下述肺炎链球菌荚膜糖或其组通过还原胺化缀合至载体蛋白;血清型4、5、6A、6B、7F、9V、14、18C或23F、4和5、4和6A、4和6B、4和7F、4和9V、4和14、4和18C、4和23F、 5和6A、5和6B、5和7F、5和9V、5和14、5和18C、5和23F、6A和6B、6A和7F、6A和9V、6A和14、6A和18C、6A和23F、6B和7F、6B和9V、6B和14、6B和18C、6B和23F、7F和9V、7F和14、7F和18C、7F和23F、9V和14、9V和18C、9V和23F、14和18C、14和23F或18C和23F。在一个实施方案中,23F通过还原胺化化学作用缀合至载体蛋白。
糖缀合物的剂量
一般而言,本发明的免疫原性组合物可以包含0.1-20μg、1-5μg、1-10μg或1-3μg糖/缀合物的剂量。
在一个实施方案中,本发明的免疫原性组合物含有缀合物,所述缀合物包含以0.1-20μg;0.5-10μg;0.5- 5μg 或1-3μg糖剂量的每种肺炎链球菌荚膜糖。在一个实施方案中,荚膜糖可以以不同剂量存在,例如一些荚膜糖可以以确切地1μg的剂量存在,或一些荚膜糖可以以确切地3μg的剂量存在。在一个实施方案中,来自血清型3、18C和19F(或4、18C和19F)的糖以高于其他糖的剂量存在。在该实施方案的一个方面,血清型3、18C和19F(或4、18C和19F)以约或确切地3μg的剂量存在,而免疫原性组合物中的其他糖以约或确切地1μg的剂量存在。在一个实施方案中,血清型1、5、6B、7F、9V、14和23F以约或确切地1μg的剂量存在。
佐剂
在一个实施方案中,组合物不含以脂质体形式呈现的佐剂,所述佐剂包含QS21、单磷酰脂质A(MPL)、磷脂和固醇。包含以脂质体形式呈现的佐剂的组合物在PCT申请号WO2012/156391中描述,所述佐剂包含QS21、单磷酰脂质A(MPL)、磷脂和固醇。在一个实施方案中,免疫原性组合物不包含含有QS 21的佐剂。在进一步的实施方案中,免疫原性组合物不包含含有单磷酰脂质A(MPL)的佐剂。在一个实施方案中,免疫原性组合物不含QS21或MPL。QS21是来源于皂树(Quillaja saponaria)的佐剂。
在一个实施方案中,免疫原性组合物进一步包含佐剂。
合适的佐剂包括但不限于铝盐(磷酸铝或氢氧化铝),单磷酰脂质A(例如3D-MPL),皂苷(例如QS21),水包油乳剂,来自革兰氏阴性细菌菌株的泡(bleds)或外膜囊泡制剂(例如由WO02/09746教导的那些),脂质A或其衍生物,烷基糖苷磷酸酯或者这些佐剂中的两种或更多种的组合。在一个实施方案中,佐剂是磷酸铝。在进一步的实施方案中,佐剂包含作为磷酸铝的100-750、150-600、 200-500、250-450、 300-400或约350μg铝/人剂量。在进一步的实施方案中,佐剂是氢氧化铝。在一个实施方案中,佐剂不含水包油佐剂。
疫苗
本发明提供了包含本发明的免疫原性组合物的疫苗。本文涉及本发明的“免疫原性组合物”的实施方案还可应用于涉及本发明的“疫苗”的实施方案,并且反之亦然。在一个实施方案中,疫苗包含本发明的免疫原性组合物和药学上可接受的赋形剂。
本发明的疫苗可以通过任何合适的递送途径进行施用,所述递送途径例如皮内、粘膜例如鼻内、口服、肌内或皮下。其他递送途径是本领域众所周知的。疫苗制剂一般在Vaccine Design(“The subunit and adjuvant approach”(编辑Powell M.F. & Newman M.J.)(1995)Plenum Press New York)中描述。
在一个方面,本发明的免疫原性组合物通过肌内递送途径进行施用。肌内施用可以是对于大腿或上臂。注射通常经由针(例如皮下注射针),但可替代地可以使用无针注射。典型肌内剂量为0.5 ml。
疫苗的皮内施用构成本发明的一个实施方案。人皮肤包含外部“角质”表皮,称为角质层,其覆盖表皮。在该表皮下的是称为真皮的层,其依次又覆盖皮下组织。常规皮内注射技术,“芒图(mantoux)操作”包括下述步骤:清洁皮肤,伸出一只手,然后使小号针(narrow gauge needle)(26-31号)的斜面朝上,以10-15°的角度将针插入。一旦针斜面被插入后,针筒下降,并且在提供轻微压力时进一步推进,以使其在皮肤下抬起。然后将液体非常缓慢地注入,从而在皮肤表面上形成包或隆起,随后缓慢抽出针。
近来,专门设计为将液体试剂施用到皮肤内或跨越皮肤的装置已得到描述,例如WO99/34850和EP1092444中所述的装置,以及例如WO01/13977、US5,480,381、US5,599,302、US5,334,144、US5,993,412、US5,649,912、US5,569,189、US5,704,911、US5,383,851、US5,893,397、US5,466,220、US5,339,163、US5,312,335、US5,503,627、US5,064,413、US5,520,639、US4,596,556、US4,790,824、US4,941,880、US4,940,460、WO97/37705和WO97/13537中所述的射流注射装置。疫苗制剂的可替代皮内施用方法可以包括常规注射器和针,或设计用于固体疫苗的弹道递送的装置(WO99/27961),或经皮贴剂(WO97/48440、WO98/28037),或应用于皮肤的表面(经皮或经皮肤递送WO98/20734、WO98/28037)。
当本发明的疫苗待施用于皮肤,或更具体而言施用到真皮内时,疫苗采取低液体体积,特别是约0.05 ml - 0.2 ml的体积。
另一种合适的施用途径是皮下途径。任何合适装置均可用于皮下递送,例如常规针。在本发明的一个方面,使用无针射流注射器服务,例如WO01/05453、WO01/05452、WO01/05451 、WO01/32243、WO01/41840、WO01/41839、WO01/47585、WO01/56637、WO01/58512、WO01/64269、WO01/78810、WO01/91835、WO01/97884、WO02/09796、WO02/34317中公开的那种。在本发明的另一个方面,装置预填充有液体疫苗制剂。
可替代地,疫苗鼻内施用。通常,疫苗局部施用于鼻咽区域,例如而不吸入肺内。期望使用鼻内递送装置,其将疫苗制剂递送至鼻咽区域,而不使其进入肺或基本上不使其进入肺。用于根据本发明的疫苗的鼻内施用的优选装置是喷雾装置。合适的商购可得的鼻喷雾装置包括Accuspray™(Becton Dickinson)。
在一个实施方案中,用于鼻内使用的喷雾装置是装置的表现不依赖于由用户施加的压力的装置。这些装置被称为压力阈值装置。仅在施加阈值压时,液体从喷嘴中释放。这些装置使得更容易实现具有常规小滴大小的喷雾。适合与本发明一起使用的压力阈值装置是本领域已知的,并且例如在通过引用并入本文的WO91/13281以及EP311 863和EP516636中描述。此类装置从Pfeiffer GmbH商购可得,并且也在Bommer,R. Pharmaceutical Technology Europe,Sept 1999中描述。
在另一个实施方案中,鼻内装置产生在1 - 200 µm例如10 - 120 µm范围内的小滴(使用水作为液体测量的)。低于10 µm,存在吸入的危险,因此,期望具有不多于约5%的低于10 µm的小滴。高于120 µm的小滴以及更小的小滴不扩散,因此期望具有不多于约5%的超过120 µm的小滴。
双剂量递送是与根据本发明的疫苗一起使用的鼻内递送系统的另一个实施方案。双剂量装置含有单个疫苗剂量的两个亚剂量,一个亚剂量施用于每个鼻孔。一般地,两个亚剂量存在于单个室中,并且装置的构造允许每次单个亚剂量的有效递送。可替代地,单剂量装置可以用于施用根据本发明的疫苗。
本发明的进一步方面是制备本发明的疫苗的方法,其包括将未缀合的肺炎链球菌蛋白与佐剂组合物混合的步骤。
尽管本发明的疫苗可以作为单次剂量施用,但其组分也可以同时或在不同时间一起共施用(例如肺炎链球菌糖缀合物可分开施用,同时施用,或在施用疫苗的任何细菌蛋白组分之后1 - 2周施用,用于彼此之间免疫应答的最佳协调)。在初始疫苗接种后,主体可以接受足够间隔开的一次或几次加强免疫。
在本发明的一个方面,提供了针对由肺炎链球菌感染引起的疾病免疫人宿主的方法,其包括给宿主施用免疫保护剂量的本发明的免疫原性组合物或疫苗。在本发明的进一步方面,提供了用于治疗或预防由肺炎链球菌感染引起的疾病的本发明的免疫原性组合物或疫苗。在本发明的进一步方面,提供了本发明的免疫原性组合物或疫苗在制造用于治疗或预防由肺炎链球菌感染引起的疾病的药物中的用途。
在一个实施方案中,宿主是成年人,成年人是大于18岁的人。在进一步的实施方案中,宿主是老年人,适当地年龄60、62、65、67或70岁及以上的老年人。在进一步的实施方案中,宿主是更年轻的成人(即18 - 64岁),任选更年轻的高危成人,例如在健康机构工作的更年轻的成人或具有危险因素(例如心血管和肺疾病或糖尿病)的年轻成人。在进一步的实施方案中,宿主是婴儿,例如大于6个月的儿童,尤其是6 - 23个月的儿童。任选地,宿主是初学走路的孩子,例如9个月到3岁的儿童。
在本发明的进一步的实施方案中,由肺炎链球菌感染引起的疾病选自肺炎、侵袭性肺炎球菌疾病(IPD)、慢性阻塞性肺疾病(COPD)的加重、中耳炎、复发性中耳炎、脑膜炎、菌血症和结膜炎。
一般描述
为了本发明的目的,“约”或“大约”定义为在给定数字多或少10%内。
在所有情况下,本发明人都预期本文的术语“包含(comprising)”、“包含(comprise)”和“包含(comprises)”可用术语“由……组成(consisting of)”、“由……组成(consist of)”和“由……组成(consists of)”分别任选地代替。
本文的涉及本发明的“疫苗组合物”的实施方案也适用于涉及本发明的“免疫原性组合物”的实施方案,并且反之亦然。
提及‘肺炎球菌’和‘肺炎链球菌(S.pneumoniae)’可以视为提及肺炎链球菌(Streptococcus pneumoniae)。
在本专利说明书中引用的所有参考文献或专利申请都通过引用并入本文。
为了可以更好地理解本发明,提供以下实施例。这些实施例仅用于举例说明的目的,并且不应解释为以任何方式限制本发明的范围。
实施例
实施例1 –用于临床试验研究的疫苗生产
设计了6种疫苗:
dPly-10-AlPO4:包含由磷酸铝佐剂化的10μg dPly的疫苗。
dPly-30-AlPO4:包含由磷酸铝佐剂化的30μg dPly的疫苗。
dPly/PhtD-10-AlPO4:包含由磷酸铝佐剂化的10μg dPly和10μg PhtD的疫苗。
dPly/PhtD-30-AlPO4:包含由磷酸铝佐剂化的30μg dPly和30μg PhtD的疫苗。
10PCV/dPly/PhtD -10-AlPO4:包含由磷酸铝佐剂化的下述抗原的疫苗:
缀合至蛋白D的来自血清型1的1μg荚膜糖(1-PD)
缀合至蛋白D的来自血清型4的3μg荚膜糖(4-PD)
缀合至蛋白D的来自血清型5的1μg荚膜糖(5-PD)
缀合至蛋白D的来自血清型6B的1μg荚膜糖(6B-PD)
缀合至蛋白D的来自血清型7F的1μg荚膜糖(7F-PD)
缀合至蛋白D的来自血清型9V的1μg荚膜糖(9V-PD)
缀合至蛋白D的来自血清型14的1μg荚膜糖(14-PD)
缀合至蛋白D的来自血清型23F的1μg荚膜糖(23F-PD)
缀合至破伤风类毒素的来自血清型18C的3μg荚膜糖(18C-TT)
缀合至白喉毒素的来自血清型19F的1μg荚膜糖(19F-DT)
10μg dPly
10μg PhtD。
10PCV/dPly/PhtD -30-AlPO4:包含由磷酸铝佐剂化的下述抗原的疫苗:
缀合至蛋白D的来自血清型1的1μg荚膜糖(1-PD)
缀合至蛋白D的来自血清型4的3μg荚膜糖(4-PD)
缀合至蛋白D的来自血清型5的1μg荚膜糖(5-PD)
缀合至蛋白D的来自血清型6B的1μg荚膜糖(6B-PD)
缀合至蛋白D的来自血清型7F的1μg荚膜糖(7F-PD)
缀合至蛋白D的来自血清型9V的1μg荚膜糖(9V-PD)
缀合至蛋白D的来自血清型14的1μg荚膜糖(14-PD)
缀合至蛋白D的来自血清型23F的1μg荚膜糖(23F-PD)
缀合至破伤风类毒素的来自血清型18C的3μg荚膜糖(18C-TT)
缀合至白喉毒素的来自血清型19F的1μg荚膜糖(19F-DT)
30μg dPly
30μg PhtD。
10PCV:包含由磷酸铝佐剂化的下述抗原的疫苗:
缀合至蛋白D的来自血清型1的1μg荚膜糖(1-PD)
缀合至蛋白D的来自血清型4的3μg荚膜糖(4-PD)
缀合至蛋白D的来自血清型5的1μg荚膜糖(5-PD)
缀合至蛋白D的来自血清型6B的1μg荚膜糖(6B-PD)
缀合至蛋白D的来自血清型7F的1μg荚膜糖(7F-PD)
缀合至蛋白D的来自血清型9V的1μg荚膜糖(9V-PD)
缀合至蛋白D的来自血清型14的1μg荚膜糖(14-PD)
缀合至蛋白D的来自血清型23F的1μg荚膜糖(23F-PD)
缀合至破伤风类毒素的来自血清型18C的3μg荚膜糖(18C-TT)
缀合至白喉毒素的来自血清型19F的1μg荚膜糖(19F-DT)
30μg dPly
30μg PhtD。
抗原的制备
dPly的制备:如WO2004/081515和WO2006/32499中所述,使用甲醛脱毒,将肺炎球菌溶血素制备且脱毒。
PhtD的表达和纯化:
PhtD的表达:PhtD蛋白是特征在于三联组氨酸的存在的肺炎球菌三联组氨酸(Pht)蛋白家族的成员。PhtD是838 aa-分子且携带5个三联组氨酸(关于氨基酸序列参见Medlmmune WO00/37105 SEQ ID NO: 4,并且关于DNA序列参见SEQ ID NO: 5)。PhtD还含有在中间的富含脯氨酸区(氨基酸位置348-380)。PhtD具有20 aa-N末端信号序列。PhtD的制备和纯化在WO2007/071710中描述(参见例如实施例1b)。
蛋白D的表达
蛋白D如WO2007/071710中所述进行表达。
缀合物的制备
本领域众所周知如何制备纯化的肺炎球菌多糖。为了这些实施例的目的,多糖基本上如EP072513中所述或通过紧密相关方法进行制备。在缀合前,多糖可以如下所述通过微流化具有一定大小。
活化和偶联条件对于每种多糖是特异性的。这些在表1中给出。将具有一定大小的多糖(除了6B和23F之外)溶解于NaCl 2M、NaCl 0.2M或注射用水(WFI)中。对于所有血清型评估最佳多糖浓度。如下文详述的,除了血清型18C之外的所有血清型均直接缀合至载体蛋白。
从在乙腈或乙腈/水(50%/50%)溶液中的100 mg/ml原液中,将CDAP(1-氰基-4-二甲基氨基吡啶鎓四氟硼酸盐)(CDAP/PS比0.5-1.5 mg/mg PS)加入多糖溶液中。1.5分钟后,加入0.2M-0.3M NaOH以获得特异性活化pH。多糖的活化在该pH下在25℃下执行3分钟。将纯化的蛋白(蛋白D、CRM197或DT)(数量取决于初始PS/载体蛋白比)加入活化的多糖中,并且在pH调节下,在特异性pH下执行偶联反应最高达2小时(取决于血清型)。为了猝灭未反应的氰酸酯基团,随后将2M甘氨酸溶液加入混合物中。将pH调整至猝灭pH(pH 9.0)。将溶液在25℃下搅拌30分钟,并且随后在2-8℃下伴随连续缓慢搅拌温育过夜。
18C的制备:
经由接头 - 己二酸二酰肼(ADH),将18C连接至载体蛋白。
在缀合前使多糖血清型18C微流化。
破伤风类毒素用EDAC(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺)的衍生
对于破伤风类毒素的衍生,将纯化的TT以25 mg/ml在0.2M NaCl中稀释,并且加入ADH间隔物,以便达到0.2M的最终浓度。当间隔物的溶解完成时,将pH调整至6.2。随后加入EDAC(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺),以达到0.02M的最终浓度,并且将混合物在pH调节下搅拌1小时。通过在25℃下将pH增加到最高达9.0至少30分钟停止缩合反应。
随后将衍生的TT渗滤(10 kDa CO膜),以便去除残留ADH和EDAC试剂。
TTAH(缀合至ADH接头的破伤风类毒素)批次(batch)最终无菌过滤,直至偶联步骤,且贮存于-70℃下。
TTAH与PS 18C的化学偶联
缀合参数的细节可以在表1中找到。
将2克微流化PS在水中以限定浓度稀释,并且通过NaCl粉末添加调整至2M NaCl。
加入CDAP溶液(在50/50 v/v乙腈/WFI中新鲜制备的100 mg/ml),以达到适当的CDAP/PS比。
通过添加0.3M NaOH使pH上升高达活化pH 9.0,并且在该pH下稳定直至TTAH添加时。
在3分钟后,加入衍生的TTAH(在0.2 M NaCl中20 mg/ml),以达到TTAH /PS比为2;将pH调节至偶联pH 9.0。溶液在pH调节下静置一小时。
对于猝灭,将2M甘氨酸溶液加入混合物PS/TTAH/CDAP中。
将pH调整至猝灭pH(pH 9.0)。
将溶液在25℃下搅拌30分钟,并且随后伴随连续缓慢搅拌在2-8℃下过夜。
肺炎链球菌荚膜糖-蛋白D/TT/DT/PhtD/Ply缀合物的特异性活化/偶联/猝灭条件
当“μ流体”在行标题中出现时,它指示糖在缀合前通过微流化具有一定大小。在微流化后的糖大小在表2中给出。
表1肺炎链球菌荚膜糖-蛋白D/TT/DT/CRM197缀合物的特异性活化/偶联/猝灭条件
注:pHa、c、q对应于分别用于活化、偶联和猝灭的pH。
缀合物的纯化:
使用由0.15M NaCl(除了S500HR用作18C的缓冲液,并且含20mM乙酸盐的1.15MNaCl pH6.2用于19A之外)平衡的Sephacryl S400HR凝胶过滤柱,通过凝胶过滤纯化缀合物,以去除小分子(包括DMAP)以及未缀合的糖和蛋白。基于反应组分的不同分子大小,PS-PD、PS-TT、PS-CRM197或PS-DT缀合物首先洗脱,随后为游离PS,随后为游离蛋白载体,并且最后为DMAP及其他盐(NaCl、甘氨酸)。
通过UV280 nm检测含有缀合物的级分。根据其Kd合并级分,无菌过滤(0.22μm)且贮存于+2-8℃下。测定缀合物制剂中的PS/蛋白比。
实施例2 –研究在成人中进行的包含高和低剂量dPly和PhtD的疫苗功效的临床试验
使用七个平行组进行临床试验;
1. dPly-10-AlPO4组(结果表和图中的‘Ply-10’):主体接受如实施例1中所述的dPly-10-ALPO4疫苗(由167μg AlPO4、150mM NaCl和0.78mM PO4缓冲液配制)。
2. dPly-30-AlPO4组(结果表和图中的‘Ply-30’):主体接受如实施例1中所述的dPly-30-ALPO4疫苗(由500 AlPO4、150nM NaCl和0.78mM PO4缓冲液配制)。
3. dPly/PhtD-10-AlPO4组(结果表和图中的‘PlPh-10’):主体接受如实施例1中所述的dPly/PhtD-10-AlPO4疫苗(由500 μg AlPO4、150mM NaCl和0.72mM PO4缓冲液配制)。
4. dPly/PhtD-30-AlPO4组(结果表和图中的‘PlPh-30’):主体接受如实施例1中所述的dPly/PhtD-30-AlPO4疫苗(由500 μg AlPO4、150mM NaCl和0.86mM PO4缓冲液配制)。
5. 10PCV/dPly/PhtD -10-AlPO4组(结果表和图中的‘10vPP10’):主体接受如实施例1中所述的10PCV/dPly/PhtD -10-AlPO4疫苗(由500 μg AlPO4、150mM NaCl和0.72mM PO4缓冲液配制)。
6. 10PCV/dPly/PhtD -30-AlPO4组(结果表和图中的‘10vPP30’):主体接受如实施例1中所述的10PCV/dPly/PhtD -30-AlPO4疫苗(由500 μg AlPO4、150mM NaCl和0.86 mM PO4缓冲液配制)。
7. 23PPV比较物(Comparator)组(结果表和图中的‘23PPV’):主体接受在第0天(第0个月)时一个剂量的商购可得的得到批准的23价c多糖疫苗(23PPV)(命名为Pneumovax 23TM),随后为在第60天(第2个月)时的安慰剂。
在所有组中的主体均接受2个剂量的各自研究疫苗,一个在第0天(第0个月)时,并且一个在第60天(第2个月)时;23PPV比较物组接受在第0天(第0个月)时的得到批准的23PPV疫苗和在第60天(第2个月)时的安慰剂。疫苗在不明显的三角肌中作为肌内注射施用。主体是在第一次疫苗接种时在18 - 40岁之间且包括18和40岁的健康男性或女性。
安全/反应原性方法
根据症状类型、强度及与疫苗接种的关系,在每个疫苗剂量和全体后,用95% CI(置信区间)计算在31天疫苗接种后的随访期过程中,征求(solicited)和/或未征求的局部和一般AE(不利事件)的发生率。根据症状类型、强度及与疫苗接种的关系,在每个疫苗剂量和全体后,用95% CI计算在7天疫苗接种后的随访期过程中,报告的每个局部和每个一般征求症状的发生率。根据强度及与疫苗接种的关系,使用95% CI(置信区间),根据药事管理医学词典(Medical Dictionary for Regulatory Activities)(MedDRA),概括在31天疫苗接种后的随访期内报告的具有未征求症状的主体/剂量百分比。在每个疫苗剂量和全体后,用95% CI计算在7天疫苗接种后的随访期过程中和在31天疫苗接种后的随访期过程中的伴随解热药/药物治疗的普遍性。详细描述了在整个研究期过程中报告的严重不利事件(SAE)和由于一种或多种不利事件的撤出。对于每种血液病学和生物化学参数,在每个评价时间点,按照研究组将低于正常范围的水平、在正常范围内的水平和高于正常范围的水平的主体数目和百分比制表。在每个评价时间点,按照研究组概括分级和在分级中距离基线的变化(基线:第0天评价)。对于每种尿参数,在每个评价时间点,按照研究组概括分级和在分级中距离基线的变化(基线:第0天评价)。按照研究组展示随着时间过去在尿分析中定量的pH。
用于免疫原性评估的实验室测定和时间点
对于所有主体,在就诊1 [之前(Pre)]、就诊4 [(PI(D30)(在第30天时的剂量I后)]和就诊8 [(PII(D90)(在第90天时的剂量II后)]时,就血清学收集大约20 mL静脉全血样品。在血液离心和血清分离后,将样品贮存于-20℃下直至通过发起人收集时。将血清等分试样(大约10 mL)送往GSK Biologicals,用于在下述段落中所述的血清学测试。
通过使用HL 60细胞系的杀死测定,来测量针对10个肺炎球菌血清型各自的抗体(针对1、4、5、6B、7F、9V、14、18C、19F、23F的抗体)的调理吞噬活性。结果呈现为在测定条件下能够持续50%活肺炎球菌杀死的血清稀释度(调理滴度)。测定的截止为调理滴度为8。
使用ELISA(酶联免疫吸附测定)定量抗dPly和抗PhtD抗体。
样品ELISA方案在下文描述:
使微量滴定板包被有纯化的血清型特异性肺炎球菌PS(多糖),并且与甲基化的人血清白蛋白(0.5 - 7.5 μg/ml,取决于PS)混合。将血清样品在吸附缓冲液(磷酸盐缓冲盐水[PBS]、10%胎牛血清[FCS]、0.1%聚乙烯醇)中稀释,所述吸附缓冲液含有10 μg/ml CWPS(荚膜壁多糖)(SSI)和2 μg/ml血清型22F(ATCC)的PS,并且在4℃下温育过夜。89-SF参考血清样品(FDA)(89-SF是由世界卫生组织校准的参考血清编号)在相同吸附缓冲液中稀释,但仅具有10 μg/ml CWPS,并且将混合物在4℃下温育过夜。在每一块板中包括针对标准血清样品89-SF校准的内部参考血清样品。与工作标准血清样品不同,与WHO建议一致,89-SF参考血清样品仅与CWPS而不是22F预吸附,因为不使用22F PS来指定89-SF参考血清样品的抗PS浓度的值。通过使用碱性磷酸酶缀合的抗人IgG来检测结合的抗体。
样品OPA(调理吞噬测定)在下文描述:
OPA测定如下执行:将血清样品在56℃下加热40分钟,以使任何剩余的内源补体失活。在96孔圆底微量滴定板(Nalge Nunc International,Rochester,NY,USA)的每个孔中,将每份1:2稀释的血清样品的二十五微升等分试样在25 μl OPA缓冲液(Hank’s平衡盐溶液或HBSS –14.4%灭活的FBS(胎牛血清))中进行两倍系列稀释。在每块测定板上运行具有特异性肺炎球菌血清型的已知调理吞噬滴度的两个阳性对照样品,以确定测定可靠性。在一列中不加入血清样品,以估计平均CFU(菌落形成单位),其对应于在不存在调理吞噬抗体的情况下的0%杀死。随后,将以例如4/2/2.82比(体积/体积/体积(v/v/v);该比可以取决于补体批次而改变)的活化HL-60细胞(1×107细胞/ml)、新鲜解冻的肺炎球菌工作种子和新鲜解冻的幼兔补体的25 μl混合物加入稀释的血清中,以获得50μl的最终体积。因此,血清样品的最终系列稀释度为1:8–1:1024。测定板在37℃下伴随定轨振荡(210 rpm)温育2小时,以促进吞噬过程。通过将微量滴定板置于冰上至少1分钟来停止反应。随后将板的每个孔的20μl等分试样转移到96孔平底微量滴定板(Nalge Nunc International)的相应孔内,并且将100μl Todd–Hewitt Broth–0.9%琼脂加入每个孔中。在37℃和5% CO2下过夜温育后,使用自动化图像分析系统(KS 400,Zeiss,Oberkochen,德国),计数在琼脂中出现的肺炎球菌菌落。不含血清样品的八个孔用作细菌对照,以确定每个孔的肺炎球菌数目。确定对照孔的平均CFU数目,且用于计算每份血清样品的杀死活性。通过能够促进50%肺炎球菌杀死的血清的倒数稀释度,来确定血清样品的OPA滴度。通过使用4参数曲线拟合分析来计算调理吞噬滴度。基于在每个测定中包括的两个阳性对照样品的实际测量滴度/已知滴度的平均比,通过调整因子来调整每个样品滴度。所有血清型的截止OPA滴度是血清的倒数稀释度为8。为了数据分析的目的,OPA滴度<8的血清样品指定滴度为4。
样品抗PhtD和抗Ply ELISA在下文描述:
用100 µl/孔的在PBS中的2 µg/ml PhtD(1021 µg/ml)、在TR034( Na 50mM ph 9.5)中的3 µg/ml Ply(3675µg/ml),将板在4℃下包被过夜。
随后用TR 112(Na2K 39.65 mM - NaCl 1.73 M - 聚山梨醇酯20 0.275% 5P/V° pH 6.6-6.8),将板洗涤三次。
在第一次洗涤后,用200µl/孔的稀释缓冲液(不含Ca和Mg的PBS -BSA 1%用于PhtD)或BSA 5%用于Ply - 聚山梨醇酯20 0.1% - ProClin 300TM 0.2% pH 7.0),将板在RT下伴随振荡来饱和1小时。
在第二次洗涤(相同缓冲液)后,将100µl血清以在稀释缓冲液中1/100、1/1000和 1/10000的稀释度加入微孔中。
板在室温下伴随振荡温育1小时。在5次洗涤后,板与缀合至过氧化物酶的山羊抗人IgG Fc抗体一起温育,对于PhtD稀释1/20000并且对于Ply稀释1/12500(100 µl/孔),在室温下伴随振荡1小时。板如上进行洗涤,且将100µl TMB底物缀合物加入每个孔中在黑暗中10分钟。
通过添加H2SO4(0.18M)100 µl来停止反应,并且在450nm和650 nm处阅读吸光度。
免疫原性
根据免疫原性的方案(ATP)队列,执行免疫原性分析。不对接种疫苗的总队列执行二次分析,因为小于5%的主体从免疫原性的ATP队列中排除。就针对dPly、PhtD以及肺炎链球菌荚膜糖血清型1、4、5、6B、7F、9V、14、18C、19F和23F的抗体的存在分析血清。
抗Ply抗体的血清阳性率和GMC在下表1中描述,这些数据在图1中举例说明:
血清阳性的主体定义为抗体浓度≥ 0.05 µg/mL的主体。
GMC = 对所有主体计算的几何平均抗体浓度
N = 具有可用结果的主体数目
n/% = 浓度在指定范围内的主体数目/百分比
95% CI = 95%置信区间;LL = 下限,UL = 上限
PRE = 疫苗接种前的血样
PI(D30)= 在第30天时剂量I后获得的血样
PII(D90)= 在第90天时剂量II后获得的血样。
在所有组中在每次疫苗接种后观察到抗dPly抗体GMC中的增加,除了未接受dPly的23PPV组之外。分别与Ply-10和Ply-30组比较,抗dPly抗体GMC在PIPh-10和PIPh-30组中趋于更高,这是出乎意料的,因为可能预期在PhtD和dPly之间的抗原干扰。对于含有30μg dPly和PhtD蛋白的制剂(即PlPh-30和10vPP30组),观察到最高的抗dPly抗体GMC。
抗PhtD抗体(免疫原性的ATP队列)的血清阳性率和GMC在下表2中描述,并且在图2中举例说明:
。
对于每个剂量观察到抗PhtD抗体GMC中的增加,除了未接受PhtD的Ply-10、Ply-30和23PPV组之外。分别与PlPh-10和PlPh-30组比较,剂量1后和剂量2后的抗PhtD抗体GMC在10vPP10和10vPP30组中趋于更低。对于含有30μg dPly和PhtD蛋白的制剂(即PlPh-30和10vPP30组),观察到最高的抗PhtD抗体GMC。
血清型1抗体的血清阳性率和GMT在下表3中描述,这些数据在图3中举例说明:
。
血清型4抗体的血清阳性率和OPA(调理吞噬)GMT在下表4中描述,这些数据在图4中举例说明:
。
血清型5抗体的血清阳性率和OPA(调理吞噬)GMT在下表5中描述,这些数据在图5中举例说明:
。
血清型6B抗体的血清阳性率和OPA(调理吞噬)GMT在下表6中描述,这些数据在图6中举例说明:
。
血清型7F抗体的血清阳性率和OPA(调理吞噬)GMT在下表7中描述,这些数据在图7中举例说明:
。
血清型9V抗体的血清阳性率和OPA GMT在下表8中描述,这些数据在图8中举例说明:
。
血清型14抗体的血清阳性率和OPA GMT在下表9中描述,这些数据在图9中举例说明:
。
血清型18C抗体的血清阳性率和OPA GMT在下表10中描述,这些数据在图10中举例说明:
。
血清型19F抗体的血清阳性率和OPA GMT在下表11中描述,这些数据在图11中举例说明:
。
血清型23F抗体的血清阳性率和OPA GMT在下表12中描述,这些数据在图12中举例说明:
。
结果概括
所有候选疫苗制剂均为安全和良好耐受的。随着时间过去未观察到在血液病学、生物化学和尿参数中的临床显著变化。
在剂量1后的7天的疫苗接种后时期的过程中,最大4.2% - 12.5%剂量的候选疫苗制剂随后分别为3级征求的局部和一般AE。这些发生率在与23PPV比较物组(4.2%剂量)中观察到的那些相同的范围内。未报告3级发热(口腔温度> 39.5℃)。
对于候选疫苗制剂的连续剂量,在所有组中一般未观察到朝向3级征求的局部和/或一般AE的更高发生率的趋势。
对于候选疫苗制剂,在4.5% - 13.3%剂量后,报告3级未征求的AE。对于候选疫苗制剂,在10.4% - 33.3%剂量后,报告由研究者视为与疫苗接种原因相关的未征求AE,并且主要是局部反应。
在接受候选疫苗制剂的主体中未报告SAE。
含有肺炎球菌蛋白dPly连同或不连同PhtD的制剂是免疫原性的。在用含dPly制剂接种疫苗的组中,在每次疫苗接种后观察到抗Ply抗体GMC中的增加;在用含PhtD制剂接种疫苗的组中,在每次疫苗接种后观察到抗PhtD抗体GMC中的增加。对于含有30μg dPly和PhtD蛋白的制剂(即PlPh-30组,随后为10vPP30组),观察到最高的抗Ply和抗PhtD抗体GMC。
游离蛋白制剂(铝吸附的)不诱导OPA应答。在剂量1后一个月和剂量2后一个月,对于疫苗肺炎球菌血清型中的每一个,至少95.7%接受组合肺炎球菌蛋白(dPly和PhtD)和10Pn-PD-DiT的制剂的主体具有OPA滴度≥ 8。对于一些肺炎球菌血清型,从剂量1后到剂量2后时间点,观察到OPA GMT中的增加。对于大多数测试的血清型(6B、7F、9V、18C、19F、23F),与10vPP10组相比较,剂量1后或剂量2后计算的OPA GMT点估计量在10vPP30组中更高。
实施例3 –研究在婴儿中进行的包含高和低剂量dPly和PhtD的疫苗功效的临床试验
II期、随机化、受控制、观察者不知情研究,以评价两种含GlaxoSmithKline(GSK)Biologicals的肺炎链球菌蛋白的疫苗制剂的安全性、反应原性和免疫原性,作为在生命的前6个月(时期1)期间与DTPa-HBV-IPV/Hib疫苗共施用的3剂量初次疫苗接种过程,以及作为在12-15月龄(时期2)时的加强剂量给予。
该临床试验使用4个平行组进行;
1. 10PCV/dPly/PhtD-10-AlPO4组(结果表和图中的‘10vPP10’):主体接受与DTPa-HBV-IPV/Hib疫苗共施用的GSK Biologicals的10PCV/dPly/PhtD-10-AlPO4疫苗。
2. 10PCV/dPly/PhtD-30-AlPO4组(结果表和图中的‘10vPP30’):主体接受与DTPa-HBV-IPV/Hib疫苗共施用的GSK Biologicals的10PCV/dPly/PhtD-30-AlPO4疫苗。
3. 10PCV组(结果表和图中的‘10Pn’):主体接受与DTPa-HBV-IPV/Hib疫苗共施用的GSK Biologicals的10PCV疫苗。
4. Prev13组(结果表和图中的‘13Pn-DTPa’):主体接受与DTPa-HBV-IPV/Hib疫苗共施用的Pfizer的商购可得的13价肺炎球菌缀合物疫苗(Prevenar 13)。
疫苗根据在2、3、4月龄(时期1,完成的)时的3剂量初次疫苗接种时间表给予健康婴儿,随后为在12-15月龄(时期2,研究进行中)时的加强剂量。
安全性/反应原性方法
组内评价(描述性分析):
使用确切的95% CI(置信区间),在每个疫苗剂量和全体初次剂量后,对于每组将在7天(第0天-第6天)征求的随访期过程中报告每种各个征求的局部和一般AE(不利事件)的主体百分比制表。使用确切的95% CI,经过完全初次疫苗接种过程,对于每组将剂量百分比随后为每种各个征求的局部和一般AE制表。对于3级征求AE和与疫苗接种具有原因关系的征求AE执行相同制表。对于发红和肿胀,还将2或3级AE制表。按照0.5℃累积增量报告发热的发生。对于每次疫苗接种后的4天随访期(第0天-第3天),还执行每种各个征求的不利事件的所有上述制表。
对于每组使用确切的95% CI,将通过药事管理医学词典(MedDRA)分类且在初次疫苗接种后最高达30天报告的未征求AE的至少一次报告的主体/剂量比例制表。对于3级未征求AE和与疫苗接种具有关系的未征求AE执行相同制表。
还将导致医学出现就诊(medically attended visit)的AE比例制表。
详细描述了SAE(严重不利事件)和由于一种或多种SAE的撤出。
用于免疫原性评估的实验室测定和时间点
在时期001过程中,在就诊1和就诊4时收集血样。在血液离心和血清分离后,将样品贮存于-20℃下直至通过发起人收集时。将血清等分试样(大约2.5 mL)送往GSK Biologicals,用于在下述段落中所述的血清学测试。
如实施例2所述,通过22F抑制ELISA(酶联免疫吸附测定)各自测量肺炎球菌血清型特异性总IgG抗体(针对1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F的抗体)。用可得自美国食品和药物管理局(FDA)的标准参考血清89-SF,通过ELISA曲线的逻辑对数比较确定抗体浓度,对于所述标准参考血清89-SF,针对10个血清型的IgG和IgM浓度是以μg/mL已知的。测定的截止为0.05 μg/mL。
通过OPA测定(类似于实施例2中所述的那种),来测量针对肺炎球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F各自的抗体的调理吞噬活性(OPA)。结果呈现为在测定条件下能够持续50%活肺炎球菌杀死的血清稀释度(调理滴度)。测定的截止为调理滴度为8。
使用各个ELISA定量抗dPly和抗PhtD抗体。使用标准参考血清,确定特异性抗dPly和抗PhtD抗体的浓度。测定的截止为对于PD为100 EL.U/mL,对于dPly 12为 EL.U/mL和对于PhtD为 17 EL.U/mL。
安全性和反应原性结果(研究的初步结果)
对疫苗接种的总队列执行安全性分析。
征求的不利事件
在7天疫苗接种后时期过程中:
发红是每组中最频繁报告的征求的局部AE(在10PCV/dPly/PhtD -10-AlPO4、10PCV/dPly/PhtD -30-AlPO4、10PCV和Prev13组中,分别为43.6%、44.7%、40.1%和41.1%剂量后)。在每组中,不多于3.3%剂量随后为给定类别的3级征求的局部AE。
应激性是每组中最频繁报告的征求的一般AE(在10PCV/dPly/PhtD -10-AlPO4、10PCV/dPly/PhtD -30-AlPO4、10PCV和Prev13组中,分别为55.5%、55.5%、55.0%和56.6%剂量后)。在每组中,不多于4.8%剂量随后为给定类别的3级一般的征求AE,并且其中大多数由研究者视为与疫苗接种原因相关。
在3剂量初次疫苗接种过程期间,对于10PCV/dPly/PhtD -10-AlPO4或10PCV/dPly/PhtD -30-AlPO4疫苗的连续剂量,未观察到征求的局部和一般AE发生率中的增加。
未征求的不利事件
在31天初次疫苗接种后时期过程中:
在10PCV/dPly/PhtD -10-AlPO4、10PCV/dPly/PhtD -30-AlPO4、10PCV和Prev13组中,分别为16.9%、21.1%、20.1%和19.7%剂量随后为至少一次未征求的AE。
在10PCV/dPly/PhtD -10-AlPO4、10PCV/dPly/PhtD -30-AlPO4、10PCV和Prev13组中,分别在0.0%、0.2%、0.5%和0.2%剂量后,报告3级未征求的AE。在这些中,10PCV组中报告的一次3级AE(低渗低反应事件)由研究者视为与疫苗接种原因相关。
在10PCV/dPly/PhtD -10-AlPO4、10PCV/dPly/PhtD -30-AlPO4、10PCV和Prev13组中,对于0.2%、0.5%、0.9%和0.0%的剂量分别报告由研究者视为与疫苗接种原因相关的未征求AE。
严重不利事件:
在初次时期(从剂量1一直到就诊4)过程中,对于20个主体报告至少一次SAE:在10PCV/dPly/PhtD -10-AlPO4组中146个接种疫苗主体中的5个(3.4%),10PCV/dPly/PhtD -30-AlPO4组中142个接种疫苗主体中的2个(1.4%)、10PCV组中145个接种疫苗主体中的10个(6.9%)和Prev13组中142个接种疫苗主体中的3个(2.1%)。在这些中,在10Pn组中的31天随访期过程中报告为3级AE的一次SAE(低渗低反应事件)由研究者视为与疫苗接种原因相关。所有SAE均消退而无后遗症,除了10Pn组中的一次SAE(精神运动性迟滞)之外,其在就诊4时未消退。未报告致命SAE。
由于不利事件/严重不利事件的撤出:
10PCV组中的一个主体(主体编号607)由于SAE(低渗低反应事件)从研究中撤出,所述SAE由研究者视为与疫苗接种原因相关。该事件在6天后消退而无后遗症。
免疫原性
结果提示10PCV/dPly/PhtD -10-AlPO4和10PCV/dPly/PhtD -30-AlPO4疫苗诱导针对所有疫苗抗原的免疫应答(即dPly和PhtD肺炎球菌蛋白、肺炎球菌血清型特异性荚膜多糖和NTHi蛋白D)。
实施例4:包含PE-PilA融合蛋白的多价疫苗的配制
设计了3种疫苗:
10V:含有下述十种肺炎链球菌荚膜糖缀合物的十价(10V)疫苗:缀合至蛋白D的来自血清型1的荚膜糖(1-PD),缀合至蛋白D的来自血清型4的荚膜糖(4-PD),缀合至蛋白D的来自血清型5的荚膜糖(5-PD),缀合至蛋白D的来自血清型6B的荚膜糖(6B-PD),缀合至蛋白D的来自血清型7F的荚膜糖(7F-PD),缀合至蛋白D的来自血清型9V的荚膜糖(9V-PD),缀合至蛋白D的来自血清型14的荚膜糖(14-PD),缀合至蛋白D的来自血清型23F的荚膜糖(23F-PD),缀合至破伤风类毒素的来自血清型18C的荚膜糖(18C-TT),和缀合至白喉毒素的来自血清型19F的荚膜糖(19F-DT)。
12V:含有与10V相同的十种肺炎链球菌荚膜糖缀合物连同下述另外两种肺炎链球菌糖缀合物的十二价(12V)疫苗:缀合至CRM197的19A(19ACRM)和缀合至CRM197的6A(6ACRM)。
12V+蛋白(12V+prot):含有与12V相同的十二种肺炎链球菌荚膜糖缀合物连同PhtD、dPly和PE-PilA融合蛋白的添加的疫苗。
抗原的制备
抗原如实施例1中所述进行制备。PEPilA抗原如WO2012/139225中所述进行制备。
疫苗的配制
10V疫苗含有以1、3、1、1、1、1、1、3、3、1 μg的人剂量一起吸附到磷酸铝上的肺炎链球菌荚膜糖血清型1、4、5、6B、7F、9V、14、18C、19F和23F缀合物(糖个别吸附至磷酸铝,随后将它们混合在一起,并且将磷酸铝水平调整至500μg)。
12V疫苗以与10V疫苗相同的方式进行制备,其中添加以2μg的剂量吸附到磷酸铝上的另外血清型19A和6A缀合物。
12V +蛋白疫苗以与12V疫苗相同的方法进行制备,除了添加蛋白PhtD、dPly和PE-PilA之外。使用上文对于12V描述的剂量和各30μg剂量的蛋白(注:这指30μg PE-PilA,而不是30μg PE和30μg PilA),将12种缀合物和蛋白混合在一起。
实施例5:10V、12V和12V+蛋白疫苗在小鼠中的免疫原性比较
抗肺炎球菌多糖PS(多糖)ELISA的描述
用荚膜多糖(CPS)(100 µl/孔的在PBS中的2.5 µg/ml PS1和PS3,5 µg/ml PS4、5、6A、6B、7F、9V或14;10 µg/ml PS19A和23F或40 µg/ml PS18C和PS19F),将微量滴定板在37℃下包被2小时。将板用NaCl 150 mM(0.9%)-聚山梨醇酯20 0.05%洗涤三次。将血清在含CPS的PBS-聚山梨醇酯20 0.05%(1 mg CPS/ml未稀释的血清,除了以2.5mg/ml的6A和6B之外)V/V中稀释(对于6A和6B 为1/2,并且对于其他血清型为1/10),并且在37℃下温育1小时,以中和针对CPS的抗体。将来自如名称为‘三种疫苗制剂在小鼠中的免疫原性’的部分中所述免疫的小鼠的血清或参考血清(用Chrompure小鼠IgG校准的内部参考)加入微孔中,并且在PBS-聚山梨醇酯20 0.05%中系列稀释100 µl(两倍稀释步骤)。将板在搅动下在室温下温育30分钟。板如上进行洗涤,并且加入缀合至过氧化物酶的抗小鼠IgG抗体(100 µl/孔),使板在室温下伴随振荡温育30分钟。在洗涤后,将底物(在10 ml柠檬酸盐0.1M pH 4.5-4.6和5 µl H2O2中的4 mg OPDA(邻苯二胺(ortho phenylen-diamine))加入每个孔中(100 µl),并且使板在黑暗中温育15分钟。通过添加HCl 1N(50μl)来停止反应。使用分光光度计,在490nm或用于参考的620nm处阅读吸光度。显示的颜色与血清中存在的抗体量成正比。
测量PD、PE和PilA抗体的ELISA的描述
用100 µl/孔的在碳酸盐缓冲液pH 9.6中的2 µg/ml PD(1 mg/ml)、2 µg/ml PE(1500 µg/ml)、2 µg/ml PilA(3660 µg/ml),将板在4℃下包被过夜。将板用NaCl 0.9% 聚山梨醇酯20 0.05%洗涤四次。对于PE和PilA ELISA,将板用PBS-BSA1%在室温下(伴随振荡)饱和30分钟。在洗涤后,将来自如名称为‘三种疫苗制剂在小鼠中的免疫原性’的部分中所述免疫的小鼠的血清或参考血清(用Chrompure小鼠IgG校准的内部参考)加入微孔中,并且在PBS聚山梨醇酯20 0.05%(用于PD测定)和PBS 聚山梨醇酯20 0.05% BSA 0.1%(用于PE和PilA测定)中系列稀释100 µl(两倍稀释步骤)。随后板在室温下伴随搅动温育30分钟。在洗涤后,使板与缀合至过氧化物酶的抗小鼠IgG抗体(100 µl/孔)一起在室温下伴随振荡温育30分钟。板随后如上进行洗涤,并且将底物缀合物(在10 ml柠檬酸盐0.1M pH 4.5-4.6和5 µl H2O2中的4 mg OPDA(邻苯二胺))加入每个孔中(100 µl),在黑暗中15分钟。通过添加HCl 1N 50μl来停止反应,并且在490nm(用于参考的620nm)处阅读吸光度。
测量PhtD和dPly抗体的ELISA的描述
用100 µl/孔的1 µg/ml PhtD(1021 µg/ml)或4μg/ml Ply(367μg/ml),将板在37℃下包被2小时。随后将板用NaCl 0.09% 聚山梨醇酯0.05%洗涤三次。在洗涤后,将来自如名称为‘三种疫苗制剂在小鼠中的免疫原性’的部分中所述免疫的小鼠的血清或参考(用Chrompure小鼠IgG校准的内部参考)加入微孔中,并且在PBS聚山梨醇酯20 0.05%中系列稀释100 µl(两倍稀释步骤)。板在室温下伴随搅动温育30分钟。在洗涤后,使板与缀合至过氧化物酶的抗小鼠IgG抗体(100 µl/孔)一起在室温下伴随振荡温育30分钟。板如上进行洗涤,并且将底物缀合物(在10 ml柠檬酸盐0.1M ph 4.5和5 µl H2O2中的4 mg OPDA)加入每个孔中(100 µl),在黑暗中15分钟。通过添加HCl 1N 50μl来停止反应,并且在490nm(用于参考滤波器的620nm)处阅读吸光度。
调理吞噬测定(OPA)的描述
将血清样品在56℃下加热45分钟,以使任何剩余的内源补体失活。在96孔圆底微量滴定板的每个孔中,将每份1:2稀释的血清样品的二十五微升等分试样在25 μl OPA缓冲液(HBSS(Hank’s平衡盐溶液)–14.4%灭活的FCS(胎牛血清))中进行两倍系列稀释。随后,将以例如4/2/1比(v/v/v)(除了该比为4/2/2的血清型1、6B和6A之外)的活化HL-60细胞(1 × 107细胞/ml)、新鲜解冻的肺炎球菌工作种子和新鲜解冻的幼兔补体的25 μl混合物加入稀释的血清中,以获得50μl的最终体积。测定板在37℃下伴随定轨振荡(210 rpm)温育2小时,以促进吞噬过程。通过将微量滴定板置于冰上至少1分钟来停止反应,板在冰上保持直至使用时。随后将板的每个孔的20μl等分试样转移到96孔平底微量滴定板的相应孔内,并且将50μl Todd–Hewitt Broth–0.9%琼脂加入每个孔中。在37℃和5% CO2下过夜温育后,使用自动化图像分析系统(KS 400,Zeiss,Oberkochen,德国),计数在琼脂中出现的肺炎球菌菌落。不含血清样品的八个孔用作细菌对照,以确定每个孔的肺炎球菌数目。确定对照孔的平均CFU数目,且用于计算每份血清样品的杀死活性。通过能够促进50%肺炎球菌杀死的血清的倒数稀释度,来确定血清样品的OPA滴度。通过使用4参数曲线拟合分析来计算调理吞噬滴度。
三种疫苗制剂在小鼠中的免疫原性
用1/10人剂量的不同制剂,包括单独的蛋白(PhtD、dPly和PEPilA – 结果未呈现),Prevnar 13(TM商购可得的链球菌疫苗 – 结果未呈现),10V、12V(DSP2A017)和12V+蛋白(DSP2A012)GMP批次,在第0、14和28天时,通过肌内(IM)注射免疫2组27只雌性Balb/c小鼠。小鼠接受在不同腿中(模拟在临床试验中婴儿的不同部位处的共施用)1/10人剂量的Infanrix Hexa(TM疫苗,包含白喉类毒素,破伤风类毒素,百日咳类毒素,丝状血凝素(haemmagglutinin),百日咳杆菌黏附素,乙肝表面抗原,灭活的脊髓灰质炎病毒1、2和3型以及流感嗜血杆菌b糖(PRP))。
在第42天时收集的各个和合并血清中分别测定抗IgG水平和调理吞噬滴度。
评估12V +蛋白疫苗诱导IgG抗体滴度和调理活性的潜力,并且与12V和10V疫苗的那种相比较。
来自用不同制剂注射的小鼠的血清在针对多糖血清型和蛋白的ELISA(如上所述)以及针对12个多糖血清型的OPA中进行测试。
对于大多数血清型,12V +蛋白疫苗诱导与12V相似的应答(图14和15)。
图16中的结果证实对于12V+制剂和不含肺炎链球菌糖缀合物的制剂测量的,在PE、PilA、PhtD、Ply和PD抗体应答之间不存在统计差异。
实施例6:10V、12V和12V+蛋白疫苗在豚鼠中的免疫原性比较
抗肺炎球菌多糖PS的ELISA描述
用100 µl/孔的在PBS中的2.5 µg/ml PS1,5 µg/ml PS4、5、6A、6B、7F、9V或14;10 µg/ml PS19A和23F,40 µg/ml PS18C和PS19F,或用于参考孔的稀释至2μg/ml的Affinipure山羊抗豚鼠IgG(2.4mg/ml),将微量滴定板在37℃下包被2小时。将板用NaCl 150 mM(0.9%)-聚山梨醇酯20 0.05%洗涤三次。将来自每组的合并血清在含CPS的PBS-聚山梨醇酯20 0.05%(1 mg CPS/ml未稀释的血清,除了以2.5mg/ml的6A和6B之外)V/V中稀释(对于PS 6A和6B为 1/2,并且对于所有其他血清型为1/10),并且在37℃下温育1小时,以中和针对CPS的抗体。将来自如名称为‘三种疫苗制剂在豚鼠中的免疫原性’的部分中所述免疫的豚鼠的血清加入微孔中,并且在PBS-聚山梨醇酯20 0.05%中系列稀释100 µl(两倍稀释步骤),或者加入参考血清(在PBS-聚山梨醇酯20 0.05%中稀释至0.25μg/ml的Chrompure豚鼠IgG(11mg/ml))。将板在搅动下在室温下温育30分钟。板如上进行洗涤,并且加入缀合至过氧化物酶的抗豚鼠IgG抗体(100 µl/孔),并且使板在室温下伴随振荡温育30分钟。在洗涤后,将底物(在10 ml柠檬酸盐0.1M pH 4.5-4.6和5 µl H2O2中的4 mg OPDA)加入每个孔中(100 µl),并且在黑暗中温育15分钟。通过添加HCl 1N来停止反应。使用分光光度计,在490nm(用于参考的620nm)处阅读吸光度。显示的颜色与血清中存在的抗体量成正比。
测量抗PD、PE和PilA抗体的ELISA的描述
用100 µl/孔的在PBS中的碳酸盐缓冲液pH 9.6中的2 µg/ml PD(1 mg/ml)、2 µg/ml PE(1500 µg/ml)或2 µg/ml PilA(3660 µg/ml),或用于参考孔的在PBS中稀释至2μg/ml的Affinipure山羊抗豚鼠IgG(2.4mg/ml),将板在37℃下包被2小时。将板用NaCl 0.9% 聚山梨醇酯20 0.05%洗涤4次。对于PE和PilA ELISA(该步骤对于PD和Ply ELISA不执行),将板用PBS-BSA1%在室温下饱和30分钟。在洗涤后,将来自如名称为‘三种疫苗制剂在豚鼠中的免疫原性’的部分中所述免疫的豚鼠的血清或参考血清样品(用Chrompure豚鼠IgG校准的内部参考)加入微孔中,并且在PBS聚山梨醇酯20 0.05%(用于PD ELISA)和PBS 聚山梨醇酯20 0.05% BSA 0.1%(用于PE和PilA ELISA)中系列稀释100 µl(两倍稀释步骤)。板在室温下温育30分钟。在洗涤后,使板与缀合至过氧化物酶的抗豚鼠IgG抗体(100 µl/孔)一起在室温下伴随振荡温育30分钟。板如上进行洗涤,并且将底物缀合物(在10 ml柠檬酸盐0.1M pH 4.5-4.6和5 µl H2O2中的4 mg OPDA)加入每个孔中(100 µl),在黑暗中15分钟。通过添加HCl 1N 50μl来停止反应,并且在490nm(用于参考滤波器的620nm)处阅读吸光度。
测量PhtD和dPly抗体的ELISA的描述
用100 µl/孔的在PBS中的1 µg/ml PhtD(1021 µg/ml)或2μg/ml Ply(376μg/ml),将板在37℃下包被2小时。随后将板用NaCl 0.9% 聚山梨醇酯20 0.05%洗涤4次。在洗涤后,将来自如名称为‘三种疫苗制剂在豚鼠中的免疫原性’的部分中所述免疫的豚鼠的血清或参考(用Chrompure豚鼠IgG校准的内部参考)加入微孔中,并且在PBS聚山梨醇酯20 0.05%中系列稀释100 µl(两倍稀释步骤)。板在室温下伴随搅动温育30分钟。在洗涤后,使板与缀合至过氧化物酶的抗豚鼠IgG抗体(100 µl/孔)一起在室温下伴随振荡温育30分钟。板如上进行洗涤,并且将底物缀合物(在10 ml柠檬酸盐0.1M pH 4.5-4.6 和5 µl H2O2中的4 mg OPDA)加入每个孔中(100 µl),在黑暗中15分钟。通过添加HCl 1N 50μl来停止反应,并且在490nm(用于参考滤波器的620nm)处阅读吸光度。
调理吞噬测定
将血清样品在56℃下加热45分钟,以使任何剩余的内源补体失活。在96孔圆底微量滴定板的每个孔中,将每份1:2稀释的血清样品的二十五微升等分试样在25 μl OPA缓冲液(HBSS(Hank’s平衡盐溶液)–14.4%灭活的FCS(胎牛血清))中进行两倍系列稀释。随后,将以例如4/2/1比(v/v/v)(除了该比为4/2/2的血清型1、6B和6A之外)的活化HL-60细胞(1 × 107细胞/ml)、新鲜解冻的肺炎球菌工作种子和新鲜解冻的幼兔补体的25 μl混合物加入稀释的血清中,以获得50μl的最终体积。测定板在37℃下伴随定轨振荡(210 rpm)温育2小时,以促进吞噬过程。通过将微量滴定板置于冰上至少1分钟来停止反应(板应在冰上保持直至进一步使用时。随后将板的每个孔的20μl等分试样转移到96孔平底微量滴定板的相应孔内,并且将50μl Todd–Hewitt Broth–0.9%琼脂加入每个孔中。在37℃和5% CO2下过夜温育后,使用自动化图像分析系统(KS 400,Zeiss,Oberkochen,德国),计数在琼脂中出现的肺炎球菌菌落。不含血清样品的八个孔用作细菌对照,以确定每个孔的肺炎球菌数目。确定对照孔的平均CFU数目,且用于计算每份血清样品的杀死活性。通过能够促进50%肺炎球菌杀死的血清的倒数稀释度,来确定血清样品的OPA滴度。通过使用4参数曲线拟合分析来计算调理吞噬滴度。
三种制剂在豚鼠中的免疫原性
用¼人剂量的不同制剂,包括单独的蛋白(PhtD、dPly和PEPilA – 结果未呈现),Prevnar 13(TM商购可得的链球菌疫苗 – 结果未呈现),10V、12V(DSP2A017)和12V+蛋白(DSP2A012)GMP批次,在第0、14和28天时,通过肌内(IM)注射免疫2组17只豚鼠。豚鼠接受在不同腿中(模拟在临床试验中婴儿的不同部位处的共施用)¼人剂量的Infanrix Hexa(TM疫苗,包含白喉类毒素,破伤风类毒素,百日咳类毒素,丝状血凝素,百日咳杆菌黏附素,乙肝表面抗原,灭活的脊髓灰质炎病毒1、2和3型以及流感嗜血杆菌b糖(PRP)。
在第42天时收集的各个和合并血清中分别测定抗IgG水平和调理吞噬滴度。
评估IgG抗体滴度和调理活性,并且在12V+蛋白、12V和10V疫苗之间进行比较。
来自用不同制剂注射的豚鼠的血清在针对多糖血清型和蛋白的ELISA以及针对制剂中的12个血清型的OPA中进行测试。
12V +蛋白诱导与12V制剂相似的应答。
图17和18中的结果证实当它们与PEPilA组合时,对12价缀合物的免疫原性不存在负面影响。
用12V +蛋白GMP制剂获得的结果证实10V多糖以及蛋白的免疫原性,并且支持该制剂的临床评估。
- 还没有人留言评论。精彩留言会获得点赞!