用于体液样品收集、运输和处理的系统、装置和方法与流程
用于实验室检测的血液样品通常通过静脉穿刺的方式而获得的,静脉穿刺通常涉及将皮下注射针插入到受试者的静脉中。由皮下注射针抽取的血液可被直接吸入到注射器中,或者吸入到一个或多个密封小瓶中,以供后续处理。当静脉穿刺可能难以进行或不切实际时,例如在新生儿身上,可以使用诸如足跟刺破或其他替代部位穿刺等非静脉穿刺来抽取血液样品以供检测。在收集到血液样品之后,通常将抽取到的样品包装并转移至处理中心以供分析。
遗憾的是,体液样品的常规样品收集和检测技术存在缺点。例如,除了最基本的检测以外,目前可用的血液检测通常要求从受试者身上抽取相当大体积的血液。由于血液的大体积,从受试者身上的替代采样部位抽取血液(可以痛苦较少和/或侵入性较少)往往是不利的,这是因为其不产出常规检测方法所需的血液体积。在一些情况下,与静脉穿刺相关联的患者忧虑可能降低对检测方案的患者依从性。此外,在运送小体积样品流体的同时仍保持样品完整性可能是有问题的。
技术实现要素:
本公开内容中所描述的至少一些或全部实施方式克服了至少一些与现有技术相关联的缺点。虽然通常在获得流体样品(诸如但不限于血液样品)的背景下描述本文的实施方式,但应当理解的是,本文的实施方式并不限于血液样品,并且还可以适于采集一种或多种其他流体或者一种或多种身体样品以供分析。
在本文所描述的一个实施方式中,提供了一种用于收集体液样品的装置。在实施方式中,所述体液可以是血液。在收集血液的实施方式中,该实施方式对于准确地收集通常关联于非静脉抽血的小体积的体液样品可能是有用的。在一个非限制性示例中,所述样品体积约为1mL或更少。可选地,所述样品体积约为900uL或更少。可选地,所述样品体积约为800uL或更少。可选地,所述样品体积约为700uL或更少。可选地,所述样品体积约为600uL或更少。可选地,所述样品体积约为500uL或更少。可选地,所述样品体积约为400uL或更少。可选地,所述样品体积约为300uL或更少。可选地,所述样品体积约为200uL或更少。可选地,所述样品体积约为100uL或更少。可选地,所述样品体积约为90uL或更少。可选地,所述样品体积约为80uL或更少。可选地,所述样品体积约为70uL或更少。可选地,所述样品体积约为60uL或更少。可选地,所述样品体积约为50uL或更少。
在一个非限制性示例中,该装置可以用于将所述体液样品直接分成两个或更多个不同部分,继而将所述部分存放至其相应的样品器皿中。在一个非限制性示例中,所述装置包括第一部分,所述第一部分具有至少两个样品收集通道,所述样品收集通道被配置用于经由第一型动力将流体样品吸入到所述样品收集通道中,其中所述样品收集通道中之一具有设计用于与流体样品相混合的内部涂层,而所述样品收集通道中的另一个具有化学上不同于所述内部涂层的另一内部涂层。所述样品收集装置包括第二部分,所述第二部分包括用于接收被收集于所述样品收集通道中的所述体液样品的多个样品器皿,所述样品器皿可以可操作地接合以与所述收集通道流体连通,于是当建立了流体连通时,所述器皿提供不同于所述第一动力的第二动力以将所述体液样品的大部分从所述通道移动至所述样品器皿中。可以布置所述样品器皿以使得不会发生所述流体样品在所述器皿之间的混合。该装置可以用于收集血液或其他体液。从静脉收集血液可能相对较快;然而,非静脉抽血可能花费较长的一段时间来获得期望体积的样品,并且诸如抗凝剂等可涂覆通道的材料的早期引入可以防止在收集期间通道的过早堵塞。
在本文所描述的另一实施方式中,提供了一种用于收集体液样品的装置。该装置包括第一部分,所述第一部分包括多个样品收集通道,其中所述通道中的至少两个被配置用于经由第一型动力同时将流体样品吸入到所述至少两个样品收集通道中的每一个中。所述装置还可包括第二部分,所述第二部分包括用于接收被收集于所述样品收集通道中的所述体液样品的多个样品器皿,其中所述样品器皿具有第一情况和第二情况,在所述第一情况中所述样品器皿不与所述样品收集通道流体连通,而在所述第二情况中所述样品器皿可以可操作地接合以与所述收集通道流体连通,于是当建立了流体连通时,所述样品器皿提供不同于所述第一动力的第二动力以将体液样品从所述通道移动至所述样品器皿中。在实施方式中,用以移动体液的动力可以包括来源于毛细作用、减小的压强(例如,真空或部分真空,其将流体吸入至具有减小的压强的位置中)、增大的压强(例如,以迫使流体离开具有增大的压强的位置)、芯吸材料或其他装置的动力。
在本文所描述的更进一步实施方式中,提供了一种方法,包括通过使用样品收集装置来将最少量的样品计量到至少两个通道中,所述样品收集装置具有样品收集通道中的至少两个,所述样品收集通道被配置用于经由第一型动力同时将流体样品吸入到所述至少两个样品收集通道中的每一个中。在已经确认期望量的样品流体处于所述收集通道中之后,在所述样品收集通道与所述样品器皿之间建立流体连通,于是所述器皿提供不同于用以收集样品的所述第一动力的第二动力,以将体液样品从所述通道移动至所述器皿中。在一些备选实施方式中,不排除仅使用单一通道来收集所述体液的装置或者具有多个通道但不同时收集体液的装置。可选地,在不使用芯吸材料的情况下执行样品流体的收集。
在一个实施方式中,在样品收集与所述样品向样品预处理装置中的引入之间存在离散量的时间。在一个非限制性示例中,该过程是非连续过程。所述样品收集发生在一个处理站并且继而所述样品被带至第二站。该第二站可以在样品建筑中。可选地,所述第二站可以位于另一地点,其中所述样品需要靠步行、驾车、空运、输送、放置于运输装置中或放置于运输容器中以到达所述第二地点。以这种方式,在处理中存在离散的间歇,以允许与样品运输相关联的时间。
在本文的另一实施方式中,还可以在所述样品器皿中包含一个或多个分离凝胶,以使得所述凝胶将会使全血的无细胞部分与样品的细胞部分或者其他固体或半固体部分相分离。这样的凝胶或其他类似的分离材料可以在向所述样品器皿中引入样品之前、期间或之后被包含在所述样品器皿中。所述分离材料可具有介于细胞与溶液组分的密度之间的密度,以便使所述材料通过在分离(诸如通过离心分离)期间流向介于溶液样品层与非溶液样品层之间的位置,而分离所述样品组分。在离心分离之后,所述分离材料停止流动并保留成为所述层之间的软屏障。在一些实施方式中,可进一步处理所述分离材料以使其硬化成更坚硬的屏障。在一个非限制性示例中,所述分离材料可以是UV可固化材料,诸如但不限于二丙烯酸酯低聚物中基于山梨醇的胶凝剂的触变凝胶。所述样品器皿可使整个器皿或者可选地使具有UV可固化材料的部分暴露于UV光达诸如但不限于10至30秒的一段时间以硬化所述材料。这样的硬化可涉及UV可固化材料中材料的交联。可选地,所述UV可固化材料可与传统分离凝胶材料联合使用,以使得仅一侧(溶液侧或固体侧)与所述UV固化材料相接触。可选地,所述UV固化材料可与第三材料一起使用,以使得所述UV固化材料位于两种分离材料之间,并且不与所述样品的溶液和非溶液部分直接接触。
体液样品可以由本文所公开和描述的装置收集。本文公开并描述了使用这些装置来收集体液的方法。体液样品,例如已经由本文所公开和描述的所述装置和/或方法所收集的样品,可以从样品收集场所运输至一个或多个其他场所。
在本文所描述的至少一个实施方式中,提供了用于将液体形式的小体积的体液从一个位置物理运输至另一位置的方法。举非限制性示例而言,所述样品以液体形式在收集场所收集,以液体形式运输,并且以液体形式到达分析场所。在许多实施方式中,运输期间的液体形式并不保持在多孔基质、芯吸材料、织物(webbing)或将阻止在目标场所以液体形式提取样品的类似材料中。在一个实施方式中,每个样品器皿中的小体积的样品在约1ml至约500微升的范围内。可选地,小体积在约500微升至约250微升的范围内。可选地,小体积在约250微升至约100微升的范围内。可选地,小体积在约100微升至约50微升的范围内。可选地,小体积在约80微升至约40微升的范围内。可选地,小体积在约40微升至约1微升的范围内。可选地,小体积在约1微升至约0.3微升的范围内。可选地,小体积在约0.3微升或更少的范围内。
如本文所公开和描述的,运输容器可包括被配置用于接收并保留样品器皿的组件。在实施方式中,被配置用于接收并保留样品器皿的组件可被配置用于接收并保留多个样品器皿。在实施方式中,这样的组件可包括平板,例如托盘。在实施方式中,这样的组件(例如,平板)可包括具有被配置用于接受样品器皿的内表面的开口(例如,槽、孔或受器)。在实施方式中,运输容器可以包括包含多个开口(例如,槽、孔或受器)的组件,所述多个开口各自具有被配置用于接受样品器皿的内表面。在实施方式中,这样的内表面可以至少部分地与样品器皿的外表面或其一部分基本互补。
在本文所描述的另一实施方式中,所述运输容器可以提供每单位面积高密度的样品器皿,该样品器皿在运输期间以固定方式保持但在目标位置可移除。在一个非限制性示例中,所述样品器皿以阵列形式定位,其中当从上至下观察该阵列时,每平方英寸存在至少六个样品器皿。可选地,当从上至下观察所述阵列时,每平方英寸存在至少八个样品器皿。可选地,当从上至下观察所述阵列时,每平方英寸存在至少十个样品器皿。运送多个样品的任何传统技术通常使用大包,其中大包中的样品器皿处于松散的、无约束的形式。在一些实施方式中,所述运输容器可容纳某些样品器皿,诸如那些来自同一受试者的样品器皿,其相对于水平或其他间隔相邻的样品器皿而言更加紧密地靠近,以便它们可以在视觉上被标识为来自共同的受试者。可选地,所述运输容器具有用以接收载体的开口,所述载体将一个或多个样品器皿保持在一起,其中那些器皿具有共同之处,诸如但不限于来自同一受试者。
在实施方式中,所述样品器皿适于帮助以液体形式保持所述样品。在实施方式中,在所述样品以适于以液体形式保持所述样品的方式到达样品器皿之前,对该样品进行处理。例如,样品器皿可包括抗凝固剂,或者样品可以在运输至样品器皿或运输到样品器皿中之前或期间,用抗凝固剂进行处理。在实施方式中,抗凝固剂可以选自肝素(例如,肝素锂或肝素钠)、乙二胺四乙酸、4-羟基香豆素、维生素K拮抗剂(VKA)抗凝剂、抗凝剂或其他添加剂。除了每单位面积的高密度之外,所述运输容器的一些实施方式还包含高密度的样品,包括那些来自多个不同受试者的样品。举非限制性示例而言,所述运输容器可具有来自一个受试者的四个样品、来自另一受试者的两个样品等,直到所述运输容器中的大部分或全部可用开口得到填充。
应当理解,可将每个样品单独地送往选定分析,并且至少在一个实施方式中,基于要执行的检测而在所述运输容器中并未进行分组。举非限制性示例而言,并非运输容器中所有的样品均被收集用于同一检测。传统的检测系统可以仅仅为了运输而将那些送往完全相同检测的样品分组在一起。在本文的至少一个实施方式中,存在多种样品,每种样品被指定接受其自身的一组检测。在这样的实施方式中,所述运输容器中的分组并不只限于那些针对同一检测的样品。由于不需要基于待执行的检测而进一步地分开进行样品运输,因此这可以进一步地简化样品处理。所述运输容器的一些实施方式包含来自至少三个或更多个不同患者的样品。所述运输容器的一些实施方式包含来自至少五个或更多个不同患者的样品。所述运输容器的一些实施方式包含来自至少十个或更多个不同患者的样品。所述运输容器的一些实施方式包含来自至少二十个或更多个不同患者的样品。
举非限制性示例而言,本文所描述的一个实施方式可以可选地使用一个或多个托盘,所述托盘具有用于容纳所述样品器皿和/或样品器皿保持器的槽。在一个实施方式中,所述托盘在等待更多样品或运输的同时,还可兼作存储于冷却室期间的容纳装置,在一个实施方式中,所述托盘本身还可以进行清洗和灭菌,因为在一些实施方式中,所述托盘可以从所述运输容器中移除。在一些实施方式中,所述运输容器中的所述托盘可以按平行于所述运输容器的覆盖物的方式来保持。可选地,所述托盘可以与所述运输容器的所述覆盖物成角度地保持在该运输容器内部。可选地,所述托盘不可移除地固定于所述运输容器。可选地,所述托盘与所述运输容器本身一体成型。可选地,具有相同或不同大小或配置的多个托盘可以放置于所述运输容器的内部。
在本文所描述的又一实施方式中,提供了用于使用运输容器来运送小体积样品器皿的方法,所述运输容器具有提供主动和/或被动冷却的集成式热控制单元和/或材料。在一个实施方式中,所述热控制材料可以是,但不限于是嵌入式相变材料(PCM),所述材料使温度保持在先前的或期望的温度。举非限制性示例而言,所述相变材料可以对抗围绕临界温度的温度变化,在所述临界温度处,所述材料会经历相变。如果嵌入所述PCM,则所述器皿和被动冷却元件可以是同一个。可选地,所述运输容器可以使用主动冷却系统。可选地,所述运输容器可以使用主动冷却系统来保持和/或延长与被动冷却组件相关联的冷却时间。在实施方式中,运输容器可以包括具有高热容量(即,相比于诸如塑料或聚合材料等材料,具有高热容量)的材料,并且可以包括大量的这样的高热容量材料,该材料在延长的时间段内有效地保持所述运输容器的至少一部分处于或接近期望的温度。
可选地,所述方法包括用于将来自不同受试者的多个样品器皿从控温存储区转移到运输容器中的单一步骤。举非限制性示例而言,该单一步骤可以同时将二十四个或更多个样品器皿从存储位置转移到所述运输容器中的固定位置。可选地,该单一步骤可以同时将三十六个或更多个样品器皿从存储位置转移到所述运输容器中的固定位置。可选地,该单一步骤可以同时将四十八个或更多个样品器皿从存储位置转移到所述运输容器中的固定位置。在这样的实施方式中,所述托盘最初可以在控热环境中,所述控热环境诸如但不限于冷藏箱,其中随着时间的推移收集来自各个受试者的样品,直到达到期望的数目。在一个这样的实施方式中,所述运输容器中容纳所述一个或多个样品器皿的所述托盘是在所述存储区中容纳所述样品器皿的同一托盘。可选地,所述托盘可以与存储保持器相同,所述存储保持器用于在将样品装载至所述运输容器之前容纳该样品。因为容纳所述样品器皿的同一托盘将在所述运输容器中使用,所以在该转移期间丢失样品、在非调节热环境中遗漏样品等的风险降低。因为在单一步骤中,所述托盘中基本上所有的样品器皿均累积在所述控热存储区中并继而被转移,所以所述样品在从所述控热存储区转移至所述运输容器中的同时均经历基本上相同的热暴露。因为样品器皿经历了基本上相同的暴露,所以样品与样品之间的可变性由于不同的暴露时间而降低。
可选地,所述方法包括使用可单独寻址的样品器皿配置。可选地,样品器皿的分组,诸如在公共载体中的那些,可以在预定义分组中寻址。可选地,甚至公共载体中的样品器皿可以是单独寻址的。尽管这并非为对本文所有实施方式的要求,但这在从所述托盘装载和/或卸载样品、样品器皿和/或样品保持器时是特别有用的。
一些实施方式可以使用在所述运输容器外部的又一容器(“外箱(outerbox)”)以提供进一步的物理保护和/或热控制能力。所述运输容器中的一个或多个可以放置在所述外箱之内,并且可以将该组合从一个位置运送到目的位置。举非限制性示例而言,这可以是波纹塑料外箱的形式,其中所述外箱被配置成至少部分地包住或包围运输容器。在实施方式中,外箱为其中所包围的运输容器提供热绝缘。一些实施方式可以使用闭孔挤塑聚苯乙烯泡沫外箱。所述外箱的一些实施方式可以由热成型板形成。在一些实施方式中,外箱可具有握把、手柄、衬垫、轮子、闩锁、拉杆和/或用于保持、操纵、紧固、保护、运输或以其他方式控制所述外箱的内容物的位置、定向和/或进入的其他特征。所述外箱的一些实施方式可具有其自身的主动和/或被动热控制单元。在实施方式中,外箱为其中所包围的一个或多个运输容器提供冷却和热绝缘。所述外箱的一个或多个实施方式可被配置用于收容一个或多个运输容器。可选地,该容器还可通过向其中的一个或多个运输容器提供在期望的温度范围之间的热调节环境,来向所述运输容器提供附加的热控制。可选地,该温度范围在约1℃到10℃之间,可选地在2℃到8℃之间或者2℃到6℃之间。
在本文所描述的又一实施方式中,提供了一种用于在若干冷却循环之后热表征运输容器的方法。举非限制性示例而言,在一定数目的循环之后,可以热表征所述运输容器以确保该容器继续在期望范围内执行操作。
所述容器和/或托盘的一些实施方式可以包括热变化指示器。在一个非限制性示例中,所述指示器集成在所述运输容器、托盘的可视表面上,以及/或者集成在所述外箱上。在一个非限制性示例中,热致变色油墨可以用作热变化的指示器,特别是如果所述热变化导致温度在期望范围之外。在一个实施方式中,该指示器可被配置用于使整个箱和/或托盘变色。该变化可以是可逆的或不可逆的。可选地,所述指示器仅定位于所述运输容器和/或托盘的选定部分上,而非整个容器或托盘上。
在本文所描述的一个实施方式中,提供了一种方法,该方法包括在受试者表面收集体液样品,其中所收集的样品储存在一个或多个样品器皿中;提供运输容器,以在第一定向上收容至少两个或更多个样品器皿;以及进行布置以使所述样品器皿在所述运输容器中从第一位置运送至第二位置,其中每个样品器皿到达所述第二位置并容纳其非芯吸、非基质形式的体液样品的大部分,该体液样品可以以液体形式从所述样品器皿中移取,并且其中每个样品器皿中样品的量不超过约2ml。在实施方式中,每个样品器皿中的样品的量不超过约1ml,或不超过约500μL,或不超过约250μL,或不超过约100μL,或不超过约50μL或更少。
在本文所描述的另一实施方式中,提供了一种用于运送多个样品器皿的方法,所述方法包括:提供容器,该容器被配置用于收容至少五个或更多个各自包含毛细血管血液的样品器皿;以及进行布置以使所述样品器皿在所述运输容器中从第一位置运送至第二位置,其中每个样品器皿到达所述第二位置并容纳其液体、非芯吸形式的毛细血管血液的大部分,该毛细血管血液可从所述样品器皿中移取用于进一步处理,并且其中每个样品器皿中的毛细血管血液的量不超过约2ml。在实施方式中,每个样品器皿中的毛细血管血液的量不超过约1ml,或不超过约500μL,或不超过约250μL,或不超过约100μL,或不超过约50μL或更少。
在本文所描述的另一实施方式中,提供了一种用于运送多个用于包含生物样品的样品器皿的方法,所述方法包括:提供容器,该容器被配置用于收容所述样品器皿中的至少五个或更多个,其中每个样品器皿中的样品的量不超过约2ml;以及将所述容器和样品器皿从第一位置运送至第二位置,其中每个样品器皿到达第二位置并容纳其液体、非芯吸形式的生物样品的大部分,该生物样品可以从所述样品器皿中移取用于进一步处理。在实施方式中,每个样品器皿中的样品的量不超过约1ml,或不超过约500μL,或不超过约250μL,或不超过约100μL,或不超过约50μL或更少。
在本文所描述的另一实施方式中,提供了一种用于运送多个包含毛细血管血液的样品器皿的方法,所述方法包括:提供具有热调节内部区域的容器,其被配置用于收容至少五个或更多个样品器皿于受控配置中,以使得所述容器的至少一个冷却表面朝向所述样品器皿并且根据温度曲线来传送热冷却的控制释放,所述温度曲线在运输期间保持所述内部区域在约1到10℃而不冻结所述血液样品;以及将所述容器从第一位置运送到第二位置,其中每个样品器皿到达并容纳其液体、非芯吸形式的毛细血管血液中的大部分,该毛细血管血液可以从所述样品器皿中移取用于进一步处理。
在本文所描述的另一实施方式中,提供了一种用于运送多个血液样品器皿的方法,所述方法包括运送具有热控内部的容器,其被配置用于收容呈阵列配置的10个或更多个样品器皿,其中每个器皿容纳其自由流动的、非芯吸形式的血液样品中的大部分,并且其中在每个器皿中存在约1ml或更少的血液,且每个器皿有具有至少部分真空气氛的内部;其中样品器皿以阵列配置保持以使所述样品器皿定位在距冷却表面受控距离和定向处,其中存在至少一个从所述表面到所述样品器皿的优先的热通路。
在本文所描述的另一实施方式中,提供了一种用于运送多个低于1ml的样品器皿的方法,所述方法包括在将样品转移至每个样品器皿之前将样品与抗凝剂混合;将每个样品器皿与受试者以及一组要求的样品检测相关联;以及运送热控容器,该热控容器收容呈阵列配置的所述多个低于1ml的样品器皿,其中每个器皿容纳其自由流动的、非芯吸形式的样品中的大部分,其中器皿被布置成使得每个容器中存在至少两个器皿与每个受试者相关联,其中至少第一样品包括第一抗凝剂而第二样品包括在基质中的第二抗凝剂。
在本文所描述的另一实施方式中,提供了一种方法,所述方法包括:a)将所述多个样品器皿放置在温度控制运输容器中,所述温度控制运输容器包括被配置成与所述样品器皿热连通的受控均匀热分布、高热的融合材料(fusion material),其中所述材料不导致所述样品器皿中的样品流体的冻结;b)将所述热分布运输容器放置在由运输容器的至少顶壁和底壁所限定的产物腔中;c)将主动冷却装置放置为与所述腔热连通,由此所述冷却装置适于在激活时冷却所述腔,所述吸附冷却装置包括吸收体,该吸收体被定位成使得在所述吸收体中产生的热量消散在所述产物腔外部;d)激活所述冷却装置以开始所述腔的冷却;e)将所述运输容器从第一位置运输至第二位置;以及f)从所述腔中移除所述产物。
在本文所描述的另一实施方式中,提供了一种运送多个低于1ml的样品器皿的方法,所述方法包括:运送热控容器,该热控容器收容呈阵列配置的所述多个低于1ml的样品器皿,其中每个器皿容纳其自由流动的、非芯吸形式的样品中的大部分,并且其中器皿被布置成使得每个容器中存在至少两个器皿与每个受试者相关联,其中至少第一样品包括第一抗凝剂而第二样品包括在基质中的第二抗凝剂。
应当理解,本文的任何实施方式可以适于具有以下特征中的一个或多个。在一个非限制性示例中,所述体液样品是血液。可选地,所述体液样品是毛细血管血液。可选地,收集所述体液样品包括对所述受试者进行至少一次穿刺以释放体液,其中所述穿刺并非静脉穿刺。可选地,收集包括使用至少一个微针来对所述受试者进行至少一次穿刺。可选地,收集包括使用至少一个刺血针来对所述受试者进行至少一次穿刺。可选地,通过手指刺伤来形成所述穿刺。可选地,通过刺伤所述受试者前臂上的皮肤来形成所述穿刺。可选地,通过刺伤所述受试者肢体上的皮肤来形成所述穿刺。可选地,所述表面为所述受试者的皮肤。可选地,所述运输容器具有内部,所述内部最初在亚大气压下。可选地,所述亚大气压至少是部分真空。可选地,所述运输容器的内部在亚大气压下,该亚大气压至少在低于环境压强的压强下。可选地,选择所述亚大气压以提供足够的力来将期望体积的样品吸入至所述样品器皿中。可选地,所述运输容器包含至少五个或更多个样品器皿。可选地,所述运输容器运送来自多个不同受试者的体液样品。可选地,与每个样品器皿相关联的信息确定将对其中的体液样品进行哪些检测。可选地,所述运输容器在运送期间放置于另一容器内。可选地,所述方法还包括在运送至所述第二位置之前对所述样品器皿中的样品进行预处理。
可选地,所述运输容器具有每平方英寸至少约4个器皿的样品器皿阵列密度。可选地,所述运输容器中的冷却表面提供了在针对所述器皿中的样品器皿的期望范围内的温度曲线。可选地,所述样品器皿是可单独寻址的。可选地,所述方法还包括在将所述器皿装载至所述容器中之前使用冷却托盘来容纳冷却室中的样品器皿,并使用同一托盘来容纳所述器皿中的样品器皿,其中所述样品随所述冷却托盘一起放置在容器中。可选地,布置样品器皿以使得每个容器中存在至少两个具有来自同一受试者的体液样品的器皿,其中至少第一样品包括第一抗凝剂而第二样品包括在基质中的第二抗凝剂。可选地,所述流体样品包括毛细血管血液,以用于通过FDA许可的或FDA认证的测定装置和程序进行的检测,或者通过CLIA认证实验室进行的检测。可选地,所述流体样品包括血液,以用于通过FDA许可的或FDA认证的测定装置和程序进行的检测,或者通过CLIA认证实验室进行的检测。可选地,提供受控热分布和高热的融合材料的外壳提供至少一个面向所述器皿的冷却表面。可选地,高热的融合材料嵌入在用于形成所述器皿的材料中。可选地,受控热分布、高热的融合材料占约30%至50%。可选地,受控热分布、高热的融合材料占约10%至30%。可选地,所述方法还包括金属材料的外壳,该材料具有低于环境温度的静止温度(resting temperature)。
可选地,所述方法还包括扫描所述接收场所处每个样品上的信息存储单元并且自动地将所述器皿放置在筒匣中,可选地,所述方法还包括扫描所述接收场所处每个样品上的信息存储单元并且自动地将所述器皿放置在筒匣中,可选地,所述方法还包括当样品器皿在运输之前处于制冷装置中以及在运输期间处于所述运输容器中时,使用同一托盘将该样品器皿容纳于所述阵列配置中。可选地,所述方法还包括使用托盘以用于容纳包含高导热材料的样品器皿。可选地,所述托盘包括多个槽,所述槽具有用以将样品器皿保持器保持在优先定向的形状。可选地,所述托盘被配置用于直接接合样品器皿保持器。可选地,托盘锁定机构用于使所述托盘保持在所述器皿内,其中所述托盘锁定机构仅在施加磁力时释放所述托盘。可选地,所述方法包括在运输期间保持温度在2℃到8℃的范围。可选地,所述方法还包括温度控制材料,该材料在运输期间保持在冻结点以上,而为约10℃或更低。可选地,所述方法包括使用温度阈值检测检测器,以指示所述样品器皿是否达到阈值水平之外的温度。可选地,所述方法还包括:在运送之前扫描所述托盘中的器皿,以确定是否已对所述样品执行了处理步骤;使用处理器来执行或重新执行步骤。可选地,所述方法还包括将所述一个或多个样品器皿装载至所述托盘中的单一步骤以及将所述托盘装载至所述运输容器中的单一步骤。
可选地,所述运输容器具有第一表面,该第一表面被配置用于将导热通路限定至所述运输容器中的受控热分布、高热的融合材料。可选地,所述第一表面被配置成与由吸附冷却装置冷却的另一表面直接接触。可选地,所述方法包括同时对所述托盘中的样品器皿进行条形码扫描。可选地,所述方法包括同时对所述托盘中的样品器皿的底面进行条形码扫描。可选地,所述方法包括对样品器皿行列进行条形码扫描。可选地,所述方法包括对样品器皿行列的底面进行条形码扫描。可选地,所述方法包括反向运送多个样品器皿。可选地,所述方法包括运送多个样品器皿,其中血细胞和血浆由所述样品器皿中的阻隔材料分离开。可选地,所述方法包括通过解锁并打开运输容器来打开该容器,其中至少一个铰接件将两个部件保持在一起。可选地,所述托盘具有至少一个磁性接触点,用于将该托盘从所述器皿中移除。可选地,计算机控制的末端执行器用于从所述运输容器装载和/或卸载样品器皿,其中在卸载之前、期间或之后,读取器从附接至一个或多个样品器皿的至少一个信息存储单元中获得信息。应当理解,尽管所述运输容器通常用于运输,但当该运输容器不用于运输时,其还可以用作所述托盘和/或样品器皿的存储容器。因此,所述容器的用途不限于运输,并且不排除用于任何所述实施方式的其他合适的用途。
在本文的又一实施方式中,提供了一种用于运送多个样品器皿的热控运输容器,所述运输容器包括:至少具有共同限定腔的顶壁、底壁和侧壁的容器,其中所述顶壁、底壁和侧壁中的至少一个包含相变材料;框架,该框架的尺寸设置成配合于所述腔内,并且该框架限定被配置用于容纳多个样品器皿的开口并且具有被配置成与所述样品器皿的侧壁相接触的侧壁,其中布置器皿以使得每个患者至少具有包含第一抗凝剂的第一样品和具有在基质中的第二抗凝剂的第二样品。
在本文所描述的另一实施方式中,提供了一种用于运送多个样品器皿的热控运输容器,所述运输容器包括:a)底部容器部分,其包括限定腔的底壁和至少第一侧壁,所述腔适于在其中包含产物;b)顶部容器部分,其包括顶面和地面并且适于结合所述底部容器部分以限定产物腔,所述顶部容器部分形成针对所述器皿的顶壁;其中所述顶壁、底壁和侧壁中的至少一个包括相变材料。
在本文所描述的另一实施方式中,提供了一种用于运输多个样品器皿的热控运输容器,所述运输容器包括:a)底部容器部分,其包括限定腔的底壁和至少第一侧壁,所述腔适于在其中包含产物;b)顶部容器部分,其包括顶面和底面并且适于与所述底部容器部分结合以限定产物腔,所述顶部容器部分形成所述器皿的顶壁;c)保持器,其用于限定多个样品器皿容纳空间以将所述样品器皿定位在预定方向上;其中所述顶壁、底壁和侧壁中的至少一个包括相变材料。
在本文所描述的另一实施方式中,提供了一种用于运送样品器皿的运输容器,所述容器包括:通常为矩形的底板;通常为从所述底板的纵向边缘凸出的平行的侧面;通常为从所述底板的端边缘凸出并且桥接所述侧面的平行的端;覆盖物,其可配合于所述侧面和端之上并且与所述侧面和端以及与所述底板形成通常为封闭的空间;样品器皿保持器,其可移除地耦合至所述容器内部中的底板并且被配置用于限定器皿容纳空间。可选地,所述器皿容纳空间被配置用于容纳真空血液收集管,所述血液收集管具有约2ml或更小的内部容积。在至少一个实施方式中,所述器皿容纳空间被配置用于容纳器皿,该器皿诸如但不限于真空收集管,该收集管具有约1ml、或小于约500μL、或小于约250μL、或小于约100μL、或小于约50μL或更小的内部容积。
在本文所描述的另一实施方式中,提供了一种用于运送多个样品器皿的热控运输容器,所述运输容器包括:用于使多个样品器皿保持在至少一个固定方向上的装置;用于热控制所述样品器皿的温度使其在约0℃到10℃的期望范围之内的装置;其中用于容纳所述多个样品器皿的装置是可以从所述运输容器中移除的。可选地,所述器皿容纳空间被配置用于容纳真空血液收集管,所述血液收集管具有约2ml或更小的内部容积。在实施方式中,所述器皿容纳空间被配置用于容纳真空收集管,该收集管具有约1ml、或小于约500μL、或小于约250μL、或小于约100μL、或小于约50μL或更小的内部容积。
应当理解,一些实施方式可包括试剂盒,该试剂盒包括如任何上述实施方式中所阐述的运输容器。可选地,所述试剂盒包括运输容器以及关于其使用的说明。
在本文所描述的一个实施方式中,描述了一种用于将全血样品和/或其部分从发送者提供给接收者的方法。所述方法包括运输包括样品器皿的包装,直到至少当全血样品和/或其部分到达所述接收者时,所述样品器皿包括一个或多个通道,该通道包含(a)具有小于或等于约200微升(ul)体积的流态的全血样品和/或其部分以及(b)一种或多种用于保存所述全血样品和/或其部分中用于分析的一个或多个分析物的试剂,并且其中所述存放导致所述样品器皿递送至所述接收者。举非限制性示例而言,运输所述样品器皿可以通过使用包裹递送服务、快递或其他运送服务而发生。
在本文所描述的一个实施方式中,描述了一种用于准备全血样品以供递送至样品处理站的方法,所述方法包括采用递送服务来存放具有流态的全血样品以及小于或等于约200ul容积的样品器皿,所述递送服务用于将所述样品器皿递送至用于处理所述全血样品的样品处理位置。所述样品器皿可以通过(a)借助于毛细管通道来从受试者抽取所述全血样品以及(b)将该全血样品放置在所述样品器皿中而进行准备,其中所述全血样品与包含在所述毛细管通道和/或所述样品器皿中的一种或多种试剂一起以流态进行保存。
应当理解,本文的任何实施方式可以适于具有以下特征中的一个或多个。举非限制性示例而言,一些实施方式中的样品可以是半固态或凝胶态。这可以发生在所述样品处于所述样品器皿中之后。可选地,所述递送服务是邮政递送服务。可选地,所述血液样品从在护理点位置处的受试者收集。可选地,所述护理点位置是所述受试者的家。可选地,所述护理点位置是医疗保健提供者的位置。
在本文所描述的另一实施方式中,用于处理全血样品的方法包括在处理站从包裹递送服务接收样品器皿,所述样品器皿具有小于或等于约200ul的全血样品,其中所述样品器皿在所述处理站接收且具有流态的全血样品;以及在所述处理站对所述流态的全血样品进行至少一种预分析测定和/或分析测定。
应当理解,本文的任何实施方式可以适于具有以下特征中的一个或多个。举非限制性示例而言,所述测定具有一个或多个步骤。可选地,所述样品器皿包含在具有一个或多个环境控制区的外壳中。可选地,所述外壳适于控制每个环境控制区的湿度。可选地,所述外壳适于控制每个环境控制区的压强。
在本文所描述的又一实施方式中,提供了一种用于对血液样品进行排队以供在处理位置进行处理的计算机实现方法。所述方法包括(a)借助于具有计算机处理器的地理定位系统来标识具有血液或其他体液样品的运输容器的地理位置;(b)借助于计算机处理器来估计所述运输容器到所述处理位置的递送时间;以及(c)基于所估计的递送时间来提供针对准备工作的通知,以供在所述处理位置处理所述样品。
在本文所描述的又一实施方式中,描述了一种用于准备全血样品以供递送至样品处理站的方法,所述方法包括采用递送服务来存放具有流态的全血样品的样品器皿,所述递送服务用于将所述样品器皿递送至用于处理所述全血样品的样品处理位置,其中所述样品器皿通过(a)使用装置来从受试者抽取所述全血样品以及(b)将该全血样品放置在所述样品器皿中而进行准备。
可选地,存放可包括样品器皿的拾起和/或放下。可选地,处理可包括样品的预分析处理、分析处理和后分析处理。可选地,递送服务可包括受试者的递送服务或第三方递送服务。可选地,所述全血样品与包含在所述毛细管通道或所述样品器皿中的一种或多种试剂一起以流态进行保存。
在本文所描述的又一实施方式中,提供了一种用于在处理站处理全血样品的方法。所述方法包括在所述处理站从递送服务接收具有全血样品的样品器皿,其中所述样品器皿通过(a)使用收集装置从受试者抽取所述全血样品以及(b)将该全血样品放置在所述样品器皿中而进行准备。所述方法还包括在所述处理站对所述全血样品进行至少一种预分析测定或分析测定。
应当理解,本文的任何实施方式可以适于具有以下特征中的一个或多个。举非限制性示例而言,借助于计算机处理器由所估计的递送时间来提供用于完成所述处理的时间。可选地,所述方法包括在于所述处理位置估计所述样品器皿的递送时间后,对所述样品器皿进行排队以供处理。可选地,借助于通信网络来标识所述样品器皿的地理位置。
在本文所描述的一个实施方式中,描述了一种用于提供用于处理血液样品的估计完成时间的计算机实现方法。所述方法包括接收关于通过递送服务而被运输至处理站(用于样品处理)的运输容器的信息,所述运输容器具有从受试者中取出的血液样品。所述方法还包括借助于计算机处理器,在所述处理站计算所述血液样品在处理队列中的位置,其中所述预测基于(i)关于来自其他受试者的血液或其他体液样品在所述处理队列中的位置的信息,以及(ii)关于与所述样品器皿(具有从所述受试者中移取的血液样品)相关的其他样品器皿(具有来自其他受试者的血液样品)的地理位置的信息。所述方法包括预测在将所述样品器皿通过递送服务递送至所述处理站后,用于在该处理站处理所述血液样品的时间;以及基于所述预测和所估计的将所述样品器皿递送至所述处理站的时间,为所述受试者或者与该受试者相关的医疗保健提供者提供用于处理来自所述受试者的血液样品的估计时间,所述估计时间从用所述递送服务存放所述样品器皿的时间点测量。可选地,将所述样品运输至多个处理站。应当理解,如本文所用的处理应被宽泛地解释并且可包括一个或多个预分析、分析和/或后分析步骤。
在本文所描述的又一实施方式中,描述了一种用于提供用于处理来自受试者的血液样品的估计完成时间的计算机实现方法。所述方法包括接收关于通过递送服务而被运输至处理站(用于样品处理)的运输容器的信息,所述运输容器具有至少一个从所述受试者中移取的血液或体液样品。所述方法还包括借助于计算机处理器,在所述处理站计算所述血液样品在处理队列中的位置,其中所述预测基于(i)关于来自其他受试者的血液样品在所述处理队列中的位置的信息,以及(ii)关于与所述运输容器(具有从所述受试者中移取的血液样品)相关的其他样品器皿(具有来自其他受试者的血液样品)的地理位置的信息。所述方法包括预测在将所述运输容器通过递送服务递送至所述处理站后,用于在该处理站处理所述血液样品的时间;以及基于所述预测和所估计的将所述运输容器递送至所述处理站的时间,在所述处理站分配一个或多个资源,用于在将所述血液样品递送至该处理站后处理该血液样品。
应当理解,本文的任何实施方式可以适于具有以下特征中的一个或多个。举非限制性示例而言,所述运输容器具有信息存储单元,该信息存储单元允许由所述递送服务和/或所述处理位置来标识所述运输容器。可选地,所述信息存储单元是射频识别(RFID)标签。可选地,所述信息存储单元是条形码。可选地,所述信息存储单元是微芯片。可选地,所述运输容器包括一个或多个用于收集所述体液样品(例如,血液样品)的温度、所述样品器皿的压强、所述样品的pH、所述样品的浊度、所述样品的粘度或者所述样品的其他特性中的一个或多个的传感器。可选地,所述处理位置根据需求处理所收集的体液样品。可选地,所述运输容器包括用于提供所述样品器皿的位置的地理定位装置。可选地,所述抗凝固剂选自肝素、乙二胺四乙酸、抗凝剂或其他添加剂。可选地,所述运输容器(其中所述容器容纳空间被配置用于容纳真空血液收集管)被配置用于容纳真空样品收集管,所述样品收集管具有最多约30%真空、或最多约40%真空、或最多约50%真空、或最多约60%真空、或最多约70%真空、或最多约80%真空、或最多约90%真空的部分真空。
在本文所描述的、涉及第一器皿和第二器皿的实施方式中,在某些实施方式中,所述第一器皿和第二器皿的内部容积各自为1000微升、750微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升、2微升或更少。在本文所描述的、涉及第一器皿和第二器皿的实施方式中,在某些实施方式中,所述第一器皿和第二器皿的内部容积均不超过1000微升、750微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升。在本文所描述的、涉及一个或多个器皿的实施方式中,在某些实施方式中,所述一个或多个器皿中的每一个的内部容积为1000微升、750微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升、2微升或更少。在本文所描述的、涉及一个或多个器皿的实施方式中,在某些实施方式中,所述一个或多个器皿的内部容积均不超过1000微升、750微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升。
在本文所描述的、涉及第一器皿和第二器皿的实施方式中,每个器皿包含小体积体液样品中的一部分,在某些实施方式中,所述第一器皿和第二器皿均不包含具有大于500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升的体积的所述小体积体液样品的一部分。
在本文所描述的、涉及包含小体积体液样品的器皿的实施方式中,在某些实施方式中,所述器皿中的小体积体液样品的体积不大于500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升。
在本文所描述的,涉及包含体液样品的一个或多个器皿的实施方式中,在某些实施方式中,所述一个或多个器皿中的至少一个包含填充所述器皿的内部容积的至少99%、98%、97%、96%、95%、90%、85%、80%、75%、70%、60%、50%、40%、3%、20%、10%或5%的体液样品。在本文所描述的,涉及包含体液样品的一个或多个器皿的实施方式中,在某些实施方式中,所述一个或多个器皿中的所有器皿均包含填充所述器皿的内部容积的至少99%、98%、97%、96%、95%、90%、85%、80%、75%、70%、60%、50%、40%、3%、20%、10%或5%的体液样品。
在本文所描述的、涉及样品收集场所和样品接收场所的实施方式中,在实施方式中,所述样品收集场所和样品接收场所可以在相同的房间、建筑物、园区或建筑物群中。在本文所描述的、涉及样品收集场所和样品接收场所的实施方式中,在实施方式中,所述样品收集场所和样品接收场所可以在不同的房间、建筑物、园区或建筑物群中。在实施方式中,样品收集场所和样品接收场所可以相隔至少1米、5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米或500千米。在实施方式中,样品收集场所和样品接收场所可以相隔不超过5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米、500千米或1000千米。在实施方式中,样品收集场所和样品接收场所可以相隔至少1米、5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米或500千米,且不超过5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米、500千米或1000千米。在实施方式中,本文所描述的第一位置可以是样品收集场所,而本文所描述的第二位置可以是样品接收场所。
在本文所描述的、涉及器皿的实施方式中,所述器皿包含从样品收集场所运输至样品接收场所的小体积体液样品中的至少一部分,在实施方式中,所述体液样品在所述器皿的运输期间可以保持为液体形式。在本文所描述的、涉及两个或更多个器皿的实施方式中,每个器皿包含从样品收集场所运输至样品接收场所的小体积体液样品中的至少一部分,在实施方式中,每个器皿中的所述体液样品在所述器皿的运输期间可以保持为液体形式。
在本文所描述的、涉及从样品收集场所运输至样品接收场所的一个或多个器皿的实施方式中,在实施方式中,所述一个或多个器皿可以在运输容器中运输。在本文所描述的、涉及在运输容器中运输的一个或多个器皿的实施方式中,在实施方式中,所述一个或多个器皿可以以阵列形式定位在所述运输容器中,并且当从上至下观察时,所述阵列每平方英寸可包含至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、30个、35个、40个、50个或100个器皿。
在本文所描述的、涉及在运输容器中运输一个或多个器皿的实施方式中,在实施方式中,所述运输容器可包含来自至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、30个、35个、40个、50个或100个不同受试者的体液样品。
在本文所描述的、涉及包含体液样品的至少一部分的器皿的实施方式中,在实施方式中,所述器皿可包含抗凝剂。在涉及两个或更多个各自包含来自受试者的体液样品的一部分的器皿的实施方式中,在实施方式中,至少一个或全部器皿可包含抗凝剂。在实施方式中,当两个或更多个各自包含来自受试者的体液样品的一部分的器皿还各自包含抗凝剂时,所述器皿可包含相同的抗凝剂或不同的抗凝剂。器皿中的抗凝剂可以是例如肝素或EDTA。
在本文所描述的、涉及将一个或多个器皿中的体液样品从样品收集场所运输至样品接收场所的方法中,在实施方式中,所述体液样品可以在从所述受试者获得所述体液样品后不超过48小时、36小时、24小时、16小时、12小时、8小时、7小时、6小时、5小时、4小时、3小时、2小时、60分钟、45分钟、30分钟、20分钟、15分钟、10分钟或5分钟到达所述样品接收场所。
在本文所描述的、涉及将至少一个器皿从样品收集场所运输至样品接收场所的方法中,在实施方式中,所述方法还可包括在运输所述器皿之前对其进行离心。在本文所描述的、涉及将多个器皿从样品收集场所运输至样品接收场所的方法中,在实施方式中,所述方法还可包括在运输所述多个器皿之前对其进行离心。
在本文所描述的、涉及将至少第一器皿从样品收集场所运输至样品接收场所的方法中,在实施方式中,在所述样品接收场所并且在从所述第一器皿中移取样品之前,将该第一器皿插入到包含自动化流体处理装置的样品处理装置中。在本文所描述的、涉及将至少第一器皿和第二器皿从样品收集场所运输至样品接收场所的方法中,在实施方式中,在所述样品接收场所并且在从所述第一器皿中移取样品之前,将所述第一器皿和第二器皿插入到包含自动化流体处理装置的样品处理装置中。在实施方式中,当包含样品的器皿插入到包括自动化流体处理装置的样品处理装置中时,样品可通过该自动化流体处理装置从所述器皿中移取。在实施方式中,在将包含样品的器皿插入到包括自动化流体处理装置的样品处理装置中之前,将所述器皿插入到筒匣中,并继而将所述筒匣插入到所述样品处理装置中。筒匣可容纳任何数目的、包含样品的器皿,诸如至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、50个或100个器皿。筒匣还可包含用于对所述样品执行一个或多个实验室检测的一种或多种试剂。在实施方式中,筒匣可包含执行将用所述筒匣中的一个或多个样品执行的所有检测所必需的所有试剂。
在实施方式中,器皿中的体液样品的部分的一部分可以是任意量。例如,在实施方式中,第一器皿中的体液样品的部分的一部分可以是第一器皿原始样品的一部分或第一器皿稀释样品的一部分。在另一示例中,在实施方式中,第二器皿中的体液样品的部分的一部分可以是第二器皿原始样品的一部分或第二器皿稀释样品的一部分。
在本文提供的、涉及运输一个或多个器皿的实施方式中,每个器皿包含从样品收集场所到样品接收场所的至少部分体液样品,在实施方式中,可以对所述器皿中的所述至少部分体液样品中的一部分执行任何数目的实验室检测中的一个或多个步骤。例如,在实施方式中,可以对所述至少部分体液样品中的一部分执行1、2、3、4、5、6、7、8、9、10、15、20、25、30、40、50、60、70、80、90、100、200、300、400、500或1000种或更多种不同的实验室检测中的一个或多个步骤。各种不同的实验室检测可使用所述体液样品的单独的一部分,或者在实施方式中,可以用所述体液样品的特定部分执行多于一种不同的实验室检测。所述不同的实验室检测可以是相同类型的,不同类型的,或者是相同类型和不同类型的混合。所述一个或多个器皿可以是,例如,第一器皿,或者第一器皿和第二期皿。
在实施方式中,当根据本文提供的系统或方法而运输的来自受试者的体液样品用于多于一种实验室检测时,每种实验室检测可使用每个检测不超过50、40、30、25、20、15、10、9、8、7、6、5、4、3、2、1、0.5、0.1、0.05或0.01当量的纯体液样品(例如,未稀释的全血、唾液或尿)。
在本文提供的、涉及在样品收集场所获得多个器皿的实施方式中,所述多个器皿共同包含来自受试者的小体积体液样品,在实施方式中,在所述多个器皿的全部器皿之间的、从所述受试者获得的所述小体积体液样品的总体积可以不大于500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升。
在本文提供的、涉及将包含至少部分体液样品的器皿从样品收集场所运输至样品接收场所的实施方式中,在所述样品接收场所从所述器皿中移取原始样品,并继而从该原始样品生成稀释样品,在实施方式中,所述稀释液可以逐步地或连续地生成。在实施方式中,所述稀释样品可具有不超过1000微升、900微升、800微升、700微升、600微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升的总体积。在实施方式中,所述稀释样品可相对于所述原始样品稀释了至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍、100倍、200倍、300倍、400倍、500倍、1000倍、5,000倍、10,000倍、50,000倍或100,000倍。
在本文提供的、涉及将至少第一器皿和第二器皿从样品收集场所运输至样品接收场所的实施方式中,所述第一器皿和第二器皿各自包含从所述受试者获得的小体积体液样品的一部分,在实施方式中,在所述样品接收场所,第一器皿原始样品可以从所述第一器皿中移取而第二器皿原始样品可以从所述第二器皿中移取。第一器皿稀释样品可以从所述第一器皿原始样品生成。第二器皿稀释样品可以从所述第二器皿原始样品生成。所述第一器皿稀释样品和第二器皿稀释样品可具有相同的或不同的体积和稀释度。在实施方式中,多个不同的稀释样品可以从所述第一器皿原始样品或第二器皿原始样品中之一或全部两者生成。所述不同的稀释样品可用于一种或多种不同的实验室检测,所述实验室检测可为不同类型。在实施方式中,第一器皿稀释样品可相对于所述第一器皿原始样品稀释了至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍、100倍、200倍、300倍、400倍、500倍、1000倍、5,000倍、10,000倍、50,000倍或100,000倍,并且具有不超过1000微升、900微升、800微升、700微升、600微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升的总体积,而第二器皿稀释样品可相对于所述第二器皿原始样品稀释了至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍、100倍、200倍、300倍、400倍、500倍、1000倍、5,000倍、10,000倍、50,000倍或100,000倍,并且具有不超过1000微升、900微升、800微升、700微升、600微升、500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升的总体积。
在本文提供的、涉及在样品收集场所获得器皿的实施方式中,所述器皿包含从受试者获得的小体积体液样品,在实施方式中,所述器皿中的所述小体积体液样品的体积可以不大于500微升、400微升、300微升、250微升、200微升、150微升、100微升、90微升、80微升、70微升、60微升、50微升、40微升、30微升、25微升、20微升、15微升、10微升、9微升、8微升、7微升、6微升、5微升、4微升、3微升或2微升。
在本文提供的、涉及在样品收集场所获得器皿并将该器皿从所述样品收集场所运输至样品接收场所的实施方式中,所述器皿包含从受试者获得的小体积体液样品,在实施方式中,所述小体积体液样品可被分成任意数目的部分,诸如2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、30个、40个、50个、60个、70个、80个、90个、100个、200个、300个、400个、500个或1000个不同的部分。所述部分可被稀释成相同的或不同的量,并且可用于,例如1、2、3、4、5、6、7、8、9、10、15、20、25、30、40、50、60、70、80、90、100、200、300、400、500或1000种或更多种不同的实验室检测。
在本文提供的、涉及在样品收集场所获得包含来自受试者的小体积体液样品中的至少一部分的至少一个器皿的实施方式中,在实施方式中,所述获得步骤可包括从所述受试者(例如,来自手指针刺或静脉抽血)收集所述小体积体液样品。
在本文提供的、涉及在测定单元中执行实验室检测的至少一部分的实施方式中,在实施方式中,所述测定单元可以是可移动的,诸如通过流体处理装置移动。在包括两个或更多个测定单元的实施方式中,在实施方式中,所述测定单元可以是可独立移动的。
在本文提供的、涉及一个或多个包含体液样品的器皿的运输的实施方式中,在一些实施方式中,所述器皿可具有本文所描述的器皿或者适于储存体液的其他器皿的任何特性。在一些实施方式中,所述器皿可通过本文提供的任何装置或方法,或者通过用于装载具有小的内部容积的器皿的其他合适的技术来装载体液样品。例如,在某些实施方式中,要根据本文提供的系统或方法来运输的器皿可通过注射器或移液管尖端而装载样品。
可选地,本文的样品收集装置的至少一个实施方式可将单个血液样品分离至不同的器皿中,以用于不同的预分析处理。这可以通过所述装置中的流体通路以及/或者通过所述装置上的不同入口端口来实现。
提供本发明内容来以简化形式介绍挑选出的概念,所述概念在以下具体实施方式中进一步描述。本发明内容并不旨在确定请求保护的主题的关键特征或主要特征,也不旨在用于限制请求保护的主题的范围。
援引并入
本说明书中所提及的所有出版物、专利和专利申请均通过引用而并入于此,程度犹如具体地和个别地指出要通过引用而并入每一个别出版物、专利或专利申请。
附图说明
图1A-图1B示出了根据如本文所描述的一个实施方式的样品收集装置的透视图。
图2A-图2C示出了根据如本文所描述的一个实施方式的、没有帽的样品收集装置的透视图。
图3A-图3B示出了根据如本文所描述的一个实施方式的样品收集装置的侧视图和剖视图。
图4A-图4B示出了根据如本文所描述的一个实施方式的样品收集装置的侧视图和剖视图。
图5A-图5B示出了根据如本文所描述的另一实施方式的样品收集装置的透视图。
图6A-图6B示出了根据如本文所描述的一个实施方式的样品收集装置的侧视图。
图7A-图8B示出了根据如本文所描述的一个实施方式的样品收集装置的侧视图和剖视图。
图9A-图9C示出了根据如本文所描述的一个实施方式的、处于各个使用阶段的样品收集装置的侧剖视图。
图10A-图10B示出了根据如本文所描述的一个实施方式的样品收集装置的透视图。
图11A-图11Z示出了根据如本文所描述的实施方式的样品收集装置的各个示例的视图。
图12示出了与如本文所描述的一个实施方式相关联的、套筒的尖端部分和相关联的力的平衡的示意图。
图13A-图13D示出了根据如本文所描述的实施方式的、具有面向上的收集位置的各个收集装置的视图。
图14-图15示出了根据如本文所描述的一个实施方式的、具有单一收集位置的收集装置的各个视图。
图16-图17示出了根据如本文所描述的一个实施方式的、使用具有标识物的器皿的样品收集装置的透视图和端视图。
图18A-图18G示出了根据如本文所描述的实施方式的样品器皿的各个视图。
图19A-图19C示出了样品收集装置的前端的各个实施方式的视图。
图20-图21示出了具有集成式组织穿透构件的样品收集装置的各个实施方式。
图22示出了根据本文所描述的实施方式的、用于与血液器皿或其他组织穿透器以及样品收集器一起使用的收集装置的透视图。
图23-图28示出了根据本文所描述的实施方式的、用于与各种样品收集器一起使用的收集装置的各个视图。
图29A-图29C示出了如本文所描述的各个实施方式的示意图。
图30-图31示出了根据本文所描述的实施方式的方法的示意图。
图32示出了本文所描述的系统的一个实施方式的示意图。
图33至图37示出了本文所描述的收集装置的又一实施方式。
图38A-图39示出了根据本文所描述的至少一个实施方式的热控制运输容器运输装置的各个视图。
图40A-图40C示出了本文所描述的各个实施方式的示意图。
图41示出了根据本文所描述的至少一个实施方式的、在其中具有多个样品器皿的运输容器的一个部分的透视图。
图42是根据本文所描述的至少一个实施方式的、在其中具有多个样品器皿的运输容器的一个部分的分解透视图。
图43示出了根据本文所描述的又一实施方式的运输容器的透视图。
图44示出了根据本文所描述的一个实施方式的样品收集和运送过程的示意图。
图45示出了根据本文所描述的又一实施方式的样品收集和运送过程的示意图。
图46示出了根据本文所描述的一个实施方式的样品收集装置。
图47示出了根据本文所描述的一个实施方式的、用于从运输容器卸载样品器皿的一个系统的示意图。
图48是曲线图,其示出了本文所提供的器皿中的样品中的分析物的稳定性。
图49至图51示出了根据本文所描述的至少一个实施方式的检测的一个非限制性示例。
图52至图55示出了根据本文实施方式的装置和系统的各个视图。
图56至图59示出了根据本文至少一些实施方式的样品运输装置的各个视图。
具体实施方式
应当理解,前文的概括描述和以下的详细描述都仅仅是示例性的和解释性的,并且不对所要求保护的本发明构成限制。可以注意到,如本说明书和所附权利要求书中所使用,单数形式“一个”、“一种”和“该”等包括复数指代对象,除非上下文另有明确规定。因此,举例而言,提到“一种材料”可包括多种材料的混合物,提到“一种化合物”可包括多种化合物等。本文引用的参考文献通过特此引用而全文并入于此,除非它们达到与本说明书中明确阐述的教导相冲突的程度。
在本说明书中以及在随后的权利要求书中,将会提到若干术语,这些术语应被定义为具有以下含义:
“可选的”或“可选地”意指随后描述的事件可能发生或者可能不发生,从而该描述包括发生该事件的情况和不发生该事件的情况。例如,如果装置可选地包含针对样品收集孔的特征,这意味着该样品收集孔可能存在或者可能不存在,并且因此,该描述同时包括其中装置具备该样品收集孔的结构和其中不存在该样品收集孔的结构。
本文所使用的术语“基本上的”意指多于最小的或不显著的量;并且“基本上地”意指多于最小地或不显著地。因此,举例而言,本文所使用的短语“基本上不同的”表示两个数值之间足够高的差异程度,以至于本领域技术人员将会认为这两个值之间的差异在由所述值所测量的特性的背景内具有统计显著性。因此,作为基准值或比较值的函数,两个基本上不同于彼此的值之间的差异通常大于约10%,并且可大于约20%,优选大于约30%,优选大于约40%,优选大于约50%。
本文所使用的“样品”可以是但不限于血液样品或血液样品的一部分,可以是任何合适的尺寸或体积,并且优选地是小尺寸或体积。在本文公开的测定和方法的一些实施方式中,可以使用小体积血液样品或者不超过血液样品的小体积部分来进行测量,其中小体积包括不超过约5mL;或者包括不超过约3mL;或者包括不超过约2mL;或者包括不超过约1mL;或者包括不超过约500μL;或者包括不超过约250μL;或者包括不超过约100μL;或者包括不超过约75μL;或者包括不超过约50μL;或者包括不超过约35μL;或者包括不超过约25μL;或者包括不超过约20μL;或者包括不超过约15μL;或者包括不超过约10μL;或者包括不超过约8μL;或者包括不超过约6μL;或者包括不超过约5μL;或者包括不超过约4μL;或者包括不超过约3μL;或者包括不超过约2μL;或者包括不超过约1μL;或者包括不超过约0.8μL;或者包括不超过约0.5μL;或者包括不超过约0.3μL;或者包括不超过约0.2μL;或者包括不超过约0.1μL;或者包括不超过约0.05μL;或者包括不超过约0.01μL。
本文所使用的术语“服务点位置”可以包括受试者可在其中接受服务(例如,检测、监控、治疗、诊断、指导、样品收集、ID验证、医疗服务、非医疗服务等)的位置,并且可以包括但不限于受试者的住所、受试者的工作场所、医疗保健提供者(例如,医生)的位置、医院、急诊室、手术室、诊所、医疗保健专业人员的办公室、实验室、零售商[例如药房(例如,零售药房、临床药房、医院药房)、药店、超市、杂货店等]、交通工具(例如,轿车、舟船、卡车、公共汽车、飞机、摩托车、救护车、移动单元、消防车/救火车、应急车辆、执法车辆、警车或者被配置用于将受试者从一个点运送到另一点的其他载具等)、巡回医疗保健单元、移动单元、学校、日托中心、安检地点、作战地点、医疗辅助生活住所、政府机关、办公建筑、帐篷、体液样品采集地点(例如,血液收集中心)、受试者可能希望进入的地点的入口处或其附近的场所、受试者可能希望访问的装置处或其附近的场所(例如,计算机的位置——如果受试者希望访问计算机)、样品处理装置接收样品的位置,或者本文其他各处所描述的任何其他服务点位置。
本文所使用的“体液”可以是从受试者获得的或者可从受试者获得的任何流体。体液例如可以是源于受试者的或者从受试者获得的血液、尿、唾液、泪液、汗液、身体分泌物、身体排泄物或任何其他流体。具体而言,体液包括但不限于血液、血清、血浆、骨髓、唾液、尿、胃液、脊髓液、泪液、粪便、粘液、汗液、耳垢、油、腺分泌物、脑脊液、精液、阴道液、源于肿瘤组织的组织液、眼部液体、胎液、羊水、脐带血、淋巴液、腔液、痰液、脓、胎粪、母乳和/或其他分泌物或排泄物。
本文所使用的“体液样品收集器”或任何其他收集机构可以是一次性的。例如,体液收集器可以使用一次并抛弃。体液收集器可以具有一个或多个一次性组件。或者,体液收集器可以是可重复使用的。体液收集器可以重复使用任意次数。在一些情况下,体液收集器既包括可重复使用的组件又包括一次性组件。
本文所使用的“样品收集单元”和/或装置的任何其他部分可以能够接收单一类型的样品或多种类型的样品。例如,样品收集单元可以能够接收两种不同类型的体液(例如,血液、泪液)。在另一示例中,样品收集单元可以能够接收两种不同类型的生物样品(例如,尿液样品、粪便样品)。多种类型的样品可以是或者可以不是流体、固体和/或半固体。例如,样品收集单元可以能够接受体液、分泌物和/或组织样品中的一种或多种、两种或更多种或者三种或更多种。
本文所使用的“非芯吸、非基质形式”意指液体或悬浮液不被织物、筛眼、纤维垫、吸收材料、吸收结构、纤维的渗透网络等吸收或拉入其中,所述织物、筛眼、纤维垫、吸收材料、吸收结构、纤维的渗透网络改变液体或悬浮液的形式或将样品的组分捕陷于其中达到如此程度,使得液体形式的样品的完整性被改变以及无法在仍保持样品完整性的情况下以液体形式提取样品以供样品分析。
本文所使用的术语“样品处理系统”是指被配置用于帮助样品成像、检测、定位、重新定位、保留、摄取和存放的装置或系统。在一个示例中,具有移液能力的机器人是样品处理系统。在另一示例中,可以具有或者可以不具有(其他)机器人能力的移液器是样品处理系统。由样品处理系统处理的样品可以包括或者可以不包括流体。样品处理系统可以能够运送体液、分泌物或组织。样品处理系统可以能够运送装置内不必一定是样品的一种或多种物质。例如,样品处理系统可以能够运送可与一种或多种样品反应的粉末。在一些情况下,样品处理系统为流体处理系统。流体处理系统可以包括各种类型的泵和阀或者移液器,所述移液器可以包括但不限于容积式移液器、排气式移液器和吸取式移液器。样品处理系统可以借助于本文其他各处描述的机器人来运送样品或其他物质。
本文所使用的术语“医疗保健提供者”是指向受试者提供医学治疗和/或医学建议的医生或其他医疗保健专业人员。医疗保健专业人员可以包括与医疗保健系统相关联的人员或实体。医疗保健专业人员的示例可以包括医生(包括全科医生和专科医生)、外科医生、牙科医生、听力学家、言语病理医生、医师助理、护士、助产士、药师/药剂师、营养师、治疗师、心理医生、按摩师、临床医官、理疗师、抽血师、职业治疗师、验光师、急诊医疗技师、辅助医务人员、医学实验室技师、医疗假体技师、放射科技师、社工,以及受训提供一些类型的医疗保健服务的众多其他人力资源。医疗保健专业人员可能有资质或者可能无资质开处方。医疗保健专业人员可能工作于或隶属于医院、医疗保健地点和其他服务提供点,或者还可以工作于学术培训、研究和管理机构。一些医疗保健专业人员可以在私人或公共处所、社区中心或者聚集场所或移动单元中为患者提供护理和治疗服务。社区保健工作者可以在正式医疗保健机构以外的地方工作。医疗保健服务管理者、医疗记录与健康信息技术人员以及其他支持人员也可以是医疗保健专业人员或隶属于医疗保健提供者。医疗保健专业人员可以是为个人、家庭或社区提供预防性、治疗性、宣传性或康复性医疗保健服务的个人或机构。
在一些实施方式中,医疗保健专业人员可能已经熟悉受试者或者已与受试者进行过沟通。受试者可能是医疗保健专业人员的患者。在一些情况下,医疗保健专业人员可能已经要求受试者遵医嘱进行临床检测。医疗保健专业人员可能已经指示或建议受试者经受在服务店位置处或由实验室进行的临床检测。在一个示例中,医疗保健专业人员可以是受试者的初级保健医生。医疗保健专业人员可以是受试者的任何类型的医师(包括全科医生,转诊执业医师(referred practitioners),或者可选地通过远程医疗服务选择和联系的患者自己的医师,以及/或者专科医师)。医疗保健专业人员可以是医疗护理专业人员。
本文所使用的术语“机架”是指用于安装多个模块的框架或外壳。机架被配置用于允许将模块紧固到该机架或与该机架相接合。在一些情况下,机架的各尺寸是标准化的。在一个示例中,模块之间的间距标准化为至少约0.5英寸、或1英寸、或2英寸、或3英寸、或4英寸、或5英寸、或6英寸、或7英寸、或8英寸、或9英寸、或10英寸、或11英寸、或12英寸的倍数。
在生物样品背景下所使用的术语“细胞”包含尺寸大体上与单个细胞相似的样品,包括但不限于囊泡(诸如脂质体)、细胞、病毒体以及与诸如小珠、纳米颗粒或微球等小颗粒相结合的物质。特性包括但不限于大小;形状;诸如细胞移动或增殖等时间变化和动态变化;粒度;细胞膜是否完整;内部细胞内含物,包括但不限于蛋白质内含物、蛋白质修饰、核酸内含物、核酸修饰、细胞器内含物、核结构、核内含物、内部细胞结构、内部囊泡的内含物、离子浓度、以及诸如类固醇或药物之类的其他小分子的存在;以及细胞表面(细胞膜和细胞壁)标记物,包括蛋白质、脂质、碳水化合物及其修饰。
本文所使用的“样品”是指整个原始样品或其任何部分,除非上下文另有明确说明。
本发明提供了用于样品或健康参数的多用途分析的系统和方法。可以收集样品,并且可以在装置上进行一个或多个样品制备步骤、测定步骤和/或检测步骤。本文描述的本发明的各个方面可适用于以下阐述的任何特定应用、系统和装置。本发明可作为独立系统或方法来应用,或者作为集成系统的一部分来应用,诸如应用于涉及服务点医疗保健的系统之中。在一些实施方式中,系统可以包括外部定向的成像技术(诸如超声波或MRI),或者与用于集成式成像以及其他健康检测或服务的外围设备相集成。应当理解,本发明的不同方面可以单个地、共同地或者相互结合地理解和实践。
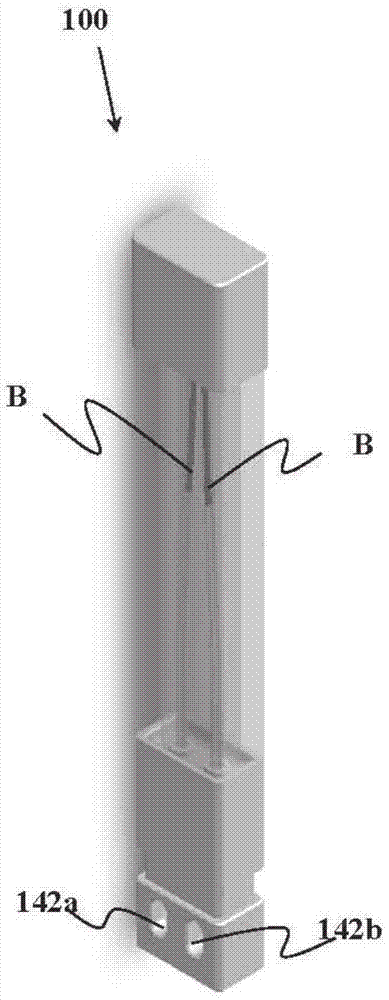
参考图1A-图1B,现将描述样品收集装置100的一个实施方式。在该非限制性示例中,样品收集装置100可包括收集装置主体120、支架130和基座140。在一些情况下,可选地可以提供帽110。在一个实施方式中,所述帽可以用于保护开口,保持其清洁,以及用于在收集之后遮盖带血的尖端。可选地或备选地,所述帽还可用于在样品流体向样品器皿中的转移期间,通过控制提供至毛细管的排放量来限制流速。一些实施方式可包括帽中的排放孔通路(永久敞开或者可以可操作地关闭),而其他实施方式则不包括该排放孔通路。可选地,收集装置主体120可以包括在其中具有一个或多个收集通路(诸如但不限于收集通道122a、122b)的装置100的第一部分,该第一部分可以能够接收样品B。图1A示出了样品B仅部分地填充了通道122a、122b,应当理解的是,尽管在一些备选实施方式中不排除部分填充,但在大多数实施方式中,当填充过程完成时,所述通道将会由样品B完全填充。在本实施方式中,基座140可具有一个或多个填充指示器142a、142b,诸如但不限于光学指示器,所述指示器可以提供对样品是否已经到达收容于基座中的一个或多个器皿的指示。应当理解,尽管该指示可以是通过视觉指示的方式,但亦可使用其他指示方法诸如音频、振动或其他指示方法,来替代所述指示方法或与之组合。所述指示器可以位于所述器皿中的至少一个上。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
虽然为了易于说明而没有示出,但支架130也可包括一个或多个这样的填充指示器:该填充指示器示出在通道122a和122b中是否已经达到期望的填充水平。这可以替代或附加于填充指示器142a、142b。当然,所述一个或多个通路填充指示器可以定位在不同的部件上,并且不限于在支架130上。应当理解,尽管通道122a和122b中的一个或多个通道中的这样的填充水平指示可以是通过视觉指示的方式,但亦可使用其他指示方法诸如音频、振动或其他指示方法,来替代所述指示方法或与之组合。所述指示器可以位于所述收集通路中的至少一个上。可选地,指示器位于所有的收集通路上。
在本实施方式中,支架130可用于联结主体120和基座140以形成集成式装置。应当理解,尽管装置主体120、支架130和基座140被阐述为分离的部件,但这些部件中的一个或多个可以一体形成以便简化制造,并且本文不排除这样的集成。
在本文的一些实施方式中,可选地可以提供帽110。在一个非限制性示例中,所述帽可以配合在收集装置主体120的一部分上。帽110可以是可从收集装置主体120拆卸的。在一些情况下,帽110可以是可从收集装置主体120完全分离的,或者可以保留一部分连接至收集装置主体,诸如但不限于铰接或以其他方式连结至收集装置。帽110可以覆盖在其中包含一个或多个通道的暴露端的收集装置主体120的一部分。当帽就位时,帽110可以防止诸如空气、流体或微粒等材料进入装置主体内的通道。可选地,帽110可以使用本领域中任何已知或今后研发的技术而附接至收集主体120。例如,所述帽可以卡扣配合、旋接于、摩擦配合、夹合于、具有磁性部分、系至、利用弹性部分以及/或者可以可移除地连接至收集装置主体。帽可与收集装置主体形成不漏流体的密封。帽可由不透明、透明或半透明材料形成。
在一个实施方式中,样品收集装置的收集装置主体120可包含诸如但不限于通道122a、122b等一个或多个收集通路的至少一部分于其中。应当理解,不排除不是通道的收集通路。收集装置主体可以连接至可包含一个或多个通道的一部分于其中的支架130。收集装置主体可永久固定至支架,或者可以是相对于该支架可移除的。在一些情况下,收集装置主体和支架可由单一整体件形成。或者,收集装置主体和支架可由分离件形成。在装置的操作期间,收集装置和支架不相对于彼此移动。
可选地,收集装置主体120可全部或部分地由光透射材料形成。例如,收集装置主体可由透明或半透明材料形成。可选地,只有主体的选定部分为透明或半透明的,以使一个或多个流体收集通道可视化。可选地,主体包括不透明材料,但可在主体中形成开口和/或窗口来示出其中的填充水平。收集装置主体可以使得用户能够观察该装置主体内和/或穿过该装置主体的通道122a、122b。所述通道可由透明或半透明材料形成,其可允许用户查看样品B是否已经穿过该通道。所述通道可具有基本上相同的长度。在一些情况下,支架130可由不透明材料、透明材料或半透明材料形成。支架可以具有或者可以不具有与收集装置主体相同的光学特性。支架可以由与收集装置主体不同的材料形成,或者由与收集装置主体相同的材料形成。
收集装置主体120可具有任何形状或大小。在一些示例中,收集装置主体可具有圆形、椭圆形、三角形、四边形(例如,正方形、矩形、梯形)、五边形、六边形、八边形或任何其他横截面形状。沿着收集装置主体的长度,所述横截面形状可以保持相同或者可以变化。在一些情况下,收集装置主体可具有小于或等于约10cm2、7cm2、5cm2、4cm2、3cm2、2.5cm2、2cm2、1.5cm2、1cm2、0.8cm2、0.5cm2、0.3cm2或0.1cm2的横截面积。沿着收集装置主体120的长度,横截面积可以变化或者可以保持相同。收集装置主体可具有小于或等于约20cm、15cm、12cm、10cm、9cm、8cm、7cm、6cm、5cm、4cm、3cm、2cm、1cm、0.5cm或0.1cm的长度。收集装置主体120可具有比帽、支架或基座更大或更小的长度,或者与帽、支架或基座相等的长度。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
在一个实施方式中,诸如但不限于通道122a、122b等收集通路也可具有选定的横截面形状。通道的一些实施方式沿着该通道的全长可具有相同的横截面形状。可选地,沿着所述长度,横截面形状可以保持相同或者可以变化。例如,一些实施方式可在沿着通道的长度的一个位置处具有一种形状,而在一个或多个不同位置处具有不同的形状。一些实施方式可具有拥有一个横截面形状的一个通道以及不同横截面形状的至少一个其他通道。举非限制性示例而言,一些实施方式可以具有圆形、椭圆形、三角形、四边形(例如,正方形、矩形、梯形)、五边形、六边形、八边形或任何其他横截面形状。对于主体、支架和基座,横截面形状可以相同或者可以变化。一些实施方式可以选择形状以使得对于特定的通道宽度和/或高度,可容纳于通道中的液体体积最大化。一些实施方式可使通道122a、122b中之一具有一种横截面形状,而使另一通道具有不同的横截面形状。在一个实施方式中,通道的横截面形状可帮助使其中的容积最大化,但是可选地,其还可以优化对血液的毛细拉力。这将会允许最大化的填充速率。应当理解,在一些实施方式中,通道的横截面形状可直接影响毛细力。举非限制性示例而言,可以将一定体积的样品包含在浅而宽的通道或圆形通道中,两者都含有相同的容积,但对于填充速度、滞留空气的较低可能性或者与通道性能相关的因素而言,一种通道可能比另一种通道更理想。
虽然通道可具有任何形状或大小,但一些实施方式被配置成使得通道在与样品流体相接触时表现出毛细作用。在一些情况下,通道可具有小于或等于约10mm2、7mm2、5mm2、4mm2、3mm2、2.5mm2、2mm2、1.5mm2、1mm2、0.8mm2、0.5mm2、0.3mm2或0.1mm2的横截面积。沿着长度,横截面大小可以保持相同或者可以变化。一些实施方式可以为了沿着某一长度的较大的力以及继而在另一长度上的较小的力而定制。沿着长度,横截面形状可以保持相同或者可以变化。一些通道在配置上是笔直的。一些实施方式可单独地或者与笔直的部分相组合地具有弯曲的或其他形状的路径形状。一些实施方式在装置主体120内可具有不同的定向。例如,当装置保持基本上水平时,一个或多个通道在其从装置上的初始收集点带走流体时,可以向下倾斜、向上倾斜或者不倾斜。
通道122a、122b可由装置主体120和/或支架130来支撑。在一些情况下,通道的全长可被包含在装置主体和支架的组合之内。在一些情况下,通道的一部分可位于装置主体之内,并且通道的一部分可位于支架之内。通道的位置可由装置主体和/或支架所固定。在一些实施方式中,通道可被限定为空心针内的内腔。在一些实施方式中,只在三侧上限定通道,至少一侧是敞开的。可选地,与主体分离的覆盖层可以限定否则将会是敞开的一侧。一些实施方式可以用不同材料限定通道的不同侧。这些材料可以全部由主体所提供,或者它们可以由收集装置的不同零件所提供。一些实施方式可具有全都位于同一平面中的通道。可选地,一些实施方式可具有将通道的至少一部分带至不同平面和/或定向的形状。可选地,一些通道可完全处于不同平面和/或定向中。
在一些情况下,可以提供多个通道。在一些实施方式中,一个通道分成两个或更多个通道。可选地,一些通道分成甚至更大数目的通道。一些通道可包括控制机构,诸如但不限于用于引导一个或多个通道中的流动的阀。通道的至少一部分可基本上彼此平行。或者,通道的任何部分都不需要彼此平行。在一些情况下,通道的至少一部分不彼此平行。可选地,通道可稍微弯曲。可选地,通道可以在一个位置处具有一个横截面积,而在沿着该通道的不同位置处具有更小的横截面积。可选地,通道可以在一个位置处具有一个横截面积,而在沿着该通道的不同位置处具有更大的横截面积。对于Y形设计的一些实施方式,可能期望通道将会具有适当放置以针对每个小瓶而限定样品的排放孔,从而不会存在从其他通道拉出的样品或交叉污染。举非限制性示例而言,图11I中示出了具有排放孔的一个实施方式。
基座140可以提供于样品收集装置内。该基座可连接至支架130。在一些情况下,基座的一部分可以是可插入于支架内的,并且/或者支架的一部分可以是可插入于基座内的。基座可以能够相对于支架移动。在一些情况下,样品收集装置可具有沿着该样品收集装置的长度延伸的纵轴。基座和/或支架可相对于彼此在所述纵轴的方向上移动。基座和/或支架可以能够相对于彼此移动有限距离。或者,基座可相对于支架固定。基座可以提供在与包括帽110的样品收集装置的一端相对的、样品收集装置的一端处。可选地,一些实施方式可以包括集成式基座/器皿部件,从而不再存在组装至基座零件中的分离的器皿。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
基座140可在其中收容一个或多个器皿。所述器皿可与通道流体连通,并且/或者可被带至与通道流体连通。通道的一端可位于器皿内,或者可被带至器皿内。基座可具有一个或多个光学指示器142a、142b,所述光学指示器可以提供对样品是否已经到达被收容于基座中的一个或多个器皿的视觉指示。在一些实施方式中,光学指示器可以是可使得用户能够查看到基座内的光学窗口。该光学窗口可由透明和/或半透明材料形成。或者,光学窗口可以是在其中没有任何材料的开口。光学窗口可以使得用户能够直接观察基座内的器皿。基座内的器皿可由透明和/或半透明材料形成,其可以使得用户能够查看样品是否已经到达基座的器皿。例如,如果沿着通道将血液运送至器皿,则器皿可以视觉地指示血液在其中的存在。在其他实施方式中,光学指示器可以包括可指示器皿已被填充的其他特征。例如,可以在基座或器皿内提供一个或多个传感器,所述传感器可以确定是否已经在器皿内提供了足够量的样品。所述一个或多个传感器可向基座上的光学指示器提供信号,该信号可指示是否已经向器皿提供样品以及/或者已经向器皿提供的样品量。例如,光学传感器可包括显示器,诸如但不限于LCD显示器、光显示器(例如,LED显示器)、等离子屏显示器,其可以提供对器皿已经被充分填充的指示。在备选实施方式中,无需提供光学指示器,但可以提供替代的指示器,诸如但不限于可以用于指示器皿已于何时得到填充的音频指示器或温控指示器。
图2A-图2C提供了没有帽110的样品收集装置200的视图。样品收集装置200可包括主体220、支架230和基座240。主体可连接至支架。在本实施方式中,基座240可在与连接至主体的一端相对的一端处连接至支架。主体可支撑和/或包含一个、两个或更多个通道222a、222b的至少一部分。通道可以能够从装置的样品接收端226接收样品224a、224b。
主体220可在其中具有空心部分225。或者,主体可由实心件形成。通道222a、222b可一体形成至主体中。例如,它们可以是穿过主体的实心部分的通路。所述通路可被钻通或者使用光刻技术而形成。或者,通道可以是可由主体支撑的分离的结构。例如,通道可以由可被主体支撑的一个或多个管所形成。在一些情况下,通道可在主体的某些实心部分处保持就位,并且可穿过主体的一个或多个空心部分。可选地,主体220可由联结在一起的两个零件形成,以限定其中的通道222a和222b。
通道222a、222b可包括本文其他各处提到的一个或多个特征或特性。通道的至少一部分可基本上彼此平行。或者,通道可相对于彼此成角度。在一些实施方式中,通道可具有第一端,该第一端可位于样品收集装置的样品接收端226处。通道的第一端可以是能够接收样品的开放端。在一些实施方式中,可以在样品接收装置的样品接收端处提供每个通道的端。一个、两个或更多个通道可具有位于样品收集装置的样品接收端处的第一端。可以使用分离的通道以使一个通道与另一通道之间的血液交叉污染的风险最小化。可选地,通道可具有倒Y形配置,其中通道起始于公共通道并且分成两个或更多个分离的通道。在污染不成问题的情况下,这样的Y形配置可以是有用的。可选地,Y形配置的备选方法将会是直通道,并且使样品收集器皿移动以便按顺序接合来自直通道的同一针。
在一些情况下,可以提供多个通道。在样品接收端处的通道的端可彼此紧密靠近。在样品接收端处的通道的端可彼此相邻。在样品接收端处的通道的端可彼此接触,或者可以处于彼此边缘到边缘或者中心到中心约0.5mm、1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、12mm、15mm或20mm内。通道可从样品接收端彼此发散。例如,与样品接收端处通道的端相对的通道另一端可进一步彼此远离。它们可以彼此边缘到边缘或者中心到中心相隔大于或等于约3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、12mm、15mm、20mm、25mm或30mm。
在一些实施方式中,主体220可具有细长形状。主体在样品接收端226处或其附近可具有一个或多个锥形部分228。主体的各侧可聚集于样品接收端。锥形部分和/或样品接收端可以是弯曲的。或者,可以提供边缘。可以相对于装置的纵轴成任何角度地提供锥形部分的表面。例如,锥形部分可相对于纵轴成约5度、10度、15度、30度、45度、60度或75度。
装置的样品接收端226可接触样品。样品可直接提供自受试者。样品接收端可接触受试者或者正在接触受试者或正在从受试者身上渗出的样品。例如,样品接收端可接触受试者手指上的一滴血液。所述血液可以进入通道。可以经由毛细作用、压差、重力或任何其他动力而通过通道运送所述血液。所述血液可从样品接收端穿过通道抵达样品递送端。样品递送端可与收容在装置的基座内的一个或多个器皿流体连通或者可被带至与所述器皿流体连通。样品可从通道传递至器皿。可以经由压差、毛细作用、重力、摩擦力和/或任何其他动力而驱动样品进入器皿中。可选地,样品还可以是用移液器、注射器等引入的血液。应当理解,虽然图2B示出了样品B仅仅部分地填充通道222a、222b,但在大多数实施方式中,当填充过程完成时通道将会由样品B完全填充。
图3A-图3B示出了在将通道322a、322b带至与收容在装置的基座340内的一个或多个器皿346a、346b流体连通之前的样品收集装置300的示例。样品收集装置可包括帽310、主体320、支架330和基座340。主体和/或支架可支撑和/或包含一个、两个或更多个通道的至少一部分。基座可支撑和/或包含一个、两个或更多个器皿。
在一个实施方式中,主体320和/或支架330可支撑样品收集装置中的一个或多个通道322a、322b。在一个示例中,提供两个通道,但是关于两通道实施方式的描述亦可适用于任何数目的通道,包括但不限于1个、3个、4个、5个、6个或更多个通道。每个通道可具有第一端323a、323b,所述第一端可提供于装置的样品接收端326处。各个通道的第一端可以是敞开的。通道可向周围空气敞开。当通道的第一端接触诸如血液等流体时,可将该流体吸入至通道中。可以经由毛细作用或本文其他各处所描述的任何其他技术而吸取血液。所述血液可沿着通道的长度行进至通道的相应第二端325a、325b。通道可彼此流体隔离。例如,流体可经由第一端323a进入第一通道322a,穿过通道的长度,并在第二端325a处离开该第一通道。类似地,流体可经由第一端323b进入第二通道322b,穿过通道的长度,并在第二端325b处离开该第二通道。该第一通道和第二通道可流体隔离,以使得来自第一通道的流体不传递到第二通道中,并且反之亦然。在一些实施方式中,流体可传递至通道的第二端而不首先离开。
通道322a、322b可具有发散配置。例如,比起通道的第二端325a、325b,通道的第一端323a、323b可以彼此更近。比起通道的第一端之间,可在通道的第二端之间提供更多空间。通道的第一端可以彼此接触或者可以彼此不接触。通道的第一端可以彼此相邻。
基座340可连接至样品收集装置的支架330。基座340可以直接接触或者可以不直接接触支架。在装置的使用期间,基座可以是可相对于支架移动的。在一些实施方式中,基座可相对于支架在纵向上滑动。在一些情况下,基座可相对于支架在纵向上滑动而不旋转。在一些情况下,基座可与支架同轴地滑动而不旋转。在一些情况下,基座可以在相对于支架移动的同时旋转。基座的一部分可配合于支架的一部分内,或者反之亦然。例如,基座的一部分可以是可插入至支架的一部分中的,并且/或者支架的一部分可以是可插入至基座中的。可以在基座和/或框架中提供一个或多个限位特征,以提供基座与支架之间受控的移动程度。限位特征可包括搁板、凸起或凹槽。
基座340可以能够支撑一个或多个器皿346a、346b。基座可以具有可至少部分地包围一个或多个器皿的外壳。在一些情况下,当基座与支架330相接合时,器皿可被完全包围。基座可具有一个或多个凹陷、凸起、凹槽或塑形特征以接受器皿。基座可形成为具有与器皿的形状互补的形状。可以将器皿保持在相对于基座的直立位置上。
可以提供与通道的数目相同的数目的器皿。例如,如果提供了N个通道,则可以提供N个器皿,其中N是正整数(例如,1、2、3、4、5、6、7、8或更多)。每个通道可对应于相应的器皿。在一个示例中,样品收集装置可具有第一通道和第二通道,以及相应的第一器皿和第二器皿。第一通道322a可与第一器皿346a流体连通或者可被配置用于被带至与第一器皿346a流体连通,并且第二通道322b可与第二器皿346b流体连通或者可被配置用于被带至与第二器皿346b流体连通。
在一些实施方式中,每个器皿可具有主体349a、349b和帽348a、348b。在一些情况下,器皿主体可由透明或半透明材料形成。器皿主体可允许被提供于器皿主体内的样品在从器皿之外观察时是可见的。器皿主体可具有管状的形状。在一些情况下,器皿主体可具有圆柱形部分。器皿的底部可以是平坦的、锥形的、圆润的或其任意组合。器皿可包括开放端和封闭端。开放端可以是器皿的顶端,其可位于器皿的更靠近一个或多个通道的一端。封闭端可以是器皿的底端,其可位于器皿的更远离一个或多个通道的一端。可以在本文其他各处更详细地描述器皿的各个实施方式。
基座340可具有一个或多个光学指示器,诸如光学窗口342a、342b。光学窗口可定位于器皿346a、346b之上。在一些情况下,光学窗口可定位于器皿主体之上。单一窗口可以提供对单一器皿或对多个器皿的观察。在一个示例中,可提供与器皿相同数目的光学窗口。每个光学窗口可对应于相应的器皿。光学窗口和器皿都可由光透射材料形成,该材料可允许用户从样品收集装置的外部观察样品是否已经到达器皿。
在一些实施方式中,可以存在通道322a和322b的光学窗口,以使得用户可以观察何时已在通道中达到期望的填充水平。在主体320完全地透明或半透明的一些实施方式中,沿着通道可存在标记物或指示器标记以标注何时达到期望的填充水平。
器皿的大小可被设置用于容纳小流体样品。在一些实施方式中,器皿可被配置用于容纳不超过约5ml、4ml、3ml、2ml、1.5mL、1mL、900uL、800uL、700uL、600uL、500uL、400uL、300uL、250uL、200uL、150uL、100uL、80uL、50uL、30uL、25uL、20uL、10uL、7uL、5uL、3uL、2uL、1uL、750nL、500nL、250nL、200nL、150nL、100nL、50nL、10nL、5nL或1nL。器皿可被配置用于容纳不超过若干滴血液、一滴血液或不超过一滴血液的一部分。
器皿可包含帽348a、348b。插塞可被配置用于配合于器皿的开放端之上。帽可阻塞器皿的开放端。帽可流体密封器皿。帽可与器皿主体形成不漏流体的密封。例如,帽可以是不透气体的和/或不透液体的。或者,帽可允许某些气体和/或液体穿过。在一些情况下,帽可以是透气而不透液体的。帽对于样品可以是不可渗透的。例如,帽对于全血、血清或血浆可以是不可渗透的。在一些情况下,帽的一部分可配合至器皿主体的一部分中。帽可与器皿主体形成塞子。帽可以包括可笼罩于器皿主体的一部分之上的凸缘或搁板。凸缘或搁板可防止帽滑入器皿主体中。在一些情况下,帽的一部分可覆在器皿主体的顶部和/或侧面之上。本文对器皿的任何描述均可适用于与样品收集装置相组合。可选地,一些实施方式可包括器皿组装件中的附加部件,诸如帽保持器。在一个实施方式中,帽保持器的用途是维持帽与器皿之间的紧密密封。在一个实施方式中,帽保持器接合附接件、凸缘、凹陷或位于器皿外部上的其他附接位置,以将帽保持在适当位置。可选地,一些实施方式可同时将帽和帽保持器的功能组合到一个组件中。
可以提供一个或多个接合组装件。该接合组装件可包括通道保持器350和/或施力组件,诸如弹簧352或橡皮带。在一个实施方式中,保持器350可使适配器通道354保持固定至支架。如本文其他各处将会描述,适配器通道354可与收集通道一体形成,或者可以是分立元件,其可以是独立件、收集通道的一部分或者器皿的一部分。在一个实施方式中,保持器350可防止适配器通道354相对于支架滑动。保持器350可以可选地提供可让诸如弹簧等施力组件居于其上的支架。
在一个示例中,接合组装件可各自包括弹簧352,该弹簧352可以施加力以使得当弹簧处于其自然状态时,基座340处于伸展状态。当基座处于其伸展状态时,可在器皿346a、346b与接合组装件之间提供空间。在一些情况下,当基座340处于其伸展状态时,通道的第二端可以接触或者可以不接触器皿的帽。通道325a、325b的第二端可处于它们与器皿的内部不流体连通的位置上。
样品收集装置可具有任何数目的接合组装件。例如,可以提供与通道的数目相同的数目的接合组装件。每个通道可具有一个接合组装件。例如,如果提供第一通道和第二通道,则可为该第一通道提供第一接合组装件,并且可为该第二通道提供第二接合组装件。可以提供相同数目的接合组装件和器皿。
在一个实施方式中,接合组装件可收容适配器通道354,诸如但不限于具有成角度的、锥形的或尖锐的端327a和327b的细长构件。应当理解,在一些实施方式中,所述端327a和327b是与通道322a和322b分开形成并继而耦合至通道322a和322b的针的一部分。所述针可由与来自限定通道322a和322b的主体相同或不同的材料形成。例如,一些实施方式可以使用金属来形成针,而对于限定通道322a和322b的主体则使用聚合物或塑料材料。可选地,一些实施方式可在与通道322a和322b一体形成的构件上形成端327a和327b。在一些情况下,通道的第二端可被配置用于穿透材料,诸如器皿的帽348a、348b。在一些实施方式中,适配器通道354的一部分可以是可插入于收集通道内的,或者收集通道的一部分可以是可插入于适配器通道内的,或者这两者可被配置成平齐对准。可选地,一些实施方式可使适配器通道354与收集通道322a一体地形成。应当理解,图3B(和图4B)示出了样品B仅仅部分地填充通道122a、122b,但在大多数实施方式中,当填充过程完成时通道将会由样品B完全填充。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
图4A-图4B示出了具有通道422a、422b的样品收集装置400的示例,所述通道422a、422b与装置内的器皿446a、446b的内部流体连通。样品收集装置可包括帽410、主体420、支架430和基座440。主体和/或支架可以支撑和/或包含一个、两个或更多个通道的至少一部分。基座可以支撑和/或包含一个、两个或更多个器皿。
在一个实施方式中,主体420和/或支架430可以支撑样品收集装置中的一个或多个通道422a、422b。例如,可以提供第一通道和第二通道。每个通道可具有第一端423a、423b,该第一端423a、423b可提供于装置的样品接收端426处。各个通道的第一端可以是敞开的。通道可向周围空气敞开。当通道的第一端接触诸如血液等流体时,可以将该流体吸入至通道中。可以经由毛细作用或本文其他各处所描述的任何其他技术而吸入流体。所述流体可沿着通道的长度行进至通道的相应第二端425a、425b。在一些实施方式中,流体可经由毛细作用或本文所描述的其他技术而到达通道的第二端。在其他实施方式中,流体无需到达通道的第二端。通道可彼此流体隔离。
在一些实施方式中,当通道不与器皿446a、446b的内部流体连通时,流体可传递至通道的第二端而不离开。例如,流体可经由毛细作用而被吸入至通道中,这可致使流体流向或流近通道的末端而不致使流体离开通道。
基座440可连接至样品收集装置的支架430。在装置的使用期间,基座可以是相对于支架可移动的。在一些实施方式中,基座可相对于支架在纵向上滑动。在一个示例中,基座可具有(i)伸展位置,在其中通道不与器皿的内部流体连通,以及(ii)压缩位置,在其中通道与器皿的内部流体连通。可以初始提供处于伸展状态下的样品收集装置,如图3中所示。在样品已经被收集并且流过通道的长度之后,用户可以推入基座以提供处于其压缩状态下的样品收集装置,如图4中所示。一旦基座已被推入,则基座可自然保持被推入,或者一旦移除推力,则可回弹至伸展状态。在一些情况下,基座可被拔出至伸展状态,或者可被完全拔出以提供对其中的器皿的进入。
基座440可以能够支撑一个或多个器皿446a、446b。基座可以具有可至少部分地包围所述一个或多个器皿的外壳。在一些情况下,当基座与支架430相接合时,器皿可被完全包围。基座可具有一个或多个凹陷、凸起、凹槽或塑形特征以接受器皿。基座可形成为具有与器皿的形状互补的形状。可以将器皿保持在相对于基座的直立位置上。
可以提供与通道的数目相同的数目的器皿。每个通道可对应于相应的器皿。在一个示例中,样品收集装置可具有第一通道和第二通道,以及相应的第一器皿和第二器皿。第一通道422a可与第一器皿446a流体连通或者可被配置用于被带至与该第一器皿流体连通,并且第二通道422b可与第二器皿446b流体连通或者可被配置用于被带至与该第二器皿流体连通。第一通道初始可不与第一器皿流体连通,并且第二通道初始可不与第二器皿流体连通。当相对于支架推入基座时,第一通道和第二通道可被带至分别与第一器皿和第二器皿的内部流体连通。第一通道和第二通道可同时被带至与第一器皿和第二器皿流体连通。或者,它们无需被同时带至流体连通。流体连通的时序可取决于器皿的高度和/或通道的长度。流体连通的时序可取决于通道的第二端与器皿之间的相对距离。
在一些实施方式中,每个器皿可具有主体449a、449b和帽448a、448b。器皿主体可具有管状的形状。在一些情况下,器皿主体可具有圆柱形部分。器皿的底部可以是平坦的、锥形的、圆润的或其任意组合。器皿可包括开放端和封闭端。开放端可以是器皿的顶端,其可位于器皿的更靠近一个或多个通道的一端。封闭端可以是器皿的底端,其可位于器皿的更远离一个或多个通道的一端。
基座440可具有一个或多个光学指示器,诸如光学窗口442a、442b。光学窗口可定位于器皿446a、446b之上。在一些情况下,光学窗口可定位于器皿主体之上。光学窗口和器皿都可由光透射材料形成,该材料可允许用户从样品收集装置的外部观察样品是否已经到达器皿。在一些实施方式中,器皿可以包含位于器皿本身上的标记物以指示填充水平要求。
器皿可包含帽448a、448b。帽可被配置用于配合于器皿的开放端之上。帽可阻塞器皿的开放端。帽可流体密封器皿。帽可与器皿主体形成不漏流体的密封。例如,帽对于全血、血清或血浆可以是不可渗透的。在一些情况下,帽的一部分可配合至器皿主体的一部分中。帽可以包括可笼罩于器皿主体的一部分之上的凸缘或搁板。在一些实施方式中,帽可具有空心或凹坑。空心或凹坑可帮助将通道的第二端引导至帽的中心。在一些情况下,当样品收集装置处于伸展状态时,通道425a、425b的第二端可位于器皿的帽上方。通道的第二端可以接触或者可以不接触器皿帽。在一些情况下,通道的第二端可放置在帽的空心或凹坑内。在一些情况下,通道的第二端可部分地穿透帽而不达到器皿的内部。可选地,帽的一些实施方式可包括卷夹件以保持真空。
通道的第二端可具有成角度的、锥形的或尖锐的端427a和427b。应当理解,在一些实施方式中,所述端427a和427b是与通道422a和422b分开形成并继而耦合至通道422a和422b的针的一部分。所述针可由与来自限定通道422a和422b的主体相同或不同的材料形成。例如,一些实施方式可以使用金属来形成针,而对于限定通道422a和422b的主体则使用聚合物或塑料材料。可选地,一些实施方式可在与通道422a和422b一体形成的构件上形成端427a和427b。在一些情况下,通道的第二端可被配置用于穿透材料,诸如器皿的帽448a、448b。帽可以由在没有穿透构件时可防止样品穿过的材料所形成。帽可由单一实心件形成。或者,帽可以包括狭缝、开口、孔洞、薄部分或者可接受穿透构件的任何其他特征。当穿透构件不在狭缝或开口中时,或者当穿透构件被从狭缝或开口移除时,狭缝或其他开口可以能够将样品保留于其中。在一些情况下,帽可由自恢复材料形成,以便当移除穿透构件时,由穿透构件形成的开口关闭。通道的第二端可以是可穿过帽并进入器皿内部之中的穿透构件。在一些实施方式中,应当清楚的是,穿透构件可以是允许样品穿过的空心针,而不只是用于穿刺的针。在一些实施方式中,穿刺尖端可以是不取芯设计,诸如但不限于穿刺而不对帽材料取芯的锥形套管。
可以提供一个或多个接合组装件。所述接合组装件可包括通道保持器450和/或施力组件,诸如弹簧452或橡皮带。在一个实施方式中,保持器450可使适配器通道454保持固定至支架。如本文其他各处将会描述,适配器通道454可与收集通道一体形成,或者可以是分立元件,其可以是独立件、收集通道的一部分或者器皿的一部分。在一个实施方式中,保持器450可防止适配器通道454相对于支架滑动。保持器450可以可选地提供可让诸如弹簧等施力组件居于其上的支架。
在一个示例中,接合组装件可包括弹簧452,该弹簧可以施加力以使得当弹簧处于其自然状态时,基座处于其伸展状态。当基座处于其伸展状态时,可在器皿446a、446b与接合组装件之间提供空间。通道425a、425b的第二端可处于它们与器皿的内部不流体连通的位置上。
样品收集装置可具有任何数目的接合组装件。例如,可以提供与通道的数目相同的数目的接合组装件。每个通道可具有一个接合组装件。例如,如果提供第一通道和第二通道,则可以为该第一通道提供第一接合组装件,并且可以为该第二通道提供第二接合组装件。在一个实施方式中,可以提供相同数目的接合组装件和器皿。
当压入基座时,可以压缩弹簧452。通道的第二端425a、425b可以穿透器皿的帽。通道的第二端可以进入器皿的内部。在一些情况下,可以提供力以驱动流体从通道进入器皿中。例如,可以在通道的第一端与第二端之间生成压差。在通道的第一端423a、423b处可提供正压并且/或者在通道的第二端处可提供负压。正压可相对于通道的第二端处和/或周围空气的压强为正。负压可相对于通道的第一端处和/或周围空气的压强为负。在一个示例中,器皿可在其中具有真空。当通道的第二端穿透器皿时,器皿内的负压可将样品拉入器皿中。在备选实施方式中,样品可由毛细力、重力或任何其他动力驱动而进入器皿。在实施方式中,器皿不在其中具有真空。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
在一些情况下,可以在样品收集的不同阶段使用不同类型的动力。因此,可以使用一种类型的动力来将样品吸入到通道中,并且继而可以使用不同类型的动力来将样品从通道移动至器皿中。例如,毛细力可将样品吸入到通道中,而压差可将样品从通道驱动至器皿中。可以使用动力的任意组合来将样品吸入至通道中和器皿中。在一些实施方式中,用于向通道中吸入样品的一种或多种动力不同于用于向器皿中吸入样品的一种或多种动力。在一些备选实施方式中,一种或多种动力对于每个阶段可以是相同的。在一些实施方式中,按顺序或在限定的时间段施加一种或多种动力。举非限制性示例而言,不施加用以向器皿中吸入样品的一种或多种动力,直到至少一个通道已达到最小填充水平。可选地,不施加用以向器皿中吸入样品的一种或多种动力,直到至少两个通道已各自达到对于该通道的最小填充水平。可选地,不施加用以向器皿中吸入样品的一种或多种动力,直到所有的通道已各自达到对于该通道的最小填充水平。在一些实施方式中,同时施加一种或多种动力。
一些实施方式可以使用加压气源,所述加压气源耦合至样品收集装置并且被配置用于将收集到的体液从一个或多个通道推入其相应的器皿中。可选地,一些实施方式可以使用不与器皿相关联的真空源将样品流体拉向器皿。
此外,通道的一些实施方式可被配置成使得通道内存在足够的毛细力,从而一旦被填充,该力大于重力以使得样品不会仅基于重力而从通道逸出。使用附加的动力来打破一个或多个通道的毛细作用的保持。可选地,如本文其他各处所描述,诸如但不限于套筒等装置可容纳体液以防其在最靠近器皿的一端处离开通道,从而使任何损失最小化,直到开始向器皿的转移。
可选地,可以使用其他材料诸如但不限于冻干球(lyosphere)、海绵或其他动力提供物等,来提供向器皿中吸入样品的动力。当使用多个力时,这可以是用以向器皿中吸入样品的初级、次级或三级动力。可选地,一些实施方式可包括推式动力提供者,诸如但不限于柱塞,以便按期望的方式来移动样品。
在样品已被引入到通道中之后,可能经过一些时间,以供样品沿着通道的长度行进。用户可将样品引入到样品收集装置中,并且可以等待该样品沿着通道的长度行进。可以提供一个或多个光学指示器,其可指示样品是否已经达到期望的填充水平,诸如但不限于到达通道的末端。在其他实施方式中,在推入基座之前,用户可以等待预定量的时间。在用户已经确定样品已行进达通道的足够长度以及/或者从引入样品起已经过去了足够量的时间之后,可以推入基座。在推入基座之后,通道可被带至与器皿流体连通,并且样品可从通道流入器皿中。可以提供光学指示器,以使得用户可以知道器皿何时被填充。
一旦器皿已经被填充,则可以使用本文其他各处所描述的系统和方法来将其转移至期望的地点。在一些情况下,可以转移整个样品收集装置。可以将帽放置在样品收集装置上用于转移。在其他实施方式中,基座部分和/或支架部分可以是可从装置的其余部分移除的。在一个示例中,可以将基座从样品收集装置移除,并且器皿可连同基座一起被转移。或者,可以将基座从样品收集装置移除以提供对器皿的进入,并且可以从装置移除和传送器皿。基座的移除可涉及样品收集装置的一些拆解以便卸下基座。这可涉及使用足够的力来克服内置于装置中的、用于防止意外脱离的止动件或限位件。可选地,在卸下基座之前可以由用户进行一些其他主动行动,诸如但不限于脱开闩锁或其他锁定机构。可选地,一些实施方式可以允许移除器皿而不移除基座,但允许通过基座上的开口、进入端口或可敞开覆盖物的方式进入器皿。
在一些实施方式中,所述通道和/或器皿中的一个或多个可包括本文其他各处所描述的特征,诸如分离构件、涂层、抗凝剂、珠粒或任何其他特征。在一个示例中,引入到样品收集装置的样品可以是全血。可以提供两个通道和相应的器皿。在该非限制性示例中,每个通道具有涂层,诸如但不限于通道中的抗凝剂涂层。这样的抗凝剂涂层可发挥一个或多个以下功能。首先,抗凝剂可防止全血在样品收集过程期间凝结在通道内。取决于所要收集的全血量,凝结可能在已将足够量的血液带至通道中之前过早地堵塞通道。另一功能是将抗凝剂引入到全血样品中。通过在通道中具有抗凝剂,相对于可能只在器皿446a或446b中具有抗凝剂的一些实施方式,该过程在收集过程中可更早地开始。在将会沿着可具有未涂覆有抗凝剂的部分(诸如但不限于连接至通道422a或422b的针的内表面)的通路而引导全血样品的情况中,抗凝剂的这样的早期引入也可以是有利的。可选地,一些实施方式可以包括可用于更改表面的接触角(可湿性)的表面活性剂。
在一些实施方式中,通道的内表面和/或沿着流体通路的其他表面,诸如但不限于通往样品收集器皿内部的样品入口,可以涂覆有表面活性剂和/或抗凝剂溶液。表面活性剂为流体装置的疏水层提供可润湿表面,并且促进计量通道由例如血液等液体样品的填充。抗凝剂溶液帮助防止例如血液等样品在向流体装置提供时凝结。可以使用的示例性表面活性剂包括但不限于Tween、20、脱氧胆酸钠、Triton、X-100、Pluronic和/或提供表面活性剂的适当润湿特性的其他非溶血性去污剂。EDTA和肝素是可以使用的非限制性抗凝剂。在一个非限制性示例中,实施方式中溶液包含在50%甲醇/50%H2O中的2%Tween、25mg/mL EDTA,其继而被风干。甲醇/水混合物提供溶解EDTA和Tween的方法,并且还从塑料的表面迅速干燥。可以通过将会确保在表面上涂覆均匀的膜的任何技术(例如,移液、喷射、印刷或芯吸),来将溶液施加到通道或沿着流体流动通路的其他表面。
还应当理解,对于本文的任何实施方式,通道中的涂层可以沿着通道的整个路径延伸。可选地,涂层可以覆盖通道的大部分但非全部。可选地,一些实施方式在最靠近进入开口的区域中可以不覆盖通道以使得交叉污染的风险最小化,其中通过使所有通道都与目标样品流体同时接触并从而具有连通的流体通路的方式,来自一个通道的涂层材料迁移至附近的通道中。
尽管已将本文的实施方式示出为具有位于样品收集装置中的两个分离的通道,但应当理解,一些实施方式可以使用不只两个分离的通道。可选地,一些实施方式可以使用少于两个完全分离的通道。一些实施方式可以仅使用一个分离的通道。可选地,一些实施方式可以使用倒Y形通道,该倒Y形通道初始作为一个通道开始,并继而分成两个或更多个通道。这些概念中的任何概念均可适于随本文所描述的其他实施方式一起使用。
具有自支撑收集通道的收集装置
图5A-图5B提供了根据本文所描述的实施方式而提供的样品收集装置500的另一示例。该样品收集装置可包括收集装置主体520、支架530和基座540。在一些情况下,可选地可以提供帽。收集装置主体可包含由可以能够接收样品的收集管所限定的一个或多个收集通道522a、522b。基座可具有一个或多个光学指示器542a、542b,所述光学指示器可以提供对样品是否到达收容于基座中的一个或多个器皿的视觉指示。支架可具有一个或多个光学指示器532a、532b,所述光学指示器可以提供对样品是否到达或穿过通道的一部分的视觉指示。
样品收集装置的收集装置主体520可在其中包含具有通道522a、522b的一个或多个管的至少一部分。可选地,装置收集主体520还可限定耦合至由所述管所限定的通道522a、522b的通道。在一些实施方式中,所述通道的一部分可延伸超出收集装置主体。通道可延伸超出收集装置主体的一端或两端。
收集装置主体520可连接至支架530。支架可在其中包含一个或多个通道的一部分。收集装置主体可永久固定到该支架,或者可以是相对于该支架可移除的。在一些情况下,收集装置主体和支架可由单一整体件形成。或者,收集装置主体和支架可由分离的零件形成。
在装置的操作期间,收集装置主体520和支架530可相对于彼此移动。在一些情况下,主体520的一部分可以是可插入于支架530内的,并且/或者支架的一部分可以是可插入于主体内的。该主体可以能够相对于支架移动。在一些情况下,样品收集装置可具有沿着该样品收集装置的长度延伸的纵轴。主体和/或支架可相对于彼此在所述纵轴的方向上移动。主体和/或支架可以能够相对于彼此移动有限距离。主体和/或支架可在无旋转运动的情况下同轴移动。或者,可以提供旋转运动。
收集装置主体520可由光透射材料形成。例如,收集装置主体可由透明或半透明材料形成。或者,主体可由不透明材料形成。支架530可由光学不透明、半透明或透明材料形成。支架可以具有或者可以不具有与收集装置主体相同的光学特性。支架可以由与收集装置主体不同的材料形成,或者由与收集装置主体相同的材料形成。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
收集装置主体、支架和/或基座可具有任何形状或大小。在一些示例中,收集装置主体、支架和/或基座可具有圆形、椭圆形、三角形、四边形(例如,正方形、矩形、梯形)、五边形、六边形、八边形或任何其他横截面形状。沿着长度,横截面形状可以保持相同或者可以变化。对于主体、支架和/或基座,横截面形状可以相同或者可以变化。在一些情况下,收集装置主体、支架和/或基座可具有小于或等于约10cm2、7cm2、5cm2、4cm2、3cm2、2.5cm2、2cm2、1.5cm2、1cm2、0.8cm2、0.5cm2、0.3cm2或0.1cm2的横截面积。沿着长度,横截面积可以变化或者可以保持相同。对于收集主体、支架和基座,横截面大小可以相同或者可以变化。收集装置主体、支架和/或基座可具有小于或等于约20cm、15cm、12cm、10cm、9cm、8cm、7cm、6cm、5cm、4cm、3cm、2cm、1cm、0.5cm或0.1cm的长度。收集装置主体可具有比支架或基座更大或更小的长度,或者与支架或基座相等的长度。
通道522a、522b可由装置主体520和/或支架530来支撑。在一些情况下,管或其中的通道的全长可被包含在装置主体与支架的组合之内。或者,通道可延伸超出装置主体和/或支架,如图5中所见。在一些情况下,通道可延伸超出装置主体/支架组合的一端,或者延伸超出全部两端。在一些情况下,通道的一部分可处于装置主体之内,并且通道的一部分可处于支架之内。通道的位置可由装置主体和/或支架所固定。在一些情况下,通道可固定至装置主体并且/或者不相对于装置主体移动。通道可以是相对于支架可移动的。在一些情况下,可以提供多个通道。通道的至少一部分可基本上彼此平行。通道可平行于彼此和/或沿着样品收集装置的长度延伸的纵轴。或者,通道的任何部分都无需彼此平行。在一些情况下,通道的至少一部分不彼此平行。通道可稍微弯曲。可选地,它们可以是笔直的,但在它们靠近样品收集点时被对准成更靠近于彼此。应当理解,限定通道522a和522b的管可由光学透明材料、透射材料或者其他足以提供样品已达到至少一个通道中的期望填充水平的可检测变化的材料所制成。可选地,所述可检测变化可以用于检测全部两个通道何时至少达到期望的填充水平。
在样品收集装置内可提供基座540。该基座可连接至支架530。在一些情况下,基座540的一部分可以是可插入于支架530内的,并且/或者支架的一部分可以是可插入于基座内的。基座可相对于支架固定,或者可以是相对于支架可移动的。基座可提供在与连接至主体的支架的一端相对的支架的一端。基座可形成为与支架分离的零件。基座可以是可从支架分离的。或者,基座可固定至支架以及/或者与支架形成为整体件。
基座540可在其中收容一个或多个器皿。所述器皿可与通道流体连通,并且/或者可被带至与通道流体连通。通道的一端可处于器皿内,或者可被带至器皿内。基座可具有一个或多个光学指示器542a、542b,所述光学指示器可提供对样品是否到达收容于基座中的一个或多个器皿的视觉指示。在一些实施方式中,光学指示器可以是可使得用户能够查看向基座内的光学窗口。该光学窗口可由透明和/或半透明材料形成。或者,光学窗口可以是在其中没有任何材料的开口。光学窗口可以使得用户能够直接观察基座内的器皿。基座内的器皿可由透明和/或半透明材料形成,其可以使得用户能够查看样品是否已经到达该基座的器皿。例如,如果沿着通道将血液运送至器皿,则器皿可以示出其中的血液。在其他实施方式中,光学指示器可以包括可指示器皿已被填充的其他特征。例如,可以在基座或器皿内提供一个或多个传感器,所述传感器可以确定是否已经在器皿内提供了足够量的样品。所述传感器可向基座上的光学指示器提供信号,该信号可指示是否已经向器皿提供样品以及/或者已经向器皿提供的样品量。例如,光学传感器可包括显示器,诸如LCD显示器、光显示器(例如,LED显示器)、等离子屏显示器,其可以提供对器皿已经被充分填充的指示。在备选实施方式中,无需提供光学指示器,但可以提供替代的指示器,诸如但不限于可以通过可检测信号(诸如可由用户检测的信号)指示器皿已于何时得到填充的音频指示器、温控指示器或其他器件。
支架530可具有一个或多个光学指示器532a、532b,所述光学指示器可提供对样品是否到达或穿过由支架所收容的通道的一部分的视觉指示。在一些实施方式中,光学指示器可以是可使得用户能够看向支架内的光学窗口。光学窗口可由透明和/或半透明材料形成。或者,光学窗口可以是在其中没有任何材料的开口。光学窗口可以使得用户能够直接观察支架内的通道的一部分。通道可由透明和/或半透明材料形成,其可以使得用户能够查看样品是否已经到达光学窗口下面的通道的部分。在其他实施方式中,光学指示器可以包括可对样品已经穿过通道的一部分加以指示的其他特征,诸如本文其他各处所描述的传感器。
现参考图6A-图6B,根据本文所描述的一个实施方式提供样品收集装置500的附加视图。
在一些实施方式中,包含通道522a、522b的管的一部分可延伸超出收集装置主体520。延伸出的通道的部分可包括被配置用于接收来自受试者的样品的通道的部分。在一个示例中,通道可具有第一端523a、523b,该第一端可以是通道的样品接收端。
通道可以可选地由刚性材料所限定。或者,通道可以由柔性材料所限定,或者可以具有柔性组件。通道可以被设计用于或者可以不被设计用于弯折或弯曲。通道可以基本上彼此平行,或者可以不基本上彼此平行。在一些情况下,通道的第一端在处于松弛状态时可以相隔一定距离。通道的第一端在装置操作期间可保持相隔该距离。或者,通道的第一端可被带至相互更加靠近。例如,通道的第一端可被挤在一起。通道的每个开放端可单独地接收样品。可以按顺序接收样品。样品可以来自同一受试者。或者,通道可以能够同时接收同一样品。
通道522a、522b可包括本文其他各处提到的一个或多个特征或特性。通道的至少一部分可基本上彼此平行。或者,通道可相对于彼此成角度。在一些实施方式中,通道可具有第一端,该第一端可位于样品收集装置的样品接收端526处。通道的第一端可以是能够接收样品的开放端。在一些实施方式中,可在样品接收装置的样品接收端处提供每个通道的所述端。一个、两个或更多个通道可具有位于样品收集装置的样品接收端处的第一端。
在一些实施方式中,装置主体520可以是相对于支架530可移动的。装置主体的一部分可以是可插入于支架内的,或者反之亦然。在一个示例中,装置主体可具有凸缘527和内部部分529。凸缘可具有比内部部分更大的横截面积。内部部分可以能够被插入到支架中。凸缘可充当用以防止整个主体被插入到支架中的限位件。凸缘可位于支架的肩部上。
图7A-图7B示出了根据本文所描述的实施方式而提供的样品收集装置700的示例的局部剖视图。在将通道722a、722b带至与收容在装置的基座740内的一个或多个器皿746a、746b流体连通之前,样品收集装置处于伸展状态。样品收集装置可包括主体720、支架730和基座740。主体和/或支架可支撑和/或包含一个、两个或更多个通道的至少一部分。基座可支撑和/或包含一个、两个或更多个器皿。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
在一个实施方式中,主体720和/或支架730可支撑样品收集装置中的一个或多个通道722a、722b。在一个示例中,提供两个通道,但关于两通道实施方式的描述亦可适用于任何数目的通道,包括但不限于1个、3个、4个、5个、6个或更多个通道。每个通道可具有第一端723a、723b,该第一端可以是装置的样品接收端。各个通道的第一端可以是敞开的。通道可向周围空气敞开。当通道的第一端接触诸如血液等流体时,可将该流体吸入至通道中。可以经由毛细作用或本文其他各处所描述的任何其他技术来吸入流体。所述流体可沿着通道的长度行进至通道的相应第二端。通道可彼此流体隔离。例如,流体可经由第一端723a进入第一通道722a,穿过通道的长度,并在第二端处离开该第一通道。类似地,流体可经由第一端723b进入第二通道722b,穿过通道的长度,并在第二端处离开该第二通道。该第一通道和第二通道可流体隔离,以便来自第一通道的流体不向第二通道中传递,并且反之亦然。在一些实施方式中,流体可传递至通道的第二端而不首先离开。
通道722a、722b可具有平行配置。例如,通道的第一端723a、723b可以相距与通道的第二端大致相同的距离。通道的第一端可以彼此接触或者可以不彼此接触。
支架730可具有一个或多个光学指示器,诸如光学窗口732a、732b。光学窗口可定位于通道722a、722b之上。在一些情况下,光学窗口可定位于通道的部分之上。单一窗口可提供对单一通道部分或对多个通道部分的观察。在一个示例中,可以提供与通道相同数目的光学窗口。每个光学窗口可对应于相应的通道。光学窗口和通道都可由光透射材料形成,其可允许用户从样品收集装置的外部观察样品是否已经到达和/或穿过下面的通道部分。这样的确定可以用于确定在何时压缩样品收集装置。
基座740可连接至样品收集装置的支架730。该基座可以直接接触或者可以不直接接触支架。在装置的使用期间,基座可相对于支架固定。在一些情况下,基座可以是可从支架移除的。基座的一部分可以是可插入至支架中的,并且/或者反之亦然。在一些实施方式中,基座可在相对于支架的纵向上从支架滑出。在一些情况下,基座可与支架同轴滑动而不旋转。在一些情况下,基座可在相对于支架移动的同时旋转。
基座740可以能够支撑一个或多个器皿746a、746b。基座可以具有可至少部分地包围所述一个或多个器皿的外壳。在一些情况下,当基座与支架730相接合时,器皿可被完全包围。基座的高度可延伸超出器皿的高度。或者,基座的高度可延伸至与器皿的高度相同的程度或小于器皿的高度。基座可具有一个或多个凹陷、凸起、凹槽或塑形特征以接受器皿。基座可形成为具有与器皿的形状互补的形状。例如,基座可具有一个或多个管状凹陷,管状器皿可紧贴地配合至其中。器皿可摩擦配合至基座中。可以将器皿保持在相对于基座的直立位置上。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
可以提供与通道的数目相同的数目的器皿。例如,如果提供了N个通道,则可提供N个器皿,其中N是正整数(例如,1、2、3、4、5、6、7、8或更多)。每个通道可对应于相应的器皿。在一个示例中,样品收集装置可具有第一通道和第二通道,以及相应的第一器皿和第二器皿。第一通道722a可与第一器皿746a流体连通或者可被配置用于被带至与该第一器皿流体连通,并且第二通道722b可与第二器皿746b流体连通或者可被配置用于被带至与该第二器皿流体连通。
在一些实施方式中,每个器皿可具有主体749a、749b和帽748a、748b。器皿可具有如本文其他各处所描述的任何特征或特性。
基座740可具有一个或多个光学指示器,诸如光学窗口742a、742b。光学窗口可定位于器皿746a、746b之上。在一些情况下,光学窗口可定位于器皿主体之上。单一窗口可提供对单一器皿或对多个器皿的观察。在一个示例中,可以提供与器皿相同数目的光学窗口。每个光学窗口可对应于相应的器皿。光学窗口和器皿都可由光透射材料形成,其可允许用户从样品收集装置的外部观察样品是否已经到达器皿。这样的视觉评估可用于确定样品何时到达器皿,以及在何时可从样品收集装置移除基座。
可以提供一个或多个接合组装件。所述接合组装件可包括通道保持器750和/或施力组件,诸如弹簧752或橡皮带。在一个实施方式中,保持器750可使适配器通道754保持固定到支架。如本文其他各处将会描述,适配器通道754可与收集通道一体形成,或者可以是分立元件,其可以是独立件、收集通道的一部分或者器皿的一部分。在一个实施方式中,保持器750可防止适配器通道754相对于支架滑动。保持器750可以可选地提供可让诸如弹簧等施力组件居于其上的支架。
在一个示例中,接合组装件可包括弹簧752,该弹簧可施加力以使得当弹簧处于其自然状态时,主体720处于伸展状态。当主体处于其伸展状态时,可在器皿746a、746b与接合组装件之间提供空间。当主体处于其伸展状态时,主体的内部部分729可由支架730所暴露和/或揭露。在一些情况下,当主体处于其伸展状态时,通道722a、722b的第二端可以接触或者可以不接触器皿的帽。通道的第二端可处于它们与器皿内部不流体连通的位置上。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
样品收集装置可具有任何数目的接合组装件。例如,可以提供与通道的数目相同的数目的接合组装件。每个通道可具有接合组装件。例如,如果提供第一通道和第二通道,则可以为该第一通道提供第一接合组装件,并且可以为该第二通道提供第二接合组装件。可以提供相同数目的接合组装件和器皿。
图8A-图8B提供了具有通道822a、822b的样品收集装置800的示例,所述通道与装置内的器皿846a、846b的内部流体连通。样品收集装置可包括主体820、支架830和基座840。主体和/或支架可支撑和/或包含一个、两个或更多个通道的至少一部分。通道可延伸超出主体的一端。基座可支撑和/或包含一个、两个或更多个器皿。
在一个实施方式中,主体820和/或支架830可支撑样品收集装置中的一个或多个通道822a、822b。例如,可以提供第一通道和第二通道。每个通道可具有第一端823a、823b,该第一端可以提供于可延伸超出主体的装置的样品接收端处。各个通道的第一端可以是敞开的。通道可向周围空气敞开。通道可以是刚性的或者可以是柔性的。在一些实施方式中,通道可以具有可允许其弯曲以与彼此相接触的长度。当通道的第一端接触诸如血液等流体时,可将该流体吸入至通道中。每个通道端可单独地接触流体,该流体可被吸入至相应的通道中。这可以涉及调整样品收集装置的角度,以使得在任一时间只有进入通道中的一个开口与样品流体相接触。或者,所有通道可同时接触同一样品,该样品被同时吸入至相应的通道中。或者,多个但不是所有通道可同时接触同一样品,该样品继而被同时吸入至相应的通道中。可以经由毛细作用或本文其他各处所描述的任何其他技术来吸入流体。所述流体可沿着通道的长度行进至通道的相应第二端。在一些实施方式中,流体可经由毛细作用或本文所描述的其他技术而到达通道的第二端。在其他实施方式中,流体无需到达通道的第二端。通道可彼此流体隔离。
在一些实施方式中,当通道不与器皿846a、846b的内部流体连通时,流体可传递至通道的第二端而不离开。例如,流体可经由毛细作用而被吸入至通道中,这可致使流体流向或流近通道的末端而不致使流体离开通道。
在装置的使用期间,主体820可以是相对于支架830可移动的。在一些实施方式中,主体可在相对于支架的纵向上滑动。在一个示例中,主体可具有(i)伸展位置,在其中通道不与器皿的内部流体连通,以及(ii)压缩位置,在其中通道与器皿的内部流体连通。可以初始提供处于伸展状态的样品收集装置,如图7中所示。在样品已经被收集并且流过通道的长度之后,用户可以推入主体以提供处于其压缩状态的样品收集装置,如图8中所示。在一些情况下,当主体处于伸展状态时,暴露出主体的内部部分。当主体处于压缩状态时,主体的内部部分可由支架所覆盖。主体的凸缘可接触支架。一旦主体已被推入,则主体可自然保持被推入,或者一旦移除推力,则可回弹至伸展状态。在一些情况下,主体可被拔出至伸展状态,或者可被完全拔出以提供对其中的器皿的进入。可选地,在一些组装件中,主体的移除将不会提供对器皿的进入。
基座840可连接至样品收集装置的支架830。基座840可以能够支撑一个或多个器皿846a、846b。基座可以具有可至少部分地包围所述一个或多个器皿的外壳。在一些情况下,当基座与支架830相接合时,器皿可被完全包围。基座可具有一个或多个凹陷、凸起、凹槽或塑形特征以接受器皿。基座可形成为具有与器皿的形状互补的形状。可以保持器皿处于相对于基座的直立位置上。
可以提供与通道的数目相同的数目的器皿。每个通道可对应于相应的器皿。在一个示例中,样品收集装置可具有第一通道和第二通道,以及相应的第一器皿和第二器皿。第一通道822a可与第一器皿846a流体连通或者可被配置用于被带至与该第一器皿流体连通,并且第二通道822b可与第二器皿846b流体连通或者可被配置用于被带至与该第二器皿流体连通。第一通道初始可不与第一器皿流体连通,并且第二通道初始可不与第二器皿流体连通。当相对于支架推入主体时,第一通道和第二通道可被带至分别与第一器皿和第二器皿的内部流体连通。第一通道和第二通道可被同时带至与第一器皿和第二器皿流体连通。或者,它们无需被同时带至流体连通。流体连通的时序可取决于器皿的高度和/或通道的长度。流体连通的时序可取决于通道的第二端与器皿之间的相对距离。
在一些实施方式中,每个器皿可具有主体849a、849b和帽848a、848b。器皿主体可具有管状的形状。在一些情况下,器皿主体可具有圆柱形部分。器皿的底部可以是平坦的、锥形的、圆润的或其任意组合。器皿可包括开放端和封闭端。开放端可以是器皿的顶端,其可处于器皿的更靠近一个或多个通道的一端。封闭端可以是器皿的底端,其可处于器皿的更远离一个或多个通道的一端。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
支架830可具有一个或多个光学指示器,诸如光学窗口832a、832b。光学窗口可定位于通道822a、822b的部分之上。光学窗口可提供对样品是否已经到达和/或穿过由该光学窗口所示出的通道的部分的指示。这可以用于评估样品是否已充分流动以便用户将主体推入到样品收集装置中。在一些情况下,可能期望样品在致使通道与器皿进入流体连通之前到达通道的第二端或通道的第二端附近。在一些情况下,样品可能需要在推入主体以将通道带至与器皿流体连通之前到达通道的特定部分。所述通道的特定部分可位于光学窗口之下。
基座840可具有一个或多个光学指示器,诸如光学窗口842a、842b。光学窗口可定位于器皿846a、846b之上。在一些情况下,光学窗口可定位于器皿主体之上。光学窗口可提供对样品是否已经进入器皿的指示。光学窗口可示出有多少样品已经填充了器皿。这可以用于评估是否已有足够量的样品进入器皿。在一些情况下,在将器皿从与通道的流体连通移除之前,可能期望特定量的样品进入该器皿。在移除装置的基座从而将器皿带离与通道的流体连通之前,可能期望器皿中的预定体积的样品。
器皿和/或与通道的接口可具有任何特性或特征,诸如本文其他各处所描述的特性或特征。在一些情况下,通道的第二端可穿透器皿的帽,从而将通道带至与器皿流体连通。在一些情况下,通道可从器皿撤出,并且器皿的帽可形成不漏流体的密封,从而当通道被带离与器皿的流体连通时,允许器皿内不漏流体的环境。
可以提供一个或多个接合组装件。所述接合组装件可包括通道保持器和/或施力组件,诸如弹簧或橡皮带。保持器可使通道保持固定至主体。保持器可防止通道相对于主体滑动。保持器可以可选地提供可让诸如弹簧等施力组件居于其上的支架。
在一个示例中,接合组装件可包括弹簧,该弹簧可施加力以使得当弹簧处于其自然状态时,主体处于其伸展状态。当主体处于其伸展状态时,可在器皿846a、846b与样品主体820的底部部分之间提供空间。通道的第二端可处于它们与器皿内部不流体连通的位置上。
当压入主体时,可以压缩弹簧852(另见图9A-图9C)。通道的第二端可穿透器皿的帽。通道的第二端可进入器皿的内部。在一些情况下,可提供力以将流体从通道驱动至器皿中。例如,可以在通道的第一端与第二端之间生成压差。在通道的第一端823a、823b处可提供正压并且/或者在通道的第二端处可提供负压。正压可相对于通道的第二端处和/或周围空气的压强为正。负压可相对于通道的第一端处和/或周围空气的压强为负。在一个示例中,器皿846a和846b可各自在其中具有真空。当通道的第二端穿透器皿时,器皿内的负压可将样品吸进器皿中。在备选实施方式中,样品可由毛细力、重力或任何其他动力驱动而进入器皿。可选地,可以存在力的单个或多个组合以用流体填充器皿。
在一些情况下,可以使用不同类型的动力向通道中以及从通道向器皿中吸入样品。例如,毛细力可将样品吸入到通道中,而压差可将样品从通道驱动至器皿中。可以使用动力的任意组合来向通道中以及向器皿中吸入样品。
在样品已被引入到通道中之后,可能经过一些时间,以供样品沿着通道的长度行进。用户可将样品引入到样品收集装置中,并且可以等待该样品沿着通道的长度行进。可以提供沿着通道的长度的一个或多个光学指示器,其可指示样品是否已经到达通道的末端。在其他实施方式中,在推入主体之前,用户可以等待预定量的时间。在用户已经确定样品已行进达通道的足够长度以及/或者从引入样品起已经过去了足够量的时间之后,可以推入主体。主体可具有平坦表面,该平坦表面可易于用户推动。在一些情况下,该平坦表面可以具有可足以让用户的手指在主体上向下按压的横截面积。在推入主体之后,通道可被带至与器皿流体连通,并且样品可从通道流入器皿中。可以提供光学指示器,以使得用户可以知道器皿何时被填充。
一旦器皿已经被填充,则可以使用本文其他各处所描述的系统和方法来将其转移至期望的地点。如前文所述,可以转移整个样品收集装置。在其他实施方式中,基座部分可以是可从装置的其余部分移除的。在一个示例中,可将基座从样品收集装置移除,并且器皿可连同基座一起被转移。或者,可以将基座从样品收集装置移除以提供对器皿的进入,并且可以从装置移除和传送器皿。
参考图9A-图9B,现将描述样品收集装置900和使用方法的示例。在一个非限制性示例中,该装置可具有主体920、支架930和基座940。主体920、支架930和基座940可以是相对于彼此可移动的。在一些情况下,装置的各个组件可以是在不同使用阶段期间可移动的。使用阶段的示例可包括当装置处于伸展状态、压缩状态和分离状态时。
图9A示出了装置900处于伸展状态的示例。主体920可相对于支架伸展。被配置用于运送样品的通道922a、922b可固定至主体。通道的第一端可从主体和/或样品收集装置的其余部分延伸出去。通道的第二端可位于样品收集装置的一部分内或被其所包含。通道可与由基座940收容的相应器皿流体隔离。支架930可定位于主体与基座之间。支架可至少部分地包含通道的一部分。在一些情况下,支架可包含通道的第二端。
当处于伸展状态时,装置可具有伸展的长度。装置的长度可以是从基座的底部到通道的第一端。或者,装置的长度可以从基座的底部到主体的顶部来测量。
如图9A中所见,当样品引入至装置时,装置900可处于伸展状态。例如,样品可由通道的至少第一端所接触。可以经由毛细作用或本文所描述的任何其他技术或动力来向通道中吸入样品。力可单独作用或组合作用以向装置中吸入样品。当样品正在穿越通道时,装置900可保持处于伸展状态。样品可以填充通道的全长、通道长度的一部分或至少最小部分,以满足期望的样品采集体积。
图9B示出了装置900处于压缩状态的示例。主体920可相对于支架压缩。通道922a、922b可固定至主体。通道可与它们相应的器皿流体连通。当装置被带至压缩状态时,第一通道可被带至与第一器皿的内部流体连通,并且第二通道可被带至与第二器皿的内部流体连通。
举非限制性示例而言,用户可以朝向支架930推动主体920(或者反之亦然)以将装置带至压缩状态。部件之间的相对运动可涉及这两个零件的移动。可选地,移动可涉及仅移动它们之中的一个。在本示例中,可以将主体920一直推到支架930,以使得主体的任何内部部分都不暴露并且/或者主体的凸缘接触支架。可以使用可在装置被完全压缩时接合的任何止动机构。或者,可以仅部分地推动主体。例如,可以暴露主体的内部部分的一部分。支架可定位于主体与基座之间。支架可至少部分地包含通道的一部分。在一些情况下,通道的第二端可延伸超出装置的支架。
当处于压缩状态时,应当理解,装置900可具有压缩长度。装置900的长度可以是从基座的底部到通道的第一端。或者,装置的长度可以从基座的底部到主体的顶部来测量。装置的压缩长度可小于装置的伸展长度。在一些实施方式中,装置的压缩长度可以比装置的伸展长度小至少约0.1cm、0.5cm、1.0cm、1.5cm、2.0cm、2.5cm、3.0cm、3.5cm、4.0cm或5.0cm。装置的压缩长度可以小于或等于装置的伸展长度的约50%、60%、70%、75%、80%、85%、90%、95%、97%或99%。
可以随装置900提供一个或多个接合组装件。所述接合组装件可包括通道保持器950和/或施力组件,诸如弹簧952或橡皮带。保持器950可使适配器通道954保持固定至支架。如本文其他各处将会描述,适配器通道954可与收集通道一体形成,或者可以是分立元件,其可以是独立件、收集通道的一部分或者器皿的一部分。在一个实施方式中,保持器950可防止适配器通道954相对于支架滑动。保持器950可以可选地提供可让诸如弹簧等施力组件居于其上的支架。当装置处于压缩状态时,诸如弹簧等施力组件可处于压缩状态。当装置处于压缩状态时,弹簧可对装置的主体施加力。
当样品从通道向相应的器皿转移时,装置可处于压缩状态。在一些示例中,可以经由通道与器皿内部之间在它们被带至流体连通时的压差而发生转移。例如,通道的第二端可被带至与器皿的内部流体连通。器皿可在其中具有真空和/或负压。当通道被带至与真空器皿流体连通时,样品可被吸进器皿中。当样品正在被转移至器皿时,装置可保持处于压缩状态。样品可填充整个器皿或器皿的一部分。来自通道的全部样品(和/或样品的90%、95%、97%、98%、99%、99.5%或99.9%以上)可被转移至器皿。或者,可以仅将来自通道的样品的一部分转移至器皿。
参考图9C,现将描述处于分离状态的装置900的示例。基座940可从装置900的其余部分分离。主体920可相对于支架930伸展或压缩。在一个示例中,伸展状态可以是自然状态,以便当用户不再对主体施加力时,主体可伸展回到伸展状态。通道922a、922b可固定至主体。
当装置900处于分离状态时,基座940可从装置的支架930分离。可以将通道922a、922b从与它们相应的器皿946a、946b的流体连通中移除。当装置900被带至分离状态时,可将第一通道带离与第一器皿的内部的流体连通,并且可将第二通道带离与第二器皿的内部的流体连通。这可以按顺序或者同时发生。当通道被从器皿移除时,器皿可呈现密封状态以防止不期望的材料进入该器皿。在一些实施方式中,在通道的移除之后器皿可以是不漏流体的。可选地,在通道的移除之后器皿可以是不漏气体的。
用户可将基座940从支架930分离以将装置带至分离状态,从而移除其中的器皿。在一些实施方式中,可以将基座从支架分离,或者反之亦然。从支架分离基座可以暴露出由基座支撑的器皿946a、946b。器皿可以压装于或以其他方式保持于基座内。器皿946a、946b可以是可从基座移除的。举非限制性示例而言,移除器皿946a、946b允许其与其他器皿一起放置在气候控制的运输容器中,以用于运输至接收场所,诸如但不限于分析场所。可选地,可以移除器皿946a、946b以允许在被转送用于在诸如但不限于分析场所的接收场所进行处理之前进行预处理,诸如但不限于离心分离。或者,器皿946a、946b可以保持与基座在一起。
图10A-图10B提供了处于分离状态的样品收集装置1000的附加视图。当处于分离状态时,基座1040可从装置的支架1030和/或主体1020分离(部分地或完全地分离)。这允许通过先前当装置1000不处于分离状态时未暴露在外的基座1040的一端来移除器皿1046a和1046b。
当装置处于分离状态时,一个或多个通道1022a、1022b可与由基座1040收容的一个或多个器皿1046a、1046b流体隔离。器皿可与它们的环境流体隔绝。器皿可在其中包含样品,该样品已通过收集通道运送、达到最小填充水平,并且继而基本上完全存放至相应的器皿中。基座1040可包括一个或多个光学指示器1046a、1046b。所述光学指示器可示出其中的器皿的一部分,从而不将装置1000移至分离状态,直到器皿中已经达到最小填充水平。举非限制性示例而言,器皿可具有光透射材料,其允许用户从基座之外观察器皿内的样品。
在一些实施方式中,基座1040可包含器皿的至少一部分。基座可具有空心的内部以及包围该空心内部的壁。基座可以具有可支撑器皿的一个或多个塑形特征。器皿可提供于空心内部之内。壁可以包围器皿。基座可具有开放的顶部,通过该顶部可以暴露器皿。器皿可以通过或者可以不通过所述开放顶部而移除。
具有多个收集通道的收集装置
参考图11A-图11F,现将描述如本文所描述的进一步实施方式。该实施方式提供体液样品收集装置1100用于收集可汇集于或以其他方式形成于表面(诸如但不限于受试者的皮肤或其他目标区域)上的流体样品。尽管本实施方式示出了在其中限定不同容积的至少两个收集通道的装置主体,但应当理解,不排除具有更少或更多数目的收集通道的装置。也不排除对于一个或多个通道使用相同收集容积的实施方式。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
图11A图示了具有远端1102的体液样品收集装置1100的一个实施方式的透视图,所述远端1102被配置用于接合表面上的流体样品。在本实施方式中,远端1102可具有被设计用于更好地接合形成于表面上的一小滴或一滩体液或样品的配置。除了期望的形状之外,一些实施方式还可在远端1102处具有表面处理,诸如但不限于化学处理、纹理、表面特征或涂层,以促进流体朝向远端1102上的、通向装置1100中的通道的一个或多个开口1104和1106流动。
如图11A中所见,样品收集装置1100的本实施方式可具有两个开口1104和1106,用于接收样品流体。应当理解,一些实施方式可在远端处具有不只两个开口。一些实施方式可在远端处仅具有一个开口。可选地,一些实施方式可沿着通向远离装置1100的远端1102之处的一侧或其他表面具有附加开口。开口1104和1106可具有任何横截面形状。在一些非限制性示例中,开口可具有圆形、椭圆形、三角形、四边形(例如,正方形、矩形、梯形)、五边形、六边形、八边形或任何其他横截面形状。沿着收集装置主体的长度,横截面形状可以保持相同或者可以变化。在一些情况下,开口可具有小于或等于约2mm2、1.5mm2、1mm2、0.8mm2、0.5mm2、0.3mm2或0.1mm2的横截面积。一些实施方式可具有相同形状的开口。其他实施方式可针对一个或多个开口使用不同的形状。
样品填充部分1120可以是样品收集装置1100的主体,其可以由透明和/或半透明材料形成,该材料可使得用户能够查看样品是否已经进入样品填充部分1120中的一个或多个样品收集通道(参见图11B)。在一些实施方式中,整个样品填充部分1120是透明或半透明的。或者,一些实施方式可仅使得通道上的所有区域或者仅通道或样品填充部分1120的选定部分是透明或半透明的,以允许用户可见样品向样品收集装置1100中的填充。可选地,样品填充部分由不透明材料制成,但具有开口或窗口以允许对其中的填充水平的可视化。装置1100可进一步包括一个或多个可视化窗口1112和1114,以允许用户查看何时达到了期望的填充水平。可视化窗口可由透明和/或半透明材料形成。或者,可视化窗口可以是在其中没有任何材料的开口。还可以使用附加的可视化窗口来确定收集通道中的所有流体已经被清空至器皿1146a和1146b中(参见图11B)。
图11A还示出支架1130的一些实施方式可具有光学窗口1132和1134,该光学窗口被定位用以示出器皿1146a和1146b中的填充水平,从而示出基座1140中的器皿是否已经被移动至用以接收样品流体的位置上。可选地,窗口1132和1134可以是切口,其充当用于基座的卡扣特征的导轨,以便在激活期间限定起始位置和结束位置。应当理解的是,基座可被配置用于保持一个或多个样品器皿。通过示例而非限制的方式而言,整个基座1140可在样品填充之前或之后从样品收集装置移除。基座1140可用作保持器以在运输期间将样品器皿保留于其中,并且在这样的实施方式中,基座1140将会连同样品器皿一起被装载至运送托盘或用于运输的其他保持器中。或者,一些实施方式可从基座1140移除样品器皿,并继而运输器皿而不用基座1140保持它们。
图11B示出了沿着图11C中所示实施方式的截面线B-B的剖视图。图11B示出了部分1120中的通道1126和1128。样品填充部分1120可由联结在一起以限定部分1120的两个或更多个零件形成。一些实施方式可将通道限定在一个零件中并继而具有另一零件,该另一零件与第一零件相配合以限定通道的相对壁或顶壁表面。就制造而言,这允许一个零件具有模塑的或以其他方式形成于主体中的通道,并且相对的零件将会配合以充当所述通道的覆盖物或者还可以包括所述通道的部分。通道1126和1128可以仅形成于部分1120中,或者还可以延伸至支架1130中,该支架1130具有用以与被保持在基座或载体1140中的器皿相连接的特征。一些实施方式可使部分1120和部分1130一体地形成在一起。支架1130还可被配置用于保持适配器通道1150,该适配器通道1150将会使通道1126和1128与它们相应的器皿1146a和1146b流体连接。
尽管本文的这些实施方式被描述为使用两个通道和两个器皿,但应当理解,不排除其他数目的通道和器皿。一些实施方式可具有比器皿更多的通道,其中一些通道将会耦合至同一器皿。一些实施方式可具有比通道更多的器皿,在这种情况下多个器皿可以可操作地耦合至同一通道。
如图11B中所见,通道1126和1128可以是不同大小。这允许将不同的流体体积在其被同时转移至器皿1146a和1146b中之前收集于每个通道中。可选地,一些实施方式可以具有尺寸设置为包含相同体积的流体的通道1126和1128。在一些实施方式中,对通道1126和1128的流体通路塑形和/或使其成角度,以使得远端1102附近的开口比近端相互更加靠近,开口可进一步间隔开以将它们对准用于进入到器皿1146a和1146b中。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
图11B还示出一些实施方式可以使用针用于与通道1126和1128相通的主体1130中的适配器通道1150和1152。所述针各自具有通道以允许流体从收集通道1126和1128穿过其中而抵达针的末端。如图11B中所见,基座1140中的器皿1146a和1146b可相对于支架1130滑动,如箭头1156所指示。支架1130与基座1140之间的相对运动可缩小间隙1154。缩小间隙1154将适配器通道1150带至器皿1146a的帽1148a中,直到在器皿1146a的内部与收集通道1126之间存在流体连通。此时,形式上的动力将会继而将通道1126中的流体移动至器皿1146a中。
通过示例而非限制的方式而言,可以使用动力的任意组合来向器皿中吸入样品。一些实施方式可以使用来自器皿1146a中的真空的拉力来向器皿中吸入样品。一些实施方式可以使用来自外部压强的推力来将流体移动至器皿中。一些实施方式可以同时使用这两种力。一些实施方式可依赖于毛细力和/或重力。在一些实施方式中,用于向通道中吸入样品的一种或多种动力不同于用于向器皿中吸入样品的一种或多种动力。在一些备选实施方式中,所述一种或多种动力对于每个阶段可以是相同的。在一些实施方式中,按顺序或以限定的时间段施加所述一种或多种动力。举非限制性示例而言,不施加用以向器皿中吸入样品的一种或多种动力,直到至少一个通道已达到最小填充水平。可选地,不施加用以向器皿中吸入样品的一种或多种动力,直到至少两个通道已各自达到该通道的最小填充水平。可选地,不施加用以向器皿中吸入样品的一种或多种动力,直到所有通道已各自达到该通道的最小填充水平。在一些实施方式中,同时施加一种或多种动力。列举的这些特征可以适用于本文的任何实施方式。
现参考图11E,图中示出了装置1100的放大剖视图。该实施方式示出了支架1130具有凸缘部分1136,该凸缘部分1136的尺寸设置为在适配器通道1150和1152上延伸足够的量,以防止用户将手指插入到间隙1154中并且在所述针中之一上刺破手指。
此外,如图11B和图11E中所示,本实施方式在样品收集装置1100中具有至少两个通道。这允许通道1128和1126中的每一个向样品中引入不同的材料。举非限制性示例而言,如果样品是全血,则一个通道可向血液中引入肝素而另一通道引入乙二胺四乙酸(EDTA)。这些抗凝剂不仅在填充期间防止通道的过早堵塞,而且还向全血中引入抗凝剂以便为在器皿1146a和1146b中运输作准备。可选地,除了抗凝剂以外或者作为抗凝剂的替代,一个或多个通道还可以进行等离子体涂覆。等离子体涂层可降低体液样品在通道中的流阻。这样的涂层可按图案施加,所述图案诸如但不限于条状、环状或连同要在通道中使用的任何其他一种或多种涂层的其他图案。
可选地,在相应通道中存在足够量的抗凝剂,以使得在流体仅单次穿过通道之后,样品流体将会在样品流体中包含期望水平的抗凝剂。在传统的血液小瓶中,血液样品不含抗凝剂直到其进入小瓶,并且一旦处于小瓶中,技术人员一般会反复倾斜、摇动和/或搅动小瓶,以使小瓶中的抗凝剂能够混合。在本实施方式中,样品流体将会在进入样品器皿之前包含抗凝剂,并且它将会如此而不必反复倾斜或搅动样品收集装置。在本文的实施方式中,单次通过提供了足够的时间以及进入样品流体中的诸如抗凝剂等添加剂的足够的浓度。在一个实施方式中,EDTA通道具有的容积为54uL,涂覆有200mg/mL的EDTA;肝素的通道具有的容积为约22uL,涂覆有250单位/mL的肝素。在另一实施方式中,EDTA通道具有的容积为70uL,涂覆有300mg/mL的EDTA;肝素的通道具有的容积为约30uL,并且涂覆有250单位/mL的肝素。举非限制性示例而言,容积从50uL至70uL的通道可涂覆有EDTA,其范围为从约200mg/mL至300mg/mL的EDTA。可选地,容积从70uL至100uL的通道可涂覆有EDTA,其范围为从约300mg/mL至450mg/mL的EDTA。可选地,容积从20uL至30uL的通道可涂覆有肝素,其范围为自250单位/mL的肝素。举例而言,材料可以是涂覆在目标表面上达少于1小时并继而干燥过夜的溶液。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
参考图11G,现将描述进一步实施方式。图11G的实施方式示出了在样品收集装置1200的远端1202处,样品收集装置1200将两个或更多个通道合并成单一通道,而不是针对每个通道具有一个开口1204。图11G的实施方式示出了在公共通道分成多个分离的通道之前,存在公共通道部分。如下文在图11I中将会描述,可选地,可以存在回流防止器,诸如但不限于沿着分离的通道定位的排放孔,以降低在样品从通道向一个或多个器皿中的填充和/或抽取期间从一个通道向另一通道吸入样品的可能性。
如图11H中所见,这样的公共流路的使用可产生在样品收集装置1200外部上数目减少的开口,这可使其对准开口1204以接合体液样品。其还可通过具有在体液样品进入收集装置的同一通道上拉动的更多毛细管,来增大用于向样品收集装置1200中吸入体液样品的毛细力。
参考图11I,现将描述样品收集装置的选定组件的剖视图。图11I示出了样品收集装置可具有两个通道1182和1184,所述通道具有公共部分1186通向装置上的入口开口。在一些实施方式中,公共部分1186是通道1182或1184中之一在大小、形状和/或定向方面的延续。可选地,公共部分1186与通道1182、1184或者可与公共部分1186流体连通的任何其他通道中的任何一个的大小、形状和/或定向都不相同。图11I示出了在一个非限制性示例中,在通道1182与1184之间的接口1188处可以存在阻流板。该接口1188可被配置用于确保向全部两个通道中的流动,以使得它们都将会达到完全填充。在一个实施方式中,接口1188具有比通向远离接口1188之处的通道1182更大的尺寸。尽管不排除其他尺寸,但更大尺寸的该接口1188可确保充足的流量将会进入通道1182,该通道1182在本实施方式中相对于通道1184具有较小的直径和减小的容积。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
图11I还示出了可以存在排放孔1190和1192,所述排放孔可以用于防止通道之间的交叉流动,特别是当样品正在向样品器皿中转移时。在一个实施方式中,排放孔1190和1192始终敞开。在另一实施方式中,排放孔1190和1192可以仅在选定时间敞开,所述选定时间诸如但不限于在通道1182和1184被填充或被基本上填充之后。一些实施方式可以使用可溶解材料来塞住排放孔1190和1192,直到它们与样品流体相接触。可选地,一些实施方式可以使用可滑动覆盖物来覆盖排放孔1190和1192中的一个或多个,以使得它们仅在由用户所选定的时间敞开。在一个实施方式中,覆盖物连结至样品器皿,以使得用以移入与通道的流体连通的样品器皿的移动还将会敞开一个或多个排放孔1190和1192,以降低通道之间交叉流动的风险。可选地,还可以使用诸如但不限于阀、闸门或插塞等其他防交叉流动机构来防止通道1190与1192之间的流体转移。
图11I还示出了可以存在定位于适配器1150和1152之上的防泄漏器件1194。在本实施方式中,防泄漏器件1194是熔块,其可以可滑动地从在其中它们防止样品从适配器1150和1152中泄漏出去的第一位置移动至在其中它们允许适配器向样品器皿中递送流体的第二位置。在一个非限制性示例中,防泄漏器件1194在其由样品器皿或容纳样品器皿的外壳所接合时将会滑动。该非限制性示例中的样品器皿或外壳的移动示出了这些元件的移动还将会导致防泄漏器件1194的移动。
参考图11J,现将描述样品收集装置1160的又一实施方式。样品收集装置1160的本实施方式示出了该装置1160具有样品进入位置1204,该样品进入位置1204通向装置1160中的多个通道1162和1164。尽管图11J示出了通道1162和1164可具有不同的形状和/或大小,但一些实施方式可被配置成具有相同的容积和/或形状。还应当理解,样品进入位置1204可以是在装置1160的表面上,或者可选地,其可以是尖端、喷嘴、轴端或者从装置1160的主体延伸的其他凸起的一部分。该凸起可以与装置的主体处于同一平面中并且与该主体平行对准,或者可选地,其可以成角度,使得该凸起的轴与与装置1160的平面相交。
图11J进一步示出了对于一些实施方式,可以存在样品流动特征1166和1168以在期望的方向上吸入或以其他方式优先引导样品。在一些实施方式中,特征1166和1168是导轨,其操作以减小至少一个轴上的通道尺寸(诸如但不限于宽度或高度),并从而增大通过那些尺寸减小的区域的毛细作用。在一个非限制性示例中,在样品进入通道中的过程中,这些流动特征1166和1168可以辅助流体流经位于防交叉流动特征1170附近的通道区域。在一个实施方式中,设置流动特征1166和1168的大小,以便当流动主要由毛细作用吸取时,优先地改善内向方向上的流动。在一种情形下,外向流动不是基于毛细力,而是基于真空拉力(诸如来自相邻通道的拉力),并且本实施方式的这些流动特征1166和1168不被配置用于在那些真空的、非毛细流动条件下提供辅助。因此,流动特征1166和1168的一些而非全部实施方式被配置用于在至少一种类型的流动条件但不是某些其他一个或多个流动条件下进行辅助。可选地,一些实施方式可单独地或者与导轨相结合地使用其他技术(诸如但不限于塑形特征、一种或多种疏水材料、一种或多种亲水材料或者其他技术)来朝向期望方向推/拉样品。
图11J还示出了在本文的一个或多个实施方式中,存在成角度的侧壁特征1167,该特征1167以使样品汇集的方式呈圆锥形地或以其他方式使通道的横截面积变窄,以使可保留于通道中而不被收集的样品量最小化。图11J还示出了可存在一个或多个定位特征1169,以在制造期间帮助将部件一起联结于限定的位置和定向上。
图11K示出了样品收集装置1160的本实施方式的侧视图。装置1160的侧视图示出了存在这样的实施方式:其中存在一个或多个防交叉流动特征1170(诸如但不限于排放孔),用以使通道1162与1164之间的非期望的样品交叉流动最小化,特别是当在相应通道中已经达到期望的填充水平时尤为如此。由于排放孔在流体通路中创造出的中断,因此防交叉流动特征1170和1172可防止交叉流动。交叉流动问题本身最经常出现在当保持器1140中的器皿被接合并提供附加的动力以将样品从通道拉入器皿中时。这样的“拉动”效应可能无意地将样品从一个通道吸入至相邻通道。为了使交叉流动最小化,与将样品从通道拉入至器皿中相关联的力将会从排放孔而不是相邻通道中的流体拉动,从而使非期望的样品混合最小化。
图11K还示出了在本文的一些实施方式中,存在可适于随不同的样品填充部分1120一起使用的公共部分1130和1140。一些实施方式可使用不同的毛细填充部分1120。一些实施方式可使用这样的填充部分:所述填充部分使用不同类型的捕捉技术,诸如但不限于从静脉抽血、动脉抽血采集到的样品,或者从受试者的内部位置或目标部位抽取的其他样品。
现参考图11L,图中示出了样品流动特征1166和1168的一个实施方式。具有通道1162和1164以及公共入口通路1165附近的样品流动特征1166和1168的样品收集部分的该横截面视图示出了在一个实施方式中,所述特征在样品进入通道之处附近是期望的。图11L还示出了对于不同容积的通道,可能期望将入口1165定位成更靠近具有较大容积的通道1164,如入口1165的不对称位置所见。在一些实施方式中还可看到,还可以选择样品流动特征1166和1168的一个或多个位置以控制样品收集装置1160中的填充速率、填充体积等。应当理解,所描述特征中的一个或多个特征可适于随本文的其他实施方式一起使用。
现参考图11M,图中示出了具有样品防交叉流动特征的通道1162和1164。在一个实施方式中,样品防交叉流动特征是位于通道1162和1164的至少一个表面上的排放孔1170和1172。在一个非限制性示例中,这些样品防交叉流动特征位于装置中的任何样品流动特征1166和1168附近。在一个实施方式中,这些防交叉流动特征被配置用于防止通道之间的流动。这些防交叉流动特征可位于每个通道的最大填充位置附近,以使得当所述通道处于或接近其最大样品容量时,防交叉流动特征1170和1172被定位用以防止过满的样品导致已在一个通道中处理过的样品进入另一通道并且不期望地使来自两个通道的样品混合在一起。
图11N示出了具有样品填充指示器1112和1114的样品收集装置1160的透视图。在一个实施方式中,这些指示器1112和1114是开口或者是装置1160的透明部分,其允许观察一个或多个通道1162或1164的至少一部分。当样品在指示器1112和1114中的至少一个中可见时,其向用户提供提示以继而采取另一行动,诸如但不限于接合保持器1140中的样品器皿。在一些实施方式中,仅存在一个样品填充指示器,该指示器是在两个或更多个通道中的样品的充分填充的代用指标。在一些实施方式中,仅当由指示器1112和1114指示时,才会采取行动来接合样品器皿。在一些实施方式中,仅当由所述指示器中的仅一个指示时,才会采取行动来接合样品器皿。
现参考图11O、图11P和图11Q,图中示出了在沿着图11J中装置1160的一个实施方式的各个位置上的横截面。图11O示出了显示样品流动特征1166和1168的横截面。还示出了防交叉流动特征1170和1172。还可以提供接合特征1174来使得零件能够配合在一起,以形成装置160。
图11P示出了将适配器通道1150和1152定位成延伸至样品通道1162和1164中或者至少与之流体连通。可选地,一些实施方式可具有多内腔适配器通道1150或1152。可选地,一些实施方式可以每一样品通道具有多个适配器通道,其中这样的附加通道可以彼此平行、彼此成角度、彼此包裹或者以其他方式相对于彼此定向。
图11Q示出了在一些实施方式中,器皿保持器1140可以成不对称形状(在横截面中)或者以其他方式塑形,以使得在装置1160中仅能以一个定向接收保持器1140。当期望将样品从某个通道引导至选定通道中时,这可能是特别期望的。如果能够以各种定向插入保持器1140,则来自一个通道的样品可能最终位于错误的器皿中。可选地,可以使用其他特征,诸如对准特征、槽、视觉提示、纹理线索等,来促进样品器皿在装置中的优选定向。
集成式组织穿透构件
参考图11R,现将描述样品收集装置的又一实施方式。该样品收集装置1210包括类似于图11G中所示的特征,区别在于它还包括安装至样品收集装置1210的组织穿透构件1212。可以使用诸如但不限于弹簧致动器等致动机构1214来发射该组织穿透构件。图11R示出了处于备用状态的致动机构1214,并且示出其可以是可被压缩以朝向目标组织发射组织穿透构件1212的弹簧。组织穿透构件1212可收容在外壳1216之内(以虚影示出)。在一个实施方式中,外壳1216包括可被剥开、刺穿、释放或以其他方式打开的一部分,用以允许组织穿透构件1212离开外壳但还在组织穿透构件1212的使用之前保持其无菌性。在一些实施方式中,该部分可以是箔、帽、聚合物层等。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
在一个实施方式中,组织穿透构件1212路径可被控制成同时沿着轨迹的“正常”(即,组织穿透构件的向前方向)和“正交”(即,垂直于主运动矢量)。一些实施方式在穿透的最深点(即,返回点)处可不具有硬停止或猛然停止,所述硬停止或猛然停止是自发性疼痛的主要成因。一些实施方式可以使用垫子、凸轮通路或其他非硬止动机构来防止与突然停止的冲击波相关联的疼痛。这样的冲击波即使在组织穿透构件成功地避免了撞击伤口位置附近的神经的情况下也是有害的,这是因为即使避免了直接接触,冲击波仍可激活这样的神经。可选地,一些实施方式可具有遵循非抖动路径的组织穿透构件,以防止粗糙的伤口通道(残痛)。这在一些实施方式中可以通过在与组织穿透构件或者与组织穿透构件相关联的销一起使用的任何引导通路中更严格的容限来实现。当穿透组织时,这可以是非抖动路径。可选地,这可以是组织穿透构件在组织之外和当其处于组织之内时的非抖动路径。这可以减少可导致残痛、持久创伤和瘢痕形成的组织穿透构件的整体运动“摇晃”。
一些实施方式可具有受控的外向速度以防止缓慢和延迟的伤口闭合和术后出血。举非限制性示例而言,组织穿透构件的受控外向速度可由诸如但不限于凸轮或较高摩擦材料等机械机构来控制。
一些实施方式还可包括防弹跳机构以防止可能与在初始伤口产生之后回弹至组织中的不受控的组织穿透构件相关联的意外再刺血。本文的一些实施方式可具有将会接合组织穿透构件或其附接件的“停泊(parking)”机构或锁定机构,以防止组织穿透构件在其一旦从组织中缩出或缩回任何其他期望距离时的重新进入。
刺血针在其开始其外向运动以及返回至其起始位置之前在皮肤中最大深度处停止的急缓度在此设计中是固有问题。在刺血针处于其穿透的最深点处时,对皮肤施加最大量的力。驱动机构简单地从装置的末端反弹,就像球从地板弹回一样。在其内向运动的终点处突然停下来的刺血针向皮肤中传送冲击波,从而导致刺血针附近的许多痛觉感受器激发,即使它们没有被直接冲击。这大幅放大了自发性疼痛。
如前所述,一些实施方式可以使用机械凸轮致动来代替简单的弹簧致动式组织穿透构件。具有凸轮致动设计的装置可使组织穿透构件的“硬停止”最小化。凸轮机构通常是弹簧驱动的,并且一般提供更好的引导致动。组织穿透构件的轨迹经由搭乘在凸轮中的销而被严格控制成经过组织穿透构件保持器的引导路径。凸轮机构允许具有较软返回的预定速度曲线以及对组织穿透构件外向轨迹的明确速度控制。该机构还有效地避免了当该机构到达其运动终止点时刺血针向皮肤中的回弹。此外,当在空气中发射时,刺血针路径在全部两个方向上的机械振荡(或抖动/摆动)均得到减小。本文的一些实施方式还可使驱动机构的任何机械摆动(例如,由于不均匀或粗糙的凸轮槽所造成)最小化,以防止这样的驱动机构摆动由于其“受迫运动曲线”而直接传递到组织中。
可选地,一些实施方式可通过电子控制的驱动机构而使用电子致动。该技术使用与非常准确的位置传感器相耦合的微型化电子马达(例如,音圈、螺线管),从而以精确受控的运动和速度将组织穿透构件移入和移出皮肤。在快速进入之后,装置使组织穿透构件减速至准确的、预设的深度,以便平稳地、无抖动地并且相对较慢地返回。这允许快速的伤口闭合并避免长期创伤。利用该装置,当组织穿透构件前进时,使刺血针穿透到皮肤中所需的力得到控制。组织穿透构件致动“曲线”的严格控制的益处在于可重现的无痛采血,其产出足够并且一致的血液样品用于检测。
就用于血液样品抽取的穿刺部位创建而言,可能期望在患者的非优势手上的手指(无名指或中指)上选出合适的穿刺部位。穿刺部位可位于手指指尖的侧面。在一个非限制性示例中,可能期望将暖手带抵接患者的选定手指保持15秒。可选地,一些实施方式可温暖患者的一个或多个手指达从10到60秒。其他实施方式可温暖手指达更长时间。这样的温暖将会增加通向目标部位的血流量。为了准备目标部位,可能期望用酒精擦拭物或类似的清洁剂来擦拭选定手指的侧尖端或者受试者的表面,从而确保擦拭了选定的穿刺部位。在一些实施方式中,期望等待直到皮肤完全干燥。通常,不用纱布或在指尖吹气来加速干燥。
在已经形成穿刺之后,保持手指向下,低于患者腰部,以便允许血液流动。从指根到指尖轻轻按摩手指,直到形成血滴。通过使装置的尖端触及手指上的血珠而小心地填充血液收集装置。确保装置得到完全填充。一旦填充了血液收集装置,将手指的出血区域按在桌子上的纱布垫上。将血液样品转移到收集器皿中。在手指上放置绷带。将具有样品的器皿放置到冰箱内的运输盒中。将所有供应品丢弃至生物危害锐器器皿中。所有供应品仅供一次性使用。
如果未从第一次穿刺获得足够的血液,则将血液收集装置小心地放置在桌子表面上,确保装置保持水平。在被穿刺的手指上放置绷带。在患者同一只手上的不同手指上选择合适的穿刺部位。如果首先穿刺了无名指,则在中指上选择新的穿刺部位,并且反之亦然。使暖手带抵接患者的选定手指保持60秒。可选地,一些实施方式可温暖患者的一个或多个手指达从30到90秒。这将会增加通向手指的血流量。使用诸如本文的任何样品收集装置之类的样品收集装置来进行血液收集的这些技术可以支持毛细血管血的充足的样品收集,以用于在经临床实验室改进修正案(CLIA)认证的设施和/或标准下的实验室检测。
参考图11S,现将描述样品收集装置1220的又一实施方式。在本实施方式中,可以相对于样品收集装置1220成角度地安装组织穿透构件1222。这种成角度的配置允许组织穿透构件在与一个或多个样品采集开口1103和1105对准的位置上创造伤口。尽管标准的弹簧发射式致动器被示出为用于组织穿透构件1222的驱动机构1224,但应当理解,还可以替代弹簧发射器或与之结合地使用凸轮和/或电驱动系统。当驱动机构1224是弹簧时,可以压缩该弹簧以将组织穿透构件1222移动至发射位置,并且释放弹簧以刺入目标组织中。图11S示出了处于备用位置上的组织穿透构件1222。尽管附图示出了用于驱动机构1224的弹簧,但应当理解,不排除适合用于发射组织穿透构件以在受试者身上创造可愈合伤口的其他驱动机构。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
类似于针对外壳1216所描述的那样,外壳1226可形成于组织穿透构件1222周围。尽管图11S示出了安装在样品收集装置上的两个组织穿透构件1222,但应当理解,不排除具有更多或更少个组织穿透构件的装置。例如,一些实施方式可具有安装至样品收集装置1220的仅一个组织穿透构件1222。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
参考图11T,现将描述样品收集装置1230的另一实施方式。本实施方式示出了组织穿透构件1232被包含于样品收集装置1230内,并且如图11T中所见,其实际上与样品收集装置的中心轴同轴对准。这使组织穿透构件1232定位成用于在靠近开口1103和1105在样品收集装置1230上定位之处的位置上从样品收集装置1230向外延伸。当然,不排除具有更多或更少个开口的装置,并且图11T的实施方式是示例性和非限制性的。图11T示出了在样品收集装置的一个实施方式中,发射按钮1234可安装在样品收集装置1230上。可选地,一些实施方式可具有塑形的前端1236,该前端1236发挥致动按钮的功能,其中当将组织按到前端1236上至特定深度和/或特定压力时,组织穿透构件将会被致动。
一旦发射,组织穿透构件1232如箭头1233所指示那样移动。在一些实施方式中,组织穿透构件1232在致动之前被完全包含在样品收集装置1230内。一些实施方式可具有位于装置1230上的视觉指示器1235,以帮助关于组织穿透构件1232将会从何处离开装置以及大致将会在哪里形成伤口对用户给予指导。
在本非限制性示例中,整个装置1230可处于仅在使用装置1230之前才打开的无菌袋或包装中。以这种方式,可以在使用之前为组织穿透构件和收集装置保持无菌条件。这样的外部无菌袋或包装还可适用于本文任何其他实施方式。图11L还示出了塑形的前端1236(以虚影示出),其可一体形成或者可单独地附接至样品收集装置1230。这样的塑形前端1236可提供吸力以向样品收集装置1230中吸取样品流体。可选地,塑形前端1236可以用于拉伸目标组织和/或迫使其进入塑形前端之中以施加压力从而增加来自由样品穿透构件1232所形成的伤口的样品流体量。应当理解,本文的任何实施方式均可适于具有塑形前端1236。可选地,塑形前端可具有一个或多个选定的疏水区域,以朝向前端上的一个或多个收集区域引导样品流体。可选地,塑形前端可具有一个或多个选定的亲水区域,以朝向前端上的一个或多个收集区域引导样品流体。
参考图11U,现将描述样品收集装置的又一实施方式。本实施方式类似于图11T的实施方式,区别在于图11T的实施方式使用多个组织穿透构件1242而不是单一组织穿透构件诸如刺血针。在一个实施方式中,这些组织穿透构件是相比于传统刺血针具有减小的直径的微针1242。可以为装置1240同时致动多个微针1242,并且在组织上创造多个伤口部位。微针1242的间距可导致更多个毛细血管袢被刺穿并且有更多个通道可用于让血液到达组织表面。这还允许相比于具有尖锐尖端和锥形轮廓的刺血针更“方”的穿透轮廓。这可使微针1242能够在更大的面积上接合更多的毛细血管袢而不向更密集地聚集着神经末梢的更深组织层中穿透过深。
参考图11V和图11W,现将描述样品收集装置的进一步实施方式。在这些附图中所示的实施方式中,可以将样品收集装置1100安装成与专用伤口创造装置1250成角度,该专用伤口创造装置1250具有被配置用于从装置1250向外延伸的组织穿透构件1252。样品收集装置1100可以可选地被配置成具有塑形前端1236(有或者没有用以容纳组织穿透构件1252的开口),其可以可移除地安装至伤口创造装置1250。可选地,样品收集装置1100可以平坦安装至装置1250。可选地,在装置1250上可以存在塑形的切口,用于压配合保持样品收集装置1100。应当理解,不排除用于可移除地安装样品收集装置1100的其他技术。收集装置与伤口创造装置的这样的解耦允许使用更复杂的、可能非一次性的伤口创造装置1250,该装置可以创造出更受控的、减少疼痛的伤口创造体验。
图11W示出了样品收集装置1100可以大致水平地对准,以关于对样品收集的重力作用保持中性。不排除装置1100向伤口创造装置1250的其他安装配置。
参考图11X至图11Z,现将描述各种样品收集装置的进一步实施方式。图11X示出了样品收集装置1240,其中可随装置1240使用塑形前端1236。该塑形前端1236类似于前文所述的塑形前端。可以使用真空源1270来辅助向装置1240中吸入体液样品。真空源1270可连结至装置1240的主体以及/或者连结至塑形前端1236。应当理解,本公开内容中所描述的任何实施方式均可适于与诸如但不限于真空源1270等样品采集辅助装置一起使用。
图11Y示出了样品收集装置的又一实施方式。本实施方式使用具有用于收集样品流体的尖端1280的移液器系统。所述尖端可包括同轴安装的组织穿透构件1282。可选地,示出了侧装的或成角度的组织穿透构件1284以在目标部位处创造伤口。具有尖端1280的移液器系统可应用真空以从受试者身上拉取样品流体。可选地,塑形前端1236可与尖端1280一起使用,以辅助在目标部位处的皮肤拉伸或组织重塑。
图11Z示出了一些实施方式可以使用隔膜1291连结的致动机构来创造真空用于吸取血液样品。这样的连结允许隔膜在组织穿透构件1292从目标部位的回程上创造真空。在一个实施方式中,组织穿透构件1292是微针。组织穿透构件的致动如箭头1294所指示那样发射组织穿透构件1292,并且在返回路径上由于与组织穿透构件1292的运动相连结的隔膜的运动而创造出真空。可以耦合一个或多个器皿1296以容纳由装置1290所收集的流体。一些实施方式可具有仅一个器皿1296。一些实施方式可具有一组器皿1296。一些实施方式可具有多组器皿1296。一些实施方式可外部安装于装置1290上。一些实施方式可内部安装于装置1290中。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
垂直流出限制器
图11E还更清楚地示出了在适配器1150和1152周围存在套筒1156。尽管仅在图11A-图11F中示出,但应当理解,具有或不具有排放孔的套筒可被配置用于与本文所设想的任何实施方式一起使用。如图11E的实施方式中所见,通道可由针所限定。这些套筒1156防止流体样品在器皿1146a和1146b接合针之前从适配器通道1150和1152过早流出。由于所采集的样品流体的小体积,因此防止过早流动减少了与流体从通道向器皿的转移相关联的流体损失量。在一个实施方式中,套筒1156可通过提供不透液体但非不透空气的套筒来使流体损失最小化。如果套筒是不透空气的,则其可能阻碍通道的毛细作用正常发挥作用。可选地,一些实施方式可将排放孔定位于针的基座附近、远离尖端,以使得套筒可在远离排放孔的位置处包含样品。
图11F示出了在示例性实施方式中,套筒1156被配置成具有贯穿该套筒的开口1158。这提供了相比于通常松配合于针之上的传统套筒的改进的实施方式。由于松配合,在传统套筒中,在尖端中和在针与套筒之间的侧壁空间中存在套筒空间,而流体样品可累积于其内。尽管与可能持续损失流体的不带有套筒的针相比,这样设计的套筒可通过将损失限制于限定量来帮助防止流体的较大损失,但沿着尖端和侧壁的套筒区域中累积的流体仍然被损失,并且未由器皿1146a或1146b所收集。套筒1156还可包括变窄区域1176以促进套筒对提供与通道1126和1128的流体连通的装置的接合,诸如但不限于针、探针、管、通道或其他适配器通道1150。
在图11F的实施方式中,基于计算来设置开口1158的大小,所述计算足以承受与来自样品填充部分1120中通道的毛细作用的流动相关联的流体压强。该力允许开口1158在所在处从通道排出空气,并且还防止流体离开套筒,直到器皿1146a和1146b被推动以接合适配器通道1150和1152。由于开口1158创造出的排放作用,可以使套筒侧壁和其他区域比在传统套筒中紧密得多地接合针。这减小了针与套筒之间的间隙空间,并且因此与由于配合的松散性而具有大得多的间隙空间的不具有排放孔洞的套筒相比,使得可能损失的流体量最小化。此外,还可设置开口1158的大小以使得一旦流体到达开口,则开口提供足够的阻力以至于也停止了从通道或针的流出,以使得在此处套筒与针尖端之间的任何间隙中的流体损失为最小。
用于设置开口大小的计算如图12中所示。期望是平衡各个力,以使得存在与限定排放孔的疏水材料相关联的充足的防泄漏力,以便包含样品流体在套筒之外的流出。在图12中,套筒1156的侧壁可以与针直接接触,或者在一些实施方式中,沿着套筒的侧壁可存在间隙。在一个实施方式中,套筒1156包含疏水材料,诸如但不限于热塑性弹性体(TPE)、丁基橡胶、硅氧烷或其他疏水材料。在一个实施方式中,套筒的厚度还将会决定套筒1156中的开口或排放孔1158的侧壁的长度。
开口1158可位于沿着套筒1156的一个或多个位置处。一些实施方式可如图12中所示那样具有开口。或者,一些实施方式可具有位于套筒的侧壁上的开口1158。不排除其他位置。可选地,套筒1156可具有多个开口,该多个开口贯穿该套筒,但被配置成使得流体不从套筒离开并且来自开口的阻力足以防止从通道的额外流出,直到器皿1146a或1146b与通道接合且流体连通。
关于如何使用装置1100来收集样品而言,在一种技术中,使样品收集装置1100保持接合目标体液并且将其保持就位,直至达到期望的填充水平。在此期间,可以水平地保持装置1100以使在更垂直地保持装置1100的情况下将会需要克服的重力最小化。在达到填充水平之后,可以将装置1100从目标流体脱开,并且继而接合器皿1146a和1146b以向器皿中吸入收集到的流体。可选地,可以保留装置1100与目标流体相接触,并且将器皿接合成与通道流体接触,以使得填充将会在通道中吸入流体以及可能还吸入残留在目标部位处的任何额外的样品流体。这可以确保向器皿中吸入足够的体液。
在填充了器皿1146a和1146b之后,可以准备容器用于装运。可选地,可以在运送之前将它们送去进行预处理。器皿1146a和1146b的一些实施方式包括器皿中的一种密度的材料,以使得在诸如离心分离等预处理之后,该材料由于其选定的密度而将会使经离心分离的样品的一部分与同一器皿中的经离心分离的样品的另一部分相分离。
容器1146a或1146b可在其中具有真空和/或负压。当通道被带至与真空器皿流体连通时,样品可被吸入至器皿中。可选地,器皿可采取试管状装置的形式,具有由新泽西州East Rutherford的Becton-Dickinson Company以“Vacutainer”商标销售的那些装置的性质。当样品正被转移至器皿中时,装置可保持处于压缩状态而基座1140关闭间隙1154。样品可以填充整个器皿或器皿的一部分。来自通道的全部样品(和/或样品的90%、95%、97%、98%、99%、99.5%或99.9%以上)可被转移至器皿。或者,可以仅将来自通道的样品的一部分转移至器皿。
在如本文所描述的一个实施方式中,样品流体向样品收集装置1100中的两阶段填充允许:i)样品流体的计量收集以确保在经处理以防止过早凝结的收集通道中获得足够的量,以及继而ii)向器皿中转移高百分比的样品流体的有效方式。用以向器皿1146中计量最小量的样品流体的这种从预填充通道对器皿的低损失填充提供了多种优点,特别是当应对收集小体积的样品流体时尤为如此。将通道预填充至期望的水平确保了器皿中存在足够的体积以对样品流体进行期望的检测。
如本文所描述,包括样品填充部分1120、支架1130和基座1140在内的整个装置是完全透明或半透明的,以允许对其中的组件的可视化。可选地,样品填充部分1120、支架1130和基座1140中的仅一个是完全透明或半透明的。可选地,仅样品填充部分1120、支架1130或基座1140的选定部分是透明或半透明的。用户可继而基于样品流体填充的进度和样品器皿向样品填充部分1120中的通道的接合而更准确地确定在何时执行各个程序。在填充期间收集通道中的气泡可以是可见的,并且如果看到气泡,则用户可以调整样品收集装置1100的位置以更好地接合目标样品流体,从而使吸入至通道中的空气最小化。其还将会允许用户知道当填充完成时在何时解脱或脱开诸如基座或器皿保持器1140等零件。
应当理解,可以使用其他方法以在装置被保持于非水平角度(诸如但不限于以垂直方式向下)的情况下防止从适配器通道1150和1152向外的样品流动。在一个实施方式中,熔块1194可与具有中心孔的针一起使用,所述针用作适配器通道1150和1152。熔块可以位于样品收集装置的主体内或收集容器上。在一些实施方式中,熔块包含诸如但不限于PTFE等材料。可选地,一些实施方式可以使用在发挥适配器通道1150和1152的功能的针上的胶带/粘合剂。在一个实施方式中,可以使用胶带和/或粘合剂来覆盖针开口以防止样品的过早排出。可选地,一些实施方式可具有这样的适配器通道1150和1152:其具有疏水表面以防止从通向样品器皿的适配器通道开口的受控外流。在一些实施方式中,适配器通道1150和1152是仅在出口附近的内表面上具有疏水材料的针。可选地,疏水材料仅位于出口附近的针的外表面上。可选地,疏水材料位于针的内表面和外表面上。可选地,防止向下流动的另一方法是通过改变横截面来增大毛细管的表面积。举非限制性示例而言,一些实施方式可在毛细管内引入齿状或指状结构,以便增大毛细管的横截面中的表面积。可选地,一些实施方式可包括毛细管内朝向和/或背向流体流动的翅片,以便增大毛细管的横截面中的表面积。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
通向多个通道的一个样品收集器位置
参考图13A-图13B,现将描述如本文所描述的又一实施方式。图13A示出了具有单一收集位置1322的样品填充部分1320的俯视图,所述单一收集位置为诸如但不限于两个通道1324和1326相遇以将流体从该单一样品收集位置1322吸离之处的收集孔。可选地,一些实施方式可使用Y形分开通道配置,其中仅单一通道通向远离收集位置1322之处并且在已成为通向远离收集位置1322之处的单一公共通道之后继而分成通道1324和1326。提供向通道1324和1326的流体连通的构件,诸如但不限于针、探针、管、通道、中空细长构件或其他结构等,可以耦合至样品填充部分1320的一端。
图13B示出了侧剖视图,其中示出了收集位置1322并且其与通道1326流体连通,而通道1326转而与诸如但不限于流体连通构件等适配器通道1352流体连通。在一些实施方式中,流体连通构件可具有足够的刚度和充分穿透的尖端以穿刺隔膜、帽或器皿的其他结构。一些实施方式可具有适配器通道1352、1150等不取芯结构,以便不在器皿的隔膜、帽或其他结构中留下将不会密封的孔洞。
如图13B中所见,由液滴D所指示,样品流体可被施加至或滴入收集位置1322中。可选地,一些实施方式可直接施加或直接接触收集位置1322以施加样品流体。尽管本文的实施方式被示出为仅使用单一收集位置1322,应当理解,还预想到其中多个通道耦合至公共样品收集点的其他实施方式。举非限制性示例而言,收集装置的一个实施方式可具有两个收集位置1322,每个具有其自己的一组通道通向远离其相应收集位置之处。一些实施方式可将图13A-图13B中所示的公共收集点通道与诸如图11A-图11F中所示的分离的通道组合起来。不排除公共收集位置结构与具有分离的通道的其他结构的其他组合。
图13B还示出了本实施方式可包括被配置用于从收集位置1322向外延伸的一个或多个组织穿透构件1327。在一个实施方式中,这使得用户能够将目标组织同时放置在收集位置1322和伤口创造位置上以供流体样品采集。可选地,可以定位触发器1323以发射组织穿透构件。可选地,将触发器内置于装置的组织接口中,以在接触目标组织以及/或者在充足的压力或接触就位时支持装置的发射。这两个位置的这种重叠允许让用户遵循以便成功采集样品的简化方案。一个或多个组织穿透构件1327可由一种或多种致动技术所致动,所述技术诸如但不限于弹簧致动、弹簧/凸轮致动、电子致动或上述各项的单个或多个组合。应当理解,诸如但不限于真空源、组织拉伸装置、组织接合管嘴等其他辅助方法亦可单独或与任何前述方法组合使用以改进样品采集。
参考图13C,现将描述样品收集装置的进一步实施方式。本实施方式示出了筒匣1400,其具有集成于其中的样品收集装置1402。存在收集位置1322以及一个或多个样品开口1325和1329,其中可以继而在位置1322处访问样品收集,诸如但不限于通过移液器尖端(未示出)处理。来自液滴D的样品将会如箭头所指示,沿着通路1326朝向开口1325和1329行进,其中位于开口中以及通向其相应开口1325和1329的通路1324和/或1326中的任何样品被吸入至移液器P中。如移液器P附近的箭头所指示,移液器P在至少一个轴上可移动以支持样品流体向一个或多个期望位置的运送。在本实施方式中,筒匣1400可具有多个针对试剂、冲洗流体、混合区域、温育区域等的容纳器皿1410。可选地,筒匣1400的一些实施方式可以不包括任何容纳器皿,或者可选地,仅包括一类或两类容纳器皿。可选地,在一些实施方式中,容纳器皿可以是移液器尖端。可选地,在一些实施方式中,容纳器皿是这样的移液器尖端:其经处理以在尖端表面(通常是尖端内表面,但不排除其他表面)上包含一种或多种试剂。可选地,筒匣1400的一些实施方式可仅包括样品收集装置1402而不包括组织穿透构件,或者反之亦然。
现参考图13D,图中示出了图13C的实施方式的侧剖视图。可选地,可以包括样品穿透构件1327以供伴随创造用于要在位置1322处收集的样品流体的伤口使用。
图14示出了样品填充部分1320可与支架1330和1340相联结以形成样品收集装置1300。可以存在可视化窗口1312,以便查看样品流体是否已经达到期望的填充水平。可以包括施力组件,诸如弹簧1356或橡皮带。通道保持器可使通道保持固定至支架。在一个实施方式中,保持器可防止通道相对于支架滑动。其可以使用压配合、机械紧固、粘合剂或其他附接技术以耦合至通道。保持器可以可选地提供可让诸如弹簧等施力组件居于其上的支架。
在一个示例中,接合组装件可包括弹簧1356,该弹簧可施加力以使得当弹簧处于其自然状态时,基座1340处于伸展状态。当基座处于其伸展状态时,可在器皿1346a、1346b与接合组装件之间提供空间。在一些情况下,当基座1340处于其伸展状态时,通道的第二端可以接触或者可以不接触器皿的帽。流体连通构件1352的第二端可处于它们与器皿内部不流体连通的位置上。
将支架1330和基座1340放在一起将会在构件1352穿透器皿上的帽时将通道1324和1326带至与器皿1346a和1346b流体连通,并从而向器皿1346a和1346b中吸入样品流体。
器皿1346a或1346b可在其中具有真空和/或负压。当通道被带至与真空器皿流体连通时,样品可被吸入至器皿中。装置可保持在压缩状态,而基座1340被定位成使得当样品流体正在被转移至器皿时,器皿与通道1326和1328流体连通。样品可填充整个器皿或器皿的一部分。来自通道的全部样品(和/或样品的90%、95%、97%、98%、99%、99.5%或99.9%以上)可被转移至器皿。或者,可以将来自通道的样品的仅一部分转移至器皿。
如图15中所见,在如本文所描述的一个实施方式中,样品流体向样品收集装置1300中的两阶段填充允许:i)样品流体的计量收集以确保在经处理以防止过早凝结的收集通道中获得足够的量,以及继而ii)向器皿中转移高百分比的样品流体的有效方式。用以向器皿1346中计量最小量的样品流体的这种从预填充通道对器皿的低损失填充提供了多种优点,特别是当应对收集小体积的样品流体时尤为如此。将通道预填充至期望的水平确保了器皿中存在足够的体积以对样品流体进行期望的检测。
参考图16和图17,现将描述进一步的实施方式。图16示出了血液收集装置1300,其在收集位置1322周围具有次级收集区域1324。次级收集区域1324可用于将任何溢出的、洒出的或错误引导的流体样品朝向收集位置1322引导。
图17进一步示出了器皿1346a和1346b可各自具有与器皿1346a和1346b相关联的标识物。图17示出了在一个非限制性示例中,标识物1600和1602可为以下各项中的至少一项:条形码(例如,1-D、2-D或3-D)、快速响应(QR)码、图像、形状、单词、数字、字母数字串、颜色或其任意组合,或者任何类型的视觉标识物。其他实施方式可以使用不在可见光谱中的标识物。其他实施方式可以使用RFID标签、RF标识物、IR发光标签,或者不依赖于通过经可见光谱发送的信号的标识的其他标记物。
标识物1600和1602可以用于标识样品收集装置中的样品和/或样品类型。每一器皿可存在一个或多个标识物。一些实施方式还可在器皿保持器上使用标识物。标识物可以标识样品收集装置、装置内的一个或多个单个器皿,或者装置的组件。在一些情况下,可以运输样品收集装置、样品收集装置的一部分和/或器皿。在一个示例中,可以经由递送服务或本文其他各处所描述的任何其他服务来运输样品收集装置、样品收集装置的部分。可以递送样品以对样品执行一种或多种检测。
可以追踪样品身份和/或提供样品的个体的身份。可以包括与提供样品的一个或多个个体相关联的信息(例如,姓名、联系信息、社会保险号、出生日期、保险信息、账单信息、病史)以及样品提供者的其他信息。在一些情况下,可以追踪样品的类型(例如,全血、血浆、尿等)。还可以追踪样品将会遇到的试剂的类型(例如,抗凝剂、标记物等)。可以考虑关于样品收集的附加信息,诸如收集日期和/或时间、样品收集时所处的环境、要对样品进行的检测类型、保险信息、医疗记录信息或任何其他类型的信息。
标识物可辅助于追踪这样的信息。标识物可与这样的信息相关联。这样的信息可储存在样品收集装置之外、样品收集装置之内或其任意组合。在一些情况下,所述信息可储存在一个或多个外部装置上,所述外部装置诸如为服务器、计算机、数据库或具有存储器的任何其他装置。在一些情况下,所述信息可储存在云计算基础设施上。储存信息的一个或多个资源可分布在云上。在一些情况下,可以提供点对点基础设施。所述信息可储存在标识物本身之中,或者可以在别处与标识物相关联,或者是其任意组合。
标识物可提供唯一标识,或者可以提供高的提供唯一标识的可能性。在一些情况下,标识物可以具有可视组件。标识物可以是光学可检测的。在一些情况下,标识物可以是可使用可见光来辨识的。在一些示例中,标识物可以是条形码(例如,1-D、2-D或3-D)、快速响应(QR)码、图像、形状、单词、数字、字母数字串、颜色或其任意组合,或者任何类型的视觉标识物。
在其他实施方式中,标识物可以是可经由任何其他种类的辐射来光学检测的。例如,标识物可以是可经由红外线、紫外线或任何其他类型的电磁谱波长来检测的。标识物可以利用发光,诸如荧光、化学发光、生物发光或任何其他类型的光发射。在一些情况下,标识物可以是无线电发射器和/或接收器。标识物可以是射频识别(RFID)标签。标识物可以是任何类型的无线发射器和/或接收器。标识物可以发送一个或多个电信号。在一些情况下,GPS或其他位置相关信号可与标识物一起使用。
标识物可以包括音频组件或声学组件。标识物可以发出声音,该声音可以是可辨识的,以便唯一地标识所标识的组件。
标识物可以是可经由光学检测装置来检测的。例如,条形码扫描仪可以能够读取标识物。在另一示例中,相机(例如,用于静止图像或视频图像的相机)或其他图像捕捉装置可以能够捕捉标识物的图像并且分析该图像以确定标识。
图16和图17示出了根据本文所描述的实施方式的、被提供用于与样品收集装置1300一起使用的标识物的示例。在一个示例中,样品收集装置可包括基座1340,该基座1340可支撑和/或包含一个或多个器皿1346a、1346b。可以向样品收集装置提供样品。可以经由入口1322向样品收集装置提供样品。样品可行进至装置内的一个或多个器皿1346a、1346b。
可以在样品收集装置上提供一个或多个标识物1600、1602。在一些实施方式中,标识物可定位于样品收集装置的基座1340上。标识物可定位于基座的底部表面、基座的侧表面或基座的任何其他部分上。在一个示例中,基座可具有平坦的底部表面。标识物可位于该基座的平坦底部表面上。可以在基座中提供一个或多个凹陷。标识物可位于该凹陷内。凹陷可位于该基座的底部表面或侧表面上。在一些实施方式中,基座可包括一个或多个凸起。标识物可位于该凸起上。在一些情况下,可以在基座的外表面上提供标识物。标识物可以备选地定位于基座的内表面上。可以从样品收集装置外部检测标识物。
在一些实施方式中,标识物可提供于器皿1346a、1346b上。标识物可位于器皿的外表面上或者器皿的内表面上。标识物可以是可从器皿外部检测的。在一些实施方式中,可以在器皿的底部表面上提供标识物。
在一个示例中,基座可包括光透射部分。所述光透射部分可以位于基座的底部或基座的侧面上。例如,可以提供透明或半透明窗口。在另一示例中,光透射部分可以是无需窗口的孔洞。光透射部分可允许基座内的部分可见。标识物可以在光透射部分上提供于基座的外表面上,提供于基座的内表面上但可通过光透射部分而可见,或者提供于器皿的外表面或内表面上但可通过光透射部分而可见。在一些情况下,可以在器皿的内表面上提供标识物,但器皿可以是光透射的,以便可以通过器皿和/或光透射部分来观察标识物。
标识物可以是QR码或者是可从样品收集装置的外部光学可见的其他光学标识物。QR码可以是通过在样品收集装置的基座的底部的光学窗口或孔洞可见的。QR码可提供于样品收集装置基座上或者通过基座可见的器皿的一部分上。诸如相机或扫描仪等图像捕捉装置可以提供于样品收集装置外部,并且可以能够读取QR码。
单个或多个QR码或其他标识物可提供于样品收集装置上。在一些情况下,每个器皿可具有至少一个标识物,诸如与其相关联的QR码。在一个示例中,可以在基座中为每一器皿提供至少一个窗口,并且每个窗口可允许用户观察QR码或其他标识物。例如,两个器皿1346a、1346b可被收容于基座1340内,其中每个器皿具有可从样品收集装置外部辨识的关联的标识物1600、1602。
基座1340可以是可与支架1330或样品收集装置的其他部分相分离的。一个或多个标识物可连同基座一起从样品收集装置的其余部分分离。
在一些实施方式中,标识物可随由基座所收容的器皿一起提供。将基座与样品收集装置的其余部分相分离可以致使器皿与样品收集装置的其余部分相分离。器皿可保留在基座内或者可从基座移除。即使从基座中移除器皿,标识物仍可与器皿保留在一起。或者,即使器皿被移除,标识物仍可与基座保留在一起。在一些情况下,基座和器皿均可具有标识物,以使得器皿和基座甚至在分离时仍可被单个地追踪和/或匹配。
在一些情况下,可以在样品收集装置内提供任何数目的器皿。样品器皿可以能够接收来自受试者的样品。每个样品器皿可具有唯一标识物。唯一标识物可与涉及样品、受试者、装置或装置的组件的任何信息相关联。
在一些情况下,每个器皿的每个标识物可以是唯一的。在其他实施方式中,器皿上的标识物无需是唯一的,但对于装置、对于受试者或者对于样品类型可以是唯一的。
样品收集装置可以接收来自受试者的样品。受试者可以直接接触样品收集装置或者向该装置提供样品。样品可通过装置行进至装置内的一个或多个器皿。在一些情况下,可在样品到达器皿之前对其进行处理。可以在可将样品输送至器皿的样品收集单元和/或通道内提供一个或多个涂层或物质。或者,在样品到达器皿之前不对样品提供处理。在一些实施方式中,在器皿内可以处理或者可以不处理样品。在一些情况下,在样品到达器皿之前或之时,可以对样品提供多个不同类型的处理。可以按预选顺序提供处理。例如,首先期望第一处理,并且其可被提供于第二处理的上游。在一些情况下,不在任何点处理样品。
在一些实施方式中,样品可以是血液样品。第一器皿可以接收全血,而第二器皿可以接收血浆。可以沿着流体路径和/或在器皿中提供抗凝剂。
一旦已经向器皿提供了样品并且器皿已被密封,则可以将器皿送往单独的地点用于样品分析。所述单独地点可以是实验室。单独地点可以是相对于样品收集场所的远程设施。可以将整个样品收集装置送往单独地点。一个或多个标识物可提供于样品收集装置上,并且可以用于识别样品收集装置和/或在其中的器皿。或者,基座1340可从样品收集装置移除,并且可随其中的器皿被送往单独地点。一个或多个标识物可提供于基座上,并且可以用于识别基座和/或在其中的器皿。在一些情况下,器皿可从基座移除并且可被送往单独地点。一个或多个标识物可提供于每个器皿上,并且可以用于识别器皿。
标识物可通过任何合适的技术来读取。通过示例而非限制的方式而言,在一些情况下,使用诸如图像捕捉装置或条形码扫描仪等光学检测器来读取标识物。在一个示例中,图像捕捉装置可以捕捉QR码的图像。可以追踪关于器皿的信息。例如,当器皿到达某一地点时,可以扫描标识物,并且可以保留器皿到达的记录。可以主动和/或被动地更新器皿的进展和/或位置。在一些情况下,可能需要有意地扫描标识物以便确定器皿的位置。在其他示例中,标识物可以主动发射可由信号读取器拾取的信号。例如,当标识物经过建筑物时,信号读取器可以追踪标识物的位置。
在一些情况下,读取标识物可以允许用户获取与标识物相关联的附加信息。例如,用户可以使用某种装置来捕捉标识物的图像。该装置或另一装置可以显示关于样品、受试者、装置、装置的组件的信息或者本文其他各处所描述的任何其他信息。可以包括关于所要进行的检测和/或检测结果的信息。用户可以基于与标识物相关联的信息,对样品执行后续检测或行动。例如,用户可以将器皿引导至适当位置用于检测。在一些情况下,能够以无需人工干预的自动化方式将器皿引导至适当位置和/或对器皿的内容物进行适当的样品处理(例如,样品制备、测定、检测、分析)。
关于样品处理的信息可被收集并被关联于标识物。例如,如果器皿具有标识物,并且已经对器皿的内容物执行了样品处理,则可以储存响应于样品处理而产生的一个或多个信号并且/或者将其与标识物相关联。这样的更新能够以无需人工干预的自动化方式进行。或者,用户可以开始信息的储存,或者可以手动输入信息。因此,能够以自动化方式聚合关于受试者的医疗记录。标识物可以用于索引和/或访问关于受试者的信息。
样品器皿
图18A-图18B示出了根据本文所描述的实施方式的样品器皿1800的非限制性示例,该样品器皿1800可与样品收集装置一起使用。在一些情况下,样品器皿可由样品收集装置所支撑。可选地,样品器皿可由样品收集装置的一部分所包含或包围。在一个示例中,样品收集装置可具有第一配置,其中样品器皿被完全封闭。可以提供第二配置,其中样品收集装置可以是敞开的,并且可以暴露出样品器皿的至少一部分。在一些示例中,样品器皿可由样品收集装置的保持器所支撑和/或至少部分地由其封闭。保持器可以是可与样品收集装置的其余部分相分离的,从而提供对其中的样品器皿的进入。
在体液样品收集的情况下,可使用诸如但不限于在2012年9月6日提交的美国专利申请序列号61/697,797和在2013年3月15日提交的美国专利申请序列号61/798,873中所描述的样品收集装置,从患者抽取样品流体,上述文献均通过引用而全文并入于此用于所有目的。在血液样品的非限制性示例中,一些实施方式可以通过收集来自受试者的毛细血管血来收集血液样品。这可通过通往来自受试者的毛细血管血的伤口、穿透部位或其他进入部位的方式而发生。可选地,还可通过静脉穿刺或其他血管穿刺来收集血液,以获得用于装载到一个或多个样品器皿中的血液样品。例如,可以由被配置用于通过静脉穿刺进行小体积的血液收集的装置来收集血液。这样的装置例如可以包括与具有较小内部容积的器皿流体连接或能够与其流体连接的空心针。所述具有较小内部容积的器皿可具有例如等于或不超过5ml、4ml、3ml、2ml、1ml、750l、500l、400l、300l、200l、100l、90l、80l、70l、60l、50l、40l、30l、20l、10l或5l的内部容积。不排除用于收集体液的其他类型的装置和技术。
可通过多种方式从受试者身上吸取体液并将其提供给装置,所述方式包括但不限于:手指针刺、切开、注射、抽吸、擦拭、移液、静脉抽血、静脉穿刺和/或本文其他各处所描述的任何其他技术。在一些实施方式中,可从受试者的呼吸收集样品。可使用体液收集器来提供体液。体液收集器可包括刺血针、毛细管、管、移液器、注射器、针、微针、泵或本文其他各处所描述的任何其他收集器。在一些实施方式中,样品可以是可从受试者提供的组织样品。样品可从受试者身上移除或者可以是已经被受试者抛弃的。
在一个实施方式中,刺血针穿刺受试者的皮肤并例如使用重力、毛细作用、吸取、压差或真空力抽取样品。刺血针或任何其他体液收集器可以是装置的一部分、装置的筒匣的一部分、系统的一部分或独立组件。在需要时,可通过多种机械的、电气的、机电的或任何其他已知的启用机制或此类方法的任何组合来启用刺血针或任何其他体液收集器。
在一个示例中,可穿刺受试者的手指(或受试者身体的其他部位)以获得体液。体液可使用毛细管、移液器、拭子、滴剂或本领域已知的任何其他机制来收集。毛细管或移液器可以与装置和/或装置的筒匣相分离,或者可以是装置和/或筒匣的一部分,所述筒匣可插入到装置内或附接至装置。在不需要启用机制的另一实施方式中,受试者可简单地向装置和/或筒匣提供体液,例如,用唾液样品提供体液。
可以通过多种方式从受试者吸取体液并将其提供给装置,所述方式包括但不限于:手指针刺、切开、注射和/或移液。可使用静脉方法或非静脉方法收集体液。可使用体液收集器提供体液。体液收集器可包括刺血针、毛细管、管、移液器、注射器、静脉抽血器或本文其他各处所描述的任何其他收集器。在一个实施方式中,刺血针穿刺皮肤并例如使用重力、毛细作用、吸取或真空力抽取样品。刺血针可以是装置的一部分、装置的筒匣的一部分、系统的一部分或独立组件。在需要时,可通过多种机械的、电气的、机电的或任何其他已知的启用机制或此类方法的任何组合来启用刺血针。在一个示例中,可穿刺受试者的手指(或受试者身体的其他部位)以获得体液。受试者身体的其他部位的示例可包括但不限于:受试者的手、手腕、手臂、躯干、腿、脚或颈部。体液可使用毛细管、移液器或本领域已知的任何其他机制来收集。毛细管或移液器可以与装置和/或筒匣相分离,或者可以是装置和/或筒匣的一部分。在不需要启用机制的另一实施方式中,受试者可简单地向装置和/或筒匣提供体液,例如,可用唾液样品进行提供。收集的体液可放置在装置内。体液收集器可附接至装置、可移除地附接至装置或者可以与装置分开提供。
从受试者获得的样品可储存在样品器皿1800中。在本文所描述的一个实施方式中,样品器皿1800包括主体1810和帽1820。在一些情况下,样品器皿主体的至少多个部分可由透明或半透明材料形成。样品器皿主体可允许被提供于样品器皿主体内的样品在从样品器皿之外观察时可见。样品器皿主体可以是光透射的。样品器皿主体可以由可允许电磁辐射穿过的材料形成。在一些情况下,样品器皿主体可以由可允许选定波长的电磁辐射穿过而不允许其他非选定波长的电磁辐射穿过的材料形成。在一些情况下,主体的一部分或整个主体可以由沿着电磁辐射的选定波长(诸如可见光的波长)不透明的材料形成。可选地,可以塑形样品器皿主体的一些部分以提供一定的光路长度。可选地,可以塑形样品器皿主体的一些部分以提供平坦表面(外表面和/或内表面)或其他结构来允许在样品处于样品器皿中的同时对其进行分析。
在一个实施方式中,可以在样品器皿主体1810上提供开放端和封闭端。开放端可以是样品器皿1800的顶端1812,其可以处于可被配置用于与帽相接合的一端。封闭端可以是样品器皿的底端1814,其可处于与帽相对的样品器皿的一端。在备选实施方式中,底端也可以是可使用底板关闭的开放端。在一些实施方式中,顶端和底端的横截面积和/或形状可以基本上相同。或者,顶端的横截面积可以大于底端的横截面积,或者反之亦然。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
在一个实施方式中,样品器皿主体可具有内表面和外表面。样品器皿主体的表面可以是光滑的、粗糙的、有纹理的、有刻面的、闪亮的、阴暗的、包含凹槽、包含凸脊或者具有任何其他特征。可以处理样品器皿主体的表面以提供期望的光学性质。内表面和外表面可具有相同的性质或者可以不同。例如,外表面可以是光滑的而内表面是粗糙的。
可选地,样品器皿主体可具有管状的形状。在一些情况下,样品器皿主体可具有圆柱形部分。在一些情况下,样品器皿可具有圆形的横截面形状。或者,样品器皿可具有任何其他横截面形状,所述形状可以包括椭圆形、三角形、四边形(例如,正方形、矩形、梯形、平行四边形)、五边形、六边形、七边形、八边形或任何其他形状。样品器皿的横截面形状可以具有或者可以不具有凸形和/或凹形。样品器皿的横截面形状可以沿着样品器皿的长度保持相同,或者可以变化。样品器皿可沿着主体的长度具有棱柱形状。棱柱可具有如本文所描述的横截面形状。
可选地,样品器皿的底部1814可以是平坦的、锥形的、圆润的或其任意组合。在一些情况下,样品器皿可具有半球形底部。在其他实施方式中,样品器皿可具有带有平坦部分的圆润底部。样品器皿可以能够或者可以不能够竖立于其自身的平坦表面上。
在一个实施方式中,样品器皿1800的尺寸可设置为包含小流体样品。在一些实施方式中,样品器皿可被配置用于包含不超过约5ml、4ml、3ml、2ml、1.5mL、1mL、900uL、800uL、700uL、600uL、500uL、400uL、300uL、250uL、200uL、150uL、100uL、80uL、50uL、30uL、25uL、20uL、10uL、7uL、5uL、3uL、2uL、1uL、750nL、500nL、250nL、200nL、150nL、100nL、50nL、10nL、5nL、1nL、500pL、300pL、100pL、50pL、10pL、5pL或1pL。举非限制性示例而言,样品器皿可在其上具有信息存储单元,诸如针对图18F和图18G所讨论的。在一个非限制性示例中,样品器皿100可容纳液体形式的小体积的样品流体,而不使用芯吸材料、筛、固体基质等以在运输期间容纳样品流体。这允许基本上以液体形式从样品器皿移除样品流体,而没有由于液体被芯吸材料或其他材料吸收所造成的样品或样品完整性的损失。
可选地,样品器皿1800可被配置用于包含不超过若干滴血液、一滴血液,或者不超过一滴血液的一部分。例如,样品器皿可具有不大于其被配置用于包含的流体样品量的内部容积。具有小容积样品器皿可有利地允许在小体积内对大量样品器皿的存储和/或运输。这可减少用于储存和/或运输样品器皿的资源。例如,可能需要较少的存储空间。此外,可以使用较少的成本和/或燃料来运输样品器皿。对于相同量的努力,可以运输更多数目的样品器皿。
在一些实施方式中,样品器皿1800可具有小长度。例如,样品器皿长度可以不大于8cm、7cm、6cm、5cm、4cm、3.5cm、3cm、2.5cm、2cm、1.7cm、1.5cm、1.3cm、1.1cm、1cm、0.9cm、0.8cm、0.7cm、0.6cm、0.5cm、0.4cm、0.3cm、0.2cm、0.1cm、700um、500m、300um、100um、70um、50um、30um、10um、7um、5um、3um或1um。在一些情况下,样品器皿的最大尺寸(例如,长度、宽度或直径)可以不大于8cm、7cm、6cm、5cm、4cm、3.5cm、3cm、2.5cm、2cm、1.7cm、1.5cm、1.3cm、1.1cm、1cm、0.9cm、0.8cm、0.7cm、0.6cm、0.5cm、0.4cm、0.3cm、0.2cm、0.1cm、700um、500m、300um、100um、70um、50um、30um、10um、7um、5um、3um或1um。
样品器皿1800可具有任何横截面积。横截面积可以不大于约16cm2、8cm2、7cm2、6cm2、5cm2、4cm2、3.5cm2、3cm2、2.5cm2、2cm2、1.5cm2、1cm2、0.9cm2、0.8cm2、0.7cm2、0.6cm2、0.5cm2、0.4cm2、0.3cm2、0.2cm2、0.1cm2、0.07cm2、0.05cm2、0.03cm2、0.02cm2、0.01cm2、0.5cm2、0.3cm2或0.1cm2。沿着样品器皿的长度,横截面积可以保持相同或者可以变化。
样品器皿1800可具有任何厚度。厚度可以沿着样品器皿的长度保持相同或者可以变化。在一些情况下,厚度可被选择以及/或者可以变化以便提供期望的光学性质。在一些情况下,厚度可以不大于5mm、3mm、2mm、1mm、700um、500um、300um、200um、150um、100um、70um、50um、30um、10um、7um、5um、3um、1um、700nm、500nm、300nm或100nm。
在一个实施方式中,样品器皿1800可具有有利于支持小体积血液样品的离心分离的形状。这允许直接将样品器皿中的所收集样品带至离心机,而不必进一步将样品流体转移至离心机装置中使用的又一样品器皿。
可选地,样品器皿可包含帽1820。帽1820可被配置用于配合于样品器皿的开放端之上。帽可阻塞样品器皿的开放端。帽可以流体密封样品器皿。帽可以与样品器皿主体形成不漏流体的密封。例如,帽可以是不透气体和/或不透液体的。或者,帽可允许某些气体和/或液体穿过。在一些情况下,帽可以是透气而不透液体的。帽对于样品可以是不可渗透的。例如,帽对于全血、血清或血浆可以是不可渗透的。
可选地,帽可被配置用于以任何方式与样品器皿主体相接合。例如,帽可与样品器皿主体压配合。摩擦配合和/或过盈配合可允许帽停留在主体上。在其他示例中,可以提供锁定机构,诸如滑动机构、夹具、紧固件或其他技术。在一些情况下,帽和/或样品器皿主体可以带有螺纹以允许螺杆式接合。在其他示例中,可以利用粘合剂、焊接、软焊、硬焊来将帽连接至样品器皿主体。帽可以可移除地附接至样品器皿主体。或者,帽可以永久固定至样品器皿主体。
在一些情况下,帽的一部分可配合至样品器皿主体的一部分中。帽可与样品器皿主体形成塞子。在一些情况下,样品器皿主体的一部分可配合至帽的一部分中。插塞可以包括可笼罩于样品器皿主体的一部分之上的凸缘或搁板。凸缘或搁板可防止帽滑入样品器皿主体中。在一些情况下,帽的一部分可覆在样品器皿主体的顶部和/或侧面之上。可选地,一些实施方式可包括器皿组装件中的附加部件,诸如帽保持器。在一个实施方式中,帽保持器的用途是维持帽与样品器皿之间的紧密密封。在一个实施方式中,帽保持器接合附接件、凸缘、凹陷或位于样品器皿外部上的其他附接位置,以将帽保持在适当位置。可选地,一些实施方式可同时将帽和帽保持器的功能组合到一个组件中。
在一些实施方式中,样品器皿主体可由刚性材料形成。例如,样品器皿主体可由诸如聚丙烯、聚苯乙烯或丙烯酸类等聚合物形成。在备选实施方式中,样品器皿主体可以是半刚性的或柔性的。样品器皿主体可由单一整体件形成。或者,可以使用多个零件。所述多个零件可由相同材料或者由不同材料形成。
可选地,样品器皿帽可由弹性体材料或者本文其他各处所描述的任何其他材料形成。在一些情况下,帽可由橡胶、聚合物或者可以是柔性的和/或可压缩的任何其他材料形成。或者,帽可以是半刚性的或刚性的。样品器皿帽可由高摩擦材料形成。样品器皿帽可以能够摩擦配合以与样品器皿主体相接合。当样品器皿帽与样品器皿主体相接合时,可形成不漏流体的密封。样品器皿主体的内部可以与周围空气流体隔离。在一些情况下,帽和/或接触该帽的样品器皿主体的部分中的至少一个可由高摩擦和/或可压缩材料形成。
在一些实施方式中,帽1820可以是样品器皿的开放端中的密封接合中的针和/或套管可穿透的自密封式气密闭合,以便保持样品器皿内的真空和/或封闭的气氛。在一些实施方式中,样品器皿的内部仅处于部分真空而不是完全真空。过度的真空可能损坏在样品流体中的形成的血液组分。举非限制性示例而言,部分真空的范围为完全真空的约50%至60%。可选地,部分真空不超过完全真空的约60%。可选地,部分真空不超过完全真空的约50%。可选地,部分真空不超过完全真空的约40%。举非限制性示例而言,部分真空的范围为完全真空的约10%至约90%,或者在完全真空的约20%至约70%之间或者约30%至60%之间。举非限制性示例而言,部分真空的范围为完全真空的约10%至约60%,或者在完全真空的约20%至约50%之间或者约30%至50%之间。以这种方式,对体液样品施加减小量的力以使得关于样品完整性的问题最小化。可选地,在样品转移之后,所述气氛处于环境压强下。可选地,在样品转移之后,所述气氛处于某一部分真空下。可选地,多个样品器皿中的仅一个样品器皿处于部分真空下,而其他样品器皿处于更高真空度或处于完全真空。
在一些实施方式中,帽1820可以是一端在样品器皿内部而另一端在样品器皿外部的闭合装置,其中内部端具有与样品器皿持续密封接触的表面,该内部端具有从表面朝向封闭端延伸的环形套筒,该环形套筒具有穿过该环形套筒的壁延伸并与样品器皿并置的第一缺口。在一个实施方式中,该闭合具有围绕内部端的第一缺口形成的凹陷环,并且该锯齿环接合管状样品器皿的隆起。
可选地,样品器皿帽可由单一整体件形成。或者,可以使用多个零件。所述多个零件可由相同材料或者由不同材料形成。帽材料可与样品器皿主体材料相同或不同。在一个示例中,样品器皿主体可由光透射材料形成,而帽由不透明材料形成。
可选地,帽1820可以可移除地与主体相接合。帽的一部分可以是可插入至主体中的。帽可包括凸缘,该凸缘可位于主体的顶部。凸缘不插入到主体中。在该非限制性示例中,凸缘可防止帽整个插入至主体中。凸缘可围绕帽形成连续法兰。在一些情况下,凸缘的一部分可重叠于或覆在主体的一部分上。主体的一部分可以是可插入至帽的一部分中的。
可选地,可以是可插入至主体中的帽的所述部分可以具有圆润的底部。或者,所述部分可以是平坦的、锥形的、弯曲的、波状的,或者具有任何其他形状。帽的形状可被设置成可以容易地插入至主体中。
在一些情况下,可在帽的顶部处提供凹坑。该凹坑可遵循插入至主体中的帽的部分。在一些情况下,可在帽中提供空心或凹坑。凹坑可以能够接受可用于向样品器皿递送样品的通道的一部分。凹坑可辅助于将通道引导至帽的期望部分。在一个示例中,在将通道和样品器皿的内部带至流体连通之前可将通道定位在凹坑内。
可选地,可以将通道和帽压在一起,以使得通道穿透帽并进入样品器皿的内部,从而将通道与样品器皿的内部带至流体连通。在一些情况下,帽可具有狭缝,通道穿过该狭缝。或者,通道可戳穿不间断的帽材料。通道可从样品器皿撤出,从而将通道与样品器皿带离流体连通。帽可以能够在通道被移除时重新密封。对于该示例,帽可由自恢复材料形成。在一些情况下,帽可具有狭缝,该狭缝可在通道被移除时关闭,从而形成不漏流体的密封。
在一些实施方式中,主体可包括一个或多个法兰或其他表面特征。表面特征的示例可包括法兰、隆起物、凸起、凹槽、凸脊、螺纹、孔洞、刻面或任何其他表面特征。法兰和/或其他表面特征可外切主体。法兰和/或其他表面特征可位于或靠近主体的顶部。法兰和/或其他表面特征可位于主体的顶部二分之一处、顶部三分之一处、顶部四分之一处、顶部五分之一处、顶部六分之一处、顶部八分之一处或顶部十分之一处。表面特征可用于样品器皿在样品收集装置内的支撑。表面特征可用于从样品收集装置移除样品器皿和/或在样品收集装置内定位样品器皿。法兰和/或其他表面特征可以与帽接合或者可以不与之接合。
可选地,帽可以相对于样品器皿主体具有任何尺寸。在一些情况下,帽和/或主体可具有相似的横截面积。帽可具有与主体的顶部相同的或基本相似的横截面积和/或形状。在一些情况下,帽可具有比主体小的长度。例如,帽可以具有可小于主体长度的60%、50%、40%、30%、25%、20%、15%、10%、7%、5%、3%或1%的长度。
现参考图18C至图18E,样品器皿1800的进一步实施方式可包括帽保持器1830,该帽保持器1830配合在帽上以将帽固定就位。举非限制性示例而言,帽保持器1830还可包括位于帽保持器1830中的开口,所述开口允许诸如适配器等构件滑动穿过并穿透帽1820。图18C以分解图示出了所述部件。
图18D示出了剖面图,该剖面图示出一个实施方式,其中样品器皿主体1810具有由帽保持器1830所覆盖的帽1820。如图18D中所见,帽保持器1830具有锁定特征1832用于将帽保持器1830紧固至样品器皿主体1810和/或帽1820。在一个实施方式中,锁定特征1832包括内部凸脊,该内部凸脊将会接合样品器皿主体1810上的凸脊1812和1814中的一个或多个。图18E示出了耦合至样品器皿主体1810的帽保持器1830的侧视图。
在一些情况下,可以用材料涂覆或处理样品器皿的表面(内表面和/或外表面)。例如,可以用固定剂、抗体、光学涂层、抗凝剂、样品添加剂和/或防腐剂来涂覆样品器皿的内表面。这些可与通道中的任何材料涂层相同或不同。在一个非限制性示例中,涂层可以是但不限于:聚四氟乙烯、聚二甲苯、聚山梨酯表面活性剂(例如聚山梨酯20)或其他材料,作为对表面的处理以减小表面张力。
在实施方式中,样品器皿可包含血液凝固活化剂(例如,凝血酶、二氧化硅颗粒、玻璃颗粒)、抗糖解剂(例如,氟化钠)或凝胶以促进血细胞与血浆的分离。在示例中,样品器皿可包含聚茴脑磺酸钠(SPS)、酸式柠檬酸盐葡萄糖添加剂、高氯酸或柠檬酸钠。一些实施方式可包括至少一种来自以上分组中的每一分组的材料。可选地,还应当理解,不排除其他添加剂或材料,特别是在添加剂在功能方面互不干扰的情况下尤为如此。
可选地,将涂层施加于样品器皿的所有内表面上。可选地,一些实施方式可以按仅覆盖样品器皿中的选定区域的图案来施加涂层。一些实施方式可以仅覆盖样品器皿的上内部区域。可选地,一些实施方式可以仅覆盖样品器皿下内部区域。可选地,一些实施方式可覆盖样品器皿的内部区域的条、线或其他几何图案。可选地,一些实施方式还可涂覆帽、插塞的表面,或者涂覆与样品器皿一起使用的覆盖物。一些实施方式可以涂覆样品从中进入样品器皿的表面,以提供对样品远离进入区域并朝向目的地点(诸如但不限于器皿的底部部分)的平滑转移。
可选地,涂层可以是湿涂层或干涂层。一些实施方式可具有至少一个干涂层和至少一个湿涂层。在一些情况下,一种或多种试剂可在样品器皿的内表面上涂覆和干燥。涂层可以备选地被提供于潮湿的环境中或者可以是凝胶。一些实施方式可包括样品器皿中的分离凝胶,以保持样品的选定部分远离该样品的其他部分。一些实施方式可包括血清分离凝胶和血浆分离凝胶,诸如但不限于可从Becton Dickinson购得的、基于聚酯的分离凝胶。
可选地,可以在样品器皿内提供一种或多种固体基质。例如,可以在样品器皿内提供一种或多种珠粒或颗粒。珠粒和/或颗粒可涂覆有试剂或本文所描述的任何其他物质。珠粒和/或颗粒可以能够在样品存在的情况下溶解。珠粒和/或颗粒可由一种或多种试剂形成,或者可有助于处理样品。试剂能够以气态形式提供于样品器皿内。样品器皿可以是密封的。在将样品引入到样品器皿中之前、在已经将样品引入到样品器皿之后以及/或者在将样品引入到样品器皿中的同时,样品器皿可保持密封。在一个实施方式中,样品器皿可具有光滑表面和/或圆形底部。这有助于使得对血液样品的应力最小化,特别是在离心分离期间尤为如此。当然,在备选实施方式中,不排除样品器皿的底部的其他形状。
在实施方式中,密封样品器皿中的体液样品可在体液样品中保留溶解气体,以使得储存在密封样品器皿中的样品保留与从受试者的身体新抽取的体液样品或从不同的样品新制备的样品(例如,从全血中新制备的血浆)相似或相同的溶解气体组成。在实施方式中,经10分钟、20分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、8小时、12小时、16小时、24小时、48小时或72小时的时间段,密封样品器皿中的体液样品可以保留至少99%、98%、95%、90%、80%、70%、60%、50%、40%、30%或20%的溶解气体。通常,在这样的实施方式中,所述时间段始于将样品放置到样品器皿中的时间或将样品器皿密封的时间。为了促进在体液样品中对溶解气体的保留,可以在例如20℃、15℃、10℃、4℃等选定的温度下,或者在低于0℃的冷冻温度下,将样品储存在密封的样品器皿中。不排除其他用于样品储存的温度。
类似地,在实施方式中,密封样品器皿中的体液样品可保留体液样品中的分析物,以使得储存在密封样品器皿中的样品保留与从受试者的身体新抽取的体液样品或新制备的体液样品(例如,从全血中新制备的血浆)相似或相同的分析物组成。在实施方式中,经10分钟、20分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、8小时、12小时、16小时、24小时或48小时的时间段,密封样品器皿中的体液样品可保留至少99%、98%、95%、90%、80%、70%、60%、50%、40%、30%或20%的分析物。通常,在这样的实施方式中,所述时间段始于将样品存放到样品器皿中的时间或将样品器皿密封的时间。为了促进在体液样品中对一种或多种分析物的保留,,可以在例如20℃、15℃、10℃、4℃等选定的温度下,或者在低于0℃的冷冻温度下,将样品储存在密封的样品器皿中。不排除其他用于样品储存的温度。可选地,在将样品引入到器皿中之后可对样品器皿进行离心。例如,可以在样品引入到器皿中的30秒、1分钟、2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、20分钟、30分钟、45分钟、1小时、2小时、4小时、8小时、24小时、2天、3天、4天、5天、7天或10天内对样品器皿进行离心。例如,在全血样品的情况下,对包含样品的样品器皿进行离心可促进血细胞与血浆的分离,以获得血浆和沉淀的细胞。在一些情况下,对样品进行离心提高了血液或血浆中的一种或多种分析物的稳定性。
图18F进一步示出了样品器皿可各自具有至少一个关联于该样品器皿的信息存储单元。可选地,一些实施方式可使一个信息存储单元传送关于多个样品器皿的信息,特别是在(但不仅限于)样品器皿全都包含来自同一受试者的样品的情况下。这样的信息存储单元可以位于保持多个样品器皿的载体上,而不是位于样品器皿本身上。
图18F示出了所述样品器皿中之一的底面的仰视图,在一个非限制性示例中,信息存储单元1860可为以下各项中的至少一项:条形码(例如,1-D、2-D或3-D)、快速响应(QR)码、图像、形状、单词、数字、字母数字串、颜色或其任意组合,或者任何类型的视觉信息存储单元。其他实施方式可以使用不在可见光谱中的信息存储单元。其他实施方式可以使用RFID标签、RF信息存储单元、IR发光标签,或者不依赖于通过经可见光谱发送的信号的鉴别的其他标记物。当然,信息存储单元1860还可以定位于样品器皿的顶端表面上。图18G示出了可选地,信息存储单元1860还可被包含在样品器皿的侧表面上。这可以附加于或替代于顶部或底部定位的一个或多个信息存储单元1860。
在一个非限制性示例中,信息存储单元1860可以用于标识样品收集装置中的样品和/或样品类型。可选地,每一样品器皿可存在一个或多个信息存储单元。一些实施方式还可在样品器皿保持器上使用信息存储单元。样品存储单元可标识样品收集装置、装置内的一个或多个单个样品器皿,或者装置的组件。在一些情况下,可以运输样品收集装置、样品收集装置的一部分和/或样品器皿。在一个示例中,可以经由递送服务或本文其他各处所描述的任何其他服务来运输样品收集装置或样品收集装置的部分。可以递送样品器皿以便可对样品执行一种或多种检测。
可选地,可以追踪样品身份和/或提供样品的个体的身份。举非限制性示例而言,可以包括与提供样品的一个或多个个体相关联的信息(例如,姓名、联系信息、社会保险号、出生日期、保险信息、账单信息、病史)以及样品提供者的其他信息。在一些情况下,可以追踪样品的类型(例如,全血、血浆、尿等)。可选地,还可以追踪样品将会遇到的试剂的类型(例如,抗凝剂、标记物等)。可以考虑关于样品收集的附加信息,诸如收集日期和/或时间、样品收集时所处的环境、要对样品进行的检测类型、针对检测的一种或多种设置、检测方案、保险信息、医疗记录信息或任何其他类型的信息。
在本文描述的至少一个或多个实施方式中,信息存储单元可辅助追踪这样的信息。信息存储单元可与这样的信息相关联。这样的信息可储存在样品收集装置之外、样品收集装置之内或其任意组合。在一些情况下,所述信息可储存在一个或多个外部装置上,所述外部装置诸如为服务器、计算机、数据库或具有存储器的任何其他装置。在一些情况下,所述信息可储存在云计算基础设施上。储存信息的一个或多个资源可分布在云上、通过因特网来自远程服务器、与远程计算机处理器无线连接等。在一些情况下,可以提供点对点基础设施。所述信息可储存在信息存储单元本身之中,或者可以在别处与信息存储单元相关联,或者是其任意组合。
可选地,信息存储单元可提供唯一标识,或者可以提供高的提供唯一标识的可能性。在一些情况下,信息存储单元可以具有可视组件。信息存储单元可以是光学可检测的。在一些情况下,信息存储单元可以是可使用可见光来辨识的。在一些示例中,信息存储单元可以是条形码(例如,1-D、2-D或3-D)、快速响应(QR)码、图像、形状、单词、数字、字母数字串、颜色或其任意组合,或者任何类型的视觉信息存储单元。
在其他实施方式中,信息存储单元可以是可经由任何其他种类的辐射来光学检测的。例如,信息存储单元可以是可经由红外线、紫外线或任何其他类型的电磁谱波长来检测的。信息存储单元可以利用发光,诸如荧光、化学发光、生物发光或任何其他类型的光发射。在一些情况下,信息存储单元可以是无线电发射器和/或接收器。信息存储单元可以是射频识别(RFID)标签。信息存储单元可以是任何类型的无线发射器和/或接收器。信息存储单元可以发送一个或多个电信号。在一些情况下,GPS或其他位置相关信号可与信息存储单元一起使用。
可选地,信息存储单元可以是以及/或者包括音频组件或声学组件。信息存储单元可以发出声音,该声音可以是可辨识的,以便唯一地标识所标识的组件。
可选地,信息存储单元可以是可经由光学检测装置来检测的。例如,条形码扫描仪可以能够读取信息存储单元。在另一示例中,相机(例如,用于静止图像或视频图像的相机)或其他图像捕捉装置可以能够捕捉信息存储单元的图像并且分析该图像以确定标识。
可选地,信息存储单元可以位于一个或多个样品器皿的保持器上。可以在保持器中提供一个或多个凹陷。信息存储单元可位于该凹陷内。凹陷可位于保持器的底部表面或侧表面上。在一些实施方式中,保持器可包括一个或多个凸起。信息存储单元可位于该凸起上。在一些情况下,可以将信息存储单元提供于保持器的外表面上。信息存储单元可以备选地定位于保持器的内表面上。可以从样品收集装置外部检测信息存储单元。
在一些实施方式中,信息存储单元可位于样品器皿的外表面上或者样品器皿的内表面上。信息存储单元可以是可从样品器皿外部检测的。在一些实施方式中,可以将信息存储单元提供于样品器皿的底部表面上。
在一个非限制性示例中,保持器可包括光透射部分。所述光透射部分可以位于保持器的底部或保持器的侧面上。例如,可以提供透明或半透明窗口。在另一示例中,光透射部分可以是无需窗口的孔洞。光透射部分可允许保持器内的部分可见。信息存储单元可以在光透射部分上提供于保持器的外表面上,提供于保持器的内表面上但可通过光透射部分而可见,或者提供于样品器皿的外表面或内表面上但可通过光透射部分而可见。在一些情况下,可以在样品器皿的内表面上提供信息存储单元,但样品器皿可以是光透射的,以便可以通过样品器皿和/或光透射部分来观察信息存储单元。
可选地,信息存储单元可以是QR码、条形码或其他光学信息存储单元,所述其他光学信息存储单元可以是光学可见的,诸如但不限于可从样品收集装置的外部光学可见。QR码可以是通过在样品收集装置的保持器的底部的光学窗口、孔洞等可见的。QR码可提供于样品收集装置保持器上或者通过保持器可见的样品器皿的一部分上。诸如相机或扫描仪等图像捕捉装置可以提供于样品器皿或运输容器外部,并且可以能够读取QR码。
在一些实施方式中,单个或多个QR码或其他信息存储单元可提供于样品收集装置上。在一些情况下,每个样品器皿可具有至少一个信息存储单元,诸如与其相关联的QR码。在一个示例中,可以在保持器中为每一样品器皿提供至少一个窗口,并且每个窗口可允许用户观察QR码或其他信息存储单元。例如,两个样品器皿可被收容于保持器内,所述样品器皿中的每一个具有可从保持器外部辨识的关联的信息存储单元。
在一些实施方式中,信息存储单元可随由保持器所收容的样品器皿一起提供。将保持器与样品收集装置的其余部分相分离可以致使样品器皿与样品收集装置的其余部分相分离。样品器皿可保留在保持器内或者可从保持器移除。即使从保持器中移除样品器皿,信息存储单元仍可与样品器皿保留在一起。或者,即使样品器皿被移除,信息存储单元仍可与保持器保留在一起。在一些情况下,保持器和样品器皿均可具有信息存储单元,以使得样品器皿和保持器甚至在分离时仍可被单个地追踪和/或匹配。
在一些情况下,可以在样品收集装置内提供任何数目的样品器皿。一些实施方式可一次全部将所有这些样品器皿连接至样品收集装置。可选地,能够以顺序方式或其他非同时方式来耦合样品器皿。样品器皿可以能够接收从受试者接收的样品。每个样品器皿可以可选地具有唯一信息存储单元。唯一信息存储单元可与涉及样品、受试者、装置或装置的组件的任何信息相关联。
在一些情况下,每个样品器皿的每个信息存储单元可以是唯一的,或者包含唯一信息。在其他实施方式中,样品器皿上的信息存储单元无需是唯一的。可选地,一些实施方式可具有对于装置、对于受试者和/或对于样品类型是唯一的信息。在一些实施方式中,信息存储单元上的信息可用于将若干个样品器皿与同一受试者或同一信息相关联。
在一些实施方式中,信息存储单元在收集约定时附接至或以其他方式关联于(物理地或通过诸如数据库指针或链接等非物理关联)样品器皿或成组的样品器皿。如果按组关联,则关联可基于全都来自于同一用户或如本文所阐述的其他因素。可选地,一些实施方式可以已经在样品器皿或成组的样品器皿上具有信息存储单元。在一个非限制性示例中,信息存储单元提供标识物信息,该标识物信息继而在样品收集时间或临近样品时间时与受试者相关联。在该示例中,信息存储单元上的信息保持不变但继而链接至受试者。在另一实施方式中,将信息存储单元上的信息改变为包括关于受试者的信息。可选地,一些实施方式可以二者兼有,其中一些信息被改变而一些信息不变(但可继而与受试者或诸如时间日期等关于收集事件的其他信息相关联)。
参考图19A至图19C,现将描述样品收集装置的前端的各个实施方式。图19A示出了样品收集装置的前端的上视图,该样品收集装置具有开口1103和1105针对于其相应通道。在本实施方式中,将开口1103和1105放置成彼此紧密靠近,在开口1103与1105之间具有分隔壁1910。在一个非限制性示例中,分隔壁1910的厚度设置成可以通过用于形成样品收集装置的制造工艺而可靠地形成的最小厚度。在一个实施方式中,壁厚度应当为约1-10mm。在一些实施方式中,开口1103和1105可以处于上下配置、对角线配置或者其中两个开口彼此紧密靠近的其他配置,以代替并排配置。
现参考图19B,本实施方式示出了被配置为相对于彼此同轴的开口1910和1912。开口1910和1912的这样的同轴配置允许两个开口之间的更大的重叠。
现参考图19C,本实施方式类似于图19B的实施方式,区别在于这些开口1920和1922是圆形的,而不是方形开口。应当理解,可以使用任何各种形状,包括但不限于圆形、椭圆形、三角形、四边形(例如,正方形、矩形、梯形)、五边形、六边形、八边形或任何其他横截面形状。当然,应当理解,对于每个开口可以使用不同形状,并且收集装置对于所有的开口无需具有相同的横截面形状。一些实施方式对于开口可具有一种横截面形状,但对于开口下游的通道具有不同的横截面形状。
单通道样品收集装置
现参考图20A-图20B,尽管本文的实施方式通常被描述为具有两个分离的通道的样品收集装置,但应当理解,一些实施方式可使用单一进入通道2010。该单一进入通道2010可以带有涂层或者可以不带有涂层。合适的涂层包括但不限于抗凝剂、等离子体或其他材料。
图20A示出了在样品收集装置2000的本实施方式中,可以在单一进入通路2010内同轴地安装组织穿透构件2112。这允许以将会与单一进入通路2010对准的方式形成位于目标组织处的伤口。组织穿透构件2012可由多种技术之一来激活,所述技术诸如但不限于在按下触发器时致动、在装置前端与目标组织接触时致动,或者一旦用足够的压力将装置按在目标组织上则通过压力致动。在致动之后,组织穿透构件2012可保持在单一进入通路2010中。可选地,组织穿透构件2012可从单一进入通路2010缩回。
进入样品收集装置2000的样品流体可从单一进入通路2010分成两个或更多个分离的通路2014和2016。这使得样品流体能够从被收集于单一接触点处的样品分成至少两个部分。该两个部分可以可选地保持在两个分离的保持室2018和2020中。这些室可各自具有一个或多个适配器通道2022和2024,以将样品流体转移到诸如但不限于器皿1146a和1146b等器皿。应当理解,保持室2018和2020以及/或者器皿1146a和1146b可以在其中包含抗凝剂以准备样品流体用于处理。
现参考图20B,本实施方式示出了在其中具有组织穿透构件2012的单一进入通路2010,在致动之后,所述组织穿透构件2012被配置成整个或部分地保留在单一进入通路2010内。应当理解,本实施方式可以使用实心穿透构件或者空心的、在其中具有内腔的穿透构件。
参考图21,现将描述样品收集装置2030的又一实施方式。本实施方式示出了具有组织穿透构件2012的长度减小的单一进入通路2032,所述组织穿透构件2012被配置用于从通路2032向外延伸。在致动之后,组织穿透构件2012可以位于通路2032中,或者可选地,被缩回成不位于通路2032中。进入样品收集装置2030的样品流体可从单一进入通路2032分成两个或更多个分离的通路2034和2036。这使得样品流体能够从被收集于单一接触点处的样品分成至少两个部分。本实施方式示出了通路2034和2036保持在毛细管通道配置中,并且不扩大以成为室,诸如图20A-图20B的实施方式。应当理解,本文的任何实施方式均可包括针对收集通路和/或装置上的器皿的一个或多个填充指示器,以使得用户可以知道何时已经达到足够的填充水平。
应当理解,由于用诸如但不限于器皿1146a和1146b等器皿收集到的小样品体积,来自于器皿中的减小的压强(诸如但不限于真空压强)的“拉动”被最低程度地以可能使得从中收集样品流体的血管或其他管腔塌陷或有害地重塑的方式传递到受试者体内或者不传递到受试者体内。例如,儿童患者和老年患者通常具有小的和/或脆弱的静脉,当使用传统的大容积真空容器时,由于与向那些传统器皿中吸入较大样品体积相关联的较高真空力,所述静脉可能塌陷。在装置的至少一个实施方式中,由于其不会对静脉施加真空(抽吸)力,因此其将不会具有这样的问题。在一个实施方式中,真空力的量向器皿1146a中吸取不超过120uL的样品流体。可选地,真空力的量向器皿1146a中吸取不超过100uL。可选地,真空力的量向器皿1146a中吸取不超过80uL。可选地,真空力的量向器皿1146a中吸取不超过60uL。可选地,真空力的量向器皿1146a中吸取不超过40uL。可选地,真空力的量向器皿1146a中吸取不超过20uL。在一个实施方式中,这种类型的吸取在不使用注射器的情况下进行,并且主要基于来自器皿的拉力和来自离开受试者的流体的任何力。可选地,贯穿装置以吸取已经到达装置内部的样品的塑形通路可辅助于减小从器皿1146a和1146b向受试者的血管或其他体腔的力传递。一些实施方式可以在以上列举的小容积器皿中使用约四分之三真空或更小,以使得样品的溶血最小化并且防止受试者体内的血管塌陷。一些实施方式可以在以上列举的小容积器皿中使用约二分之一真空或更小,以使得样品的溶血最小化并且防止受试者体内的血管塌陷。一些实施方式可以在以上列举的小容积器皿中使用约四分之一真空或更小,以使得样品的溶血最小化并且防止受试者体内的血管塌陷。本文的真空是相对于大气压的完全真空。
应当理解,在一个实施方式中,装置中的室的横截面积大于用于从受试者身上吸取体液的针和/或柔性管道的横截面直径。这进一步辅助于减小向受试者的力传递。来自器皿的真空拉力最直接地对装置中的液体样品而不直接对更接近于受试者的针中的样品进行吸取。较长的通路由收集装置中的较大容积室所缓冲,其抑制了对受试者体内血管的拉力。此外,相对于也在真空下的较大容积器皿,在小容积器皿中的初始峰值拉力大幅减小。“拉”的持续时间也会更长,以使得更大量的样品能够进入器皿。在较小容积中,所要收集的样品的很大一部分已经在装置中,并且存在较少的从受试者身上吸取而在开始样品拉取之前尚未处于装置中的样品。
参考图22,现将描述样品收集装置的又一实施方式。本实施方式示出了具有连接器2102的收集装置2100,该连接器诸如为但不限于鲁尔连接器(Luer connector),其允许连接至诸如组织穿透构件、针等多种样品采集装置。一些鲁尔连接器可使用压配合来接合其他连接器,而连接器2102的一些实施方式可包括螺纹以促进接合。图22示出了在这一当前实施方式中,蝴蝶针2104耦合至诸如但不限于通向连接器2108的柔性管等流体连接通路2106,以将样品采集特征连接至样品收集装置2100。柔性管道2106允许针部分2104定位成远离样品收集装置2100但仍可操作地流体耦合至该样品收集装置2100。这允许在针2104的定位方面有更大的灵活性,以在不必还移动样品收集装置2100的情况下采集样品流体。可选地,一些实施方式可在不使用柔性管道的情况下直接将组织穿透构件耦合至装置2100。
至少一些或所有实施方式可具有填充指示器,诸如但不限于观察窗口或开口,其示出样品何时存在于收集装置内并从而指示出接合一个或多个样品器皿是可接受的。可选地,不排除不具有填充指示器的实施方式。一些实施方式可以可选地包括一个或多个排放孔,诸如但不限于端口,用以在收集装置中的通道被填充了样品时允许空气逸出。在大多数实施方式中,在达到期望的填充水平之后,可以将一个或多个被填充的样品器皿从样品收集装置断开。可选地,可以将一个或多个额外的样品器皿接合至样品收集装置,以收集额外量的体液样品。可选地,样品器皿的内部条件是使得器皿具有减小的压强,从而被配置用于仅吸入预定量的样品流体。
图23示出了样品收集装置2100的一个实施方式的分解图。在该非限制性示例中,部分1130可被配置用于保持器皿保持器1140和具有采样装置保持器2160的部分。装置2100可包括防泄漏器件2162,该防泄漏器件2162可接合适配器通道2022和2024的开放端以使通过开放端的样品损失最小化,直到保持器1140中的器皿被接合以向其中的任何一个或多个器皿中吸取样品。在当前实施方式中,防泄漏器件2162覆盖了至少两个适配器通道2022和2024,并且被配置成可移动的。防泄漏器件2162的本实施方式的大小被设置成使得其可以移动以露出适配器通道2022和2024上的开口,同时仍允许适配器通道2022和2024接合保持器1140中的一个或多个器皿。
现参考图24和图25,图中更详细地示出了采样装置保持器2160的一个实施方式。图24将采样装置保持器2160示出为组装单元。图25示出了具有第一部分2164和第二部分2166的采样装置保持器2160的分解图。适配器通道2022和2024还被示出为可从第二部分2166移除。尽管采样装置保持器2160的本实施方式被示出为两个单独的部分,但应当理解,一些备选实施方式可将样品装置保持器2160配置成单一的一体单元。可选地,一些实施方式可配置成具有多于两个部分,所述部分组装在一起以形成保持器2160。可选地,一些实施方式可以沿着保持器2160的纵轴2165或其他轴而不是沿着保持器2160的横轴来创建单独的部分,这由图25中的分割线所示出。
现参考图26到图28,图中示出了样品装置保持器2160和装置2100的实施方式的各个剖视图。图26示出了部分2164和部分2166的剖视图。尽管不受任何特定理论的约束,但可以选择使用单独的部分2164和2166以简化制造,特别是用于形成保持器2160中的各个内部通道和室。例如,室的至少一个壁2167可形成于第一部分2164中,而室的互补的壁2168可形成于第二部分2166中。图27示出了部分2166的俯视端视图,其中从该端视图可以看到壁2168。
参考图28,现将描述组装装置2100的剖视图。该图28示出了通过连接器2102进入装置的样品将会在通向适配器通道2022和2024之前进入公共室2170。从适配器通道2022和2024起,保持器1140在由箭头2172所指示的方向上的移动将会可操作地将器皿1146a和1146b流体耦合至适配器通道2022和2024,从而将样品从通道移入器皿中。在本实施方式中,有充足的空间2174来允许器皿1146a和1146b的移动,以使适配器通道2022和2024穿透器皿1146a和1146b的帽,使得适配器通道2022和2024与器皿1146a和1146b的内部流体连通。尽管附图中仅示出了两个器皿与适配器通道组,但应当理解,具有更多或更少组的器皿和适配器通道的其他配置亦可被配置用于与诸如图28中所示的装置一起使用。
模块化样品收集装置
现参考图29A-图29C,尽管本文的实施方式通常将样品收集装置描述为具有用于将样品收集通道与器皿相连接的适配器通道,但应当理解,不排除没有这样的配置的实施方式。
举图29A中的非限制性示例而言,如本文先前所提出,一些实施方式可以没有分立的、分离的适配器通道。在此,收集通道2422可通过如箭头2449所指示的在这些元件中的一个或全部两个之间的相对运动的方式而直接连接至器皿2446。
举图29B中的非限制性示例而言,一个或多个适配器通道2454可以是分立元件,其最初不与收集通道2422或器皿2446中的任一个直接流体连通。在此,收集通道2422可通过收集通道、一个或多个适配器通道2454或者器皿2446中的一个或多个之间的相对运动的方式(按顺序或者同时)连接至器皿2446,以创建从收集通道经过所述一个或多个适配器通道通往器皿中的流体通路。
举图29C中的非限制性示例而言,一个或多个适配器通道2454可以是最初与器皿2446相接触的元件。适配器通道2454可以不与器皿的内部直接连通。在此,收集通道2400可通过那些元件中的一个或多个之间的相对运动的方式(按顺序或者同时)连接至器皿,以创建从收集通道经过所述一个或多个适配器通道通往器皿中的流体通路。一些实施方式可以在将会由适配器通道所接合的收集通道的一端上具有隔膜、套筒、具有排放孔的套筒或覆盖物2455。各个元件的接合还可将适配器通道2454移入器皿2446的内部中,因为最初适配器通道2454可能不与所述内部流体连通。本文的一些实施方式可具有不止一个适配器通道,并且一些实施方式可使用在通道的两端具有尖锐端的适配器通道。对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单个实施方式解释为包含整个发明。
应当理解,可以修改本文的任何实施方式以包括针对图29A-图29C的描述中所阐述的特征。
样品处理
参考图30,现将描述体液样品收集和运输系统的一个实施方式。图30示出了在受试者的皮肤表面S上的体液样品B。在图30的非限制性示例中,体液样品B可由多种装置中的一种来收集。举非限制性示例而言,收集装置1530可以是但不限于在2012年9月6日提交的美国专利申请序列号61/697,797中所描述的那些收集装置,该文献通过引用而全文并入于此用于所有目的。在本实施方式中,体液样品B由一个或多个毛细管通道收集并继而被引导至样品器皿1540中。举非限制性示例而言,样品器皿1540中的至少一个样品器皿可具有最初处于部分真空下的内部,用于将体液样品吸入至样品器皿1540中。一些实施方式可同时从样品收集装置中的相同或不同的收集通道,将样品从样品收集装置吸入至样品器皿1540中。可选地,一些实施方式可同时将样品吸入至样品器皿中。
在本实施方式中,在体液样品处于样品器皿1540内之后,在其保持器1542中(或者可选地,从其保持器1542移除)的样品器皿1540被装载至运输容器1500中。在该实施方式中,可以存在大小设置为针对样品器皿保持器1542的一个或多个槽,或者针对运输容器1500中的样品器皿的槽。举非限制性示例而言,所述槽可按阵列配置容纳样品器皿并且定向成垂直的或一些其他预定的定向。应当理解,样品器皿1540的一些实施方式被配置成使得它们在每个器皿中容纳不同量的样品。举非限制性示例而言,这可以基于每个样品器皿中的真空力的量、收集装置的一个或多个样品收集通道中收集的样品量以及/或者其他因素而得到控制。可选地,在样品器皿中还可以存在不同的预处理,诸如但不限于不同的抗凝剂等。
如图30中所见,样品器皿1540正在第一位置(诸如但不限于样品收集场所)处收集样品。举非限制性示例而言,体液样品继而在运输容器1500中运送至第二位置,该第二位置诸如但不限于接收场所,诸如但不限于分析场所。运输方法可以是通过快递、邮政速递或其他运输技术。在许多实施方式中,可通过具有将运输容器容纳于其中的又一器皿来实现运输。在一个实施方式中,样品收集场所可以是护理点。可选地,样品收集场所是服务点。可选地,样品收集场所远离样品分析场所。
尽管图30的本实施方式示出了从受试者的表面对体液样品的收集,但其他备选实施方式可使用用于从受试者的其他区域收集样品的收集技术,诸如通过静脉穿刺,以填充一个或多个样品器皿1540。不排除这样的其他收集技术用于作为表面收集的备选或与表面收集联合使用。表面收集可以在受试者的外表面上。可选地,一些实施方式可从受试者体内可及的表面进行收集。体液样品B在这些表面上的存在可以自然出现或者可以通过伤口创造或使体液表面可及的其他技术而出现。
现参考图31,在此描述了又一实施方式,其中相比于收集汇集于受试者的表面上的样品,可以从受试者体内收集体液样品。图31的该实施方式示出了具有皮下注射针1552的收集装置1550,该皮下注射针1552被配置用于收集体液样品,诸如但不限于静脉血。在一个实施方式中,体液样品可以填充装置1550中的室1554,此时,可以接合一个或多个样品器皿1540以将样品吸入至相应的一个或多个器皿中。可选地,一些实施方式可不具有室1554,而是除了用于将样品从针1552引导至一个或多个样品器皿1540的一个或多个通道、一个或多个通路或一个或多个管之外具有非常小的空余空间。对于体液样品诸如血液,来自血管内的压强是使得血液样品可以填充室1554而无需来自收集装置的很多(如果有的话)辅助。这样的实施方式可以可选地包括一个或多个排放孔,诸如但不限于端口,用以在收集装置中的通道被样品填充时允许空气逸出。可选地,一些实施方式可具有向收集装置1550的直接针附接(而不是向针的管道连接),类似于图44中所示,其中针刚性地或基本上刚性地连接至收集装置。一些实施方式可以具有可移除的连接、可释放的连接、鲁尔连接(Luer connection)、螺纹连接,或者在未来可能研发的其他针连接技术。
至少一些或所有实施方式可具有填充指示器,诸如但不限于观察窗口或开口,其示出样品何时存在于收集装置内并从而指示出接合一个或多个样品器皿1540是可接受的。可选地,不排除不具有填充指示器的实施方式。在达到期望的填充水平之后,可以将一个或多个被填充的样品器皿1540从样品收集装置断开。可选地,可以将一个或多个额外的样品器皿1540接合至样品收集装置1550(或1530),以收集额外量的体液样品。
服务点系统
现参考图32,应当理解,本文所描述的过程可以使用自动化技术来执行。自动化处理可以用于集成的、自动化的系统中。在一些实施方式中,这可以是在其中具有多个功能组件并且由公共外壳所包围的单一仪器。可以预设用于沉降措施的处理技术和方法。可选地,其可以基于可按美国专利申请序列号13/355,458和13/244,947中所描述的方式而动态改变的方案或程序,上述文献均通过引用而全文并入于此用于所有目的。
在如图32中所示的一个非限制性示例中,集成式仪器2500可配备有可编程处理器2502,该处理器可以用于控制仪器的多个组件。例如,在一个实施方式中,处理器2502可以控制可在如箭头2506和2508所指示的X-Y和Z方向上移动的单个或多个移液器系统2504。同一处理器或不同的处理器还可以控制仪器中的其他组件2512、2514或2516。在一个实施方式中,组件2512、2514或2516的类型包括离心机。
如图32中所见,由处理器2502作出的控制可以允许移液器系统2504从筒匣2510采集血液样品,并将样品移动至组件2512、2514或2516中之一。这样的移动可以涉及向筒匣2510中的可拆卸器皿中分配样品,以及继而将所述可拆卸器皿运送至组件2512、2514或2516中之一。可选地,将血液样品直接分配至已经安装在组件2512、2514或2516中之一上的器皿中。在一个非限制性示例中,这些组件2512、2514或2516中之一可以是具有成像配置以允许器皿中样品的照明和可视化的离心机。其他组件2512、2514或2516执行其他分析、测定或检测功能。
所有前述各项均可集成于单一外壳2520内,并且被配置用于台面安装或小占用面积地面安装。在一个示例中,小占用面积地面安装的系统可占用约4m2或更小的地面面积。在一个示例中,小占用面积地面安装的系统可占用约3m2或更小的地面面积。在一个示例中,小占用面积地面安装的系统可占用约2m2或更小的地面面积。在一个示例中,小占用面积地面安装的系统可占用约1m2或更小的地面面积。在一些实施方式中,仪器占用面积可以小于或等于约4m2、3m2、2.5m2、2m2、1.5m2、1m2、0.75m2、0.5m2、0.3m2、0.2m2、0.1m2、0.08m2、0.05m2、0.03m2、100cm2、80cm2、70cm2、60cm2、50cm2、40cm2、30cm2、20cm2、15cm2或10cm2。在美国专利申请序列号13/355,458和13/244,947中描述了处于服务点环境中的一些合适的系统,上述文献全都通过引用而全文并入于此用于所有目的。本实施方式可被配置用于与这些专利申请中所描述的任何模块或系统一起使用。
参考图33至图37,现将描述样品收集装置的进一步实施方式。如图33和图34中所见,至少一个实施方式示出了具有毛细管通道区域的样品收集区域2600以及继而较低流阻区域2610,该较低流阻区域2610增大了通道的横截面积以提供较低的流阻和增大的流速。在至少一个实施方式中,该较低流阻区域2610仍是毛细管通道,但却是一个具有较低流阻的毛细管通道。可选地,其他实施方式可增大大小,其中样品在其中流动,但不是在毛细作用下流动。增大了大小的通道还可以用于在其中储存样品。举非限制性示例而言,这样的储存可以是临时在收集期间,可以是更长期的,诸如用于从收集场所到冷藏、从收集场所到接收场所的运输,其他的位置到位置运输或其他目的。一个实施方式可被配置成具有安在装置两端上的帽,以使得样品被包含于其中而无需转移至器皿1146a和1146b。
由于区域2600与2610之间的联结处可位于跨过中线2620之处,因此这样还可以减少将所述物件联结在一起所使用的粘接材料的量。应当理解,实施方式可具有这样的通道2612和2614:所述通道具有相同的横截面大小以及/或者被配置用于在通道中包含相同的或基本上相同的容积。可选地,通道2612和2614可被配置用于容纳不同的体积。对于该通道当其继续进入区域2610时可能同样如此。可选地,一些实施方式可以当在区域2610中时具有不同大小,而在区域2600中具有相同大小,或者反之亦然。不排除其他大小配置。尽管这里将通道示出为直线的,但应当理解,对于本文公开的任何实施方式,一些实施方式可具有一个或多个通道的弯曲部分或其他非笔直部分。
其他部件类似于本文先前关于器皿1146a和1146b、适配器通道、熔块、保持器130等所描述的那些部件。全部两个通道在接合处的芯吸(填充时间都小于6秒)得到了改进(移除了步骤)并且血液在无需倾斜的情况下容易地进入通道和穿过接合区域。部件可由PMMA、PET、PETG等制成。在该实施方式中,这可以提供相对于一个横截面大小的毛细管通道快7.5倍的填充,这是因为区域2610中的通道大小的增大将会允许向该区域中更容易的流动。
区域2610中的流阻基于通道大小的改变而得到四次方的减小,如以下公式中所见:
应当理解,一旦在一个或多个通道中有期望的样本量,则可配置一些实施方式以使得可以操纵样品移入储存器皿中。举非限制性示例而言,样品的这样的移动可以是通过拉力、推力或二者兼有的方式。在一个实施方式中,拉力可由在其中具有真空的器皿、具有柱塞或其他进行移动以增大容积并于其中吸取样品的可移动表面的器皿或者主动真空力来提供。在一个实施方式中,推力可以是来自从团剂(bolus)或其他流体分组的后面提供的空气或其他气体的压力。在实施方式中,可以施加压缩气体,来自具有围绕装置的密封的、在收集装置上滑动的帽的压力,耦合至一端并施加气压的注射器或者其他力来促使气体向前。所提供的力可不同于用来收集一个或多个通道中的样品的动力。可选地,一些实施方式可在每一通道使用不同的动力。可选地,一些实施方式在区域2600中可使用相对于区2610不同的动力。
尽管已经通过参考其某些特定实施方式而描述并说明了本教导,但本领域技术人员将会明白,可以在不脱离本发明的精神和范围的情况下作出对程序和方案的各种改制、改变、修改、替代、删除或添加。例如,就任何上述实施方式而言,应当理解,流体样品可以是全血、稀释血、组织液、直接收集自患者的样品、位于表面上的样品、经过一些预处理之后的样品等。本领域技术人员应当理解,备选实施方式可具有不止一个器皿,所述器皿可以按顺序可操作地耦合至针或通道的开口以将流体吸入器皿中。可选地,一些实施方式可以具有被配置用于可操作地同时耦合至通道的器皿。一些实施方式可将刺切装置或其他伤口创造装置与样品收集装置相集成,以将目标样品流体带至组织表面并继而收集样品流体,这些全都使用单一装置来进行。举非限制性示例而言,可以安装弹簧致动的、机械致动的和/或机电致动的组织穿透构件以具有从样品收集通道开口附近的样品收集装置的一端附近离开的穿透尖端,以使得创造出的伤口部位也将会沿着与收集开口一样的装置的同一端。可选地,集成式装置可以具有位于装置的一个表面上的收集开口,以及沿着另一表面的组织穿透元件。在本文所公开的任何实施方式中,收集通道的第一开口可具有钝形,其被配置成不容易刺破人的皮肤。
此外,在手指或其他目标组织上使用加热贴可以增加向目标区域的血流量,并从而增大可从受试者身上吸取足够的血液或其他体液的速度。加热用于将目标组织升至约40C至50C。可选地,热量将目标组织升至约44至47C的温度范围。
此外,本领域技术人员将会认识到,如本文所描述的任何实施方式均可适用于来自人类、动物或其他受试者的样品流体的收集。如本文所描述的一些实施方式还可适合用于非生物流体样品的收集。一些实施方式可以使用不可从载体移除的器皿。一些实施方式可以通过第二动力将流体样品在被计量于样品收集部分中之后引导至筒匣,该筒匣继而被放置于分析物或其他分析装置中。可选地,应当理解,虽然许多实施方式示出器皿位于载体中,但不排除其中器皿是裸露的或未安装在载体中的实施方式。一些实施方式可以具有与装置分离的器皿,并且该器皿仅在通道已达到最小填充水平的情况下才被带至流体连通。例如,器皿可被保持在不同的位置,并且仅在足够量的血液或样品流体处于样品收集装置中时才由技术人员来接触。此时,可以同时或按顺序将器皿带至与样品收集装置的通道中的一个或多个通道流体连通。
此外,浓度、量和其他数值数据可在本文中以范围格式呈现。应当理解,这样的范围格式仅仅是为了方便和简洁而使用的,并且应当被灵活地解释为不仅包括被明确表述为范围界限的数值,而且还包括被包含于该范围内的单个数值或子范围,犹如明确表述了每个数值和子范围。例如,约1nm至约200nm的大小范围应当解释为不仅包括明确表述的约1nm和约200nm的界限,而且还包括单个大小诸如2nm、3nm、4nm,以及子范围诸如10nm至50nm、20nm至100nm等。
运输容器
现参考图38A-图38B,图中示出了根据本文所描述的一个实施方式而提供的运输容器3200的一个非限制性示例的分解透视图。应当理解,运输容器3200可被配置成具有本文其他各处所描述的任何其他运输容器的一个或多个特征。举非限制性示例而言,运输容器3200可有助于在其中运输一个或多个样品器皿。在一些实施方式中,运输容器3200提供了热控制内部区域以在将样品运输到另一位置(诸如但不限于分析设施)期间使不期望的样品热分解最小化。应当理解,在运输期间,运输容器可放置在一个或多个其他器皿内。
在一个实施方式中,可以从收集体液样品的样品收集装置提供样品器皿。举非限制性示例而言,样品器皿可在其中以液体形式包含样品。在大多数实施方式中,液体形式还包括为悬浮液的实施方式。
举非限制性示例而言,运输容器3200可具有任何尺寸。在一些情况下,运输容器3200可具有小于或等于约1m3、0.5m3、0.1m3、0.05m3、0.01m3、1000cm3、500cm3、300cm3、200cm3、150cm3、100cm3、70cm3、50cm3、30cm3、20cm3、15cm3、10cm3、7cm3、5cm3、3cm3、2cm3、1.5cm3、1cm3、700mm3、500mm3、300mm3、100mm3、50mm3、30mm3、10mm3、5mm3或1mm3的总容积。运输容器的占用面积和/或最大横截面积可小于或等于约1m2、0.5m2、0.1m2、0.05m2、100cm2、70cm2、50cm2、30cm2、20cm2、15cm2、10cm2、7cm2、5cm2、3cm2、2cm2、1.5cm2、1cm2、70mm2、50mm2、30mm2、10mm2、5mm2或1mm2。在一些情况下,运输容器可具有小于或等于约1m、75cm、50cm、30cm、25cm、20cm、15cm、12cm、10cm、9cm、8cm、7cm、6cm、5cm、4cm、3cm、2cm、1cm、0.7cm、0.5cm、0.3cm或1mm的尺寸(例如,高度、宽度、长度、对角线或周长)。在一些情况下,运输容器的最大尺寸可以不大于约1m、75cm、50cm、30cm、25cm、20cm、15cm、12cm、10cm、9cm、8cm、7cm、6cm、5cm、4cm、3cm、2cm、1cm、0.7cm、0.5cm、0.3cm或1mm。
可选地,运输容器可以是轻型的。在一些实施方式中,运输容器在其中具有或不具有样品器皿的情况下的重量可以小于或等于约10kg、5kg、4kg、3kg、2kg、1.5kg、1kg、0.7kg、0.5kg、0.3kg、100g、70g、50g、30g、20g、15g、10g、7g、5g、3g、2g、1g、500mg、300mg、200mg、100mg、70mg、50mg、30mg、10mg、5mg或1mg。
如图38A和图38B中所见,运输容器的一个实施方式可具有顶部覆盖物3210,用于热调节装置的外壳3220,用于运输容器的一个或多个插入托盘3230a、3230b,以及底板3240。
在一个实施方式中,顶部覆盖物3210具有基本上平坦的形状,但不排除其他形状。顶部覆盖物3210可覆盖热调节装置,诸如但不限于包含在运输容器中的加热器或冷却器。顶部覆盖物可以具有或者可以不具有与用于热调节装置的外壳3220相同的占用面积。冷却器、加热器或其他热调节装置3220可提供于运输容器3200内。可选地,所述装置3220可以是主动单元或被动单元。热调节装置可将运输容器3200内的样品器皿保持于期望的温度或低于预定阈值温度。可选地,热调节装置可以是本领域中已知的任何温度控制单元。可选地,热调节装置可以能够加热和/或冷却。可选地,热调节装置可以是热电冷却器。可选地,热调节装置可以包封在顶部覆盖物与用于冷却器的外壳之间。
可选地,顶部覆盖物和外壳可以形成或者可以不形成气密密封。顶部覆盖物和/或外壳可由具有期望的热导率的材料形成。例如,外壳3220可以具有可选择的热导率。在一个实施方式中,外壳可包括处于箱体材料内的嵌入的相变材料(PCM),因此各处温度基本上一致。PCM拥有非常好的温度曲线。期望不造成样品的过冷,诸如与冰相关联,这可能创造出低达-5℃的负降。PCM可被配置用于将温度范围控制在冰点以上。举非限制性示例而言,热导率可以是在约100-250W/m/K(瓦特/米/开尔文)之间的范围中。可选地,每个样品器皿将会与PCM相接触。一些实施方式可针对每个层具有一个PCM。PCM材料可以流塑到运输容器材料中。可选地,可以存在PCM材料的室。可选地,可以用PCM来填充托盘中的间隙。PCM可提供被动热控制技术。
可选地,PCM可并入到注射成型材料中。在这样的实施方式中,整个器皿可以是冷却介质。这还可防止PCM从运输容器中的室泄漏。当PCM直接整合到运输容器材料中时,运输容器大小还可以缩小。由于单位质量的储存容量增加,因此能量密度更大。将塑料与PCM材料相混合可被配置成既具有强度又能冷却。举非限制性示例而言,材料的30%可以是PCM而其余部分是提供刚度的塑料。举非限制性示例而言,材料的20%至40%之间可以是PCM,而其余部分是另一材料,诸如但不限于提供机械刚度的塑料。一些实施方式可使用由PCM或其他材料填充的、吹塑成型的外部。内部可以用不同的技术来形成,这是因为内部在外观上吸引人可能不是不关键的。可选地,还可以使用铸塑成型或其他较低温度成型工艺来替代整合有PCM的运输容器材料的注射成型或者与之相结合。嵌入的PCM还可以是在托盘中。一些实施方式可以是导热性大得多的托盘,以实现均匀、一致的冷却曲线。可选地,PCM材料包含在运输容器的底盘内的室中,其中所述室的壁可以比运输盒底盘的其他区域的壁厚度更薄。
在一个实施方式中,运输容器3200还可将托盘3230a和3230b中的每一个配置成使得样品器皿上的任何信息存储单元可容易地读取,而不必从托盘3230a和3230b移除样品器皿。在一个示例中,保持器在底部具有开口,该开口允许底部上的信息存储单元在样品器皿仍在托盘3230a和3230b中的同时可见。
图39示出了运输容器3200的多个视图。一些视图示出了托盘3230a或3230b中的样品器皿保持器可具有敞开的底部,以便可从下面或不要求将样品器皿从运输容器3200移除的其他定向来读取任何信息存储单元,诸如但不限于条形码或其他信息存储单元。可选地,仅移除运输容器3200的某些部分(诸如但不限于层、托盘等)来获得期望的信息。可选地,可以通过托盘中的一个或多个开口来访问条形码或其他信息存储单元。这允许对非常小的运输容器的条形码扫描。可选地,可以单独地扫描成行的样品器皿,或者可以一次全部扫描整个托盘。可选地,用户可以看到所有样品器皿保持器。可选地,计算机视觉系统还可扫描以查看诸如离心分离等步骤是否完成。这可以是在运输过程的任一端。所述计算机视觉系统可将样品器皿可视化,并且确定那里的样品是否处于确认完成了期望步骤的形式。如果其检测到错误,则系统可将该问题告知用户或系统以及/或者重新执行遗漏的和/或错误执行的步骤。可选地,保持器可以具有封闭的底部,并且信息可以是在运输容器3200的侧面或其他表面上。
在一些实施方式中,还可以设计保持器的形状以遵循位于其中的样品器皿3134的轮廓,从而增大接触表面面积并改善对样品器皿的热控制。可选地,样品器皿的热控制可通过与托盘和/或PCM的热传递而发生,但不与PCM直接接触。可选地,一些样品器皿3134还可以与器皿和/或PCM直接接触。样品器皿和/或保持器的开口可以成直线行、成蜂巢图案或成另一图案。
现参考图40A和图40B,图中示出了完全组装的运输容器3200。图40B示出了多个样品器皿3134,诸如与样品收集装置相关联的那些样品器皿。样品器皿3134可以全都来自与一个受试者相关联的样品,在这样的情况下可以使用关联于托盘3230a的信息存储单元来提供关于这组样品的信息。可选地,单个的样品器皿可以各自仍具有与托盘3230a的信息存储单元相同的信息存储单元,或者它们可以各自是唯一的。一些实施方式可将来自多个受试者的样品器皿插入到同一托盘3230a中。可选地,一些实施方式可以仅部分地填充每个托盘。一些实施方式可以填充托盘中的每个开口,但并非每个样品器皿都将会在其中具有样品(即,一些样品器皿可能是空样品器皿,其被插入以提供均匀的热分布)。这些可堆叠式托盘3230a可以具有闭合装置,该闭合装置使用诸如但不限于磁体、机械闩锁或其他耦合机构等元件来将托盘耦合在一起。在一些实施方式中,可以使用磁体来接合容纳样品器皿的托盘,以支持在装载和卸载的自动化过程中便于打开。可选地,用户不可以从运输容器移除托盘。可选地,用户不可以在不使用工具来释放托盘的情况下从运输容器移除托盘。一些实施方式具有按键机构(磁性的或其他技术)。以这种方式,患者服务中心可以放入样品但不可以将其取出。可选地,一些实施方式可具有选定的塑形开口,以使得个人不能够以错误的方式放置样品器皿和/或其保持器,以便防止用户错误。
在一个实施方式中,装载和/或卸载可以在温度调节房或室中发生,以将样品保持在期望的温度范围中。在一个实施方式中,期望具有在约1℃至10℃之间的温度范围。可选地,期望具有在约2℃至8℃之间的温度范围。可选地,期望具有在约4℃至5℃之间的温度范围。可选地,托盘230a和230b的材料可用于为样品器皿提供温度控制的气氛。一些实施方式使用对流来控制运输容器200内的热分布。
图40B还示出了在这一特定的实施方式中,可以存在针对O型环或其他密封件的凹槽3232,所述密封件可提供运输容器的层之间的紧密连接。系统还可包括闭合机构3234,诸如但不限于磁性闭合装置,用以将可堆叠式插入托盘保持在期望位置上。应当理解,一些实施方式可具有用于为一个或多个传感器布线的通孔3236,以便检测可堆叠式插入托盘在运输期间经历的条件。
图40C示出了当诸如可堆叠式托盘和盖板等各个组件联结在一起以形成运输容器3200时,图40A和图40B的实施方式的各个透视图。如图40C中所见,运输容器可包括多层样品器皿或具有样品器皿的托盘。可选地,一些实施方式可仅具有单层样品器皿。一些实施方式可以在运输容器3200的一层或多层中使用主动冷却或热控制。举非限制性示例而言,一个实施方式可以在顶层中具有热电冷却器。可选地,一些实施方式可使用主动热控制和被动热控制的组合。举非限制性示例而言,一个实施方式可具有热质,诸如但不限于已经处于期望温度的相变材料(PCM)。可以包括主动热控制单元以将PCM保持在期望的温度范围中。可选地,一些实施方式可仅使用诸如但不限于PCM等热质来将温度保持在期望范围中。
具有可移除式托盘的运输容器
参考图41,现将描述运输容器的又一实施方式。图41示出了具有热控制内部3302的运输容器3300,该热控制内部3302收容了可按阵列配置容纳多个样品器皿3306的托盘3304,其中器皿3306中的每一个以自由流动的、非芯吸的形式容纳其样品的大部分,并且其中每个器皿中存在约1ml或更少的样品流体。可选地,每个器皿中存在约2ml或更少的样品流体。可选地,每个器皿中存在约3ml或更少的样品流体。在一个非限制性示例中,将器皿布置成使得在每个运输容器中存在至少两个具有来自同一受试者的样品流体的器皿,其中至少第一样品包括第一抗凝剂而第二样品包括基质中的第二抗凝剂。
尽管图41示出了以阵列配置保持的样品器皿,但不排除其他预定配置。一些实施方式可将样品器皿放置在托盘中的铰接、摆动或其他保持机构中,该机构可允许在一个或两个自由度上的运动。一些实施方式可将样品器皿放置到这样的装置中:该装置在装载期间具有第一配置并且继而在运输期间呈现第二配置以保持样品器皿。一些实施方式可将样品器皿放置到这样的材料中:该材料在装载期间具有第一材料性质并且继而在运输期间呈现第二配置(诸如但不限于硬化)以保持样品器皿。
在一些实施方式中,样品器皿处于保持器3310中,并且托盘3304限定了大小被设定成配合保持器3310而非样品器皿的开口和/或腔体。举非限制性示例而言,保持器3310可用于当关联的器皿3306处于托盘3304中时将其物理地保持在一起。一些实施方式具有直接接触托盘3304的保持器3310,以便保护器皿不与托盘3304直接接触。在一个非限制性示例中,托盘可容纳至少100个器皿,或者可选地,至少50个各自具有两个器皿的保持器。
仍参考图41,运输容器3300的该实施方式可具有某种保持机构3320,诸如但不限于夹子、磁性区域等,以保持托盘3306。保持机构3320可被配置成以可在期望时释放的方式保持托盘3304。可选地,保持机构3320可被配置成以不可释放的方式保持托盘3304。在图41中所示的实施方式中,保持机构3320被示出为托盘3304中的磁性和/或金属构件,该构件被吸引到运输容器3300中的金属和/或磁性构件。当运输容器3300到达处理设施时,托盘3304可被配置成从运输容器3300移除。这可以通过使用包括但不限于使用强磁体来接合托盘3304中的磁性和/或金属构件等一种或多种技术而发生。一些实施方式可使用夹钳、挂钩或其他机械机构来从运输容器3300移除托盘3304。一些实施方式可使用多种技术的组合来移除托盘3304。还应当理解,一些实施方式可选择移除器皿3306和/或保持器3310,而托盘3304保留在运输容器3300中。一些技术可进行前述技术中的两个或更多个技术。
还应当理解,运输容器3300自身可以是冷却装置,包括热控制材料,诸如但不限于冰、PCM等。其他实施方式可将热控制材料直接整合到用于形成运输容器3300的材料中。如图41中所见,运输容器3300的一些实施方式可具有基本空余的空间3324,在其中收容或整合了一种或多种热控制材料。
仍参考图41,运输容器3300还可包括开口3330,用于铰链或其他连接装置的附接,该连接装置用于覆盖物或到运输容器3300的其他层的连接。为了易于说明,图41中未示出覆盖物和/或到覆盖物或其他层的连接。尽管一些实施方式可以仅使用单层,但应当理解,不排除多层的实施方式。
参考图42,现将描述运输容器3400的又一实施方式的分解透视图。图42的实施方式被设计用于将托盘3402保持在运输容器内部3404中。分解透视图示出了托盘3402中的保持器3410中的多个器皿3406。托盘3402可被配置成使得固位机构3420的一些或所有部分类似于托盘3402中的固位机构3320。还应当理解,托盘3402可具有一个或多个切口、凸起或特征,以允许托盘3402以有限数目的预定定向插入到所述内部中。一些实施方式可被配置用于仅支持托盘在器皿中的一个定向。一些实施方式可被配置用于仅支持托盘在器皿中的两个可能的定向。
图42示出了在一个实施方式中,运输容器3400可由两个单独的零件3430和3432形成。可选地,一些实施方式可由三个或更多个零件形成。可选地,一些实施方式可以是单一零件。零件3430和3432可具有由插塞3434和3436填充的开口。运输容器3400的内部3438可保持热控制材料,诸如但不限于冰、相变材料等。其他实施方式可将热控制材料直接整合到用于形成运输容器3400的材料中。
在一种情况下,可以用诸如但不限于PCM等热控制材料来填充零件3432的内部3433。可选地,一个实施方式可使用主动热控制材料,诸如但不限于热电冷却器,用以冷却所述内部。
参考图43,现将描述运输容器3500的又一实施方式。图43示出了运输容器3500可包括用于覆盖位于其中的特征和/或样品器皿的盖板3502。在一些实施方式中,盖板3502可包含绝热材料。可选地,盖板3502可包括热控制单元,用以辅助将运输容器3500的内部保持在期望的温度范围内。可选地,一些实施方式可将盖板3502配置成导热材料,其可通过从外部热控制源的热传递来帮助将运输容器3500的内部保持在期望的温度范围内。举非限制性示例而言,热控制源可以是冷却源、加热源、热电热交换器或其他热控制装置。还应当理解,还可以在层3516之下的空余空间3514中包含类似的热控制源,诸如但不限于PCM或主动冷却装置。
应当理解,用于保持保持器3310、3410或其他针对器皿的塑形保持器的特征3512可以位于与运输容器分离的零件中,或者其可一体形成于运输容器内。可选地,特征3512可以是托盘(诸如图41和图42中所示的托盘3302和3402)的一部分。这样的托盘可以是固定的,或者是可从运输容器3500移除的。还可以将保持机构3520并入到托盘中,以允许其在运输期间保持就位。
样品收集和运输
在实施方式中,本文提供了用于小体积的体液样品的收集或运输的系统和方法。
在实施方式中,可以运输包含小体积的体液样品的样品器皿。样品和样品器皿可具有本文其他各处所描述的任何相应特性。在实施方式中,样品器皿可包含小于或等于5ml、3ml、4ml、2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l或5l的体液样品。在实施方式中,样品器皿可具有小于或等于5ml、3ml、4ml、2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l或5l的内部容积。在实施方式中,样品器皿可具有小于或等于5ml、4ml、3ml、2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l或5l的内部容积,并且可包含填充了该器皿的至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%或100%的内部容积的体液样品。在实施方式中,样品器皿可被密封,例如,用帽、盖板或膜来密封。本文所描述的任何器皿内部尺寸或样品尺寸均可分别适用于密封的样品器皿的内部尺寸,或者处于其中的样品的尺寸。在实施方式中,密封的样品器皿可具有小于或等于5ml、4ml、3ml、2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l或5l的内部容积,并且其可以包含填充了该器皿的至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%、99%或100%的内部容积的体液样品,使得在密封器皿的内部容积中存在小于或等于2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l、5l、4l、3l、2l或1l的空气。因此,举例而言,密封的样品器皿可具有小于或等于300l的内部容积,并且其可以包含填充了该器皿的至少90%的内部容积的体液样品,使得在密封器皿的内部容积中存在小于或等于30ul的空气。在另一示例中,密封的样品器皿可具有小于或等于500l的内部容积,并且其可以包含填充了该器皿的至少80%的内部容积的体液样品,使得在密封器皿的内部容积中存在小于或等于100ul的空气。在另一示例中,密封的样品器皿可具有小于或等于150l的内部容积,并且其他可以包含填充了该器皿的至少98%的内部容积的体液样品,使得在密封器皿的内部容积中存在小于或等于3l的空气。
在实施方式中,包含样品的样品器皿还可包含抗凝剂。抗凝剂可溶解在样品中或以其他方式存在于器皿中(例如,干燥于器皿的一个或多个内部表面上,或者以固体形式位于器皿的底部)。包含样品的样品器皿可具有“总抗凝剂含量”,其中所述总抗凝剂含量是存在于器皿的内部容积中的抗凝剂的总量,并且包括溶解在样品中的抗凝剂(如果有的话),以及器皿中未溶解在样品中的抗凝剂(如果有的话)。在实施方式中,包含样品的样品器皿可包含不超过1ml的样品并且具有不超过3mg EDTA的总抗凝剂含量,可包含不超过750l的样品并且具有不超过2.3mg EDTA的总抗凝剂含量,可包含不超过500l的样品并且具有不超过1.5mg EDTA的总抗凝剂含量,可包含不超过400l的样品并且具有不超过1.2mg EDTA的总抗凝剂含量,可包含不超过300l的样品并且具有不超过0.9mg EDTA的总抗凝剂含量,可包含不超过200l的样品并且具有不超过0.6mg EDTA的总抗凝剂含量,可包含不超过150l的样品并且具有不超过0.45mg EDTA的总抗凝剂含量,可包含不超过100l的样品并且具有不超过0.3mg EDTA的总抗凝剂含量,可包含不超过75l的样品并且具有不超过0.23mg EDTA的总抗凝剂含量,可包含不超过50l的样品并且具有不超过0.15mg EDTA的总抗凝剂含量,可包含不超过40l的样品并且具有不超过0.12mg EDTA的总抗凝剂含量,可包含不超过30l的样品并且具有不超过0.09mg EDTA的总抗凝剂含量,可包含不超过20l的样品并且具有不超过0.06mg EDTA的总抗凝剂含量,可包含不超过10l的样品并且具有不超过0.03mg EDTA的总抗凝剂含量,或者可包含不超过5l的样品并且具有不超过0.015mgEDTA的总抗凝剂含量。在实施方式中,包含样品的样品器皿可包含不超过1ml的样品并且具有不超过2mg EDTA的总抗凝剂含量,可包含不超过750l的样品并且具有不超过1.5mg EDTA的总抗凝剂含量,可包含不超过500l的样品并且具有不超过1mg EDTA的总抗凝剂含量,可包含不超过400l的样品并且具有不超过0.8mg EDTA的总抗凝剂含量,可包含不超过300l的样品并且具有不超过0.6mg EDTA的总抗凝剂含量,可包含不超过200l的样品并且具有不超过0.4mg EDTA的总抗凝剂含量,可包含不超过150l的样品并且具有不超过0.3mg EDTA的总抗凝剂含量,可包含不超过100l的样品并且具有不超过0.2mg EDTA的总抗凝剂含量,可包含不超过75l的样品并且具有不超过0.15mg EDTA的总抗凝剂含量,可包含不超过50l的样品并且具有不超过0.1mg EDTA的总抗凝剂含量,可包含不超过40l的样品并且具有不超过0.08mg EDTA的总抗凝剂含量,可包含不超过30l的样品并且具有不超过0.06mg EDTA的总抗凝剂含量,可包含不超过20l的样品并且具有不超过0.04mg EDTA的总抗凝剂含量,可包含不超过10l的样品并且具有不超过0.02mg EDTA的总抗凝剂含量,或者可包含不超过5l的样品并且具有不超过0.01mgEDTA的总抗凝剂含量。在实施方式中,包含样品的样品器皿可包含不超过1ml的样品并且具有不超过30美国药典(USP)单位肝素的总抗凝剂含量,可包含不超过750l的样品并且具有不超过23USP单位肝素的总抗凝剂含量,可包含不超过500l的样品并且具有不超过15USP单位肝素的总抗凝剂含量,可包含不超过400l的样品并且具有不超过12USP单位肝素的总抗凝剂含量,可包含不超过300l的样品并且具有不超过9USP单位肝素的总抗凝剂含量,可包含不超过200l的样品并且具有不超过6USP单位肝素的总抗凝剂含量,可包含不超过150l的样品并且具有不超过4.5USP单位肝素的总抗凝剂含量,可包含不超过100l的样品并且具有不超过3USP单位肝素的总抗凝剂含量,可包含不超过75l的样品并且具有不超过2.3USP单位肝素的总抗凝剂含量,可包含不超过50l的样品并且具有不超过1.5USP单位肝素的总抗凝剂含量,可包含不超过40l的样品并且具有不超过1.2USP单位肝素的总抗凝剂含量,可包含不超过30l的样品并且具有不超过0.9USP单位肝素的总抗凝剂含量,可包含不超过20l的样品并且具有不超过0.6USP单位肝素的总抗凝剂含量,可包含不超过10l的样品并且具有不超过0.3USP单位肝素的总抗凝剂含量,或者可包含不超过5l的样品并且具有不超过0.15USP单位肝素的总抗凝剂含量。在实施方式中,包含样品的样品器皿可包含不超过1ml的样品并且具有不超过15USP单位肝素的总抗凝剂含量,可包含不超过750l的样品并且具有不超过11USP单位肝素的总抗凝剂含量,可包含不超过500l的样品并且具有不超过7.5USP单位肝素的总抗凝剂含量,可包含不超过400l的样品并且具有不超过6USP单位肝素的总抗凝剂含量,可包含不超过300l的样品并且具有不超过4.5USP单位肝素的总抗凝剂含量,可包含不超过200l的样品并且具有不超过3USP单位肝素的总抗凝剂含量,可包含不超过150l的样品并且具有不超过2.3USP单位肝素的总抗凝剂含量,可包含不超过100l的样品并且具有不超过1.5USP单位肝素的总抗凝剂含量,可包含不超过75l的样品并且具有不超过1.2USP单位肝素的总抗凝剂含量,可包含不超过50l的样品并且具有不超过0.75USP单位肝素的总抗凝剂含量,可包含不超过40l的样品并且具有不超过0.6USP单位肝素的总抗凝剂含量,可包含不超过30l的样品并且具有不超过0.45USP单位肝素的总抗凝剂含量,可包含不超过20l的样品并且具有不超过0.3USP单位肝素的总抗凝剂含量,可包含不超过10l的样品并且具有不超过0.15USP单位肝素的总抗凝剂含量,或者可包含不超过5l的样品并且具有不超过0.08USP单位肝素的总抗凝剂含量。
在实施方式中,可获得或运输包含来自单一受试者的样品的两个或更多个样品器皿。当获得或运输包含来自单一受试者的样品的两个或更多个样品器皿时,所述两个或更多个器皿可在包含或不包含来自其他受试者的样品的器皿中储存或运输。在实施方式中,可获得或运输包含来自单一受试者的样品的至少2、3、4、5、6、7、8、9或10个样品器皿。在实施方式中,可获得或运输包含来自单一受试者的样品的不超过2、3、4、5、6、7、8、9或10个样品器皿。在实施方式中,可获得或运输包含来自单一受试者的样品的至少2、3、4、5、6、7、8或9个样品器皿以及不超过3、4、5、6、7、8、9或10个样品器皿。在涉及包含来自同一受试者的样品的两个或更多个样品器皿的实施方式中,每个样品器皿中的样品可在相同或不同时间从受试者获得。在涉及包含来自同一受试者的样品的两个或更多个样品器皿的一些实施方式中,每个样品器皿中的样品可来自受试者身上的同一位置或来源部位。例如,可获得包含来自同一受试者的全血的两个样品器皿,其中这两个样品器皿都包含来自同一手指针刺部位的全血。在涉及包含来自同一受试者的样品的两个或更多个样品器皿的其他实施方式中,每个样品器皿中的样品来自受试者身上的不同位置/来源部位。例如,可获得包含来自同一受试者的全血的两个样品器皿,其中一个样品器皿包含来自第一手指针刺部位(例如,第一指/趾上)的全血,而第二样品器皿包含来自第二手指针刺部位(例如,第二指/趾上)的全血。在涉及包含来自单一受试者的样品的两个或更多个样品器皿的实施方式中,所述两个或更多个样品器皿可包含不同类型的抗凝剂或其他血液添加剂。例如,第一样品器皿可包含具有EDTA的全血而第二样品器皿可包含具有肝素的全血,其中样品来自同一受试者。在另一示例中,第一样品器皿和第二样品器皿可包含具有EDTA的全血而第三样品器皿可包含具有肝素的全血,其中样品来自同一受试者。在另一示例中,第一样品器皿可包含具有EDTA的全血,第二样品器皿可包含具有肝素的全血,而第三样品器皿可包含具有柠檬酸钠的全血,其中样品来自同一受试者。在涉及包含来自单一受试者的样品的两个或更多个样品器皿的实施方式中,所述两个或更多个样品器皿可包含来自受试者的不同类型的样品。例如,第一样品器皿可包含全血而第二样品器皿可包含来自同一受试者的血浆。在另一示例中,第一样品器皿可包含全血而第二样品器皿可包含来自同一受试者的尿。在另一示例中,第一样品器皿和第二样品器皿可包含全血,而第三样品器皿可包含来自同一受试者的唾液。
在本文提供的系统和方法中,可从受试者获得总体积的体液样品。总体积的体液样品可转移到单一样品器皿中,或转移到两个或更多个样品器皿中。例如,可从受试者获得总体积为500微升的体液样品,并且可将其转移到单一样品器皿中,其中所述单一样品器皿具有600微升的最大内部容积。在另一示例中,可从受试者获得总体积为500微升的体液样品,并且可将其转移到两个样品器皿中,其中每个样品器皿具有300微升的最大内部容积。在另一示例中,可从受试者获得总体积为500微升的体液样品,并且可将其转移到两个样品器皿中,其中一个样品器皿具有400微升的最大内部容积而一个样品器皿具有100微升的最大内部容积。在本文提供的系统和方法中,可从受试者获得小于或等于5ml、4ml、3ml、2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l、5l或1l的总体积的体液样品。来自受试者的总体积的体液样品可在1、2、3、4、5、6、7、8、9、10个或更多个样品器皿之间分配,如本文其他各处所描述。当来自受试者的总体积的体液样品在两个或更多个样品器皿之间分配时,在一些或所有不同的样品器皿中的总体积的体液样品的部分可包含不同的抗凝剂或其他添加剂。例如,可从受试者获得总体积为500微升的体液样品,并且可将其转移到两个样品器皿中,其中一个样品器皿包含混有EDTA的250微升体液样品,而一个样品器皿包含混有肝素的250微升体液样品。通常,如本文所使用,总体积的体液样品意指单一类型的体液样品——例如,全血或尿或唾液等。
在实施方式中,包含全血的样品器皿在其存储或运输之前可被离心分离,以使得全血在样品器皿运输之前被分离成血浆和沉淀的细胞。在其他实施方式中,包含全血的样品器皿在其存储或运输之前不被离心分离。
在本文提供的系统和方法的一些实施方式中,体液样品在其收集之后并且在其运输之前可被干燥。在实施方式中,干燥的样品可于以后重建成液体形式,诸如在对样品的分析或处理时重建。
在本文提供的系统和方法的实施方式中,可将样品器皿从第一位置运输到第二位置。第一位置可以是从受试者收集样品的位置,并且第二位置可以是为了处理或分析该样品而执行一个或多个步骤的位置。样品和样品器皿可具有本文其他各处所描述的任何相应特性。例如,样品可以是液体、非基质的、非芯吸的形式。样品器皿可以在如本文所描述的运输容器中或其他结构中运输。例如,在一些可选的实施方式中,可以在包、小袋、信封、盒子、胶囊或其他结构中运输样品器皿。在实施方式中,所述第一位置和所述第二位置可以在同一房间、建筑物、园区或建筑群内。在实施方式中,第一位置和第二位置可相隔至少1米、5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米或500千米。在实施方式中,第一位置和第二位置可相隔不超过5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米、500千米或1000千米。在实施方式中,第一位置和第二位置可相隔至少1米、5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米或500千米并且不超过5米、10米、50米、100米、500米、1千米、5千米、10千米、15千米、20千米、30千米、50千米、100千米、500千米或1000千米。在第一位置是从受试者获得样品的位置的实施方式中,可以在从受试者收集样本的48小时、36小时、24小时、12小时、8小时、6小时、4小时、3小时、2小时、1小时、45分钟、30分钟、15分钟、10分钟、5分钟、1分钟或30秒内将样品器皿从第一位置运输至第二位置。
本文所使用的“样品接收场所”是可以接收经运输的样品的地方,并且其中可对样品执行一个或多个步骤。例如,到达样品接收场所的样品可以在该样品接收场所得到处理、分析或处置,例如,作为对样品的检测或测定的一部分。可以例如在本文所描述的任何器皿或装置中运输样品。在实施方式中,样品接收场所可包含一个或多个样品处理装置,所述样品处理装置可用于处理或分析样品。样品处理装置可以是例如在2011年9月26日提交的美国专利申请序列号13/244,947中所描述的,或者如本文其他各处通过引用而并入的任何其他文件中所描述的。在样品从样品收集场所向样品接收场所的运输期间,该样品可经过任何数目的位置。在实施方式中,第一位置可以是样品收集场所,而第二位置可以是样品接收场所。
参考图44,现将描述体液样品收集和运输的一个实施方式。图44示出了位于受试者的皮肤表面S上的体液样品B。在图44的非限制性示例中,体液样品B可由多种装置中的一种来收集。举非限制性示例而言,收集装置3530可以是但不限于在2012年9月6日提交的美国专利申请序列号61/697,797中所描述的那些收集装置,该文献通过引用而全文并入于此用于所有目的。在本实施方式中,体液样品B由一个或多个毛细管通道收集,并继而被引导至样品器皿3540中。举非限制性示例而言,样品器皿3540中的至少一个样品器皿可具有最初处于部分真空下的内部,用于将体液样品吸入至样品器皿3540中。一些实施方式可同时从样品收集装置中的相同或不同的收集通道将样品从样品收集装置吸入至样品器皿3540中。可选地,一些实施方式可同时将样品吸入至样品器皿中。
在本实施方式中,在体液样品处于样品器皿3540内之后,将位于其保持器3542中(或者可选地,从其保持器3542移除)的样品器皿3540装载至运输容器3500中。在该实施方式中,可以存在大小设置为针对样品器皿保持器3542的一个或多个槽,或者针对运输容器3500中的样品器皿的槽。举非限制性示例而言,所述槽可按阵列配置容纳样品器皿并且定向成垂直的或一些其他预定的定向。应当理解,样品器皿3540的一些实施方式被配置成使得它们在每个器皿中容纳不同量的样品。举非限制性示例而言,这可以基于每个样品器皿中的真空力的量、收集装置的一个或多个样品收集通道中收集的样品量以及/或者其他因素而得到控制。可选地,在样品器皿中还可以存在不同的预处理,诸如但不限于不同的抗凝剂等。
如图44中所见,样品器皿3540正在第一位置(诸如但不限于样品收集场所)处收集样品。举非限制性示例而言,体液样品继而在运输容器3500中运送至第二位置,该第二位置诸如但不限于接收场所,诸如但不限于分析场所。运输方法可以是通过快递、邮政速递或其他运输技术。在许多实施方式中,可通过具有将运输容器容纳于其中的又一容器来实现运输。在一个实施方式中,样品收集场所可以是护理点。可选地,样品收集场所是服务点。可选地,样品收集场所远离样品分析场所。
尽管图44的本实施方式示出了从受试者的表面对体液样品的收集,但其他备选实施方式可使用用于从受试者的其他区域收集样品的收集技术,诸如通过静脉穿刺,以填充一个或多个样品器皿3540。不排除这样的其他收集技术用于作为表面收集的备选或与表面收集联合使用。表面收集可以在受试者的外表面上。可选地,一些实施方式可从受试者体内可及的表面进行收集。体液样品B在这些表面上的存在可以自然出现或者可以通过伤口创造或使体液表面可及的其他技术而出现。
现参考图45,在此描述了又一实施方式,其中相比于收集汇集于受试者的表面上的样品,可以从受试者体内收集体液样品。图45的该实施方式示出了具有皮下注射针3552的收集装置3550,该皮下注射针3552被配置用于收集体液样品,诸如但不限于静脉血。在一个实施方式中,体液样品可以填充装置3550中的室3554,此时,可以接合一个或多个样品器皿3540以将样品吸入至相应的一个或多个器皿中。可选地,一些实施方式可不具有室3554,而是除了用于将样品从针3552引导至一个或多个样品器皿3540的一个或多个通道、一个或多个通路或一个或多个管之外具有非常小的空余空间。对于体液样品诸如血液,来自血管内的压强是使得血液样品可以填充室554而无需来自收集装置的很多(如果有的话)辅助。这样的实施方式可以可选地包括一个或多个排放孔,诸如但不限于端口,用以在收集装置中的通道被样品填充时允许空气逸出。
至少一些或所有实施方式可具有填充指示器,诸如但不限于观察窗口或开口,其示出样品何时存在于收集装置内并从而指示出接合一个或多个样品器皿3540是可接受的。可选地,不排除不具有填充指示器的实施方式。在达到期望的填充水平之后,可以将一个或多个被填充的样品器皿3540从样品收集装置断开。可选地,可以将一个或多个额外的样品器皿3540接合至样品收集装置3550(或530),以收集额外量的体液样品。
图46示出了样品收集装置3570的进一步实施方式。在此描述的该实施方式具有组织穿透部分3572,诸如但不限于具有执握部分3574的皮下注射针。执握部分3574可促进组织穿透部分3572的定位,以更准确地进入患者达期望的深度和位置。在本实施方式中,一个或多个样品收集器皿3540位于不与组织穿透部分3572直接物理接触的载体3576中。流体连接通路3578,诸如但不限于柔性管,可以用于将组织穿透部分3572与一个或多个样品收集器皿3540相连接。一些实施方式具有一个或多个这样的样品器皿3540:该样品器皿3540被配置成可滑动的,以仅在用户的控制下才与组织穿透部分3572流体连通。至少一些或所有实施方式可具有填充指示器,诸如但不限于观察窗口或开口,其示出样品何时存在于收集装置内并从而指示出接合一个或多个样品器皿3540是可接受的。可选地,不排除不具有填充指示器的实施方式。一些实施方式可以可选地包括一个或多个排放孔,诸如但不限于端口,用以在收集装置中的通道被样品填充时允许空气逸出。在大多数实施方式中,在达到期望的填充水平之后,可以将一个或多个被填充的样品器皿3540从样品收集装置断开。可选地,可以将一个或多个额外的样品器皿3540接合至样品收集装置3570,以收集额外量的体液样品。
样品处理
现参考图47,图中示出了在到达目的位置之后通过卸载组装件3600来卸载其内容物的运输容器3500的系统视图。在一个实施方式中,在将盖板3502定位于开放位置之后,可以从器皿3500中移除位于其中的样品器皿。举非限制性示例而言,所述移除可通过移除样品器皿的整个托盘、从托盘移除多个样品器皿的保持器以及/或者通过单个地移除样品器皿而进行。一些实施方式可使用机器人控制结构3602,所述机器人控制结构3602可如箭头3604所指示的那样垂直移动以及/或者如箭头3606所指示的那样沿着横动桥形台3608水平移动,以从运输容器3500移除样品器皿。可以使用可编程处理器3610来控制用于操纵样品器皿的结构3602的位置。在一个实施方式中,结构3602包括磁体,该磁体用于接合固位机构,以从结构3602移除托盘。不排除使用机械臂和/或其他类型的可编程操纵器的其他实施方式,并且可将其配置用于本文的用途。
在实施方式中,当包含样品的样品器皿到达用于该样品的处理或分析的位置时,可将样品从样品器皿移除。可以在从样品器皿移除样品之前处理(例如,摇动、旋转、混合或离心分离)样品器皿。可以通过任何适当的机制从样品器皿移除样品,所述机制诸如为吸取(例如,由流体处理系统或移液器吸取)、倾倒或机械力(例如,通过减小样品器皿内部区域的尺寸来从器皿压出样品)。在实施方式中,当从样品器皿移除样品时,很少的或没有样品仍留在器皿中(例如,作为机械/转移损失)。例如,在从器皿移除样品之后,少于或等于50l、40l、30l、20l、15l、10l、5l、4l、3l、2l、1l或0l的样品可能残留在样品器皿中。
举非限制性示例而言,可继而使用诸如在2011年9月26日提交的美国专利申请序列号13/244,947中所描述的系统来处理样品器皿中的样品,该文献通过引用而全文并入于此用于所有目的。可以按如在2011年9月26日提交的美国专利申请序列号13/244,946中所描述的符合CLIA的方式来配置分析系统,该文献通过引用而全文并入于此用于所有目的。在实施方式中,根据本文提供的系统和方法而运输的样品在到达用于处理或分析的位置时可分成两个或更多个更小的部分,并且可对样品进行各种测定。例如,在实施方式中,可对根据本文提供的系统和方法而运输的样品进行至少1、2、3、4、5、6、7、8、9、10、20、30、40或50种测定。所述测定可包括不同类型的测定(例如,用于测定蛋白质、核酸或细胞)并且使用一种或多种检测方法(例如,细胞计数、发光或基于分光光度计的方法)。在实施方式中,可运输包含来自单一受试者的样品的两个或更多个样品器皿,其中所述两个或更多个样品器皿包含与样品相混合的至少两种不同的抗凝剂(例如,一个样品器皿包含EDTA-样品而一个样品器皿包含肝素-样品)。来自EDTA-样品器皿的样品可继而用于肝素敏感的或EDTA不敏感的一种或多种测定。类似地,来自肝素-样品器皿的样品可继而用于EDTA敏感的或肝素不敏感的一种或多种测定。在实施方式中,根据本文提供的系统和方法而运输的样品在到达目的地时可分成两个或更多个部分,并在1、2、3、4、5、6、7、8、9、10个或更多个不同的样品分析仪上得到分析。
现参考图49至图51,应当理解,可以使用根据本文提供的系统或方法而制备或运输的、来自受试者的样品来进行列表(图49至图51)上的检测中的至少任何两种检测。例如,可使用来自受试者的体液样品而进行列表上的至少两种检测,其中用于进行检测的体液样品的总体积不超过300微升,并且来自受试者的总体积的体液样品以液体形式在具有400微升或更小的内部容积的样品器皿中运输。在另一示例中,可使用来自受试者的体液样品而进行列表上的至少两种检测,其中用于进行检测的体液样品的总体积不超过300微升,并且来自受试者的总体积的体液样品以液体形式在第一样品器皿和第二样品器皿中运输,每个器皿具有200微升或更小的内部容积,第一样品器皿包含混有第一抗凝剂的体液样品而第二样品器皿包含混有第二抗凝剂的体液样品。在实施方式中,可使用来自受试者的体液样品而进行列表(图49至图51)上的至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50或60种检测,所述体液样品具有不大于或等于5ml、4ml、3ml、2ml、1.5ml、1ml、750l、500l、400l、300l、200l、150l、100l、75l、50l、40l、30l、20l、10l、5l或1l的总体积。总体积的体液样品可在单一样品器皿中储存或者从收集场所运输至分析或处理位置,或者其可在2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25个或更多个样品器皿之间分配。当来自单一受试者的体液样品的总体积分到两个或更多个样品器皿中时,在一些或每个样品器皿中的样品部分可包含不同的抗凝剂或其他添加剂。在示例中,来自受试者的总体积不超过300微升的体液样品可用于进行两种或更多种检测,其中不超过300微升的样品的至少一个部分混有第一抗凝剂,而不超过300微升的样品的第二部分混有不同于第一抗凝剂的第二抗凝剂。可选地,不超过300微升的样品的每个部分处于其自己的样品器皿中。可选地,可进行两种或更多种检测,其中不超过300微升的样品全都在单一器皿中运输并且包含单一的抗凝剂。可选地,可以使用用于所有检测的、总体积不超过300微升的来自受试者的血液来进行所述列表上的至少任何三种检测。可选地,可以使用用于所有检测的、总体积不超过300微升的来自受试者的血液来进行所述列表上的至少任何五种检测。可选地,可以使用用于所有检测的、总体积不超过300微升的来自受试者的血液来进行所述列表上的至少任何七种检测。可选地,可以使用用于所有检测的、总体积不超过300微升的来自受试者的血液来进行所述列表上的至少任何十种检测。可选地,可以使用用于所有检测的、总体积不超过300微升的来自受试者的血液来进行所述列表上的至少任何十五种检测。可选地,可以使用用于所有检测的、总体积不超过300微升的来自受试者的血液来进行所述列表上的至少任何二十种检测。对于任何上述情况,在至少一些实施方式中,至少一个部分具有第一抗凝剂而第二部分具有不同于第一抗凝剂的第二抗凝剂。
现参考图52,图中示出了用于体液样品收集的装置的又一实施方式。图52示出了正在由收集装置3710收集的、受试者的体液样品B。如图52中所见,收集装置3710可包括收集部分3712,诸如但不限于毛细管或其他收集结构。收集部分3712在其中吸取流体,最后朝向装置3710的内腔3714引导该流体。在收集部分3712已经收集了期望的量之后,可如图52中所示那样定向整个装置3710,以使得重力可继而将样品吸入到腔体3714中。在已将所有样品B移入腔体3714中之后,可从装置3710移除收集部分3712。在一个实施方式中,移除并用封闭的帽3718来替换帽和收集部分3712。在一个非限制性示例中,帽3718可以是在其上没有任何开口的帽。可选地,一些实施方式可在帽中具有隔片或其他可封闭的开口,其中可在不必用不同配置的新帽来替换所述帽的情况下移除收集部分3712。
模块化样品收集装置
现参考图53A-图53C,尽管本文的实施方式通常将样品收集装置描述为具有用于将样品收集部分3740与样品储存器皿3760相连接的适配器部分3750,但应当理解,不排除没有这样的配置的实施方式。
举图53A中的非限制性示例而言,一个或多个适配器部分3750可以是分立元件,其最初不与收集部分3740或样品储存器皿3760中的任一个直接流体连通。在此,收集部分3740可通过在收集部分、适配器部分3750或者一个或多个器皿3760中的一个或多个之间的相对运动的方式(按顺序或者同时)而连接至器皿3760,以创造从收集通道经过所述一个或多个适配器通道通往所述器皿中的流体通路。
举图53B中的非限制性示例而言,如本文先前所提出,一些实施方式可以没有分立的、单独的适配器部分3750。在此,收集部分3740可通过如箭头3770所指示的在这些元件中的一个或全部两个元件之间的相对运动的方式而直接连接至器皿3760。如图53B中所见,可以存在流体流动特征3780,其具有如箭头3782所指示的在这些元件中的一个或全部两个元件之间的相对运动。在一个非限制性示例中,该流体流动特征3780可以是接合收集部分3740的一端的帽,以促进流体流入器皿3760中。可选地,流体流动特征3780可以是具有被塑形用以接合收集部分3740的前表面的帽。可选地,流体流动特征3780可以是柱塞、杆和/或其他用以促进朝向样品储存器皿3760的流动的装置。可选地,直到样品收集部分3740准备好接合器皿3760时,流体流动特征3780才完全接合。可选地,可以配置一些实施方式以使得从收集部分3740向样品储存器皿3760的流动不使用流体流动特征3780,而是取而代之地基于不同的动力,诸如但不限于重力、真空抽吸或在收集部分3740的适当端处提供的吹力。
举图53C中的非限制性示例而言,一个或多个实施方式可使用收集部分3740作为储存器皿。一旦达到了期望的填充水平,一些实施方式可简单地用帽3790和3792来盖住全部两端。如图53C中的图中所见,帽3790和3792甚至在部分3740处于垂直定向时仍可保持流体于其中。
对于本文所描述的实施方式可能存在变化和替代,并且不应当将任何单一实施方式解释为包含整个发明。例如,在收集部分3740中可以存在两个或更多个毛细管。可选地,它们可各自形成为分立的管或通道。可选地,一些实施方式可具有公共初始部分但具有分离的出口端口,诸如但不限于Y形配置。应当理解,可以修改本文的任何实施方式以包含针对图53A-图53C的描述中所阐述的特征。
现参考图54,在样品器皿3800到达期望的处理目的地之后,器皿3800中的样品可得到适当制备。在一个实施方式中,器皿3800类似于器皿3710。如图54中所见,可以处理样品以整分出一份到处理装置中,诸如但不限于筒匣3802上的入口以及到另一筒匣3804上的另一入口。在一个实施方式中,两个筒匣3802都是为了血液化学检测而处理样品的微流体盘,所述血液化学检测诸如为但不限于:全面代谢功能组(Comprehensive Metabolic Panel)(ALB、ALP、ALT、AST、BUN、Ca、Cl-、CRE、GLU、K+、Na+、TBIL、tCO2、TP);基础代谢功能组(Basic Metabolic Panel)(BUN、Ca、CRE、eGFR、GLU、Cl-、K+、Na+、tCO2);血脂组(Lipid Panel)(CHOL、HDL、CHOL/HDL、LDL、TRIG、VLDL、nHDLc);血脂组升级版(Lipid Panel Plus)(tCHOL、HDL、CHOL/HDL比、LDL、TRIG、VLDL、GLU、ALT、AST、nHDLc);肝脏组升级版(Liver Panel Plus)(ALB、ALP、ALT、AST、AMY、TBIL、TP、GGT);电解质组(Electrolyte Panel)(Cl-、K+、Na+、tCO2);普通化学(General Chemistry)(ALB、ALP、ALT、AMY、AST、BUN、Ca、CRE、eGFR、GGT、GLU、TBIL、TP、UA);普通化学6(General Chemistry 6)(ALT、AST、CRE、eGFR、GLU、BUN、GGT);肾脏功能组(Renal Function Panel)(ALB、BUN、Ca、CRE、eGFR、GLU、Cl-、K+、Na+、tCO2PHOS);Metlyte(Cl-、K+、Na+、tCO2、BUN、CK、CRE、eGFR、GLU);肾功能(Kidney Function)(BUN、CRE、eGFR);肝功能组(Hepatic Function Panel)(ALB、ALP、ALT、AST、DBIL、TBIL、TP);基础代谢功能组(Basic Metabolic Panel)(BUN、Ca、CRE、eGFR、GLU、Cl-、K+、Na+、tCO2、Mg、LDH);MetLyte Plus CRP(Cl-、K+、Na+、tCO2、BUN、CK、CRE、eGFR、GLU、CRP);生化组升级版(BioChemistry Panel Plus)(ALB、ALP、ALT、AMY、AST、BUN、Ca、CRE、eGFR、CRP、GGT、GLU、TP、UA);MetLac(ALB、BUN、Ca、Cl-、CRE、GLU、K+、LAC、Mg、Na+、Phos、tCO2)。应当理解,在未来可能研发的其他流体处理技术也可适于在本文的至少一个实施方式中使用。在一些实施方式中,可使用管道将流体运送到诸如但不限于筒匣上的流体接收端口等目的地,来将样品递送至一个或多个通用化学微流体/离心分离筒匣3802(和/或3804)。还可以使用至少一个或多个其他筒匣,诸如但不限于如通过引用而并入本文的申请中所描述的开放流体移动式筒匣,来改进可用的检测类型。尽管示出了至少两个目的地筒匣,但应当理解,不排除具有不止两个筒匣的实施方式(如以虚线示出的附加筒匣所示)。流体运输可以通过移液器、通过流体管道、微流体或通过未来可能研发的其他流体处理技术。
现参考图55A,应当理解,一些实施方式可以使用具有一个或多个移液器的样品处理系统来以无管方式从器皿3800抽取样品。尽管该实施方式中描述了一个或多个移液器,但应当理解,在未来可能研发的其他流体处理技术也可适于在本文的至少一个实施方式中使用。图55A示出了可用于整分样品的自动化系统。还应当理解,在一些实施方式中,在整分之前、期间或之后,可存在样品稀释以便增加样品的液体体积。这可有益于各种目的。图55A还示出了在一些实施方式中,可将样品递送至一个或多个通用化学微流体/离心分离筒匣3802(和/或3804)。还可以使用至少一个或多个其他筒匣,诸如但不限于如通过引用而并入本文的申请中所描述的开放流体移动式筒匣,来改进可用的检测类型。尽管示出了至少两个目的地筒匣,但应当理解,不排除具有不止两个筒匣的实施方式(如以虚线示出的附加筒匣所示)。流体运输可以通过移液器、通过流体管道、微流体或通过未来可能研发的其他流体处理技术。一些实施方式可使用相同的技术来将样品移动至筒匣或者一个或多个其他目的地,或者可选地,一些实施方式可使用一种或多种技术的组合来移动样品。通过示例而非限制的方式而言,检测可涉及使用其他检测技术,诸如但不限于ELISA、核酸扩增、显微术、分光光度法、电化学和/或其他检测技术,来扩充可以使用筒匣3806进行的、除了通用化学检测之外的分析类型。可选地,应当理解,在此可以随同从器皿3800进行整分的系统一起使用不止一个筒匣3802和/或单独单元筒匣3806。
现参考图55B,图中示出了进一步的实施方式,其中示出了器皿3800在其内具有样品流体。在一个示例中,在其中的样品流体可以是“纯净的”或未稀释的。可选地,可以配置一些实施方式以使得样品可在收集场所和/或接收场所受到预处理,以稀释该样品和/或向该样品中提供某种化学材料。如图55B中所见,流体处理系统可使用移液器3602将来自器皿3800的样品整分到一个或多个其他器皿3810、3812和/或3814。举非限制性示例而言,这些器皿3810、3812或3814可以是与器皿3800相同的器皿。可选地,它们可以是不同类型的器皿。基于条形码或关于样品的其他信息,将处理器编程以确定针对样品的至少一个期望的样品稀释度和整分物的至少一个期望的数目。在该非限制性示例中,将整分物各自运输至一个样品处理单元3820、3822和3824。这些处理单元可以都是相同类型的处理单元,每个处理单元可以是彼此不同的类型,或者一些处理单元可以相同而一些处理单元可以不同。在至少一个非限制性示例中,样品处理单元可以是单一样品处理器或者可同时处理多个样品的批量处理器。
图55C示出了进一步的实施方式,其中在收集场所收集样品并继而在样品保持液体形式的同时将其运输至第二场所。图55C示出了具有可从受试者身上的单一伤口收集的样品的多个器皿。这允许受试者提供可在每个器皿中由不同类型的化学品进行处理的多个样品。图55C示出了可以将可包含来自仅一个受试者的样品或来自多个受试者的多个样品的运输容器运送到接收场所的快递员。尽管示出了人类快递员,但应当理解,不排除机器人运输、无人机或者未来可能研发的其他运输技术、系统或装置(包括但不限于对样品的一个或多个“虚拟”版本的运输)。在该非限制性示例中,接收场所可将一个或多个器皿1504从运输容器装载到具有可独立移动的试剂单元和/或测定单元的筒匣中。继而可将该筒匣装载到一个或多个处理模块701至707中。这些单元可以是相同的模块。可选地,所述模块中的至少一个模块不同于其他模块。类似于图55B,一些实施方式可包括处理器3830,该处理器3830可在将包含样品和/或预稀释的样品的器皿1504或者一个或多个其他器皿装载到筒匣中之前,协调来自器皿1504的样品的稀释和/或整分(基于器皿ID或其他关联信息)。在本文的至少一个实施方式中,每个模块可接收至少一个筒匣和至少一个样品器皿。可选地,可以在每个筒匣中放置不止一个样品器皿。可选地,样品器皿可包含不同类型的样品,以使得筒匣可具有装载到其中的不止一种类型的样品。可选地,一些实施方式可具有带有至少一个针对筒匣的接收区域和至少一个针对样品的接收区域的模块。
可选地,一些实施方式可以仅具有一个用于接收筒匣的位置,该筒匣继而也包含至少一个样品。以这种方式,用户不得不将单独的物件装载到模块中的风险得到降低。一旦装载,配置本文的至少一个实施方式以使得一旦样品被插入到模块中,就不再有对样品的用户操纵。该非限制性示例可以用于在一旦样品正在模块中被处理的情况下使关联于人为因素的错误最小化。
还应当理解,一些实施方式可使用离心力或其他力来同时处理多个样品,以将样品在样品器皿内降低到沉淀水平。在一个非限制性示例中,这可通过托盘离心机(诸如但不限于384孔板离心机)的方式而实现。
图55C示出了根据本发明的实施方式的、具有多个模块701-706和细胞计数站707的系统700。所述多个模块包括第一模块701、第二模块702、第三模块703、第四模块704、第五模块705和第六模块706。
细胞计数站707通过样品处理系统708可操作地耦合至多个模块701-706中的每个模块。如本文所描述,样品处理系统708可包括移液器,诸如容积式、排气式或吸取式移液器。
如在上文和在本发明的其他实施方式中所述,细胞计数站707包括用于对样品执行细胞计数的细胞计数器。细胞计数站707可对样品执行细胞计数,而同时模块701-706中的一个或多个模块对另一样品执行其他制备和/或测定规程。在一些情况下,细胞计数站707在样品已于模块701-706中的一个或多个模块内经历样品制备之后,对样品执行细胞计数。
系统700包括具有多个台位(或安装台)的支撑结构709。所述多个台位用于将模块701-706对接到支撑结构709。如图所示,支撑结构709为机架。
每个模块借助于附接构件固定到机架709。在一个实施方式中,附接构件是紧固到模块或台位的挂钩。在这样的情况下,该挂钩被配置用于滑入模块或台位的插座之中。在另一实施方式中,附接构件包括紧固件,诸如螺丝紧固件。在另一实施方式中,附接构件由磁性材料形成。在这样的情况下,模块和台位可包括相反极性的磁性材料,以便提供吸引力来将模块固定到台位。在另一实施方式中,附接构件包括台位中的一个或多个轨道或导轨。在这样的情况下,模块包括用于与一个或多个轨道或导轨配合的一个或多个结构,从而将模块固定到机架709。可选地,可由导轨提供功率。
可允许模块与机架配合的结构的示例可以包括一个或多个销钉。在一些情况下,模块直接从机架接收功率。在一些情况下,模块可以是在内部为装置供电的功率源,如锂离子电池或者以燃料电池为动力的电池。在示例中,模块配置成借助于导轨与机架配合,而模块的功率直接来自于导轨。在另一示例中,模块借助于附接构件(导轨、销钉、挂钩、紧固件)与机架配合,但是无线地——诸如感应地(即,感应耦合)——向模块提供功率。在一些实施方式中,与机架配合的模块不一定需要销钉。例如,可以在模块与机架或其他支座之间提供感应电通信。在一些情况下,可以使用无线通信,诸如借助于ZigBee通信或其他通信协议或在未来可研发的协议。
每个模块可从机架709移除。在一些情况下,一个模块可用同样的、相似的或不同的模块替换。在一个实施方式中,通过将模块滑出机架709而从机架移除该模块。在另一实施方式中,通过扭转或转动模块从而使模块的附接构件从机架709脱离,而从机架709移除该模块。从机架709移除模块可终止模块与机架709之间的任何电连通性。
在一个实施方式中,通过使模块滑入台位而将模块附接到机架。在另一实施方式中,通过扭转或转动模块从而使模块的附接构件接合机架709,而将模块附接至机架。将模块附接至机架709可以在模块与机架之间建立电连接。所述电连接可用于向模块或者从模块向机架或向装置提供功率,以及/或者在模块与一个或多个其他模块或者系统700的控制器之间提供通信总线。
可占用或不占用机架的每个台位。如图所示,机架709的所有台位均由模块占用。然而,在一些情况下,机架709的一个或多个台位未被模块占用。在示例中,第一模块701已从机架移除。在这样的情况下,系统700可在不带有被移除的模块的情况下操作。
在一些情况下,台位可被配置用于接纳系统700被配置成要使用的模块类型的子集。例如,台位可被配置用于接纳能够运行凝集测定而非细胞计数测定的模块。在这样的情况下,该模块可以是“专用”于凝集的。可以通过多种方式测量凝集。测量样品浊度的时间依赖性变化是一种方法。可以通过用光照射样品并用光学传感器(诸如光电二极管或相机)测量90度的反射光来实现这种方法。随时间推移,由于更多的光被样品散射,所测量的光将会增加。测量透射率的时间依赖性变化是另一示例。在后一种情况下,这可通过照射器皿中的样品并用光学传感器(诸如光电二极管或相机)测量穿过样品的光来实现。随时间推移,由于样品凝集,所测量的光可减少或增加(例如,取决于凝集的材料是保持在悬浮液中还是从悬浮液中沉淀出来)。在其他情况下,台位可被配置用于接纳系统700被配置成要使用的所有类型的模块,范围从检测站到支持电气系统。
每个模块可被配置成与其他模块相独立地发挥功能(或执行)。在示例中,第一模块701配置成与第二模块702、第三模块703、第四模块704、第五模块705和第六模块706相独立地执行。在其他情况下,模块被配置成与一个或多个其他模块一起执行。在这样的情况下,模块可支持一个或多个样品的并行处理。在示例中,在第一模块701制备样品的同时,第二模块702对相同的或不同的样品进行测定。这可以支持对模块间停工期的最小化和消除。
支撑结构(或机架)709可以具有服务器类型配置。在一些情况下,机架的各尺寸是标准化的。在示例中,模块701-706之间的间距标准化为至少约0.5英寸、或1英寸、或2英寸、或3英寸、或4英寸、或5英寸、或6英寸、或7英寸、或8英寸、或9英寸、或10英寸、或11英寸、或12英寸的倍数。
机架709可以支撑模块701-706中的一个或多个模块重量。此外,机架709具有选定的重心,使得模块701(顶部)被安装在机架709上,而不生成可导致机架709旋转或翻倒的力臂。在一些情况下,机架709的重心安排在机架的垂直中点与机架的底部之间,垂直中心为从机架709的底部到机架顶部的50%。在一个实施方式中,如沿着远离机架709的底部的纵轴所测量,机架709的重心安排在从机架709的底部测量的机架高度的至少约0.1%、或1%、或10%、或20%、或30%、或40%、或50%、或60%、或70%、或80%、或90%、或100%之处。
机架可具有多个台位(或安装台),所述台位配置用于接纳一个或多个模块。在示例中,机架709具有六个安装台,用于允许将模块701-706中的每个模块安装到机架。在一些情况下,台位位于机架的同一侧上。在其他情况下,台位位于机架的交替的两侧上。
在一些实施方式中,系统700包括电气连通性组件,用于将模块701-706彼此电连接。电气连通性组件可以是总线,诸如系统总线。在一些情况下,电气连通性组件还使模块701-706能够彼此通信和/或与系统700的控制器通信。
在一些实施方式中,系统700包括控制器(未示出),用于借助模块701-706中的一个或多个模块促进样品的处理。在一个实施方式中,控制器促进模块701-706中样品的并行处理。在示例中,控制器指挥样品处理系统708在第一模块701和第二模块702中提供样品,以便同时运行对样品的不同测定。在另一示例中,控制器指挥样品处理系统708在模块701-706中的一个模块内提供样品,并且还向细胞计数站707提供样品(比如,样品的有限体积的一部分),从而使得对样品的细胞计数和一个或多个其他样品制备规程和/或测定并行地进行。以这样的方式,系统将模块701-706以及细胞计数站707间的停工期最小化——如果不是将其消除的话。
多个模块中的每个单个模块可包括样品处理系统,用于向单个模块的各处理模块和测定模块提供样品以及从其移除样品。此外,除了用于借助模块促进对样品的处理和/或测定的其他组件之外,每个模块可包括各种样品处理和/或测定模块。每个模块的样品处理系统可与系统700的样品处理系统708相分离。亦即,样品处理系统708向和从模块701-706转移样品,而每个模块的样品处理系统向和从包括在每个模块内的各种样品处理和/或测定模块转移样品。
在图55C的示例中,第六模块706包括样品处理系统710,该样品处理系统710包括吸取式移液器711和容积式移液器712。第六模块706包括离心机713、分光光度计714、核酸测定(诸如,聚合酶链反应(PCR)测定)站715和PMT 716。分光光度计714的示例在图55C(参见下文)中示出。第六模块706还包括筒匣717,该筒匣717用于保持多个尖端,所述多个尖端用于促进向和从第六模块的每个处理或测定模块的样品转移。
在一个实施方式中,吸取式移液器711包括1个或多个,或者2个或更多个,或者3个或更多个,或者4个或更多个,或者5个或更多个,或者6个或更多个,或者7个或更多个,或者8个或更多个,或者9个或更多个,或者10个或更多个,或者15个或更多个,或者20个或更多个,或者30个或更多个,或者40个或更多个,或者50个或更多个头。在示例中,吸取式移液器711是具有八个头的8头移液器。吸取式移液器711可以是如本发明的其他实施方式中所描述的那样。
在一些实施方式中,容积式移液器712具有小于或等于约20%、15%、12%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.3%或0.1%或更小的变异系数。该变动系数根据σ/μ而确定,其中“σ”是标准偏差,而“μ”是整个样品测量中的平均值。
在一个实施方式中,所有模块彼此相同。在另一实施方式中,至少一些模块彼此不同。在示例中,第一、第二、第三、第四、第五和第六模块701-706包括容积式移液器和吸取式移液器以及各种测定,诸如核酸测定和分光光度计。在另一示例中,模块701-706中的至少一个可具有与其他模块不同的测定和/或样品制备站。在示例中,第一模块701包括凝集测定但不包括核酸扩增测定,而第二模块702包括核酸测定但不包括凝集测定。模块可以不包括任何测定。
在图55C图示的示例中,模块701-706包括相同的测定和样品制备(或操纵)站。然而,在其他实施方式中,每个模块包括本文描述的任何数目和组合的测定和处理站。
模块可以相对于彼此垂直或水平地堆叠。如果两个模块沿着平行于、基本上平行于或几乎平行于重力加速度矢量的平面定向,则它们是关于彼此垂直定向的。如果两个模块沿着正交于、基本上正交于或几乎正交于重力加速度矢量的平面定向,则它们是关于彼此水平定向的。
在一个实施方式中,模块垂直堆叠,即,一个模块在另一模块的上面。在图55C图示的示例中,机架709被定向成使得模块701-706相对于彼此垂直地安设。然而,在其他情况下,模块相对于彼此水平地安设。在这样的情况下,可将机架709定向成使得模块701-706可以彼此并排地水平坐落。
在系统730的又一实施方式中,示出了该系统具有多个模块701至704。该实施方式示出了水平配置,其中模块701至704安装到支撑结构732,在该支撑结构732上运输装置734可沿着X轴、Y轴和/或可选地沿着Z轴移动,以使诸如但不限于样品器皿、尖端、试管等元件在模块内和/或在模块之间移动。举非限制性示例而言,如果模块701-704沿着正交于、基本上正交于或几乎正交于重力加速度矢量的平面定向,则它们是关于彼此水平定向的。
应当理解,如同图55C的实施方式,模块701-704可以全都是彼此相同的模块。在另一实施方式中,至少一些模块彼此不同。在示例中,第一、第二、第三和/或第四模块701-704可以由一个或多个其他模块所替换,所述其他模块可占用被替换的模块的位置。其他模块可以可选地提供不同功能,诸如但不限于将模块701-704中之一替换为一个或多个细胞计数模块707、通信模块、储存模块、样品制备模块、玻片制备模块、组织制备模块等。例如,模块701-704中之一可替换为提供不同的硬件配置的一个或多个模块,诸如但不限于提供热控制储存室用于温育、在检测之间的储存和/或在检测之后的储存。可选地,替换模块701-704中的一个或多个的模块可提供非测定相关的功能,诸如但不限于针对系统730的附加电信设备、附加成像或用户接口设备,或者附加功率源,诸如但不限于电池、燃料电池等。可选地,替换模块701-704中的一个或多个的模块可为附加的一次性用品以及/或者试剂或流体提供储存。应当理解,尽管一些实施方式示出了仅有四个模块安装在支撑结构上,但不从该水平安装配置中排除具有更少或更多个模块的其他实施方式。还应当理解,所述配置还可以在并非每个台位或槽都由模块所占用的情况下运行,尤其是在其中一种或多种类型的模块比其他模块吸取更多功率的任何场景中运行。在这样的配置下,本应被引导至空台位的功率可由可能比其他模块吸取更多功率的模块所使用。
应当理解,如同图55C的实施方式,模块701-706可以全都是彼此相同的模块。在另一实施方式中,至少一些模块彼此不同。在示例中,第一、第二、第三和/或第四模块701-706可以由一个或多个其他模块所替换,所述其他模块可占用被替换的模块的位置。其他模块可以可选地提供不同功能,诸如但不限于将模块701-706中之一替换为一个或多个细胞计数模块707、通信模块、储存模块、样品制备模块、玻片制备模块、组织制备模块等。
应当理解,尽管一些实施方式示出了仅有六个模块安装在支撑结构上,但不从该水平和垂直安装配置中排除具有更少或更多个模块的其他实施方式。还应当理解,所述配置还可以在并非每个台位或槽都由模块所占用的情况下运行,尤其是在其中一种或多种类型的模块比其他模块吸取更多功率的任何场景中运行。在这样的配置下,本应被引导至空台位的功率可由可能比其他模块吸取更多功率的模块所使用。
一些实施方式可提供具有多个模块701、702、703、704、706和707的系统。这样的实施方式可以具有可包含一个或多个模块的附加模块,所述一个或多个模块提供不同的硬件配置,诸如但不限于提供热控制储存室用于温育、在检测之间的储存或在检测之后的储存。可选地,替换模块701-704中的一个或多个的模块可提供非测定相关的功能,诸如但不限于针对系统的附加电信设备、附加成像或用户接口设备,或者附加功率源,诸如但不限于电池、燃料电池等。可选地,替换模块701-707中的一个或多个的模块可为附加的一次性用品以及/或者试剂或流体提供储存。
应当理解,尽管图55C示出了七个模块安装在支撑结构上,但不从该安装配置中排除具有更少或更多个模块的其他实施方式。还应当理解,配置还可以在并非每个台位或槽都由模块所占用的情况下运行,尤其是在其中一种或多种类型的模块比其他模块吸取更多功率的任何场景中运行。在这样的配置下,本应被引导至空台位的功率可由可能比其他模块吸取更多功率的模块所使用。
在一些实施方式中,模块701-706通过通信总线(“总线”)而彼此和/或与系统700的控制器通信,该通信总线可以包括用于促进模块和/或控制器间的通信的电子电路和组件。通信总线包括在系统700的模块和/或控制器之间传输数据的子系统。总线可以使系统700的各组件进入与系统700的中央处理器(CPU)、存储器(例如,内部存储器、系统缓存)和存储位置(例如,硬盘)的通信。
通信总线可以包括具有多个连接的并行电线,或者提供逻辑功能作为并行电总线的任何物理布置。通信总线可以包括并行连接和位串行连接,并且能够以多点(即,电并联)或菊花链拓扑结构联机,或者通过交换式集线器连接。在一个实施方式中,通信总线可以是第一代总线、第二代总线或第三代总线。通信总线允许在每个模块与其他模块和/或控制器之间的通信。在一些情况下,通信总线支持在多个系统间的通信,诸如,在与系统700相似或相同的多个系统间的通信。
系统700可包括一个或多个串行总线、平行总线或者自修复总线。总线可包括主调度器,该主调度器控制数据流量,诸如前往或来自模块(例如,模块701-706)、控制器和/或其他系统的流量。总线可包括外部总线,其将外部装置和系统连接至主系统板(例如,主板);以及内部总线,其将系统的内部组件连接至系统板。内部总线将内部组件连接至一个或多个中央处理器(CPU)和内部存储器。
在一些实施方式中,通信总线可以是无线总线。该通信总线可以是Firewire(IEEE 1394)、USB(1.0、2.0、3.0或其他)、Thunderbolt或其他协议(现有的或未来研发的协议)。
在一些实施方式中,系统700包括选自包含以下各项在内的组中的一个或多个总线,这些项为:媒体总线、计算机自动测量与控制(CAMAC)总线、工业标准结构(ISA)总线、USB总线、Firewire、Thunderbolt、扩展ISA(EISA)总线、低引脚数总线、MBus、微通道总线、多总线、NuBus或IEEE 1196、OPTi局部总线、外围设备互联(PCI)总线、并行先进技术附件(ATA)总线、Q-总线、S-100总线(或IEEE 696)、SBus(或IEEE 1496)、SS-50总线、STE总线、STD总线(用于STD-80[8-位]和STD32[16-/32-位])、单总线、VESA局部总线、VME总线、PC/104总线、PC/104 Plus总线、PC/104 Express总线、PCI-104总线、PCIe-104总线、1-线总线、超传输总线、互集成电路(I2C)总线、PCI Express(或PCIe)总线、串行ATA(SATA)总线、串行外围接口总线、UNI/O总线、SMBus、2-线或3-线接口、自修复弹性接口总线以及其变体和/或其组合。
在一些情况下,系统700包括串行外围接口(SPI),其为系统700的一个或多个微处理器与外围组件或I/O组件(例如,模块701-706)之间的接口。SPI可用于将2个或更多个,或者3个或更多个,或者4个或更多个,或者5个或更多个,或者6个或更多个,或者7个或更多个,或者8个或更多个,或者9个或更多个,或者10或更多个,或者50个或更多个,或者100个或更多个SPI兼容性I/O组件附接至一个微处理器或多个微处理器。在其他情况下,系统700包括RS-485或其他标准。
在一个实施方式中,提供具有SPI桥接的SPI,该SPI桥接具有并联和/或串联拓扑。这样的桥接允许在不激增芯片选择的情况下选择SPI I/O总在线的许多SPI组件之一。这是通过应用以下所述的适当控制信号从而允许在SPI总在线菊花式链接装置或为装置进行芯片选择而实现的。然而,它不保持并行数据通路,从而在SPI组件与微处理器之间没有需要传输的菊花链数据。
在一些实施方式中,在微处理器与以并行和/或串行(或串联)拓扑相连的多个SPI I/O组件之间提供SPI桥接组件。该SPI桥接组件支持使用MISO和MOSI线的并行SPI,以及通往其他从属装置的串行(菊花链)局部芯片选择连接(CSL/)。在一个实施方式中,本文提供的SPI桥接组件解决了与针对多从属装置的多芯片选择相关联的任何问题。在另一实施方式中,本文提供的SPI桥接组件支持针对4个SPI使能装置(CS1/–CS4/)的4个、8个、16个、32个、64个或更多个单个芯片选择。在另一实施方式中,本文提供的SPI桥接组件支持与外部地址线设置(ADR0–ADR1)的4倍级联。在一些情况下,本文提供的SPI桥接组件提供了对用于控制或数据的多达8个、16个、32个、64个或更多个一般输出位加以控制的能力。本文提供的SPI桥接组件在一些情况下支持对用于控制或数据的多达8个、16个、32个、64个或更多个一般输出位的控制,并可以用于对主站的装置标识和/或对主站的诊断通信。
一个实施方式可使用根据本发明的实施方式的、具有主桥接和并串联SPI从属桥接的SPI桥接方案。SPI总线通过向SPI桥接中添加局部芯片选择(CSL/)、模块选择(MOD_SEL)和选择数据输入(DIN_SEL)而得到增强,从而允许添加包括必要系统特征和非必要系统特征在内的各种系统特征,诸如多个从属装置的级联、装置芯片选择的虚拟菊花式链接从而将模块至模块的信号计数保持在可接受水平、对模块标识和诊断的支持、以及在保持与嵌入式SPI兼容从属组件保持兼容性的同时与模块上的非SPI组件通信。图55C示出了根据本发明的实施方式的SPI桥接的示例。该SPI桥接包括内部SPI控制逻辑、控制寄存器(如图所示,为8位)和各输入和输出引脚。
在并串联配置中每个从属桥接都连接至主站(本文也称“SPI主站”或“主桥接”)。每个从属桥接的MOSI引脚连接至主桥接的MOSI插脚,并且从属桥接的MOSI引脚彼此连接。类似地,每个从属桥接的MISO引脚连接至主桥接的MISO引脚,并且从属桥接的MISO引脚彼此连接。
每个从属桥接可以是模块(例如,图55C的模块701-706中的一个)或模块中的组件。在示例中,第一从属桥接是第一模块701,第二从属桥接是第二模块702,并以此类推。在另一示例中,第一从属桥接是模块的组件。
至少一个非限制性示例可使用根据本发明的实施方式的、具有相互连接的模块引脚和主桥接与从属桥接的各个组件的模块组件图。根据本发明的实施方式,从属桥接可连接到主桥接。每个从属桥接的MISO引脚与主桥接的MOSI引脚电连通。每个从属桥接的MOSI引脚与主桥接的MISO引脚电连通。第一从属桥接(左)的DIN_SEL引脚与第一从属桥接的MOSI引脚电连通。第一从属桥接的DOUT_SEL引脚与第二从属桥接(右)的DIN_SEL引脚电连通。通过使每个附加的从属桥接的DIN_SEL引脚进入与前一从属桥接的DOUT_SEL引脚的电连通,可以连接附加的从属桥接作为第二从属。在这样的情况下,从属桥接以并串联配置连接。
在一些实施方式中,在断言模块选择线(MOD_SEL)时,被引向连接的SPI桥接的CLK脉冲捕获移位至桥接中的DIN_SEL位的状态。DIN_SEL位的数目对应于在并串联SPI链路上连接在一起的模块的数目。在一个示例中,如果两个模块以并串联配置(例如,RS486)连接起来,则DIN_SEL的数目等于2。
在一个实施方式中,在模块选择序列期间锁存“1”的SPI桥接成为“选定模块”,其被设置成在随后的组件选择序列期间接收8位控制字。每个SPI桥接可以访问多达4个级联的SPI从属装置。此外,每个SPI桥接可以具有8位GP接收端口和8位GP传输端口。“组件选择”序列向“选定模块”SPI桥接控制寄存器中写入8位字,以支持与特定SPI装置的后续事务或者经由SPI桥接GPIO端口读写数据。
在一个实施方式中,通过断言局部芯片选择线(CSL/)并继而将MOSI传输的数据字的第一字节时钟输入到控制寄存器中而进行组件选择。在一些情况下,控制寄存器的格式为CS4 CS3 CS2 CS1 AD1 AD0 R/W N。在另一实施方式中,第二字节是传输或接收数据。当CSL/被解除断言时,循环完成。
在SPI事务中,随组件选择序列之后,开始后续的SPI从属数据事务。SPI CS/(其可称为SS/)按照CS4、CS3、CS2或CS1的真状态而被路由到4个可能的桥接装置之一。跳线位AD0、AD1与控制寄存器的AD0、AD1进行比较,允许模块上多达4个SPI桥接。
一个实施方式示出了根据本发明的实施方式的装置,其具有安装在装置的通信总线的SPI链路上的多个模块。图中示出了3个模块,即,模块1、模块2和模块3。每个模块包括一个或多个SPI桥接,该一个或多个SPI桥用于使模块的各组件进入与SPI链路的电连接,包括与SPI链路电连通的主控制器(包括一个或多个CPU)。模块1包括与SPI桥接00、SPI桥接01、SPI桥接10和SPI桥接11中的每一个电连通的多个SPI从属装置。此外,每个模块包括接收数据控制器、传输数据控制器和模块ID跳线器。
在其他实施方式中,模块701-706配置成借助于无线通信总线(或接口)彼此通信和/或与系统700的一个或多个控制器通信。在一个示例中,模块701-706借助于无线通信接口彼此通信。在另一示例中,模块701-706中的一个或多个模块借助于无线通信总线与系统700的控制器通信。在一些情况下,模块701-706和/或系统的一个或多个控制器之间仅通过无线通信总线进行通信。这样可以有利地排除对用于接纳模块701-706的台位中的有线接口的需求。在其他情况下,系统700包括有线接口,该有线接口与系统700的无线接口协同工作。
虽然系统700如图所示具有单一机架,但系统(诸如系统700)可以具有多个机架。在一些实施方式中,系统具有至多1个、或2个、或3个、或4个、或5个、或6个、或7个、或8个、或9个、或10个、或20个、或30个、或40个、或50个、或100个、或1000个或10000个机架。在一个实施方式中,系统具有安设于并排式配置之中的多个机架。
在一些实施方式中,用户将样品提供至具有一个或多个模块的系统,诸如图55C的系统700。用户将该样品提供至系统的样品收集模块。在一个实施方式中,样品收集模块包括一个或多个刺血针、针头、微针、静脉抽血器、手术刀、杯子、拭子、洗涤剂、桶、篮、工具包、可渗透基质或本文其他各处所述的任何其他样品采集机构或方法。接下来,系统将样品从样品收集模块引导至一个或多个处理模块(例如,模块701-706)以便进行样品制备、测定和/或检测。在一个实施方式中,借助于样品处理系统,诸如移液器,将样品从采集模块引导至所述一个或多个处理模块。接下来,在所述一个或多个模块中处理样品。在一些情况下,在一个或多个模块中测定样品,并于随后使其经受一个或多个检测例程。
在一些实施方式中,在一个或多个模块中进行处理之后,系统将结果传送到与该系统通信的用户或系统(例如,服务器)。其他系统或用户继而可以取用该结果以帮助治疗或诊断受试者。
在一个实施方式中,系统配置用于与其他系统——诸如相似的或同样的系统(例如,机架,诸如在图55C的背景下描述的机架)或包括服务器在内的其他计算机系统——进行双向通信。
本文提供的装置和方法通过支持并行处理而可以有利地降低服务点系统的能源足迹或碳足迹。在一些情况下,系统——诸如图55C的系统700——具有的足迹是其他服务点系统的至多10%、或15%、或20%、或25%、或30%、或35%、或40%、或45%、或50%、或55%、或60%、或65%、或70%、或75%、或80%、或85%、或90%、或95%、或99%。
在一些实施方式中,提供了用于检测分析物的方法。在一个实施方式中,处理例程包括检测分析物的存在或缺失。该处理例程借助于本文提供的系统和装置而得到促进。在一些情况下,分析物关联于生物过程、生理过程、环境条件、样品状况、病症或病症的阶段,诸如自身免疫性疾病、肥胖症、高血压、糖尿病、神经元和/或肌肉退行性疾病、心脏病和内分泌疾病之中的一种或多种。
在一些情况下,装置一次处理一个样品。然而,本文提供的系统配置用于多重样品处理。在一个实施方式中,装置一次或以重迭的时间处理多个样品。在一个示例中,用户将样品提供至具有多个模块的装置,诸如图55C的系统700。该装置继而借助于装置的一个或多个模块来处理样品。在另一示例中,用户将多个样品提供至具有多个模块的装置。该装置继而通过在第一模块中处理第一样品的同时在第二模块中处理第二样品,来借助多个模块同时处理样品。
系统可以处理相同类型的样品或不同类型的样品。在一个实施方式中,系统同时处理相同样品的一部分或多部分。如果期望对相同样品的各种测定和/或检测方案,则这可能是有用的。在另一实施方式中,系统同时处理不同类型的样品。在一个示例中,系统在该系统的不同模块中,或者在具有用于处理血液和尿液样品的处理站的单一模块中,同时地处理血液和尿液样品。
在一些实施方式中,一种用于借助服务点系统(诸如图55C的系统700)来处理样品的方法包括:接纳检测准则或参数,以及基于该准则而确定检测顺序或调度安排。检测准则接纳自与服务点系统通信的用户、系统或服务器。该准则可基于期望的或预定的效果来选择,这些效果诸如为:最少的时间、成本、组件使用、步骤和/或能量。服务点系统按照检测顺序或调度安排来处理样品。在一些情况下,反馈回路(与传感器耦合)使服务点系统能够监测样品处理的进展并保持或改变检测顺序或调度安排。在一个示例中,如果系统检测到处理耗费了比调度安排中阐述的预定时间量更长的时间,则系统加速所述处理或调整任何并行的处理,诸如在系统的另一模块中的样品处理。反馈回路允许实时或伪实时(例如,缓存的)监测。在一些情况下,反馈回路可提供允许反射检测,其可在开始或完成另一检测和/或测定或感测一个或多个参数之后,导致后续检测、测定、制备步骤和/或其他过程的启始。此类后续检测、测定、制备步骤和/或其他过程可自动启始,而无需任何人为干预。可选地,反射检测响应于测定结果而执行。即举非限制性示例而言,如果预定了反射检测,则为筒匣预先装载用于测定A和测定B的试剂。测定A是初步检测,而测定B是反射检测。如果测定A的结果满足了启始反射检测的预定准则,那么在装置中用同一样品运行测定B。规划装置方案以将运行反射检测的可能性纳入考虑。可以在测定A的结果完成之前执行测定B的一些或全部方案步骤。例如,可以在装置上提前完成样品制备。还有可能用来自患者的第二样品运行反射检测。在一些实施方式中,本文提供的装置和系统可包含组分以使得可以用同一装置来反射检测多种不同的测定和测定类型。在一些实施方式中,可以在本文提供的单一装置中执行具有临床意义的多种检测作为反射检测方案的一部分,其中用已知的系统和方法执行相同的检测需要两个或更多个单独的装置。因此,本文提供的系统和装置可例如允许比已知的系统和方法更快并需要更少的样品的反射检测。此外,在一些实施方式中,对于用本文提供的装置进行反射检测而言,不必提前知道将会执行哪种反射检测。
在一些实施方式中,服务点系统可基于初始参数和/或期望效果而坚持预定检测顺序或调度安排。在其他实施方式中,可以实时地修改该调度安排和/或检测顺序。可以基于一个或多个检测到的状况、一个或多个要运行的附加过程、一个或多个不再要运行的过程、一个或多个要修改的过程、一个或多个资源/组件利用率修改、一个或多个检测到的错误或警报状况、一个或多个资源和/或组件的不可用性、由用户提供的一个或多个后续输入或样品、外部数据或者任何其他原因,而修改调度安排和/或检测顺序。
在一些示例中,可以在向装置提供一个或多个初始样品之后,向装置提供一个或多个附加样品。附加样品可来自同一受试者或不同的受试者。附加样品可以是与初始样品相同类型的样品或不同类型的样品(例如,血液、组织)。可以在装置上处理一个或多个初始样品之前、之后和/或与此同时地提供附加样品。可以为附加样品提供相对于彼此和/或初始样品相同的和/或不同的检测或期望的准则。附加样品可与初始样品依次和/或并行处理。附加样品可使用一个或多个与初始样品相同的组件,或者可以使用不同的组件。鉴于初始样品的一个或多个检测到的状况,可能需要或者可能不需要附加样品。
在一些实施方式中,系统借助于诸如刺血针、手术刀或流体采集器皿等样品收集模块来接纳样品。系统继而加载或取用方案,以便执行来自多个潜在处理例程的一个或多个处理例程。在一个示例中,系统加载离心方案和细胞计数方案。在一些实施方式中,方案可从外部装置加载到样品处理装置。备选地,方案可能已经在样品处理装置上。可以基于一个或多个期望的准则和/或处理例程来生成方案。在一个示例中,生成方案可包括生成针对每个输入过程的一个或多个子任务的列表。在一些实施方式中,每个子任务要由一个或多个装置的单一组件来执行。生成方案还可包括生成列表的顺序、定时和/或分配一个或多个资源。
在一个实施方式中,方案提供了特定于样品或样品中组分的处理细节或说明。例如,离心方案可包括适合于预定样品密度的旋转速率和处理时间,其支持样品与可能和样品的期望组分一同存在的其他材料的依赖于密度的分离。
方案包含在系统中,诸如包含在系统的方案储存库中,或者从与该系统通信的另一系统(诸如数据库)中检索。在一个实施方式中,系统与数据库服务器进行单向通信,该数据库服务器根据系统对一个或多个处理方案的请求而向系统提供方案。在另一实施方式中,系统与数据库服务器进行双向通信,这使系统能够向数据库服务器上传用户特定处理例程,以供用户或可能使用到该用户特定处理例程的其他用户将来使用。
现参考图56A和图56B,运输容器4000可被配置用于在其中包含来自多个受试者(诸如患者)的多个体液样品。在一些实施方式中,存在来自每个受试者的样品的多个器皿。可选地,来自同一受试者的样品中的至少两个样品具有不同的化学预处理,诸如但不限于在每个器皿中的不同的抗凝剂。可选地,一些实施方式可使用具有两个或更多个分离的室的器皿,其中每个室被配置用于容纳与另一室中的流体样品分开的流体样品的一部分。一些实施方式可在单室器皿和/或多室器皿中包含来自受试者的样品。
如图56A和图56B中所见,示出了运输容器4000的一个实施方式的各个视图,其中盖板4010具有至少一个台面部分4012,该台面部分的大小设置为配合至运输容器4000的底部上的凹座4020中,如图57A中所见,以使得器皿4000可以是可堆叠式。运输容器4000可具有本文针对本文描述的运输容器的其他实施方式所描述的任何特征。
图57B示出了在运输容器4000中可存在托盘4030,该托盘4030是固定的并且/或者可从运输容器4000移除。在一个实施方式中,托盘4030由固定装置保持就位,该固定装置诸如但不限于与运输容器4000的底盘中的金属或磁性部分对准以形成磁性连接的磁性或金属部分4032。在一些实施方式中,长度与宽度的长宽比在约128:86至127:85的范围中。可选地,长度与宽度的长宽比在约130:90至120:80的范围中。可选地,托盘的长度在约130mm至120mm的范围中,而宽度在约90mm至80mm的范围中。在一些实施方式中,托盘的高度或厚度在约14至20mm的范围中。长宽比和/或大小被配置用于容纳大小设置用于配合槽、凹座或板离心机上其他保持器的托盘。以这种方式,可对整个托盘4030进行离心以制备位于其中的多个样品。
如图57A和57B中所见,托盘4030具有多个槽4034,其中槽4034的大小设置用于容纳至少一个样品储存器皿。槽4034的至少一个部分4040具有第一形状,并且至少第二部分4042具有不同于第一形状的第二形状,其中以样品器皿仅能按期望的定向插入到槽4034中的方式来定下所述形状。如图58B中所见,一端是半圆形而另一端是不对称形状的。托盘4030还可塑形成具有切口4036或其他形状,以使得托盘4030仅能按一个定向插入到运输容器4000中。还应当理解,托盘4030可被保持在托盘中以使得用户在不使用工具或其他托盘取出装置的情况下无法使用其手指从器皿4000移除托盘。这使得用户篡改的风险最小化。托盘4030可被配置成即使当运输容器4000倒置时仍被保持于运输容器4000中并且可抵抗地球重力的牵拉。
图59A和图59B示出了又一实施方式,其中在托盘4102中存在多个槽4100。托盘具有不同的长宽比(更接近于正方形)并且在托盘中具有多个塑形的槽用以容纳样品器皿。
在至少一些实施方式中,医疗提供者(或在适当时是其职员)可以是样品收集者、检测结果接收者和/或兼为两者。例如,在一个实施方式中,医疗保健专业人员,诸如但不限于牙医,可以作为牙科手术的一部分或独立于牙科手术而收集样品。可选地,一些实施方式可以从来自受试者的牙科手术的吸取的血液和/或唾液收集样品。收集的样品可在牙科诊所中处理和/或运送至接收多个样品以供处理的接收位置。
在实施方式中,本文提供的系统、装置或方法中使用的体液样品可被稀释。在实施方式中,体液样品可在其从第一位置运输到第二位置之前被稀释。在实施方式中,体液样品可在其从第一位置运输到第二位置之后被稀释。在实施方式中,体液样品可在其从第一位置运输到第二位置之前和之后都被稀释。在实施方式中,体液样品可在其从第一位置运输到第二位置之后并且在其于第二位置处用于执行实验室检测的一个或多个步骤之前被稀释。原始体液样品可例如被稀释至少2、3、4、5、6、7、8、9、10、15、20、50、100、200、300、400、500、1000、5,000、10,000、50,000或100,000倍。本文所使用的“n倍”稀释意指原始样品被稀释的比例——例如,稀释了5倍的原始样品在稀释之后以其原始浓度的1/5的浓度包含原始样品(即,稀释的样品以原始样品中样品浓度的1/5的浓度包含样品);类似地,稀释了500倍的原始样品在稀释之后以其原始浓度的1/500的浓度包含原始样品。因此,举例而言,如果原始样品包含5mg蛋白质/微升,并且将其稀释2倍,则稀释的样品包含2.5mg蛋白质/微升。体液样品可分成任何数目的部分,并且各个部分可稀释到不同的稀释度,从而可以处理原始体液样品以得到多个稀释的样品,每个样品具有不同的稀释度。因此,举例而言,原始体液样品可分成5个部分,其中一个部分稀释8倍、另一部分稀释12倍、另一部分稀释3倍、另一部分稀释400倍以及另一部分稀释2,000倍。可连续地或在单一步骤中执行样品的稀释。对于单一步骤稀释,可将选定量的样品与选定量的稀释剂相混合,以便实现期望的样品稀释。对于连续稀释,可执行样品的两次或更多次单独的连续稀释,以便实现期望的样品稀释。例如,可以执行对样品的第一稀释,并且可将该第一稀释的一部分用作第二稀释的输入材料,以得到处于选定稀释程度的样品。
对于本文所描述的稀释,“原始样品”等是指在给定的稀释过程开始时所使用的样品。因此,尽管“原始样品”可以是从受试者直接获得的样品(例如,全血),但其还可包括用作给定稀释过程的起始材料的任何其他样品(例如,已经处理过或先前已经在单独的稀释过程中稀释过的样品)。
在一些实施方式中,样品的连续稀释可如以下所述来执行。可以将选定量(例如,体积)的原始样品与选定量的稀释剂相混合,以得到第一稀释样品。第一稀释样品(和任何后续稀释样品)将会具有:i)样品稀释因子(例如,在第一稀释样品中原始样品被稀释的倍数)和ii)初始量(例如,在将选定量的原始样品与选定量的稀释剂合并之后存在的第一稀释样品的总量)。例如,可以将10微升的原始样品与40微升的稀释剂相混合,以得到具有5倍样品稀释因子(相比于原始样品)和50微升初始量的第一稀释样品。接下来,可以将选定量的第一稀释样品与选定量的稀释剂相混合,以得到第二稀释样品。例如,可以将5微升的第一稀释样品与95微升的稀释剂相混合,以得到具有100倍稀释因子(相比于原始样品)和100微升初始量的第二稀释样品。对于上述稀释步骤中的每一步,均可将原始样品、一个或多个稀释样品以及稀释剂储存或混合于流体隔离的器皿中。连续稀释可根据需要,按前述方式继续进行若干步骤,以达到选定的样品稀释水平/稀释因子。举例而言,在实施方式中,可以如在2013年2月18日提交的美国专利申请序列号13/769,820或本文其他各处通过引用而并入的任何其他文件中所描述那样来稀释样品。
如本文所使用,作为“稀释剂”或者可用作“稀释剂”的试剂是例如有助于增加样品或样品的一部分的体积,或者有助于液体制剂(诸如在冻干之后重建的制剂)的制备,或者用于为了任何其他原因而加至样品、溶液或材料的试剂。在实施方式中,稀释剂可被缓冲(例如,以便具有接近pH 7或接近pH 7.4或其他期望pH的pH)并且可以是药学上可接受的(对于人类给药是安全且无毒的)。稀释剂通常不与样品中的分析物反应或结合。水可以是稀释剂,水性盐水溶液、缓冲溶液、含有表面活性剂的溶液或任何其他溶液也可以是稀释剂。示例性稀释剂包括无菌水、注射用抑菌水(BWFI)、pH缓冲溶液(例如,磷酸盐缓冲盐水)、无菌盐水溶液、林格氏溶液或右旋糖溶液。在实施方式中,稀释剂可包括盐的水溶液或缓冲液。
在实施方式中,例如根据本文提供的系统或方法而从受试者收集的、处理的或运输的体液样品或其部分可分成至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000或更多个不同部分。对于本文提供的将样品分成多个部分的描述而言,“原始样品”等是指在给定的样品分配过程开始时所使用的样品。因此,尽管“原始样品”可以例如是从受试者直接获得的样品(例如,全血),但其还可包括用作给定样品分配过程的起始材料的任何其他样品(例如,已经处理过的或先前已经在单独的样品分配过程中分配的样品)。在实施方式中,“原始样品”可经受样品分配和稀释步骤;在这样的情况下,提到“原始样品”是指用于组合样品稀释/样品分配过程的起始材料。当样品分成不同部分时,所述不同部分可包含不同量的原始样品。例如,如果具有100微升体积的原始样品分成5个部分,则一个部分可包含50微升的原始样品,另一部分可包含25微升的原始样品,另一部分可包含15微升的原始样品,另一部分可包含8微升的原始样品,以及最后一部分可包含2微升的原始样品。同样地,当样品既被稀释又分成了不同部分时,所述不同部分相对于原始样品可具有不同的稀释度。例如,如果原始样品分成三个部分,则一个部分可相对于原始样品稀释5倍,另一部分可相对于原始样品稀释20倍,并且第三部分可相对于原始样品稀释200倍。
因此,在示例中,可在第一位置(例如,样品收集场所)处从受试者收集体液样品。最初从受试者收集的体液样品可被认为是“原始样品”。这样的“原始样品”例如可以是来自受试者的小量(例如少于400、300、200或100微升)全血。在从受试者收集“原始样品”之后不久或与此同时,可以将“原始样品”分成至少第一部分和第二部分,此后将第一部分转移到第一器皿中并将第二部分转移到第二器皿中。在实施方式中,第一器皿可包含第一抗凝剂(例如EDTA)而第二部分可包含第二抗凝剂(例如肝素)。可根据本文提供的系统或方法,将第一和第二器皿从第一位置运输到第二位置。在实施方式中,在第二位置处,所述器皿中之一或全部两者中的样品或其部分可经受进一步的处理或分析步骤。例如,所述器皿中之一或全部两者中的样品或其部分可分成附加部分、被稀释和/或用于执行一种或多种检测。
在另一示例中,体液样品可根据本文提供的系统和方法而在器皿中从第一位置运送到第二位置。器皿中的体液样品可以是从受试者收集的全部样品,或者是其一部分。在第二位置处,可以将器皿中的至少一些体液样品从器皿移除,并将其用于样品分配和/或稀释过程。从器皿中移除并被用于样品分配和/或稀释过程的样品可被认为是“原始样品”。该原始样品例如可以是全血、血浆、血清、唾液或尿,并且可构成在器皿中运输的样品的全部或其一部分。该原始样品可分成任何数目的部分;各个部分相对于原始样品可具有不同的稀释度。例如,从运输器皿中移除的原始样品可具有小于或等于400、300、250、200、150、100、90、80、70、60、50、40、30、25、20、15、10、9、8、7、6、5、4、3、2或1微升的体积。从运输器皿中移除的原始样品可继而分成至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000个或更多个不同部分。在实施方式中,所述不同部分相对于原始样品可具有不同的稀释度。例如,不同部分相对于原始样品可具有至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000或5,000的不同稀释度,条件是具有不同稀释度的部分的数目不超过从原始样品制备的部分的总数。所述不同部分相对于原始样品可具有任何类型的稀释,举例而言,包括无稀释、至少2倍稀释、至少3倍稀释、至少5倍稀释、至少10倍稀释、至少20倍稀释、至少50倍稀释、至少100倍稀释、至少500倍稀释、至少1000倍稀释、至少5000倍稀释、至少10,000倍稀释、至少50,000倍稀释或至少100,000倍稀释。在实施方式中,原始样品的一个或多个不同部分可用于实验室检测。在实施方式中,原始样品的一个部分可用于一种实验室检测。用于实验室检测的原始样品的一部分可以是稀释的样品。
在实施方式中,原始样品可以是从受试者获得的全血样品。原始样品可从受试者的指/趾获得。原始样品可具有不大于400、300、200、150、100、90、80、70、60、50、40、30、25、20、15、10、9、8、7、6、5、4、3、2或1微升的体积。原始样品可分成多个部分。样品分成多个部分可发生于根据本文提供的系统或方法将该样品从第一位置运输到第二位置之前、之后或者之前和之后的组合。在实施方式中,原始样品可分成至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000个或更多个不同部分,并且所述不同部分用于执行至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000种不同的实验室检测。原始样品的不同部分可具有稀释的原始样品。在实施方式中,每一实验室检测使用不超过10、9、8、7、6、5、4、3、2、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.05或0.01微升的原始样品。
在实施方式中,原始样品可以是从获自受试者的全血样品获得的血浆或血清。全血可从受试者的指/趾获得。从中获得血浆或血清的全血可具有不大于400、300、200、150、100、90、80、70、60、50、40、30、25、20、15、10、9、8、7、6、5、4、3、2或1微升的体积。血浆或血清原始样品可具有不大于300、200、150、100、90、80、70、60、50、40、30、25、20、15、10、9、8、7、6、5、4、3、2或1微升的体积。原始样品可分成多个部分。样品分成多个部分可发生于根据本文提供的系统或方法将该样品从第一位置运输到第二位置之前、之后或者之前和之后的组合。在实施方式中,原始样品可分成至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000个或更多个不同部分,并且所述不同部分用于执行至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000种不同的实验室检测。原始样品的不同部分可具有稀释的原始样品。
在实施方式中,使用不超过10、9、8、7、6、5、4、3、2、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.05或0.01微升的原始样品的当量(equivalent)来进行实验室检测。例如,如果原始样品是全血,并且将该原始样品分成多个部分,并且至少一个部分包含稀释的样品,所述稀释的样品包含已经稀释了100倍的原始样品,并且使用5微升的所述稀释的样品来执行实验室检测,则使用0.05微升的原始样品(例如,全血)的当量来进行该检测(5微升x1/100稀释度)。在另一示例中,原始样品可以是全血。可以处理该全血以获得血浆[例如,通过将血液的液体组分与血液的固体组分(例如,细胞)相分离]。可从一定体积的全血获得一定体积的血浆——举例而言,可从一定体积的全血获得的血浆的体积例如可以是全血体积的至少或大约30%、40%、50%、60%或70%。因此,举例而言,如果来自全血的血浆的体积为50%,则从2ml的全血可以获得1ml的血浆。可以进一步稀释来自全血的血浆,并且可以使用血浆的一个或多个稀释的部分来执行一种或多种实验室检测。在另一示例中,原始样品可以是全血。可处理全血以得到血浆,其中来自全血的血浆的体积是全血的60%(例如,从100微升全血获得60微升血浆)。血浆可稀释10倍。可以使用2微升的稀释的血浆来执行实验室检测。因此,对于该实验室检测,使用约0.33微升的原始样品(全血)的当量来执行该检测(2微升x1/10稀释度x 100/60全血/血浆转化率)。在另一示例中,原始样品可以是血浆,并且可将该原始样品分成多个部分,并且至少一个部分包含稀释的样品,该稀释的样品包含已经稀释了50倍的原始样品,并且使用4微升的该稀释的样品来执行实验室检测,则使用0.08微升的原始样品(例如,血浆)的当量来进行该检测(4微升x1/50稀释度)。
在实施方式中,原始样品可分成至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000个或更多个不同部分,并且所述不同部分可用于执行至少2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、50、100、200、300、400、500、1000、5,000、10,000种不同的实验室检测。在一些实施方式中,至少制备与对样品的部分执行的实验室检测一样多的样品部分(例如,为了用原始样品执行10种实验室检测,可将该原始样品分成至少10个部分,每一检测使用至少1个部分)。在某些其他实施方式中,可以用单一样品执行不止一种实验室检测。例如,在实施方式中,可以测量样品的光学性质(例如,在血液样品中的细胞计数),并且继而可以使用同一样品来测定血液中的分析物。因此,在一些实施方式中,可以对原始样品执行比从同一原始样品制备的部分的数目更多的实验室检测(例如,可以从仅分成8个部分的原始样品执行10种实验室检测)。
当原始样品分成多个部分,并且所述多个部分用于执行两种或更多种实验室检测时,实验室检测可以是相同类型的实验室检测,或者它们可以是不同类型的实验室检测。例如,如果原始样品分成10个部分,并且该10个部分各自用于实验室检测,则用所述部分中的每个部分进行的实验室检测可以是免疫测定。在另一示例中,如果原始样品分成5个部分,并且该5个部分各自用于实验室检测,则用所述部分中的每个部分进行的实验室检测可以是基于核酸扩增的检测。
在其他情况下,当原始样品分成多个部分,并且所述多个部分用于执行两种或更多种实验室检测时,至少两种实验室检测可以是不同类型的实验室检测。例如,如果原始样品分成5个部分,并且该5个部分各自用于实验室检测,则所述部分中的2个部分可用于免疫测定(例如,ELISA)并且所述部分中的3个部分可用于基于核酸扩增的检测。
根据本文提供的系统或方法而运输的体液样品或其部分可用于各种类型的实验室检测,诸如免疫测定、核酸扩增测定、普通化学测定或细胞计数测定。在实施方式中,根据本文提供的系统或方法而运输的体液样品或其部分可用于例如在2013年2月18日提交的美国专利申请序列号13/769,820或本文其他各处通过引用而并入的任何其他文件中所描述的任何类型的测定或实验室检测中。
在一些实施方式中,根据本文提供的系统或方法而运输的体液样品或其部分可在免疫测定中使用。本文所使用的“免疫测定”是指涉及用对分析物具有亲和力的抗体来探测分析物的任何测定。免疫测定例如可以包括酶联免疫吸附(ELISA)测定,并且可包括基于竞争和非竞争的测定。本文所使用的术语“抗体”是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即,包含特异性结合抗原(与抗原发生“免疫反应”)的抗原结合单元(“Abu”或复数“Abus”)的分子。在结构上,最简单的天然存在的抗体(例如,IgG)包括4条多肽链—两个重(H)链和两个轻(L)链,链间通过二硫键连接。免疫球蛋白代表一个大家族的分子,其包括几种类型的分子,例如IgD、IgG、IgA、IgM和IgE。术语“免疫球蛋白分子”包括,例如,杂合抗体或改变的抗体,及其片段。基于其分子结构,抗原结合单元可大致分为“单链”(“Sc”)和“非单链”(“Nsc”)型。
免疫球蛋白分子及其片段也包含在术语“抗体”和“抗原结合单元”中,其可以是人类、非人类(源自脊椎动物或无脊椎动物)、嵌合的或人源化的。对于嵌合的和人源化抗体的概念的描述,参见Clark等人,2000和在其中引用的参考文献(Clark,(2000)Immunol.Today 21:397-402)。在实施方式中,如本文提供的“免疫测定”还可包括其中要在测定中进行测量的分析物是抗体,并且用对该抗体具有亲和力的分子(例如该抗体的靶分子)来探测该抗体的测定。
在一些实施方式中,根据本文提供的系统或方法而运输的体液样品或其部分可在核酸扩增测定中使用。本文所使用的“核酸扩增测定”是指其中靶核酸的拷贝数可增加的测定。核酸扩增测定可包括等温和温度可变的扩增技术,并且包括,例如,诸如聚合酶链反应(PCR)和环介导等温扩增(LAMP)等技术。通常,核酸扩增测定至少包括i)核酸聚合酶,ii)可与靶核酸序列结合的引物,以及iii)可由聚合酶掺入到合成的核酸中的游离核苷酸。可按各种方式检测靶核酸的扩增,所述方式诸如为在一段时间中测量反应的荧光或浊度。
在一些实施方式中,根据本文提供的系统或方法而运输的体液样品或其部分可在普通化学测定中使用。普通化学测定可包括,例如,对基础代谢功能组(Basic Metabolic Panel)[葡萄糖、钙、钠(Na)、钾(K)、氯化物(Cl)、CO2(二氧化碳、碳酸氢盐)、肌酸酐、血尿素氮(BUN)]的测定、对电解质组(Electrolyte Panel)[钠(Na)、钾(K)、氯化物(Cl)、CO2(二氧化碳、碳酸氢盐)]的测定、对Chem 14组/全面代谢功能组(Chem 14Panel/Comprehensive Metabolic Panel)[葡萄糖、钙、白蛋白、总蛋白、钠(Na)、钾(K)、氯化物(Cl)、CO2(二氧化碳、碳酸氢盐)、肌酸酐、血尿素氮(BUN)、碱性磷酸酶(ALP)、丙氨酸转氨酶(ALT/GPT)、天冬氨酸转氨酶(AST/GOT)、总胆红素]的测定、对血脂概况/血脂组(Lipid Profile/Lipid Panel)[LDL胆固醇、HDL胆固醇、总胆固醇和甘油三酯]的测定、对肝脏组/肝功能(Liver Panel/Liver Function)[碱性磷酸酶(ALP)、丙氨酸转氨酶(ALT/GPT)、天冬氨酸转氨酶(AST/GOT)、总胆红素、白蛋白、总蛋白、γ-谷氨酰转移酶(GGT)、乳酸脱氢酶(LDH)、凝血酶原时间(PT)]、碱性磷酸酶(APase)、血红蛋白、VLDL胆固醇、乙醇、脂肪酶、pH、原卟啉锌、直接胆红素、血型分型(ABO、RHD)、铅、磷酸盐、血细胞凝集抑制、镁、铁、铁摄取、粪便潜血等的、单独或任意组合的测定。
在本文提供的普通化学测定中,在一些示例中,通过一个或多个测定步骤来确定样品中的分析物水平,所述测定步骤涉及感兴趣的分析物与一种或多种试剂的反应,引起反应中可检测到的变化(例如,反应浊度的变化、反应中产生发光、反应颜色的变化等)。在一些示例中,通过一个或多个测定步骤来确定样品的性质,所述测定步骤涉及感兴趣的样品与一种或多种试剂的反应,引起反应中可检测到的变化(例如,反应浊度的变化、反应中产生发光、反应颜色的变化等)。通常,本文所使用的“普通化学”测定不涉及核酸的扩增、在显微术阶段对细胞的成像或基于使用标记的抗体/结合物来确定溶液中的分析物水平而对溶液中分析物水平的确定。在一些实施方式中,在单一器皿中用所有试剂执行普通化学测定——即为了进行反应,将所有必要的试剂添加至反应器皿,并且在测定过程期间,不从反应或反应器皿中移除材料(例如没有洗涤步骤;它是“混合并读取”反应)。普通化学测定还可以是,例如,比色测定、酶测定、光谱测定、比浊测定、凝集测定、凝结测定和/或其他类型的测定。可通过测量由测定反应对一个或多个选定波长的光的吸光度(例如用分光光度计测量)来分析许多普通化学测定。在一些实施方式中,可通过测量反应的浊度(例如用分光光度计测量)来分析普通化学测定。在一些实施方式中,可通过测量反应中产生的化学发光(例如用PMT、光电二极管或其他光学传感器测量)来分析普通化学测定。在一些实施方式中,可基于在相同或相关测定中对一种或多种其他分析物而确定的实验值,通过计算来执行普通化学测定。在一些实施方式中,可通过测量反应的荧光(例如,用检测单元,其包含或连接至i)一个或多个特定波长(“激发波长”)的光源;以及ii)传感器,其被配置用于在一个或多个特定波长(“激发波长”)下检测所发射的光)来分析普通化学测定。在一些实施方式中,可通过测量反应中的凝集(例如通过用分光光度计测量反应的浊度或通过用光学传感器获得反应的图像)来分析普通化学测定。在一些实施方式,可通过在一个或多个时间点时对反应进行成像(例如用CCD或CMOS光学传感器来成像)之后进行图像分析,来分析普通化学测定。可选地,分析可涉及凝血酶原时间、活化部分促凝血酶原激酶时间(APTT),其中任一个可通过诸如但不限于比浊法等方法来测量。在一些实施方式中,可通过测量反应的粘度(例如用分光光度计,其中反应粘度的增大改变反应的光学性质)来分析普通化学测定。在一些实施方式中,可通过测量两种非抗体试剂之间的复合物形成(例如金属离子与发色团;可用分光光度计或通过使用另一装置的比色法来测量这样的反应)来分析普通化学测定。在一些实施方式中,可通过用于测定细胞抗原的非ELISA或基于细胞计数的方法(例如针对血型的血细胞凝集测定,这可通过例如反应的浊度来测量)来分析普通化学测定。在一些实施方式中,可借助于电化学传感器(例如针对二氧化碳或氧气的电化学传感器)来分析普通化学测定。还可使用附加方法来分析普通化学测定。
在一些实施方式中,可使用分光光度计来测量普通化学测定。在一些实施方式中,可以在测定的最后(“终点”测定)或在测定过程期间的两个或更多个时间处(“时间进程”或“动力学”测定)测量普通化学测定。
在一些实施方式中,根据本文提供的系统或方法而运输的体液样品或其部分可在细胞计数测定中使用。细胞计数测定通常用于光学、电学或声学地测量个体细胞的特征。对于本公开内容而言,“细胞”可包含通常与个体细胞大小类似的非细胞样品,包括但不限于囊泡(例如脂质体)、细胞小群体、病毒体、细菌、原生动物、结晶、通过脂质和/或蛋白质的聚合形成的实体、以及与小颗粒例如珠或微球结合的物质。此类特征包括但不限于大小;形状;粒度;光散射图样(或光学特性曲线);细胞膜是否完整;细胞内部内容物的浓度、形态和时空分布,包括但不限于蛋白质含量、蛋白质修饰、核酸含量、核酸修饰、细胞器含量、核结构、核含量、细胞内部结构、内部囊泡含量(包括pH)、离子浓度和其他小分子例如类固醇或药物的存在;和细胞表面(细胞膜和细胞壁二者)标记物,包括蛋白质、脂质、碳水化合物,及其修饰。通过使用适当的染料、染色剂或其他标记分子,无论是以纯形式、与其他分子偶联还是固定在或结合于纳米颗粒或微米颗粒上,可利用细胞计数确定特定蛋白质、核酸、脂质、碳水化合物或其他分子的存在、量和/或修饰。细胞计数分析可通过例如流式细胞术或显微术进行。流式细胞术通常使用流动的液体介质,其依次携带个体细胞到光学、电学或声波检测器。显微术通常使用光学或声学手段来检测固定的细胞,通常通过记录至少一幅放大的图像。在实施方式中,细胞计数测定可涉及获得样品中的一个或多个细胞的图像。在实施方式中,可以在可允许样品中的细胞以期望的配置沉降以供成像的显微镜载玻片或小杯之上或之中提供样品。可以用例如基于CCD或CMOS的相机来获得细胞的图像。
在一些实施方式中,可以基于如何检测到检测的结果而对实验室检测类型进行分类。不同类型的实验室检测结果检测可例如包括i)发光检测;ii)荧光检测;iii)吸光度检测;iv)光散射检测;和v)成像。这些检测方法中的每一个在例如2013年2月18日提交的美国专利申请序列号13/769,820中有描述,该文献全文特此并入用于所有目的。简言之,可以从产生可测量的光信号的检测中检测发光。这样的反应例如可以是化学发光反应。为了检测发光反应的结果,可以使用诸如PMT或光电二极管等光检测器来检测来自包含发光反应的测定单元的光。可以例如用包括光源和光检测器的光学装置来检测荧光。光源可发出一个或多个特定波长的光。包含检测材料的测定单元可位于光源的路径中,以使得所述一个或多个特定波长的光到达测定单元的内容物(一个或多个“激发波长”)。测定单元可包含感兴趣的分子,该分子至少在一些情况下吸收来自光源的一个或多个特定波长下的光,并且随后释放不同波长的光。光检测器可被配置用于检测由感兴趣的分子所释放的光(一个或多个“发射波长”)。光源和/或光检测器可在光源之后或光检测器之前包括带通滤波器,以便限制来自光源或到达光检测器的光的一个或多个波长。光源例如可以是灯泡、激光器或LED,而光检测器例如可以是PMT或光电二极管。可以例如用包括光源和光检测器的光学装置来检测吸光度。光源和光检测器可彼此成一直线,并且被配置成使得包含检测材料的测定单元可位于光源与光检测器之间,从而使一些光可穿过检测材料到达光检测器并且一些光可被吸收。基于检测的结果,不同量的光可被检测材料所吸收。类似地,可以确定穿过检测材料的光透射。对于吸收/透射确定测定,由光源发出的光的一个或多个波长可与由光检测器检测到的光的一个或多个波长相同。光源例如可以是灯泡、激光器或LED,而光检测器例如可以是PMT或光电二极管。可以例如用包括光源和光检测器的光学装置来检测光散射。光源和光检测器可相对于彼此成角度,并且被配置成使得包含检测材料的测定单元可同时与光源和光检测器成一直线,从而使来自光源的光可到达测定单元并被测定单元中的检测材料所散射,以到达光检测器。基于检测的结果,不同量的光可被检测材料所散射。光源例如可以是灯泡、激光器或LED,而光检测器例如可以是PMT或光电二极管。检测材料的图像可例如由包括图像传感器(例如,CCD或CMOS传感器)的检测器来获得。通常,图像传感器将会被包括在相机中。可以例如通过自动化或手动图像分析来分析检测材料的图像,以便确定检测结果。本文所提供的体液样品还可用于通过基于非光学的检测方法(例如,测量电导率、放射性或温度)来检测结果的实验室检测。
在实施方式中,为了用体液样品的一部分执行测定/检测,可以将体液样品的所述部分转移到测定单元中用于测定/检测中的至少一个步骤。测定单元可具有各种形状因子,诸如移液器尖端、管或显微镜载玻片。可在测定单元中发生的测定的步骤例如可以包括样品中的分析物与针对该分析物的结合物(例如,抗体)结合、在核酸扩增反应中扩增样品中的靶核酸、基于一种或多种试剂向样品中的添加的样品凝结或者采用用于光学分析的配置的样品(例如,细胞沉降到显微镜载玻片的表面上,以便促进获得所述细胞的一个或多个图像)。本文所使用的术语“测定”和“检测”可互换使用,除非上下文另有明确规定。
实施例
以下实施例仅出于示例说明目的而提供,并且不旨在以任何方式限制本公开内容。
实施例1
从受试者获得全血样品。在器皿中对该全血样品进行离心分离,以便将全血分成沉淀的细胞和血浆上清液。将离心后的器皿移动至氩气吹扫的手套箱。将血浆从离心后的器皿吸出并继而整分到如本文所提供的5个单独的样品器皿中,其中样品器皿各自具有不大于100微升的内部容积,其中将不大于95微升的血浆整分到每个样品器皿中,并且其中每个样品器皿具有相同大小并接收相同体积的血浆。器皿各自具有可移除的丁基橡胶帽。将所述5个样品器皿关联于标签“0小时”、“1小时“、“2小时”、“8小时“和“24小时”。在关联于每个样品器皿的相应时间段时,对每个器皿中的样品进行针对碳酸氢盐的测定。以下在表1中提供了测定的结果。
表1
如表1中所示,在本文所提供的样品器皿中,样品中的碳酸氢盐在至少24小时内是稳定的。
实施例2
从受试者获得全血样品。将EDTA与该全血样品相混合。将80微升含有EDTA的血液整分到如本文所提供的10个样品器皿中的每一个中,其中每个样品器皿具有不大于100微升的内部容积,并且具有相同大小。将样品器皿关联于如下标签用于分析:实时:第1天、第2天、第3天、第4天、第5天和第7天;经预离心分离:第1天、第2天、第4天和第7天。每个“经预离心分离”的器皿在将样品整分到该器皿中时得到离心分离,以生成血浆和沉淀的细胞。每个“实时”器皿在相应日中得到离心分离,以生成血浆和沉淀的细胞。在将样品整分到每个样品器皿中之后,将其封盖住。在针对每个器皿的相应日中,将血浆从器皿移除并针对血尿素氮(BUN)进行测定。在图48的图表中示出了BUN测定结果。如该图表中所示,在本文所提供的样品器皿中,样品中的BUN在至少7天内保持稳定,在全血和血浆样品中都保持稳定。
本文所讨论或阐述的出版物只是为了它们在本申请的申请日之前的公开内容而提供的。本文中的任何事项均不应解释为承认本发明无权凭借在先发明而提前于这样的出版物。此外,所提供的公开日期可能不同于实际公开日期,实际公开日期可能需要独立确认。本文提到的所有出版物均通过引用而并入于此,以便公开和描述与引用的出版物相关联的结构和/或方法。下述申请通过引用而全文并入于此用于所有目的:在2011年1月21日提交的美国临时专利申请号61/435,250(“SYSTEMS AND METHODS FOR SAMPLE USE MAXIMIZATION”)和美国专利公开号2009/0088336(“MODULAR POINT-OF-CARE DEVICES,SYSTEMS,AND USES THEREOF”)。下述申请也通过引用而全文并入于此用于所有目的:美国专利公开2005/0100937、美国专利8,380,541;在2013年2月18日提交的美国专利申请序列号61/766,113;在2013年2月18日提交的美国专利申请序列号13/769,798;在2013年2月18日提交的美国专利申请序列号13/769,779;在2013年2月18日提交的美国专利申请序列号13/769,820;在2011年9月26日提交的美国专利申请序列号13/244,947;在2012年9月25日提交的PCT/US2012/57155;在2011年9月26日提交的美国申请序列号13/244,946;在2011年9月26日提交的美国专利申请13/244,949;以及在2011年9月26日提交的美国申请序列号61/673,245,上述专利和专利申请的公开内容全都特此通过引用而全文并入于此。
实施方式
在本文所描述的一个实施方式中,提供了一种用于收集来自受试者的体液样品的装置,包括:至少两个样品收集通路,其被配置用于将所述体液样品从与所述受试者相接触的所述装置的单一端吸入至所述装置中,从而将流体样品分离成两个分离的样品;第二部分,其包括用于接收被收集于所述样品收集通路中的所述体液样品的多个样品器皿,所述样品器皿可以可操作地接合以与所述样品收集通路流体连通,于是当建立了流体连通时,所述器皿提供动力以将所述两个分离的样品的大部分从所述通路移动至所述器皿中。
在本文所描述的另一实施方式中,提供了一种用于收集体液样品的装置,包括:第一部分,其包括通向至少两个样品收集通路的至少一个流体收集位置,所述样品收集通路被配置用于经由第一型动力将流体样品吸入其中;第二部分,其包括用于接收被收集于所述样品收集通路中的所述体液样品的多个样品器皿,所述样品器皿可以可操作地接合以与所述样品收集通路流体连通,于是当建立了流体连通时,所述器皿提供不同于所述第一动力的第二动力以将所述体液样品的大部分从所述通路移动至所述器皿中;其中所述样品收集通路中的至少一个包括填充指示器,该填充指示器用于指示何时达到最小填充水平并且可以接合所述样品器皿中的至少一个以与所述样品收集通路中的至少一个流体连通。
在本文所描述的另一实施方式中,提供了一种用于收集体液样品的装置,包括:第一部分,其包括至少两个样品收集通道,所述样品收集通道被配置用于经由第一型动力将流体样品吸入到所述样品收集通道中,其中所述样品收集通道中之一具有设计用于与流体样品相混合的内部涂层,而所述样品收集通道中的另一个具有化学上不同于所述内部涂层的另一内部涂层;第二部分,其包括用于接收被收集于所述样品收集通道中的所述体液样品的多个样品器皿,所述样品器皿可以可操作地接合以与所述收集通道流体连通,于是当建立了流体连通时,所述器皿提供不同于所述第一动力的第二动力以将所述体液样品的大部分从所述通道移动至所述器皿中;其中布置器皿以使得所述器皿之间流体样品的混合不会发生。
在本文所描述的另一实施方式中,提供了一种用于收集体液样品的装置,包括:第一部分,其包括多个样品收集通道,其中所述通道中的至少两个被配置用于经由第一型动力同时将流体样品吸入到所述至少两个样品收集通道中的每一个中;第二部分,其包括用于接收被收集于所述样品收集通道中的所述体液样品的多个样品器皿,其中所述样品器皿具有第一情况和第二情况,在所述第一情况中所述样品器皿不与所述样品收集通道流体连通,而在所述第二情况中所述样品器皿可以可操作地接合以与所述收集通道流体连通,于是当建立了流体连通时,所述器皿提供不同于所述第一动力的第二动力以将体液样品从所述通道移动至所述器皿中。
在本文所描述的另一实施方式中,提供了一种样品收集装置,包括:(a)收集通道,其包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液样品;以及(b)用于接收所述体液样品的样品器皿,所述器皿可与所述收集通道相接合,具有在其中具有真空的内部,并且具有被配置用于接收通道的帽;其中所述第二开口由所述收集通道的一部分所限定,所述部分被配置用于穿透所述样品器皿的所述帽,以及提供所述收集通道与所述样品器皿之间的流体流路,并且所述样品器皿具有不大于所述收集通道的内部容积的十倍的内部容积。
在本文所描述的另一实施方式中,提供了一种样品收集装置,包括:(a)收集通道,其包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液样品;(b)用于接收所述体液样品的样品器皿,所述器皿可与所述收集通道相接合,具有在其中具有真空的内部,并且具有被配置用于接收通道的帽;以及(c)适配器通道,其被配置用于提供所述收集通道与所述样品器皿之间的流体流路,其具有第一开口和第二开口,所述第一开口被配置用于接触所述收集通道的所述第二开口,所述第二开口被配置用于穿透所述样品器皿的所述帽。
在本文所描述的另一实施方式中,提供了一种样品收集装置,包括:(a)主体,其包含收集通道,所述收集通道包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液;(b)基座,其包含用于接收所述体液样品的样品器皿,所述样品器皿可与所述收集通道相接合,具有在其中具有真空的内部,并且具有被配置用于接收通道的帽;以及(c)支架,其中,所述主体和所述基座连接至所述支架的相对端,并且被配置成可相对于彼此移动,以使得样品收集装置被配置成具有伸展状态和压缩状态,其中所述基座的至少一部分在所述装置的所述伸展状态中比在所述压缩状态中更靠近所述主体,所述收集通道的第二开口被配置用于穿透所述样品器皿的所述帽,在所述装置的所述伸展状态中,所述收集通道的所述第二开口不与所述样品器皿的所述内部相接触,并且在所述装置的所述压缩状态中,所述收集通道的所述第二开口穿过所述器皿的所述帽,延伸至所述样品器皿的所述内部中,从而提供所述收集通道与所述样品器皿之间的流体连通。
在本文所描述的另一实施方式中,提供了一种样品收集装置,包括:(a)主体,其包含收集通道,所述收集通道包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液;(b)基座,其包含用于接收体液样品的样品器皿,所述样品器皿可与所述收集通道相接合,具有在其中具有真空的内部,并且具有被配置用于接收通道的帽;(c)支架,以及(d)适配器通道,其具有第一开口和第二开口,所述第一开口被配置用于接触所述收集通道的所述第二开口,并且所述第二开口被配置用于穿透所述样品器皿的所述帽,其中,所述主体和所述基座连接至所述支架的相对端,并且被配置成可相对于彼此移动,以使得样品收集装置被配置成具有伸展状态和压缩状态,其中所述基座的至少一部分在所述装置的所述伸展状态中比在所述压缩状态中更靠近所述主体,在所述装置的所述伸展状态中,所述适配器通道不与所述收集通道以及所述样品器皿的所述内部中之一或全部两者相接触,并且在所述装置的所述压缩状态中,所述适配器通道的所述第一开口与所述收集通道的所述第二开口相接触,并且所述适配器通道的所述第二开口穿过所述器皿的所述帽,延伸至所述样品器皿的所述内部中,从而提供所述收集通道与所述样品器皿之间的流体连通。
在本文所描述的另一实施方式中,提供了一种用于收集来自受试者的流体样品的装置,包括:(a)主体,其包含收集通道,所述收集通道包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液;(b)基座,其可与所述主体相接合,其中所述基座支撑样品器皿,所述器皿可与所述收集通道相接合,具有在其中具有真空的内部,并且具有被配置用于接收通道的帽;其中所述收集通道的所述第二开口被配置用于穿透所述样品器皿的所述帽,以及提供所述收集通道与所述样品器皿之间的流体流路。
在本文所描述的另一实施方式中,提供了一种用于收集来自受试者的流体样品的装置,包括:(a)主体,其包含收集通道,所述收集通道包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液;(b)基座,其可与所述主体相接合,其中所述基座支撑样品器皿,所述样品器皿可与所述收集通道相接合,具有在其中具有真空的内部,并且具有被配置用于接收通道的帽;以及(c)适配器通道,其具有第一开口和第二开口,所述第一开口被配置用于接触所述收集通道的所述第二开口,并且所述第二开口被配置用于穿透所述样品器皿的所述帽。
应当理解,以下特征中的一个或多个可适于与本文所描述的任何实施方式一起使用。举非限制性示例而言,所述主体可包括两个收集通道。可选地,一个或多个所述收集通道的内部涂覆有抗凝剂。可选地,所述主体包括第一收集通道和第二收集通道,并且所述第一收集通道的内部涂覆有与所述第二收集通道的内部不同的抗凝剂。可选地,所述第一抗凝剂是乙二胺四乙酸(EDTA),而所述第二抗凝剂不同于EDTA。可选地,所述第一抗凝剂是柠檬酸盐,而所述第二抗凝剂不同于柠檬酸盐。可选地,所述第一抗凝剂是肝素,而所述第二抗凝剂不同于肝素。可选地,一种抗凝剂是肝素,而所述第二抗凝剂是EDTA。可选地,一种抗凝剂是肝素,而所述第二抗凝剂是柠檬酸盐。可选地,一种抗凝剂是柠檬酸盐,而所述第二抗凝剂是EDTA。可选地,所述主体由光透射材料形成。可选地,所述装置包括与收集通道数目相同的样品器皿。可选地,所述装置包括与收集通道数目相同的适配器通道。可选地,所述基座包含光学指示器,所述光学指示器提供对于所述样品是否到达所述基座中的所述样品器皿的视觉指示。可选地,所述基座是窗口,其允许用户查看所述基座中的所述器皿。可选地,所述支架包括弹簧,并且弹簧施加力以使得当所述装置处于其自然状态时,所述装置处于所述伸展状态。可选地,所述收集通道或所述适配器通道的第二开口由套筒所封盖,其中所述套筒不阻止体液经由毛细作用从所述第一开口朝向所述第二开口的移动。可选地,所述套筒包含排放孔。可选地,每个收集通道可容纳不大于500uL的体积。可选地,每个收集通道可容纳不大于200uL的体积。可选地,每个收集通道可容纳不大于100uL的体积。可选地,每个收集通道可容纳不大于70uL的体积。可选地,每个收集通道可容纳不大于500uL的体积。可选地,每个收集通道可容纳不大于30uL的体积。可选地,每个收集通道的横截面的内周长不大于16mm。可选地,每个收集通道的横截面的内周长不大于8mm。可选地,每个收集通道的横截面的内周长不大于4mm。可选地,所述内周长是圆周。可选地,所述装置包括第一收集通道和第二收集通道,并且所述第一通道的开口相邻于所述第二通道的开口,并且所述开口被配置用于同时从单滴血液采血。可选地,所述第一通道的所述开口与所述第二通道的所述开口具有小于或等于约5mm的中心至中心间距。可选地,每个样品器皿具有不大于其可接合的所述收集通道的内部容积的二十倍的内部容积。可选地,每个样品器皿具有不大于其可接合的所述收集通道的内部容积的十倍的内部容积。可选地,每个样品器皿具有不大于其可接合的所述收集通道的内部容积的五倍的内部容积。可选地,每个样品器皿具有不大于其可接合的所述收集通道的内部容积的两倍的内部容积。可选地,所述收集通道与所述样品器皿之间的流体连通的建立导致所述收集通道中的所述体液样品的至少90%向所述样品器皿中的转移。
应当理解,以下特征中的一个或多个可适于与本文所描述的任何实施方式一起使用。可选地,所述收集通道与所述样品器皿之间的流体连通的建立导致所述收集通道中的所述体液样品的至少95%向所述样品器皿中的转移。可选地,所述收集通道与所述样品器皿之间的流体连通的建立导致所述收集通道中的所述体液样品的至少98%向所述样品器皿中的转移。可选地,所述收集通道与所述样品器皿之间的流体连通的建立导致所述体液样品向所述样品器皿中的转移,并且导致不超过10uL的体液样品保留在所述收集通道中。可选地,所述收集通道与所述样品器皿之间的流体连通的建立导致所述体液样品向所述样品器皿中的转移,并且导致不超过5uL的体液样品保留在所述收集通道中。可选地,所述收集通道与所述样品器皿的接合导致所述体液样品向所述样品器皿中的转移,并且导致不超过2uL的体液样品保留在所述收集通道中。
在本文所描述的另一实施方式中,提供了一种方法,包括:使样品收集装置的一端接触体液样品,以通过经由第一型动力向所述样品收集装置的至少两个收集通道中吸入所述样品,来将所述样品分成至少两个部分;在已经确认期望量的样品流体处于所述收集通道中的至少一个中之后,在所述样品收集通道与所述样品器皿之间建立流体连通,于是所述器皿提供不同于所述第一动力的第二动力,以将体液样品的每一部分移动至其相应的器皿中。
在本文所描述的另一实施方式中,提供了一种方法,包括:通过使用样品收集装置来将最少量的样品计量到至少两个通道中,所述样品收集装置具有样品收集通道中的至少两个,所述至少两个样品收集通道被配置用于经由第一型动力同时将流体样品吸入到所述至少两个样品收集通道中的每一个中;在已经确认期望量的样品流体处于所述收集通道中之后,在所述样品收集通道与所述样品器皿之间建立流体连通,于是所述器皿提供不同于用以收集样品的所述第一动力的第二动力,以将体液样品从所述通道移动至所述器皿中。
在本文所描述的另一实施方式中,提供了一种收集体液样品的方法,包括:(a)使体液样品与包括收集通道的装置相接触,所述收集通道包括第一开口和第二开口,并且被配置用于经由毛细作用从所述第一开口朝向所述第二开口吸入体液,以使得所述体液样品从所述第一开口穿过所述第二开口填充所述收集通道;(b)在所述收集通道与样品器皿的内部之间建立流体流路,所述样品器皿具有不大于所述收集通道的内部容积的十倍的内部容积,并且在所述收集通道与所述样品器皿的所述内部之间的流体流路的建立之前具有真空,以使得所述收集通道与所述样品器皿的所述内部之间的流体流路的建立在所述收集通道的所述第二开口处生成负压,以及将流体样品从所述收集通道转移至所述样品器皿的所述内部。
在本文所描述的另一实施方式中,提供了一种收集体液样品的方法,包括:(a)使体液样品与如本文所述的任何收集装置相接触,以使得所述体液样品从所述装置中的一个或多个收集通道中的至少一个的第一开口穿过第二开口填充所述收集通道;以及(b)在所述收集通道与所述样品器皿的内部之间建立流体流路,以使得建立所述收集通道与所述样品器皿的所述内部之间的流体流路在所述收集通道的所述第二开口处生成负压,以及将流体样品从所述收集通道转移至所述样品器皿的所述内部。
应当理解,以下特征中的一个或多个可适于与本文所描述的任何实施方式一起使用。可选地,不使所述收集通道与所述样品器皿的所述内部流体连通,直到体液到达所述收集通道的所述第二开口。可选地,所述装置包括两个收集通道,并且不使所述收集通道与所述样品器皿的所述内部流体连通,直到体液到达全部两个收集通道的所述第二开口。可选地,所述装置中的所述收集通道的所述第二开口被配置用于穿透所述样品器皿的所述帽,并且其中通过提供所述收集通道的所述第二开口与所述样品器皿之间的相对移动以使得所述收集通道的所述第二开口穿透所述样品器皿的所述帽,来建立所述收集通道的所述第二开口与所述样品器皿之间的流体流路。可选地,所述装置包括针对所述装置中的每个收集通道的适配器通道,所述适配器通道具有第一开口和第二开口,所述第一开口被配置用于接触所述收集通道的所述第二开口,并且所述第二开口被配置用于穿透所述样品器皿的所述帽,并且其中通过提供(a)所述收集通道的所述第二开口、(b)所述适配器通道以及(c)所述样品器皿中的两项或更多项之间的相对移动以使得所述适配器通道的所述第二开口穿透所述样品器皿的所述帽,来建立所述收集通道与所述样品器皿之间的流体流路。
在本文所描述的另一实施方式中,提供了一种用于收集来自受试者的体液样品的方法,包括:(a)使包括第一通道和第二通道的装置与来自所述受试者的体液流体连通,每个通道具有输入开口,所述输入开口被配置用于与所述体液流体连通,每个通道具有位于每个通道的所述输入开口下游的输出开口,并且每个通道被配置用于经由毛细作用从所述输入开口朝向所述输出开口吸入体液;(b)通过所述第一通道和所述第二通道中的每一个的所述输出开口,使所述第一通道和所述第二通道相应地与第一器皿和第二器皿流体连通;以及(c)借助于以下各项,将所述第一通道和第二通道中的每一个内的所述体液引导至所述第一器皿和第二器皿中的每一个:(i)在所述第一器皿或所述第二器皿中的相对于环境压强的负压,其中所述负压足以产生所述体液穿过所述第一通道或所述第二通道向其对应的器皿中的流动,或者(ii)在所述第一通道或所述第二通道上游的相对于环境压强的正压,其中所述正压足以产生所述全血样品穿过所述第一通道或所述第二通道向其对应的器皿中的流动。
在本文所描述的另一实施方式中,提供了一种制造样品收集装置的方法,包括:形成具有至少两个通道的样品收集装置的一部分,所述通道被配置用于经由第一型动力同时将流体样品吸入到所述至少两个样品收集通道中的每一个中;形成样品器皿,于是所述器皿被配置用于耦合至所述样品收集装置,以提供不同于用以收集样品的所述第一动力的第二动力,从而将体液样品从所述通道移动至所述器皿中。
在本文所描述的另一实施方式中,提供了计算机可执行指令,用于执行一种方法,所述方法包括:形成具有至少两个通道的样品收集装置的一部分,所述通道被配置用于经由第一型动力同时将流体样品吸入到所述至少两个样品收集通道中的每一个中。
在本文所描述的另一实施方式中,提供了计算机可执行指令,用于执行一种方法,所述方法包括:形成样品器皿,于是所述器皿被配置用于耦合至所述样品收集装置,以提供不同于用以收集样品的所述第一动力的第二动力,从而将体液样品从所述通道移动至所述器皿中。
在本文所描述的又一实施方式中,一种用于收集来自受试者的体液样品的装置,所述装置包括:用于从与所述受试者相接触的所述装置的单一端向所述装置中吸入所述体液样品从而将流体样品分成两个分离的样品的装置;用于向多个样品器皿中转移所述流体样品的装置,其中所述器皿提供动力以将所述两个分离的样品的大部分从所述通路移动至所述器皿中。
尽管上文是对如本文所描述的优选实施方式的完整描述,但有可能使用各种替代、修改和等同物。因此,不应当参考以上描述而确定本发明的范围,而是应当参考所附权利要求书,连同其等同物的全部范围一起来确定本发明的范围。无论优选与否的任何特征均可与无论优选与否的任何其他特征相组合。所附权利要求书不应被解释为包括装置加功能的限定,除非这样的限定在给定的权利要求中使用短语“用于…的装置”而被明确阐述。应当理解,如本文的描述和随后的权利要求书全文中所使用,“一个”、“一种”和“该”等的含义包括复数指代对象,除非上下文另有明确规定。此外,如本文的描述和随后的权利要求书全文中所使用,“之中”的含义包括“之中”和“之上”,除非上下文另有明确规定。最后,如本文的描述和随后的权利要求书全文中所使用,“和”和“或”的含义同时包括结合的和分离的,并且可以互换地使用,除非上下文另有明确规定。因此,在使用术语“和”和“或”的上下文中,这样的连接词的使用不排除“和/或”的含义,除非上下文另有明确规定。下列美国专利申请通过引用而并入于此用于所有目的:在2012年12月5日提交的61/733,886、在2013年9月7日提交的61/875,030和在2013年9月8日提交的61/875,107。本文档包含受到版权保护的材料。版权所有者(本文的申请者)不反对对专利文件和公开内容的摹本复制,因为它们出现于美国专利商标局专利文件或记录中,但除此之外保留任何所有的版权。以下声明应当适用:版权2013赛拉诺斯股份有限公司。
- 还没有人留言评论。精彩留言会获得点赞!