运动机能减退和/或运动机能亢进状态的检测的制作方法与工艺
运动机能减退和/或运动机能亢进状态的检测本申请是2009年6月12日提交的申请号为200980121933.3、国际申请号为PCT/AU2009/000751的专利申请案的分案申请。技术领域本发明涉及通过监视动作症状对人的运动状态进行分析,以检测运动迟缓和/或运动障碍或者运动机能亢进。
背景技术:
非常多的疾病、药物、创伤及其他因素可能致使一个人具有诸如运动障碍或者运动迟缓的动作症状,其中具有运动障碍症状的人处于运动机能亢进状态,而具有运动迟缓症状的人处于运动机能减退状态。例如,运动迟缓是帕金森症的一种关键症状。通常令患有帕金森症的病人服用L-Dopa或者左旋多巴,这种药可具有使病人在服药之后的一段时期内变为运动障碍的效果。随着帕金森症的发展,左旋多巴的半衰期缩短,有效剂量范围减少,使得剂量控制极其困难和复杂。通常通过增加服药频率来对此进行控制,有时每天服用十次剂量之多,以求控制症状以及使病人能够具有适当的生活质量。因此,具有帕金森症的病人可能在一天内以及单次剂量的左旋多巴的整个疗程内,若干次地体验到运动迟缓、运动障碍和正常运动机能的周期。即使在一个时间点建立了令人满意的服药剂量制度,帕金森症的进行性特性意味着神经科医生必须定期地复查病人的症状,以便有效地控制该病人的不断增加的治疗剂量。如果没有客观和不断跟进的监视,医生很难避免开出过度增加运动障碍发作的过量剂量、或者不能防止运动迟缓发作的不足剂量。此外,也没有用以表明剂量的变化是否对改善症状起到了效果的客观量度。从临床观察来看,有经验的神经科医生通常能够检测出运动迟缓和运动障碍的存在。在一种方式中,进行临床观察的医生给出一个0到20范围内的分数,以指示所观察到的发病的严重程度。图1示出由三名神经科医生给出的分数,每一个标记点表示两名神经科医生观察一次运动障碍发作时给出的分数。相对于神经科医生2的分数,绘出了神经科医生1的分数(三角形)和神经科医生3的分数(圆形)。显然,这种评分方法的主观特性导致了相当大的差异。在一个极端范例中,神经科医生2为一次运动障碍发作评分为严重程度10(当注意到神经科医生2曾给出的最高分数是13时,可知这次发作是非常严重的),而神经科医生3对同一发作评分为严重程度0(没有观察到运动障碍)。因此,尽管医生通常能够在观察期间检测出运动障碍及其他运动状态,然而这些状态不容易被量化,使得剂量控制非常主观。此外,临床观察一般仅在病人在场的短时间内做出,通常约为数十分钟,每6或者8周一次。而运动状态在全天内、以及在每天之间的波动显著增加了评估病人的运动状态的困难度。临床医生常常依靠病人的回忆和/或日记,来了解该病人在各次临床约诊之间的不断变化的运动状态。然而,病人很少能够给出客观的分数,并且运动病症发作本身的影响可能常常使病人难以做出任何关于运动症状波动的性质和时间的任何记录。帕金森症的另一常见症状例如是颤抖。帕金森症的颤抖比大多数的颤抖形式缓慢,其频率为4-6周/秒。与其他运动构成相比较,颤抖由具有相对很少的频率分量的振动构成。在频谱分析上,它表现为窄频率范围(4-6Hz)内的离散峰值,通常明显地高于普通运动的频率范围(小于4Hz)。颤抖已经成为大量研究的主题,尤其是利用频谱分析对其进行研究。颤抖相对来说易于检测,因为它是连续的重复运动,具有正弦波的特征,易于与很少如此连续的正常人动作区分开。与运动障碍和运动迟缓相比,在帕金森症的控制中颤抖容易处理得多。已经尝试根据颤抖的测量结果来推断人的运动迟缓状态,以用于调整药物。然而,对于很多病人来讲,在颤抖和运动迟缓之间并不存在紧密的相关性,这使得使用这种技术可能会不正确地用药。对于本说明书中现已包括的文件、技术、材料、设备、制品等等的任何讨论都仅仅是为了提供本发明的上下文环境。并不应当将其视为承认这些内容中的任何或者全部构成了在本申请的每一权利要求的优先权日之前存在的现有技术基础的一部分、或是本发明的相关领域内的公知常识。在整个说明书中,措辞“包括”或其变型比如“包含”、“含有”都应理解为其意味着包含所表述的单元、整体或步骤、或者单元、整体或步骤的组,但并不排除任何其他的单元、整体或步骤、或者单元、整体或步骤的组。
技术实现要素:
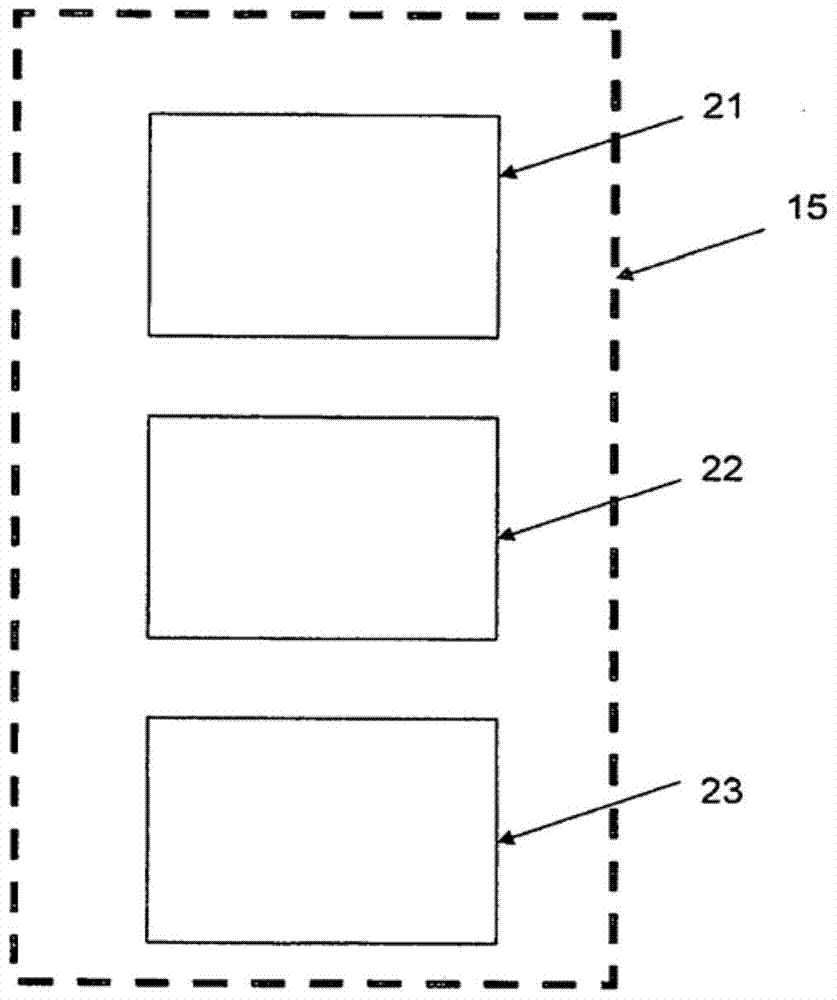
根据第一方面,本发明提供了一种确定人的运动状态的自动方法,该方法包括:从佩戴在人的肢体上的加速度仪获得数据;以及对该数据进行处理,以确定运动状态的量度,该运动状态是运动迟缓、运动障碍和运动机能亢进中的至少一种。根据第二方面,本发明提供了一种用于确定人的运动状态的设备,该设备包括:处理器,被配置为处理从佩戴在人的肢体上的加速度仪获得的数据,并根据该数据确定运动状态的量度,所述运动状态是运动迟缓、运动障碍和运动机能亢进中的至少一种。根据第三方面,本发明提供了一种计算机程序产品,包括用于使计算机执行确定人的运动状态的程序的计算机程序装置,所述计算机程序产品包括:用于从佩戴在人的肢体上的加速度仪获得数据的计算机程序代码装置;以及用于处理所述数据以确定运动状态的量度的计算机程序代码装置,所述运动状态是运动迟缓、运动障碍和运动机能亢进中的至少一种。值得注意的是,本发明由此能够根据从佩戴在人的肢体上的一个加速度仪获得的测量结果,做出有关人的运动状态的判定。在本说明书中,术语运动状态被定义为一种运动异常状态。本发明认识到,佩戴在肢体上的一个传感器提供了足以做出运动迟缓和/或运动障碍或运动机能亢进状态的判定的足够的运动相关数据。因而,本发明的实施例对于虚弱、年老或残疾人士特别适合,为这些人士配置多于一个的传感器是不实际的。在某些实施例中,加速度仪被佩戴在肘部下方,比如手腕上。在其他实施例中,传感器可以被佩戴在膝部下方,比如脚踝上。此外,本发明提供了一种运动状态的自动判定,该运动状态是运动迟缓和运动障碍中的至少一种,因而提供了一种技术,其不依赖于根据颤抖量度的可能不精确的运动迟缓推断。在优选实施例中,处理加速度仪数据,以便确定运动迟缓量度和运动障碍量度两者。运动迟缓在确定运动迟缓量度的一些实施例中,对来自加速度仪的数字数据进行带通滤波,以提取所关注频带的数据。所关注频带可以具有被选择用于去除DC的下端截止频率。该下端截止频率例如可以在0.05Hz至1Hz范围内,优选的是0.2Hz。所关注频带可以具有被选择用于消除高频分量的上端截止频率,该高频分量一般不是由正常人动作引起。该上端截止频率例如可以在3Hz至15Hz范围内,优选的是4Hz。大约4Hz的上端截止对于避免或最小化通常超过4Hz的颤抖的影响而言是有益的。附加地或者替代地,在确定运动迟缓量度的一些实施例中,从数据的时间序列中提取数字加速度数据的时间块或“选区(bin)”并对其单独考虑,每一选区是一持续时间,该持续时间被选择为短到足以确定运动迟缓的相对规律的量度,而又长到足以提供由人在该选区时间做出显著运动的合理可能性。例如,该选区持续时间可以在2秒至60分钟范围内,更优选的是在15秒至4分钟范围之内,最优选的是在30秒至2分钟范围之内。附加地或者替代地,在确定运动迟缓量度的一些实施例中,搜索数字数据中的最大值,优选的是使用具有时窗长度(windowlength)的移动平均值,该时窗长度是正常人动作的持续时间的几分之一,例如该移动平均值的时窗长度可以是在0.02秒至30秒范围内,并且可以基本上是0.2秒。其中发现数据具有最高平均值的时窗被认为是表示人的具有峰值加速度的运动。这种实施例认识到,处于正常运动状态的人的运动一般具有高于运动迟缓的人的峰值加速度,因而峰值加速度是一种可以用来检测和量化运动迟缓状态的指标。在评估数据选区的实施例中,对于选区i,用PKi表示最高平均值,其是峰值加速度的时窗。考虑到对于某些选区,运动迟缓的人和运动状态正常的人都可能完全保持静止,可以应用阈值,借以排除低于该阈值的PKi值。额外地或者替代地,在确定运动迟缓量度的一些实施例中,获得包括峰值加速度之前和之后的多个数据点的子选区。所述子选区优选的是包括多个为2的幂次的数据点,并且所述子选区优选的是对称地位于该峰值加速度周围。所述子选区优选的是包括在与单个正常人运动的持续时间基本上相同的一段时间内获得的数据点,例如所述子选区的持续时间可以在0.5秒至30秒范围内,更优选的是在1秒至3秒范围内,例如可以基本上是2.56秒。如果可以的话,,所述子选区还优选的是相关选区的长度的一小部分。优选的是,例如对子选区的数据进行快速傅里叶变换来执行所述子选区的频谱分析,以获得子频带频谱量度。所述子频带的宽度可以大约为所关注频带的四分之一。所述子频带的宽度可以在0.1Hz至2Hz范围内,更优选的是在0.6Hz至1Hz范围内,并且可以基本上是0.8Hz。所述子频带可以在频域中重叠,例如可以考虑八个部分重叠的子频带。因而,这种实施例能够获得具有峰值加速度的单个运动的频谱分量,其认识到:如果人的峰值运动具有强的低频分量,则表示运动迟缓。因而,一些实施例可以识别哪一单个子频带具有最大功率,并且当低频子频带具有最大功率时,给出存在运动迟缓的较强指示。额外地或者替代地,可以对子频带频谱量度的一些或全部进行加权,以产生加权平均谱功率(MSPi),使得当最大值(MSPi)很小并且存在于较低频率的子频带中时,给出运动迟缓的较强指示,而当最大值(MSPi)很高并且存在于高频率的子频带中时,给出运动迟缓的较弱指示。额外地或者替代地,在确定运动迟缓量度的一些实施例中,可以考虑多个(n个)连续选区,对每一选区确定PKi和MSPi,并且从所有n个选区中选择PKi的最大值(PKi.max),以及选择MSPi的最大值(MSPi.max)。然后可以如下计算运动迟缓分数BK:BK=PKi.max×MSPi.max替代地,可以如下计算运动迟缓分数:BK=A×logc(PKi.max×MSPi.max)-B其中A、c和B是可选择的调谐常数。在一非限制性的范例中,A=16.667,n=10,B=116.667。这种实施例认识到,如果人保持静止,则单个选区可能几乎不包含能够用以在运动状态正常的人和运动迟缓的人之间进行区分的信息。考虑选区的序列增加了将实际运动纳入考虑的可能性。附加的或替代的实施例使BK分数能够受到人是否长时间不运动的影响。这种实施例认识到运动状态正常的人和运动迟缓的人之间的关键区分因素,即运动状态正常的人很少在任意一段明显很长的时间内保持完全不动,而运动迟缓的人能够在一段明显很长的时间内保持不动。这种实施例例如可以考虑多个选区的PKi的阈值加速度值,比如取一小值的PKi值模式。如果人的PKi在一段长时期(被称为静态时间或QT)内都未超过该阈值,则在这种实施例中,可以将其视为表示运动迟缓状态。例如,可以如下计算运动迟缓分数:BK=A×logc(PKi.max×MSPi.max)/QTm-B大的QT减少了该BK分数,从而更强地表示运动迟缓。m的值优选是大于或等于1,使得长时间的QT更强地影响BK分数。应注意的是,这种实施例产生了与常见临床主观量度一致的BK分数,其对于运动状态正常的人为大值,而对于运动迟缓的人为接近于零的小值。在另一实施例中,QT可以独立用作BK的附加指标。大的QT将恰好为BK。可以输出多个连续BK分数的移动平均值,以使结果平滑。在一些实施例中,可以在一段时间内重复地确定运动迟缓的量度,例如可以每隔几分钟确定该量度。在这种实施例中,可以确定包括各个量度之和的累积的运动迟缓分数,以便提供运动状态的累积指示。例如,可以在单次剂量的左旋多巴的疗程期间确定该累积分数,或者可以在一天的疗程期间确定该累积分数。因而,本发明的一些实施例认识到,运动迟缓型运动具有较低的加速度和速度,并且在所有频率中由于频谱分析在低频和低功率具有相对优势,在频谱分析中显现出运动迟缓型运动的低的频率、幅度、速度和加速度。运动障碍在确定运动障碍量度的一些实施例中,对来自加速度仪的数字数据进行带通滤波,以提取所关注频带的数据。所关注频带可以具有被选择为去除DC分量的下端截止频率,例如在0.05Hz至2Hz范围之内,优选为1Hz。所关注频带可以具有被选择用于消除高频率分量的上端截止频率,例如在3Hz至15Hz范围之内,优选为4Hz,该高频率分量一般不是由正常人动作引起。大约4Hz的上端截止对于避免或最小化通常超过4Hz的颤抖的影响而言可以是有益的。附加地或者替代地,在确定运动障碍量度的一些实施例中,从数据的时间序列中提取数字加速度数据的时间块或“选区”并对其单独考虑,每一选区是一持续时间,该持续时间被选择为短到足以确定运动障碍的相对规则的量度,而又长到足以提供运动状态正常的人在该选区期间内的部分时间极少或无运动的合理可能性。例如,该选区持续时间可以在10秒至10分钟范围内,更优选的是在30秒至4分钟范围之内,最优选的是基本为2分钟。这种实施例认识到,运动状态正常的人和运动障碍的人之间的区分因素在于,运动状态正常的人具有极少运动或无运动的时间,而运动障碍的人一般无法保持静止,因而几乎没有极少运动或无运动的时间。额外地或者替代地,在确定运动障碍量度的一些实施例中,可以将数据与阈值进行比较,并且可以确定该数据保持低于该阈值的时间长度或时间所占的比例。这种量度涉及人减少运动的时间长度或时间所占的比例,在此被称为减少运动时间(TRM)。所述阈值可以是数据的平均值。可以将数据的移动平均值与该阈值进行比较,以便减少噪声效应。例如,移动平均值的时窗长度可以在0.5秒至4秒范围内,优选的是基本为1秒。在这种实施例中产生的TRM量度对于运动障碍的人很小,因为他们几乎没有无运动时间,但是对于运动状态正常的人较大,因而能够检测和量化运动障碍。额外地或者替代地,在确定运动障碍量度的一些实施例中,可以将数据与阈值进行比较,并且可以确定低于该阈值的数据的功率量度。这种实施例认识到,运动障碍的人的低于阈值的数据的功率将比运动状态正常的人的低于阈值的数据的功率高,因为运动障碍的人很少是真正不动的。该阈值可以是数据的平均值,其对于运动障碍的人将取更高的值,导致低于该阈值的数据的更高功率,从而增强了检测和量化运动障碍的能力。所述低于该量度的数据的功率量度可以包括通过对低于阈值的数据进行快速傅里叶变换而获得的平均谱功率(SPRM)。可以取SPRM的均方根(RMS)值,以获得SPRM.RMS。额外地或者替代地,在确定运动障碍量度的一些实施例中,可以获得该数据的频率分量的方差(VAR)。这种实施例认识到,运动障碍常常产生宽频率范围的运动,这导致大的VAR,而运动状态正常的人倾向于对于大多数动作都以类似的速度运动,这导致小的VAR。因而,VAR提供了可以用来检测和量化运动障碍的进一步的量度。在确定运动障碍量度的一些实施例中,可以如下计算运动障碍分数:DK=A×logc(SPRM/TRM)额外地或者替代地,在确定运动障碍量度的一些实施例中,可以如下计算运动障碍分数:DK=A×logc(Acc×SPRM/TRM)。额外地或者替代地,在确定运动障碍量度的一些实施例中,可以如下计算运动障碍分数:DK=A×logc(RMSRM/TRM)其中A和c是可选择的调谐常数,TRM是减少运动的时间,RMSRM是低于阈值的加速度仪数据的均方根值。额外地或者替代地,在确定运动障碍量度的一些实施例中,可以如下计算运动障碍分数:DK=A×logc(VAR/TRM)额外地或者替代地,在确定运动障碍量度的一些实施例中,可以如下计算运动障碍分数:DK=A×logc(VARxSPRM/TRM)由于SPRM、SPRM.RMS、VAR和Acc对于运动障碍的人是大值,而TRM对于运动障碍的人是小值,因此上述分数以高数值表示运动障碍,与常见临床主观量度一致。可以输出多个连续DK分数的移动平均值,以使结果平滑。在一些实施例中,可以在一段时间内重复地确定运动障碍量度,例如可以每隔几分钟确定该量度。在这种实施例中,可以确定包括各个量度之和的累积运动障碍分数,以便提供运动状态的累积指示。例如,可以在单次剂量的左旋多巴的疗程期间确定该累积分数,或者可以在一天的疗程期间确定该累积分数。因而,本发明的一些实施例认识到,运动障碍的运动具有更高的功率,增大的幅度,并具有连续不间断的特性。在一些实施例中,对数据进行处理,以便产生运动迟缓量度和运动障碍量度两者。这种实施例认识到,人可能同时或接连遭受运动迟缓和运动障碍两者,可以根据由加速度仪返回的数据对每一状态独立地进行量化。因而,本发明的一些实施例能够客观地检测和量化运动迟缓和/或运动障碍状态,这无论是在临床试验还是在正常临床环境中,对于评估治疗药物的效果都很重要,对于指导改善病情的介入治疗(intervention)的使用尤为重要。即使是运动症状波动的情况下,这些实施例仍可以通过全天基本连续地或频繁地测量,来实现客观的检测和量化。而且,并不是依赖于病人或神经科医生的主观量度,本发明的实施例提供了客观量度,因而能够在一段较长时期内进行自动的比较分析,比如在24小时期间内。这种实施例认识到,为了更好地评估治疗药物比如左旋多巴的影响,较长时期的分析是有益的。在一些实施例中,加速度仪是3轴加速度仪,其为灵敏性的每一轴提供与沿着该轴的加速度成比例的输出。优选的是,对每一输出进行采样以获得表示相对于时间变化的加速度的数据。例如,可以使用100Hz采样。在本发明第二方面的一些实施例中,该设备可以是与人相隔远距离的中央计算设备,其被配置为经由通信网络从加速度仪接收数据。在这种实施例中,所述中央计算设备可被进一步配置为将所确定的运动状态量度传送到与该人往来的医生或临床医生等。在本发明第二方面的其他实施例中,该设备可以是身体佩戴设备,其包括从中获得数据的加速度仪。这种实施例可以进一步包括输出装置,比如显示器,以便向人显示所确定的运动状态量度。在这种实施例中,该设备的处理器可以进一步配置为使用该运动状态量度更新该人的药物治疗方案,并为该人显示该更新的方案。可以通过改变服药剂量和/或更新服药剂量的时间,来更新药物治疗方案。附图说明现在将参考附图,说明本发明的范例,其中:图1示出由三名神经科医生给出的运动障碍分数的图示,每一个标出点表示由两名神经科医生在观察一次运动障碍发作时给出的分数;图2是根据本发明实施例的用于检测各种帕金森症临床状态的设备的图解视图;图3示出了根据本发明的一个实施例的运动状态监视和报告;图4是运动障碍分数的图示,每一点示出本发明的一个实施例为一次运动障碍发作生成的分数,该分数相对于三名神经科医生观察同一发作所给出的分数的平均值而绘制;图5示出为每一受验组(C=对照者,B=运动迟缓受验者,D=运动障碍受验者)绘制的任务2(运动迟缓分数)期间获得的平均峰值加速度(APA);图6A示出从静坐(虚线,任务3)和进行自主运动(任务1,粗实线)的正常受验者获得的功率谱;图6B示出当受验者被要求使用食指横跨示波器屏幕地移动以跟踪2Hz和4Hz振荡时的频谱输出;图7示出从书写单词"minimum"的正常受验者获得的功率谱;图8是对于每一频带的进行任务1或任务3的正常(C)、运动迟缓(B)和运动障碍(D)的受验者的MSP的图示;图9A是相对于ABS的APA的图示;图9B示出相对于时间绘制的单个病人在服用左旋多巴之后的运动迟缓的变化,粗实线表示通过APA确定的运动迟缓,虚线表示通过ABS确定的运动迟缓;图10A示出相对于ADS绘制的IMS;图10B示出相对于时间绘制的单个病人在服用左旋多巴之后的运动障碍的变化,粗实线表示通过APA确定的运动障碍,虚线表示通过ADS确定的运动障碍;图11是使用本发明的装置和系统的病人的扫描结果以及产生的判定;图12示出可以在用于实现本发明的示例性系统中使用的通用计算设备;图13示出与全身的IMS分数相比的手腕的IMS分数;图14是示出在全天疗程中的个人的基本连续的DK和BK评分的图表。图15是示出一种可用于提供本发明结果的替代方式的图表,绘制了每次剂量之后的时期内的DK分数的累加和、连同全天的BK分数值;以及图16是描绘运动障碍病人的DK和BK分数的图表。具体实施方式图2是根据本发明实施例的用于检测各种帕金森症或者运动状态的设备15的图解视图。设备15是手腕安装式的,本发明人已认识到手腕提供了全身运动状态的充分精确的表现。例如,图13中示出了手腕的IMS分数与全身的IMS分数的比较,其说明手腕给出了足够的运动状态信息。设备15包括用于获得人的肢体的运动数据的三个部件。设备15包括加速度仪形式的动作监视器21,以提供运动迟缓和运动障碍的客观判定的方式记录和分析所接收数据的评估器22,以及用于输出运动迟缓或者运动障碍在时间段内的客观判定以使临床医生能够开出药方或者使患者能够更好地了解其自身运动状态的输出装置23。设备15是一种重量轻的设备,目的是佩戴在人的受到最大影响的手腕上。该设备被安装在弹性的腕带上,以便受到足够牢固的支撑,使其不会在手臂上摇晃,且不会因此放大加速度。该设备被配置为从人的手腕升高最小的量,以便使运动的放大最小化。该设备可以位于通过带扣固定的腕带上,由此通过解开带扣和去除设备的动作来中断电路,以及向记录器告知现在未佩戴该设备。优选的是,病人在服用他们当天的首次药物之前的至少30分钟内佩戴该设备,直到就寝时间为止。这使得该设备能够记录清晨的运动迟缓,而此时运动迟缓常常处于最差状态。然后,该设备接着记录对于当天的所有药物的运动响应。加速度仪21在0-10Hz的带宽记录三个轴X、Y、Z上的加速度,并将三个通道的数据存储在该设备的机载存储器中。该设备具有250MB的存储量,以便能够在该设备上存储多达3天的数据,之后可以将该设备提供给管理人员以下载和分析数据。此外,在本实施例中,在每晚的病人睡眠时间去除该设备的时候,该设备被配置为放置在底座(dock)中并与该底座连接,以使得该设备将数据传送到底座,而该底座随后经由无线宽带将数据发送给总公司处的分析服务器(参见图3中的114)。与底座的连接还为设备的电池充电。作为预期被潜在的虚弱人士携带的腕带式设备,该设备具有极小的尺寸和重量。此外,由于这个缘故,设计了底座接口,使得该设备方便地放置就位以实现接口连接,并提供了非常清楚的实现连接的反馈。在一种替代方案中,可以通过蓝牙等将来自数据记录器的信息无线发送到PDA(个人数字助理),使病人无需底座便可实现数据传送。图3示出了根据本发明的一个实施例的运动状态监视和报告。病人112佩戴着图2的设备。该设备15记录加速度仪数据,并将其传送到中央计算设施114。计算设施114使用算法(下文将进一步讨论)分析该数据,以获得人112的运动迟缓状态分数的时间序列,以及该人的运动障碍状态分数的时间序列。以能够被神经科医生116快速解读的格式,将这些分数报告给神经科医生116,以确保有效利用神经科医生的时间。该报告显示主要运动类别,并被直接发送到医生的电子信箱,或者可在网站上查阅。根据该报告,可以使病人的用药方案最佳化。神经科医生116随后解读该运动状态报告,并据此更新病人的药物处方。通过使用频率范围0至10赫兹、测量范围+/-4g的单轴加速度仪,加速度仪测量加速度。替换地,可以使用三轴加速度仪来提供更强的灵敏度。该设备存储数据多达7天,每天16小时。然后人工地或者通过无线宽带,将所存储的数据传送到中央计算设施114,或者通过蓝牙将所存储的数据无线传送到PDA,等等。因此,该记录系统是完全移动式的,并可以由病人在家佩戴。在本实施例中,由中央计算设施114对所获得的数据应用算法,以便生成运动障碍分数和运动迟缓分数。运动迟缓评分算法用于产生自动运动迟缓分数(BK)的算法基于如下认识:运动迟缓受验者在运动之间具有较长间隔,并且当他们运动时,该运动的加速度较低。因此,运动迟缓病人运动的时间百分比低。运动状态正常的人的运动时间百分比较高且运动峰值加速度较高。与目前使用的基于临床观察的主观量度一致,在本算法中,低BK分数表示较严重的运动迟缓,而高BK分数表示几乎没有或无运动迟缓。该运动迟缓评分算法按以下步骤对所记录的数据进行运算。BK1:对数据进行带通滤波,以提取0.2至4Hz范围内的分量,以便去除DC、手腕旋转、4Hz以上的颤抖、以及对记录器的偶然碰撞等等。BK2:在某一时间检索数据的短选区,在本实施例中为每一选区30秒或者3000个数据点。选区长度足够长到使人在该选区时间内有机会进行显著运动,使得可能由这种运动中产生参数PKi和SPmaxi(下文将详细描述)。步骤BK3至BK9被设计为查找该选区中的最大加速度以及该加速度发生的频率。这是认识到,正常运动具有以较高频率发生的较高加速度,而运动迟缓的特征在于以较低频率发生的较低峰值加速度。BK3:搜索第i个选区中的最大加速度值,该最大加速度值使用0.2秒(20个数据点)的移动平均值以消除噪声。具有最高平均值的0.2秒时间被视为是峰值加速度PKi。在其他实施例中,可以通过采用中值,或者除去高值,或者低通滤波,来去除噪声。BK4:采集PKi两侧的X个点,以创建将要进行FFT的2X个数据点的子选区。在本实施例中,在每一侧获取128个点,以产生256个点(2.56s)的子选区。BK5:对原始加速度仪信号上的峰值加速度子选区执行FFT,以查找PKi周围存在的频率分量。BK6:考虑重叠的0.8Hz频带,即:A0.2-1.0HzB0.6-1.4HzC1.0-1.8HzD1.4-2.2HzE1.8-2.6HzF2.2-3.0HzG2.6-3.4HzH3.0-3.8Hz识别出包含最大平均谱功率SPmaxi的频带。BK7:如下对八个频率选区的每一个中的值进行加权:A×0.8B×0.9C×1.0D×1.1E×1.2F×1.3G×1.4H×1.5使用线性查找函数,从加权后的频带值中识别出最大加权平均谱功率(MSPMAX)。BK8:具有高频率和高振幅的高MSPmax被视为更可能表示非运动迟缓状态,而小MSPmax更可能表示运动迟缓。BK9:对于每个30秒选区重复步骤BK3至BK8,以获得一系列的MSPmax.i值。BK10:识别和记录一组分析选区中的最大运动。例如,该组分析选区可以遍布四个选区,以便每2分钟产生一个BK分数,或者可以遍布六个选区,以便每3分钟产生一个BK分数。选择该组选区的最大PKi以及该组选区的最大加权MSPmax.i,应注意的是,这两个值可能不在同一选区中出现。通过如下计算来产生运动迟缓分数:BK=A×log10(MSPmax×PKi)-B因此,这一步骤对每一个2-3分钟时窗中的“最大”或者最剧烈运动进行计算。然后相对于时间绘制出BK分数。BK11:在2至10分钟时窗(时窗长度是变量)中获取BK值的移动平均值,并相对于时间绘制该移动平均值,由此对结果进行过滤,以便为神经科医生提供直观显示。因此,由该算法产生的BK分数使得能够对每一药物引起的随时间的BK变化进行评估,并能够对从服药时间开始的BK相对变化进行度量。这还允许对病人在每天或者每次服药期间处于每一BK分数的时间所占百分比进行评估。应注意,运动状态正常的人可能在短时期内表现出运动迟缓的行为,评估人的运动迟缓的持久度和深度是很重要的,通过本实施例可以实现这一点。运动障碍评分算法用于产生自动运动障碍分数的算法基于如下认识:运动障碍受验者在运动之间几乎没有间隔或者停顿,而非运动障碍的人具有较长的无运动时期。运动障碍的人还会以较大的谱功率运动。因此,本算法用于对经历过多自主运动时期的运动状态正常的人与经历过多非自主运动的运动障碍的人进行区分。该运动障碍评分算法按以下步骤对所记录的数据进行运算。DKl:对原始数据进行带通滤波,以提取1-4Hz范围内的分量,以便去除DC、手腕旋转、颤抖和传感器碰撞。DK2:空步骤DK3至DK7的目的是去除超过平均加速度的数据部分,以便从数据集合中去除自主的正常运动。DK3:将数据分解为120s的选区,每一选区均被独立考虑。选区宽度是变量,在本实施例中选区包括12000个数据点。较长的选区周期更有可能排除加速度高的运动,因为大多数信号将具有较小振幅。DK4:对于每个120s的选区i,使用数据的绝对振幅测量平均加速度振幅(Acci)。Acci被用作阈值,低于该阈值的数据被认为表示“减少的运动”。DK5:计算整个选区的一秒(100个数据点)的移动点平均值。DK6:不再考虑任何平均加速度大于Acci的数据的一秒的时间段,以排除自主的正常运动。DK7:选区中的剩余数据被假定为与减少运动的时期有关,因此被称为减少运动(RM)的数据集合。选区内的减少运动的时间段是TRM。选区中的剩余RM数据被简单地串接起来。步骤DK8-DK12的目的在于对留在数据中的“非自主”运动集合的属性进行量度,评估对RM数据的非自主运动中的功率进行量度的几种方式。应注意的是,运动障碍病人的非自主运动具有高功率。DK8A:对每一120s选区中的RM数据集合执行FFT。每一120s选区中的RM的平均谱功率是SPRM。由于DK1步骤中的滤波,该功率是对于1-4Hz范围而言的。在运动障碍中,该功率将高于运动状态正常的人的情况。DK8B:获取该减少运动数据集合绝对值的RMS值,以得出该减少运动的功率。DK8C:获得120s选区中全部频率的或者RM数据集合中频率的方差(VAR)或者标准差。DK9:如下计算DK分数:DKsp=ASPRM/TRM并绘制DKsp。DK10:如下计算DK分数:DKacc=logc(Acci×SPRM)/TRM并绘制DKacc。DK11:如下计算DK分数:DKrms=AlogcRMSRM/TRM并绘制DKrms。DK12:如下计算DK分数:DKvar=AlogcVAR/TRM并绘制DKvar。在2至10分钟时窗(时窗长度是变量)中获取DK值的移动平均值,并相对于时间绘制该移动平均值,由此对结果进行过滤,以便为神经科医生提供直观表示。此外,评估在每一天或者每一服药期间内病人处于不同的绝对DK分数的时间所占的百分比。这是认识到:运动状态正常的人可能在短时期内进行类似运动障碍的运动,但是只有运动障碍病人才会具有不间断运动的自然状态,本方法正是对此进行测量。本实施例还提供了来自每日用药时间的DK分数,例如上午9:00至下午12:00这段时期,将多天的这种数据进行平均,以获得更权威的测量。图4是运动障碍分数的图示,每一点示出本发明的一个实施例为一次运动障碍发作生成的DK分数,其相对于三名神经科医生观察同一事件所给出的运动障碍分数的平均值而绘制。可以看出,与三名神经科医生的平均分数(被称为“黄金标准”)相比,本发明毫不逊色(特异性(specificity)93.6%;灵敏度84.6%),其表明本实施例是每日临床监护的可接受的替代方案。图11示出将图2的系统和上述算法用于一位病人所获得的结果。该病人在上午6:15醒来,戴上该腕式记录设备。她的运动状态致使该设备和算法在此时给出极低的BK分数BK4,这表示她具有严重的运动迟缓症状,而这是帕金森症的本源特征。然后她在上午7:00服用了两片左旋多巴,但是她仍为运动迟缓状态,直到药片被吸收,这时大脑中存在足够的左旋多巴浓度,开始减轻她的运动迟缓症状。从大约上午8:00直到上午9:30,她的运动迟缓状态持续地从BK4改善到BK1,BK1是正常模式的运动。然而,在大约上午9:00,此阶段的左旋多巴的浓度开始引入峰值剂量运动障碍。在上午10:00左右,她回复到BK状态。她在上午10:45第二次服用药物,这使她很快恢复到正常的BK分数BK1。在下午12:30左右,再次发展为运动障碍。正如所能理解的,这种对于运动迟缓和运动障碍两者的同时的、不断跟进的和客观的量度为神经科医生提供了详细的信息,以帮助制订合适的用药方案。例如,根据该记录,神经科医生可以选择将左旋多巴的第一次剂量移动到早晨的更早时候,以便减少她的运动迟缓时间,然后将第二次剂量的时间间隔稍微缩短,同时保持与第三次剂量之间的间隔。对于该病人,目标在于保持较高百分比的BK处于BK1状态的时间,同时还目标在于降低DK分数,以便在DK2和DK3状态中度过的时间更少。当然,可以根据本发明进行进一步的测量,以监视这种改变的效果。因此,本实施例能够以高选择性和灵敏性识别和量化人的运动迟缓和运动障碍状态,甚至是当此人正在进行涉及大量自然运动的日常活动、而不是临床环境中的受控运动的时候。图14示出在全天疗程中的个人的基本连续的DK和BK评分。在垂直线表示的时刻进行左旋多巴治疗。由本发明的实施例产生的该图表清楚地表明,该病人具有极低的运动障碍和非常显著的运动迟缓,使神经科医生能够迅速地推断该病人好像是治疗不足。图15示出一种替代方式,其中可以通过绘制每次剂量之后的时期内的DK分数的累加之和,来提供本技术的结果。实际的DK分数以虚线示出,而累积的DK分数(CUSUMDK)由实线表示。同样,每一用药的时间由垂直线表示。平的CUSUM表示正常的运动状态,因此图15示出该病人经历了显著的运动障碍,特别是在下午期间。在该情况下,本发明由此为神经科医生提供了有关于全天疗程中每一次特定剂量导致的运动障碍的有价值信息。图15也绘制了全天的BK分数的值。图16绘制了另一病人的DK和BK分数,由这些结果可以看出,该病人具有严重的运动障碍。该病人的BK分数基本上正常,因此为神经科医生提供了有价值的信息:可以减弱用药,因为运动迟缓已经得到完全治疗,但是发生了很高的运动障碍。上午8:15左右的异常BK分数可能是由于该病人去除了记录器,例如淋浴时。按如下情况,对测试受验者测试该设备和系统的一种形式:对十二名帕金森症病人受验者和八名健康受验者(对照者)进行研究(表1)。受验者被识别为运动迟缓[B]、运动障碍[D]和正常[C]。这些帕金森症病人是从一个诊所抽取的,并且正在接受帕金森症的药物治疗。这些对照者没有已知的神经系统紊乱。所有程序都符合世界医学协会赫尔辛基宣言,并得到了人体研究与伦理委员会的批准和监督。所有受验者已允诺遵循该试验程序的具体说明。表1.受验者正常受验者(C)8(4F)平均年龄,48±13帕金森症受验者11(7F)平均年龄,67±86运动迟缓(无颤抖,B)6运动障碍(D)5疾病持续时间9±4疾病发作的年龄58±10左旋多巴疗法为了确保病人在时间零为运动迟缓,他们被要求在该研究开始之前的10小时停止他们的常规治疗。食物和液体摄取不受限制。在该研究开始时(0分钟),将250mg的左旋多巴和25mg的卡比多巴(carbidopa)的单个药片提供给病人。然后,要求病人在服药之后的0、10、20、30、45、60、90、120和180分钟时完成一组分配的简单任务。临床评估通过在执行重复、振荡运动的同时测量最大加速度,对运动迟缓进行评估。受验者被要求在一块纸板上相隔300mm的两个大点(直径30mm)之间滑动他们的食指。按照他们自己的步调执行这一动作30秒,然后休息30秒,然后尽可能快地重复30秒。这些点的位置被设置为使得肢体的运动横跨身体,而不是往返于身体。这是用于评估运动迟缓的公知的并已得到验证的按键或插洞板测试的一种变型。平均峰值加速度(APA)是20个最大加速度的中值,并被用作临床的运动迟缓分数。根据熟悉帕金森症并在使用修正的IMS评分方法方面有经验的已受训练的神经科医生提供的分数的平均值,来获得运动障碍分数。评估者中的两人未曾预先对此研究中的任何病人做过检查;而第三名评估者为他们提供过常规神经学护理。这些评估者独立于他们的同事进行评分。在受验者执行5个规定的任务(稍后描述)的时候,对他们视频摄像。该视频被分成30秒的记录期,而评估者为每一记录期提供一个分数。根据先前描述的方法修正得到的修正的非自主运动分数(IMS)用于为以下五个身体部分的每一部分提供0-4的分数:上肢;手臂,手腕,手和手指,下肢;腿,膝盖,脚踝和脚趾,躯干运动;背,肩膀和臀部:头部运动;颈和面部:整体判断;运动障碍的总体严重程度。该分数如下:0=不存在运动障碍:1=除外行人士以外的已受训的医生可辨别的运动障碍:2=可容易地检测出的运动障碍:3=将影响日常活动但是不限制日常活动的运动障碍:4=将限制日常活动的运动障碍。因而,最大IMS是20。测试程序将加速度仪定向,使其对旋前/旋后运动最为敏感,并将其附装到帕金森症受验者的受到最严重影响的肢体上以及对照受验者的惯用肢体上。在肘下方单独地固定加速度仪的引线,以防止加速度仪的偶发运动。然后受验者执行以下任务。任务1.无限制的自主运动:受验者们参与到关于需要描述怎样制作、建立或者做出某些事物的主题的交谈中,比如系领带。记录这些自发运动,以确定在正常活动期间,而不只是在特别选定的任务期间,是否能使用谱图检测出运动迟缓和运动障碍。任务2.自主的重复交替运动:这已在前文描述(临床评估),并用于获得临床的运动迟缓分数。任务3.受限制的自主运动:要求受验者尽可能保持静止,以试图识别非自主运动,比如运动障碍。令受验者坐直,将他们的手放在他们的膝盖上,并要求他们在1分钟内忍住不做自主运动。在此任务期间,对受验者评定运动障碍的分数。任务4.病人从一个装有600ml水的1L水壶将水倒入三个250ml的塑料杯内。此任务花费半分钟至两分钟来完成。病人被要求使用装有加速度仪的手腕来倒水。任务5.病人行走2.5米的距离,180度转向,再走2.5米。重复这一任务至少30秒,不过一些受验者花费一分钟来完成一个循环。一个病人被限制在轮椅内,无法完成这一任务。每一任务花费大约2分钟来完成。在该研究的第一部分中,受验者一次完成前三个任务。在服用测试剂量的左旋多巴之后,要求受验者在服药之后每隔一定时间完成所有五个任务。这一试验被设计为包含单次剂量的左旋多巴的效果,并且包括随之发生的短期运动症状波动。统计分析0.5-8.0Hz频带被划分成三个选区或者频带:0.5-2.0Hz,2.0-4.0Hz,以及4.0-8.0Hz(图7)。对频带进行选择,以表示可以与特定运动行为相应的频率。由于FFT是通过一系列离散点绘制的线条,因此可以将频带中的所有点相加并求平均,以产生随后被称为该频带的MSP(平均谱功率)的平均值。因而,MSP0.5-2.0Hz指的是来自0.5-2.0Hz频带的平均谱功率。在该研究的第一阶段中,在获得自运用曼-惠特尼测试的运动迟缓和运动障碍受验者的MSP之间进行比较,并将小于0.01的P值视为显著的。即使进行了用于统计显著性的测试,唯一的功能上有用的结果是,在特定测试的各临床组之间几乎没有或无重叠。结果具有帕金森症的受验者中的运动迟缓和运动障碍的选择和表征对此研究中的病人进行选择,是因为他们具有明显的运动迟缓症状(通常所说的运动迟缓病人)或者在服用一次左旋多巴之后具有显著的运动障碍症状(运动障碍受验者)。当运动迟缓受验者停止服药时,对他们进行评估,但是大多数人进行左旋多巴治疗的时候不产生显著的运动障碍。我们使用来自于点滑动测试的APA(本方法中所描述的),作为运动迟缓严重程度的标准。运动障碍受验者的APA分数介于正常和运动迟缓的中间。由三名神经科医生提供总的IMS分数,这三名神经科医生为拍摄的运动的每两分钟时段给出一个运动障碍分数。在三个分数之间的强相关性反映出三位评估者之间达成的一致性表2:不同评估者的运动障碍分数之间的斯皮尔曼等级相关系数。所有r值都是显著的(p<0.01)评估者2评估者3评估者1r=0.796r=0.860评估者2R=0.915重要的是,所记录的手臂的IMS分数与总IMS分数高度相关(r=0.85,参见图13),说明仅仅测量一个手臂的加速度是合理的(图13)。下一组研究解答了正常受验者的功率谱是否适合于识别不同的运动这一疑问。当正常受验者静坐时(任务3,图6A),在所研究频率的整个宽范围内的功率低于当该受验者进行自主运动(任务1,图6A)时的功率。为了进而证明可以测量2和4Hz的肢体振荡,正常受验者使用他们的食指跟踪示波器屏幕上的2和4Hz振荡。在该功率谱中(图6B),相关频率处的清晰峰值很明显。当受验者写下单词“minimum”的时候,大约3Hz处的宽峰值很明显(图7)。然后,功率谱被划分为三个频带(图7),估计每一频带的MSP(图8)。当在交谈期间移动手腕(任务1)时,在运动迟缓受验者之中,所有三个频带中的功率谱低于在正常受验者之中的功率谱(图8)。毫不意外,当要求受验者保持静止时,这一差异不太明显:运动迟缓病人能够像正常受验者一样保持静止(例如任务3,图8)。运动障碍运动的频率范围与正常运动相似,但是基本上提高了功率。正如可预料的那样,运动障碍受验者难以保持完全静止状态(任务3,图8)。尽管正常受验者和运动障碍受验者的MSP在三个频谱带的每一个中都完全分离,但是分离程度在MSP2.0-4.0Hz中最大(任务3,图8)。运动迟缓所有时间点的所有病人的MSP2.0-4.0Hz都与在同一时间点测量的APA相关。表3:MSP2.0-4.0Hz和APA之间的皮尔逊相关性(对于所有任务,n=79)。*=显著的r值(p<0.01)任务1任务3任务4任务5自由交谈静坐A倒水行走0.320*r=0.146r=0.400*r=0.264MSP2.0-4.0Hz与运动迟缓弱相关(如通过APA所量度的)。这反映在MSP2.0-4.0Hz预测运动迟缓的低特异性(76%)和灵敏性(65.1%)上。该弱相关非常可能出现,因为通过MSP量度的运动迟缓是取决于任务的。例如,当正常人“选择”静坐时,MSP无法将其与不具有较快速运动能力的运动迟缓区分开。因而,要求识别出无法快速运动的运动迟缓病人和大部分时间是静止的但是能够作出快速运动的病人。考虑到,运动迟缓受验者比正常受验者运动得更少,由此在运动之间存在更长间隔。此外,当进行运动迟缓运动的时候,该运动具有较低的功率,反映出较低的加速度和振幅。因而开发了一种根据本发明的一个实施例的算法,其实质上使用了每一间隔中最大加速度以及在该峰值附近的时间内的MSP,以产生ABS(自动运动迟缓分数)。其理由在于,正常受验者可能具有低MSP的时期,但是无论他们做什么运动,该运动都将是以远远高于运动迟缓受验者的加速度进行的。对用于导出ABS的算法进行相对于APA的连续修改和优化。当实现最优化的时候,采集并相对于APA绘制一组新的数据(图9A)。ABS与运动迟缓“标准”强相关(r=0.628,p<0.001,n=79),具有87.5%的特异性,94.5%的灵敏性。在一次剂量的左旋多巴之后,绘制相对于时间的APA和ABS的图示,图9B中示出一个受验者的范例。在该情况下,APA和ABS之间的相关性是r=0.77。运动障碍还开发了一种自动运动障碍分数(ADS)。已经发现,该临床运动障碍分数与MSP1-4Hz和APA两者强相关。表4MSP2.0-4.0Hz、APA和临床运动障碍分数之间的皮尔逊相关性所有r值都是显著的(p<0.01)APA临床运动障碍分数MSPr=0.90r=0.89APAr=0.85考虑到这些相关性,任一加速度仪量度将提供与神经学评估一致的运动障碍的客观量度。然而,MSP的灵敏性(76.9%)和特异性(63.6%)是无法接受的低值。该相关性高度依赖于由病人完成的任务。特别是,该相关性不考虑当受验者静坐时的运动障碍,当受验者行走时,运动障碍的级别明显升高,即使其发生在仅仅30秒之后。因而,将谱功率用作运动障碍量度中的问题类似于运动迟缓所遇到的问题:即在自主运动增加与非自主运动增加(运动障碍)的时期之间进行区分的问题。对运动障碍受验者进行的检查和与神经科医生的讨论显示,运动障碍受验者往往具有更短的无运动时期。因而,根据本发明的一个实施例,开发了一种DK算法,以识别在加速度仪记录中运动无振幅或者具有低振幅的时期。简单地说,估计每2分钟时段中的平均加速度,并将高于平均加速度的运动视为自主运动或者运动障碍型运动。提取加速度低于平均值的时期,并将MSP1.0-4.0Hz除以低加速度时期的数目,以提供自动运动障碍分数(ADS)。非运动障碍受验者应该具有更多的低于平均加速度的时期和更低的MSP1.0-4.0Hz,而另一方面,运动障碍受验者应该具有更少的低于平均加速度时窗的时间,并应该具有更高的MSP1.0-4.0Hz。实质上,该方法对受验者保持静止的持续时间进行量化。对用于导出ADS的本实施例的算法进行相对于IMS的连续修改和优化。当实现最优化的时候,采集并相对于IMS绘制一组新的数据,并计算相关系数(斯皮尔曼相关系数)(r=0.766,p<0.0001,n=85,图10A)。尽管该相关性小于MSP1-4Hz与IMS之间的相关性,但是灵敏性和特异性高得多(灵敏性=84.6%,特异性=93.6%)。该方法更适合用于病人的长期记录,因为它较少受到所完成的任务类型的影响。作为本发明的这些实施例的基础的假定是,已受训练的观察者所识别的运动模式可以通过记录运动轨迹、和对观察者所使用的表征该模式的特征进行建模来量化。在此研究中,我们首先示出,频谱分析能够区分运动迟缓和运动障碍。然而,当进行各种活动的时候,此方法的灵敏性和选择性劣化。特别是,需要更复杂的分析来区分运动迟缓和静坐的正常受验者、以及区分运动障碍和某些形式的正常活动。这是通过对已受训练观察者所观察到的情况进行建模而实现的:运动迟缓受验者在运动之间具有较长的间隔,并且当他们运动的时候加速度较低。运动障碍受验者在运动之间具有较短的间隔,并且他们以更高的谱功率运动。通过使用这种方法,可以高特异性和高灵敏性地从自然运动的范围中识别出运动迟缓和运动障碍型运动。为了验证本发明的实施例,需要参考“黄金标准”。临床医生通过观察将分辨出运动障碍和运动迟缓,并且已经建立了临床等级,以试图量化临床观察结果。然而,这些等级是主观的,需要训练和经验,并且在由同一临床医生重复性地做出后最为精确。不可避免地,只有在已受训练医生在场的时候才能使用这些等级,但是帕金森症在一天内以及每天都变化很大,并且单次的短时诊断无法提供疾病的机能或者波动的真实量度。与频谱分析的输出相比较,运动迟缓和运动障碍的分级制度的使用是最被广泛接受的可用的半客观方法。对于运动迟缓的最常见临床测试是要求快速交替的手指运动。缓慢的小幅度运动(低加速度)被认为是运动迟缓的,并具有几个测量振荡运动期间产生的峰值加速度的定量等级,所述振荡运动例如插洞板、按键和点滑动(任务2)等。这些将根据重复次数、或者运动时间或所完成的运动“量”而变化。类似地,低幅度的缓慢手写和每分钟的按键都是运动迟缓的经验证效果良好的测试。这些等级中的每一个都根据无法达到正常加速度来作为运动迟缓的量度。运动障碍分数是其他运动障碍分级制度的修改方案。临床分级与本实施例的自动分级之间的相关程度表明,该自动分级是有价值的,可被用于长时间内连续地对临床状态评分。DK和BK分数能够识别出临床状态,因而可以提供有效的临床工具。因而,所描述的本发明实施例认识到,改进的帕金森症(PD)用药管理需要全天监视运动迟缓和运动障碍两者,即使在没有进行临床观察的时候。因而本实施例提供了一种用于在限定的时期内,远程和基本连续地取得、解读和报告病人的运动状态的装置。因为该系统自动地向神经科医生报告,因此不需要病人或者他们的看护者为记住、保有或者坚持记录而担心。此外,本实施例的这种简单的腕戴式设备容易使用,并且可以在家或者其他地方使用,而不会妨碍日常活动,因而是一种无须了解技术的简单系统。此外,对于生活在农村和边远地区、不易于到主要中心区的诊所就诊的人来说,可以由神经科医生连同病人的本地非专科医生(GP),远程地改变剂量。本文描述的本发明实施例对于神经科医生的有益之处还在于,自动地为神经科医生提供具有帕金森症(PD)的病人所经历的症状的客观评估(以数字报告格式)。这基于客观和连续的数据获取,为神经科医生提供了在有意义的时间内的有关病人运动状态的可靠信息。利用这种信息,医生能够更加有效地滴定测量用药,以便减少作为PD患者关键症状的运动障碍和运动迟缓的发作率。这改善了病人管理,并为患有PD的人提供了更高的生活质量。这还可以实现对于医生/诊所的更少次数的访问,使神经科医生能够为更多病人提供有效护理。本实施例的进一步益处可以包括改善病人管理,其减少了医疗保健制度的财政负担,更少的日间病人访问,减少与症状相关的跌倒和需要住院治疗的并发症的发生率,以及减少昂贵和专门化的老年护理。本实施例还提供了可编程的腕戴式设备,由此神经科医生能够根据病人的需要来设置用于记录的时间和频率,并且还能够让该设备提醒病人服药。因而,本实施例提供了一种客观报告工具,其在神经科医生所要求的天数内连续地远程记录PD病人的运动,并每2-3分钟提供一次评估。它解决了可靠测量PD症状的问题,并通过电子邮件或者合适的网址向神经科医生自动提供报告。尽管有助于所有PD阶段,但是它在运动障碍开始出现的疾病中间阶段期间特别有价值。医生能够根据病人来访之前的3-4天内记录的客观数据来诊断疾病发展,并改变药物剂量。他们能够使用改变剂量之后记录的数据来确定剂量有效性,或者做出进一步改变。记录易于与病人的病历一起保留。因而,本实施例提供了一种具有帕金森症的病人所经历的症状的客观连续的评估。因而,本实施例可以帮助医生更有效地确定运动迟缓和运动障碍的情况,并因此通过提供更好的药物治疗来改善病人管理,为具有运动迟缓和/或运动障碍的人,比如患有帕金森症的人提供改善的生活质量。本详细说明的某些部分是按照对计算机存储器内的数据位进行运算的算法和符号表达式而呈现的。这些算法的说明和表达式是数据处理领域的技术人员所使用的手段,用于向其它领域技术人员最有效地表达他们的工作本质。在此一般而言,算法被构思为用于获得期望结果的自相容的步骤序列。这些步骤需要对于物理量的物理操作。通常,尽管并不是必要的,这些物理量采取能够被存储、传输、组合、比较等等操作的电或者磁信号。有时候,主要是出于普遍使用的考虑,已经证实令这些信号涉及位、值、元素、码元、字符、项、数等等是便利的。因而,很清楚的是,这种动作和运算(有时指的是计算机执行的)包括计算机的处理单元对表示结构化形式的数据的电信号执行的操作。这种操作对数据进行变换,或者将其保持在计算机的存储系统中的位置处,这以本领域技术人员清楚理解的方式重新配置或者改变计算机的操作。用以保持数据的数据结构是存储器的具有由数据格式定义的特定属性的物理位置。然而,尽管已在前述内容中描述了本发明,但是其并不意图作为限制,因为本领域中的技术人员能够理解,所描述的各种动作和操作也可以以硬件方式实现。然而应记住,所有这些和相似的术语都是与适当的物理量相关联的,并且仅仅作为对这些量应用的便利称号。除非特别声明,否则正如可由说明书清楚获知的,应理解在整个说明书中,使用诸如“处理”或者“计算”或者“运算”或者“确定”或者“显示”等等术语进行的论述指的是,计算机系统或者类似的电子计算设备的动作和处理,用于把表示为计算机系统的寄存器和存储器内的物理(电子)量的数据,处理和变换为类似地表示为计算机系统存储器或者寄存器或者其他此类信息存储、传输或者显示设备内的物理量的其他数据。本发明还涉及一种用于执行此处操作的装置。该装置可以被专门地构造以用于所要求的目的,或者它可以包括由存储在计算机中的计算机程序来选择性地激活或者重新配置的通用计算机。这种计算机程序可以被存储在计算机可读存储介质中,诸如但是不局限于任何类型的盘,其包括软盘、光盘、CD-ROM和磁光盘,只读存储器(ROM),随机存取存储器(RAM),EPROM,EEPROM,磁或者光卡,或者适用于存储电子指令的任何类型的介质,并且每一存储介质均与计算机系统总线连接。此处提供的算法和显示都不是与任何特定的计算机或者其他装置固有相关的。也可以使用各种具有基于此处的教导的程序的通用系统,或者可能表现得方便的是构造更多专门的装置来执行所要求的方法步骤。根据上述说明,用于多种此类系统的所要求的结构是明显可知的。此外,并没有参考任何特定的编程语言来描述本发明。应理解的是,可使用各种编程语言来实现此处所述的本发明的教导。机器可读介质包括以可由机器(例如计算机)读取的形式存储或者传输信息的任何机制。例如,机器可读介质包括只读存储器(“ROM”);随机存取存储器(“RAM”);磁盘存储介质;光存储介质;闪速存储设备;电、光、声学或者其他形式传播的信号(例如载波,红外信号,数字信号等等);等等。参看图12,示出了在适当的计算环境中实现的本发明。尽管并不是要求的,但是将在由个人计算机执行的比如程序模块的计算机可执行指令的一般环境下描述本发明。一般来讲,程序模块包括完成特定的任务或者实现特定的抽象数据类型的例行程序、程序、对象、组件、数据结构等等。而且,本领域技术人员能理解的是,本发明可以利用其他计算机系统配置来实践,包括手持设备、多处理器系统、基于微处理器的或者可编程的电子消费品、网络PC、微型计算机、大型计算机等等。本发明可以在分布式计算环境中实现,其中任务是通过经由通信网络链接的远程处理设备完成的。在分布式计算环境中,程序模块可以位于本地和远程存储器存储设备两者中。在图12中,以传统个人计算机20的形式示出了一种通用计算设备,其包括处理单元21、系统存储器22、和系统总线23,系统总线23将包括系统存储器在内的各系统组件连接到处理单元21。该系统总线23可以是多种总线结构中的任意一种,包括使用多种总线结构中的任意一种的存储总线或者存储控制器、外围总线和局部总线。系统存储器包含只读存储器(ROM)24和随机存取存储器(RAM)25。基本输入/输出系统26(BIOS)包含例如在启动期间帮助在个人计算机20内部的各单元之间传送信息的基本例行程序,并被存储在ROM24中。个人计算机20还包括用于读取和写入硬盘60的硬盘驱动27、用于读取或写入可移动磁盘29的磁盘驱动28以及用于读取或写入可移动光盘比如CDROM或者其他光学介质的光盘驱动30。硬盘驱动27、磁盘驱动28和光盘驱动30分别通过硬盘驱动接口32、磁盘驱动接口33和光盘驱动接口34与系统总线23连接。这些驱动及其关联的计算机可读介质提供了用于个人计算机20的计算机可读指令、数据结构、程序模块及其他数据的非易失存储。尽管该示例性的环境示出采用了硬盘60、可移动磁盘29和可移动光盘31,本领域技术人员能理解的是,也可以在示例性的操作环境中使用能够存储可由计算机存取的数据的其他类型的计算机可读介质,比如磁带盒、闪存卡、数字视频盘、伯努利(Bernoulli)盒带、随机存取存储器、只读存储器、存储区域网络等等。可以在硬盘60、磁盘29、光盘31、ROM24或者RAM25上存储多个程序模块,包括操作系统35、一个或多个应用程序36、其他程序模块37和程序数据38。用户可以经由比如键盘40和指针式设备42的输入装置将命令和信息输入到个人计算机20里。其他的输入装置(未示出)可以包含麦克风、操纵杆、游戏垫、卫星碟、扫描仪等等。这些及其他输入装置常常是经由与系统总线连接的串行端口接口46而连接到处理单元21,但是也可以经由其他接口来连接,诸如并行端口、游戏端口或者通用串行总线(USB)或者网络接口卡。监视器47或者其他类型的显示设备也经由比如视频适配器48的接口连接到系统总线23。除了监视器之外,个人计算机通常包括其他外围输出设备,比如扬声器和打印机,未被示出。个人计算机20可以使用与一个或多个远程计算机、诸如远程计算机49的逻辑连接,以在网络环境中操作。远程计算机49可以是另一个人计算机、服务器、路由器、网络PC、对等设备或者其他公共网络节点,并且尽管仅仅示出一个存储器设备50,但是远程计算机49通常包括如上所述的与个人计算机20有关的单元中的一些或全部。所描述的逻辑连接包含局域网(LAN)51和广域网(WAN)52。这种联网环境在办公室、企业范围的计算机网络、内部网和尤其是因特网中是常见的。当被用于局域网联网环境中时,个人计算机20经由网络接口或者适配器53与局域网51连接。当被用于广域网联网环境中时,个人计算机20通常包括调制解调器54或者用于经由广域网52建立通信的其他装置。可以在内部的或者外部的调制解调器54经由串行端口接口46与系统总线23连接。在联网环境中,所描述的与个人计算机20或其部分相关的程序模块可以存储在远程存储器存储装置中。应理解的是,所示出的网络连接是示例性的,并且可以使用在计算机之间建立通信链路的其他手段。本领域技术人员能够理解的是,可以对如特定实施例中所示的本发明做出大量变化和/或修改,而不会脱离如广义描述的本发明的范围。例如,尽管所描述的实施例是关于获得利用左旋多巴进行治疗的先天性帕金森症病人的运动障碍分数和运动迟缓分数,但是应理解的是,可以单独获得任一种分数,或者可以对由于其他原因而遭受运动症状的人获得任一种或两种分数。对于运动迟缓评分算法,在BK7中,对在BK6中识别出的子频带A至H中的每一子频带中的值进行加权,并从该加权后的频带值中识别出MSPMAX。然后根据在BK10中定义的等式BK=10log10(MSPmax×PKi)来计算运动迟缓分数。在一种可选实施例中,包含最大平均谱功率SPmaxi的单个0.8Hz子频带可以被识别,并可以替换MSPmax。在运动障碍评分算法的DK4中,Acci被用作阈值,低于该阈值的数据被认为表示“减少的运动”。在此实施例中,或在可选实施例中,可以将Acci的最小阈值设置在例如任意的低级别上,或者可以响应于极低的BK分数而生成该最小阈值。应理解的是,本发明例如能够应用于单独评估运动机能亢进运动,比如肌张力障碍、舞蹈病和/或肌阵挛。通过本发明的替代实施例评估的运动障碍例如可能起因于亨廷顿(Huntington)病、颈部肌张力障碍、多动腿综合症、发作性运动诱发性运动障碍、运动睡眠障碍、抽搐(正常但是脱离环境的刻板性运动)、妥瑞(Tourettes)症、迟发性运动障碍、迟发性妥瑞症、哈拉尔症(Halaroidan)、棘红细胞增多症、蛋白球色素退变或者泛酸激酶不足、或者佐川(Sagawa)综合症。通过本发明的替代实施例评估的运动迟缓或者运动机能减退运动可能起因于多系统萎缩症、纹状体黑质变性、进行性核上麻痹、橄榄脑桥小脑退化症、皮质基底节变性、亨廷顿病、药物诱发的帕金森病、创伤诱发的帕金森病、苍白球路易氏体退化症或者血管帕金森病。本发明的另一实施例包括加速度仪(ADXL330),该加速度仪由飞利浦公司的ARM式微控制器LPC2138进行采样,数据被存储在该设备机载的SD闪存卡中,以供稍后手动下载至PC上进行分析。对该设备进行编程,以在无需再充电的情况下,对病人进行长达4天每天16小时的记录,这是因为病人难以进行常规充电。数据被加入日期与时间的戳印,并包括具有病人详细说明的标头。服务供应商能够对病人的详细说明、每天开始和结束的时间、以及记录的天数进行编程:所有这些都被存储在数据文件的文件头中。该设备使用DC-10Hz带宽(每一通道以100Hz采样),记录三个轴X、Y、Z上的加速度。在“重力-g”下校准信号,并从+4g和-4g之间测量加速度。能够由神经科医生或者服务供应商对实时计时器进行编程,以便在将来的某些规定的日期与时间处开始记录。很可能是在次日,并且是早晨的第一件事。该设备默认记录每天上午6:00至下午10:00的时间跨度,但是该时间跨度可由神经科医生或者服务供应商编程。记录的天数默认是3整天,但是可以编程为在1至7天或更多天的范围内。该设备还能够留存下服药的日期与时间的输入。这可以是病人与手腕设备的通信,以发出已经服药的信号。在晚上,当病人上床睡觉并从手腕上取下该数据记录器的时候,该数据记录器被放入托架(cradle),该托架用于电池充电以及将数据下载到中央服务器或者医生个人的服务器。因此,本实施例在各个方面都应被认为是例证性的而不是限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1