适用于MRI/PA及其他成像的多模式自组装纳米探针的制作方法与工艺
本发明属于生物探针领域,具体涉及一种适用于MRI/PA及其他成像的多模式自组装纳米探针及其应用。
背景技术:
分子影像学(MolecularImaging)是未来最具有发展潜力的医学前沿领域之一,它包括多种医学影像技术,如:正电子发射计算机断层成像(PET)、X射线计算机断层成像(CT)、核磁共振成像(MRI)、光学成像(包括生物发光、荧光、近红外光学成像)、超声成像(US)等。不同的影像技术各具特色,也各有缺陷,故多模式融合成像成为了当今的研发热点。随着多模式融合影像设备的高速发展,相继出现了PET/CT、PET/MR、光声成像(PA,PAUS)等新技术,通过强强联合、优势互补,有望将精细的解剖结构和分子功能信息有机结合,更好的实现疾病的早防、早诊、早治,帮助临床医生对症下药,实现个体化治疗,从而减轻患者的痛苦和经济负担,对人类的健康具有重大意义。以PET/MRI为例,PET具有高灵敏度、功能显像的特色,而MRI对软组织具有高分辨率,可精确提供解剖定位信息,二者联合,可实现在分子水平上进行生理、病理过程的无创、实时、可重复成像,在神经系统、肿瘤、心血管等疾病诊断方面具有独特的价值。光声成像(PA)是近年来迅速发展的一种影像技术,其利用有光吸收的组织可产生局部声源,即PA效应,从而根据光吸收的情况来获知不同的生理参数,比如活体内的血红蛋白、黑色素、水、离子等的浓度和氧饱和度。PA的穿透深度可达5-7cm,空间分辨率可达亚毫米级,更容易实现临床转化。故光声显像也是一种极有潜力的结构、功能和分子的成像模式。如果将PET/MRI与PA成像技术结合,则可将PET/MRI成像的精细的解剖结构与PA成像的深层的分子功能信息有效整合,在同一时刻得到带有空间与时间信息的、三维的、可定量的高质量图像,使成像具有对微小病灶的高灵敏度和高特异性,可提供全面的信息。但是,在目前的医学成像领域中,PET/MRI/PA三模式融合成像的相关技术鲜有报道。为实现多模式融合成像,多模式探针的成功开发是重要前提之一。开发多模式探针的目的在于:1)利用一种对比剂即可实现不同模式的显像;2)实现靶区信号的一致性,不存在因为使用不同的对比剂而致信号分布不同的问题。目前,多模式探针中,纳米材料作为载体的探针已有一些报道。以碳纳米管(CNT)为例,首先,CNT自身带有荧光,可用于近红外光学成像,同时CNT在近红外区的强吸收还可用于光声显像;其次,在CNT制备过程中需金属(如Co,Fe等)催化,纯化后仍有残留的铁,可用作磁共振造影剂。另外,CNT还可进行多种修饰,以实现提高其量子效率、增强光声信号、增强核磁信号、产生PET信号等效果。虽然纳米材料在多模式探针中的应用极具前景,但由于其工艺可控性、稳定性、生物相容性、可降解性、毒性、体内吸收及清除性能等一直是争议的热点,因此,至今仍未能推广应用于临床。目前已报道的纳米载体中,有以铁蛋白或去铁铁蛋白作为纳米载体的探针。例如,中国专利文献CN102462847A中,利用去铁铁蛋白作肿瘤靶向造影剂的载体,将造影剂包裹其中,靶向富集到肿瘤组织部位,进而进行核磁共振成像。铁蛋白是天然的铁储存蛋白,去铁铁蛋白(Apoferritin)是铁蛋白(ferritin)不含铁的存在形式。铁蛋白和去铁铁蛋白可在体内降解,安全无毒,无免疫原性。同时,由于很多肿瘤细胞表面可以大量表达铁蛋白特异性受体,通过运铁蛋白受体-铁蛋白的结合介导可对铁蛋白及去铁铁蛋白产生内吞作用,因此,铁蛋白和去铁铁蛋白对肿瘤细胞也具有较好的靶向性。上述造影剂以去铁铁蛋白作为载体,虽然避免了纳米材料作为载体的探针通常具有的生物相容性、可降解性、毒性、体内吸收及清除性能问题,且具有较好的靶向性,但是,仅能实现核磁共振成像,如果想利用铁蛋白或去铁铁蛋白为载体,进行PET/MRI/PA三模式融合成像,则面临以下问题:1)目前常用的PET正电子核素为C、F、I等阴离子,在标记于铁蛋白或去铁铁蛋白上时,步骤繁琐,难度高,产率低,对操作人员辐照剂量大;2)铁蛋白或去铁铁蛋白本身不具有光学性质,采用从紫外至近红外区都有光吸收的黑色素可实现PA成像。黑色素(melanin)是一种生物色素,广泛存在于动物、植物和原生生物体内,是酪氨酸或3,4-二羟苯丙氨经过一连串化学反应所形成,具有抗氧化、抗肿瘤、抗蛇毒、抗病毒、护肝、防辐射等多种生物活性,目前已商品化。但是,将黑色素加载于铁蛋白或去铁铁蛋白载体上时,不仅由于黑色素粒径较大,不溶于水、酸和常规的有机溶剂(乙醇、己烷、丙酮、笨、氯仿等),只溶于碱,遇氧化剂易脱色,难以加载于载体上,并且,更为重要的是,当用于PA成像的黑色素与用于MRI成像的常用金属离子共同存在时,由于黑色素的金属螯合能力强,遇到MRI成像的常用金属离子(如Fe3+)时易沉淀,即使对黑色素进行修饰,例如采用聚乙二醇进行修饰,也只能在一定程度上提高溶液中黑色素对金属离子的负载量,无法达到MRI成像和PA成像所需的浓度,MRI与PA的信号强度低、灵敏度也极低。
技术实现要素:
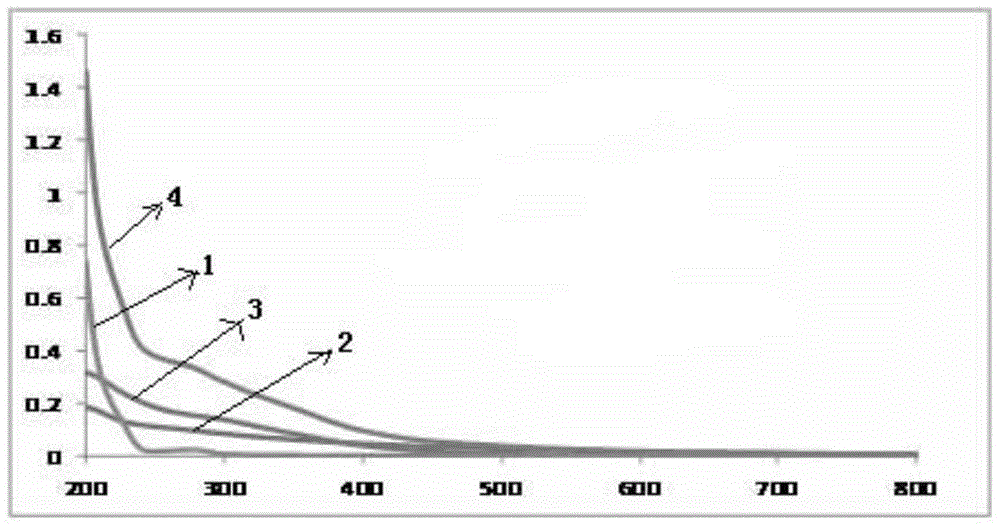
本发明所要解决的第一个技术问题是现有技术中的尚未出现适于PET/MRI/PA三模式融合显像的天然材料纳米探针、无法实现PA成像的黑色素与MRI成像的金属离子在水溶液中稳定共存、黑色素对金属离子的负载量无法达到灵敏成像、常用的PET显像的正电子非金属核素无法标记的问题,进而提供一种可实现PET/MRI/PA三模式融合显像的、高灵敏度、高特异性、可实现全面显像的纳米探针。本发明解决的第二个技术问题是现有技术中的多模式融合显像探针在工艺可控性、稳定性、生物相容性、可降解性、毒性、体内吸收及清除性能等方面存在技术缺陷,进而提供一种工艺简单、重复性好、生物相容性好、安全无毒、体内清除快的多模式融合显像的纳米探针。本发明的适用于MRI/PA及其他成像的多模式自组装纳米探针,所述纳米探针以去铁铁蛋白或者铁蛋白为载体,加载有:通过在载体蛋白溶液酸解离时加入、并在所述载体蛋白溶液重组时包埋于所述载体蛋白中的用于核磁共振成像的金属离子和用于PA成像的黑色素,以及用于其它成像的功能物质。所述其它成像为PET成像,所述PET成像的功能物质为正电子金属核素。进一步的,所述正电子金属核素为55Co、60Cu、61Cu、62Cu、64Cu、66Ga、68Ga、82Rb、86Y、86Zr中的一种。进一步的,所述黑色素为粒径3-6nm的水溶性粒子。优选的,所述黑色素的水溶性粒子的制备方法包括以下步骤:向所述黑色素中加碱使其水解,再加酸中和加入的碱,将得到的黑色素溶液置于超声波中溶解至澄清,然后再超滤离心过滤,即得。进一步的,所述核磁共振成像的金属离子为Fe2+、Fe3+、Gd3+、Zn2+、Mn2+、Mn3+、Mn4+、Mn7+、Pt2+中的一种。本发明的制备上述纳米探针的方法,包括以下步骤:(1)取去铁铁蛋白或者铁蛋白溶液,调节pH值至1-3,得到解离的蛋白溶液;(2)向步骤1)中得到的所述解离的蛋白溶液中分别加入黑色素、金属离子,混匀,然后调节pH值至7.5-10.0,得到重组的蛋白溶液;(3)向步骤2)中得到的所述重组的蛋白溶液中加入正电子金属核素,混合均匀,18-37℃下反应至正电子金属核素标记于蛋白上,即得。进一步的,步骤2)中加入的黑色素、金属离子以及所述解离的蛋白溶液中的蛋白,三者的摩尔比为(0.5-2):(500-1500):1。优选的,步骤2)中加入的黑色素、金属离子以及所述解离的蛋白溶液中的蛋白,三者的摩尔比为1:1000:1。进一步的,步骤2)中通过加入金属氯化盐加入金属离子。本领域技术人员可根据情况选择适合的阴离子,包括但不限于SO42-,NO3-,ClO4-或Cl-中的一种。进一步的,步骤2)还包括将所述重组的蛋白溶液纯化浓缩的步骤。优选的,所述纯化浓缩为透析、柱层析、超滤离心中的一种或多种。进一步的,步骤3)还包括将未标记于蛋白上、自由的正电子金属核素除去的步骤。优选的,步骤3)中采用层析脱盐除去自由的正电子金属核素。进一步的,所述正电子金属核素溶液的放射性活度为小于100mCi。上述方法中制备得到的纳米探针。本发明所述的纳米探针在多模式融合成像中的应用,特别是在PET/MRI/PA三模式融合成像中的应用。以本发明所述的纳米探针为功能成分的多模式成像剂。本发明的上述技术方案,相比现有技术具有以下优点:(1)本发明的多模式融合显像的纳米探针,以去铁铁蛋白或者铁蛋白为载体,加载有用于PET成像的正电子核素、用于核磁共振成像的金属离子、以及用于PA成像的黑色素,实现了PET/MRI/PA三模式融合成像,结合三种成像技术的优势,将PET/MRI成像的精细的解剖结构与PA成像的深层的分子功能信息有效整合,在同一时刻得到带有空间与时间信息的、三维的、可定量的高质量图像,使成像具有对微小病灶的高灵敏度和高特异性,可提供全面的信息。首先,本发明采用生物体内天然物质去铁铁蛋白或铁蛋白作为载体,生物相容性较好,并且可有效解决安全性的问题,一方面,去铁铁蛋白及铁蛋白可通过代谢被生物降解,体内清除快,另一方面,即使探针滞留生物体内,也不易造成的毒副作用;同时,具有较好的肿瘤细胞靶向性,得到的探针具有较好的特异性。第二,去铁铁蛋白/铁蛋白是由24个同源或异源亚基环绕成空心的球状,球体内腔中有8条亲水性离子通道和6条疏水性离子通道,可大量富集用于核磁共振成像的金属离子,直接包埋金属离子,不需添加螯合剂;同时,本发明的用于PET成像的正电子核素,为正电子金属核素,也可通过去铁铁蛋白/铁蛋白纳米笼中的亲水通道进入内腔,并稳定存放,因此,一方面避免了因使用多种螯合剂而产生的相互干扰、影响蛋白构象的问题,不会影响得到的纳米探针与生物体的相容性;另一方法,也避免了使用C、F、I等常见非金属正电子核素的操作繁琐、难度高、产率低,且对操作人员辐照剂量大的问题。第三,去铁铁蛋白/铁蛋白的空心的球状结构,使其外侧、内腔、内外交界处均可用于各基序加载,提供的结合位点多,同时加载用于PET成像的正电子金属核素、用于核磁共振成像的金属离子、以及用于PA成像的黑色素,仍然可实现良好的稳定性,并且三种加载的组分与去铁铁蛋白/铁蛋白可实现良好的比例控制,尤其是用于核磁共振成像的金属离子、用于PA成像的黑色素、去铁铁蛋白/铁蛋白,三者之间可实现精确定量,避免了传统生物偶联法单结合位点反复加载而造成的重复性差、无法定量的缺陷。第四,由于黑色素的金属螯合能力强,在溶液中遇到某些金属离子即沉淀(如Fe3+),这对于同时实现PA成像(黑色素)与MRI成像(金属离子)造成极大的阻碍,即使将黑色素的水溶性纳米粒子进行PEG(聚乙二醇)修饰,溶液中的黑色素与金属离子的负载量仍然较低(最大负载量仅为1:100),对于PA成像与MRI成像的信号过低,灵敏度极低。而本发明是采用去铁铁蛋白/铁蛋白包裹黑色素与金属离子,因此,克服了上述问题,得到的纳米探针具有良好的稳定性。(2)本发明的纳米探针,所述黑色素为粒径4nm的水溶性粒子,可更好的实现与载体的加载,不仅大大提高了黑色素在水中的溶解量,且更有利于实现用于核磁共振成像的金属离子、用于PA成像的黑色素、去铁铁蛋白/铁蛋白,三者之间的精确定量。(3)本发明的纳米探针,先在酸性条件下将去铁铁蛋白/铁蛋白解离,向其中加入用于核磁共振成像的金属离子以及用于PA成像的黑色素,再将pH值调节至7.5-10,即恢复重建,形成均匀的包裹上述金属离子及黑色素的重组的去铁铁蛋白/铁蛋白。利用球状结构的去铁铁蛋白/铁蛋白的上述pH依赖性,得到的纳米探针不仅具有均一、稳定的优点,其操作方法也极为简单,重复性好,为PET/MRI/PA三模式融合显像的推广应用、乃至靶向分子显像领域翻开了崭新的一页。附图说明为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。图1是实施例1的自组装PET/MRI/PA三模式纳米探针的合成路线图;图2是去铁铁蛋白、黑色素、FeCl3溶液、AMF的吸收光谱图;图3A是去铁蛋白(APF)的DLS图;图3B是黑色素(MNP)的DLS图;图3C是自组装PET/MRI/PA三模式纳米探针的AMF的DLS图;图4是去铁铁蛋白、黑色素、AMF的TEM图;其中,左上为去铁铁蛋白(染色);右上为黑色素(未染色);左下为AMF(未染色);右下为AMF(染色);图5是自组装PET/MRI/PA三模式纳米探针的PET成像图;图6是自组装PET/MRI/PA三模式纳米探针的MR成像图;图7是自组装PET/MRI/PA三模式纳米探针的PA成像图。具体实施方式本发明下述各实施例中,所述的去铁铁蛋白、铁蛋白、黑色素、PD-10柱可以选用现有技术中常规采用的产品进行自组装PET/MRI/PA三模式纳米探针的制备,以下仅给出其中一种型号的产品予以阐述本发明的效果,市售各型号的产品之间效果并无差异。其中:去铁铁蛋白,购自美国西格玛奥德里奇公司(Sigma-Aldrich);黑色素,购自美国西格玛奥德里奇公司(Sigma-Aldrich);PD-10,购自通用电气生命科学公司(GEHealthcare)。实施例1自组装PET/MRI/PA三模式纳米探针本实施例的自组装PET/MRI/PA三模式纳米探针为:以去铁铁蛋白为载体,加载有用于PET成像的64Cu、用于核磁共振成像的Fe3+、以及用于PA成像的黑色素。本实施例的自组装PET/MRI/PA三模式纳米探针的合成路线如图1所示,其具体的制备操作如下:首先,将去铁铁蛋白以及黑色素做以下处理:取去铁铁蛋白90nmol,加入3.6ml的水稀释,得到去铁铁蛋白溶液,备用;将20mg黑色素溶解于10ml的浓度为0.1M(即mol/L)的NaOH水溶液中,溶解后加入0.1M的盐酸水溶液,调整pH值至7,再置于超声中溶解,得到澄清的黑色素水溶液。将上述黑色素水溶液在超滤离心过滤器中进一步纯化,截留分子量为30kDa,用去离子水清洗3次,以除去所产生的盐和其他杂质,最后将其冷冻干燥,得到粒径为4nm的水溶性粒子的黑色素(简称MNP,下同)固体15mg,备用。(1)取上述去铁铁蛋白溶液,用HCl调节pH值至2,得到解离的蛋白溶液;(2)向步骤1)中得到的所述解离的蛋白溶液中分别加入90nmol的上述备用的黑色素、90μmol的FeCl3,混匀,放置15min,然后用NaOH调节pH值至8,得到重组的蛋白溶液;将得到的蛋白溶液通过PD-10柱,以PBS缓冲液(NaCl137mmol/L,KCl2.7mmol/L,Na2HPO410mmol/L,KH2PO42mmol/L,pH=7.2)为洗脱液,进行层析提纯,再将提纯后的蛋白溶液加入超滤离心器中,截留分子量为30kDa,进行超滤,得到重组的蛋白纳米颗粒,该重组的蛋白中包裹有黑色素及Fe3+,以下简称AMF,下同;将所述AMF颗粒用水溶解,即纯化后的AMF溶液;(3)向步骤2)中得到的所述AMF溶液中加入放射性活度为1mCi的64CuCl2,混合均匀,25℃下反应30min,将得到的蛋白溶液通过PD-10柱,以PBS缓冲液为洗脱液,进行层析提纯,再将提纯后的蛋白溶液加入超滤离心器中,截留分子量为30kDa,进行浓缩,即得。下面采用以下实验对上述PET/MRI/PA三模式纳米探针的结构进行验证:(1)步骤2)中加载用于核磁共振成像的Fe3+以及用于PA成像的黑色素的加载量的测定:以牛血清白蛋白作为标准蛋白,采用Bio-Rad蛋白测定法确定AMF中去铁铁蛋白的含量。采用电感耦合等离子体质谱仪(ICP-MS)测定Fe3+的含量。采用紫外-可见分光光度计(安捷伦科技有限公司的Cary60)测定PET/MRI/PA三模式纳米探针颗粒的吸收光谱,记录结果,其结果如图2所示。其中,曲线1为浓度25μg/mL的去铁铁蛋白的吸收光谱、曲线2为浓度4μg/mL的黑色素的吸收光谱、曲线3为浓度10μg/mL的FeCl3溶液的吸收光谱、曲线4为AMF的吸收光谱。以黑色素在不同浓度下的abs680(即吸光值),建立标准曲线,扣除去铁铁蛋白和Fe的abs680,计算AMF中黑色素的含量。由此可以算得本发明的纳米探针AMF中,去铁铁蛋白:黑色素:Fe3+的摩尔比为1:1:800。(2)PET/MRI/PA三模式纳米探针颗粒的表征:取上述步骤2)中得到的AMF溶液加去离子水稀释至含APF为250ug/mL、去铁铁蛋白溶液(APF,250ug/mL)、黑色素溶液(MNP,4ug/mL),置于测量池中,采用MalvernZetasizerNanoZS90纳米粒径电位分析仪进行动态光散射(DLS)测量,其结果如图3所示。将去铁铁蛋白、黑色素、AMF稀释后滴加到铜片上,晾干,染色剂为1%醋酸铀。采用透视电子显微镜拍摄得到其TME图像,其结果如图4所示。由上述结果可知,黑色素和Fe的加入未改变去铁铁蛋白的粒径和结构。由此可以说明,本发明的PET/MRI/PA三模式纳米探针首次包裹了粒径为4nm的黑色素粒子,黑色素和铁被包裹于去铁铁蛋白内腔。实施例2自组装PET/MRI/PA三模式纳米探针本实施例的自组装PET/MRI/PA三模式纳米探针为:以铁蛋白为载体,加载有用于PET成像的68Ga、用于核磁共振成像的Gd3+、以及用于PA成像的黑色素。本实施例的自组装PET/MRI/PA三模式纳米探针的制备操作如下:首先将铁蛋白与黑色素按照实施例1中的方法及用量进行预处理,备用。(1)取上述铁蛋白溶液,用HCl调节pH值至1,得到解离的蛋白溶液;(2)向步骤1)中得到的所述解离的蛋白溶液中分别加入90nmol的上述备用的黑色素、90μmol的GdCl3,混匀,放置15min,然后用NaOH调节pH值至10.0,得到重组的蛋白溶液;将得到的蛋白溶液通过PD-10柱,以PBS缓冲液(NaCl137mmol/L,KCl2.7mmol/L,Na2HPO410mmol/L,KH2PO42mmol/L,pH=7.2)为洗脱液,进行层析提纯,得到纯化后的重组的蛋白溶液;(3)向步骤2)中得到的纯化后的重组的蛋白溶液中加入放射性活度为10mCi的68GaCl3,混合均匀,30℃下反应30min,将得到的蛋白溶液通过PD-10柱,以PBS缓冲液为洗脱液,进行层析提纯,再将提纯后的蛋白溶液加入超滤离心器中,截留分子量为30kDa,进行超滤,即得。按照实施例1中的方法对步骤2)中加载的用于核磁共振成像的Gd3+以及用于PA成像的黑色素的加载量进行测定,得到铁蛋白:黑色素:Gd3+的摩尔比为1:1:1000。黑色素、Gd3+在铁蛋白上的加载量达到了可实现较为理想的MRI和PA成像效果的量。实施例3自组装PET/MRI/PA三模式纳米探针本实施例的自组装PET/MRI/PA三模式纳米探针为:以去铁铁蛋白为载体,加载有用于PET成像的82Rb、用于核磁共振成像的Fe2+、以及用于PA成像的黑色素。本实施例的自组装PET/MRI/PA三模式纳米探针的制备操作如下:首先将去铁铁蛋白与黑色素按照实施例1中的方法及用量进行预处理,备用。其中,黑色素的粒径为4nm。(1)取上述铁蛋白溶液,用HCl调节pH值至3,得到解离的蛋白溶液;(2)向步骤1)中得到的所述解离的蛋白溶液中分别加入90nmol的上述备用的黑色素、135μmol的FeCl2,混匀,放置15min,然后用NaOH调节pH值至7.5,得到重组的蛋白溶液;(3)向步骤2)中得到的重组的蛋白溶液中加入放射性活度为30mCi的82RbCl,混合均匀,30℃下反应30min,将得到的蛋白溶液通过PD-10柱,以PBS缓冲液为洗脱液,进行层析提纯,再将提纯后的蛋白溶液加入超滤离心器中,截留分子量为30kDa,进行超滤,即得。按照实施例1中的方法对步骤2)中加载的用于核磁共振成像的Fe2+以及用于PA成像的黑色素的加载量进行测定,得到去铁铁蛋白:黑色素:Fe2+的摩尔比为1:1:1500。黑色素、Fe2+在去铁铁蛋白上的加载量达到了可实现较为理想的MRI和PA成像效果的量。实施例4自组装PET/MRI/PA三模式纳米探针本实施例的自组装PET/MRI/PA三模式纳米探针为:以去铁铁蛋白为载体,加载有用于PET成像/核素治疗的89Zr2+、用于核磁共振成像的Gd3+、以及用于PA成像的黑色素。本实施例的自组装PET/MRI/PA三模式纳米探针的制备操作如下:首先将去铁铁蛋白与黑色素按照实施例1中的方法及用量进行预处理,备用。其中,黑色素的粒径为3nm。(1)取上述铁蛋白溶液,用HCl调节pH值至2,得到解离的蛋白溶液;(2)向步骤1)中得到的所述解离的蛋白溶液中分别加入90nmol的上述备用的黑色素、45μmol的GdCl3,混匀,放置15min,然后用NaOH调节pH值至8,得到重组的蛋白溶液;(3)向步骤2)中得到的重组的蛋白溶液中加入放射性活度为90mCi的89ZrCl2,混合均匀,30℃下反应30min,即得。按照实施例1中的方法对步骤2)中加载的用于核磁共振成像的Gd3+以及用于PA成像的黑色素的加载量进行测定,得到去铁铁蛋白:黑色素:Gd3+的摩尔比为1:1:500。黑色素、Gd3+在去铁铁蛋白上的加载量达到了可实现较为理想的MRI和PA成像效果的量。实施例5PET/MRI/PA三模式成像剂的制备取实施例1中制备得到的自组装PET/MRI/PA三模式纳米探针,溶解于生理盐水中,使所述纳米探针的浓度为1mCi/mL,即得。作为该实施例的替换方式,可所述的自组装PET/MRI/PA三模式纳米探针还可替换为实施例2-4中制备的纳米探针,纳米探针的浓度还可以是20μCi/mL到2Ci/mL中的任意值,生理盐水还可替换为注射用葡萄糖溶液。实施例6PET/MRI/PA三模式纳米探针的显像取裸鼠皮下注射2-5×106结肠癌HT29细胞(转铁蛋白受体高表达)或肝癌HepG2细胞(转铁蛋白受体低表达),接种后2-5周,得到肿瘤体积达到150-500mm3的肿瘤模型。PET成像:取实施例1中制备得到的PET/MRI/PA三模式纳米探针,配制为64Cu的放射性活度为100μCi的溶液,取0.2ml分别经尾静脉注射入裸鼠体内,注射成像剂后进行MicroPET(SIEMENSINVEON)显像,扫描不同时间点图像,IAW软件分析肿瘤摄取(ID%/g)。其结果如图5所示。核磁共振成像:取实施例1中制备得到的PET/MRI/PA三模式纳米探针,配制为按Fe浓度计算为2mg/mL的溶液。取0.2ml分别经尾静脉注射入裸鼠体内,注射成像剂后进行1TMR(Bruker)T1显像,扫描不同时间点图像,扫描参数设置为T1-flashMRI序列(重复时间(TR)/回波时间(TE)=300/6.1ms;实验次数(NEX)=16;矩阵:256×256;切片厚度:1.25cm;FOV:3.0cm;15片),其结果如图6所示。光声成像:取实施例1中制备得到的PET/MRI/PA三模式纳米探针,配制为按MNP浓度计算为2mg/mL的溶液。取0.2ml分别经尾静脉注射入裸鼠体内,注射成像剂后进行PA(VevoLAZR;VisualSonics)显像,参数设置为:光声增益45dB,动态范围20dB,中心频率21MHz。扫描不同时间点图像,其结果如图7所示。从PET显像结果可知,HT29肿瘤摄取于注射后1,2,4,18,26及48h分别达4.82±0.59,6.14±0.77,7.34±0.93,7.26±1.32,6.74±0.51,6.54±0.79%ID/g,而转铁蛋白受体低表达的肝癌HepG2肿瘤摄取则较低,于注射后1,2,4,18,26及48h分别达2.95±0.40,3.55±0.58,4.33±1.16and4.61±1.58,4.77±0.47,3.81±0.54%ID/g这说明,APF可靶向转铁蛋白受体高表达的肿瘤,摄取高且滞留长。转铁蛋白受体低表达的肿瘤摄取是因为纳米粒子的增强渗透滞留效应(EPR)效应,则摄取低且清除快。从MR显像结果可见,注射AMF后肿瘤摄取清晰可见,MR信号增强,HT29结肠癌鼠注射后1h,2h,4h及24h与注射前肿瘤的摄取值比(T/T0)为1.58,1.73,2.02,1.30,HepG2肝癌鼠则为1.21,1.44,1.03,0.99,与PET显像结果一致,再次证明了去铁铁蛋白的靶向性和EPR效应。从PA显像结果可见注射AMF后,HT29肿瘤光声信号逐渐加强,于注射后4h达高峰。此结果充分证明AMF是一有效的PET/MR/PA三模式探针。综上所述,本发明的自组装PET/MRI/PA三模式纳米探针实现了PET/MRI/PA三模式融合显像,且具有良好的灵敏度和特异性、实现良好的成像效果,加之其工艺简单、重复性好、生物相容性好、安全无毒、体内清除快,可广泛的应用于临床。显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1