治疗规划的制作方法
本发明尤其应用于辐射治疗系统。系统。然而,应认识到,所描述的技术也可以应用于其他治疗系统、其他辐射剂量控制情形,或其他辐射剂量递送技术。
背景技术:
辐射处置常常被应用于随着患者呼吸移动的肿瘤。通常,在辐射治疗规划期间定义目标体积,使得目标在全部运动相位中被覆盖。该方法辐照显著量的健康组织。例如,通用的基于群体的边缘能够被用于在运动存在时确保目标剂量。因此,围绕目标的正常组织可能接收不必要的剂量,从而导致处置之后的差的患者结果和降低的生活质量。常规的静态规划目标体积(PTV)被创建,从而涵盖目标的全部量化位置(例如,如从CT扫描等确定的)。因此,在常规处置递送期间的任何给定时间点处,显著量的正常组织接收不必要的剂量。
在外部射束辐射治疗(EBRT)中的处置规划通常为一次性的过程,跟随其处置在多个分段上被递送。一些系统提供使用来自目标的实时跟踪信息以及估计一个或多个运动参数以量化该运动的功能。在这些处置递送分段之间以及期间的目标运动妨碍如规划地递送处置的能力。
本申请涉及一种新的且改进的系统和方法,其通过提供实时目标体积跟踪,克服了在处置期间的辐照健康组织和患者运动的问题,其克服了上述问题及其他问题。
技术实现要素:
根据一个方面,一种减少对目标体积附近的健康组织的辐射剂量的方法,包括:生成针对在4D运动模型中识别的所述目标体积的多个运动相位中的每个的动态规划目标体积,所述4D运动模型是在计算机断层摄影(CT)数据采集期间通过跟踪目标体积的运动生成的,其中,所述运动相位是根据从所采集的CT数据重建的一幅或多幅CT图像识别的。此外,所述方法包括在处置阶段期间跟踪所述目标体积;并且在所述目标体积的每个运动相位处:选择对应于所述运动相位的动态PTV以覆盖所述目标体积;并且输出用于在所述目标体积的每个运动相位处辐照所选择的动态PTV的指令。
根据另一方面,一种便于减少对目标体积附近的健康组织的辐射剂量的治疗规划系统,包括:跟踪模块,其使用从所述目标体积的所采集的CT扫描数据重建的一幅或多幅4D计算机断层摄影(CT)图像来跟踪目标体积运动。所述系统还包括处理器,所述处理器被配置为:使用由所述跟踪模块生成的跟踪信息,来生成针对所述目标体积的4D运动模型;并且生成针对在所述运动模型中识别的所述目标体积的多个运动相位中的每个的动态规划目标体积(PTV)。此外,所述系统包括:运动估计工具,其被配置为跟踪所述目标体积。所述处理器还被配置为,在所述目标体积的每个运动相位处:选择对应于所述运动相位的动态PTV,以覆盖所述目标体积;并且输出用于在所述目标体积的每个运动相位处辐照所选择的动态PTV的指令。
根据另一方面,一种减少对目标体积附近的健康组织的辐射剂量的方法,包括:向运动估计工具提供来自所述目标体积的4D运动模型的跟踪目标体积位置信息;并且将从所述运动估计工具输出的运动参数信息链接到由CT扫描数据指示的所述目标体积的运动相位。所述方法还包括:生成在每个运动相位中覆盖所述目标体积的动态规划目标体积(PTV);将针对每个运动相位的所述动态PTV链接到针对每个各自的运动相位的跟踪运动参数;并且输出用于辐照针对每个运动相位的PTV的指令。
一个优点在于,对健康组织的辐射剂量被减少。
另一优点在于,对目标体积的期望辐射剂量被实现。
本领域普通技术人员在阅读并理解了以下详细描述后,应认识到本发明的另外的优点。
附图说明
本发明可以采取各种部件和各部件的布置的形式,并且可以采取各种步骤和各步骤安排的形式。附图仅是出于图示优选实施例的目的而不应被解释为对本发明的限制。
图1图示了根据本文描述的一个或多个方面的用于在外部射束辐射治疗(EBRT)期间减少对健康组织的辐射剂量的工作流程。
图2图示了根据本文描述的一个或多个方面的便于减少对正常组织的辐射剂量的系统。
图3图示了根据本文描述的一个或多个方面的用于减少对围绕规划目标体积的正常组织的剂量的方法。
图4图示了根据本文描述的一个或多个方面的,由超越模拟、处置规划和处置递送的新颖方法/工作流程实现的,用于减少对正常组织的辐射剂量的方法。
图5图示了根据本文描述的一个或多个方面的,使用实时跟踪、对4D CT相位的一对一映射,以及用于沿轨迹跟踪目标体积(虚线卵形)的运动预测的动态变化的PTV(实线卵形)。
图6图示了根据本文描述的一个或多个方面的,使用实时跟踪、对4D CT相位的多对一映射,以及运动预测的动态变化的PTV(实线卵形)。
具体实施方式
本发明通过采用实时目标体积跟踪(其使用目标位置对运动状态的映射),克服了对目标体积附近的健康组织的非期望的辐照的上述问题。在辐射治疗规划期间,目标体积针对每个运动状态被定义。在治疗期间,跟踪患者运动并且确定当前运动状态。使用查找表等,针对当前运动相位的治疗规划被确定。辐射源控制模块通过控制被定位在辐射源与患者之间的准直器来操纵治疗射束,并且剂量模块调制射束以如由针对当前运动相位的处置规划指示地控制剂量。本文中使用的“目标体积”指代要被辐照(或使用粒子治疗或任何其他适当的治疗类型消融、处置)的肿瘤或团块,并且“规划目标体积”或“PTV”指代覆盖或涵盖目标体积的体积。尽管系统和方法在本文中参考辐射治疗规划等被描述,但是本领域技术人员应认识到,这样的系统和方法也可应用于其他治疗类型,包括但不限于,消融治疗、粒子治疗,或任何其他适当类型的治疗。
图1图示了根据本文描述的一个或多个方面的用于在外部射束辐射治疗(EBRT)期间减少对健康组织的辐射剂量的工作流程10。工作流程包括三个主要阶段,包括模拟阶段12、处置规划阶段14以及递送阶段16。模拟阶段12包括跟踪步骤18,其中,在4D运动研究中跟踪目标(例如肿瘤等)位置。在一个实施例中,在18处执行电磁(EM)跟踪。运动估计工具20a(例如递送剂量调查工具(DiDIT),诸如被提供在Philips的Pinnacle3系统等中)被用于生成参数化数据集22a,所述参数化数据集包括例如目标体积在运动期间的平移、旋转、比例、变形向量等。4D计算机断层摄影(CT)扫描器24采用参数化集合数据22a,并且在处置规划阶段14中,在26处定义动态规划目标体积(PTV)。在处置递送阶段16中,在28处实时执行目标体积跟踪,以在辐射递送期间跟踪目标位置。在一个实施例中,EM跟踪被用于跟踪目标体积。运动估计工具20b被用于生成参数化集合数据22b。运动估计工具20b可以相似或相同于运动估计工具20a。在30处,基于参数化集合数据22a、参数化集合数据22b以及在26处定义的动态PTV,来动态选择并处置PTV。以这种方式,与辐照由移动的PTV穿过的整个体积的常规方法相比,所描述的工作流程10便于辐照在多个不同PTV位置处的移动的PTV,以便将对围绕PTV的健康组织的辐射剂量最小化。
将认识到,本文描述的DiDIT运动估计工具是通过范例来提供的,并且所描述的系统和方法不限于此。所描述的运动估计工具20a、20b能够前瞻性地(在模拟期间)并且在处置递送期间被利用以参数化目标运动,以及回顾性地被利用。
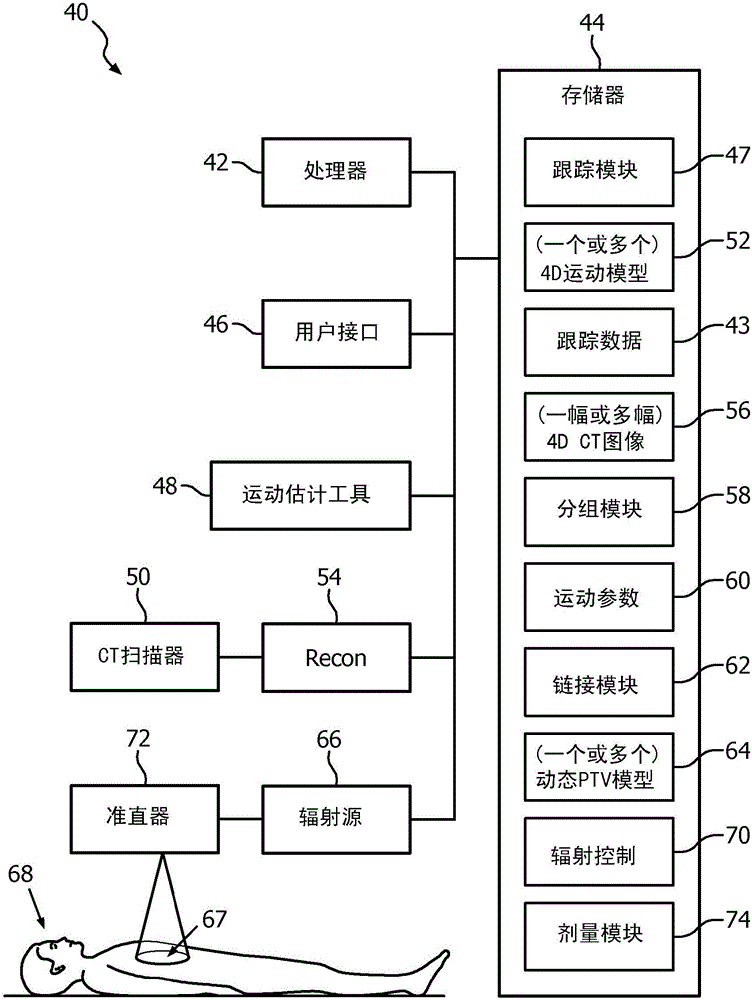
图2图示了根据本文描述的一个或多个方面的便于减少对正常组织的辐射剂量的系统40。所述系统包括可操作地被耦合到存储器44和用户接口46的处理器42。处理器42运行用于执行本文描述的各种功能、方法、流程等的计算机可执行指令(例如,例程、程序、算法、软件代码、模块等),并且存储器44存储所述计算机可执行指令。额外地,本文使用的“模块”指代一组计算机可执行指令、软件代码、程序、例程,或用于执行所描述的功能的其他计算机可执行单元等,其被存储在计算机可读介质上和/或由一个或多个处理器运行,如本领域技术人员将理解的。
存储器可以为在其上存储控制程序的计算机可读介质,诸如磁盘、硬盘驱动等。非易失计算机可读介质的常见形式例如包括软盘、柔性磁盘、硬盘、磁带或任何其他磁性存储介质,CD-ROM、DVD或任何其他光学介质,RAM、ROM、PROM、EPROM、FLASH-EPROM,它们的变体,其他存储器芯片或盒,或处理器能够从其读取和运行的任何其他有形介质。在该背景下,本文中描述的系统可以被实施在以下上或被实施为以下:一个或多个通用计算机、(一个或多个)专用计算机、编程微处理器或微控制器以及外周集成电路元件、ASIC或其他集成电路、数字信号处理器、硬连线电子或逻辑电路(诸如,分立元件电路)、可编程逻辑设备(诸如,PLD、PLA、FPGA、图形卡CPU(GPU)或PAL)等。
系统40还包括在CT扫描期间跟踪目标体积位置的跟踪模块47,以及在CT扫描器50中的运动估计工具48。处理器42使用由跟踪模块47生成的运动跟踪数据53,在模拟期间生成患者中的目标体积(例如肿瘤等)的4D运动模型52。由运动估计工具采用的跟踪技术的范例包括但不限于植入式无线电磁(EM)跟踪器、表面跟踪(使用光学形状感测或高频摄像机)、外部基准跟踪(使用高频摄像机)、内部解剖标记物跟踪(使用连续透视法)等。重建处理器54将由CT扫描器50采集的CT扫描数据重建为目标体积的4D CT图像56(第4维为时间)。处理器运行分组模块58,所述分组模块将4D CT图像分组为N个运动相位或位置,其中,N为整数。运动估计工具48(例如,DiDIT或任何其他适当的运动估计工具)计算针对目标体积的每个被跟踪的位置的运动参数60(因此,目标体积和/或PTP的例如平移、旋转、缩放因数、可变形向量场等)。
处理器运行链接模块62,所述链接模块将运动参数链接到4D CT数据集中的目标体积的特定相位或位置N。这能够使用来自所记录的跟踪数据和CT图像56的时间信息来执行。也能够使用其他配准技术,诸如将跟踪数据波形配准到对从CT图像分析获得的目标运动的估计。在一个实施例中,通过在模拟期间以延长的时间段监测患者,从而捕获大量的数据点,来构成4D运动模型52。在该过程期间,能够令患者执行罕见的但在治疗递送期间可能发生的不平常的任务(例如咳嗽、深呼吸、浅呼吸等)。
在处置规划阶段期间,处理器生成一个或多个动态PTV模型64。在一个实施例中,通过链接模块62将来自运动估计工具的运动参数输出60的每个集合链接到4D CT数据集的唯一相位或位置(一对一映射)。在这种情况下,运动估计工具的每个输出集合被分配唯一的PTV 64,所述唯一的PTV被绘制在4D CT数据集中的对应的相位上(例如参见图5)。该方法采用时间密集的4D CT数据集。在另一实施例中,来自运动估计工具的多个输出集合由链接模块62链接到4D CT数据集中的给定相位(多对一映射)。在这种情况下,运动估计工具的多个运动参数输出集合被分配公共PTV,所述公共PTV被绘制在那些输出对应于的4D CT数据集的相位上(例如参见图6)。在这种方法下,4D CT数据集能够相对稀疏(例如,10个相位或特定其他预先确定数量的相位)。尽管本文描述的4D数据集如是从CT扫描数据和/或图像生成的,但是应认识到,任何适当的成像模态能够与所描述的治疗规划系统和方法结合被采用,所述任何适当的成像模态包括但不限于,例如超声、磁共振(MR)、核成像模态(诸如正电子发射断层摄影(PET)、单光子发射计算机断层摄影(SPECT))、X射线、xCT,前述这些的变体等。
在处置递送阶段期间,辐射源66(例如线性加速器等)被提供有指令,以在辐射剂量递送期间使用由运动估计工具48提供的实时跟踪信息,向患者68中的动态变化的PTV 67递送辐射剂量。在一个范例中,模拟相位期间使用的跟踪模态也在处置递送期间被连续地被利用(例如EM跟踪、透视影片等)。基于对运动估计工具中的进入跟踪数据的实时分析,在模拟期间创建的4D运动模型52和与在处置规划阶段期间生成的动态PTV模型64有关的信息被用于确定在何者时间或相位处使用何者PTV边缘。辐射控制模块70由处理器运行,并且采用一个或多个运动预测算法来确定多叶准直器(MLC)叶片位置并且在剂量递送期间控制准直器72,以便辐照在目标体积运动的每个相位处的PTV,同时减少对目标电话附近的健康组织的辐射剂量。额外地,剂量模块74能够由处理器运行以调制辐射源射束,从而进一步控制辐射剂量。例如,如果患者在处置递送期间咳嗽,则目标体积将偏离其正常路径:4D运动模型能够被用于估计将由目标体积穿过的位置,以返回其“正常”或预期路径。基于该信息,提前选择针对那些时刻的适当的PTV,并且准直器72被控制以在给定时刻处向PTV的所述位置递送辐射。
以这种方式,使用在模拟和处置递送期间的实时跟踪,所描述的系统和方法减少对正常组织的剂量。所描述的方法能够被实施在Pinnacle3中,例如使用Pinnacle3的运动估计功能(DiDIT)。可以使用电磁(EM)跟踪、对外部身体表面的光学形状感测(OSS)、高频摄像机等来实现实时跟踪,它们都不会将患者暴露于额外的辐射剂量。
继续参考图1和图2,图3图示了根据本文描述的一个或多个方面的用于减少对围绕规划目标体积的正常组织的剂量的方法。所述方法能够由计算机和/或处理器42(图2),结合存储器44(图2)和用户接口46(图2)和/或图1和/或图2的任何其他适当的部件来运行。
在80处,在模拟相位期间使用跟踪技术和4D CT图像针对目标创建4D运动模型。在82处,跟踪目标位置被馈送到运动估计工具(例如Pinnacle3的DiDIT,其依据相对于参考位置的平移和旋转将目标位置参数化)。在84处,运动估计工具的参数化输出被链接到4D CT相位。在86处,在处置规划期间生成动态PTV。例如,动态PTV在4D CT相位的每个上被创建。在88处,基于在80处创建的4D运动模型,动态PTV被链接到跟踪目标运动参数,并且辐照规划(例如计算机可执行指令等)被输出,例如到辐射源控制器等。在90处,在递送期间使用实时跟踪信息向动态PTV递送辐射剂量。对目标的实时跟踪和4D CT运动模型被用于根据递送时间确定要使用何者PTV。
图4图示根了据本文描述的一个或多个方面的,由超越模拟、处置规划和处置递送的新颖方法/流程实现的,用于减少对正常组织的辐射剂量的方法。所述方法能够由计算机和/或处理器42(图2),结合存储器44(图2)和用户接口46(图2)和/或图1和/或图2的任何其他适当的部件来运行。
在110处,在模拟期间使用运动跟踪针对目标体积(例如肿瘤或病变等)创建4D运动模型。跟踪技术的范例包括但不限于植入式无线电磁(EM)跟踪器、表面跟踪(使用光学形状感测或高频摄像机)、外部基准跟踪(使用高频摄像机)、内部解剖标记物跟踪(使用连续透视法)等。在112处,目标体积的4D CT图像被获得并被分组为N个相位,其中,N为整数。在114处,运动估计工具(例如DiDIT或任何其他适当的运动估计工具)计算针对目标体积的每个被跟踪的位置的运动参数(例如平移、旋转、缩放因子、可变形向量场等)。在116处,来自运动估计工具的参数化输出集合被存储在存储器或数据库中,并且被链接到4D CT数据集的特定相位N。这能够使用来自所记录的跟踪数据和CT图像的时间信息来执行。也能够使用其他配准技术,诸如将跟踪数据波形配准到从CT图像分析获得的对目标运动的估计。通过在模拟期间以延长的时间段监测患者,从而捕获大量数据点,来构成4D运动模型。在该过程期间,令患者执行罕见的但在治疗递送期间可能发生的不平常的任务(例如咳嗽、深呼吸、浅呼吸等)。所述方法的模拟相位因此包括动作110、112、114和116,但不限于此。
在118处,在处置规划阶段期间生成动态PTV。在一个实施例中,来自运动估计工具(例如,DiDIT)的参数输出的每个集合被链接到4D CT数据集上的唯一相位(一对一映射)。在一对一映射的情况下,运动估计工具的每个输出集合被分配唯一的PTV,所述唯一的PTV被绘制在4D CT数据集的对应相位上(例如参见图5)。该方法采用时间密集的4D CT数据集。
在另一实施例中,来自运动估计工具(例如DiDIT)的多个输出集合被链接到4D CT数据集上的给定相位(多对一映射)。在多对一映射的情况下,运动估计工具的多个输出集合被分配公共PTV,所述公共PTV被绘制在那些输出对应于的4D CT数据集的相位上(例如,参见图6)。在这种方法下,4D CT数据集能够相对稀疏(例如,10个相位或特定其他预先确定数量的相位)。
在120处,在递送期间使用实时跟踪信息向动态变化的PTV递送辐射剂量。在一个范例中,模拟相位期间使用的跟踪模块也在处置递送期间被连续利用(例如,EM跟踪、透视影片等)。基于对运动估计工具中的进入跟踪数据的实时分析,在模拟期间(在110处)创建的4D运动模型和在处置规划阶段期间(在118处)生成的动态PTV被用于确定在何者时间处使用何者PTV边缘。在122处,运行一个或多个运动预测算法以预测递送期间的多叶准直器(MLC)叶片位置。例如,如果患者在处置期间咳嗽,则目标体积将偏离其正常路径:4D运动模型能够被用于估计将由目标体积穿过的位置,以返回其“正常”或预期路径。基于该信息,提前选择针对那些时刻的适当的PTV,并且控制准直器以在给定时刻处向PTV的所述位置递送辐射。
将理解,本文描述的范例尽管涉及辐射治疗,但是不限于此。相反地,所描述的系统和方法应用于任何治疗规划和/或递送类型,例如包括消融治疗、粒子治疗等。
图5图示了根据本文描述的一个或多个方面的,使用实时跟踪、对4D CT相位的一对一映射以及用于沿轨迹跟踪目标体积142(虚线卵形)的运动预测的动态变化的PTV 140(实线卵形)。目标体积运动的相位然后被用于控制辐射源和准直器在沿轨迹的每个位置或相位处向围绕目标体积142的PTV 140递送辐射剂量,而不是如常规地辐照涵盖全部目标体积位置的一个大的总PTV 144。以这种方式,对围绕目标体积的健康组织的辐射剂量被减少。
图6图示了根据本文描述的一个或多个方面的,使用实时跟踪、对4D CT相位的多对一映射,以及运动预测的动态变化的PTV 160(实线卵形)。目标体积运动的相位然后被用于控制辐射源和准直器在沿轨迹的每个位置或相位处向围绕目标体积162(虚线卵形)的PTV 160递送辐射剂量,而不是如常规地辐照涵盖全部目标体积位置的一个大的总PTV。以这种方式,对围绕目标体积的健康组织的辐射剂量被减少。
已经参考若干实施例描述了本发明。他人在阅读和理解了前文的详细描述后,可以实现修改和变化。本发明旨在被解释为包括所有这样的修改和变化,只要其落入权利要求书或其等价方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!