用于治疗蛋白病或构象病的聚集蛋白和分子伴侣的组合的制作方法
背景技术:
帕金森病(PD) 在阿尔茨海默病之后的第二最常见的神经退行性疾病,在工业化国家中患病率高且日益流行。这种病变和其他蛋白病或构象疾病的特征是高度有序纤维状结构的特定蛋白折叠不好并聚集,从而脑的某些细胞和区域中积累并引起蛋白质沉积物的形成(Knowles TP et al. 2014. Nat Rev Mol Cell Biol. 15:384-96.)。PD的病理特征为a突触核蛋白(αSyn)聚集沉积物存在于脑黑质内被称为路易体(LB)的细胞内包含体中的和产生多巴胺的神经元丢失。尽管原因和深层致病机理尚未完全阐明,已经确定αSyn在该疾病的发作和进展中起到基础作用(Marques & Outeiro, 2012. Cell Death Dis. 3: e350)。现今,并没有针对正常进展最终导致神经元细胞大量丢失和痴呆的该毁灭性疾病的有效的治疗。
生理功能至今未知的αSyn蛋白基本上在神经元中表达,因此,其主要在脑中发现。尽管事实上αSyn通常被认为是专有的细胞内蛋白质,已经收集了显示αSyn以聚集和非聚集形式存在于脑脊液(CSF) 和血液中的证据。事实上,已发现在CSF中的低聚物含量或αSyn总蛋白质含量的不平衡与PD,肌萎缩侧索硬化症(ALS),路易体痴呆(LBD)和阿尔茨海默病(AD)相关联。此外,有新的证据表明,扫描到的异常蛋白物种从细胞转移到细胞,促进神经退化以类似于朊病毒的方式增殖。虽然已经知道在一定的时间,由稳健、活化的小胶质细胞介导的神经炎症伴随PD的神经退化过程,最近的研究表明,细胞外αSyn,特别是低聚物形式,在炎性反应中以及在其它与神经退化关联的神经毒性机制中,起到关键作用。
肌萎缩侧索硬化症(ALS)是一种无法治愈的神经退行性疾病,该病导致的死亡时间为确诊后3至5年之间。至今,对ALS没有有效的治疗方法,因此获得支持临床研究的临床前数据以确立治疗方法改变疾病的进展是卫生系统的当务之急。至今,对于ALS仅有一种获批的治疗方法(Riluzole),该治疗方法仅实现相当有限的效果,使患者的存活期延长2-3个月。在所有的ALS病例中,90%是散发性的,10%是家族性的。虽然运动神经元的死亡是该疾病产生的原因,过去三年已经证明ALS不是一种专门与运动神经元关联的现象,因为各种细胞类型(其中有小胶质细胞活化,T细胞浸润,获得性免疫缺陷应答突出)也影响这种疾病。
至今,已知20%家族性ALS病例都与编码Cu-Zn超氧化物歧化酶1(SOD1)的基因的突变相关,Cu-Zn超氧化物歧化酶1是细胞针对氧化损伤的预防机制的主要成分之一。此外,据认为,尽管根本的致病机制仍然未知,SOD1在运动神经元中的细胞内聚集和积累对ALS发病和进展是至关重要的。
近年来,疫苗接种或免疫作为治疗某些神经退行性蛋白病的潜在的强效治疗策略而出现。尽管对于阿尔茨海默病(AD)产生了一些进步,但这种方法对其它疾病,如PD和ALS在很大程度上仍是未开发的,至今,对于PD,在阶段I研究下只有一种疫苗,对于ALS或其它“构象病”则没有疫苗。事实上,用αSyn免疫PD小鼠模型产生的抗体和用anti-αSyn抗体在路易体疾病小鼠模型或a突触核蛋白转基因小鼠上进行的被动疫苗接种已经表现出虽然不大但令人鼓舞的效果。另一方面,已经证明,用高度聚集的a-Syn免疫患PD的小鼠通过调节性T-细胞(Treg)的机能失调加重神经炎症和神经退化,众所周知,调节性T细胞是调节免疫应答的工具。一般地,虽然用a突触核蛋白免疫在当前被评为是PD和其它突触核蛋白病的非常具有吸引力的治疗选项,当前的免疫治疗方案已经证明结果直到现在喜忧参半/不大成功,显然,用于优化疫苗接种计划的新方法是必要的。
技术实现要素:
HSP (伴侣或热休克蛋白)具有两个非常宝贵的特征,可以以特异性方式有成效地利用该特征以便“明智地”操纵免疫应答,从而治疗“构象”病变或“蛋白病”:
-其典型的伴侣功能;以及
-最近发现的免疫活性性质。
在此基础上,发明人已经将与“构象病”相关的肽、蛋白质或多肽和具有生物活性或功能的HSP组合,得到不同的免疫活性复合物,该免疫活性复合物对治疗所讨论的与所使用的肽、蛋白质或多肽相关的“构象病”是有利的。
因此,本发明的第一方面涉及一种组合物,下文称为本发明的组合物,其包括:
a)肽/多肽/蛋白质的混合物,其包括i)至少一种肽/多肽/蛋白质,其氨基酸序列对应聚集肽/多肽/蛋白质(在下文称为“本发明的序列A”)或所述序列的具有生物活性的变体和片段中的任何一个,以及ii)肽/多肽/蛋白质,其氨基酸序列对应分子伴侣(在下文称为“本发明的序列B”)或所述序列的具有生物活性的变体和片段中的任何一个;和/或
b)融合肽/多肽/蛋白质,在下文称为“本发明的融合氨基酸序列”,其包括至少一种聚集肽/多肽/蛋白质的氨基酸序列(“本发明的序列A”)或其具有生物活性的变体和片段中的任何一个,以及以下肽/多肽/蛋白质的氨基酸序列:该肽/多肽/蛋白质的氨基酸序列对应伴侣(“本发明的序列B”)或其具有生物活性的变体和片段中的任何一个。
在本发明的该方面的优选实施例中,该序列A和/或B中的至少一个是重组序列。在另一优选实施例中,序列A对应α突触核蛋白的氨基酸序列,或其具有生物活性的变体和片段中的任何一个。在另一优选实施例中,序列B对应伴侣Grp94的氨基酸序列或其具有生物活性的变体和片段中的任何一个。在另一更优选实施例中,序列A对应α突触核蛋白的氨基酸序列或其具有生物活性的变体和片段中的任何一个,并且序列B对应伴侣Grp94的氨基酸序列或其具有生物活性的变体和片段中的任何一个。
在另一优选实施例中,序列A对应SOD1的氨基酸序列,或其具有生物活性的变体和片段中的任何一个。在另一优选实施例中,序列B对应伴侣Hsp70的氨基酸序列或其具有生物活性的变体和片段中的任何一个。在另一更优选实施例中,序列A对应SOD1的氨基酸序列,或其具有生物活性的变体和片段中的任何一个,并且序列B对应伴侣Hsp70的氨基酸序列或其具有生物活性的变体和片段中的任何一个。
本发明的另一方面涉及分离的核苷酸序列,在此称为“本发明的核苷酸序列”,其包括编码本发明的整个融合蛋白或其部分的一条或多条核苷酸序列。
本发明的另一方面涉及分离的表达载体(在此称为“本发明的表达载体”),其包括本发明的核苷酸序列。
本发明的另一方面是分离的宿主细胞(“本发明的宿主细胞”),其包括本发明的表达载体或本发明的核苷酸序列。
本发明的另一方面涉及一种抗体或其片段,下文称为“本发明的抗体”或“本发明的抗体片段”,其能够接合至本发明的序列A或B 中的一个或结合至本发明的融合氨基酸序列。在该方面的优选实施例中,在用本发明的序列A和B或用本发明的融合氨基酸序列免疫动物(在存在或缺乏佐剂的情况下)或动物细胞之后,获得本发明的抗体或抗体片段。在更优选的实施例中,哺乳动物为人。
本发明的另一方面涉及一种免疫治疗用细胞组合物,其包括至少一种分离的、激活的抗原递呈细胞(APC),其中从诊断患有本发明的聚集蛋白引起的疾病的患者中获得所述APC,并且其中通过间接体内暴露至包括本发明的序列A和序列B,或本发明的融合氨基酸序列或其具有生物活性的变体或片段中的任何一个的组合物刺激所述APC。
本发明的另一方面涉及药物组合物,下文称为“本发明的药物组合物”,其包括本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞,本发明的抗体或抗体片段和/或本发明的免疫治疗用细胞组合物。在该方面的优选实施例中,该药物组合物进一步包括药学上可接受的运载体。在另一优选实施例中,该药物组合物进一步包括佐剂。
本发明的另一方面涉及联合制剂,下文称为“本发明的联合制剂”,其包括本发明的序列A和本发明的序列B。
本发明的另一方面涉及本发明的序列B、本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的药物组合物、本发明的联合制剂,或本发明的抗体在药品制备中的用途。在优选实施例中,该药品为疫苗。
本发明的另一方面涉及本发明的序列B、本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的抗体或抗体片段、本发明的免疫治疗用细胞组合物、本发明的药物组合物,或本发明的联合制剂在制备用于治疗或预防聚集蛋白相关的疾病或病变的药品中的用途。在该方面的优选实施例中,该聚集蛋白相关的疾病或病变选自:帕金森病(PD)、路易体痴呆(LBD)、阿尔茨海默病的路易体变异、多系统萎缩症(MSA)、阿尔茨海默症、纯自主神经衰竭(PAF)、肌萎缩侧索硬化症(ALS)、额颞叶痴呆、戈谢病、唐氏综合征、亨廷顿氏病、朊病毒病、克-雅氏病和其它传染性海绵状脑病、多发性硬化症、格-施-沙综合征(Gerstmann-Sträussler-Scheinker syndrome)、库鲁病、致死性家族失眠症、II型糖尿病、脑血管淀粉样变性、青光眼、年龄相关性黄斑变性、精神病综合征,精神分裂症和/或精神分裂样障碍,和由于年龄相关的蛋白质聚集导致的神经退化。更优选地,该疾病或病变为帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
本发明的另一方面涉及本发明的序列A和B、本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的药物组合物、本发明的联合制剂,或本发明的抗体在药品制备中的用途。在优选实施例中,该药品为疫苗。
本发明的另一方面涉及本发明的序列A和B、本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的抗体或抗体片段、本发明的免疫治疗用细胞组合物、本发明的药物组合物,或本发明的联合制剂在制备用于治疗或预防聚集蛋白相关的疾病或病变的药品中的用途。优选地,该聚集蛋白为α突触核蛋白。在该方面的优选实施例中,该α突触核蛋白相关的疾病或病变或与另外的聚集蛋白相关的疾病或病变选自:帕金森病(PD)、路易体痴呆(LBD)、阿尔茨海默病的路易体变异、多系统萎缩症(MSA)、阿尔茨海默症、纯自主神经衰竭(PAF)、肌萎缩侧索硬化症(ALS)、额颞叶痴呆、戈谢病、唐氏综合征、亨廷顿氏病、朊病毒病、克-雅氏病和其它传染性海绵状脑病、多发性硬化症、格-施-沙综合征(Gerstmann-Sträussler-Scheinker syndrome)、库鲁病、致死性家族失眠症、II型糖尿病、脑血管淀粉样变性、青光眼、年龄相关性黄斑变性、精神病综合征,精神分裂症和/或精神分裂样障碍,和由于年龄相关的蛋白质聚集导致的神经退化。更优选地,该疾病或病变为帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
在另一优选实施例中,该α突触核蛋白相关的疾病或病变选自:帕金森病(PD)、路易体痴呆、多系统萎缩症(MSA)、戈谢病、纯自主神经衰竭(PAF),和阿尔茨海默症。
另一更优选的实施例涉及本发明的组合物在制备用于治疗或预防α突触核蛋白相关的疾病或病变的药品中的用途,本发明的组合物包括序列A(α突触核蛋白的氨基酸序列),和序列B(伴侣Grp94的氨基酸序列)。在优选的实施例中,该α突触核蛋白相关的疾病或病变选自:帕金森病(PD)、路易体痴呆、多系统萎缩症(MSA)、戈谢病、纯自主神经衰竭(PAF),和阿尔茨海默症。
另一更优选的实施例涉及本发明的组合物的用途,所述本发明的组合物包括序列A(α突触核蛋白的氨基酸序列),和序列B(伴侣Grp94的氨基酸序列)。
本发明的另一方面涉及本发明的联合制剂在制备组合、同时或序贯给药的用于治疗或预防聚集蛋白相关的疾病或病变的药品中的用途,本发明的联合制剂包括本发明的序列A和序列B。更优选地,该聚集蛋白为α突触核蛋白或α突触核蛋白病。在该方面的优选实施例中,该α突触核蛋白相关的疾病或病变选自:帕金森病(PD)、路易体痴呆(LBD)、阿尔茨海默病的路易体变异、多系统萎缩症(MSA)、阿尔茨海默症、肌萎缩侧索硬化症(ALS)、唐氏综合征、额颞叶痴呆、戈谢病、亨廷顿氏病、朊病毒病、克-雅氏病和其它传染性海绵状脑病、多发性硬化症、格-施-沙综合征(Gerstmann-Sträussler-Scheinker syndrome)、库鲁病、致死性家族失眠症、II型糖尿病、脑血管淀粉样变性、青光眼、年龄相关性黄斑变性、精神病综合征,精神分裂症和/或精神分裂样障碍,和由于年龄相关的蛋白质聚集导致的神经退化。更优选地,该疾病或病变为帕金森病。
另一更优选的实施例涉及本发明的联合制剂在制备用于治疗或预防α突触核蛋白相关的疾病或病变的药品中的用途,本发明的联合制剂包括序列A(α突触核蛋白的氨基酸序列),和序列B(伴侣Grp94的氨基酸序列)。在优选实施例中,该α突触核蛋白相关的疾病或病变选自:帕金森病(PD)、路易体痴呆(LBD)、阿尔茨海默病的路易体变异、多系统萎缩症(MSA)、阿尔茨海默症、肌萎缩侧索硬化症(ALS)、额颞叶痴呆、戈谢病、唐氏综合征、亨廷顿氏病、朊病毒病、克-雅氏病和其它传染性海绵状脑病、多发性硬化症、格-施-沙综合征(Gerstmann-Sträussler-Scheinker syndrome)、库鲁病、致死性家族失眠症、II型糖尿病、脑血管淀粉样变性、青光眼、年龄相关性黄斑变性、精神病综合征,精神分裂症和/或精神分裂样障碍,和由于年龄相关的蛋白质聚集导致的神经退化。更优选地,该疾病或病变为帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
附图说明
图1展示了用αSyn 和Grp94组合体外刺激小鼠脾细胞的效果的评估。A. 用LPS (0.5 µg/ml)、αSyn (14.3 nM或0.2 µg/ml)、Grp94 (14.3 nM 或1.3 µg/ml)、αSyn和 Grp94组合 (分别为0.2 µg/ml和1.3 µg/ml),或用缓冲液作为参考,在体外培养24小时的来源于健康C57BL/6小鼠的培养物中小鼠脾细胞的流式细胞术分析的激活分布图。B-D. 使用ELISA测得的(A)所提及的培养物的上清液中的 IFN-γ (B), IL-10 (C)和IL-17 (D)水平。该图代表两个独立实验,并且该值对应平行样本的平均值± S.D。
图2展示了根据方案1用αSyn和 Grp94组合免疫的C57BL/6小鼠产生的免疫应答。A. CD4+/CD25h/Foxp3+ (Treg)脾细胞种群相对于总CD4+ 脾细胞的流式细胞术分析。B和C.用αSyn (15 µg/ml)或缓冲液在体外培养24h的脾细胞培养物的上清液中的IFN-γ (B)和 IL-10 (C)的水平。D.使用ELISA测得的血清中的anti-αSyn IgG抗体相对于总IgG的相对水平。该值对应平均值± S.D,并且样本来自每组5只小鼠(N=5)。
图3展示了通过给药MPTP随后建立帕金森病模型的C57BL/6脾细胞受体小鼠(在根据方案1免疫突变小鼠后获得)中的免疫应答和行为测试。A和B. CD4+/CD25h (Treg)脾细胞种群相对于总CD4+脾细胞(A),以及CD4+/CD25- (Teff) 种群相对于总CD4+脾细胞(B)的流式细胞术分析。C和D. 用αSyn (15 µg/ml) 或LPS (0.5 µg /ml) 在体外培养24 hrs的脾细胞培养物的上清液中的IFN-g (B)和IL-10 (C)的水平。E.在过继转移和后续给药MPTP持续 3个月后,1个月的恢复期和给药安非他命(参见 Materials and Methods) 后的足迹法行为测试(在前爪上)。“生理盐水”和“MPTP”组对应没有接受脾细胞的“健康”和“患病”的动物对照。该值对应每组(除了“盐溶液”中N=4,和“MPTP” N=5外,N=7)的平均值± S.E.M.。
图4展示了根据方案2,用αSyn和Grp94组合免疫的C57BL/6小鼠产生的免疫应答。A和B. CD4+/CD25h (Treg)脾细胞种群相对于总CD4+脾细胞(A),以及CD4+/CD25- (Teff) 种群相对于总CD4+脾细胞(B)的流式细胞术分析。C.在体外用αSyn (15 µg/ml)或缓冲液培养的脾细胞培养物的上清液中的IFN-γ的水平。D.使用ELISA测得的血清中的anti-αSyn IgG抗体相对于总IgG的相对水平。E. 使用ELISA测得的血清中的anti-αSyn IgM抗体的水平。该值对应平均值±S.E.M.,样本来自每组5只小鼠(N=5)。
图5展示了通过给药MPTP随后建立帕金森病模型的C57BL/6脾细胞受体小鼠(在根据方案2免疫供体小鼠后获得)行为测试。在过继转移和后续给药MPTP持续 3个月后,1个月的恢复期和给药安非他命(参见 Materials and Methods) 后的足迹法行为测试(在后爪上)。 “生理盐水”和“MPTP”组对应没有接受脾细胞的“健康”和“患病”的动物对照。该值对应每组(N=5)的平均值± S.E.M.。
图6展示了根据方案4,用SOD1和Hsp70组合免疫ALS (Tg SOD1)小鼠模型产生的免疫应答。初步结果. CD4+脾细胞种群(A)、CD4+/CD25h/Foxp3+ (Treg) (B),和CD4+CD25- (Teff) (C)相对于总CD4+脾细胞的流式细胞术分析。D.用SOD1 (20μg/ml)或缓冲液在体外培养24 hrs的脾细胞培养物的上清液中的IFN-γ的水平。E和F.使用ELISA测得的血清中总IgG1/IgG2a抗体水平(E)或anti-SOD1水平(F)的每只小鼠的配对比率。无运载体:非转基因动物(健康对照)。该值对应平均值±S.E.M.,样本来自每组3只小鼠(N=3)。
图7展示了通过测量根据方案4免疫的动物的体重和存活期评估ALS的小鼠模型的保护程度。初步结果. A.体重相对于每个小鼠达到的最大体重随时间的进展的表示。B.生存期相对于时间的表示(Kaplan-Meier图)。无运载体:非转基因动物(健康对照)。每组动物的数量:3 (N=3)。
图8展示了在缺乏佐剂的情况下用αSyn和Hsp70组合/复合物免疫C57BL/6小鼠产生的免疫应答的特征。A. CD4+/CD25+/Foxp3+ (Treg)脾细胞种群的流式细胞术分析。B. 使用ELISA在血清中测得的Anti-αSyn IgG抗体的水平。C. 使用ELISA在血清中测得的IL-10/IFN-γ的水平的每只小鼠的配对比率的表示。αS: α突触核蛋白(aSyn);‘70’: Hsp70;“低”:低剂量;“高”:高剂量(参见Materials and Methods)。该值对应平均值±S.E.M.,样本来自每组6-7只小鼠(N= 6-7)。
具体实施方式
发明人已经发现用a突触核蛋白(αSyn)和分子伴侣的混合物免疫能够促进、调节和更改免疫应答,针对突触核蛋白病的新治疗和预防策略的发展非常有利。另外,发明人也证明了其它聚集蛋白与分子伴侣的组合的用途表现出作为针对各种“蛋白病”,比如阿尔茨海默病(AD)、亨廷顿氏病、朊病毒病,和II型糖尿病的治疗工具是多么优越。
因此,提供抗体和细胞(被动免疫)以及疫苗(主动免疫),该抗体和细胞以及疫苗用于若干方法中进行诊断和防治(其包括延迟发病、治疗和/或预防)聚集蛋白相关的病变,更优选地α突触核蛋白相关的病变或α突触核蛋白病,比如帕金森病(PD)、路易体痴呆(LBD)、阿尔茨海默病的路易体变异、多系统萎缩症(MSA),和其它α突触核蛋白相关的神经退行性病变。此外,抗体、细胞和疫苗可以用于延迟其它神经退行性病变的发病、治疗和/或预防,其它神经退行性病变比如:阿尔茨海默症、唐氏综合征、肌萎缩侧索硬化症(ALS)、额颞叶痴呆、戈谢病、、亨廷顿氏病、朊病毒病、克-雅氏病、多发性硬化症、格-施-沙综合征(Gerstmann-Sträussler-Scheinker syndrome)、库鲁病、致死性家族失眠症、脑血管淀粉样变性、青光眼、年龄相关性黄斑变性、精神病综合征,精神分裂症和/或精神分裂样障碍,和由于年龄相关的蛋白质聚集导致的神经退化。其中,也可以在用于诊治目的的检测方法或所述疾病的追踪中使用该抗体、细胞和疫苗。
本发明的组合物
因此,本发明的第一方面涉及一种组合物,下文称为本发明的组合物,其包括:
a)肽/多肽/蛋白质的混合物,其包括i)至少一种肽/多肽/蛋白质,其氨基酸序列对应聚集肽/多肽/蛋白质(在下文称为“本发明的序列A”)或所述序列的具有生物活性的变体和片段中的任何一个,以及ii)肽/多肽/蛋白质,其氨基酸序列对应分子伴侣(在下文称为“本发明的序列B”)或所述序列的具有生物活性的变体和片段中的任何一个;和/或
b)融合肽/多肽/蛋白质,在下文称为“本发明的融合氨基酸序列”,其包括至少一种聚集肽/多肽/蛋白质的氨基酸序列(“本发明的序列A”)或其具有生物活性的变体和片段中的任何一个,以及肽/多肽/蛋白质的氨基酸序列,其氨基酸序列对应伴侣(“本发明的序列B”)或其具有生物活性的变体和片段中的任何一个。
“序列A”或“聚集肽”和/或“聚集蛋白”在此理解为在“构象”病,特别是神经退行性疾病中常发现的肽、多肽或蛋白质(Knowles TP et al. 2014. Nat Rev Mol Cell Biol. 15:384-96.)。这些蛋白质包括,但不限于:α突触核蛋白(SEQ ID NO: 1)、亨廷顿蛋白(SEQ ID NO: 2)、β-淀粉样肽(SEQ ID NO: 3)、TDP-43 (SEQ ID NO: 4)、FUS (SEQ ID NO: 5)、τ蛋白(SEQ ID NO: 6)、朊蛋白(SEQ ID NO: 7)、纤维连接蛋白(SEQ ID NO: 8),和超氧化物歧化酶或SOD1,(SEQ ID NO: 9)。
因此,在本发明的该方面的优选实施例中,本发明的组合物的聚集蛋白或序列A选自:α突触核蛋白、亨廷顿蛋白、β-淀粉样肽、TDP-43、FUS、τ蛋白、朊蛋白、纤维连接蛋白、SOD1或其组合。
更优选地,该聚集蛋白为α突触核蛋白,或其具有生物活性的变体或片段中的任何一个。
在另一优选实施例中,该聚集蛋白为SOD1或其具有生物活性的变体或片段中的任何一个。
α突触核蛋白(SNCA、NACP、PARK1、PARK4、PD1、α突触核蛋白;AD淀粉体的非A-β成分;突触核蛋白α-140)在此理解为突触核蛋白家族的成员,突触核蛋白家族也可以包括β突触核蛋白和γ突触核蛋白。突触核蛋白在脑中大量表达并且α突触核蛋白和β突触核蛋白D2选择性地抑制磷脂酶。帕金森病的发病机理涉及α突触核蛋白缺陷。α突触核蛋白是患有阿尔茨海默症的患者的脑中淀粉样斑块的主要成分。已经确定了该基因的两种不同的亚型。其氨基酸序列(α突触核蛋白的氨基酸序列)对应SEQ ID NO: 1。
在本发明的背景下,该α突触核蛋白基因也由核苷酸或多聚核苷酸序列限定,其构成包含在SEQ ID NO: 1中的蛋白质的编码序列,并且会包括来源于下面的分子的不同变体:
a)编码包括SEQ ID NO: 1的氨基酸序列的多肽的核酸分子,
b) 互补链与a)的多聚核苷酸序列杂交的核酸分子,
c)序列与a)和/或b)由于遗传密码简并性而不同的核酸分子,
d)编码包括与SEQ ID NO: 1具有至少80%、90%、95%、98%,或99%一致性的氨基酸序列的多肽的核酸分子,并且其中所述核酸编码的多肽具有α突触核蛋白的活性和结构特征。免疫活性也包含在该活性内。
除了使用该重组蛋白或合成肽,α突触核蛋白可以直接来源于路易体,该路易体存在于患有α突触核蛋白病的病例的人脑组织的尸体解剖中。纯化可溶α突触核蛋白部分(即,可溶于Tris缓冲生理盐水的制剂)和不溶性α突触核蛋白部分(即,不溶于Tris缓冲生理盐水的制剂)。这些样本制剂可以就其本身注射至动物中,或使用层析法分馏后注射至动物中。所产生的抗体可以在被动免疫接种计划或在诊断的免疫测定中用于治疗患者。
在本发明中,α突触核蛋白病涉及可溶的、未折叠的天然形式并具有构象和翻译后修饰。此外,天然的α突触核蛋白可以通过下列方法修饰,例如,但不限于:用Cys取代Ser/Ala,例如,通过定点突变。在下面的专利申请Chang, US2006/0018918 A1中描述了该类型的例子。
SOD1 (也称为ALS、SOD、ALS1、IPOA、hSod1、HEL-S-44、同源二聚体)在此理解为结合铜和锌离子的蛋白质并且是负责破坏体内游离的超氧自由基的两种同工酶之一。编码的同工酶为可溶的胞浆蛋白,其充当同源二聚体以将天然的但有害的超氧自由基转变成分子氧和过氧化氢。另一种同工酶为线粒体蛋白质。在该基因中的突变涉及家族性的肌萎缩侧索硬化症的病因。其氨基酸序列(SOD1的氨基酸序列)包括在GenBank序列 NP_000445.1, NM_000454.4中。
在本发明的背景下,该SOD1基因也由核苷酸或多聚核苷酸序列限定,其构成序列NP_000445.1中列举中的蛋白质的编码序列,并且会包括来源于下面的分子的不同变体:
a)编码包括氨基酸序列NP_000445.1的多肽的核酸分子,
b) 互补链与a)的多聚核苷酸序列杂交的核酸分子,
c)序列与a)和/或b)由于遗传密码简并性而不同的核酸分子,
d)编码包括与NP_000445.1具有至少80%、90%、95%、98%,或99%一致性的氨基酸序列的多肽的核酸分子,并且其中所述核酸编码的多肽具SOD1蛋白的活性和结构特征。免疫活性也包含在该活性内。
在本发明的该方面的另一优选实施例中,本发明的伴侣或序列B属于Hsp70家族、Hsp90家族、亲免素家族、肽酶C56家族、 PPIase家族、14-3-3家族、小热休克蛋白组、小GTPase家族、Hsp40 (DnaJ) 家族,或其任意组合。更优选地,该Hsp90家族伴侣选自Grp94 (SEQ ID NO: 10)和Hsp90 (SEQ ID NO: 11) ,或其任意组合。在另一优选实施例中,Hsp70家族伴侣选自Hsp70 (SEQ ID NO: 12)、Hsc70 (SEQ ID NO: 13)和Grp75 (SEQ ID NO: 14) ,或其任意组合。在另一优选实施例中,亲免素家族伴侣选自FKBP12 (SEQ ID NO: 15) 和FKBP4/FKBP52 (SEQ ID NO: 16) ,或其任意组合。在另一优选实施例中,肽酶C56家族伴侣选自DJ1/PARK7 (SEQ ID NO: 17)。在另一优选实施例中,PPIase家族伴侣选自Pin1 (SEQ ID NO: 18)、CypA (SEQ ID NO: 19)、Cyp40 (SEQ ID NO: 20) ,或其任意组合。在另一优选实施例中,14-3-3家族伴侣选自14-3-3 γ(SEQ ID NO: 21), 14-3-3 ε(SEQ ID NO: 22), 14-3-3τ(SEQ ID NO: 23) ,或其任意组合。在另一优选实施例中,小热休克蛋白组伴侣为Hsp27 (SEQ ID NO: 24)。在另一优选实施例中,小GTPase家族伴侣为Rab11A (SEQ ID NO: 25)。在另一优选实施例中, Hsp40 (DnaJ) 家族伴侣选自Hsp40 (SEQ ID NO: 26)和CSP (SEQ ID NO: 27) ,或其任意组合。在另一优选实施例中,伴侣为聚集素 (SEQ ID NO: 28), Grp170 (SEQ ID NO: 29)、钙网蛋白(SEQ ID NO: 30)、Hsp105 (SEQ ID NO: 31), CHIP (SEQ ID NO: 32)、α晶体蛋白(SEQ ID NO: 33) ,或其任意组合。在本发明的组合物中,不同伴侣的组合,甚至来自于不同组或家族的伴侣的组合也是可能的。
在更优选的实施例中,该伴侣为Grp94或其具有生物活性的变体,或其组合。甚至更优选地,该伴侣为Grp94。
GRP94(热休克蛋白90kDa β(GRP94)、成员1、ECGP;GP96;TRA1;GRP94)是编码代谢三磷酸腺苷(ATP)的分子伴侣的家族成员,其在稳定和折叠其它蛋白中起作用。编码的蛋白质定位至黑素体和内质网。该蛋白质的表达与各种发病状态,包括肿瘤形成,相关。在该基因的5’外显子内有一microRNA基因。在染色体1和15上有该基因的假基因。
在本发明的背景下,该Grp94基因也由核苷酸或多聚核苷酸序列限定,其构成包含在SEQ ID NO: 10中的蛋白质的编码序列,并且会包括来源于下面的分子的不同变体:
a)编码包括SEQ ID NO: 10氨基酸序列的多肽的核酸分子,
b) 互补链与a)的多聚核苷酸序列杂交的核酸分子,
c)序列与a)和/或b)由于遗传密码简并性而不同的核酸分子,
d)编码包括与SEQ ID NO: 10具有至少80%、90%、95%、98%,或99%一致性的氨基酸序列的多肽的核酸分子,并且其中所述核酸编码的多肽具有Grp94蛋白的活性和结构特征。
在本发明的肽和蛋白质的数据库中可得到若干氨基酸序列,其与下面的氨基酸序列有一个或多个氨基酸的区别:SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33。倘若具有与其所来源的氨基酸序列类似的活性或结构性能,这些肽和蛋白质变体就包括在本发明中。在此使用的SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33的蛋白质变体是这样的蛋白质:由于一个或多个氨基酸取代、添加或缺失而与该蛋白质的氨基酸序列有区别。一般地,倘若所得的蛋白质变体呈现与其所来源的氨基酸序列类似的活性或结构性能,SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33中所示序列的任何氨基酸残基就可以被另一氨基酸取代。所述蛋白质的活性和结构性能可以使用本领域目前已知的方法确定。特别地,包括与所示的氨基酸序列在多达5, 10, 15, 20或甚至25个氨基酸位置有区别的蛋白质变体。
优选地,该取代为保守取代,即,氨基酸残基被具有相似极性,充当功能等效物的另一氨基酸取代。优选地,用作取代物的氨基酸残基选自与被取代的氨基酸残基相同的氨基酸组。例如,疏水残基可以被另一疏水残基取代,或极性残基可以被具有相同电荷的另一极性残基取代。可以用于保守取代的、功能上同源的氨基酸包括,例如,非极性氨基酸,比如甘氨酸、缬氨酸、丙氨酸、异亮氨酸、亮氨酸、蛋氨酸、脯氨酸、苯丙氨酸和色氨酸。不带电荷的极性氨基酸的例子包括丝氨酸、苏氨酸、谷氨酰胺、天冬酰胺、酪氨酸和半胱氨酸。带电荷的极性氨基酸(碱性)的例子包括:组氨酸、精氨酸和赖氨酸。带电荷的极性氨基酸(酸性)的例子包括天冬氨酸和谷氨酸。
术语“变体”也包括氨基酸序列:该氨基酸序列包括比SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32 和/或SEQ ID NO: 33序列更多氨基酸的氨基酸序列,即,插入了一个或多个氨基酸的氨基酸序列。这样的插入原则上可以在SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或 SEQ ID NO: 33的氨基酸序列的任何位置中发生。该插入可以是连续的氨基酸片段,包括,例如2、3、 4、5、6、7、8、9,或10个氨基酸。类似地,术语“变体”还包括相比SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32 和/或SEQ ID NO: 33的氨基酸序列,缺失一个或多个氨基酸的氨基酸序列。缺失可以涉及所提及的序列的若干连续的氨基酸残基,例如,2、3、 4、5、6、7、8、9,或10个氨基酸。该缺失不影响所述变体的活性或结构性能。该蛋白质变体还可以包括结构修饰,例如,修饰的氨基酸,比如,通过磷酸化、硝化、糖基化、乙酰化、硫醇化、支化和/或环化而改变的氨基酸。
通过氨基酸的取代、添加或缺失修饰的序列SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33的蛋白质变体通常表示出很大程度的氨基酸序列一致性或与SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32 和/或SEQ ID NO: 33的蛋白质具有很大程度的氨基酸序列一致性。优选地,如果变体的序列与SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33的序列分别进行最佳比对,氨基酸水平的同源性或一致性为至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。本领域周知用于确定氨基酸同源性的方法和计算机程序。
本发明的背景还考虑使用具有免疫活性的片段,该具有免疫活性的片段来源于SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33的蛋白质,或来源于其变体。SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或 SEQ ID NO: 33的免疫活性的片段,或其变体包括这样的肽或多肽:由于在该蛋白质的N端和/或C端处缺失一个或多个氨基酸而与SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32 和/或 SEQ ID NO: 33中所示的氨基酸序列,或其变体有区别。普通技术人员能够通过进行本领域目前更详细描述的常规方法确定SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32和/或SEQ ID NO: 33中代表的序列,或其变体的其它活性片段。
但是,应该理解,在具有生物活性的变体内,如果序列(A和/或B),或特定的融合氨基酸序列呈现其它有利的特征,比如,更高的稳定性和更长的保存期或改进的药理性质,则可以忍受丧失20%、30%、40%、50%、60%、70%,或甚至80%的蛋白质活性。本领域技术人员能够轻易地确定本发明的给定的融合氨基酸序列是否适合在想要的治疗环境中使用。
在本发明的更优选的实施例中,聚集蛋白和/或伴侣以重组方式获得。可替换地,该聚集蛋白和/或伴侣可以从细胞或组织获得。反过来,形成本发明的组合物的一部分的聚集蛋白和/或伴侣都可以是人源或动物来源的,可以是所述蛋白的任何已知的直系同源物。优选地,聚集蛋白和/或伴侣可以是人源的(或,在以重组方式获得的情况下,该氨基酸序列与人蛋白质的已知氨基酸序列具有较高的百分比一致性,优选与所述蛋白质的已知的人氨基酸序列具有至少70%,更优选80%、90%、95%、98%,更优选90%的一致性)
在此使用的术语“一致性”指的是所比较的2条氨基酸(或核苷酸)序列之间的相同的氨基酸(或核苷酸)的比例。
当比较聚集蛋白或人伴侣的序列与其他物种中相同蛋白质的序列时,很显然,某些区域比其它区域更保守。该信息可以指示这样的事实:这些区域对于保持蛋白质的结构或功能是至关重要的。确定所述蛋白质的活性的活性区和保守的半胱氨酸(其间建立二硫键)对蛋白质的形成都是重要的,在两种蛋白质之间将最可能是保守的,而在其它区域中的差异更明显。
在此使用的术语“同源性”指的是由于共同进化谱系造成的两个结构之间的相似性,并且更具体地,指的是两种或更多种蛋白质(多肽)或氨基酸(或核苷酸)序列的氨基酸(或核苷酸)之间相似性。
考虑到如果两种蛋白质具有相同的进化起源或如果两种蛋白质具有相似的功能和结构,则该两种蛋白质被认为是同源的,通常认为相似性或一致性的值大于30%指示同源结构。因此,可以认为,在适当情况下,至少80%的一致性百分比会包括在不同物种之间保守,能够产生免疫原性,或具有伴侣活性且还具有免疫活性的活性区域。
本发明的序列A和序列B可以结合在融合蛋白中,或可替换地通过化学方法(例如,但不限于,通过交联)彼此结合。
“交联”在此理解为通过共价键结合两个或更多个分子的化学技术,其包含末端与蛋白质或其它分子的特异性官能团反应的物质。这些物质可以划分成具有可以反向或非反向的化学交联剂的同型双功能(相同的活性基)和异型双功能(不同的活性基)物质。同型双功能交联剂具有潜在的缺点,其在纳米粒子的表面上或不想要的交联蛋白的诱导中连接两个相邻的基团。异型双功能交联剂能够产生后续的共轭作用,使聚合作用最小化。例如,考虑到异型双功能交联剂1-乙基-3- (3-二甲基氨基丙基)碳二亚胺(EDC)常用于连接NH2和-COOH基,可以将磺酸基琥珀酰4-(N-马来酰亚胺甲基)环己烷-1-羧酸(磺酸基-SMCC)用于连接硫醇生物分子的内容物和涂布胺的纳米粒子,反之亦然。
此外,本发明的序列A和B可以通过合成获得。本领域目前已知合成氨基酸序列的设计。因此,实验确定的抗原位点的数据的分析表明,疏水性残基,Leu和Leu,如果在蛋白质表面上发现,则有很大的趋势会形成抗原决定簇的一部分。因此,已经研发了使用氨基酸残基的物理化学性质和其在通过实验知晓的表位的片段中的频率和赋存状态确定蛋白质的抗原决定簇的半经验方法。
相对于特异性抗体产品和反应性,合成的氨基酸序列具有若干优势。合成肽的确切序列可以选自由蛋白质的氨基酸序列确定的蛋白质的氨基酸序列或由编码该蛋白质的DNA序列确定的预测氨基酸序列。
合成的特异性肽的使用排除了在抗体测试的疫苗接种和生产中对全长蛋白质的需要。此外,梅里菲尔德固相肽合成技术能够通过化学方法,实质上由感兴趣的合成肽产生无限量的肽。所述技术已发展到自动化合成肽的能力。
本发明的核苷酸、基因构建体、表达载体和宿主细胞
也可以通过在含有重组DNA分子,或含有这样的重组DNA分子的运载体或重组DNA克隆载体的宿主细胞中表达而制备合成的氨基酸序列,该重组DNA分子包括转录成本发明的肽或蛋白质,可操作地结合至表达控制序列的核苷酸序列。可替换地,可以通过将单独的DNA分子直接注射到宿主细胞中表达所述肽。一般地,根据本发明生产的合成肽具有保护性抗原序列。在此使用的表达“保护性抗原”定义这样的抗原:能够在宿主中产生保护性免疫(免疫原性)应答,即,宿主应答,导致产生免疫效应分子、抗体、或细胞,消灭、抑制或降低引起疾病的聚集蛋白的活性,从而“保护”宿主不受临床或亚临床疾病之害和/或丧失生产力。通常可以通过产生免疫活性细胞介导的保护性应答和能够抑制聚集蛋白的功能、细胞毒性机制或细胞-至-细胞的繁殖的抗体,导致其在宿主上的负面效应消除或丧失而产生这样的保护性免疫应答。所述宿主优选为哺乳动物,并且甚至更优选为人类。
因此,本发明的另一方面涉及核苷酸序列,下文称为本发明的核苷酸序列,其包括编码本发明的序列A、序列B,或融合氨基酸序列的整体或部分的一条或多条核苷酸序列。
因此提供根据本发明的核酸分子或核苷酸序列可能获得本发明的序列A和B,和/或融合氨基酸序列,以及其具有生物活性的变体或免疫原性的片段(到现在为止数量无法估计),从而能够研发组合物,优选药物组合物。
本发明的该方面提供一种用于制备本发明的核酸分子或核苷酸序列编码的重组蛋白或肽的方法,其包括在表达所述蛋白质或肽的情况下,培养含有本发明的核酸分子或核苷酸序列的真核细胞或原核细胞,并且回收由此所产生的所述肽。
该方法包括含有本发明的核酸分子或核苷酸序列的克隆和表达载体。所述表达载体包括合适的控制序列,比如,翻译控制元件(如,启动和停止密码)和转录控制元件(例如,启动子 - 操纵子区域,结合位点等)。根据本领域周知和记载的方法,根据本发明的载体可以包括质粒和病毒(包括噬菌体和真核病毒),并且能够以同样在本领域中周知和记载的各种不同的表达系统中表达。合适的病毒载体包括杆状病毒,也包括腺病毒和疫苗病毒。本领域描述了并且知晓许多其它病毒和非病毒载体。
因此,本发明的另一方面涉及分离的表达载体(在下文称为本发明的表达载体),其包括本发明的核苷酸序列。
也知晓可以用于将这样的载体引入真核细胞或原核细胞以进行表达或引入种系,或引入体细胞以形成转基因动物的各种技术。参考文献中很好地描述了合适的转化或转染技术。
如上文所定义,用根据本发明的核酸分子或核苷酸序列转化或转染真核或原核宿主细胞也形成本发明的该方面的一部分。
因此,本发明的另一方面涉及分离的宿主细胞(下文称为本发明的宿主细胞),其包括本发明的表达载体或本发明的核苷酸序列。
本发明的抗体
本发明的组合物配制为用作免疫原。这些免疫原也可以用作动物,并且更特别地,哺乳动物,包括人,的疫苗,或用于在动物产生抗体时产生应答。对于这些组合物的配制,需要使哺乳动物,包括人类,服用具有免疫有效量的本发明的组合物的序列A和B中的每一种连同合适的生理上可接受的运载体。序列A和B可以通过共价键彼此结合,结合至其它肽,结合至载体蛋白或结合至其它运载体,并入纳米粒子、脂质体或其它类似运载体中,和/或与疫苗领域中周知的佐剂或吸附剂混合。例如,序列A和B可以与免疫刺激复合物混合。可替换地,序列A和B不连接至生理上可接受的运载体,而是仅仅与生理上可接受的运载体混合,该生理上可接受的运载体比如,适合给哺乳动物包括人服用的生理盐水或缓冲化合物。
因此,如上文所述,根据本发明产生的合成序列A和B具有保护性抗原序列。这些保护性抗原能够在宿主中产生保护性免疫(免疫原性)应答,即,宿主应答,导致产生免疫效应分子、抗体或细胞,使引起疾病的聚集蛋白的活性失活或降低,从而“保护”宿主不受临床或亚临床疾病之害和丧失生产力。通常可以通过产生能够抑制引起疾病的聚集蛋白的功能的免疫活性细胞和/或抗体而产生这样的保护性免疫应答。
就用于在抗体中产生应答的所有的免疫原性组合物来说,必须根据经验来确定免疫有效量的本发明的序列A和B。考虑的因素包括天然肽的免疫原性,该肽是否通过共价键与佐剂或载体蛋白或其它运载体复合,和该组合物的给药途径,以及,将将要服用的免疫剂量的次数,该给药途径例如,但不限于:静脉途径,肌肉途径、皮下途径,和如在本发明的特定实施例中所述的鼻内途径或口服途径。在疫苗领域中,这些因素是已知的并且与在没有过度实验的情况下进行这些确定的免疫学家的技术一致。该抗体能够结合至本发明的序列A或B,或结合至本发明的融合氨基酸序列。
因此, 本发明的另一方面涉及一种抗体或其片段,在下文称为本发明的抗体或本发明的抗体片段,其能够结合至本发明的序列A或B,或本发明的融合氨基酸序列。在该方面的优选实施例中,在用本发明的序列A和B 或用本发明的融合氨基酸序列免疫动物或动物细胞之后获得本发明的抗体或抗体片段。在本发明的该方面的特定的实施例中,用于免疫的动物为哺乳动物,包括人类。
在优选实施例中,用于免疫的动物为哺乳动物,不包括人类。
这些抗体可以是单克隆的或多克隆的。本发明的抗体也可以是重组的、嵌合的、人源化的、合成的,或前述的任意组合。
在本发明的该方面的另一特定实施例中,该抗体用作药品。
本发明的抗体可以配制成以各种形式给动物,更优选地,哺乳动物,包括人类服用。因此,该抗体可以在灭菌水溶液或生物流体,比如血清中。该水溶液可以是或不是起缓冲作用的,并且具有另外的活性或无活性成分。该另外的成分包括用于调节离子强度的盐、防腐剂和养分,该防腐剂包括,但不限于抗菌剂、抗氧化剂、螯合剂等,该养分包括葡萄糖、右旋糖、核苷酸、维生素和矿物质。可替换地,该抗体可以制备成以固定形式服用。该抗体可以与若干惰性赋形剂或运载体组合,该惰性赋形剂或运载体包括,但不限于,粘合剂,比如,微晶纤维素、黄蓍胶或明胶;赋形剂,比如,淀粉或乳糖;分散剂,比如,褐藻酸或玉米淀粉;润滑剂,比如,硬脂酸镁;助流剂,比如,胶体二氧化硅;甜味剂,比如,蔗糖或糖精;或调味剂,比如,薄荷或水杨酸甲酯。
所述抗体或其制剂可以给动物,包括哺乳动物,因此,包括人类,以许多方式服用。这样的方式包括,但不限于,经腹膜内,经静脉,经肌内,经皮下,经鞘内,经心室内,经口,经肠内,经肠胃外,经鼻内或经皮。
用于获得药物学上有效量的抗体剂量取决于各种因素,例如,动物的年龄、体重、性别、耐受性等。
术语“抗原”在此是指可诱导抗体形成的细胞表面分子(通常为蛋白质或多糖)。有许多不同类型的分子可以充当抗原,比如,蛋白质或肽、多糖,以及罕有地,其它分子如核酸。具体地讲,术语抗原在此是指本发明的氨基酸序列A和B,以及本发明的融合氨基酸序列,即是指聚集蛋白和伴侣。
本发明的该方面的优选实施例涉及本发明的片段,其使用方法和方式与描述的本发明的抗体的方法和方式相同。本发明的片段的一些实施例如下面所示:
-“Fab”片段来自于用木瓜蛋白酶消化完整的抗体并且仅包括一个抗原结合位点以及CL区和CH1;
-“F(ab')2”片段来自于用胃蛋白酶消化完整的抗体并且包含两个抗原结合位点,
-“Fab''”含有轻链恒定区和第一重链恒定区(CH1),并且仅具有一个抗原结合位点。Fab'片段与Fab片段的区别在于在重链区CH1的羧基末端增加了某些残基,包括抗体的铰链区的一个或多个半胱氨酸,
-“Fv”为最短抗体片段,其包括完整的抗原识别和结合位点。该区域由一个重链和一个轻链可变区以闭合非共价连接的二聚体组成。在该构型中,每个可变区的三个高变区(CDR)相互作用以在VH-VL二聚体的表面上限定抗原结合位点。六个高变区共同赋予抗体以抗原结合特异性。但是,甚至单个可变区(或对抗原具有特异性的仅包括三个高变区的半个Fv)具有识别和结合抗原的能力,尽管比起完整的结合位点,其亲和力较低。
-单链FV或“scFv”抗体片段,其包括VL和VH抗体区域,这些区域存在于单条多肽链中。优选地,VL和VH区通过多肽接头连接,使得scFv形成结合抗原所需的结构。
-“双抗体(diabodies)”包括在通过肽接头连接的相同的多肽链(VH-VL)中连接至轻链可变区(VL)的重链可变区(VH),该肽接头太短而不能使相同链上的两个区域之间配对。这迫使与另一条链的互补区域配对并且促进具有2个功能性抗原结合位点的二聚体分子的组装。
-“双特异性抗体”(BAb)是单独的二价抗体(或二价抗体在免疫治疗方法中有效的片段),其具有两个特异性抗原结合位点用于以不同的方式结合至抗原。该两个抗原结合位点可以通过化学方法或通过本领域已知的基因工程方法彼此连接。
所有这些抗体片段可以使用本领域已知的常规技术进行另外的修饰,例如,单独或组合使用氨基酸缺失、插入、取代、添加,和/或重组,和/或本领域已知的任何其它修饰(例如,翻译后修饰或化学修饰,比如糖基化和磷酸化)。
本发明的免疫治疗用细胞组合物
本发明的另一方面涉及一种免疫治疗用细胞组合物,下文称为本发明的免疫治疗用细胞组合物,其包括至少一种活化抗原递呈细胞(APC),下文称为本发明的活化抗原递呈细胞,其中所述APC从诊断患有本发明的聚集蛋白引起的疾病的患者中获得,并且其中通过间接体内暴露至本发明的组合物刺激所述APC。在本发明的该方面的优选实施例中,分离的活化抗原递呈细胞或APC为树突状细胞(DC)。
在此使用的术语“抗原递呈细胞”或“APC”指的是能够激活T细胞的细胞,并且包括,但不限于,某些巨噬细胞、B细胞,和更优选地,树突状细胞(DC)。“有效的抗原呈递细胞”是在与抗原接触后,可以在初始免疫应答中激活CD8+细胞毒性T淋巴细胞(原态CTL)的细胞。
“树突状细胞”或“DCS”为在淋巴或非淋巴组织中发现的形态上相似的不同种群的细胞类型的成员。
这些细胞的特征在于其与众不同的形态和高水平的MHC II类表达表面。Steinman et al., Ann. Rev. Immunol. 9: 271 (1991)。APC和DC可以从一系列的组织来源,并适当地从外周血分离出来,如在WO2004026238中所描述。本发明的优选的免疫治疗用组合物使用从诊断患有聚集蛋白引起的疾病,或优选地患有α突触核蛋白病的患者中分离出来的APC或DCS。
APC或DC可以通过本领域可用的常规方法分离出来。专利号为No. 5976,546、No. 6,080,409,和No. 6,210,662的美国专利中公开了用于分离DC的方法的合适的例子。
本发明的药物组合物
本发明的另一方面涉及一种药物组合物,下文称为本发明的药物组合物,其包括本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的抗体,或本发明的免疫治疗用细胞组合物。在该方面的优选实施例中,该药物组合物进一步包括药学上可接受的运载体。在另一优选实施例中,该药物组合物进一步包括佐剂。在另一优选实施例中,本发明的组合物不包括佐剂。
术语“佐剂”在此指的是一种只要其自身不具有抗原效果而可以刺激免疫系统增加对疫苗的应答的试剂。尽管不受限制,在疫苗中,铝盐,“磷酸铝”和“氢氧化铝”是两种最常用的佐剂。其它物质,例如角鲨烯,也可以用作佐剂。
本发明的另一方面涉及剂型。下文称为本发明的剂型,其包括本发明的组合物。
在此提供的药物组合物包含治疗有效量的在此提供的序列A和B中的每一种,该序列A和B可以用于治疗或改善聚集蛋白毒性相关的疾病或病变的一个或多个症状。
用于在此提供的组合物的给药的合适的药物运载体包括本领域技术人员已知的被认为适于特定模式的给药的任何一种运载体。
此外,本发明的组合物可以与其他活性组分组合。
本发明的药物组合物可以被配制在合适的药物制剂中,比如,溶液、悬浮液、片剂、可分散片剂、丸剂、胶囊、粉末或持续释放的制剂或酏剂,用于口服给药;或配制成灭菌溶液或悬浮液用于胃肠外给药,以及透皮贴剂和干粉吸入器的制剂。在优选的实施例中,使用本领域中周知的技术和方法配制本发明的药物组合物(参见,例如Ansel Introduction to Pharmaceutical Dosage Forms, Fourth Edition 1985, 126)。
活性组分可以一气呵成服用,或可以划分成若干小剂量间隔服用。应该理解治疗的剂量和准确的持续时间取决于待治疗的疾病,并且可以使用已知的测试方案通过经验确定或由来自体内或体外试验数据推断确定。必须指出,剂量的浓度和值也可以随待减轻的症状的严重程度而变化。此外,必须理解,对于任何特定的受试者,必须根据个体的需要和给药或监督该组合物的人员的职业标准随时间调整特定的剂量方案,并且在此描述的浓度范围仅用于说明,而非限制所要求保护的组合物的范围或实践。
在此使用的术语“活性组分”、“活性物质”、“药用活性物质”、或“药用活性组分”意为在诊断、治愈、缓解、治疗或预防疾病中潜在地提供药用活性或另一不同的效果的或影响人体或其它动物体的结构或功能的任何成分。该术语包括在药物制备中促进化学变化并且以设计的修饰形式存在其中,提供特异性或效果的那些成分。在本发明中,其主要是指,但不限于,本发明的序列A和B的组合,以及本发明的融合氨基酸序列、本发明的抗体和本发明的活化抗原递呈细胞。
在本发明的另一优选实施例中, 本发明的药物组合物为疫苗。
本发明的联合制剂
可以发现本发明的序列A和B彼此结合在一种相同的组合物中,或并列地同时,组合的或贯序给药至哺乳动物,包括人类。
因此,本发明的另一方面涉及联合制剂,下文称为本发明的联合制剂,其包括本发明的序列A和B或其具有生物活性的片段和/或变体中的任何一个。
必须强调,术语“联合制剂”或也称为“并列物”,在此意为,联合制剂的成分不用彼此结合(例如,在真正的组合物中),从而其可以用于组合、分开或贯序施用。因此,表述“并列的”意为:考虑到各成分在物理上的分离,真正的结合并不是必要的。
在本发明的另一优选实施例中,本发明的联合制剂为疫苗。
本发明的用途
本发明的另一方面涉及本发明的序列A和B、本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的抗体、本发明的免疫治疗用细胞组合物、本发明的药物组合物,或本发明的联合制剂在制备药品中的用途。在优选的实施例中,该药品为疫苗。因此,本发明的另一方面涉及一种疫苗,下文称为本发明的疫苗,其包括本发明的序列A和B、本发明的组合物、本发明的核苷酸序列、本发明的表达载体、本发明的宿主细胞、本发明的抗体、本发明的免疫治疗用细胞组合物、本发明的药物组合物,或本发明的联合制剂。
在本发明的背景下,术语“疫苗”是指用于建立免疫系统对疾病的应答的抗原制剂。该疫苗为一旦在身体中通过抗体生产,引起免疫系统应答,并且形成免疫记忆,产生永久或暂时的免疫力的抗原制剂。
疫苗可包括涵盖不同或类似表位的单种肽或各种肽。此外,或作为替代,可以提供具有多个表位的单种多肽。最后一类疫苗被称为多价疫苗。多个表位包括2个或更多个重复表位。
本发明的另一方面涉及本发明的序列A和B、本发明的组合物、本发明的核苷酸、本发明的表达载体、本发明的宿主细胞、本发明的抗体、本发明的免疫治疗用细胞组合物、本发明的药物组合物,或本发明的联合制剂在制备用于治疗或预防聚集蛋白相关的疾病或病变的药品中的用途。
在本发明的该方面的优选实施例中,该聚集蛋白为α突触核蛋白或α突触核蛋白病。在该方面的优选实施例中,α突触核蛋白相关疾病或病变选自:帕金森病(PD)、路易体痴呆(LBD)、阿尔茨海默病的路易体变异、多系统萎缩症(MSA)、阿尔茨海默症、唐氏综合征、肌萎缩侧索硬化症(ALS)、额颞叶痴呆、戈谢病、亨廷顿氏病、朊病毒病、克-雅氏病、多发性硬化症、格-施-沙综合征(Gerstmann-Sträussler-Scheinker syndrome)、库鲁病、致死性家族失眠症、脑血管淀粉样变性、青光眼、年龄相关性黄斑变性、由于年龄相关的蛋白质聚集导致的神经退化、精神病综合征,精神分裂症和/或精神分裂样障碍。更优选地,该疾病或病变为帕金森病(PD)。
在另一优选实施例中,该聚集蛋白为SOD1,并且更优选地,该疾病为肌萎缩侧索硬化症(ALS)。
本发明的另一方面涉及本发明的联合制剂在制备药品中的用途,所述本发明的联合制剂包括本发明的序列A和B,所述药品组合、同时或贯序给药以治疗或预防本发明的聚集蛋白相关的疾病或病变。在优选的实施例中,该聚集蛋白为α突触核蛋白或α突触核蛋白病。
在此使用的术语“药品”指的是用于预防、诊断、缓解、治疗或治疗人类和动物的疾病的任何物质。在本发明的背景中,药品也指的是能够针对聚集蛋白(只要其在人类或动物中引起疾病)产生免疫应答的组合物。因此,其包括如上文所定义的被称为疫苗的那些药品。
本发明的诊断方法
本发明的另一方面涉及用于本发明的聚集蛋白的体外检测方法,其包括将本发明的抗体添加至包括或疑似包括所述聚集蛋白的生物样品中,并检测和测量抗体和聚集蛋白之间形成的任何复合物的浓度。在优选的实施例中,所述聚集蛋白为α突触核蛋白。更优选地,该抗体用可检测的标志物标记,并且通过检测标志物加亮抗体和α突触核蛋白之间形成的复合物的存在。在另一优选实施例中,聚集蛋白的检测可以用于与所述聚集蛋白相关的疾病的诊断、预后或跟进。在说明书中,上文已经以非限制方式描述所述蛋白质和疾病。
术语 “多聚核苷酸”和“核酸”在此可交替地使用,指的是任何长度的核苷酸,核糖核苷酸(RNA)和脱氧核糖核苷酸(DNA),的聚合形式。
术语“氨基酸序列”、“肽”、“寡肽”、“多肽”和“蛋白质”在此可交替地使用,并且指的是任何长度的氨基酸的聚合形式,其可以为通过化学方法,或生物化学方法修饰的,编码或非编码形式。
在说明书和权利要求书中,词语“包括”及其变体不意为排除其它技术特征、增补、成分或步骤。对于本领域技术人员来说,本发明的优势和特征会从本说明书部分地并且从本发明的实践部分地推断出。下面的实施例和附图以说明方式提供,其不意为限制本发明。
本发明的实施例
α突触核蛋白的过度表达和纯化
使用质粒pT7-7在E. coli BL21(DE3)细胞中使人野生型α突触核蛋白(αSyn)过度表达并且按之前所述进行纯化(Roodveldt et al., 2010. PLoS One 5(10): e13481; Roodveldt et al., 2013. PLoS One. 8(11):e79160)。如(Roodveldt et al., PLoSOne 2010)中所述,使用15% SDS-PAGE、质谱分析法、梯度为4-10%的非变性电泳(Lonza, Basel, Switzerland)评估制剂的纯度(>95%)和单体状态。在使用之前,为了清除任何可能的内毒素含量,通过用Amicon Ultra-100 kDa (Merck Millipore Ltd., Carrigtwohill, IRL)离心过滤溶液中的蛋白质。用Oxisens或Chromogenic LAL Assay Kit (GenScript, Piscataway, USA)测量蛋白质制剂中的内毒素含量,并且获得的值<1 EU/mg蛋白质。用Micro BCA Reagent Kit (Pierce, Rockford, IL, USA)确定αSyn蛋白质的浓度。
α突触核蛋白低聚物的制备和特征
根据描述(Roodveldt et al., 2012. Biochemistry 51(44):8771-8)进行αSyn可溶性低聚物的制备和表征,并且将纯化的低聚物部分储存在4°C至最长24 hrs。如上文所述确定蛋白质浓度。
Grp94蛋白质
使用在来自Abcam (英国剑桥; #ab92290)的杆状病毒(无内毒素)中表达的犬全长重组Grp94 (Gp96)。
Hsp70蛋白质
使用在E. coli中过度表达并纯化的人胞浆全长重组Hsp70 (HSPA1A)蛋白质(Roodveldt et al., 2009. EMBO J. 28(23):3758-70)。使用15% SDS-PAGE评估制剂的纯度(>95%)。在使用之前,为了清除任何可能的内毒素含量,通过用Amicon Ultra-100 kDa (Merck Millipore Ltd., Carrigtwohill, IRL)离心过滤溶液中的蛋白质。用Oxisens或Chromogenic LAL Assay Kit (GenScript, Piscataway, USA)测量蛋白质制剂中的内毒素含量,并且获得的值<1 EU/mg蛋白质。用Micro BCA Reagent Kit (Pierce, Rockford, IL, USA)确定αSyn蛋白质的浓度。
SOD1蛋白质
使用通过色谱法纯化的、纯度>95%的在E. coli中过度表达的人全长重组超氧化物歧化酶SOD1蛋白质(ProSpec, 以色列霍霍沃特)。
小鼠免疫方案
方案1:
用5 µg Grp94 和/或用0.8 µg非聚集的αSyn免疫小鼠。用于免疫的蛋白质溶液的制备如下:将Grp94 和αSyn以伴侣:αSyn摩尔比为1:1 (在20 mM HEPES中, pH 7.5) 组合或单独(在对照的情况下)在42ºC培养2小时后,对于每只小鼠,得到最终体积为150 µl的 DPBS溶液。接着将该溶液与另一150 µl完全弗氏佐剂混合,并且将混合充分搅拌直至获得乳液。每个老鼠给药300µl乳液,分布在三处进行皮下注射:一是在每个后爪的上部,另一处是在颈部。7天后,执行相同的过程,但在这种情况下,使用不完全弗氏佐剂。在第二次免疫后7天将小鼠处死。
方案2
用8 µg Grp94 和/或用13µg αSyn低聚物接种小鼠。用于免疫的蛋白质溶液的制备如下:将Grp94 和αSyn低聚物以伴侣:αSyn原体摩尔比为1:10 (在20 mM HEPES中, pH 7.5) 组合或单独(在对照的情况下)在42ºC培养2小时,对于每只小鼠,溶液最终体积为100µl。在缺乏佐剂的情况下,将该溶液以单次皮下注射接种,在腰部施用。在接着第一免疫7天和21后,重复相同的过程。在最后一次免疫后7天,即,在该过程开始后28天将动物处死。
在两种情况下,从小鼠中抽取500~700µl血液以获得血清并分析抗体的存在,取出脾脏以提取脾细胞,该脾细胞用于分析调节性T淋巴细胞(Treg)和针对αSyn的免疫应答。
方案3:
用11 µg Hsp70 和2.5 µg 非聚集的SOD1的组合,或可替换地用11 µg Hsp70,或2.5 µg SOD1,或运载体,作为对照免疫小鼠。用于免疫的蛋白质溶液的制备如下:将Hsp70 和SOD1以伴侣:SOD1摩尔比为1:1 (在20 mMTris中, pH 7.4) 组合或单独(在对照的情况下)在室温下培养2小时后,对于每只小鼠,得到最终体积为150 µl 的PBS溶液。接着与另一150 µl完全弗氏佐剂混合,并且在两个注射器之间转移混合物5分钟使混合物乳化。每个老鼠给药300µl乳液,分布在三处进行皮下注射:一是在每个后爪的上部,另一处是在颈部。在接着第一次注射14天和28天后,执行相同的过程以增强应答,但在这种情况下,使用不完全弗氏佐剂。
方案4:在没有佐剂的情况下用aSyn和Hsp70免疫(蓝本)
用5 µg或50 µg Hsp70(分别为低剂量和高剂量)和/或用1.06 µg 或10.6 µg非聚集αSyn(分别为低剂量和高剂量)免疫小鼠。用于免疫的蛋白质溶液的制备如下:在存在4mM ATP的情况下,将Hsp70和αSyn以伴侣:αSyn摩尔比为1:1 (Tris/HCl 50 mM, pH 7.4;150 mM KCl, 2 mM MgCl2) 组合或单独(在对照的情况下)在37ºC培养2小时,其后加入2.5 mM ADP并且再培养2小时。对于每只小鼠,得到最终体积为200 µl的 PBS溶液,并且小鼠以单次皮下注射在腰部给药。7天后,执行相同的过程。在第二次免疫后7天将小鼠处死。
脾细胞过继转移
在根据方案1和2免疫并且处死免疫的小鼠之后,将来源于一个相同组中每个小鼠的相同数量的脾细胞混合,并且通过单次腹腔注射将1千万个脾细胞转移至每个受体小鼠中。转移后,在开始用MPTP处理之前,给予该小鼠10天的时间以便脾细胞在宿主中定植。
用MPTP处理小鼠
如上文所述(Villadiego J. et al., 2005. 25, 4091 - 4098),长期用MPTP处理接受过继转移的动物。在处理之后,在进行行为测试之前,使动物恢复一个月。
用MPTP处理的动物的行为评估
用MPTP长期处理并使小鼠恢复一个月后进行行为分析(足迹法),接着按照在Muñoz-Manchado A.B. et al,2013. Neurobiol Aging 34(3):902-15中先前所述的方案服用安非他命。
处死经处理的动物并提取样本
用MPTP处理和后续的恢复和行为评估之后,搁置小鼠10天以确保安非他命完全清除并且消除任何不想要的相互作用。处死小鼠并抽取其血液以获得血清,取出脾脏以分离脾细胞。
免疫和受体动物的免疫应答的评估
-使用流式细胞术确定Treg细胞
通过上述的灌注,使用标准方法从脾脏中分离出脾细胞。按照制造商的介绍使用Mouse Foxp3 Buffer Set (BD PharmigenTM)以及anti-CD4 FITC, anti-CD25 APC和anti-Foxp3 PE抗体(都来自BD PharmigenTM)标记06个细胞。使用FACS Calibur流式细胞仪和CellQuest Pro软件(BD PharmigenTM)分析这些细胞。
-用抗原进行体外刺激和细胞因子的确定(IFN-γ, IL-10和IL-17):
将3x106个细胞划分到三个孔中并且视情况在1 ml培养基中仅用培养基、αSyn (15 µg每孔)、SOD1 (20μg每孔),或 LPS (0.5 µg 每孔)进行刺激。在36小时后,收集上清液并且离心以清除细胞碎片和细胞,并保持在-80ºC,以进行后续的细胞因子分析。
为了测量IFN-γ、IL-10 和 IL-17,使用特异性ELISA试剂盒、BD OptEIATM Set Mouse IFN-γ、BD OptEIATM Set Mouse IL-10 (BD PharmigenTM)和BD OptEIATM Set Mouse IL17(BD PharmigenTM)并按照制造商说明进行ELISA。
-血清中总IgG和anti-α突触核蛋白SOD1的确定
处死动物,同时抽取的血液在室温下搁置1小时,并且在4ºC再搁置1小时,从而使其凝块。接着在21,000g离心15分钟,以便获得无细胞血清,将无细胞血清在-80ºC冷冻,以进行后续分析。为了测量IgG1和IgG2a的水平以及总IgM和IgG水平,将血清以1:240000稀释于PBS中,以每孔100µl转移至MaxiSorp 96孔板 (NUNC)中并且在37ºC培养1小时,接着用PBST (0.05% Tween 20)洗涤每个孔,用Assay Diluent (BD PharmigenTM) 阻断1小时。再次洗涤所述孔,使特异性anti-IgG抗体(Promega)、IgG1 (AbCam)、IgG2a (AbCAm)或IgM (Miltenyi)与以1:4000稀释于Assay Diluent中的HRP结合并在37ºC下培养1小时。洗涤所述孔之后,使用TMB Substrate Reagent (BD PharmigenTM)以确定存在于血清中的IgG、IgG1、IgG2a或IgM的数量。
使用类似但有变化的方案以测量特异性anti-αSyn抗体的数量。简单地,用稀释于PBS中的αSyn或anti-αSyn抗体(N19, Santa Cruz)以每个100µl孔1µg对所述板进行预处理,并且在37ºC下培养2小时,接着洗涤所述孔并且按照先前方案进行阻断。在用anti-αSyn抗体进行了预处理的情况下,在37ºC下用每孔10µg αSyn将所述孔培养1小时,并且用PBST洗涤。在两种情况下,每个100µl孔在37ºC下用以1:50稀释在Assay Diluent中的血清培养1小时,接着以与先前方案相同的方式进行洗涤、检测和显影。
使用类似但有变化的方案以测量特异性anti-SOD1抗体的数量。简单地,用稀释在PBS中的SOD1以每100 µl孔0.5 µg处理该板并且在37ºC下培养2小时,接着用以1:50稀释在Assay Diluent中的血清在37ºC下培养每个100 µl孔,然后以与先前方案相同的方式进行洗涤、检测和显影。
结果
用Grp94/Gp96和α突触核蛋白组合对脾细胞进行体外刺激以评估其诱导免疫应答的潜力
为了促进对α突触核蛋白(αSyn)(在突触核蛋白病的背景下其可以潜在地充当神经保护者)的免疫应答,首先在体外评估αSyn和Grp94组合的效力。为了达到该目的,用a Grp94和αSyn组合(1:1摩尔比),或等量的Grp94或aSyn作为对照将小鼠脾细胞培养物培养24 hrs。在分离细胞后,使用流式细胞术进行分析,定量所表达的细胞活性表面标志物,特别是MHC II和CD86,观察到,相对于用缓冲液进行刺激的对照,用αSyn和Grp94进行刺激的情况下,这些标志物的表达分别下降50%和增加2倍(图1A)。另一方面,用αSyn和Grp94组合(αSyn+Grp94)刺激脾细胞引起所表达的这些标志物相对于对照增加4.5倍(图1A)。此外,使用ELISA测量上清液中的细胞因子IFN-γ, IL-10,和 IL-17的水平,也检测出在用蛋白质组合进行刺激的情况下IFN-γ和IL-10相对增加(图 1B和1C)。
用Grp94/Gp96和α突触核蛋白组合免疫小鼠,将脾细胞过继转移至受体小鼠并且后续给药MPTP(帕金森病模型)以评估其PD保护潜力
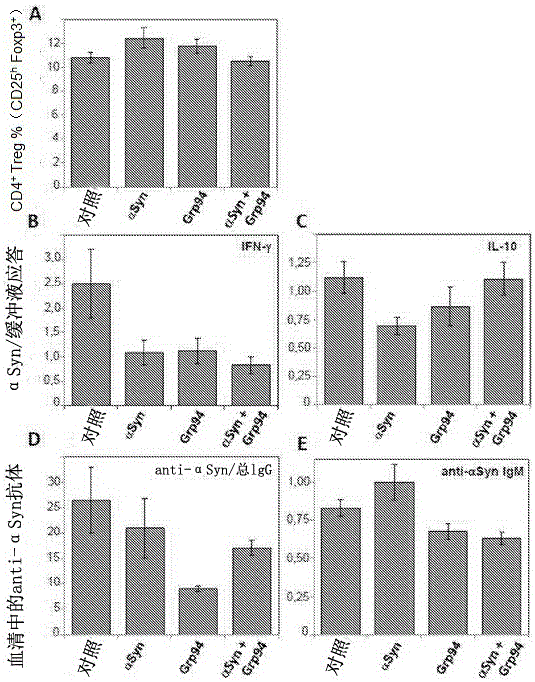
在培养物中已经观察到作为用蛋白质组合进行刺激的结果的脾细胞的不同应答,用所述制剂(αSyn、Grp94、αSyn和Grp94组合,以及缓冲液作为对照)免疫健康C57BL/6雄性小鼠5-7星期,以评估体内应答。为了该目的,设计两个疫苗接种方案(方案1和2)。在完成应用免疫方案1后7天,处死小鼠以分析脾细胞和血清。首先,观察到调节性T细胞(Treg)含量相对于总CD4+细胞没有变化(图2A)。接着,用αSyn或用缓冲液作为对照培养或者可替换地培养脾细胞,此后分离上清液以分析某些细胞因子的水平(图2B和2C)。在该情况下,对于αSyn和Grp94组合,还观察到不同的应答,证明作为在体外用αSyn 刺激脾细胞的结果,IFN-γ水平下降至最小(图 2B)并且对于αSyn+Grp94, IL-10等值(图2C)。最后,测量血清中的anti-αSyn抗体的水平和比例。首先,观察到,在单独用αSyn 免疫小鼠的情况下,anti-αSyn IgG抗体含量令人意外地显著下降(图2D),而相对于用αSyn和Grp94免疫,用αSyn+Grp94免疫产生中等水平的anti-αSyn IgG抗体(图2D)。
另一方面,作为评估突触核蛋白病治疗潜力的策略,来源于根据疫苗接种方案1免疫的小鼠的脾细胞转移至健康C57BL/6小鼠,将这些小鼠用MPTP长期处理3个月作为帕金森病模型(参见Materials and Methods)。对于所有的组(除了“生理盐水对照”)在服用最后一剂MPTP后43天并且在进行行为测试后,处死小鼠并且提取脾脏和血清用于分析。使用流式细胞术分析分离的脾细胞并且在体外用αSyn或缓冲液培养和刺激分离的脾细胞以分析细胞因子介导的应答(图3 A-D)。根据结果,没有接受脾细胞的用MPTP处理的动物(MPTP对照)比没用用MPTP或用脾细胞处理的动物(“健康”或“生理盐水”对照)的Treg细胞水平较低(图3A)。以来源于αSyn或Grp94免疫动物的脾细胞处理的受体动物的值显示比“生理盐水”对照的值分别稍大或稍小,而来自于αSyn+Grp94免疫小鼠的脾细胞的受体显示Treg的百分比最高(图3 A)。对于效应子T细胞观察到相同但相反的分布图(Teff,图3B),并且“αSyn+Grp94”和“生理盐水”小鼠,水平一致。
另一方面,在体外评估培养的脾细胞对αSyn 或 LPS刺激的应答。在该情况下,观察到相对于单独的等量αSyn和Grp94,来自于αSyn+Grp94免疫的动物细胞的受体的脾细胞上清液的IFN-γ和 IL-10的水平下降(图 3B和3C),这展示用αSyn和Grp94组合进行疫苗接种的不同效果。
最后,受体动物的行为测试(足迹法)结果分别显示测量参数(步幅变化)的最小值和最大值为平均值± S.E.M.,对于“MPTP”和“生理盐水”对照,分别为1.43±0.25(N=5)和0.76 ± 0.26 (N=4),并且用“αSyn+Grp94”进行处理所获得的值接近“健康”对照0.83±0.17 (N=7),小于单独用“αSyn”或“Grp94” 获得的值(图3E)。
接着,在健康的5-7周龄C57BL/6雄性小鼠(每组5只小鼠)中测试第二免疫方案(方案2),其中在缺乏佐剂的情况下执行3次免疫,并且使用低聚的/聚集的αSyn。在该情况下,在Treg含量相对总CD4+细胞中,没有观察到区别 (图4A),但检测到用Ol. αSyn+Grp94免疫的小鼠中的Teff细胞含量相对于分开地用Ol. αSyn和Grp94免疫的那些小鼠中的Teff细胞含量高的某些倾向(图4B)。如之前所述,测量用αSyn或缓冲液作为参考培养和刺激的脾细胞的上清液中的IFN-γ水平,观察到来源于Ol. αSyn免疫的样本中IFN-γ水平提高,并且对于“Grp94”和“Ol. αSyn+Grp94”,值与对照类似(图4C)。此外,血清anti-αSyn IgG抗体含量相对于总IgG以及anti-αSyn IgM抗体含量的结果显示用“Ol. αSyn+Grp94”免疫的小鼠比分开地用Ol. αSyn 或Grp94免疫的小鼠,其水平较高(图4D和4E)。
如之前所述,将来自根据方案2免疫的小鼠的脾细胞转移至健康的C57BL/6雄性小鼠,接着使所述小鼠服用MPTP 3个月作为帕金森病模型。受体动物的行为测试(足迹法)结果(图5)显示测量参数(步幅变化)的最小值和最大值为平均值± S.E.M. ,对于“MPTP”和“生理盐水”对照,分别为1.79 ± 0.26 (N=5)和1.06±0.16 (N=5),并且对于用αSyn+Grp94进行的处理,其值与“健康”对照的值1.02±0.23 (N=5) 类似,而不同于单独用“αSyn”或“Grp94”进行处理获得的值(1.98±0.39, N=5; 2.01±0.55, N=5) (图5)。
这些结果证明用αSyn(以非聚集的和低聚形式)和伴侣Grp94的组合进行免疫对免疫小鼠的免疫应答产生不同的效果,并且来源于所述免疫的脾细胞的过继转移能够在受体小鼠中预防或抵抗与帕金森病相关症状的发展。
用Hsp70和SOD1组合对ALS (SOD1 G93A)转基因小鼠模型进行疫苗接种以评估其ALS治疗/预防能力
进行初始实验以评估用SOD1和伴侣Hsp70组合免疫的治疗潜力。为了该目的,使用ALS转基因小鼠模型(Tg SOD1 G93A, Jackson Laboratories Inc., USA),并且将9周龄的小鼠(每组3只小鼠;N=3)根据方案3进行免疫。接着,在发病(通常为12-13周)之前,通过测量ALS小鼠模型的各种标准参数,小心地监测小鼠,直到根据“终点”标准终止该疾病(通常为18-19周,当动物体重相对于其最大体重下降达到<80%时)。在“终点”处死小鼠后,提取脾脏和血液以分析脾细胞和血清。
使用流式细胞术分析分离的脾细胞以分析CD4+细胞、调节性T细胞(Treg) ,和效应子T 细胞(Teff)种群(图 6)。根据该分析,相对于用运载体处理的动物,用SOD1+Hsp70免疫引起CD4+种群和Teff细胞含量增加,而没有观察到Treg细胞含量的变化。另一方面,在体外用SOD1对分离的脾细胞进行刺激以定量IFN-γ分泌物,作为抗原特异性应答类型的指示(图6)。所获得的数据显示相对于对照,用SOD1刺激后分泌的IFN-γ的水平增加3倍。最后,测量血清中IgG抗体的水平以分析不同组中的IgG1/IgG2a比率。该定量结果指示在SOD1+Hsp70组的情况下,对于总IgG抗体和对于SOD1特异性抗体种群所述商增大(图6),表明在神经退行性疾病的背景下,Th2类或“神经保护”应答的重要性。
另一方面,从体重进展分析和每个小鼠的存活观察到,相对于对照,用SOD1+Hsp70免疫的小鼠针对重量减轻具有一定程度的保护以及存活期的增加(图7).这些初始结果指示SOD1+Hsp70诱导不同的免疫应答并且该疫苗接种策略针对ALS具有潜在的有利效果。
用无佐剂的αSyn和Hsp70复合体/组合免疫C57BL/6小鼠及所产生的免疫应答
首先,在缓冲液中进行蛋白质的预培养之后通过PAGE- Western印迹和Biacore,证明αSyn和Hsp70之间的复合体的形成。在缺乏佐剂的情况下,根据方案4,用以相同方式制备的、两种不同剂量(“低”和“高”剂量)的所述制剂或相应的对照免疫健康的C57BL/6小鼠(N=6-7) 。在免疫方案结束后7天,处死小鼠并且提取脾脏和血液以分离脾细胞并获得血清。脾细胞的流式细胞术分析显示,单独用αSyn或Hsp70免疫使Treg种群增加,αSyn+Hsp70组能够抑制该效果,使该种群相对于对照保持在“正常”水平内(图8)。另一方面,对于αSyn+Hsp70,在anti-αSyn IgG抗体水平中观察到类似的不同效果,指示由复合体诱导的应答能够抑制对自身抗原αSyn的抗原特异性体液应答(图8)。最后,定量血清中的IL-10和IFN-γ水平,并且分析每个小鼠的IL-10/IFN-γ成对的商(图8)。所获得的结果清楚地证明对于用αSyn+Hsp70组合免疫的动物,所述商增大,指示在神经退行性疾病背景下,该应答为Th2-类或“神经保护”应答。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人分子伴侣cpn60蛋白26和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人分子伴侣cpn60蛋白8和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——分子伴侣cpn60蛋白15和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——分子伴侣cpn60蛋白10和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人分子伴侣蛋白18和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人分子伴侣蛋白14和编码这种多肽的多核苷酸的制作方法
- 含有分子内伴侣样序列的嵌合蛋白及其在胰岛素生产中的应用的制作方法
- 一种分子伴侣TSPcpn47和编码此分子伴侣的多核苷酸的制作方法
- 一种可溶性表达人脑利钠肽重组蛋白的方法和应用的制作方法
- 修饰的Cpn10以及PRR信号的制作方法