Tenascin-C在制备诊断和治疗肾脏损伤制剂中的应用的制作方法
本发明生物医药
技术领域:
,涉及Tenascin-C的医药新用途,涉及Tenascin-C在制备诊断和治疗肾脏损伤制剂中的应用,具体涉及Tenascin-C在用于制备修复急性肾脏损伤和诊断,治疗慢性肾间质纤维化病症制剂中的应用。
背景技术:
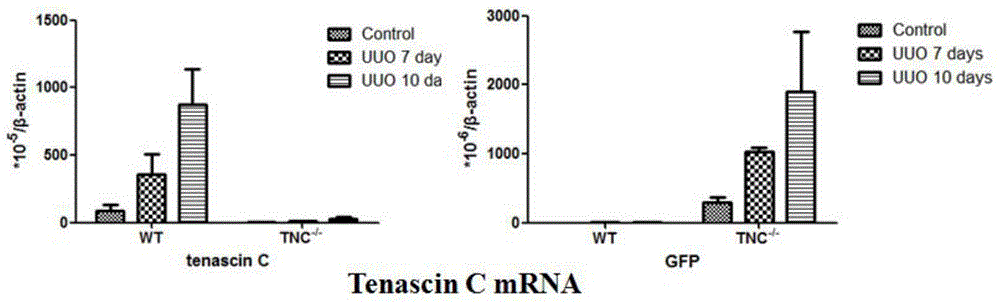
:研究显示,随着人口的老龄化,慢性肾脏病(chronickidneydisease,CKD)的发病率和死亡率也逐年升高,这与CKD的传统因素包括糖尿病、高血压和心血管疾病的患病率逐年上升密切相关。据调查,在美国成人CKD患病率为11%,在年龄超过60岁的人群中则高达39.4%,统计表明CKD的患病率超过单纯糖尿病(9.3%)和CVD(8.5%),已经成为严重的公共卫生问题。无论何种原因引起的CKD,慢性肾间质纤维化为其最终共同通路,表现为肾间质小管的萎缩及细胞外基质的沉积。通常关于CKD的病因研究及肾间质纤维化的严重程度的诊断主要依赖于肾活检,但肾活检是临床实践中采用的有创伤性的诊断措施,且其无法监测纤维化的动态变化速度及严重程度。虽然肾功能(如血清肌酐)与肾间质纤维化的严重程度密切相关,但其诊断的敏感性较差,当出现肌酐升高时,肾脏的纤维化通常已经较严重了,达不到早期诊断的目的。与CKD相对应的另一严重影响人类健康的肾脏疾病是急性肾损伤(acutekidneydisease,AKI),近年来AKI的发病率也是逐年上升,这与人口的老龄化及手术量的增加密切相关。2013年cJASN发表了关于AKI发病率的系统综述,结果表明:基于KDIGO指南提供的AKI诊断标准,住院患者AKI的发病率为23.2%(95%CI21.0-25.7%),全因死亡率为23.0%(21.3-24.8%);如此高的发病率及死亡率不仅危害人类的健康,也给社会和政府带来巨大负担。虽然AKI能恢复甚至肌酐下降至基线水平,但其中仍有很大一部分患者无法完全恢复而转变为CKD,表现为肾间质纤维化的进行性进展。目前尚缺乏有效的生物标志物用于检测AKI的恢复以及是否遗留肾间质纤维化,以及缺乏有效的药物促进肾小管坏死后肾小管上皮细胞的再生。因此,本申请的发明人拟提供Tenascin-C作为肾脏损伤或肾脏纤维化的生物标志物,通过监测血、尿中的指标反应肾脏损伤的严重程度并预测肾脏恢复的机会;以及提供Tenascin-C在制备诊断和治疗肾脏损伤制剂中的应用,将有助于慢性肾脏纤维化的早期诊断及监测、干预肾脏纤维化的进展。技术实现要素:本发明的目的提供Tenascin-C在制备诊断和治疗肾脏损伤制剂中的应用,具体涉及Tenascin-C在用于制备修复急性肾脏损伤和诊断,治疗慢性肾间质纤维化病症制剂中的应用。进一步的,本发明提供Tenascin-C作为肾脏损伤或肾脏纤维化的生物标志物,尤其是作为肾脏损伤或肾脏纤维化的血液及尿液中的生物标志物;更进一步的,本发明提供Tenascin-C在制备检测,诊断和治疗肾脏损伤或肾脏纤维化的试剂盒中的应用。本发明中通过检测肾组织、血清和尿液中的Tenascin-C,反应肾间质纤维化的严重程度;本发明中通过抑制Tenascin-C的功能,减轻慢性肾间质纤维化的进展;本发明中通过检测肾组织、血清和尿液中的Tenascin-C,反应急性肾损伤的严重程度并预测遗留慢性肾间质纤维化的风险;本发明中通过同在急性期上调Tenascin-C的功能,减轻急性肾损伤的严重程度。更具体的,本发明中,进行了慢性肾间质纤维化患者肾活检标本中的TNC检测,结果发现慢性肾间质纤维化过程中TNC的表达明显增加;进一步,通过构建双转基因小鼠TNC-CreER-eGFP转基因小鼠,该小鼠与报告基因小鼠Rosa26-tdTomato小鼠交配获得双转基因小鼠,利用该种转基因小鼠构建单侧输尿管梗阻模型(UUO),结果证实,在慢性肾间质纤维化过程中肾组织TNC的表达明显增加;而采用TNC基因缺失小鼠证实TNC基因缺失显著减轻慢性肾间质纤维化的严重程度。本发明中,进行了急性肾损伤患者肾活检标本的TNC检测,发现急性肾小管坏死部位TNC的表达明显增加;进一步,通过构建TNC-CreER-eGFP转基因小鼠,该小鼠与报告基因小鼠Rosa26-tdTomato小鼠交配获得双转基因小鼠,利用该种转基因小鼠构建急性缺血再灌注损伤模型,证实在急性肾损伤过程中肾组织TNC的表达变化趋势;采用TNC基因缺陷小鼠证实TNC基因缺失显著加重急性肾损伤的严重程度。本发明中,从患者肾活检标本及动物研究证实的在慢性肾间质纤维化过程中的TNC表达上调可作为反应慢性肾间质纤维化的生物标志物;经试验证实的在急性缺血再灌注损伤过程中证实的TNC表达上调可作为反应急性肾损伤严重程度和预测遗留慢性肾间质纤维化风险的生物标志物。本发明的试验检测结果证实,TNC基因缺失显著减轻慢性肾间质纤维化严重程度,可用于制备通过抑制TNC的作用能减轻慢性肾间质纤维化的严重程度的检测试剂及试剂盒;本发明试验检测结果证实,TNC基因缺失显著加重急性肾损伤的严重程度,可用于制备通过上调TNC的功能可减轻慢性肾间质纤维化的严重程度的检测试剂及试剂盒。本发明的优点在于:提供Tenascin-C作为肾脏损伤或肾脏纤维化的生物标志物,尤其是作为肾脏损伤或肾脏纤维化的血液及尿液中的生物标志物;以及提供Tenascin-C在制备检测,诊断和治疗肾脏损伤或肾脏纤维化的试剂盒中的应用;本发明中通过监测血、尿中的生物标志物指标能反应肾脏损伤的严重程度并预测肾脏恢复的机会,并进一步提供促进急性肾损伤的修复减轻肾脏损伤的严重程度的干预措施;以及通过检测血液及尿液中的生物标志物反应肾脏纤维化的严重程度,提供有助于慢性肾脏纤维化的早期诊断及监测肾脏纤维化的进展的干预措施。附图说明图1是CKD患者慢性肾间质纤维化时TNC表达增加,其中,左上图为正常对照肾脏,TNC表达少;右上图为较弥漫肾间质纤维化,可见TNC表达上调且位于肾间质;下图为肾间质的灶性纤维化组织,可见TNC在纤维化病灶里有显著的表达,而在旁边纤维化不明显的小管,TNC表达不明显。图2显示了TNC的表达随着纤维化程度的加重而增加,其中,采用WT小鼠和TNC-/-小鼠,检测UUO后7天、10天TNC及报告基因eGFP的mRNA表达,可见在WT小鼠,TNCmRNA水平随着UUO时间的延长而逐渐增加,TNC-/-小鼠未检测到TNCmRNA表达(左图);在TNC-/-小鼠,eGFPmRNA的水平随着UUO时间的延长而逐渐增加,WT小鼠未检测到eGFP的表达(右图)。图3显示了TNC表达的细胞在UUO诱导的纤维化模型中显著增加,与对照肾脏(左上)相比,UUO5天时肾髓质和皮髓交界线附近tdTomato阳性的细胞明显增加,肾皮质也有较多的阳性细胞(右上),随着UUO时间的延长,tdTomato阳性的细胞进一步增加(左下),在肾脏皮质部位有明显的主要是肾间质细胞的阳性细胞(右下)。图4显示TNC基因缺失改善UUO诱导的慢性肾间质纤维化,其中,Masson染色提示和WT小鼠相比,TNC-/-小鼠在UUO5天、7天、10天,慢性肾间质纤维化的严重程度均明显减轻(n=8,p<0.05)。图5显示TNC基因缺失减轻肾间质纤维化过程中巨噬细胞的浸润,其中图示为巨噬细胞的标志物F4/80组化染色,结果表明,与WT小鼠相比,TNC-/-小鼠在UUO5天、7天和10天,肾组织巨噬细胞的浸润明显减轻,采用ImageJ软件扫面阳性面积,表明TNC-/-较WT小鼠F4/80阳性面积显著减少(n=8,p<0.05)。图6显示TNC基因缺失减少纤维化过程中FSP-1阳性细胞的数量,其中图示为FSP-1免疫荧光,与WT小鼠相比,TNC-/-小鼠在UUO5天、7天FSP-1阳性细胞的数量明显减少(n=8,p<0.05)。图7显示TNC基因缺失改善纤维化相关基因的表达,其中,采用WT和TNC-/-小鼠,检测UUO7天和UUO10天肾组织纤维化相关指标α-SMA、collagenI、fibronectin及PAI-1的mRNA水平,结果与WT小鼠相比,TNC-/-小鼠collagenI、fibronectin及PAI-1的水平均明显降低(n=4,2wayANOVAp<0.05),α-SMA的mRNA水平无显著差异。图8显示纤维化过程中TNC的表达来源于其他细胞的诱导(UUO模型),其中,采用TNC-CreER+/-;R26-tdTomato+/-小鼠,术前3月给予tamoxifen诱导TNC阳性肾间质细胞基因重组而持续表达tdTomato红色荧光蛋白,经3个月的洗脱期,构建UUO模型;A、D为未梗阻侧肾脏,可见tdTomato阳性的细胞位于肾乳头部位,肾皮质有散在少量的阳性细胞,主要位于肾小球鲍曼氏囊壁;B、E围术期未再给予tamoxifen诱导,UUO7天可见肾髓质部位的tdTomato阳性细胞明显增多,而皮质增加的TNC表达细胞并不明显;C、F为围术期再次给予tamoxifen诱导,UUO7天可见整个肾脏尤其肾皮质部位tdTomato阳性细胞增加更明显。图9显示纤维化过程中TNC的表达源于其他细胞的诱导(IR模型),其中,采用TNC-CreER+/-;R26-tdTomato+/-小鼠,术前3月给予tamoxifen诱导TNC阳性肾间质细胞基因重组而持续表达tdTomato红色荧光蛋白,经3个月的洗脱期,构建IR模型;A、D为对照侧肾脏,可见tdTomato阳性的细胞主要位于肾乳头部位,肾皮质仅有散在少量的阳性细胞,位于肾小球鲍曼氏囊壁;B、E在IR后未再给予tamoxifen诱导,IR后14天可见肾髓质部位的tdTomato阳性细胞明显增多,而皮质增加的TNC表达细胞并不明显;C、F为IR后9天再次给予tamoxifen诱导,IR后14天可见整个肾脏tdTomato阳性细胞增加更明显,提示IR晚期纤维化过程中持续有其他非TNC阳性细胞被诱导表达TNC。图10表达TNC固有肾脏细胞是肌成纤维细胞的一个来源,其中,采用TNC-CreER+/-;R26-tdTomato+/-小鼠,术前给予tamoxifen诱导TNC阳性肾间质细胞基因重组而持续表达tdTomato红色荧光蛋白,经3个月的洗脱期,构建IR模型,IR后14天发现肾髓质大部分α-SMA阳性(绿色荧光,eGFP在无抗体染色时一般检测不到绿色荧光)的myofibroblast均有红色荧光蛋白。图11显示急性肾小管坏死患者损伤肾小管周围出现TNC表达,其中,左上图为正常肾组织,可见肾小管周围很少有TNC的表达,右上和左下为ATN患者,肌酐最高达900μmol/L,肾活检时肾功能已有所恢复并脱离透析,遗留部分未修复完成的肾小管,可见其周围有明显的TNC表达。右下为移植肾,由于缺血时间较长,有显著的肾小管坏死,移植后肾功能没有恢复,可见TNC的表达更显著。图12显示急性肾脏缺血再灌注损伤后TNC呈一过性表达增加,其中,上图为TNC-CreER-eGFP+/-小鼠肾脏IR后不同时间TNCmRNA的表达水平,可见IR后2天TNCmRNA表达水平显著增加,4天达峰,6天开始下降,14天虽仍高于正常对照,但已明显下降;下图为TNC-CreER-eGFP+/-小鼠肾脏IR后不同时间TNC的报告基因eGFP的mRNA表达水平,结果与TNCmRNA变化趋势相似,反映TNC在急性缺血再灌注损伤后的表达变化。图13显示急性肾脏缺血再灌注损伤后TNC被诱导的主要部位,其中,正常肾脏,TNC的表达主要位于肾脏乳头部位,肾脏外髓及皮质表达均少;采用TNC-CreER-eGFP+/-小鼠IR后2天,发现肾脏外髓、内侧皮质出现大量表达eGFP的细胞,其中以皮髓交界线的表达增加最为显著;IR后14天,eGFP表达的细胞减少,但较正常对照仍显著增加,主要位于髓质及近髓皮质部位。图14显示IR14d肾间质TNC蛋白表达水平明显上升,其中,IR后14天,TNC蛋白表达水平较正常组织显著增高,肾皮质和髓质均有明显的TNC表达,以皮髓交界线两侧及髓质部位显著。图15显示TNC诱导表达的主要时间,其中,采用TNC-CreER+/-;R26-tdTomato+/-小鼠,构建单侧IR模型,分别于不同时间注射tamoxifen,观察tdTomato阳性细胞的数量及分布情况;A1-3为IR术前4周注射tamoxifen1.5mgqd*5d,经3周的洗脱期后构建IR模型,分别于术后7天(A1)、14天(A2)、2月(A3)留取肾脏标本观察,提示tdTomato阳性细胞主要位于肾脏内髓部位,数量较对照组轻度升高;B1-3为IR围术期前、后各2天注射tamoxifen1.5mgqd,共4天,分别于术后7天(B1)、14天(B2)、2月(B3)留取肾脏标本观察,提示tdTomato阳性的细胞均显著的增加,主要位于外髓及内侧皮质,虽然IR后14天肾脏缩小,但tdTomato阳性的细胞并没有减少,B3的IR时间较B1、B2短,因此tdTomato阳性的细胞也较少;C1-3为术后全程注射tamoxifen,与围术期注射tamoxifen相比tdTomato阳性细胞数量有所增加,但分布的范围无明显增大,C3肾脏IR后2月的tdTomato阳性细胞数量较C1-2少可能与IR时间较短有关;D1-4为小鼠留取肾脏标本前4天注射tamoxifen1.5mg/d,结果提示IR后3-7天有大量TNC的诱导表达,而IR10天以后TNC的诱导表达明显减少,IR28天左右,基本没有TNC的诱导表达。图16显示表达TNC细胞的增加程度与肾脏IR损伤的严重程度正相关,其中,A1-3为IR前4周注射tamoxifen诱导,经过洗脱期后,构建肾脏IR模型,48h取肾脏观察,结果提示tdTomato阳性的细胞较对照组增加不明显;B1-3为IR前、后各2天注射tamoxifen,48h取肾脏标本观察,发现肾脏缺血时间越长,tdTomato阳性细胞增加的数量和范围越大;C1-3为IR后3天注射Tamoxifen4天,IR后7天观察,发现IR50min较IR35min肾脏tdTomato阳性细胞的数量及分布范围均显著增加。图17显示TNC诱导表达的细胞主要位于损伤小管周围,其中,采用TNC-CreER+/-小鼠,构建IR模型,观察eGFP的主要表达部位,上图为IR后2天,下图为IR后14天,eGFP阳性细胞主要围绕损伤的肾小管周围。图18显示TNC基因缺失降低小鼠急性缺血再灌注损伤的生存率,其中,采用同窝TNC-CreER+/+小鼠(即TNC-/-小鼠)和TNC+/+小鼠(n=14),构建单侧肾脏切除+单侧IR模型,观察生存情况,结果提示TNC基因缺陷小鼠较野生型小鼠生存率明显降低。图19显示TNC基因缺失加重小鼠缺血再灌注损伤后肾脏肿胀,其中,采用同窝TNC-CreER+/+小鼠(即TNC-/-小鼠)和TNC+/+小鼠,构建单侧肾脏切除+单侧IR模型,分别于IR0天、2天、5天、7天取存活小鼠肾脏(n=4),记录肾脏的重量及小鼠体重,结果提示TNC-/-小鼠较野生型小鼠体重下降更明显,肾脏的肿胀(用肾重量/体重表示)也更显著。图20显示TNC基因缺失加重小鼠肾脏IR后的肾功能损伤,其中采用同窝TNC-CreER+/+小鼠(即TNC-/-小鼠)和TNC+/+小鼠,构建单侧肾脏切除+单侧IR模型,分别于IR0天、2天、5天、7天取存活小鼠肾脏(n=4),留取血清检测血尿素氮水平,结果提示TNC-/-小鼠较野生型小鼠肾功能损害更显著。图21显示TNC基因缺失加重小鼠IRI后的肾小管坏死,其中,同窝TNC-CreER+/+小鼠(即TNC-/-小鼠)和TNC+/+小鼠,构建单侧肾脏切除+单侧IR模型,分别于IR2天、5天、7天取存活小鼠肾脏(n=4),行PAS染色,提示TNC-/-小鼠较野生型小鼠肾小管坏死明显加重。图22显示TNC基因缺失小鼠IRI后肾乳头部位的损伤明显加重,其中,同窝TNC-CreER+/+小鼠(即TNC-/-小鼠)和TNC+/+小鼠,构建单侧肾脏切除+单侧IR模型,分别于IR2天、5天、7天取存活小鼠肾脏(n=4),行PAS染色,提示TNC-/-小鼠较野生型小鼠肾乳头坏死更明显。具体实施方式实施例1检测肾组织、血清和尿液中的Tenascin-C,反应肾间质纤维化的严重程度1.临床研究获取于本中心肾活检证实存在肾间质纤维化的肾组织石蜡切片(n=5),行TNC免疫荧光染色,观察纤维化肾组织中TNC的表达情况。采用ELISA方法检测血清和尿液中的Tenascin-C水平。2.实验动物研究TNC基因缺失对肾间质纤维化的影响采用同窝TNC-CreER-eGFP+/+(即TNC-/-)小鼠和野生型小鼠,荧光共染对TNC表达细胞进行定性研究采用TNC-CreER-eGFP+/-小鼠,表达TNC细胞的谱系追踪采用TNC-CreER+/-;R26-tdTomato+/-小鼠。所有小鼠均为129品系,养于SPF级环境中,室内温度保持在25℃,昼夜明暗交替时间为12/12小时,自由饮食、饮水和活动。实验通过伦理委员会批准,小鼠饲养者均获得参与动物实验资格证。3.UUO模型获得8-10周龄雄性小鼠,术前用5%水合氯醛麻醉(0.5g水合氯醛溶于10ml无菌生理盐水,0.008ml/g小鼠体重),术中钝性分离右侧肾脏,双次结扎肾下极输尿管,逐层缝合腹腔。4.TNC诱导表达的评价首先采用TNC-CreER+/-小鼠,构建UUO模型,分别于UUO后7天和10天检测肾脏TNC和eGFPmRNA水平(n=5),观察TNCmRNA在IR的变化趋势。其次采用TNC-CreER+/-小鼠,在UUO后10天通过免疫荧光法检测eGFP和TNC蛋白的表达水平及表达部位。再次采用TNC-CreER+/-;R26-tdTomato+/-小鼠,于UUO前、后各2天注射tamoxifen,UUO后5天、7天获得小鼠肾脏标本,直接观察tdTomato阳性的细胞量及部位,判断UUO后TNC表达细胞的数量。实施例2抑制Tenascin-C的功能,减轻慢性肾间质纤维化的进展1.慢性肾间质纤维化的评价采用盲法原则由有经验的病理医生完成。采用masson染色,根据小鼠肾脏横切面纤维化的严重程度分为0-10分,半定量肾脏的纤维化程度;利用巨噬细胞的标志物F4/80对小鼠肾脏横切面进行免疫组化染色,采用ImageJ软件进行扫描,通过比较阳性面积的大小,评价巨噬细胞的浸润程度;通过FSP-1对小鼠肾脏横切面进行免疫荧光染色,100倍视野下随机选取20个视野,计算小鼠肾脏横切面FSP-1阳性细胞数;提取整个肾脏mRNA和蛋白,检测纤维化相关蛋白包括collagenI,fibronectin,PAI-1,α-SMA的mRNA,比较组间纤维化指标的差异。2.表达TNC细胞的类型鉴定采用TNC的报告基因eGFP和多种间质细胞的marker进行免疫荧光共染,判断TNC表达细胞是间质细胞中的哪一群细胞。共染的marker包括间质细胞的PDGFRβ、pericyte的NG2、巨噬细胞的F4/80、myofibroblast的α-SMA以及FSP-1。结果使用共聚焦显微镜观察,判断TNC表达的细胞是否是上述细胞群。由于发现在IR后纤维化的部位,eGFP阳性和F4/80阳性的细胞占很大比例,因此采用IR14天肾脏,200倍视野下随机选取髓质部位20个视野,计算所有间质细胞以及eGFP阳性细胞和F4/80阳性细胞的比例。3.谱系追踪方法采用TNC-CreER+/+的小鼠与报告基因小鼠R26-tdTomato+/+进行交配,即可获得TNC-CreER+/-;R26-tdTomato+/-双转基因小鼠。正常情况下,该双转基因小鼠并不表达红色荧光蛋白tdTomato,在tamoxifen的诱导下,表达TNC的细胞出现tdTomato表达而使细胞发红色荧光。该小鼠报告基因tdTomato与TNC-CreER-eGFP自带的报告基因eGFP的区别:前者需在tamoxifen的诱导下表达,且在tamoxifen和重组酶Cre同时存在的情况下给细胞带上永久的标记;后者不需要tamoxifen诱导,当TNC表达上调时上调,TNC表达消失时消失。利用该小鼠造模后可直接荧光显微镜观察特定时期的TNC表达细胞及谱系追踪。于小鼠4周龄时予注射tamoxifen1.5mg/d*5d,经过3个月的洗脱期,小鼠用于构建UUO模型或者IR模型。UUO模型分为2组,组1术后未再次使用tamoxifen诱导,UUO7天留取肾脏组织直接观察,tdTomato阳性的细胞代表术前原TNC阳性的细胞及其子代细胞;组2术后1-5天再次给予tamoxifen诱导,UUO7天留取肾脏组织直接观察,tdTomato阳性细胞代表原TNC阳性细胞及其子代细胞,以及UUO过程中被诱导表达TNC的细胞。IR模型也分为2组,组1术后未再次使用tamoxifen诱导,IR14天留取肾脏组织直接观察,tdTomato阳性的细胞代表术前原TNC阳性的细胞及其子代细胞;组2术后9-13天再次给予tamoxifen诱导,IR14天留取肾脏组织直接观察,tdTomato阳性细胞代表原TNC阳性细胞及其子代细胞,以及IR9天后被诱导表达TNC的细胞。利用该方法可以判断表达TNC的细胞是来源于原TNC阳性细胞的增殖,还是来自于其他细胞的诱导表达。通过tdTomato和α-SMA染色的共定位,可判断原TNC阳性的细胞是否会变成myofibroblast。此外,为了判断TNC-CreER诱导系统的leakage情况,我们在谱系追踪研究前采用TNC-CreER+/-;R26-tdTomato+/-双转基因小鼠,未予注射tamoxifen,判断该小鼠在没有tamoxifen诱导时存在多少的leakage。实施例3检测肾组织、血清和尿液中的Tenascin-C,反应急性肾损伤的严重程度1.临床研究获取于本中心肾活检证实为急性肾小管坏死(ATN)的肾组织石蜡切片(n=5),行TNC免疫荧光染色,观察ATN肾组织中TNC的表达情况。采用ELISA方法检测血清和尿液中的Tenascin-C水平。2.实验动物研究肾脏IR后TNCmRNA的表达增加采用TNC-CreER-eGFP+/-小鼠,研究IR后TNC表达细胞增加及增加的位置分别采用TNC-CreER-eGFP+/-小鼠和TNC-CreER+/-;R26-tdTomato+/-小鼠,研究TNC基因缺失对IR肾损伤的影响采用同窝TNC-CreER-eGFP+/-(即TNC-/-)和野生型小鼠。所有小鼠均为129品系,养于SPF级环境中,室内温度保持在25℃,昼夜明暗交替时间为12/12小时,自由饮食、饮水和活动。实验通过伦理委员会批准,小鼠饲养者均获得参与动物实验资格证。3.TNC-CreER;R26-tdTomato双转基因小鼠的获取及实验采用TNC-CreER+/+的小鼠与报告基因小鼠R26-tdTomato+/+进行交配,即可获得TNC-CreER+/-;R26-tdTomato+/-双转基因小鼠。TNC-CreER小鼠为本实验室制备,R26-tdTomato小鼠购自Jax实验室。正常情况下,该双转基因小鼠并不表达红色荧光蛋白tdTomato,在tamoxifen的诱导下,表达TNC的细胞出现tdTomato表达而使细胞发红色荧光。该小鼠报告基因tdTomato与TNC-CreER-eGFP自带的报告基因eGFP的区别:前者需在tamoxifen的诱导下表达,且在tamoxifen和重组酶Cre同时存在的情况下给细胞带上永久的标记;后者不需要tamoxifen诱导,当TNC表达上调时上调,TNC表达消失时消失。利用该小鼠造模后可直接荧光显微镜观察特定时期的TNC表达细胞及谱系追踪。4.肾脏缺血再灌注损伤模型的构建本部分研究TNC基因缺失对IR肾损伤严重程度的影响采用单侧肾脏切除+单侧肾脏缺血再灌注损伤40min,获得8-10周龄雄性小鼠,I/R前用5%水合氯醛麻醉(0.5g水合氯醛溶于10ml无菌生理盐水,0.008ml/g小鼠体重),术中钝性分离右侧肾脏,结扎肾蒂,切除肾脏,再钝性分离左侧肾脏周围软组织,定位肾动脉,血管夹夹闭,见肾脏立刻失去血供,变为苍白,记录肾脏缺血时间,伤口表面覆盖盐水纱布,将动物移至温控板上,体表覆盖干纱布。肾脏缺血40min后小心移除血管夹,肉眼观察肾脏恢复灌注,逐层缝合腹腔。其他研究采用单侧肾脏IR模型,获得8-10周龄雄性小鼠,I/R前用5%水合氯醛麻醉,术中钝性分离左侧肾脏周围软组织,定位肾动脉,血管夹夹闭,见肾脏立刻失去血供,变为苍白,记录肾脏缺血时间,伤口表面覆盖盐水纱布,将动物移至温控板上,体表覆盖干纱布。肾脏缺血时间根据不同的实验要求决定,分别为35min、40min、50min、60min和70min,后小心移除血管夹,肉眼观察肾脏恢复灌注,逐层缝合腹腔。5.IR后TNC诱导表达的变化趋势和部位首先采用TNC-CreER+/-小鼠,构建单侧IR50min模型,分别于IR后2天、4天、6天和14天检测肾脏TNC和eGFPmRNA水平(n=5),观察TNCmRNA在IR的变化趋势。其次采用TNC-CreER+/-小鼠,在IR后2天、7天和14天通过免疫荧光法检测eGFP和TNC蛋白的表达水平及表达部位。再次采用TNC-CreER+/-;R26-tdTomato+/-小鼠,分别于IR前4周注射tamoxifen,IR后1、2天注射tamoxifen,IR后3、4天注射tamoxifen,IR后1、2、4、6天注射tamoxifen,均于IR后7天获得小鼠肾脏标本,直接观察tdTomato阳性的细胞量及部位,分析不同时间TNCmRNA的诱导情况。6.IR后TNC诱导表达位置与损伤小管的关系采用TNC-CreER+/-小鼠,构建单侧IR50min模型,分别于IR后2天和14天留取肾脏冰冻标本,采用eGFP抗体染色,观察eGFP阳性部位周围肾小管的损伤情况。实施例4急性期上调Tenascin-C的功能,减轻急性肾损伤的严重程度1.TNC影响急性肾损伤严重程度的研究方法采用同窝的TNC-/-和WT小鼠各至少20只,构建单侧肾切+单侧肾脏缺血再灌注损伤(UN+UIR)模型,术后隔天记录小鼠体重,体重减轻用体重下降百分比,即(当天体重-基础体重)/基础体重表示,同时记录自然死亡的小鼠;于IR2天、5天和7天分别取尚存活的小鼠每组各4只,留取血清,采用生化检测仪检测血清尿素氮,留肾脏标本,秤肾脏的重量,一半留石蜡组织,另一半冰冻组织。石蜡切片PAS染色观察急性肾小管坏死的严重程度。2.急性肾小管坏死严重程度的病理评价方法采用盲法原则由有经验的病理科医生完成。根据石蜡切片PAS染色,每个标本在光镜400倍下选取皮质和外髓(不同标本之间两者选取比例一致)至少40个不重叠视野,判断肾小管损伤程度。肾小管损伤定义为肾小管扩张或小管上皮细胞脱落或细胞肿胀或者小管基底膜裸露,其严重程度根据损伤的比例分为5个级别:评分评分标准0分损伤肾小管小于5%1分损伤肾小管小于5%-25%2分损伤肾小管25%--50%3分损伤肾小管50-75%4分损伤肾小管超过75%3.统计分析小鼠术后的生存率差异采用K-M曲线表示,组间比较采用logrank方法检验。体重的变化采用repeatedmeasurementANOVA分析,肾脏重量变化的比较和血清尿素氮的比较采用twowayANOVA分析,余连续变量的比较采用t检验,分类变量的比较采用卡方检验。本发明上述实验结果显示:一、检测组织、血清和尿液中的Tenascin-C,反应肾间质纤维化的严重程度1.CKD患者肾间质纤维化时TNC表达升高取肾活检组织证实存在肾间质纤维化的石蜡切片,免疫荧光染色发现在轻度肾间质纤维化时小管周围的间质即出现明显的TNC表达,随着间质纤维化严重程度的增加,TNC的表达也增加,且无论是弥漫的间质纤维化还是灶性的纤维化组织,TNC的表达均显著增加。2.慢性肾脏纤维化时TNC的表达增加采用WT小鼠和TNC-/-小鼠,构建UUO模型,发现在WT小鼠,随着UUO时间的延长,TNCmRNA的表达逐渐升高,而TNC-/-小鼠TNC报告基因eGFPmRNA的结果也一致,两者均说明随着组织纤维化的加重,TNC基因转录逐渐增加。对肾组织进行TNC及eGFP染色,结果表明纤维化后TNC蛋白及eGFP的表达也是显著增加的。3.慢性肾脏纤维化过程中表达TNC的细胞明显增加UUO是经典的慢性肾间质纤维化模型,采用TNC-CreER+/-;R26-tdTomato+/-小鼠构建UUO模型,并在术前2天至术后2天予tamoxifen诱导Cre基因重组。结果提示随着UUO时间的延长,tdTomato阳性的细胞逐渐增多,增多的部位不仅位于肾髓质,在肾皮质部位也有显著的tdTomato阳性细胞的增多。该结果进一步证明在慢性肾间质纤维化过程中,肾皮质和髓质均有明显的TNC表达。二、抑制Tenascin-C的功能,减轻慢性肾间质纤维化的进展1.TNC基因缺失缓解慢性肾间质纤维化采用WT及TNC-CreER+/+(即TNC-/-小鼠),构建UUO模型,发现和WT小鼠相比,TNC基因缺失可减轻肾间质的纤维化,Masson染色纤维化评分明显降低,巨噬细胞的浸入减少(F4/80阳性面积减少),FSP-1阳性细胞的数量减少,纤维化相关指标包括collagenI、fibronectin、PAI-1的mRNA水平也明显降低。这些结果均提示TNC基因缺失可减轻慢性肾脏纤维化。2.表达TNC细胞的谱系追踪既然TNC在慢性肾间质纤维化过程中表达增加,且TNC基因缺失可明显减轻肾脏纤维化,那么表达TNC的细胞来自于哪里呢?是原有TNC阳性细胞的增殖迁移还是其他间质细胞的诱导?因此我们对表达TNC的细胞进行谱系追踪。首先采用TNC-CreER+/-;R26-tdTomato+/-小鼠,未给予tamoxifen诱导,构建UUO10天/IR7天模型,判断造模后该小鼠leakage的情况。结果发现tdTomato阳性的细胞较造模前明显增多,但与注射tamoxifen的小鼠相比,其阳性细胞的比例还是很小的。因此,我们继续使用该小鼠,术前3月给予tamoxifen诱导TNC阳性肾间质细胞基因重组而持续表达tdTomato红色荧光蛋白,经过3个月的洗脱期,构建UUO模型。对照组tdTomato阳性的细胞主要位于肾乳头部位,肾皮质有散在少量的阳性细胞,位于肾小球鲍曼氏囊壁;若围术期未再给予tamoxifen诱导,UUO7天肾髓质部位的tdTomato阳性细胞明显增多,说明UUO过程中tdTomato阳性细胞(即原TNC表达细胞)出现明显增殖;若围术期再次给予tamoxifen诱导,UUO7天肾髓质和皮质部位tdTomato阳性细胞增生较未再次tamoxifen诱导的小鼠更明显,说明UUO过程中TNC的表达来源于其他细胞的诱导。类似地,在IR14天模型中,对照肾脏的tdTomato阳性细胞主要位于肾乳头部位,术后未再次tamoxifen诱导,可见原TNC表达细胞出现增殖,若在IR9天后(肾小管坏死修复完成)再次予tamoxifen诱导,可见肾脏皮质和髓质tdTomato阳性细胞的增加更加明显,提示在IR晚期纤维化过程中,仍有TNC被诱导表达,且表达TNC的细胞来源于其他非TNC表达细胞的诱导。3.肾髓质TNC阳性细胞可转分化为myofibroblast细胞采用TNC-CreER+/-;R26-tdTomato+/-小鼠,术前3月给予tamoxifen诱导TNC阳性肾间质细胞基因重组而持续表达tdTomato红色荧光蛋白,经过3个月的洗脱期,构建IR模型,发现肾髓质大部分α-SMA阳性(绿色荧光,eGFP在没有抗体染色的情况下一般检测不到绿色荧光)的myofibroblast均有红色荧光蛋白,提示这些myofibroblast均来自原有TNC阳性间质细胞的增殖和转分化。三、检测肾组织、血清和尿液中的Tenascin-C,反应急性肾损伤的严重程度1.急性肾小管坏死患者TNC表达上调在人肾组织中,正常肾小管周围很少有TNC的表达,当发生ATN后,损伤肾小管周围的TNC表达明显上调,上调的水平与损伤的严重程度正相关。2.肾脏缺血再灌注损伤后TNC表达增加TNC-CreER-eGFP+/-小鼠急性缺血再灌注损伤后,TNCmRNA表达显著增加,4天达高峰,6天开始下降,14天接近正常对照;TNC的报告基因eGFP的mRNA表达水平变化趋势同TNCmRNA,IR后6天TNC的表达开始下降。免疫荧光提示表达eGFP的细胞显著增加,其中以外髓及内侧皮质增加明显,IR后2天,eGFP阳性的细胞已明显增加,皮髓交界线部位的增加尤其显著;IR后14天,eGFP阳性的细胞较IR后2天明显下降,但较正常小鼠仍增加,主要分布于外髓部位。3.TNC一过性诱导表达主要在IR后的1周采用TNC-CreER+/-;R26-tdTomato+/-小鼠,构建单侧IR模型,分别于不同时间注射tamoxifen,观察tdTomato阳性细胞的数量及分布情况。我们发现当IR前4周注射tamoxifen,经过洗脱期后再构建IR模型,结果tdTomato阳性的细胞仅轻度增加,增加的细胞主要来源于正常情况下固有TNC表达细胞的增殖或者少量leakage,分布于肾髓质。当围术期给予tamoxifen诱导,发现无论是IR后7天、14天、2月,tdTomato阳性的细胞均显著增加,IR14天和IR7天相比,阳性细胞增多的数量并不显著,提示TNC的诱导表达主要在前7天,IR2月可能因缺血时间较短(45minvs50min),阳性细胞增加的数量较前者少。当IR后全程注射tamoxifen诱导时,tdTomato阳性细胞较围术期诱导虽有所增加,但范围扩大得并不明显。当留取肾脏标本前4天注射tamoxifen诱导时发现TNC的诱导表达主要在IR前7天,IR10天后TNC的诱导表达已经显著减少,IR28天时几乎没有TNC的诱导表达。由此可见,TNC的诱导表达主要发生在IR后的1周,结果和TNC及eGFPmRNA在IR后的变化趋势相一致,且TNC的诱导表达主要位于肾脏皮髓交界线的两侧,越靠近外侧肾脏皮质,TNC的诱导表达越少,这和肾脏IR后损伤最严重的部位相一致,提示TNC诱导表达可能和肾脏急性缺血再灌注损伤的修复相关。比较IR围术期即给予tamoxifen诱导和IR3天后再诱导,后者在髓质部位TNC的诱导表达较少,提示IR后1-2天,TNC的诱导表达主要位于髓质,3天后外移至皮髓交界线两侧,而在前2天有表达TNC的细胞其TNC表达已下调,说明TNC的一过性表达时间短暂。4.TNC的诱导表达与损伤的严重程度呈正相关由于eGFP表达荧光较弱,因此我们采用TNC-CreER+/-;R26-tdTomato+/-小鼠,构建单侧不同严重程度的IR模型,观察tdTomato阳性细胞的数量。当IR前4周tamoxifen诱导时,不同缺血时间tdTomato阳性细胞的变化数量较正常对照变化均不明显。当围术期tamoxifen诱导时,随着缺血时间的增加,IR后2天tdTomato阳性细胞的数量也增加。当IR时间均为50分钟时,围术期tamoxifen诱导的小鼠肾脏tdTomato阳性的细胞较术前4周诱导的明显增多,说明TNC的表达不是来自于原TNC表达细胞的增殖,而是其他未表达TNC的细胞被诱导表达TNC。当IR后3天开始tamoxifen诱导,7天观察肾脏tdTomato阳性细胞数量,发现缺血时间长的肾脏阳性细胞的数量也显著增加。由此可见,TNC诱导表达的细胞数量与缺血再灌注损伤严重程度呈正相关。5.表达TNC的细胞主要位于损伤肾小管的周围IR后eGFP阳性的细胞一般围绕着损伤的肾小管,在IR后2天,eGFP阳性的细胞围绕的肾小管有上皮细胞的肿胀坏死,在IR后14天,修复好的肾小管已无eGFP阳性的细胞包围,而在损伤较严重,仍有形态异常的肾小管周围持续有eGFP阳性的细胞存在,表明TNC的表达还在诱导。由此可见,TNC表达于损伤的肾小管周围可能和肾小管的修复密切相关。四、急性期上调Tenascin-C的功能,减轻急性肾损伤的严重程度,TNC基因缺失加重肾脏急性缺血再灌注损伤采用同窝TNC-CreER+/+小鼠(即TNC-/-小鼠)和TNC+/+小鼠,构建单侧肾脏切除+单侧IR模型,发现TNC-/-小鼠生存率较野生型小鼠明显降低,WT组在IR2天、5天和7天为获得肾脏标本各处死4只小鼠,整个观察过程中未出现小鼠死亡;TNC-/-小鼠在IR2天、5天和7天也各处死3-4只小鼠,但整个观察期死亡率超过50%以上。所有造模后TNC-/-小鼠体重下降更明显,在相应时间点处死的小鼠肾脏肿胀更厉害,肾功能更差,病理肾脏皮质和髓质的肾小管坏死更严重,存在显著的差异肾乳头部位有大量的管型;病理评分,IR2天时,WT组小鼠均1-2分,而TNC-/-小鼠均4分,IR7天时,WT组小鼠0-1分,而TNC-/-小鼠均2-3分。由此可见,TNC基因缺失显著加重急性肾损伤的严重程度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1