一种治疗糖尿病的中药制剂及其制备方法和检测方法与流程
本发明涉及一种治疗糖尿病的中药制剂(糖宁通络片)及其制备方法,属于中药技术领域。
背景技术:
糖尿病是严重危害人类健康的常见多发病,目前我国的糠尿病患者逐年增多,已经超过了两千多万人,全世界的糖尿病患者已经超过了一亿人,已然,糖尿病已经成为一个世界性问题。糖尿病死亡率仅次于恶性肿瘤及心血管疾病,是危及人类生命的第三大疾病。
数千年来我国在治疗糖尿病方面,积累了丰富的经验。近年来,已经有不少治疗糖尿病的中药配方申请了发明专利,例如申请号为201010259466.5公开的“根治糖尿病的药物及其制备方法”、申请号为201110346174.X公开的“一种治疗2型糖尿病胰岛素抵抗的中药”、申请号为201110048889.7公开的“一种治疗2型糖尿病胰岛素抵抗的药物”等。但是这些现有的降糖药效果并不显著,没有达到很好的治疗效果。因而需要人们继续挖掘中药材资源,研制更为有效的药物。
技术实现要素:
本发明的目的在于,提供一种治疗糖尿病的中药制剂及其制备方法,所述的中药制剂降糖效果显著,可以取得更好的治疗效果。
为解决上述技术问题,本发明采用如下的技术方案:一种治疗糖尿病的中药制剂,按重量份计算,它的活性成分由以下原料药制备而成:
科夭罗曲400~550份 车前草300~400份 仙鹤草300~400份 山银花300~400份。
前述的治疗糖尿病的中药制剂中,优选的,按重量份计算,它由以下原料药制备而成:
科夭罗曲480份 车前草350份
仙鹤草335份 山银花335份。
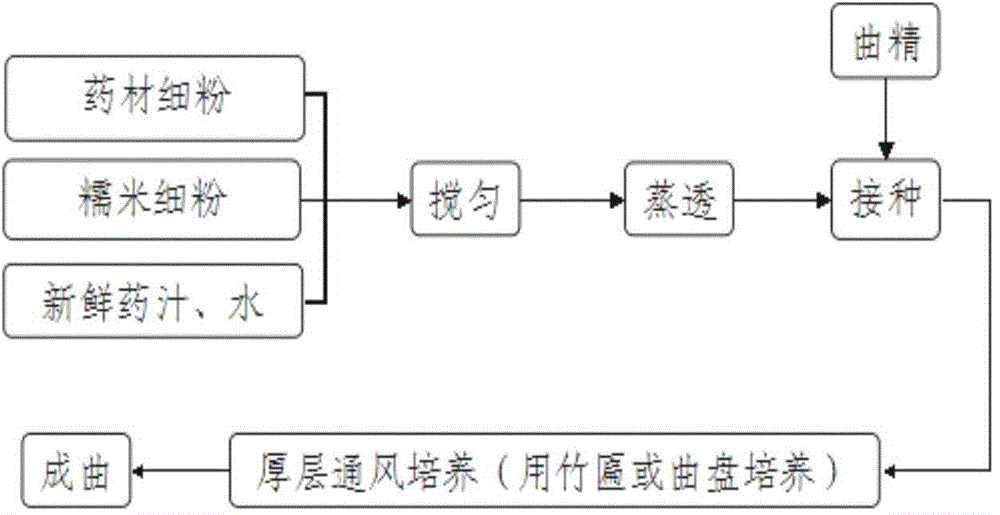
前述的治疗糖尿病的中药制剂中,所述的科夭罗曲,按重量份计算,由药材新鲜瓜蒌2份、新鲜鸡血藤2份和新鲜垂盆草1份所组成的混合物经压榨取汁后,药渣的干燥细粉再与麦粉2份、麸皮1份混合,加入药汁,经曲制进行酵解而成。
前述的治疗糖尿病的中药制剂中,优选的,所述的药渣的干燥细粉与麦粉和麸皮的混合物,加入药汁搅匀制成软材,蒸透,保持温度为18~26℃、湿度为45%~65%,添加曲精发酵20天~30天,取出,干燥,粉碎,即得科夭罗曲。
前述的治疗糖尿病的中药制剂中,前述科夭罗曲的制备方法中,加入全部药汁的同时也可以加入水。
前述的治疗糖尿病的中药制剂中,所述的科夭罗曲,按重量份计算,由药材新鲜瓜蒌2份、新鲜鸡血藤2份和新鲜垂盆草1份所组成的混合物经压榨取汁后,药渣的干燥细粉再与麦粉2份、麸皮1份混合,加入药汁,经曲制进行酵解而成。
前述的治疗糖尿病的中药制剂中,所述的科夭罗曲由药材新鲜瓜蒌、新鲜冬瓜皮、垂盆草以2:2:1的重量比混合;干燥后,粉碎成细粉,再以该细粉:麦粉:麸皮=5:2:1的重量配比混匀,加入药汁,同时加水搅匀制成软材,蒸透,保持温度为18~26℃、湿度为45%~65%,添加曲精发酵20~30天,取出,干燥,粉碎,即得。
前述的治疗糖尿病的中药制剂的制备方法,,按重量份计算,称取科夭罗曲、车前草、仙鹤草和山银花,加6~10倍量水,浸泡30~120分钟,煎煮1~2小时,过滤,取滤液备用;药渣加6~10倍量水煎煮1~2小时,过滤;合并两次滤液,滤过,浓缩,干燥,粉碎,加入辅料,制成相应的中药制剂,即得。
前述的治疗糖尿病的中药制剂的制备方法,优选的,所述的制备方法包括:按重量份计算,称取科夭罗曲、车前草、仙鹤草和山银花,将车前草和仙鹤草切制成1.0cm段,加8倍量水,浸泡30分钟,煎煮2小时,过滤,取滤液备用;药渣加6倍量水煎煮1小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.2~1.3的清膏,于温度55~75℃、真空度0.08~0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,加入辅料,制成相应的中药制剂,即得。
前述的治疗糖尿病的中药制剂的制备方法,更优选的,所述的制备方法包括:按重量份计算,称取科夭罗曲、车前草、仙鹤草和山银花,将车前草和仙鹤草切制成1.0cm段,加8倍量水,浸泡30分钟,煎煮2小时,过滤,取滤液备用;药渣加6倍量水煎煮1小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.2的清膏,于温度65℃、真空度0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,整粒,加入干膏总重的0.37%的二氧化硅,混匀,装入胶囊,即得胶囊剂。
前述中药制剂制得的片剂,还包括活性成分重量1%-5%的填充剂、活性成分重量10%-20%的崩解剂、物料量40-60%且浓度为10-15%的粘合剂、物料量0.1-0.5%润滑剂。所述的物料量40-60%的粘合剂是指粘 合剂的量为活性成分加入填充剂、崩解剂后的物料总量的40-60%;所述的物料量0.1-0.5%的润滑剂是指润滑剂的量为活性成分加入填充剂、崩解剂、粘合剂后的物料总量的0.1-0.5%。
前述中药制剂制得的片剂,所述的填充剂为预胶化淀粉,所述的崩解剂为羧甲基淀粉或/和微晶纤维素,所述的粘合剂为淀粉浆,所述的润滑剂为二氧化硅或/和硬脂酸镁。
前述中药制剂制得的片剂,所述的崩解剂按重量份包括1-3份羧甲基淀粉和10-20份微晶纤维素;所述的润滑剂按重量份包括1-5份二氧化硅和1-5份硬脂酸镁。
前述中药制剂制得的片剂,还包括活性成分重量1.67%的羧甲基淀粉钠、活性成分重量2.9%的预胶化淀粉、活性成分重量15.67%的微晶纤维素、物料量55%且浓度为12%的淀粉浆、物料量0.16%的二氧化硅和硬脂酸镁,其中二氧化硅:硬脂酸镁的重量比为1:1。
前述片剂的制备方法,取科夭罗曲、车前草、仙鹤草和山银花四味,加水浸泡30分钟,煎煮两次,第一次2小时,第二次1小时,合并煎液,滤过,浓缩,干燥成干膏;粉碎,过100目筛,加羧甲基淀粉钠、预胶化淀粉及微晶纤维素,制粒,干燥,整粒,加入润滑剂混合均匀,压制成1000片,包薄膜衣,即得。
前述片剂的制备方法,称取科夭罗曲、车前草、仙鹤草和山银花,将车前草和仙鹤草切制成1.0cm段,加8倍量水,浸泡30分钟,煎煮2小时,过滤,取滤液备用;药渣加6倍量水煎煮1小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.2的清膏,于温度65℃、真空度0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,整粒,过100目筛,加入干膏总重1.67%的羧甲淀粉钠,2.9%的预胶化淀粉,15.67%的微晶纤维素,用物料量55%的、且浓度为12%的淀粉浆为粘合剂制粒,取出湿颗粒于65~75℃干燥,干颗粒用二号筛整粒后,加入物料量0.16%的1:1的二氧化硅和硬脂酸镁作润滑剂混合均匀,压片,包薄膜衣,即得。
前述片剂的检测方法,(1)取本品去包衣,研磨成细粉,称取1.3g,加入10ml的甲醇超声30分钟过滤,取滤液5ml,加入少量的镁粉,滴加12~14滴浓盐酸,水浴1~2分钟,溶液变为红紫色。
(2)取本品去包衣,研磨成细粉,称取3.8g,加95%乙醇50ml,回流提取2小时,滤过,滤液浓缩至5ml,作为供试品溶液。另取木犀草苷对照品,加甲醇制成每1ml含0.4mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取供试品溶液3.5μl、对照品溶液1μl,分别点于同一硅胶G板上,以乙酸乙酯-丙酮-甲酸-水(7:3:1:1.2)为展开剂,展开,取出,晾干,喷以5%三氯化铝乙醇溶液,105℃加热10分钟,放冷,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱相应位置上,显相同颜色的荧光斑点。
(3)取本品去包衣,研磨成细粉,称取2.6g,加95%乙醇50ml,回流提取2小时,滤过,滤液浓缩至10ml,作为供试品溶液。另取大车前苷对照品,加60%甲醇制成每1ml含0.1mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取供试品溶液2μl、对照品溶液2μl,分别点于同一聚酰胺薄膜上,以乙酸乙酯-丙酮-甲酸-水(7:3:1:1.2)为展开剂,展开,展距为5cm,取出,在60℃加热10分钟,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。
(4)取本品去包衣,研磨成细粉,称取2.6g,加甲醇30ml,回流提取3小时,滤过,滤液浓缩至10ml,作为供试品溶液。另取异绿原酸A对照品,加甲醇制成每1ml含0.4mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2010版一部附录ⅥB)试验,吸取供试品溶液2μl、对照品溶液1μl,分别点于同一聚酰胺薄膜上,以乙酸乙酯-丙酮-甲酸-水(7:3:1:1.2)为展开剂,展开,展距为5cm,取出,在60℃加热10分钟,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱相应位置上,显相同颜色的荧光斑点。
【检查】应符合片剂项下有关的各项规定(《中国药典》2010年版一部附录I D)
【浸出物】照浸出物测定法(《中国药典》2010年版附录ⅩA浸出物测定法热浸法)测定,本品水溶性浸出物不得低于25.0%。
【性状】本品为薄膜衣片,除去包衣后应显棕色至棕褐色,气微,味苦。
为了确保本发明的效果,本申请人进行了一系列实验来选择本发明提供的药物制剂的制备工艺,保证科学、合理、可行。具体如下:
实验例1:剂型的选择
本品由科夭罗曲、车前草、仙鹤草、山银花四味药组成,是结合苗医长期临床运用的经验方的基础上,以辩病与辩证相结合,根据“从脾论治糖尿病”的治疗方法和“两病两纲”的苗医理论,糖尿病及并发症属内冷外热症,需热冷兼顾用药以确立治法,进行选药组方的。方中科夭罗曲碳为苗医特有,具益气健脾、生津消渴之效,调理脾胃,益液充盈为热药,入冷经,属主药;仙鹤草收敛止血,截疟,止痢,解毒;车前草清热利尿,祛痰,凉血,解毒;山银花疏风解毒,和胃生津;后三味均属冷药入热经,共为辅药;诸药 伍用,共奏固本养阴、化浊通脉、生津止渴之功效。胶囊剂与片剂相比较,胶囊剂不加压力,所以药物在胃肠道崩解快,从而显效快,吸收好;另外,胶囊不透光,对光敏感的药物及遇湿热不稳定的药物,装入胶囊后,可保护药物不受湿气和空气中的氧以及光线的影响,从而可提高其稳定性。因此,在尽量保留中药传统煎煮后汤剂直接服用的特点上,考虑用胶囊的剂型,并在其中尽可能少的加辅料来进行工艺研究。
实验例2:制备工艺研究
为使处方中药材的成份尽量提取出来,以出膏率为考察指标,对药材的炮制长度、加水量,浸泡时间、煎煮时间、煎煮次数分别进行考察,其结果如下:
(1)处方中药材的炮制长度对出膏率的影响
将车前草、仙鹤草炮制成不同长度,山银花的饮片和科夭罗曲直接投料,称取处方量药材,用10倍量水将药材浸润30分钟,煎煮2次,每次2小时,过滤,合并滤液,浓缩,进行出膏率测定,结果见表1:
表1药材炮制长度对出膏率的影响
由表1可知:药材粗粉的出膏率最高,但药材粗粉提取后药液难于过滤,实验时所用机械的方法榨干药渣,并不适于大工业生产;而切制成1.0cm段的出膏率与其相近,故将车前草、仙鹤草切制成1.0cm段进行提取为佳。
(2)浸泡时间对出膏率的影响
将车前草、仙鹤草炮制成1.0cm段,山银花的饮片和科夭罗曲直接投料,称取处方量药材,用10倍量水将药材浸润不同时间,煎煮2次,每次2小时,过滤,合并滤液,浓缩,进行出膏率测定,结果见表2所示:
表2不同浸泡时间对出膏率的影响
由表2可知:不同的浸泡时间,对药材的出膏率影响不大,从节约时间和成本考虑,以浸润30分钟为佳。
(3)不同的加水量、煎煮时间和提取次数对出膏率的影响
将车前草、仙鹤草炮制成1.0cm段,山银花的饮片和科夭罗曲直接投料,称取处方量药材,用不同的加水量,浸泡30分钟,用不同的煎煮时间和提取次数提取,过滤,滤液,浓缩,进行出膏率测定,具体以下表3中的方案进行考察,试验结果如表4所示:
表3不同的提取方案
表4不同提取方案对浸膏收率的影响
由表3、表4可知:处方药材提取2次,第一次加8倍量水浸泡30分钟,煎煮2小时,第二次加6倍量水煎煮1小时后,浸膏收率几乎不再增加,从节约能源和时间成本考虑,以车前草、仙鹤草炮制成1.0cm段,山银花的饮片和科夭罗曲直接投料,称取处方量药材,煎煮2次,第一次用8倍量水将药材浸润30分钟,煎煮2小时;第二次用6倍量水煎煮1小时,过滤,合并滤液的工艺为佳。
所述的出膏率测定的具体方法为:取浓缩至相对密度为1.2~1.3(测定温度60℃)的清膏,转移并定容至1000ml容量瓶中,摇匀;精密量取20ml,分别置于已恒重的蒸发皿中,水浴挥干,残渣于105℃干燥3小时,取出,置干燥器中放置30分钟,称重,计算。
(4)浓缩及干燥工艺研究
粗提液试验中采用滤过(300目滤布)法进行,为防止有效成分长时间受热破坏,结合工业生产条件,采用三效减压浓缩设备进行浓缩。结果显示:合并的滤液减压浓缩成相对密度为1.2~1.3的清膏,测量温度为60℃;同时干燥条件为:温度55~75℃,真空度0.08~0.1Mpa时效果最好。
(5)润滑剂及用量的筛选
将干燥后的浸膏打粉过60目,直接填充胶囊,发现粉末的流动性太差,影响装量,故考虑加入润滑剂。经过预实验,得出用二氧化硅作润滑剂效果最佳;以粉末流动性为考察指标,对二氧化硅的加入量进行考察,结果如表5所示:
表5二氧化硅的加入量试验考察结果
由表5可知:二氧化硅的加入量为原料药总量的0.27%时,粉末流动性一般,加入总量的0.37%及总量的0.47%时,粉末流动性均较好,从节省成本方面考虑,以加入总量0.37%的二氧化硅为最佳选择。
(6)科夭罗曲的制备方法研究:
研究表明,科夭罗曲采用以下方法制备效果较好:
按配比称取药材新鲜瓜蒌、新鲜鸡血藤和新鲜垂盆草,压榨取汁,备用;将药渣干燥后,粉碎成细粉;按配比称取麦粉和麸皮,将麦粉和麸皮与药渣细粉混匀,加入药汁和水搅匀制成软材,蒸透,保持温度为18~26℃、湿度为45%~65%,添加曲精发酵20~30天,取出,干燥,粉碎,即得。
科夭罗曲的制备方法中:
一、
1、发酵曲胚排列间隔:3-4cm(侧掌杆下自如);
2、发酵培养起点温度23-25℃(夏季越低越好);
3、入房培养要求稻草视季节而定,冬季:垫和盖达3公分厚;夏季:垫和盖达2公分厚;
4、发酵培养,品温最高时达56℃(后三天要根据气候适当排潮);
5、上小墙要求为正长方行,高度4-7层;
6、后期发酵培养温度28-30℃,并做好通风;
7、发酵完毕,上大墙高度6-8层。
二、发酵管理:
1、前发酵2-3天内,保温、保水,使其正常发酵;
2、发酵中期4-7天内,通风排潮得当,保持曲胚表面湿度,不干燥、开裂;
3、翻曲上、下换面,如温度过高,拉开曲胚之间的距离。
三、关键工序:
1、前期培菌:
随着季节和室温的不同,曲胚升温也有所不同,夏季升温快些,冬季慢些,当随着温度逐渐上升,曲房水汽增大,潮湿闷热,曲房温度升到30-45℃,曲胚表面有菌丝(呈现白色斑点时,应勤加检查,并根据室内温度、湿度情况,进行排潮)。若曲胚表面水份已蒸发到一定程度,且带硬,不粘手,即可进行翻曲,其方法是将曲块底部翻到上面,四周的翻至中间,中间的翻至四周,根据季节确定曲块的距离,并盖好一层稻草,关闭门窗保温。
2、中期管理:
①翻曲后,关闭门窗,曲房温度会逐渐上升,当温度上升到45-50℃以上时(视中、高温曲而定)进行第二次翻曲,翻完后关闭门窗。
②当温度又继续上升到35-45℃时,要打开门窗,并要排潮,调节温度,温度降到30℃时(夏季以室温为准)进行第二次翻曲。
③根据升温情况,曲胚的干燥程度,翻曲4-6次;每翻一次,上小墙后曲块高一层,当曲房升温基本结束时,有明显曲香气味时,曲块已基本成熟。
3、后期管理:
视季节不同,当曲房温度逐渐降至10-35℃时,可以上大墙,即把基本成熟的曲块逐渐集中堆放在一间房内,要求摆实、靠紧(地面要加垫板)。整个发酵时间在16-25天,要求内无积湿、长霉好、水分≤20.0%;储存三个月以后使用,理化指标:水分≤14.0%。
另外,对于科夭罗曲:
检查:水分不得过9.0%(《中国药典》2010年版一部附录ⅨH第一法);酸不溶性灰分不得过1.0%(《中国药典》2010年版一部附录ⅨK);
性状:为不规则细粉或细小颗粒状腐熟物,表面灰白色至微黄色,粗糙,质脆易碎,气香;
性味与归经:甘、辛,温;归脾、胃经;
功能与主治:益气健脾,生津消渴,调理脾胃,益液充盈。用于口渴喜饮、多食、多尿、消瘦、气短、体倦乏力;
用法与用量:3~6g;
贮藏:置阴凉干燥处,防蛀。
实验例3:对本发明的治疗糖尿病的胶囊制剂的物理性质研究
①性状:以3批制剂样品为依据描述剂型颜色、外形、气味等,如表6所示:
表6三批样品的性状描述
结论:通过对三批样品的形状描述,说明该药品的性状稳定,确定本药品的性状为硬胶囊;除去囊壳后显棕色至棕褐色,味苦。
其中,科夭罗曲的性状如表7所示:
表7
②堆密度:称取一定重量合格颗粒,装入10ml量筒中,以一定高度落下数次(尽可能控制条件一致),使松紧适度,以重量除以容积得堆密度,结果如表8所示:
表8颗粒堆密度测定结果
③休止角的测定:取合格颗粒经漏斗流下并呈圆锥体状,测定其休止角,结果如表9所示:
表9颗粒休止角测定结果
由表9可知:颗粒的休止角低于45.0°,具有良好的流动性,适合于填充胶囊的要求。
④颗粒的临界相对湿度测定,如表10、表11所示,临界相对湿度测定曲线如图3所示:
表10不同溶液的相对湿度表
表11临界相对湿度测定数据
由图3的吸湿曲线可求得,临界相对湿度约为58%;结合生产,在打粉、混合、填充及贮存时应将相对湿度控制在55%以下,以减少水分对药物性质及稳定性的影响。
实验例4:中试生产试验
按照本发明的制备工艺,进行中试规模的工艺试验,共投料3批,三批中试产品检测数据如表12所示,检验结果如表13所示:
表12三批中试试验数据
表13三批试制样品检验结果
进行三批次中试生产的验证,如表12、表13,结果表明:本发明的治疗糖尿病的中药制剂的工艺是合理的、可行的。
实验例5:浸出物测定
本品未含有毒性药材,含量测定确有一定难度,根据《贵州省医疗机构制剂技术评审要点-中药民族药》(试行)增加该项目的测定,测定方法依据《中国药典》2010年版一部附录ⅩA浸出物测定法热浸法予以测定,测试3批中试样品浸出物含量,结果见下表14:
表14本发明3批中药制剂的浸出物测定
故将本品水溶性浸出物含量暂定为不低于50.0%。
实验例6:药效学试验
一、本发明的中药制剂对db/db自发性糖尿病小鼠的影响
1.仪器与试药
1.1本发明的中药制剂
本发明的中药制剂(批号:20130401,规格:0.3g/粒,相当于1.5g生药/粒,人用量为每次3粒,每 日3次,由贵州百灵企业集团制药股份有限公司提供)。
试验设3个剂量组:低剂量组(4倍临床等效剂量)1.8g/kg、中剂量组(8倍临床等效剂量)3.6g/kg、高剂量组(16倍临床等效剂量)7.2g/kg,动物给药体积为0.1ml/10g体重;故药物配制浓度分别为7.2g/kg/10ml=0.72g/ml,3.6g/kg/10ml=0.36g/ml,1.8g/kg/10ml=0.18g/ml。
配制方法:胶囊每粒为0.3g,故每次分别取24、12、6粒,加蒸馏水配制成10ml待用。
2.2盐酸二甲双胍片
盐酸二甲双胍片由中美上海施贵宝制药有限公司生产(批号:1303107);适应症:高胰岛素血症、2型糖尿病。用法用量:通常本品(盐酸二甲双胍片)的起始剂量为0.5克,每日2次,一日用药量为1g。人体重按照60kg计算,折算成动物给药剂量为120mg/kg;动物给药体积为0.1ml/10g体重;故药物配制浓度为120mg/kg/10ml/kg=12mg/ml。
配制方法:片剂规格为0.5g,故每次取1粒,加蒸馏水配制成41.70ml待用。
2.3.试剂与仪器
葡萄糖,购自北京化工厂(批号:20121205);血脂四项CHO(批号:120971),TG(批号:125161),HDL(批号:120331),LDL(批号:120411),试剂盒购自日立高科技贸易(上海)有限公司;小鼠胰岛素ELISA试剂盒(批号:13061201),购自美国Crystal Chem公司;稳豪型血糖试纸(批号:3462320)和稳豪型血糖仪,购自强生(上海)医疗器材有限公司;酶标仪,购自帝肯(上海)公司;日立7080全自动生化仪,购自日本日立株式会社;电子天平,购自梅特勒托利多仪器(上海)有限公司。
3.动物与饲养条件
3.1试验动物:SPF级自发性糖尿病小鼠模型C57BL/KsJ-db/db小鼠(简称db/db小鼠),6~8周龄,体重45~55g,雄性;由中国科学院上海实验动物中心/上海斯莱克实验动物有限责任公司提供。
3.2饲养条件:在中国医学科学院药用植物研究所动物中心进行动物饲养,动物实验设施持续保持屏障环境标准。主要环境指标的控制范围:室温20~26℃,日温差≤4℃;相对湿度40%~70%;最小换气次数15次/小时;光照明:暗=12h,明=12h。动物饲养于标准盒内,每盒5只,其饲养空间符合中华人民共和国国家标准GB14925-2010中关于实验动物所需最小空间的规定。所有动物均由培训合格的人员进行饲养管理,整个饲养过程中保持动物饮食活动自由。
3.3检疫及驯化过程:新领到的动物检疫期3~5天。在检疫期间观察动物饮水、摄食和健康状况,以及是否存在疾病和死亡征兆。健康动物皮毛光滑、反应灵敏、无异常分泌物等。发现任何异常现象都需向专题负责人和临床兽医报告,在兽医指导下、经专题负责人确认,剔除有病的动物、用健康动物进行代替。确认动物健康无病,方能使用。动物适应性饲养1周后方可进行试验。
4试验方法
4.1对db/db小鼠空腹血糖的影响
同周龄C57/BL雄性小鼠为空白对照组,25只雄性db/db小鼠随机分为5组,6-8周龄,试验分别为模型组、盐酸二甲双胍组、本发明中药制剂高剂量组、本发明中药制剂中剂量组、本发明中药制剂低剂量组,共5组,每组5只。均给予标准颗粒饲料适应性喂养14d后,血糖值超过13.9mmol/L后开始给予药物干预,各组灌胃给药,每日1次,灌胃体积0.1ml/10g,连续给药35天,其中空白对照组和模型组每天灌胃0.1ml/10g的饮用水。动物禁食不禁水5h后,用全自动血糖仪测定小鼠尾静脉血血糖值,给药期间,每周测定一次。
4.2对db/db小鼠葡萄糖耐量的影响
同周龄C57/BL雄性小鼠为空白对照组,25只雄性db/db小鼠随机分为5组,分别为模型组、盐酸二甲双胍组、本发明中药制剂高剂量组、本发明中药制剂中剂量组、本发明中药制剂低剂量组,共5组,每组5只。均给予标准颗粒饲料适应性喂养14d后,血糖值均超过13.9mmol/L后开始给予药物干预,各组灌胃给药,每日1次,灌胃体积0.1ml/10g,连续给药35天,其中空白对照组和模型组每天灌胃0.1ml/10g的饮用水。动物禁食不禁水,5h后,2.5g/kg葡萄糖灌胃后0min,30min,60min,90min,120min用全自动血糖仪测定尾静脉血血糖值。
4.3对db/db小鼠血清胰岛素水平的影响
给药和处理同上4.2,动物禁食不禁水,5h后测定空腹血糖和糖耐量之后,动物麻醉,腹主动脉采血500μL,3500rpm离心15min,取上清,胰岛素ELISA试剂盒检测血清胰岛素。
4.4对db/db小鼠血脂四项CHO,TG,HDL,LDL的影响
给药和处理同上4.2,动物禁食不禁水,5h后测定空腹血糖和糖耐量之后,动物麻醉,腹主动脉采血500μL,3500rpm离心15min,取上清,全自动生化仪检测血脂四项。
5实验结果
5.1对db/db小鼠一般状态的影响
与C57/BL对照组比较,db/db模型组体型肥胖,体重显著增加,活动减少,其他状态如毛色,饮食无变化;与db/db模型比较,二甲双胍和本发明中药制剂对db/db小鼠体型、活动、毛色、饮食无显著性改变。本发明中药制剂组体重偏轻,但无统计学差异。
5.2对db/db小鼠空腹血糖的影响
结果表明,给予药物处理1周后,与模型组比较空腹血糖有降低的趋势,但无统计学差异;给予药物处理2周后,与模型组比较空腹血糖有降低的趋势,本发明中药制剂高剂量组有统计学差异。给予药物处理4周后,阳性药物和本发明中药制剂组与模型组比较空腹血糖均有统计学差异,本发明中药制剂组剂量与降糖效果存在量效关系;给予药物处理5周后,阳性药物和本发明中药制剂组与模型组比较空腹血糖均有统计学差异,本发明中药制剂组剂量与降糖效果存在量效关系。本发明中药制剂高剂量组在给药2周后与模型组空腹血糖有差异,中、低剂量组在给药4周后与模型组空腹血糖有差异。高剂量组在给药2周后血糖值接近正常(低于13.9mmol/L),此后空腹血糖一直维持在此水平。低剂量组随着给药时间的延长,降糖效果逐渐加强,在第四周与模型组比较有统计学差异。结果见表15:
表15二甲双胍和本发明的中药制剂对db/db小鼠空腹血糖的影响(mmol/L,n=5)
*,p<0.05;**,p<0.01,和同时间点db/db模型组比较。
5.3对db/db小鼠葡萄糖耐量的影响
结果表明,与C57正常对照组比较,模型组不同时间点的血糖均显著升高。给药组服用葡萄糖后各时间点血糖值均升高,与模型组比较有降低趋势,均但无统计学差异,见表16:
表16二甲双胍和本发明的中药制剂对db/db小鼠葡萄糖耐量的影响(不同时间点血糖值,mmol/L,n=5)
*,p<0.05,与正常对照组比较。#,p<0.05;##,p<0.01,与模型组比较。
与C57正常对照组比较,模型组服用葡萄糖后血糖-时间曲线下面积(AUC)均显著升高。与模型组 比较,给药组服用葡萄糖后血糖-时间曲线下面积(AUC)降低,与模型组比较有统计学差异,见表17:
表17二甲双胍和本发明的中药制剂对db/db小鼠葡萄糖耐量的影响(曲线下面积,AUC,min·mmol/L,n=5)
*,p<0.05,与正常对照组比较;#,p<0.05;##,p<0.01,与模型组比较。
5.4对db/db小鼠血清胰岛素的影响
结果表明,与C57正常对照组比较,db/db小鼠模型组血清胰岛素下降,但没有显著性差异,与db/db小鼠模型组比较,给药组可以增加血清胰岛素,但没有显著性差异,见表18:
表18二甲双胍和本发明的中药制剂对db/db小鼠血清胰岛素的影响(n=5)
5.5对db/db小鼠血脂四项的影响
结果表明,与C57正常对照组比较,db/db小鼠模型组CHO下降,TG升高趋势明显,但没有显著性差异;与db/db小鼠比较,给药组TG下降趋势明显,没有显著性差异;其他指标变化不明显,见表19:
表19二甲双胍和本发明的中药制剂对血脂四项的影响(n=5)
6.结论
给予药物处理5周后,与模型组比较,阳性药物和本发明中药制剂组空腹血糖显著降低;本发明中药制剂组剂量与降糖效果存在量效关系。本发明中药制剂高剂量组在给药2周后,与模型组比较,空腹血糖显著降低;中、低剂量组在给药4周后空腹血糖显著低于模型组。高剂量组在给药2周后空腹血糖值接近正常(低于13.9mmol/L),此后空腹血糖一直维持在此水平。低剂量组随着给药时间的延长,降糖效果逐渐显现,在第四周空腹血糖显著低于模型组。在此模型(db/db)上,本发明中药制剂表现出降糖和改善糖耐量的效果,较高剂量较早出现降糖效果,低剂量给药一定时间(4周)也表现出较好的降糖效果,该药物表现出现持续的降糖作用。本发明中药制剂对db/db小鼠血清胰岛素、血脂四项的影响试验中,对血清胰岛素有升高趋势,TG有降低趋势,由于动物数量较少,与db/db小鼠模型比较,本发明中药制剂的效果无显著性差异。
通过上述试验结果初步证明本发明的中药制剂具有较好的降血糖作用,高剂量组略优于二甲双胍组,同时对于糖耐量有显著的改善作用;因而该中药制剂具有较好的开发前景。
二、本发明的中药制剂对2型糖尿病大鼠降糖作用的实验研究
1.材料与方法
1.1材料
1.1.1动物 清洁级雄性SD大鼠,体重150~180g,购于重庆腾鑫比尔实验动物销售有限公司,动物许可证号SCXK(渝),2012-0006。
1.1.2药品及试剂
1.1.2.1本发明的中药制剂:由贵州百灵企业集团制药股份有限公司提供(以下简称TNTL),成人临床剂量为0.045g/kg,大鼠等效剂量与人换算为7倍人用临床剂量。临用时将中药制剂的内容物(褐色粉末)取出用纯水配制。试验时大鼠TNTL低剂量组为0.63g/kg(二倍临床剂量),高剂量组为1.26g/kg(四倍临床剂量)。
1.1.2.2链脲佐菌素(Streptozotocin STZ),北京博奥拓达科技有限公司,批号:040M1367。
1.1.2.3大鼠胰岛素试剂盒:Manufactured by Mercodia AB,Sylveniusgatan 8A,SE-754 50 Uppsala,Sweden。批号:20518,用时按说明书操作。
1.1.2.4大鼠C肽试剂盒:上海蓝基科技有限公司,批号:20130617。用时按说明书操作。
1.1.2.5二甲双胍:为天安牌盐酸二甲双胍肠溶片,成人临床剂量为每日0.03g/kg,换算为大鼠等效量0.21g/kg。
1.1.2.6普通饲料,购于重庆腾鑫比尔实验动物销售有限公司。
1.1.2.7高脂高糖饲料制作:白砂糖、猪油、鸡蛋均购于超市,鸡蛋煮熟只用蛋黄,普通饲料打碎成粉。饲料配方:每100g高脂饲料中含普通饲料35g(重庆滕鑫比尔实验动物销售有限公司),猪油15g、白砂糖25g、鸡蛋黄25g、饲喂动物20天。
1.2动物分组及给药方法
1.2.1预先给予TNTL对Ⅱ型糖尿病大鼠的影响试验:大鼠分为3组,分别为正常组、模型组、TNTL组。正常组给予普通饲料,模型组和TNTL组高脂高糖饲料喂养,同时TNTL组每天灌胃给予本发明的中药制剂(0.63g/kg,1次/天),20天后,模型组和TNTL组腹腔注射STZ(临用时以柠檬酸盐缓冲液配制,pH值4.2,30mg/kg,在30分钟内完成注射),制造糖尿病模型,筛选出造模成功的大鼠用普通饲料喂养12天(TNTL组全程给药32天)。
1.2.2TNTL对2型糖尿病大鼠的影响试验:大鼠分成5组,正常组、模型组、二甲双胍组、TNTL低剂量组、TNTL高剂量组。正常组给予普通饲料,其他4组高脂高糖饲料喂养20天后造模(同上),造模成功的大鼠改用普通饲料喂养,同时各组开始给药,2次/d,上、下午各1次。二甲双胍组ig 0.21g/kg,TNTL低剂量ig 0.63g/kg,(二倍临床剂量),TNTL高剂量ig 1.26g/kg(四倍临床剂量)。全程给药27天。
1.2.3TNTL与西药联合使用对2型糖尿病大鼠和正常大鼠的影响试验:大鼠分成4组,正常组、模型组、二甲双胍+TNTL低剂量组、正常+TNTL高剂量组。正常组和正常+TNTL高剂量组给予普通饲料,模型组、二甲双胍+TNTL低剂量组高脂饲料喂养20天后造模(同上),筛选造模成功的大鼠改用普通饲料喂养,同时各组开始给药,2次/d,上、下午各1次。二甲双胍+TNTL低剂量组先给二甲双胍27天(ig,0.21g/kg),然后换成TNTL低剂量(ig,0.63g/kg,二倍临床剂量)21天。正常+TNTL高剂量组给TNTL高剂量(ig,1.26g/kg,四倍临床剂量)21天。
1.3检测方法及仪器
1.3.1胰岛素、C肽均用ELISA法检测,检测仪器Biotek Synergy 2荧光酶标仪,美国Biotek公司产品。
1.3.2血糖检测仪及试纸:美国罗氏产品,ACCU-CHEK Pertorma。
1.4病理切片检查大鼠空腹16小时后,断头处死,取胰腺置于中性甲醛液中固定保存,做病理检测。该项检测在贵阳中医学院第二附属医院病理科完成。根据胰腺被损伤后的萎缩程度将其分成正常和萎缩,按每组萎缩和正常的只数进行统计学(卡方)检验处理。
1.5统计方法:使用SPSS17.0统计软件,计量资料以表达,计数资料以百分比表达,组后计量资料以T检验比较,计数资料以卡方检验比较。
2.结果
2.1预先给予TNTL对Ⅱ型糖尿病大鼠的影响
2.1.1糖耐量:大鼠空腹16小时后,给予葡萄糖溶液(灌胃,20g/100mL,3mL/只),测定大鼠的空腹、1h、2h、3h血糖值,结果见表20、图4:
表20预先给本发明的中药制剂对2型糖尿病大鼠糖耐量的影响
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01
由表20、图4可知,TNTL组3h的血糖值明显低于模型组(P<0.05),其他两时间点亦有降低。
2.1.2胰腺组织病理切片检查
病理检测结果提示,预先给TNTL组较模型组胰腺病理损伤明显减轻。见表21、图5-图7:
表21预先给本发明的中药制剂对2型糖尿病大鼠胰腺的影响(单位:只)
注:与正常组比较,*p<0.05;与模型组比较,#p<0.05
2.2TNTL对2型糖尿病大鼠的影响
2.2.1体重
TNTL可显著改善糖尿病大鼠降低的体重,结果见表22、图8:
表22本发明的中药制剂对2型糖尿病大鼠体重的影响
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01
2.2.2糖耐量
大鼠空腹16小时后,给予葡萄糖溶液(灌胃,20g/100mL,3mL/只),使用罗氏血糖仪测定空腹、1h、2h、3h血糖值。结果见表23、图9:
表23本发明的中药制剂对2型糖尿病大鼠糖耐量的影响
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01
由表23、图9可知,各组大鼠的空腹血糖没有显著差异,TNTL低剂量和高剂量各时间点的血糖值均低于模型组,差异有显著意义(p<0.01),但是与正常组尚有差异。中药TNTL低剂量组与中药TNTL高剂量组间无显著性差异。
2.2.3胰岛素和C肽
大鼠空腹16小时后,取血离心取上清,使用大鼠胰岛素ELISA试剂盒(Mercodia)、大鼠C肽ELISA试剂盒(BluGene),检测450nm波长处的OD值,结果见表24:
表24本发明的中药制剂对2型糖尿病大鼠空腹胰岛素、C肽的影响
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01
由表24所示,模型组的胰岛素显著低于正常组,TNTL高、低剂量组胰岛素较模型组有增加趋势,但仍明显低于正常组。C肽结果显示,模型组有所降低,TNTL高、低剂量组较模型组有轻度增高趋势。
2.2.4胰腺病理检查
采集胰腺置于中性甲醛液中固定保存,病理切片检查,结果见表25、图10-图14:
表25本发明的中药制剂对2型糖尿病胰腺的影响(单位:只)
注:与正常组比较,*p<0.05;与模型组比较,#p<0.05
2.3 TNTL与二甲双胍联合使用对2型糖尿病大鼠的影响
2.3.1糖耐量:
大鼠空腹16小时后,给予葡萄糖溶液(灌胃,20g/100mL,3mL/只),测定大鼠的空腹、1h、2h、3h血糖值。结果见表26、图15:
表26联合用药对2型糖尿病大鼠糖耐量的影响
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05,##p<0.01
由表26、图15可知,二甲双胍+TNTL低剂量组空腹血糖显著低于模型组,正常+TNTL高剂量组与正常组糖耐量值没有差异,说明该TNTL对正常血糖值没有影响。
2.3.2胰腺病理检查
采集胰腺置于中性甲醛液中固定保存,做病理检测,结果见表27、图16-图19:
表27联合用药对大鼠胰腺病理切片检查的影响(单位:只)
注:与正常组比较,*p<0.05
该项试验前3组做比较,结果二甲双胍+TNTL低剂量组对大鼠胰岛有一定保护作用,但没有统计学意义。正常+TNTL高剂量组与正常组比较,两组间没有差异性,高剂量的TNTL对正常大鼠胰腺没有影响。
结论:
本实验用雄性SD大鼠,以高热卡饲喂加半量链脲佐菌素部分破坏胰岛B细胞的经典方法,成功地构建了2型糖尿病大鼠模型。
本研究发现,无论是以预先给药的方法还是常规治疗给药的方法,无论是单独给药的方法还是与二甲双胍联合给药的方法,无论是以糖耐量观察还是以常规血糖观察,TNTL皆能明显降低2型糖尿病大鼠血糖(P值均<0.05),表明TNTL具明显降糖作用。
本研究还发现,TNTL作用于2型糖尿病大鼠后,在血糖明显降低的同时,其空腹胰岛素和C肽并无明显改变,提示此降糖作用机制不一定是胰岛B细胞促泌作用,可能与改善胰岛素抵抗(IR)等因素有关。
本研究观察了TNTL作用后的胰腺病理学变化,发现其萎缩数明显低于未经TNTL作用的模型组(P<0.05),表明TNTL对2型糖尿病大鼠具一定程度的胰岛保护作用。
本研究将TNTL作用于正常SD大鼠,其结果发现正常SD大鼠的血糖在TNTL作用前后无变化,其胰腺亦无病理变化,表明TNTL对正常大鼠无血糖影响,对其胰岛亦无明显影响。此结果也进一步提示TNTL的降糖作用可能不是主要通过促进胰岛B细胞分泌胰岛素来实现的。
实验例7:急性毒性试验
1.1药物
本发明的中药制剂,由贵州百灵企业集团制药股份有限公司提供,批号:20130106。临用时用蒸馏水配制成所需浓度的混悬液灌胃给药。
1.2动物
昆明种小鼠,雌雄各半,体重20±2g,由中国人民解放军第三军医大学实验动物中心提供,合格证号:SCXK(渝)2012-0003。
1.3饲料
饲料为全价颗粒饲料,由上述单位提供。
1.4动物实验场所
贵阳中医学院药理毒理实验室通风良好,清洁卫生,温度、湿度均达到新药药理研究要求。
1.5主要仪器
ALC-210.3型电子天平,上海良平仪器仪表有限公司。
1.6统计学处理
数据采用组间比较差异性,以表示,进行t检验。
2实验方法与结果
2.1预试试验
以最大浓度23%的本发明的中药制剂水溶液,0.3ml/10g体重一次灌胃给予小鼠,观察7天。结果:未见动物死亡,表明不能测定其LD50,故测定本发明的中药制剂的最大给药量。
2.2正式试验
取昆明种小鼠40只,随机分成空白对照组、本发明的中药制剂组,每组20只,雌雄各半。实验前禁食不禁水12h,本发明的中药制剂组灌胃给予小鼠23%的本发明的中药制剂水溶液0.3ml/10g体重,一日二次,相当于13.8g/kg体重,为临床拟用剂量0.0345g/kg体重的400倍;空白对照组以相同量的生理盐水灌胃,一日二次。给药后连续观察14d,记录动物有无毒性反应以及实验前后体重变化,以不产生死亡的剂量为最大给药量。
结果:昆明种小鼠灌胃本发明的中药制剂水溶液13.8g/kg后,发育健康,肌肉丰满,被毛密而有光泽,眼睛明亮而灵活、无异常的分泌物,肛周洁净,摄食正常,四肢健壮,自发活动正常,观察期内体重逐渐增加,与空白对照组比较无明显差异。14d内未见动物死亡及毒副反应。实验结束时肉眼尸解未见明显病理改变。实验结果见表28:
表28本发明的中药制剂对小鼠体重(g)的影响(n=10)
注:本发明的中药制剂组雌性与空白对照组雌性比较P>0.05;本发明的中药制剂组雄性与空白对照组雄性比较P>0.05。
结论:昆明种小鼠灌胃本发明的中药制剂,以最大浓度0.23g/ml,给药容积0.3ml/10g体重,一日二次给药,相当于13.8g/kg体重,为临床拟用剂量的400倍。根据文献报道“一般认为按体重计算小鼠的最大耐受量相当于人用量100倍以上则较安全”,因此,可以认为本发明的中药制剂对动物的急性毒性甚小,安全,可以提供临床试用;此外,发明人还对本发明的中药制剂进行了长期毒性试验,试验结果也表明本发明的中药制剂毒性较小,临床使用较安全。
实验例8长期毒性试验
1.目的
观察较大剂量、较长时间、连续给予大鼠重复灌胃本发明的中药制剂12周、24周及停药4周对大鼠所产生毒性反应,严重程度及首先出现的症状;观察毒性反应的靶器官恢复和发展情况,确定无毒反应剂量,为拟定人用安全剂量提供依据。
2.实验材料
2.1药物
本发明的中药制剂,由贵州百灵企业集团制药股份有限公司提供,批号:20130106。功能主治:养阴通脉、生津止渴、清热泻火。用于气阴两虚所致的消渴病,症见口渴喜饮、多食、多尿、消瘦、气短、乏力、眠差、腰痛、手足心热;2型糖尿病见上述证候者。剂型:胶囊剂。用法用量:口服,一日3次,一次3-4粒;饭前服用。规格:每粒胶囊重0.3g,相当于生药量1.73g。成人体重按照60kg计算,则临床拟定成人日用量为0.0345g/kg体重,相当于0.19895g生药量/kg体重。
临用时用蒸馏水配制成所需浓度的混悬液灌胃给药。
2.2动物
SD大鼠,雌雄各半,120只,体重100g±20g,由中国人民解放军第三军医大学实验动物中心提供,合格证号:SCXK(渝)2012-0003。
2.3主要仪器
JY601型电子天平,上海良平仪器仪表有限公司;OLYMPUS BH-2显微镜,日本;SC-970全自动血 细胞分析仪,瑞士贝肯公司;日立7170A全自动生化分析仪,美国柯达;HPIAS-1000高清晰度彩色图文病理分析系统、光镜。
2.4实验数据统计
实验数据以表示,进行组间t检验。
3实验方法
3.1实验条件
给药前后的大鼠均单性别每笼5只群养,以全价颗粒饲料喂养,自由饮水,室温20℃~23℃,湿度55%~65%。给药前先适应环境,观察7天大鼠一般状况,无异常变化,再开始分组给药进行试验。
3.2分组和剂量
SD大鼠120只,雌雄各半,随机分为4组,每组30只,分别作为本发明的中药制剂高、中、低三个剂量组及空白对照组。给药组剂量分别为2.07g、1.035g、0.5175g/kg体重,给药浓度分别为20.7%、10.35%、5.175%,即为该制剂拟定临床成人日用剂量0.0345g/kg体重的60倍、30倍、15倍。给药容积为10ml/kg体重。
3.3给药途径及方法
因为本发明的中药制剂临床给药途径是口服给药,所以各组动物均灌胃给药。每日上午8-10时灌胃给药一次,给药容积为10ml/kg体重,连续24周;每天观察动物一般状况,每周记录各组动物体重及进食量一次,根据动物体重增长变化,调整给药量。
3.4试验周期
试验总周期为28周,前24周为给药时间,后4周停药,分别观察动物不同时间有否毒性反应。给药期,分别于给药12周、24周时,于末次给药后禁食不禁水12小时,每组取10只动物(雌雄各半)称重后股静脉取血,测定动物血液细胞学、血液生化学,同时处死动物进行系统尸解,观察动物各脏器组织有无充血、肿大、出血等异常变化后,再取各鼠主要脏器分别称重,计算脏器系数后及其他脏器组织标本仔细剥离周围脂肪组织等浸入10%甲醛固定,进行病理组织形态学检查。停药期,其余动物停药常规饲养4周,每天进行一般状况观察,每周记体重及进食量,禁食不禁饮12小时处死动物,检测上述各项指标。
4检查项目
4.1一般观察
每日观察各组动物的外观形态体征、行为活动、毛发光泽、进食、饮水、大便性状等;发现中毒动物立即隔离,重点观察;发现死亡或濒死动物,即刻尸检。每周称动物体重,据此调整给药量,同时记录各组动物饲料消耗量。
4.2检测项目
4.2.1血液细胞学检查指标
白细胞(WBC)、中性粒细胞总数(#NEUT)、淋巴细胞绝对值(#LYMPH)、单核细胞计数(MONO#)、嗜酸细胞数(#EOS)、嗜碱细胞数(#BASO)、红细胞分布宽度(RDW)、中性粒细胞百分比(%NEUT)、淋巴细胞百分比(%LYMPH)、单核细胞百分比(%MONO)、嗜酸细胞百分比(%EOS)、嗜碱细胞百分比(%BASO)、红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、红细胞平均血红蛋白量(MCH)、红细胞平均血红蛋白浓度(MCHC)、血小板(PLT)、平均血小板容积(MPV)。
4.2.2血液生化学检查指标
钾(K)、钠(Na)、氯(CL)、葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(CHOL)、尿素氮(BUN)、肌酐(CREA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)、肌酸激酶(CK)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、总胆红素(TBIL)。
4.2.3主要器官组织标本
心、肝、脾、肺、肾、肾上腺、胸腺、大脑、子宫、卵巢、睾丸、附睾,分别称重,计算器官系数;再于心、肝、脾、肺、肾、肾上腺、胸腺、脑组织、甲状腺、垂体、气管、食管、胃、肠、膀胱、胰腺、淋巴结、视神经等脏器同一部位取材进行石蜡包埋,切片,HE染色;置光学显微镜观察并与空白对照组进行脏器病理组织比较。先对比检查高剂量组与空白对照组动物组织形态病理变化,中剂量组及低剂量组动物器官组织标本10%甲醛固定备查。
4.2.4病理学检查
进行尸析,并将主要的器官和组织用10%甲醛固定、保存。当各剂量组动物尸析未发现明显病变时只进行高剂量组和空白对照组动物的组织病理学检查。如发现病变再对中、低剂量组动物进行相应的检查。
4.3指标观察时间
每天全面观察所有实验动物的一般状况,动物活动行为,大便性状,外观体征,饲料一周的消耗量; 每周称体重一次;给药12周、24周末次药后12小时及停药4周恢复期末,各进行一次上述项目全面检查。
5实验结果
5.1本发明的中药制剂对大鼠一般情况及进食的影响
在连续给药12周、24周及停药4周内,将各给药组与空白对照组比较,观察动物活动、行为、饮食、大便、毛发光泽等,4组动物情况相似,未见明显异常变化。在同一时间内大鼠摄食量亦无明显差异。结果见表29、表30:
表29本发明的中药制剂连续给药12周、24周及停药4周期间对雌性大鼠周平均进食量(g)的影响
注:不同时间点,各给药组与空白对照组比较,P>0.05。
表30本发明的中药制剂连续给药12周、24周及停药4周期间对雄性大鼠周平均进食量(g)的影响
注:不同时间点,各给药组与空白对照组比较,P>0.05。
结果表明,各组动物周消耗食量均呈逐渐增加趋势,各给药组与空白对照组比较,无明显差异,P>0.05。表明大鼠连续灌胃给药12周、24周及停药4周,对雌雄大鼠食物周消耗量无明显影响。
5.2本发明的中药制剂对大鼠体重的影响
本发明的中药制剂高、中、低三种剂量对大鼠连续给药不同时间后的体重与空白对照组比较,其差异无明显变化,结果见表31、表32。
表31本发明的中药制剂长期连续给药12周、24周及停药4周期间对雌性大鼠体重(g)的影响
注:各给药组与空白对照组比较,P>0.05;0周为药前期,n=15;1-12周为给药期1,n=15;13-24周为给药期2,n=10;25-28周为停药期,n=5。
表32本发明的中药制剂长期连续给药12周、24周及停药4周期间对雄性大鼠体重(g)的影响
注:各给药组与空白对照组比较,P>0.05;0周为药前期,n=15;1-12周为给药期1,n=15;13-24周为给药期2,n=10;25-28周为停药期,n=5。
结果表明,观察期内,各组雌雄大鼠体重均逐渐增加,生长发育良好;各给药组与同时间段空白对照组相比,各时间点体重与空白对照组相比无明显差异,P>0.05。表明大鼠连续灌胃给药12周、24周及停药4周,对雌雄大鼠体重无明显毒性影响。
5.3本发明的中药制剂对大鼠血液细胞学影响
本发明的中药制剂给大鼠灌胃给药12周、24周和停药4周,各组动物血液学指标检测结果见表33~35。
表33本发明的中药制剂连续给药12周对大鼠血液细胞学指标的影响(n=10)
注:各给药组动物血液细胞学各项指标数值分别与空白对照组相应指标数值比较,P>0.05。
表34本发明的中药制剂连续给药24周对大鼠血液细胞学指标的影响(n=10)
注:各给药组动物血液细胞学各项指标数值分别与空白对照组相应指标数值比较,P>0.05。
表35本发明的中药制剂停药4周对大鼠血液细胞学指标的影响(n=10)
注:各给药组动物血液细胞学各项指标数值分别与空白对照组相应指标数值比较,P>0.05。
结果表明,本发明的中药制剂高、中、低三种剂量连续给药12周、24周及停药4周,对大鼠的血细胞均未见显著影响,经统计学处理,P>0.05。因此,可以认为本发明的中药制剂较大剂量、较长时间(24周)给药及停药4周,对大鼠的造血功能无显著的毒性影响。
5.4本发明的中药制剂对大鼠血液生化学的影响
本发明的中药制剂给大鼠灌胃给药12周、24周和停药4周,各组动物血液生化学指标检测结果见表36、表37、表38。
表36本发明的中药制剂连续给药12周对大鼠血液生化学指标的影响(n=10)
注:各给药组动物血液细胞学各项指标数值分别与空白对照组相应指标数值比较,P>0.05。
表37本发明的中药制剂连续给药24周对大鼠血液生化学指标的影响(n=10)
注:各给药组动物血液细胞学各项指标数值分别与空白对照组相应指标数值比较,P>0.05。
表38本发明的中药制剂停药4周对大鼠血液生化学指标的影响(n=10)
注:各给药组动物血液细胞学各项指标数值分别与空白对照组相应指标数值比较,P>0.05。
结果表明,本发明的中药制剂高、中、低三种剂量连续给药12周、24周及停药4周,对大鼠的血液生化指标均未见显著影响,大鼠的肝功能及肾功能等各项生化指标数值分别与空白对照组相应数值相比较,未见明显差异,P>0.05;故表明本发明的中药制剂较大剂量连续给药12周、24周及停药4周对大鼠肝功能、肾功能等指标均无显著毒性作用。
5.5本发明的中药制剂对大鼠主要器官指数的影响
本发明的中药制剂给大鼠灌胃给药12周、24周和停药4周,系统尸体解剖:大脑、心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、胸腺、甲状腺、胃、肠、睾丸、附睾、前列腺、子宫、卵巢等脏器的形态、大小、颜色均未发现肉眼可见的变化。各组动物主要脏器指数检测结果见表39,表40,表41,表42,表43,表44。
表39本发明的中药制剂连续给药12周对雌性大鼠主要脏器指数(g/100g)的影响(n=5)
注:各给药组动物各脏器指数值分别与空白对照组相应指数值比较,P>0.05。
表40本发明的中药制剂连续给药24周对雌性大鼠主要脏器指数(g/100g)的影响(n=5)
注:各给药组动物各脏器指数值分别与空白对照组相应指数值比较,P>0.05。
表41本发明的中药制剂停药4周对雌性大鼠主要脏器指数(g/100g)的影响(n=5)
注:各给药组动物各脏器指数值分别与空白对照组相应指数值比较,P>0.05。
表42本发明的中药制剂连续给药12周对雄性大鼠主要脏器指数(g/100g)的影响(n=5)
注:各给药组动物各脏器指数值分别与空白对照组相应指数值比较,P>0.05。
表43本发明的中药制剂连续给药24周对雄性大鼠主要脏器指数(g/100g)的影响(n=5)
注:各给药组动物各脏器指数值分别与空白对照组相应指数值比较,P>0.05。
表44本发明的中药制剂停药4周对雄性大鼠主要脏器指数(g/100g)的影响(n=5)
注:各给药组动物各脏器指数值分别与空白对照组相应指数值比较,P>0.05。
结果表明,本发明的中药制剂高、中、低三种剂量连续给药12周、24周及停药4周,对大鼠主要脏器组织未见明显的毒性影响,各给药组大鼠各项脏器指数与空白对照组相比均无显著差异,P>0.05;故表明本发明的中药制剂较大剂量连续给药12周、24周及停药4周对大鼠各脏器组织无显著毒性作用。
5.6本发明的中药制剂对大鼠重要脏器组织器官病理形态的影响
对本发明的中药制剂连续给药12周、24周,以及停药4周的高、中、低三种剂量组及空白对照组三批次,杀取大鼠并解剖出各组大鼠的心、肝、脾、肺、肾、肾上腺、胸腺、大脑、子宫、卵巢、睾丸、附睾、前列腺、甲状腺、气管、食管、胃、主动脉、十二指肠、结肠、膀胱、胰腺、淋巴结、视神经、坐骨神经等组织器官,在相同部位取材,用10%甲醛溶液固定。将本发明的中药制剂高剂量组及空白对照组大鼠脏器标本进行组织切片,进行病理学检查,其余标本保留以备用。结果:经对两组动物脏器标本检查,各种器官组织结构基本正常,细胞染色均匀,无明显改变。由于本发明的中药制剂高剂量组动物被检查的器官组织未出现药物致病理改变,故对本发明的中药制剂中剂量组及低剂量组未进行器官组织切片。被检器官组织形态切片照片及病理切片报告附后。
病理观察结果表明,各给药组大鼠诸多脏器的组织细胞无损害,形态学上提示该药物对各脏器组织无毒性作用。
6.结论
大鼠长期毒性试验结果表明,以本发明的中药制剂2.07g/kg、1.035g/kg、0.5175g/kg,相当于临床成人日剂量0.0345g/kg体重的60倍、30倍、15倍,每日一次,连续12周、24周大鼠灌胃给药及停药4周,与空白对照组比较;各个剂量给药对大鼠的一般状态(外观形态、活动、大便形状等),生长发育(体重增长),造血功能(血液学检查),肝、肾功能(血液生化学),重要器官重量指数,均未发现有明显的毒性作用;经病理学检查证明,本发明的中药制剂高剂量组与空白对照组比较观察,对大鼠心、肝、脾、肺、肾、肾上腺、胸腺、大脑、子宫、卵巢、睾丸、附睾、前列腺、甲状腺、气管、食管、胃、主动脉、十二指肠、结肠、膀胱、胰腺、淋巴结、视神经、坐骨神经等组织器官均未发现明显的毒性损伤变化。由于本发明的中药制剂高剂量组动物各组织器官未出现明显病理变化,故对本发明的中药制剂中剂量组、低剂量组未进行器官组织切片检测,其标本保存备用。所以可以认为较大剂量、较长时间口服给予本发明的中药制剂的毒性较低,临床使用安全。
由治疗糖尿病的中药制剂制成的片剂的实验过程:
本品薄膜衣片具有片剂美观,标志更清晰,不易冒仿,体积更小,更易吞咽,方便携带的优点,计量更准确的优势。在不改变原提取工艺、干燥工艺及给药途径的条件下特对其进行了研究,增加本品不含糖的薄膜衣片剂,弥补临床上糖宁通络片的剂型空白,更好地服务于患者。
提取工艺研究实验:
为使处方中药材的成份尽量提取出来,以出膏率为考察指标,对药材的炮制长度、加水量,浸泡时间、煎煮时间、煎煮次数分别进行考察,其结果如下:
(1)处方中药材的炮制长度对出膏率的影响
将车前草、仙鹤草炮制成不同长度,山银花的饮片和科夭罗曲直接投料,称取处方量药材,用10倍量水将药材浸润30分钟,煎煮2次,每次2小时,过滤,合并滤液,浓缩,进行出膏率测定,结果见表51:
表51药材炮制长度对出膏率的影响
由表51可知:药材粗粉的出膏率最高,但药材粗粉提取后药液难于过滤,实验时所用机械的方法榨干药渣,并不适于大工业生产;而切制成1.0cm段的出膏率与其相近,故将车前草、仙鹤草切制成1.0cm段进行提取为佳。
(2)浸泡时间对出膏率的影响
将车前草、仙鹤草炮制成1.0cm段,山银花的饮片和科夭罗曲直接投料,称取处方量药材,用10倍量水将药材浸润不同时间,然后用个筛子把水过滤掉,称取药材的重量,进行吸湿率(湿重减去干重除以药材干重即为吸湿率)测定,结果见表52所示:
表52不同浸泡时间对出膏率的影响
由上表可见,药材浸润30分钟后,吸水率几乎不再增加,从节约时间和成本考虑,以浸润30分钟为佳。
(3)不同的加水量、煎煮时间和提取次数对出膏率的影响
将车前草、仙鹤草炮制成1.0cm段,山银花的饮片和科夭罗曲直接投料,称取处方量药材,用不同的加水量,浸泡30分钟,用不同的煎煮时间和提取次数提取,过滤,滤液,浓缩,进行出膏率测定,具体以下表53中的方案进行考察,试验结果如表54所示:
表53不同的提取方案
表54不同提取方案对浸膏收率的影响
由表53、表54可知:处方药材提取2次,第一次加8倍量水浸泡30分钟,煎煮2小时,第二次加6倍量水煎煮1小时后,浸膏收率几乎不再增加,从节约能源和时间成本考虑,以车前草、仙鹤草炮制成1.0cm段,山银花的饮片和科夭罗曲直接投料,称取处方量药材,煎煮2次,第一次用8倍量水将药材浸润30分钟,煎煮2小时;第二次用6倍量水煎煮1小时,过滤,合并滤液的工艺为佳。
所述的出膏率测定的具体方法为:取浓缩至相对密度为1.2~1.3(测定温度60℃)的清膏,转移并定容至1000ml容量瓶中,摇匀;精密量取20ml,分别置于已恒重的蒸发皿中,水浴挥干,残渣于105℃干燥3小时,取出,置干燥器中放置30分钟,称重,计算。
实验例3:过滤、浓缩及干燥工艺研究
3.1过滤工艺研究:
粗提液试验中采用滤过(300目滤布)法进行,结合生产设备条件,考察了用离心机离心和板框过滤两种方案:
离心方案:取粗提液经离心机3000/min离心1分钟、2分钟、3分钟、5分钟、观察离心效果,离心2分钟以上时,上清液明显变清和沉淀分离良好。
板框过滤方案:取粗提液经5块、8块、10块过滤板过滤,取过滤液经离心机3000/min离心2分钟,观察沉淀的多少,发现粗提液经10块过滤板过滤后,几乎没有沉淀。
从简便省时,节省能源的角度考虑用粗提液经10块过滤板过滤的方案较好。
3.2浓缩工艺研究:
结合工业生产条件,有敞口倾倒式夹层蒸锅和三效减压浓缩设备,
为防止有效成分长时间受热破坏,采用三效减压浓缩设备进行浓缩。合并的滤液减压浓缩成相对密度为1.2~1.3的清膏,测量温度60℃。
减压浓缩条件:温度为65~75℃,真空度为0.04~0.06Mpa,温度和真空度高出上限提取液会爆沸,低于下限耗时较长。
3.3干燥工艺研究:结合工业生产条件,有常压干燥和减压干燥设备,为使生产周期缩短,选用减压干燥。
干燥条件:
采用温度为65~75℃,真空度为0.07~0.09Mpa进行减压干燥。温度和真空度过高会起泡溢出盘外,污染干燥器,浪费物料。
实验例4:制剂成型工艺研究
4.1辅料种类及用量选择
①、崩解剂种类的筛选
根据预实验的筛选,在本处方药粉与辅料比例恒定的情况下,将药物浸膏粉直接加入不同崩解剂,混匀,压片,以崩解时间为考察指标,测定其崩解时限。
崩解时限的测定:按《中国药典》2010年一部附录ⅫA崩解时限检查法项下薄膜衣片检查要求进行。记录完全崩解时间,结果见表54-1:
表54-1崩解剂种类筛选结果
由上可见:以羧甲基淀粉钠和微晶纤维素的崩解时间较短,故选择羧甲基淀粉钠和微晶纤维素联合应用作为崩解剂。
②助悬剂的筛选
因本品崩解后,即形成粘稠状混悬液,故不必加助悬剂。
③填充剂的筛选
实验中发现,应用多种优质崩解剂,硬度小、崩解均不太理想,因为药物浸膏粉粘性、吸潮性都较强,而常用的崩解剂多有吸湿性,浸膏粉吸潮性增强,粘性增加而使片剂难崩解。因此应选择一种辅料作填充剂以降低浸膏粉的吸湿性及增大水分子的渗入作用,便于制粒及降低崩解剂的用量。实验以羧甲基淀粉钠和微晶纤维素联合作崩解剂,浸膏粉与辅料为2︰1的比例加入不同种类相同量的填充剂,混匀,压片,以崩解时间为考察指标,结果见表54-2:
表54-2:填充剂种类筛选结果
结果表明,预胶化淀粉为填充剂时,片剂崩解时间短,硬度相对较好,故选择预胶化淀粉做填充剂。
④粘合剂的筛选
在药物浸膏粉中加入羧甲淀粉钠、微晶纤维素及预胶化淀粉,压制所得的片子虽然硬度和崩解时限都很好,但外观不光洁,粉性很大,因此考虑选用粘合剂来改善这一状况,实验以浸膏粉占2份,羧甲淀粉钠、微晶纤维素及预胶化淀粉三者等量加入,共占1份,用不同种类不同用量的粘合剂,制粒,压片,以崩解时间、硬度、外观为考察指标,结果见表54-3:
表54-3粘合剂种类筛选结果
结果表明,以用量为物料量55%的淀粉浆(浓度为12%)为粘合剂时,片剂崩解时间短,硬度相对较好,外观光洁。
⑤润滑剂的筛选
在用淀粉浆制成颗粒后,压片时其流动性不是很好,经过预实验,得出用二氧化硅和硬脂酸镁两者比例为1:1配合作润滑剂最佳,以浸膏粉占2份,羧甲淀粉钠、微晶纤维素及预胶化淀粉三者等量加入,共占1份,用物料量55%的淀粉浆(浓度为12%)为粘合剂,制粒,压片,以可压性为考察指标,结果见表54-5:
表54-5润滑剂及用量的筛选实验
其中以加入物料量0.16%的(二氧化硅:硬脂酸镁)1:1作润滑剂可压性为最佳。
⑥崩解剂、填充剂用量的筛选
指标的确定:
颗粒流动性:采用测定休止角的方法测定颗粒的流动性。休止角:
α值越小表明颗粒的流动性越好。
颗粒粒度:根据生产实践颗粒粒度在20-60目之间越大颗粒的可压性越好。测定过20目筛不过60目筛的颗粒重量,并计算重量百分比。
外观的评价:观察片子的完整性,有无裂片,光洁程度,是否粘冲,色泽是否均匀。
片重差异:按《中国药典》2005年版一部(附录ⅠD片剂项下)测定。
硬度:用片剂硬度测试仪测定片子的硬度。
崩解时限:按《中国药典》2005年版一部(附录ⅠD片剂项下)测定。
指标的评价:
可压性非常好:指休止角α小于45度,颗粒粒度20-60目重量百分比大于70%,片子外观完整,光洁,片重差异符合规定。片子硬度大于5Kg;
可压性较好:指休止角α大于45度小于50度,颗粒粒度20-60目重量百分比在60%~70%之间,片子外观完整,光洁,片重差异符合规定。片子硬度在4Kg~5Kg之间;
可压性一般:指休止角α大于50度小于55度,颗粒粒度20-60目重量百分比在50%~60%之间,片子外观完整,但光洁度差,片重差异符合规定,片子硬度大于3~4Kg;
可压性差:指休止角α大于55度小于60度,颗粒粒度20-60目重量百分比大于40%小于50%,片子外观不够完整。片重差异大,片子硬度小于3Kg;
可压性较差:指休止角α大于60度,颗粒粒度20-60目重量百分比小于40%,片子外观不够完整。片重差异较大,片子硬度小于3Kg;
当确定辅料的种类之后,为了保证质量,并使其质量更为优良,应对各种辅料的用量进行筛选。采用正交实验的方法,根据预实验的结果确定各因素的不同水平,见表54-6:
表54-6综合评价实验水品的建立
按照L9(34)实验,将药粉(按药材提取出干膏率20.30%计)加入适当比例的辅料混匀,用物料量55%的淀粉浆(浓度为12%)为粘合剂,制粒,加入优选用量的润滑剂,压片,以可压性为考察指标,进行评价。正交实验结果:见表54-7:
表54-7正交实验结果
X1、X2、X3分别为各因素下不同水平的3次结果均值。
表54-8正交设计方差分析表:
*P<0.05
由表54-8可见,根据数字愈小愈好各因素影响的顺序为C>A>B,即微晶纤维素具有海绵状的多孔管状结构,受压时其多孔结构由杂乱无章变为线性排列,使水分子容易进入片剂内部,协助崩解,微晶纤维素的加入对实验结果影响最大;羧甲淀粉钠具有良好的亲水性、吸水性和膨胀性,膨胀本身体积的200~300倍,崩解效果优越,提高片子的可压性,压得的片子的硬度增加,外观光洁,没有出现粉性的情况。最佳处方组成A2B2C2,即羧甲淀粉钠占药粉量1.67%,预胶化淀粉占药粉量的2.9%,微晶纤维素为药粉量的15.67%,其它辅料适量。
4.2颗粒物理性质研究
①性状:本品颗粒为棕色至棕褐色,气微,味苦。
②堆密度:称取一定重量合格颗粒,装入10ml量筒中,以一定高度落下数次(尽可能控制条件一致),使松紧适度,以重量除以容积得堆密度,结果见表54-9。
表54-9颗粒堆密度测定结果
③休止角的测定:取合格颗粒经漏斗流下并呈圆锥体状,测定其休止角,结果见表54-10。
表54-10颗粒休止角
颗粒的休止角低于45.0°,具有良好的流动性,适合于压片的要求。
④颗粒的临界相对湿度测定
表54-11不同溶液的相对湿度表
表54-12临界相对湿度测定数据
由吸湿曲线求得,临界相对湿度约为58%。结合生产,在打粉、混合、填充及贮存时应将相对湿度控制在55%以下,以减少水分对药物性质及稳定性的影响。
4.3压片工艺研究
4.3.1颗粒水分的选择
颗粒水分影响片子质量,含水量适当的颗粒可塑性大,所压成的片剂的硬度较好,颗粒太湿,则易发生粘冲。通过试验,颗粒中的水分控制在4.0~5.5%时,硬度较好,片面光洁,破碎度较好,合格率较高。
4.3.2硬度 在不同的压力下,制得的片子硬度对崩解时间的影响很大,随着片硬度的增加,崩解时间减慢。通过对不同硬度下制得的片子外观和崩解时间结果,见表54-13
表54-13不同硬度下的外观和崩解时间
由此可见,硬度为3~4kg时,崩解时间在40分钟以内,而且表面有光泽,因此确定硬度为3~4kg。
4.3.3压片
根据上述研究结果,制成颗粒,干燥,混匀,调节片重为0.39g,硬度为3~4kg,压制成1000片素片。
4.4包薄膜衣工艺研究
4.4.1薄膜包衣预混剂用量的选择
取4.93kg的纯化水,用搅拌浆搅拌形成旋涡,称取薄膜包衣预混剂1.01kg加入到旋涡侧壁配制成浓度为17%的包衣溶液,持续搅拌45分钟,过60~80目筛待用。取本品素片(批号:20120901,平均片重为0.3915g)19.57kg,约50000片,放入高效包衣机中,升温至40~60℃。用喷枪将包衣溶液喷入旋转的高效包衣机内,控制转速为5~20rpm,片床温度要求在38~45℃,压缩空气0.4~0.5Mpa,直至将包衣材料喷完。关掉热风,将转速降至≤5。待片子冷却后,关掉排风。检测外观、水分≤4%。分别在包衣溶液喷去2.30kg、2.50kg、3.00kg、3.45kg、4.60kg、5.25kg和喷至包衣溶液用完时各取出样品20片,分别记为样品1、样品2、样品3、样品4、样品5、样品6、样品7,置烘箱50℃时恒温干燥8小时,此时取各个样品4片,用快速水分测定仪测得水分为3.5%。剩余的样品对其进行外观和崩解时限进行考察,结果见下表54-14。
表54-14不同用量薄膜包衣预混剂下的外观和崩解时间
由上表中结果可知,50000片本品素片,在喷入浓度为17%的包衣溶液4.60kg及至喷完实验用的包衣溶液后的样品,外观和崩解时限均符合要求。结合生产成本等因素,选取喷浓度为17%的包衣溶液4.60kg为最佳,4.60kg包衣溶液里含17%薄膜包衣预混剂,即782.8g,折合成处方量1000片来计算,薄膜包衣预混剂用量应为15.66g。
4.4.2包衣工艺
取适量的水,用搅拌浆搅拌形成旋涡,称取将薄膜包衣预混剂加入到旋涡侧壁配制成浓度为17%的包衣溶液,持续搅拌45分钟,过60-80目筛待用。素片放入高效包衣机中,升温至40-60℃。用喷枪将包衣溶液喷入旋转的高效包衣机中,控制转速为5-20rpm,片床温度要求在38-45℃,压缩空气0.4-0.5Mpa,直至将包衣材料喷完。关掉热风,将转速降至≤5。待片子冷却后,关掉排风。检测外观、水分≤4%,增重4.0%。
实验例5:中试生产试验
按照本发明优选出的提取工艺、过滤、浓缩及干燥工艺、制剂成型工艺,进行中试规模的工艺试验,共投料三批,按100倍处方量进行,三批中试产品检测数据见表56-1、表56-2:
表56-1三批中试试验数据
表56-2三批试制样品检验结果
经过三批次中试生产的验证,结果表明:糖宁通络片的工艺是合理的、可行的。
与现有技术相比,本发明由苗药秘方制成的治疗糖尿病的中药制剂降糖显著,具有更好的治疗效果。本处方来源于民间验方,已有五十多年的使用历史,是通过临床实践总结出的处方,具有固本养阴、化浊通脉、生津止渴之功效,尤其对于气阴两虚所致的糖尿病及并发症具有明显的降糖作用,并且该降糖作用不完全依赖于促进胰岛B细胞分泌;另外,本发明的中药制剂对2型糖尿病具有一定程度的胰岛保护作用,可以改善胰岛素抵抗;其对正常SD大鼠不具降糖作用;此外,本发明的中药制剂质量安全可靠,未发现不良反应及毒副作用。此外,本发明制成的片剂,只有崩解时间较短、硬度相对较好、外表光洁、可压性佳、堆密度佳、减少水分对药物性质及稳定性好等优点。
附图说明
图1是本发明治疗糖尿病的中药制剂的制备工艺流程图;
图2是科夭罗曲的制备工艺流程图;
图3是临界相对湿度测定曲线图;
图4是大鼠空腹16小时后,给予葡萄糖溶液(灌胃,20g/100mL,3mL/只),测定大鼠的空腹、1h、2h、3h血糖值结果曲线;
图5是正常组对Ⅱ型糖尿病大鼠胰腺病理改变示意图;
图6是模型组对Ⅱ型糖尿病大鼠胰腺病理改变示意图;
图7是模型组对Ⅱ型糖尿病大鼠胰腺病理改变示意图;
图8是本发明的中药制剂对Ⅱ型糖尿病大鼠体重的影响示意图;
图9是本发明的中药制剂对2型糖尿病大鼠糖耐量的影响示意图;
图10是正常组大鼠胰腺的切片示意图;
图11是模型组糖尿病大鼠胰腺的切片示意图;
图12是二甲双胍组对糖尿病大鼠胰腺的切片影响示意图;
图13是TNTL低剂量组对糖尿病大鼠胰腺的切片影响示意图;
图14是TNTL高剂量组对糖尿病大鼠胰腺的切片影响示意图;
图15是联合用药对2型糖尿病大鼠糖耐量的影响示意图;
图16是正常组大鼠的胰腺示意图;
图17是模型组大鼠的胰腺示意图;
图18是二甲双胍+TNTL低剂量组联合用药对大鼠胰腺的影响示意图;
图19是正常+TNTL高剂量组对大鼠胰腺的影响示意图;
图20是临界相对湿度测定曲线。
具体实施方式
实施例1:
科夭罗曲的制备方法:将药材新鲜瓜蒌2g、新鲜鸡血藤2g和新鲜垂盆草1g所组成的混合物经压榨取汁后,药渣的干燥细粉再与麦粉2g、麸皮1g混合,加入药汁和水搅匀制成软材,蒸透,保持温度为22℃、湿度为50%,添加曲精发酵25天,取出,干燥,粉碎,即得。所述的新鲜瓜蒌也可以是瓜蒌子、瓜蒌皮和天花粉中的一种或几种。
治疗糖尿病的胶囊剂的制备方法:称取科夭罗曲480g、车前草350g、仙鹤草335g和山银花335g,将车前草和仙鹤草切制成1.0cm段,加8倍量水,浸泡30分钟,煎煮2小时,过滤,取滤液备用;药渣加6倍量水煎煮1小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.2的清膏,于温度65℃、真空度0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,整粒,加入1.13g二氧化硅,混匀,装入胶囊,即制得胶囊剂。服用方法:以生药粉计,3g/次,每日服用3次,每日服用生药粉计9-12g,饭前服用;以胶囊计:由于药材投料量为1500g,出膏率为20.3%,因而计算干膏约304.5g,又辅料二氧化硅1.13g,总计305.63g,制成1000粒,每粒重0.3056g,即每粒相当于生药材1.5g,平均每粒重为0.30g,因此设计每次服用2-3粒(0.30干膏/粒),每日3次,与每日服用9-12g生药粉相当,饭前服用。
性状:本品为硬胶囊,内容物应为棕色至棕褐色的粉末,味苦。
实施例2:
科夭罗曲的制备方法:将药材新鲜瓜蒌2g、新鲜鸡血藤2g和新鲜垂盆草1g所组成的混合物经压榨取汁后,药渣的干燥细粉再与麦粉2g、麸皮1g混合,加入药汁搅匀制成软材,蒸透,保持温度为26℃、湿度为65%,添加曲精发酵30天,取出,干燥,粉碎,即得科夭罗曲。
治疗糖尿病的片剂的制备方法:称取科夭罗曲400g、车前草300g、仙鹤草400g和山银花400g,将车前草和仙鹤草切制成1.0cm段,加10倍量水,浸泡120分钟,煎煮2小时,过滤,取滤液备用;药渣加10倍量水煎煮2小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.3的清膏,于温度75℃、真空度0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,加入片剂相应的辅料,即得片剂1000粒。服用方法:每日3次,每次2粒,每粒重0.15g,饭前服用。
实施例3:
科夭罗曲的制备方法:将药材新鲜瓜蒌2g、新鲜鸡血藤2g和新鲜垂盆草1g所组成的混合物经压榨取汁后,药渣的干燥细粉再与麦粉2g、麸皮1g混合,加入药汁搅匀制成软材,蒸透,保持温度为18℃、湿度为45%,添加曲精发酵20天,取出,干燥,粉碎,即得科夭罗曲。
治疗糖尿病的颗粒剂的制备方法:称取科夭罗曲500g、车前草400g、仙鹤草300g和山银花300g,将车前草和仙鹤草切制成1.0cm段,加6倍量水,浸泡90分钟,煎煮1小时,过滤,取滤液备用;药渣加8倍量水煎煮1小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.2的清膏,于温度55℃、真 空度0.08Mpa的条件下将清膏减压干燥成干膏;粉碎,加入颗粒剂相应的辅料,即得颗粒剂1000粒。服用方法:每日3次,每次2粒,每粒重0.15g,饭前服用。
实施例4:
治疗糖尿病的滴丸的制备方法:称取实施例1中制备的科夭罗曲550g、车前草350g、仙鹤草300g和山银花300g,将车前草和仙鹤草切制成1.0cm段,加10倍量水,浸泡120分钟,煎煮2小时,过滤,取滤液备用;药渣加10倍量水煎煮2小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.3的清膏,于温度75℃、真空度0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,加入滴丸相应的辅料,即得滴丸剂。服用方法:每日3次,每次2-3粒,每粒重0.3g,饭前服用。
实施例5:一种治疗糖尿病的片剂:
处方:
科夭罗曲400g 车前草300g 仙鹤草400g 山银花400g
制成1000个制剂单位
其中,所述的科夭罗曲为苗族习用药材,由贵州道地药材新鲜瓜蒌和新鲜冬瓜皮以9:1的重量比混合糯米粉经曲制进行经曲制进行酵解而成。
具体的说,所述的科夭罗曲通过以下方法制备而成:称取原料药新鲜瓜蒌和新鲜冬瓜皮,压榨取汁,备用;将药渣干燥后,粉碎成细粉,将该药渣细粉按照药渣细粉:糯米粉=9:1的重量配比与糯米粉混匀,加入药汁,同时加水搅匀制成软材,蒸透,保持温度为18~26℃、湿度为45%~65%,添加曲精发酵16~30天(夏季16~25,冬季20~30,春秋16~30),取出,粉碎,干燥,即得。
制备方法:称取处方量科夭罗曲(由新鲜瓜蒌全株和新鲜鸡血藤、垂盆草经曲制进行酵解而成。)、车前草、仙鹤草和山银花,加8倍量水,浸泡30分钟,煎煮2小时,过滤,药渣加6倍量水煎煮1小时,过滤,合并滤液,浓缩至相对密度为1.2~1.3(测定温度60℃)的清膏,65~75℃减压干燥。干膏粉碎,过100目筛,加羧甲基淀粉钠、预胶化淀粉及微晶纤维素,制粒,取出湿颗粒于65~75℃干燥,干颗粒用二号筛整粒后,加入润滑剂混合均匀,压片,包薄膜衣,即得片剂。服用方法:口服。一次3-4片,一日3次;饭后服用或遵医嘱。每片重0.4g
本发明公开了一种治疗糖尿病的中药制剂及其制备方法,所述制备方法包括:按重量份计算,称取科夭罗曲、车前草、仙鹤草和山银花,加6~10倍量水,浸泡30~120分钟,煎煮1~2小时,过滤,取滤液备用;药渣加6~10倍量水煎煮1~2小时,过滤;合并两次滤液,滤过,浓缩,干燥,粉碎,加入辅料,制成相应的中药制剂,即得。
实施例6:一种治疗糖尿病的片剂的制备方法:
活性成分处方:
科夭罗曲480g 车前草350g 仙鹤草335g 山银花335g
称取科夭罗曲、车前草、仙鹤草和山银花,将车前草和仙鹤草切制成1.0cm段,加8倍量水,浸泡30分钟,煎煮2小时,过滤,取滤液备用;药渣加6倍量水煎煮1小时,过滤,合并两次滤液,滤过,浓缩成60℃的相对密度为1.2的清膏,于温度65℃、真空度0.1Mpa的条件下将清膏减压干燥成干膏;粉碎,整粒,过100目筛,加入干膏总重1.67%的羧甲淀粉钠,2.9%的预胶化淀粉,15.67%的微晶纤维素,用物料量55%的、且浓度为12%的淀粉浆为粘合剂制粒,取出湿颗粒于65~75℃干燥,干颗粒用二号筛整粒后,加入物料量0.16%的1:1的二氧化硅和硬脂酸镁作润滑剂混合均匀,压成1000片,包薄膜衣,每片重0.4g,即得。服用方法:口服,一次3-4片,一日3次;饭后服用或遵医嘱。
实施例7:治疗糖尿病的片剂的检测方法:
(1)取本品去包衣,研磨成细粉,称取1.3g,加入10ml的甲醇超声30分钟过滤,取滤液5ml,加入少量的镁粉,滴加12~14滴浓盐酸,水浴1~2分钟,溶液变为红紫色。
(2)取本品去包衣,研磨成细粉,称取3.8g,加95%乙醇50ml,回流提取2小时,滤过,滤液浓缩至5ml,作为供试品溶液。另取木犀草苷对照品,加甲醇制成每1ml含0.4mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取供试品溶液3.5μl、对照品溶液1μl,分别点于同一硅胶G板上,以乙酸乙酯-丙酮-甲酸-水(7:3:1:1.2)为展开剂,展开,取出,晾干,喷以5%三氯化铝乙醇溶液,105℃加热10分钟,放冷,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱相应位置上,显相同颜色的荧光斑点。
(3)取本品去包衣,研磨成细粉,称取2.6g,加95%乙醇50ml,回流提取2小时,滤过,滤液浓缩至10ml,作为供试品溶液。另取大车前苷对照品,加60%甲醇制成每1ml含0.1mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取供试品溶液2μl、对照品溶液2μl,分别点于同一聚酰胺薄膜上,以乙酸乙酯-丙酮-甲酸-水(7:3:1:1.2)为展开剂,展开,展距为5cm,取出,在60℃加热10分钟,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。
(4)取本品去包衣,研磨成细粉,称取2.6g,加甲醇30ml,回流提取3小时,滤过,滤液浓缩至10ml,作为供试品溶液。另取异绿原酸A对照品,加甲醇制成每1ml含0.4mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2010版一部附录ⅥB)试验,吸取供试品溶液2μl、对照品溶液1μl,分别点于同一聚酰胺薄膜上,以乙酸乙酯-丙酮-甲酸-水(7:3:1:1.2)为展开剂,展开,展距为5cm,取出,在60℃加热10分钟,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱相应位置上,显相同颜色的荧光斑点。
- 还没有人留言评论。精彩留言会获得点赞!