用于中枢神经损伤修复的三维多孔聚氨酯支架及制备方法与流程
本发明涉及中枢神经损伤修复领域,具体涉及一种用于中枢神经损伤修复的三维多孔聚氨酯支架及制备方法。
背景技术:
一般而言,成人神经系统的再生能力是有限的,这使得一旦人们遭受神经损伤,便会造成不同程度的感觉或运动功能的丧失以及神经性疼痛。
神经移植是目前治疗神经损伤的“黄金法则”。然而,由于供体短缺以及手术具有一定风险,使得该治疗手段的推广十分的艰难,更为重要的是其治疗效果并非十分令人满意。
利用组织工程技术,特别是利用人工神经组织工程支架促进受损神经的修复,近些年来受到了高度的关注并获得了一系列令人瞩目的成果。
不过,目前的研究主要集中在难度较小的外周神经修复方面,对于难度较高的中枢神经修复方面鲜有涉及,这是因为中枢神经系统的再生能力要明显弱于外周神经系统(J.W. Fawcett, R.A. Asher, The glial scar and central nervous system repair, Brain Res. Bull. 49 (1999) 377–391),同时,中枢神经纤维在受损后目前被认为是无法再生的(Sabrina Morelli, Antonella Piscioneri,Neuronal growth and differentiation on biodegradable membranes,J Tissue Eng Regen Med (2012))。因此,目前适用于外周神经系统的修复方法几乎都不适用于中枢神经系统的修复。这使得利用现有组织工程技术修复受损中枢神经的研究多年来都未获得重大突破,与其相比,利用组织工程支架在外周神经系统修复方面已取得显著成效。
在利用人工神经组织工程支架修复外周神经系统的研究中,人们发现神经的修复可能依赖于支架结构、化学或生物诱导刺激等因素,并在该发现之下利用可降解天然大分子材料(如胶原、壳聚糖、海藻酸盐等)或人工合成可降解材料(如聚乳酸-聚乙醇酸共聚物、聚已内酯、聚吡咯等),制备了中空管、电纺纤维膜等支架,获得了一定的外周神经修复效果。在此基础上,通过种入一些功能细胞(如施万细胞、嗅鞘细胞、神经干细胞等)或者生长因子(如神经生长因子、脑源性神经营养因子、胶质源性神经营养因子等)实现了更好的外周神经修复效果。
然而,对于中枢神经系统的修复,至今尚未发现有适用的并具有显著效果的人工神经组织工程支架。在现有报道中,研究者一般仅使用凝胶来作为中枢神经系统修复的支架,并只有在种入的细胞和携载的因子的共同作用下,才能达到一定的效果。值得指出的是,凝胶支架在体内的维持时间十分短暂,无法提供长时的修复作用。更为重要的是,据目前所知,现有的任何研究成果均未能使得受试动物的原有神经功能得到恢复。也就是说,目前的研究成果主要停留在体外实验水平,如何找到一种具有实际应用价值的用于中枢神经系统修复的支架,仍旧是本领域研究的重大挑战。
为了克服凝胶维持时间短的缺点,研究者尝试了利用聚羟基脂肪酸(PHA)三维纳米纤维作为支架对中枢神经系统修复,所得成果在一定程度上解决了支架维持时间短的问题,但其修复效果的产生依赖于种入的神经干细胞(NSC),更为重要的是其仍然停留在体外实验水平,未显现出明显的实用前景。
对于医疗领域而言,在判断某项技术的实用前景时,体内实验结果是否有效以及重复性是否良好,是基本的指标。对于含有细胞的支架而言,由于细胞的功能的发挥受到环境的影响较大,在植入支架以及支架植入后发挥疗效过程中,植入操作步骤和植入部位的周围环境以及其中的生理环境均会影响修复效果的优劣。因此,现有的中枢神经修复方法不仅还未见到可预期的优良的动物实验效果,即使实施,其难度也是十分的大。
综上所述,本领域亟待寻求一种能够修复受损中枢神经、具有良好动物实验效果以及实施难度小的用于中枢神经系统修复的组织工程支架。
技术实现要素:
针对现有技术的缺点,本发明的目的之一在于提供一种用于中枢神经损伤修复的三维多孔聚氨酯支架。该三维多孔聚氨酯能促进神经细胞的粘附、爬行、生长和突触的重塑,更为重要的是可以恢复受中枢神经损伤受试动物的部分原有神经功能,解决了现有技术中无法单纯依靠支架恢复受损中枢神经功能的重大技术难题。
该支架包括三维多孔聚氨酯,三维多孔聚氨酯的压缩模量为0.001-10.0兆帕;孔径为10-200微米。
利用惯用于周围神经修复的组织工程支架来进行中枢神经修复,经多年的实验验证,是难以获得满意的效果的。这是由于中枢神经受损后,将在其周围产生对神经再生具有抑制性的环境,抑制了受损中枢神经的修复。目前,对中枢神经具有修复效果的体外实验主要集中在载有相关细胞和因子的壳聚糖凝胶支架的研究上,并极少见到具有良好体内修复效果(主要是原有神经功能的修复效果)的研究报道。
聚氨酯具有良好的生物相容性,在药物控释、组织工程支架等方面均有应用,也被大量用于受损周围神经系统修复的研究。在中枢神经系统修复方面,2015年8月17日,本领域较为著名的杂志Biomaterials刊载了一项利用载有神经干细胞的热敏性聚氨酯凝胶对斑马鱼受损中枢神经系统进行修复的研究,并取得了不错的效果,但斑马鱼仅是一类较低级的生物,其种系与哺乳动物差别较大。并且该研究仅仅解决了利用PLA、PLGA或PCL等材料作为支架所具有的弹性较小或者不易加工的缺点,以及解决了利用天然高分子所具有的机械强度低的缺点,除此之外,其对于本领域而言并没有进一步的突破性贡献,仍高度的依赖神经干细胞来修复受损中枢神经。
经过长时间大量的摸索研究,本发明的发明人惊喜的发现,仅利用含有压缩模量为0.001-10.0兆帕、孔径为10-200微米的三维多孔聚氨酯的支架便能很好的修复受损中枢神经。更值得一提的是,其还能直接使得中枢神经受损后的受试动物部分的恢复原有神经功能(特别是运动功能)。本发明不仅解决了凝胶在体内维持时间短、种入细胞操作复杂且易受环境影响的缺点,还使得对中枢神经系统修复的效果显著得到了提高,能使受试动物恢复部分运动功能。目前,本发明在修复受损中枢神经系统方面的机理尚未完全清楚,仍在研究当中。
显而易见的,本发明对于本领域的贡献在于:提供了一种克服了现有技术维持时间短、操作难度高、易受环境影响缺点的、并具有突出的修复受损中枢神经系统效果的组织工程支架。
作为优选方案,所述三维多孔聚氨酯的压缩模量为0.01-7.0兆帕;更优的,所述三维多孔聚氨酯的压缩模量为0.1-3.0兆帕。
作为优选方案,所述三维多孔聚氨酯的孔径为20-150微米。
所述三维多孔聚氨酯的孔隙率为30-95 %,优选为70-90 %。
对于神经系统修复而言,支架的机械性能、孔径和孔隙率起着至关重要的作用。
理论上而言,支架的压缩模量太低则不能发挥支撑细胞生长的作用,而压缩模量太高则容易对周围组织造成损害;同时,支架孔径过小,细胞不易进入,而孔径过大,用于细胞粘附的位点则变少,不利于细胞的生长;另外,支架孔隙率过小,细胞之间的营养传输及相互之间的生长信号受阻,不利于细胞生长,支架孔隙率过大,材料力学性能太差,无法起到支撑细胞生长作用。
无论对于外周神经系统还是中枢神经的修复,上述认识已经成为本领域的常识。然而,多年来,本领域研究人员仍然无法仅仅通过调节支架的压缩模量、孔径和孔隙率来实现受损中枢神经的修复。虽然三维多孔聚氨酯的压缩模量、孔径和孔隙率为上述各自优选的范围时,本发明支架对于受损中枢神经的修复效果更好,但其中的机理仍然需要进一步的考察。
所述三维多孔聚氨酯的结构包括聚氨酯电纺纤维多孔支架、聚氨酯冷冻干燥多孔支架、聚氨酯3D打印多孔支架、聚氨酯离子沥滤多孔支架、聚氨酯气体发泡多孔支架中的一种。
优选的,所述三维多孔聚氨酯支架还包括功能细胞因子和/或功能细胞;所述功能细胞因子包括神经生长因子、脑源性神经营养因子、胶质源性神经营养因子中的至少一种。
功能细胞因子和/或功能细胞的种入能使得中枢神经系统的修复效果得到进一步的提升。但值得指出的是,本发明支架中的三维多孔聚氨酯是本发明之所以取得优异效果的关键,功能细胞因子和/或功能细胞的加入仅仅起到在已取得的优异效果的基础上进一步提高修复效果而已,不应理解为功能细胞因子和/或功能细胞的加入对于本发明的技术效果的产生是必不可少的。
所述中枢神经损伤包括脑损伤、脊髓神经损伤和视网膜损伤中的一种。
本发明的另一个目的在于提供制备用于中枢神经损伤修复的三维多孔聚氨酯支架的方法,该方法包括如下步骤:
利用至少含有聚氨酯的原料制备成三维多孔聚氨酯支架,所用制备方法包括冷冻干燥法、静电纺丝法、3D打印法、粒子沥滤法、气体发泡法中的一种;所述聚氨酯包括生物可降解聚氨酯,所述生物可降解聚氨酯包括热塑性生物可降解聚氨酯或交联生物可降解聚氨酯。
所述冷冻干燥法操作过程为:将聚氨酯乳液在4℃下保存4小时,排除乳液中的气体;然后置于-20℃过夜,再冷冻干燥2天;之后烘干,即得。
所述静电纺丝法操作过程为:将聚氨酯溶解于四氢呋喃与二甲基乙酰胺的混合溶剂或者六氟异丙醇中,以锡箔纸为接收物,进行电纺得到聚氨酯电纺纤维多孔支架。
所述3D打印法的操作过程为:在聚氨酯乳液中加入明胶,进行3D打印,得到聚氨酯3D打印多孔支架。
所述粒子沥滤法的操作过程为:向聚氨酯乳液中加入氯化钠,然后将溶液铺散在光滑平面上,自然挥发之后进行烘干;再用水洗去其中的氯化钠颗粒,得到聚氨酯粒子沥滤多孔支架。
所述气体发泡法的操作过程为:将聚氨酯溶液烘干得到薄膜,之后将所得薄膜浸入到超临界二氧化碳中至饱和状态,最后降至常压状态,得到聚氨酯气体发泡多孔支架。
作为优选方案,所述原料还包括功能细胞因子和/或功能细胞;所述功能细胞因子包括神经生长因子、脑源性神经营养因子、胶质源性神经营养因子中的至少一种。
本发明的另外一个目的在于提供上述三维多孔聚氨酯在修复中枢神经损伤上的应用。
本发明的有益效果:
1、本发明三维多孔聚氨酯无需额外种入功能细胞或者功能性细胞因子,便具有高效的中枢神经修复功能,能部分恢复受试动物的原有神经功能;
2、本发明三维多孔聚氨酯的制备方法简单;
3、本发明三维多孔聚氨酯使用方法简单,具有巨大的应用前景。
附图说明
图1为本发明三维多孔聚氨酯支架的SEM形貌表征结果;其中,A:冷冻干燥三维多孔交联生物可降解聚氨酯支架断面形态;B:冷冻干燥三维多孔交联生物可降解聚氨酯支架表面形态;
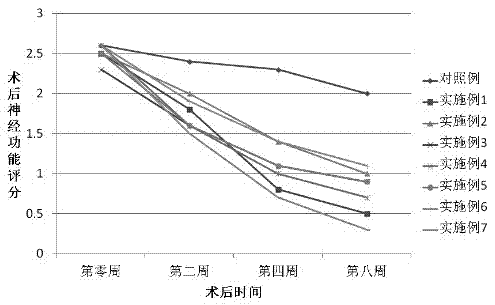
图2为在本发明所用模型中,术后鼠神经功能评分结果;
图3为在本发明所用模型中,植入本发明多孔聚氨酯支架之前和之后的形貌表征;其中,A:大鼠植入冷冻干燥三维多孔交联生物可降解聚氨酯支架术中情况,虚线框处为植入支架处;B:对照例大鼠植入生理盐水术中情况;C:大鼠植入冷冻干燥三维多孔交联生物可降解聚氨酯支架8周后的大脑形态,虚线框处为植入支架处;D:对照例大鼠植入生理盐水8周后的大脑形态,虚线框处为植入生理盐水处;
图4为在本发明实施例1所用模型中,植入支架4周后脑组织冰冻切片HE染色的结果图;其中A图为100倍放大图像,B图为200倍放大图像;
图5为在本发明实施例1所用模型中,植入支架8周后脑组织石蜡切片HE染色结果图;其中A图为400倍放大结果图,示支架再生部分边缘情况,所示箭头处为降解的支架,B图为400倍放大结果图,示支架再生部分中心情况,所示箭头处为降解的支架;
图6为在本发明所用模型中,轴突再生效果的激光共聚焦扫描结果图;其中,A:实施例1脑组织细胞核;B:实施例1中GAP43于术后4周的表达情况;C:实施例1细胞核与GAP43合成图;D:对照例脑组织细胞核;E:对照例中GAP43于术后4周的表达情况;F:对照例细胞核与GAP43合成图;
图7为在本发明所用模型中,突触重建效果的激光共聚焦扫描结果图; A:实施例1脑组织细胞核;B:实施例1中突触素在术后8周的表达情况;C:实施例1细胞核与突触素合成图;D:对照例脑组织细胞核;E:对照例中突触素在术后8周的表达情况;F:对照例细胞核与突触素合成图。
图8为GAP43和突触素的Western 杂交实验结果图。
具体实施方式
下面通过实施例对本发明进行具体描述,有必要在此指出的是以下实施例只是用于对本发明进行进一步的说明,不能理解为对本发明保护范围的限制,该领域的技术熟练人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
实施例1
将交联的生物可降解聚氨酯水乳液在4℃下保存4小时,排除乳液中的气体;然后置于-20 ℃过夜,再采用冷冻干燥24小时;之后于40 ℃烘干,得到冷冻干燥的三维多孔聚氨酯支架。其平均孔径为80 mm,孔隙率为90 %,压缩模量为1.0 MPa,结构如图1所示。用此冷冻干燥三维多孔交联生物可降解聚氨酯支架对大鼠脑轴突及突触再生功能进行修复。
实施例2
将热塑性生物可降解聚氨酯溶于二甲基亚砜,配成质量浓度为30 %的溶液,在4 ℃下保存4小时,排除溶液中的气体;然后置于-20 ℃过夜,再冷冻干燥24小时,得到冷冻干燥的三维多孔聚氨酯支架。其平均孔径为150 mm,孔隙率为70 %,压缩模量为3.0 MPa。用此冷冻干燥三维多孔热塑性生物可降解聚氨酯支架对大鼠脑轴突及突触再生功能进行修复。
实施例3
在交联的生物可降解聚氨酯乳液中加入质量比为40 %的氯化钠,然后将乳液铺散在光滑平面上,自然挥发4 天,之后进行烘干;再用水洗去其中的氯化钠颗粒,得到离子沥滤三维多孔交联生物可降解聚氨酯支架。其平均孔径为200 mm,孔隙率为30 %,压缩模量为7.0 MPa。用此离子沥滤三维多孔交联生物可降解聚氨酯支架对于大鼠脑轴突及突触再生功能进行修复。
实施例4
将热塑性的生物可降解聚氨酯溶解于四氢呋喃与二甲基乙酰胺的混合溶剂,以锡箔纸为接收物,设置电纺电压为20 kv,接收距离为15 cm,流速为1 ml/h,电纺得到热塑性生物可降解聚氨酯电纺纤维支架。其平均孔径为100 mm,孔隙率为85 %,压缩模量为0.001 MPa。用此电纺纤维热塑性生物可降解聚氨酯支架对于大鼠脑轴突及突触再生功能进行修复。
实施例5
将热塑性生物可降解聚氨酯溶液烘干得到薄膜,之后将所得薄膜浸入到超临界二氧化碳中至饱和状态,最后降至常压状态,得到气体发泡三维多孔热塑性生物可降解聚氨酯支架。其平均孔径为20 mm,孔隙率为40 %,压缩模量为10.0 MPa。用此气体发泡三维多孔热塑性生物可降解聚氨酯支架对于大鼠脑轴突及突触再生功能进行修复。
实施例6
将热塑性生物可降解聚氨酯溶解于四氢呋喃与二甲基乙酰胺的混合溶剂中,以锡箔纸为接收物,设置电纺电压为15 kv,接收距离为10 cm,流速为0.5 ml/h,电纺得到电纺纤维热塑性生物可降解聚氨酯支架。其平均孔径为10 mm,孔隙率为85 %,压缩模量为0.01 MPa。用此热塑性生物可降解聚氨酯电纺纤维支架对于大鼠脑轴突及突触再生功能进行修复。
实施例7
向交联的生物可降解聚氨酯水乳液加神经生长因子,在4 ℃下保存4小时,排除乳液中的气体;然后置于-20 ℃过夜,再采用冷冻干燥24小时;之后烘箱40 ℃烘干,得到冷冻干燥的含生长因子的三维多孔聚氨酯支架。使用其平均孔径在为80 mm,孔隙率为85 %,压缩模量为1.0 MPa。用该加有神经生长因子支架对大鼠脑轴突及突触再生功能进行修复。
实验例
对实施例1-7所得三维多孔聚氨酯支架进行相关实验,具体实验内容如下:
二、动物实验
(一)动物模型的建立
成年SD大鼠用10 %水合氯醛进行麻醉(0.5 ml/100 g),麻醉结束后剃去头部毛发,取大鼠头部正中切口切开,找到前囟后于前囟前方开一5×4 mm大小骨窗,去除硬脑膜,随后挖去4mm×4mm×3mm大小的M1区。充分止血后分别植入实施1-7所得三维多孔生物可降解聚氨酯支架,不必封闭骨窗,止血后缝合皮肤。术后连续3日注射头孢硫脒(0.05g/日)预防感染。在切除大鼠M1区并植入三维多孔聚氨酯支架之后的2、4、8周后观察鼠前肢运动功能恢复情况并进行评分后,处死大鼠。
对照例:大鼠颅脑损伤模型制造方法与实施例动物模型相同,在制造模型后除使用生理盐水代替聚氨酯支架填充入脑组织外,其余手术过程均相同,并采用相同环境饲养,并同样在实施例植入支架的2、4、8周后,在观察对照组鼠前肢运动功能恢复情况并进行评分后,处死大鼠。
(二)功能评定
因本实验切除了大鼠的M1区,而该区域主要功能为前肢运动,故引入Bederson评分标准进行实验结果评价。评分标准见表1,具体如下:将大鼠尾部提起至1米高度观察双侧上肢,如双上肢均指向地面,认为无瘫痪记0分,如手术对侧持续挛缩,记1分;将记1分大鼠置于充分摩擦力的地面,保证其爪子能够紧紧抓住地面,轻轻提起尾巴,从各方向给予侧方力量直至前肢滑行一段距离,若患侧表现出抵抗侧方力量下降,记2分;让2分大鼠自由运动,如大鼠出现圆圈状运动,记3分。
表1
利用Bederson评分方法,在切除大鼠M1区并植入实施例1-7所得三维多孔聚氨酯支架之后的2、4、8周后的鼠前肢运动功能。
如图2所示,本发明各实施例神经功能评分均值均较之对照例显著下降。结果显示实施例1的平均孔径为80 μm,孔隙率为90 %,压缩模量为1.0 MPa的冷冻干燥三维多孔交联生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低1.5分。实施例2的平均孔径为150 μm,孔隙率为70 %,压缩模量为3.0 MPa的冷冻干燥三维多孔热塑性生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低1.0分。实施例3的平均孔径为200 μm,孔隙率为30 %,压缩模量为7.0 MPa的离子沥滤三维多孔交联生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低1.1分。实施例4的平均孔径为100 μm,孔隙率为85 %,压缩模量为0.001 MPa的电纺纤维热塑性生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低1.3分。实施例5平均孔径为20 μm,孔隙率为40 %,压缩模量为10.0 MPa的气体发泡三维多孔热塑性生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低1.1分。实施例6平均孔径为10 mm,孔隙率为85 %,压缩模量为0.01 MPa的电纺纤维热塑性生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低0.9分。实施例7加入神经生长因子的平均孔径在为80 μm,孔隙率为85 %,压缩模量为1.0 MPa的冷冻干燥三维多孔交联生物可降解聚氨酯支架在植入大鼠8周后,平均Bederson评分比对照例低1.7分。
上述结果证明,本发明所有实施例的三维多孔聚氨酯支架可以很好的部分恢复大鼠的前肢运动功能,加入神经生长因子的支架的修复效果更佳。
图3是向大鼠植入三维多孔聚氨酯支架时的手术方法图及对照例手术图,其同时显示了三维多孔聚氨酯支架在植入8周后的体内情况及对照例体内的情况。结果显示,本发明的三维多孔聚氨酯支架比对照例而言,在手术过程中有足够的强度维持支架的完整性以支持细胞浸润、轴突再生和突触重建。
(三)组织学评价:
大鼠在记录评分后处死,利用PBS灌注脑组织后,取出脑组织,取填入材料部分于OCT胶于-80℃速冻,切成5μm切片后,用4%多聚甲醛固定1小时,之后用PBS洗片两次;利用0.3% Trition X-100打孔15分钟,PBS清洗一次后,室温下抗原封闭液封闭1小时;利用PBS清洗两次后加入一抗,4℃过夜;利用PBS清洗两次后加入二抗,室温孵育1小时后,PBS清洗两次,加入DAPI染色15分钟;利用抗荧光淬灭剂封片,次日于激光共聚焦显微镜下观察。
注:本实验一抗选用抗GAP43抗体及抗突触素抗体。GAP43是一种公认的神经再生标志,其在轴突再生及突触形成时高表达。突触素被认为是一种代表突触的可靠标志。
如图4和图5所示,HE染色结果显示神经纤维从本发明支架的边缘快速的生长至了支架的中部,血管也进入了支架中,且未见炎症或不利的组织反应发生。
如图6和图7所示,以本发明三维多孔聚氨酯作为支架,进行手术之后的第4周,GAP43得到了大量的表达,同时在手术后第8周,突触素也得到了大量的表达,表明轴突和突触得到了修复重建。
(四)Western 杂交
取灌注后大鼠脑组织,选取填入材料部分于液氮中研磨碎,使用RIPA+PMSF(5 μL/mL)消化组织粉末,30分钟。于4℃下12000 rpm离心5min。测定蛋白含量后加入上样缓冲液在100℃下煮沸10分钟。清洗玻璃板后配4%的浓缩胶,加入TEMED后立即灌胶。待到浓缩胶凝固后,将胶放入电泳槽中,加足够的电泳液后,上样。设置电压为120 V,进行电泳1 h。准备6张7.0~8.3 cm的滤纸和1张7.3~8.6 cm的硝酸纤维素膜,将夹子放入转移槽槽中,用60 V转移2 h或40 V转移3 h,膜晾干备用。膜用TBS从下向上浸湿后,移至含有封闭液(5 %脱脂牛奶)的平皿中,室温下在摇床上摇动封闭2小时;将一抗稀释至适当浓度,将膜与抗体在4摄氏度下孵育过夜,用TBST在室温下摇床上洗三次,每次10min;二抗稀释至适当浓度并与膜接触,室温下孵育1~2 h,用TBST在室温下摇床上洗三次,每次10 min;将ECL的A和B两种试剂混合;与膜蛋白面所在面充分接触1-2 min,然后去尽残液,包好,放入X-光片夹中;暗室中,将1×显影液和定影液分别倒入塑料盘中;在红灯下取出X-光片,用切纸刀剪裁适当大小;打开X-光片夹,把X-光片放在膜上,关上X-光片夹,开始计时;根据信号的强弱适当调整曝光时间,一般为1 min或5 min。曝光完成后,打开X-光片夹,取出X-光片,迅速浸入显影液中显影,待出现明显条带后,即刻终止显影。显影时间一般为1~2 min(20~25 ℃),温度过低时(低于16 ℃)需适当延长显影时间;显影结束后,马上把X-光片浸入定影液中,定影时间一般为5~10 min,以胶片透明为止;用自来水冲去残留的定影液后,室温下晾干;将胶片进行扫描或拍照,用凝胶图象处理系统分析目标带的分子量和净光密度值。
注:本实验一抗选用抗GAP43抗体及抗突触素抗体。GAP43是一种公认的神经再生标志,其在轴突再生及突触形成时高表达。突触素被认为是一种代表突触的可靠标志。
Western 杂交实验结果可以验证本发明支架植入后的突触素和GAP43的表达结果。如图8所示,实施例的神经轴突再生和对照例的相比较有明显的恢复。
- 还没有人留言评论。精彩留言会获得点赞!