包含抗血管发生剂和OX40结合激动剂的组合疗法的制作方法
本申请要求2014年3月31日提交的流水号61/973,193的美国临时申请;2014年5月6日提交的流水号61/989,448的美国临时申请;2014年10月31日提交的流水号62/073,873的美国临时申请;2014年11月14日提交的流水号62/080,171的美国临时申请;和2015年2月6日提交的流水号62/113,345的美国临时申请的优先权,通过援引将其每一篇完整收入本文。
序列表
通过援引将ASCII文本文件上的下述提交的内容完整收入本文:计算机可读形式(CRF)的序列表(文件名称:146392031540SEQLIST.txt,记录日期:2015年3月26日,大小:188KB)。
发明领域
本发明涉及通过施用抗血管发生剂和OX40结合激动剂来治疗癌症的方法。
发明背景
血管发生对于癌症形成是必需的,其不仅调节原发性肿瘤大小和生长,而且还影响侵入性和转移性潜力。因而,已经调查了介导血管发生过程的机制作为定向抗癌疗法的潜在靶物。血管发生调控物的研究早期,发现了血管内皮生长因子(VEGF)信号传导途径调节多种癌症类型中的血管发生活性,并且已经开发出多种治疗剂来在多个点调控此途径。虽然血管发生抑制剂在临床中的使用已经显示获得成功,但是,不是所有患者都响应或完全响应这种疗法。此类不完全响应根本的机制是未知的。因此,需要鉴定对抗血管发生癌症疗法敏感或响应的患者亚组。而且,仍然需要可提高抗血管发生癌症疗法的功效的组合疗法。
贝伐珠单抗(bevacizumab)是一种重组人源化单克隆IgG1抗体,其特异性结合VEGF并阻断其生物学效应。贝伐珠单抗已经在欧洲批准用于治疗晚期阶段的六种常见癌症类型:结直肠癌,乳腺癌,非小细胞肺癌(NSCLC),卵巢癌,宫颈癌,和肾癌,这些癌症每年共同引起超过250万例死亡。在美国,贝伐珠单抗是得到FDA批准的第一种抗血管发生疗法,而且它现在批准用于六种肿瘤类型的治疗:结直肠癌,NSCLC,脑癌(成胶质细胞瘤),肾癌(肾细胞癌),卵巢癌,和宫颈癌。至今已经用贝伐珠单抗治疗了超过50万名患者,并且一项全面临床项目正调查在多种癌症类型的治疗中进一步使用贝伐珠单抗。
贝伐珠单抗已经显示了有希望作为共治疗剂,其在与一大批化学疗法和其它抗癌治疗组合时表明功效。例如,III期研究已经表明组合贝伐珠单抗与标准的化学治疗方案的有益效果(参见例如Saltz et al.,2008,J.Clin.Oncol.,26:2013-2019;Yang et al.,2008,Clin.Cancer Res.,14:5893-5899;Hurwitz et al.,2004,N.Engl.J.Med.,350:2335-2342)。然而,如在血管发生抑制剂的先前研究中,这些中的一些III期研究已经显示了一部分患者经历对向其化学治疗方案添加贝伐珠单抗的不完全响应。因而,需要鉴定那些如下的患者的方法,所述患者有可能响应不仅是单独的血管发生抑制剂,而且还有包含血管发生抑制剂(例如贝伐珠单抗)的组合疗法,或者所述患者不仅对单独的血管发生抑制剂,而且还对包含血管发生抑制剂(例如贝伐珠单抗)的组合疗法具有改善的响应。
因而,需要可提高抗血管发生癌症疗法的功效的组合疗法。组合疗法可提高显示不完全响应的患者中的响应性和/或进一步提高确实响应抗血管发生癌症疗法的患者中的响应性。
OX40(也称作CD34,TNFRSF4和ACT35抗原)是肿瘤坏死因子受体超家族的一个成员。OX40不在幼稚T细胞上组成性表达,但是在T细胞受体(TCR)卷入后诱导。OX40的配体OX40L主要在抗原呈递细胞上表达。OX40由活化后的CD4+ T细胞,活化后的CD8+ T细胞,记忆T细胞,和调节T细胞高表达。OX40信号传导能给CD4和CD8 T细胞提供共刺激信号,引起增强的细胞增殖,存活,效应器功能和迁移。OX40信号传导还增强记忆T细胞发育和功能。
调节T细胞(Treg)细胞在自多种癌症适应症(包括黑素瘤,NSCLC,肾癌,卵巢癌,结肠癌,胰腺癌,肝细胞癌,和乳腺癌)衍生的肿瘤和肿瘤引流淋巴结中高度富集。在这些适应症的子集中,升高的肿瘤内Treg细胞密度与较差的患者预后有关,提示这些细胞在遏制抗肿瘤免疫中发挥重要作用。OX40阳性肿瘤浸润性淋巴细胞已有记载。
调控OX40信号传导与在肿瘤细胞中失调的其它信号传导途径(例如血管发生途径)可进一步增强治疗功效。如此,仍然需要用于治疗各种癌症,免疫相关疾病,和T细胞功能障碍性病症,或延迟其形成的此类最佳疗法。
通过援引将本文中引用的所有参考文献(包括专利申请和出版物)完整收入本文。
发明概述
一方面,本文中提供的是一种用于在个体中治疗癌症或延迟癌症进展的方法,其包括对该个体施用有效量的抗血管发生剂和OX40结合激动剂。
另一方面,本文中提供的是抗血管发生剂在制备用于在个体中治疗癌症或延迟癌症进展的药物中的用途,其中该药物包含该抗血管发生剂和任选的药学可接受载剂,且其中该治疗包括与包含OX40结合激动剂和任选的药学可接受载剂的组合物组合施用该药物。本文中进一步提供的是OX40结合激动剂在制备用于在个体中治疗癌症或延迟癌症进展的药物中的用途,其中该药物包含该OX40结合激动剂和任选的药学可接受载剂,且其中该治疗包括与包含抗血管发生剂和任选的药学可接受载剂的组合物组合施用该药物。
仍有另一方面,本文中提供的是一种包含抗血管发生剂和任选的药学可接受载剂的组合物,其用于在个体中治疗癌症或延迟癌症进展,其中该治疗包括与第二组合物组合施用所述组合物,其中该第二组合物包含OX40结合激动剂和任选的药学可接受载剂。本文中进一步提供的是一种包含OX40结合激动剂和任选的药学可接受载剂的组合物,其用于在个体中治疗癌症或延迟癌症进展,其中该治疗包括与第二组合物组合施用所述组合物,其中该第二组合物包含抗血管发生剂和任选的药学可接受载剂。
还有另一方面,本文中提供的是一种试剂盒,其包含包含抗血管发生剂和任选的药学可接受载剂的药物,和包含说明书的包装插页,该说明书关于与包含OX40结合激动剂和任选的药学可接受载剂的组合物组合施用该药物用于在个体中治疗癌症或延迟癌症进展。本文中进一步提供的是一种试剂盒,其包含包含抗血管发生剂和任选的药学可接受载剂的第一药物和包含OX40结合激动剂和任选的药学可接受载剂的第二药物。在一些实施方案中,该试剂盒进一步包含包含说明书的包装插页,该说明书关于施用该第一药物和该第二药物用于在个体中治疗癌症或延迟癌症进展。本文中仍然进一步提供的是一种试剂盒,其包含包含OX40结合激动剂和任选的药学可接受载剂的药物,和包含说明书的包装插页,该说明书关于与包含抗血管发生剂和任选的药学可接受载剂的组合物组合施用该药物用于在个体中治疗癌症或延迟癌症进展。
在一些实施方案中,该抗血管发生剂选自下组:抗VEGFR2抗体;抗VEGFR1抗体;VEGF陷阱;双特异性VEGF抗体;包含选自下组的两种臂的组合的双特异性抗体:抗VEGF臂,抗VEGFR1臂,和抗VEGFR2臂;抗VEGF-A抗体;抗VEGFB抗体;抗VEGFC抗体;抗VEGFD抗体;非肽小分子VEGF拮抗剂;抗PDGFR抑制剂;和天然血管发生抑制剂。在一些实施方案中,该抗血管发生剂选自下组:ramucirumab,tanibirumab,aflibercept,icrucumab,ziv-aflibercept,MP-0250,vanucizumab,sevacizumab,VGX-100,pazopanib,axitinib,vandetanib,stivarga,cabozantinib,lenvatinib,nintedanib,orantinib,telatinib,dovitinig,cediranib,motesanib,sulfatinib,apatinib,foretinib,famitinib,imatinib,和tivozanib。
在一些实施方案中,该抗血管发生剂是抗血管发生抗体。在一些实施方案中,该抗血管发生抗体是单克隆抗体。在一些实施方案中,该抗血管发生抗体是人抗体或人源化抗体。在一些实施方案中,该抗血管发生剂是VEGF拮抗剂。在一些实施方案中,该VEGF拮抗剂将VEGF的表达水平或生物学活性降低至少10%,20%,30%,40%,50%,60%,70%,80%,或90%。在一些实施方案中,该VEGF是VEGF(8-109),VEGF(1-109),或VEGF165。在一些实施方案中,与用该VEGF拮抗剂处理之前树突细胞上的MHC II类表达相比,该VEGF拮抗剂提高树突细胞上的MHC II类表达。在一些实施方案中,与用该VEGF拮抗剂处理之前树突细胞上的OX40L表达相比,该VEGF拮抗剂提高树突细胞上的OX40L表达。在一些实施方案中,该树突细胞是髓样树突细胞。在一些实施方案中,该树突细胞是非髓样树突细胞。在一些实施方案中,该VEGF拮抗剂包含特异性结合VEGF的可溶性VEGF受体或可溶性VEGF受体片段。在一些实施方案中,该VEGF拮抗剂是嵌合VEGF受体蛋白。在一些实施方案中,该VEGF拮抗剂是通过基因疗法施用的。
在一些实施方案中,该VEGF拮抗剂是抗VEGF抗体。在一些实施方案中,该抗VEGF抗体是人抗体或人源化抗体。在一些实施方案中,该抗VEGF抗体结合A4.6.1表位。在一些实施方案中,该抗VEGF抗体结合包含人VEGF残基F17,M18,D19,Y21,Y25,Q89,I91,K101,E103,和C104的功能性表位。在一些实施方案中,该抗VEGF抗体结合包含人VEGF残基F17,Y21,Q22,Y25,D63,I83,和Q89的功能性表位。在一些实施方案中,该抗VEGF抗体是G6系列抗体。在一些实施方案中,该抗VEGF抗体是B20系列抗体。在一些实施方案中,该抗VEGF抗体是单克隆抗VEGF抗体。在一些实施方案中,该单克隆抗VEGF抗体是贝伐珠单抗。在一些实施方案中,该抗VEGF抗体包含包含氨基酸序列DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ GTKVEIKR(SEQ ID NO:214)的轻链可变区。在一些实施方案中,该抗VEGF抗体包含包含氨基酸序列EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS(SEQ ID NO:215)的重链可变区。在一些实施方案中,该抗VEGF抗体包含包含氨基酸序列DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ GTKVEIKR(SEQ ID NO:214)的轻链可变区和包含氨基酸序列EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS(SEQ ID NO:215)的重链可变区。在一些实施方案中,该抗VEGF抗体包含贝伐珠单抗的一个,两个,三个,四个,五个,或六个高变区(HVR)序列。在一些实施方案中,该抗VEGF抗体包含一个,两个,三个,四个,五个,或六个选自下述的高变区(HVR)序列:(a)包含氨基酸序列GYTFTNYGMN(SEQ ID NO:216)的HVR-H1;(b)包含氨基酸序列WINTYTGEPTYAADFKR(SEQ ID NO:217)的HVR-H2;(c)包含氨基酸序列YPHYYGSSHWYFDV(SEQ ID NO:218)的HVR-H3;(d)包含氨基酸序列SASQDISNYLN(SEQ ID NO:219)的HVR-L1;(e)包含氨基酸序列FTSSLHS(SEQ ID NO:220)的HVR-L2;和(f)包含氨基酸序列QQYSTVPWT(SEQ ID NO:221)的HVR-L3。在一些实施方案中,该抗VEGF抗体包含美国专利No.6,884,879中记载的抗体的一个,两个,三个,四个,五个,或六个高变区(HVR)序列。在一些实施方案中,该抗VEGF抗体包含包含下述氨基酸序列的轻链可变区的一个,两个,或三个高变区(HVR)序列:DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ GTKVEIKR(SEQ ID NO:214)和/或包含下述氨基酸序列的重链可变区的一个,两个,或三个高变区(HVR)序列:EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS(SEQ ID NO:215)。在一些实施方案中,该抗VEGF抗体包含贝伐珠单抗的一个,两个,三个,四个,五个,或六个高变区(HVR)序列。
在一些实施方案中,该OX40结合激动剂选自下组:OX40激动性抗体,OX40L激动性片段,OX40寡聚受体,和OX40免疫粘附素。在一些实施方案中,该OX40结合激动剂是三聚OX40L-Fc蛋白。在一些实施方案中,该OX40结合激动剂是包含一个或多个OX40L胞外域的OX40L激动性片段。在一些实施方案中,该OX40结合激动剂是结合人OX40的OX40激动性抗体。在一些实施方案中,该OX40激动性抗体消减表达人OX40的细胞。在一些实施方案中,该OX40激动性抗体在体外消减表达人OX40的细胞。在一些实施方案中,该细胞是CD4+效应T细胞。在一些实施方案中,该细胞是Treg细胞。在一些实施方案中,该消减是通过ADCC和/或吞噬进行的。在一些实施方案中,该消减是通过ADCC进行的。在一些实施方案中,该OX40激动性抗体以小于或等于约1nM的亲和力结合人OX40。在一些实施方案中,该OX40激动性抗体在体外消减表达人OX40的细胞且以小于或等于约1nM的亲和力结合人OX40。在一些实施方案中,该OX40激动性抗体以小于或等于约0.45nM的亲和力结合人OX40。在一些实施方案中,该OX40激动性抗体以小于或等于约0.4nM的亲和力结合人OX40。在一些实施方案中,OX40激动性抗体结合亲和力是使用放射免疫测定法测定的。在一些实施方案中,对人OX40的结合具有小于或等于0.2ug/ml的EC50。在一些实施方案中,对人OX40的结合具有小于或等于0.3ug/ml的EC50。在一些实施方案中,与用抗人OX40激动性抗体处理之前的增殖和/或细胞因子生成相比,该OX40激动性抗体提高CD4+效应T细胞增殖和/或提高CD4+效应T细胞的细胞因子生成。在一些实施方案中,该细胞因子是γ-干扰素。在一些实施方案中,该OX40激动性抗体提高记忆T细胞增殖和/或提高记忆细胞的细胞因子生成。在一些实施方案中,该细胞因子是γ-干扰素。在一些实施方案中,该OX40激动性抗体抑制Treg功能。在一些实施方案中,该OX40激动性抗体抑制效应T细胞功能的Treg遏制。在一些实施方案中,效应T细胞功能是效应T细胞增殖和/或细胞因子生成。在一些实施方案中,该效应T细胞是CD4+效应T细胞。在一些实施方案中,该OX40激动性抗体提高表达OX40的靶细胞中的OX40信号转导。在一些实施方案中,OX40信号转导是通过监测NFkB下游信号传导检测的。在一些实施方案中,该OX40激动性抗体于40℃处理2周后是稳定的。在一些实施方案中,该OX40激动性抗体包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变),且其中该抗体具有相对于包含天然序列IgG1 Fc部分的抗人OX40激动性抗体降低的活性。在一些实施方案中,该OX40激动性抗体包含包含DANA突变的变异Fc部分。在一些实施方案中,抗人OX40激动性抗体功能需要OX40激动性抗体交联。在一些实施方案中,该OX40激动性抗体包含(a)VH域,该VH域包含(i)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:4,15或19的HVR-H3;和(iv)包含氨基酸序列SEQ ID NO:5的HVR-L1,(v)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(vi)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27或28的HVR-L3。在一些实施方案中,该OX40激动性抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:7的HVR-L3。在一些实施方案中,该OX40激动性抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:26的HVR-L3。在一些实施方案中,该OX40激动性抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:27的HVR-L3。在一些实施方案中,该OX40激动性抗体包含与氨基酸序列SEQ ID NO:56,58,60,62,64,66,68,70,72,74,76,78,80,82,84,86,88,90,92,94,96,98,100,108,114,116,233,或234具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在一些实施方案中,该OX40激动性抗体包含与氨基酸序列SEQ ID NO:57,59,61,63,65,67,69,71,73,75,77,79,81,83,85,87,89,91,93,95,97,99,101,109,115,或117具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在一些实施方案中,该OX40激动性抗体包含与氨基酸序列SEQ ID NO:56具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在一些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的OX40激动性VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合人OX40的能力。在一些实施方案中,在SEQ ID NO:56中替代,插入和/或删除了总共1至10个氨基酸。在一些实施方案中,该OX40激动性VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。在一些实施方案中,该OX40激动性抗体包含与氨基酸序列SEQ ID NO:57具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在一些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的OX40激动性VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合人OX40的能力。在一些实施方案中,在SEQ ID NO:57中替代,插入和/或删除了总共1至10个氨基酸。在一些实施方案中,该OX40激动性VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。在一些实施方案中,该OX40激动性抗体包含VH序列SEQ ID NO:56。在一些实施方案中,该OX40激动性抗体包含VL序列SEQ ID NO:57。在一些实施方案中,该OX40激动性抗体包含VH序列SEQ ID NO:56和VL序列SEQ ID NO:57。在一些实施方案中,该OX40激动性抗体包含VH序列SEQ ID NO:94。在一些实施方案中,该OX40激动性抗体包含VL序列SEQ ID NO:95。在一些实施方案中,该OX40激动性抗体包含VH序列SEQ ID NO:94和VL序列SEQ ID NO:95。在一些实施方案中,该OX40激动性抗体包含VH序列SEQ ID NO:96。在一些实施方案中,该OX40激动性抗体包含VL序列SEQ ID NO:97。在一些实施方案中,该OX40激动性抗体包含VH序列SEQ ID NO:96和VL序列SEQ ID NO:97。在一些实施方案中,该OX40激动性抗体是MEDI6469,MEDI0562,或MEDI6383。
在一些实施方案中,该OX40激动剂在包含本文中提供的任何抗人OX40抗体(例如激动性抗体)和药学可接受载剂的药物配制剂中。在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,处于介于约10mg/mL和约100mg/mL之间的浓度,(b)聚山梨酯(polysorbate),其中该聚山梨酯浓度是约0.02%至约0.06%;(c)组氨酸缓冲液,处于约pH 5.0至约pH 6.0;和(d)糖,其中该糖浓度是约120mM至约320mM。在一些实施方案中,该组氨酸缓冲液处于pH 5.0至6.0。在一些实施方案中,该糖是蔗糖。在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.02%;(c)组氨酸乙酸酯缓冲液,处于pH 6.0;和(d)蔗糖,其中该蔗糖浓度是约320mM。在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.02%;(c)组氨酸乙酸酯缓冲液,处于pH 5.5;和(d)蔗糖,其中该蔗糖浓度是约240mM。在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.04%;(c)组氨酸乙酸酯缓冲液,处于pH 6.0;和(d)蔗糖,其中该蔗糖浓度是约120mM。在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯40,其中该聚山梨酯浓度是约0.04%;(c)组氨酸乙酸酯缓冲液,处于pH5.0;和(d)蔗糖,其中该蔗糖浓度是约240mM。在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯40,其中该聚山梨酯浓度是约0.04%;(c)组氨酸乙酸酯缓冲液,处于pH 6.0;和(d)蔗糖,其中该蔗糖浓度是约120mM。在一些实施方案中,该配制剂的抗体包含(a)VH域,该VH域包含(i)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:4,15或19的HVR-H3;和(iv)包含氨基酸序列SEQ ID NO:5的HVR-L1,(v)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(vi)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27或28的HVR-L3。在一些实施方案中,该配制剂的抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:7的HVR-L3。在一些实施方案中,该配制剂的抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:26的HVR-L3。在一些实施方案中,该配制剂的抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:27的HVR-L3。在一些实施方案中,该配制剂的抗体包含与氨基酸序列SEQ ID NO:56,58,60,62,64,66,68,70,72,74,76,78,80,82,84,86,88,90,92,94,96,98,100,108,114,116,183,或184具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在一些实施方案中,该配制剂的抗体包含与氨基酸序列SEQ ID NO:57,59,61,63,65,67,69,71,73,75,77,79,81,83,85,87,89,91,93,95,97,99,101,109,115,或117具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在一些实施方案中,该配制剂的抗体包含与氨基酸序列SEQ ID NO:56具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在一些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合人OX40的能力。在一些实施方案中,在SEQ ID NO:56中替代,插入和/或删除了总共1至10个氨基酸。在一些实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。在一些实施方案中,该配制剂的抗体包含与氨基酸序列SEQ ID NO:57具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在一些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合人OX40的能力。在一些实施方案中,在SEQ ID NO:57中替代,插入和/或删除了总共1至10个氨基酸。在一些实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:56。在一些实施方案中,该配制剂的抗体包含VL序列SEQ ID NO:57。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:56和VL序列SEQ ID NO:57。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:94。在一些实施方案中,该配制剂的抗体包含VL序列SEQ ID NO:95。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:94和VL序列SEQ ID NO:95。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:96。在一些实施方案中,该配制剂的抗体包含VL序列SEQ ID NO:97。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:96和VL序列SEQ ID NO:97。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:179。在一些实施方案中,该配制剂的抗体包含VL序列SEQ ID NO:180。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:179和VL序列SEQ ID NO:180。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:181。在一些实施方案中,该配制剂的抗体包含VL序列SEQ ID NO:182。在一些实施方案中,该配制剂的抗体包含VH序列SEQ ID NO:181和VL序列SEQ ID NO:182。
在一些实施方案中,该癌症是肺癌,成胶质细胞瘤,宫颈癌,卵巢癌,乳腺癌,结肠癌,结直肠癌,输卵管癌,腹膜癌,肾癌(kidney cancer),肾癌(renal cancer),非霍奇金(Hodgkin)氏淋巴瘤,前列腺癌,胰腺癌,软组织肉瘤,卡波西(kaposi)氏肉瘤,类癌癌,头和颈癌,间皮瘤,多发性骨髓瘤,非小细胞肺癌,成神经细胞瘤,黑素瘤,胃癌,或肝癌。在一些实施方案中,该癌症是妇科癌症。在一些实施方案中,该癌症是晚期,顽固性,复发性,化疗抗性,和/或铂抗性的。在一些实施方案中,该个体具有癌症或已经诊断有癌症。在一些实施方案中,该治疗在该治疗停止后在该个体中导致持久响应。在一些实施方案中,该OX40结合激动剂在该抗血管发生剂之前,与该抗血管发生剂同时,或在该抗血管发生剂之后施用。在一些实施方案中,该个体是人。在一些实施方案中,该抗血管发生剂和/或该OX40结合激动剂静脉内,肌肉内,皮下,脑脊髓内,表面,口服,经皮,腹膜内,眼窝内,通过植入,通过吸入,鞘内,室内,关节内,滑膜内,或鼻内施用。在一些实施方案中,该方法进一步包括施用化疗剂用于治疗癌症或延迟癌症进展。
要理解,可以组合本文所述各个实施方案的一个,一些,或所有特性以形成本发明的其它实施方案。本发明的这些和其它方面对本领域技术人员会变得显而易见。通过下面的详述进一步描述本发明的这些和其它实施方案。
附图简述
图1显示在CT26肿瘤模型中不同处理对抑制肿瘤生长的功效。为每一个实验组将平均肿瘤体积(y轴)随时间(x轴)绘图。实验组为抗OX40和抗GP120处理(加号),抗GP120处理(圆形),抗VEGF和抗GP120处理(三角形),和抗VEGF和抗OX40处理(X)。
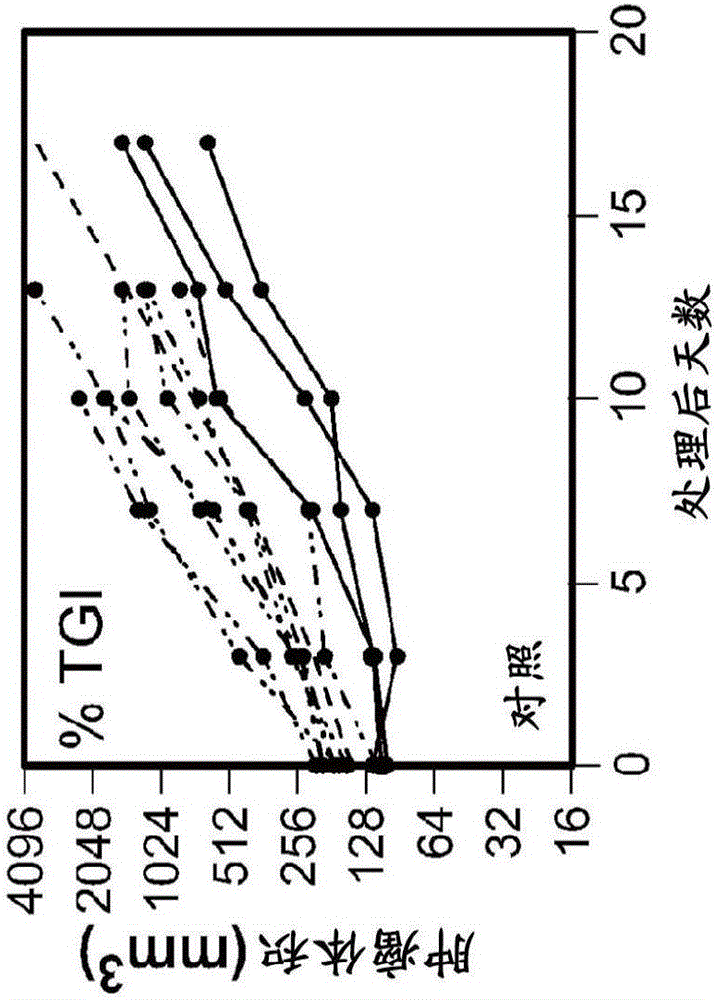
图2A-2D随时间跟踪在下述处理组中来自小鼠个体的肿瘤体积:抗GP120(对照;图2A),抗VEGF+抗GP120(图2B),抗OX40+抗GP120(图2C),和抗VEGF+抗OX40(图2D)。黑色实线和短划及点线代表来自每一个实验组内的小鼠个体的肿瘤。黑色实线代表实验结束时仍然活着的小鼠,而短划及点线代表由于肿瘤溃烂或肿瘤大小超过2000mm3而在实验结束之前处以安乐死的小鼠。均匀的短划线描绘接受单独的抗GP120的小鼠(如通过箭标注的)随时间的平均肿瘤体积。不均匀的短划线代表每一个实验组内随时间的平均肿瘤体积(如通过箭标注的)。每幅图左上角的百分比是%肿瘤生长抑制(TGI),是针对接受单独的抗GP120的小鼠判断的。
图3A和3B显示在CT26肿瘤模型中抗VEGF处理后升高的肿瘤内树突细胞激活。图3A显示升高的髓样树突细胞(CD11b+)激活。图3B显示升高的非髓样树突细胞(CD11b-)激活。星号指示使用Student氏t检验确定的统计学显著性,其中假设不等方差和显著性水平0.05(*指示p<0.05)。
发明详述
一方面,本文中提供的是用于在个体中治疗癌症或延迟癌症进展的方法,组合物和用途,其包括施用有效量的抗血管发生剂和OX40结合激动剂。
I.定义
术语“功能障碍”在免疫功能障碍的背景中指降低的对抗原性刺激的免疫响应性的状态。
如本文中使用的,术语“功能障碍”还包括对抗原识别的不感受或不响应,特别地,将抗原识别转化成下游T细胞效应器功能,诸如增殖,细胞因子生成(例如γ干扰素)和/或靶细胞杀伤的能力受损。
“增强T细胞功能”意指诱导,引起或刺激效应或记忆T细胞具有更新,持续或放大的生物学功能。增强T细胞功能的例子包括:相对于干预前的此类水平,升高的来自CD8+效应T细胞的γ-干扰素分泌,升高的来自CD4+记忆和/或效应T细胞的γ-干扰素分泌,升高的CD4+效应和/或记忆T细胞增殖,升高的CD8+效应T细胞增殖,升高的抗原响应性(例如清除)。在一个实施方案中,增强的水平是至少50%,或者60%,70%,80%,90%,100%,120%,150%,200%。测量此增强的方式是本领域普通技术人员已知的。
“肿瘤免疫”指肿瘤逃避免疫识别和清除的过程。如此,作为治疗概念,肿瘤免疫在此类逃避减弱时得到“治疗”,并且肿瘤被免疫系统识别并攻击。肿瘤识别的例子包括肿瘤结合,肿瘤收缩和肿瘤清除。
“免疫原性”指特定物质引发免疫应答的能力。肿瘤是免疫原性的,并且增强肿瘤免疫原性有助于通过免疫应答清除肿瘤细胞。
“持续应答”指在停止处理后对降低肿瘤生长的持续影响。例如,与施用阶段开始时的大小相比,肿瘤大小可以保持为相同或更小。在一些实施方案中,持续应答具有与处理持续时间至少相同的持续时间,处理持续时间的至少1.5倍,2.0倍,2.5倍,或3.0倍长度。
出于本文中的目的,“受体人框架”指包含自人免疫球蛋白框架或如下文定义的人共有框架衍生的轻链可变域(VL)框架或重链可变域(VH)框架的氨基酸序列的框架。自人免疫球蛋白框架或人共有框架“衍生”的受体人框架可以包含其相同的氨基酸序列,或者它可以含有氨基酸序列变化。在一些实施方案中,氨基酸变化的数目是10或更少,9或更少,8或更少,7或更少,6或更少,5或更少,4或更少,3或更少,或2或更少。在一些实施方案中,VL受体人框架与VL人免疫球蛋白框架序列或人共有框架序列在序列上相同。
“亲和力”指分子(例如抗体)的单一结合位点与其结合配偶体(例如抗原)之间全部非共价相互作用总和的强度。除非另有指示,如本文中使用的,“结合亲和力”指反映结合对的成员(例如抗体和抗原)之间1:1相互作用的内在结合亲和力。分子X对其配偶体Y的亲和力通常可以用解离常数(Kd)来表述。亲和力可以通过本领域知道的常用方法来测量,包括本文中所描述的方法。下文描述了用于测量结合亲和力的具体的说明性和例示性的实施方案。
如本文中使用的,“激动性抗体”指活化它所结合的抗原的生物学活性的抗体。
“抗体依赖性细胞介导的细胞毒性”或“ADCC”指其中结合到某些细胞毒性细胞(例如NK细胞,嗜中性粒细胞和巨噬细胞)上存在的Fc受体(FcR)上的分泌型免疫球蛋白使得这些细胞毒性效应细胞能够特异性结合携带抗原的靶细胞,随后用细胞毒素杀死靶细胞的细胞毒性形式。介导ADCC的主要细胞,NK细胞,只表达FcγRIII,而单核细胞表达FcγRI,FcγRII和FcγRIII。Ravetch and Kinet,Annu.Rev.Immunol.9:457-92(1991)第464页表3总结了造血细胞上的FcR表达。为了评估目的分子的ADCC活性,可进行体外ADCC测定法,诸如美国专利No.5,500,362或5,821,337或美国专利No.6,737,056(Presta)中所记载的。可用于此类测定法的效应细胞包括PBMC和NK细胞。或者/另外,可在体内评估目的分子的ADCC活性,例如在动物模型中,诸如Clynes et al.,PNAS(USA)95:652-656(1998)中所披露的。本文实施例中提供了用于评估ADCC活性的一种例示性测定法。
术语“抗OX40抗体”和“结合OX40的抗体”指能够以足够亲和力结合OX40,使得该抗体可作为诊断剂和/或治疗剂用于靶向OX40的抗体。在一个实施方案中,根据例如通过放射免疫测定法(RIA)的测量,抗OX40抗体结合无关的,非OX40的蛋白质的程度小于该抗体对OX40的结合的约10%。在某些实施方案中,结合OX40的抗体具有≤1μM,≤100nM,≤10nM,≤1nM,≤0.1nM,≤0.01nM,或≤0.001nM(例如10-8M或更少,例如10-8M到10-13M,例如10-9M到10-13M)的解离常数(Kd)。在某些实施方案中,抗OX40抗体结合在来自不同物种的OX40中保守的OX40表位。
如本文中使用的,术语“结合”,“特异性结合”或“对……特异性的”指可测量且可再现的相互作用,诸如靶物和抗体之间的结合,其确定在存在分子(包括生物学分子)的异质群体的情况中靶物的存在。例如,结合或特异性结合靶物(其可以是表位)的抗体是以比其结合其它靶物更大的亲和力,亲合力,更容易,和/或以更大的持续时间结合此靶物的抗体。在一个实施方案中,抗体结合无关靶物的程度小于抗体结合靶物的约10%,如例如通过放射性免疫测定法(RIA)测量的。在某些实施方案中,特异性结合靶物的抗体具有≤1μM,≤100nM,≤10nM,≤1nM,或≤0.1nM的解离常数(Kd)。在某些实施方案中,抗体特异性结合蛋白质上在来自不同物种的蛋白质间保守的表位。在另一个实施方案中,特异性结合可以包括但不需要排他结合。
本文中的术语“抗体”以最广义使用,并且涵盖各种抗体结构,包括但不限于单克隆抗体,多克隆抗体,多特异性抗体(例如双特异性抗体),和抗体片段,只要它们展现出期望的抗原结合活性。
“抗体片段”指与完整抗体不同的分子,其包含完整抗体的一部分且结合完整抗体结合的抗原。抗体片段的例子包括但不限于Fv,Fab,Fab’,Fab’-SH,F(ab’)2;双抗体;线性抗体;单链抗体分子(例如scFv);和由抗体片段形成的多特异性抗体。
与参照抗体“结合相同表位的抗体”指在竞争测定法中将参照抗体对其抗原的结合阻断50%或更多的抗体,且相反,参照抗体在竞争测定法中将该抗体对其抗原的结合阻断50%或更多。本文中提供了例示性的竞争测定法。
术语“结合结构域”指多肽中能结合另一分子的区域。在FcR的情况中,结合结构域可以包含其多肽链(例如其α链)中负责Fc区结合的部分。一种有用的结合结构域是FcRα链的胞外结构域。
具有FcR,ADCC或吞噬活性“改变”了的变异IgG Fc的多肽指与亲本多肽或者与包含天然序列Fc区的多肽相比FcR结合活性(例如FcγR)和/或ADCC活性和/或吞噬活性得到增强或减弱的多肽。
如本文中使用的,术语“OX40”指来自任何脊椎动物来源,包括哺乳动物诸如灵长类(例如人)和啮齿类(例如小鼠和大鼠)的任何天然OX40,除非另有说明。该术语涵盖“全长”,未加工的OX40以及因细胞中的加工所致的任何形式的OX40。该术语还涵盖OX40的天然发生变体,例如剪接变体或等位变体。一种例示性的缺少信号肽的人OX40的氨基酸序列显示于SEQ ID NO:1。
“OX40活化”指OX40受体的活化。通常,OX40活化导致信号转导。
术语“癌症”和“癌性”指或描述哺乳动物中特征通常为细胞生长不受调控的生理疾患。此定义中包括良性和恶性癌症。癌症的例子包括但不限于癌瘤,淋巴瘤,母细胞瘤,肉瘤,和白血病。此类癌症的更具体例子包括上皮卵巢癌,输卵管癌,原发性腹膜癌,鳞状细胞癌,肺癌(包括小细胞肺癌,非小细胞肺癌,肺的腺癌,和肺的鳞癌),腹膜癌,肝细胞癌,胃癌(gastric or stomach cancer)(包括胃肠癌),胰腺癌,成胶质细胞瘤,宫颈癌,卵巢癌(包括铂敏感性和铂抗性卵巢癌),肝癌(liver cancer or hepatic carcinoma),膀胱癌,肝瘤(hepatoma),成神经细胞瘤,黑素瘤,乳腺癌,结肠癌,结直肠癌,输卵管,腹膜,子宫内膜或子宫癌,妇科癌症(例如卵巢,腹膜,输卵管,宫颈,子宫内膜,阴道,和外阴癌),唾液腺癌,肾癌(kidney or renal cancer),前列腺癌,外阴癌,甲状腺癌,软组织肉瘤,卡波西(kaposi)氏肉瘤,类癌癌,间皮瘤,多发性骨髓瘤,及各种类型的头和颈癌,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金(Hodgkin)氏淋巴瘤(NHL),小淋巴细胞性(SL)NHL,中级/滤泡性NHL,中级弥漫性NHL,高级成免疫细胞性NHL,高级成淋巴细胞性NHL,高级小无核裂细胞性NHL,贮积病(bulky disease)NHL,套细胞淋巴瘤,AIDS相关淋巴瘤,和瓦尔登斯特伦(Waldenstrom)氏巨球蛋白血症),慢性淋巴细胞性白血病(CLL),急性成淋巴细胞性白血病(ALL),毛细胞性白血病,慢性成髓细胞性白血病,和移植后淋巴增殖性病症(PTLD),以及与瘢痣病(phakomatoses),水肿(诸如与脑瘤有关的)和梅格斯(Meigs)氏综合征有关的异常血管增殖。
术语“细胞增殖性病症”和“增殖性病症”指与一定程度的异常细胞增殖有关的病症。在一个实施方案中,细胞增殖性病症指癌症。
术语“嵌合”抗体指其中的重和/或轻链的一部分自特定的来源或物种衍生,而重和/或轻链的剩余部分自不同来源或物种衍生的抗体。
抗体的“类”指其重链拥有的恒定域或恒定区的类型。抗体有5大类:IgA,IgD,IgE,IgG,和IgM,并且这些中的几种可以进一步分成亚类(同种型),例如,IgG1,IgG2,IgG3,IgG4,IgA1,和IgA2。与不同类免疫球蛋白对应的重链恒定域分别称作α,δ,ε,γ,和μ。
“补体依赖性细胞毒性”或“CDC”指存在补体时对靶细胞的溶解。经典补体途径的激活是由补体系统第一组分(C1q)结合抗体(适宜亚类的)起始的,该抗体已结合至其关联抗原。为了评估补体激活,可进行CDC测定法,例如如Gazzano-Santoro et al.,J.Immunol.Methods 202:163(1996)中所记载的。具有更改的Fc区氨基酸序列(具有变异Fc区的多肽)及提高或降低的C1q结合能力的多肽变体记载于例如美国专利No.6,194,551 B1和WO 1999/51642。还可参见例如Idusogie et al.,J.Immunol.164:4178-4184(2000)。
术语“细胞抑制剂”指在体外或在体内阻滞细胞生长的化合物或组合物。如此,细胞抑制剂可以是显著降低处于S期的细胞百分比的药剂。细胞抑制剂的其它的例子包括通过诱导G0/G1停滞或M期停滞来阻断细胞周期行进的药剂。人源化抗Her2抗体曲妥珠单抗(trastuzumab)是诱导G0/G1阻滞的细胞抑制剂的一个例子。经典的M期阻断剂包括长春药类(vincas)(长春新碱(vincristine)和长春碱(vinblastine)),紫杉烷类(taxanes),和拓扑异构酶II抑制剂诸如多柔比星(doxorubicin),表柔比星(epirubicin),柔红霉素(daunorubicin),依托泊苷(etoposide)和博来霉素(bleomycin)。某些阻滞G1的药剂也溢出进入S期停滞,例如DNA烷化剂类诸如他莫昔芬(tamoxifen),泼尼松(prednisone),达卡巴嗪(dacarbazine),双氯乙基甲胺(mechlorethamine),顺铂(cisplatin),甲氨蝶呤(methotrexate),5-氟尿嘧啶(5-fluorouracil)和ara-C。更多信息可参见Mendelsohn和Israel编,《TheMolecular Basis of Cancer》,第1章,题为“Cell cycle regulation,oncogenes,and antineoplastic drugs”,Murakami等,W.B.Saunders,Philadelphia,1995,例如第13页。紫杉烷类(帕利他赛(paclitaxel)和多西他赛(docetaxel))是衍生自紫杉树的抗癌药。衍生自欧洲紫杉的多西他赛(Rhone-Poulenc Rorer)是帕利他赛(Bristol-Myers Squibb)的半合成类似物。帕利他赛和多西他赛促进由微管蛋白二聚体装配成微管并通过防止解聚使微管稳定,导致对细胞中有丝分裂的抑制。
如本文中使用的,术语“细胞毒剂”指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒剂包括但不限于:放射性同位素(例如At211,I131,I125,Y90,Re186,Re188,Sm153,Bi212,P32,Pb212和Lu的放射性同位素);化学治疗剂或药物(例如甲氨蝶呤(methotrexate),阿霉素(adriamicin),长春花生物碱类(vinca alkaloids)(长春新碱(vincristine),长春碱(vinblastine),依托泊苷(etoposide)),多柔比星(doxorubicin),美法仑(melphalan),丝裂霉素(mitomycin)C,苯丁酸氮芥(chlorambucil),柔红霉素(daunorubicin)或其它嵌入剂);生长抑制剂;酶及其片段,诸如溶核酶;抗生素;毒素,诸如小分子毒素或者细菌,真菌,植物或动物起源的酶活性毒素,包括其片段和/或变体;及下文公开的各种抗肿瘤或抗癌剂。
“消减性抗OX40抗体”指杀死或消减表达OX40的细胞的抗OX40抗体。消减表达OX40的细胞可以通过多种机制来实现,诸如抗体依赖性细胞介导的细胞毒性和/或吞噬作用。消减表达OX40的细胞可以在体外测定,而且本文中提供了体外ADCC和吞噬作用测定法的例示性方法。在一些实施方案中,表达OX40的细胞是人CD4+效应T细胞。在一些实施方案中,表达OX40的细胞是表达人OX40的转基因BT474细胞。
“效应器功能”指那些可归于抗体Fc区且随抗体同种型而变化的生物学活性。抗体效应器功能的例子包括:C1q结合和补体依赖性细胞毒性(CDC);Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如B细胞受体)下调;和B细胞活化。
“有效量”至少是实现特定病症的可测量改善或预防需要的最小量。本文中的有效量可以随诸如患者的疾病状态,年龄,性别,和重量,和抗体引发个体中期望的应答的能力等因素而变化。有效量也是治疗有益效果超过治疗的任何毒性或不利效果的量。为了预防性使用,有益或期望的结果包括如下的结果,诸如消除或降低风险,减轻严重性,或者延迟疾病的发作,包括疾病的生物化学,组织学和/或行为症状,其并发症和疾病形成期间呈现的中间病理学表型。为了治疗性使用,有益或期望的结果包括临床结果,诸如减少源自疾病的一种或多种症状,提高那些患有疾病的对象的生命质量,降低治疗疾病需要的其它药物的剂量,增强另一种药物的效果(诸如经由靶向),延迟疾病的进展,和/或延长存活。在癌症或肿瘤的情况中,药物的有效量在减少癌细胞的数目;降低肿瘤大小;抑制(即在一定程度上减缓或者期望地停止)癌细胞浸润入外周器官中;抑制(即在一定程度上减缓且期望地停止)肿瘤转移;在一定程度上抑制肿瘤生长;和/或在一定程度上减轻一种或多种与病症有关的症状中可以具有效果。可以在一次或多次施用中施用有效量。出于本发明的目的,药物,化合物,或药物组合物的有效量是足以直接或间接实现预防或治疗性处理的量。如在临床背景中理解的,药物,化合物,或药物组合物的有效量可以与或不与另一种药物,化合物,或药物组合物一起实现。如此,可以在施用一种或多种治疗剂的背景中考虑“有效量”,并且若与一种或多种其它药剂一起,可以实现期望的结果或者实现了期望的结果,则可以认为单一药剂以有效量给予。
“Fc受体”或“FcR”描述结合抗体Fc区的受体。在一些实施方案中,FcR是天然人FcR。在一些实施方案中,FcR是结合IgG抗体的FcR(γ受体),包括FcγRI,FcγRII和FcγRIII亚类的受体,包括那些受体的等位变体和可变剪接形式。FcγRII受体包括FcγRIIA(“活化受体”)和FcγRIIB(“抑制受体”),它们具有相似的氨基酸序列,区别主要在于其胞质结构域。活化受体FcγRIIA在其胞质结构域中包含免疫受体基于酪氨酸的活化基序(ITAM)。抑制受体FcγRIIB在其胞质结构域中包含免疫受体基于酪氨酸的抑制基序(ITIM)(参见例如Annu.Rev.Immunol.15:203-234(1997))。FcR的综述参见例如Ravetch and Kinet,Annu.Rev.Immunol.9:457-492(1991);Capel et al.,Immunomethods 4:25-34(1994);及de Haas et al.,J.Lab.Clin.Med.126:330-41(1995)。术语“FcR”在本文中涵盖其它FcR,包括那些未来将会鉴定的。术语“Fc受体”或“FcR”还包括新生儿受体,FcRn,其负责将母体IgG转移给胎儿(Guyer et al.,J.Immunol.117:587(1976)及Kim et al.,J.Immunol.24:249(1994))和调节免疫球蛋白的体内稳态。测量对FcRn的结合的方法是已知的(参见例如Ghetie and Ward.,Immunol.Today 18(12):592-598(1997);Ghetie et al.,Nature Biotechnology,15(7):637-640(1997);Hinton et al.,J.Biol.Chem.279(8):6213-6216(2004);WO 2004/92219(Hinton et al.))。可测定人FcRn高亲和力结合多肽与人FcRn的体内结合和血清半衰期,例如在表达人FcRn的转基因小鼠或经转染的人细胞系中,或者在施用了具有变异Fc区的多肽的灵长类动物中。WO 2000/42072(Presta)记载了对FcR的结合提高或降低的抗体变体。还可参见例如Shields et al.,J.Biol.Chem.9(2):6591-6604(2001)。
本文中的术语“Fc区”用于定义免疫球蛋白重链中至少含有恒定区一部分的C端区。该术语包括天然序列Fc区和变体Fc区。在一个实施方案中,人IgG重链Fc区自Cys226,或自Pro230延伸至重链的羧基端。然而,Fc区的C端赖氨酸(Lys447)可以存在或不存在。除非本文中另有规定,Fc区或恒定区中的氨基酸残基的编号方式依照EU编号系统,又称作EU索引,如记载于Kabat等,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD,1991。
“功能性Fc区”拥有天然序列Fc区的“效应器功能”。例示性的“效应器功能”包括C1q结合;CDC;Fc受体结合;ADCC;吞噬作用;细胞表面受体(例如B细胞受体;BCR)下调等。此类效应器功能一般要求Fc区与结合结构域(例如抗体可变域)联合,而且可以使用多种测定法来评估,例如本文定义中所公开的。
“人效应细胞”指表达一种或多种FcR并行使效应器功能的白细胞。在某些实施方案中,该细胞至少表达FcγRIII并行使ADCC效应器功能。介导ADCC的人白细胞的例子包括外周血单个核细胞(PBMC),天然杀伤(NK)细胞,单核细胞,细胞毒性T细胞和嗜中性粒细胞。效应细胞可以从其天然来源分离,例如血液。
“框架”或“FR”指除高变区(HVR)残基外的可变域残基。一般地,可变域的FR由4个FR域组成:FR1,FR2,FR3,和FR4。因而,HVR和FR序列在VH(或VL)中一般以如下的顺序出现:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。
术语“全长抗体”,“完整抗体”,和“全抗体”在本文中可互换使用,指与天然抗体结构具有基本上类似的结构或者具有含有如本文中所限定的Fc区的重链的抗体。
术语“宿主细胞”,“宿主细胞系”,和“宿主细胞培养物”可互换使用,并且指已经导入外源核酸的细胞,包括此类细胞的后代。宿主细胞包括“转化体”和“经转化的细胞”,其包括原代的经转化的细胞及自其衍生的后代而不考虑传代的次数。后代在核酸内容物上可以与亲本细胞不完全相同,而是可以含有突变。本文中包括具有与在初始转化细胞中筛选或选择的相同功能或生物学活性的突变体后代。
“人抗体”指拥有与由人或人细胞生成的或利用人抗体全集或其它人抗体编码序列自非人来源衍生的抗体的氨基酸序列对应的氨基酸序列的抗体。人抗体的此定义明确排除包含非人抗原结合残基的人源化抗体。
“人共有框架”指代表人免疫球蛋白VL或VH框架序列选集中最常存在的氨基酸残基的框架。通常,人免疫球蛋白VL或VH序列选集来自可变域序列亚组。通常,序列亚组是如Kabat等,Sequences of Proteins of Immunological Interest,第五版,NIH Publication 91-3242,Bethesda MD(1991),第1-3卷中的亚组。在一个实施方案中,对于VL,亚组是如Kabat等,见上文中的亚组κI。在一个实施方案中,对于VH,亚组是如Kabat等,见上文中的亚组III。
“人源化”抗体指包含来自非人HVR的氨基酸残基和来自人FR的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体会包含至少一个,通常两个基本上整个可变域,其中所有或基本上所有HVR(例如,CDR)对应于非人抗体的那些,且所有或基本上所有FR对应于人抗体的那些。任选地,人源化抗体可以至少包含自人抗体衍生的抗体恒定区的一部分。抗体,例如非人抗体的“人源化形式”指已经经历人源化的抗体。
如本文中使用的,术语“高变区”或“HVR”指抗体可变域中在序列上高变的(“互补决定区”或“CDR”)和/或形成结构上限定的环(“高变环”)和/或含有抗原接触残基(“抗原接触”)的每个区。一般地,抗体包含6个HVR:三个在VH中(H1,H2,H3),且三个在VL中(L1,L2,L3)。本文中的例示性HVR包括:
(a)高变环,存在于氨基酸残基26-32(L1),50-52(L2),91-96(L3),26-32(H1),53-55(H2),和96-101(H3)(Chothia and Lesk,J.Mol.Biol.196:901-917(1987));
(b)CDR,存在于氨基酸残基24-34(L1),50-56(L2),89-97(L3),31-35b(H1),50-65(H2),和95-102(H3)(Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,MD(1991));
(c)抗原接触,存在于氨基酸残基27c-36(L1),46-55(L2),89-96(L3),30-35b(H1),47-58(H2),和93-101(H3)(MacCallum et al.J.Mol.Biol.262:732-745(1996));和
(d)(a),(b),和/或(c)的组合,包括HVR氨基酸残基46-56(L2),47-56(L2),48-56(L2),49-56(L2),26-35(H1),26-35b(H1),49-65(H2),93-102(H3),和94-102(H3)。
除非另有说明,HVR残基及可变域中的其它残基(例如FR残基)在本文中是依照Kabat等,见上文编号的。
“免疫缀合物”指与一种或多种异源分子,包括但不限于细胞毒剂缀合的抗体。
“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于驯养的动物(例如,牛,绵羊,猫,犬,和马),灵长类(例如,人和非人灵长类诸如猴),家兔,和啮齿类(例如,小鼠和大鼠)。在某些实施方案中,个体或受试者是人。
“促进细胞生长或增殖”意指将细胞的生长或增殖提高至少10%,20%,30%,40%,50%,60%,70%,80%,90%,95%,或100%。
“分离的”抗体指已经与其天然环境的组分分开的抗体。在一些实施方案中,抗体纯化至大于95%或99%的纯度,如通过例如电泳(例如,SDS-PAGE,等电聚焦(IEF),毛细管电泳)或层析(例如,离子交换或反相HPLC)测定的。关于用于评估抗体纯度的方法的综述,见例如Flatman等,J.Chromatogr.B 848:79-87(2007)。
“分离的”核酸指已经与其天然环境的组分分开的核酸分子。分离的核酸包括通常含有核酸分子的细胞中含有的核酸分子,但是核酸分子在染色体外或在与其天然染色体位置不同的染色体位置处存在。
“编码抗OX40抗体的分离的核酸”指编码抗体重和轻链(或其片段)的一种或多种核酸分子,包括单一载体或不同载体中的此类核酸分子,和存在于宿主细胞中的一个或多个位置的此类核酸分子。
如本文中使用的,术语“单克隆抗体”指从一群基本上同质的抗体获得的抗体,即构成群体的各个抗体是相同的和/或结合相同表位,除了例如含有天然存在的突变或在单克隆抗体制备物的生成期间发生的可能的变体抗体外,此类变体一般以极小量存在。与通常包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物不同,单克隆抗体制备物的每种单克隆抗体针对抗原上的单一决定簇。如此,修饰语“单克隆”指示抗体自一群基本上同质的抗体获得的特性,而不应解释为要求通过任何特定方法来生成抗体。例如,可以通过多种技术来生成要依照本发明使用的单克隆抗体,包括但不限于杂交瘤方法,重组DNA方法,噬菌体展示方法,和利用含有所有或部分人免疫球蛋白基因座的转基因动物的方法,本文中描述了用于生成单克隆抗体的此类方法和其它例示性方法。
“裸抗体”指未与异源模块(例如细胞毒性模块)或放射性标记物缀合的抗体。裸抗体可以存在于药物配制剂中。
“天然抗体”指具有不同结构的天然存在的免疫球蛋白分子。例如,天然IgG抗体是约150,000道尔顿的异四聚糖蛋白,由二硫化物键合的两条相同轻链和两条相同重链构成。从N至C端,每条重链具有一个可变区(VH),又称作可变重域或重链可变域,接着是三个恒定域(CH1,CH2,和CH3)。类似地,从N至C端,每条轻链具有一个可变区(VL),又称作可变轻域或轻链可变域,接着是一个恒定轻(CL)域。根据其恒定域氨基酸序列,抗体轻链可归入两种类型中的一种,称作卡帕(κ)和拉姆达(λ)。“天然序列Fc区”包含与在自然界中找到的Fc区的氨基酸序列相同的氨基酸序列。天然序列人Fc区包括天然序列人IgG1 Fc区(非A和A同种异型);天然序列人IgG2 Fc区;天然序列人IgG3 Fc区;和天然序列人IgG4 Fc区;及其天然存在变体。
术语“包装插页”用于指治疗产品的商业包装中通常包含的用法说明书,其含有关于涉及此类治疗产品应用的适应症,用法,剂量,施用,联合疗法,禁忌症和/或警告的信息。
关于参照多肽序列的“百分比(%)氨基酸序列同一性”定义为比对序列并在必要时引入缺口以获取最大百分比序列同一性后,且不将任何保守替代视为序列同一性的一部分时,候选序列中与参照多肽序列中的氨基酸残基相同的氨基酸残基的百分率。为测定百分比氨基酸序列同一性目的的对比可以以本领域技术范围内的多种方式进行,例如使用公众可得到的计算机软件,诸如BLAST,BLAST-2,ALIGN或Megalign(DNASTAR)软件。本领域技术人员可以决定用于比对序列的合适参数,包括对所比较序列全长获得最大对比所需的任何算法。然而,为了本发明的目的,%氨基酸序列同一性值是使用序列比较计算机程序ALIGN-2产生的。ALIGN-2序列比较计算机程序由Genentech,Inc.编写,并且源代码已经连同用户文档一起提交给美国版权局(US Copyright Office,Washington D.C.,20559),其中其以美国版权注册号TXU510087注册。公众自Genentech,Inc.,South San Francisco,California可获得ALIGN-2程序,或者可以从源代码编译。ALIGN2程序应当编译成在UNIX操作系统,包括数码UNIX V4.0D上使用。所有序列比较参数由ALIGN-2程序设定且不变。
在采用ALIGN-2来比较氨基酸序列的情况中,给定氨基酸序列A相对于(to),与(with),或针对(against)给定氨基酸序列B的%氨基酸序列同一性(或者可表述为具有或包含相对于,与,或针对给定氨基酸序列B的某一%氨基酸序列同一性的给定氨基酸序列A)如下计算:
分数X/Y乘100
其中X是由序列比对程序ALIGN-2在该程序的A和B比对中评分为相同匹配的氨基酸残基数,且其中Y是B中的氨基酸残基总数。应当领会,若氨基酸序列A的长度与氨基酸序列B的长度不相等,则A相对于B的%氨基酸序列同一性将不等于B相对于A的%氨基酸序列同一性。除非另有明确说明,本文中所使用的所有%氨基酸序列同一性值都是依照上一段所述,使用ALIGN-2计算机程序获得的。
术语“药物配制剂”指处于如下的形式,使得容许其中含有的活性成分的生物学活性是有效的,且不含对会接受配制剂施用的受试者具有不可接受的毒性的别的组分的制剂。
“药学可接受载剂”指药物配制剂中与活性成分不同的,且对受试者无毒的成分。药学可接受载剂包括但不限于缓冲剂,赋形剂,稳定剂,或防腐剂。
如本文中使用的,“治疗”(及其语法变化形式,诸如“处理”或“处置”)指试图改变所治疗个体的自然进程的临床干预,可以是为了预防或在临床病理学的进程中进行。治疗的期望效果包括但不限于预防疾病的发生或复发,缓解症状,削弱疾病的任何直接或间接病理学后果,预防转移,减缓疾病进展的速率,改善或减轻疾病状态,及免除或改善预后。在有些实施方案中,本发明的抗体用于延迟疾病的发生/发展,或用于减缓疾病的进展。
如本文中使用的,“与……联合/组合/一起”指在一种治疗形态外施用另一种治疗形态。因而,“与……联合/组合/一起”指在对个体施用一种治疗形态之前,期间,或者之后施用另一种治疗形态。例如,抗血管发生剂可以与OX40结合激动剂联合施用。抗血管发生剂和OX40结合激动剂可以与另一种化疗剂联合施用。
术语“肿瘤”指所有赘生性(neoplastic)细胞生长和增殖,无论是恶性的还是良性的,及所有癌前(pre-cancerous)和癌性细胞和组织。术语“癌症”,“癌性”,“细胞增殖性病症”,“增殖性病症”和“肿瘤”在本文中提到时并不互相排斥。
术语“可变区”或“可变域”指抗体重或轻链中牵涉抗体结合抗原的域。天然抗体的重链和轻链可变域(分别为VH和VL)一般具有类似的结构,其中每个域包含4个保守的框架区(FR)和3个高变区(HVR)。(见例如Kindt等,Kuby Immunology,第6版,W.H.Freeman and Co.,第91页(2007))。单个VH或VL域可以足以赋予抗原结合特异性。此外,可以分别使用来自结合抗原的抗体的VH或VL域筛选互补VL或VH域的文库来分离结合特定抗原的抗体。见例如,Portolano等,J.Immunol.150:880-887(1993);Clarkson等,Nature 352:624-628(1991)。
“变异Fc区”包含由于至少一处氨基酸修饰(优选一处或多处氨基酸替代)而与天然序列Fc区有所不同的氨基酸序列。优选的是,变异Fc区与天然序列Fc区相比或与亲本多肽的Fc区相比具有至少一处氨基酸替代,例如在天然序列Fc区中或在亲本多肽的Fc区中具有约1处至约10处氨基酸替代,优选约1处至约5处氨基酸替代。变异Fc区在本文中优选与天然序列Fc区和/或亲本多肽的Fc区拥有至少约80%的同源性,最优选与它们具有至少约90%的同源性,更优选与它们具有至少约95%的同源性。
如本文中使用的,术语“载体”指能够增殖与其连接的另一种核酸的核酸分子。该术语包括作为自身复制型核酸结构的载体及整合入接受其导入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作连接的核酸的表达。此类载体在本文中称为“表达载体”。
“VH亚组III共有框架”包含从Kabat等人的可变重链亚组III中的氨基酸序列获得的共有序列。在一个实施方案中,VH亚组III共有框架氨基酸序列包含下列各序列的至少一部分或整个:EVQLVESGGGLVQPGGSLRLSCAAS(SEQ ID NO:222)-H1-WVRQAPGKGLEWV(SEQ ID NO:223)-H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC(SEQ ID NO:224)-H3-WGQGTLVTVSS(SEQ ID NO:225)。
“VL亚组I共有框架”包含从Kabat等人的可变轻链κ亚组I中的氨基酸序列获得的共有序列。在一个实施方案中,VL亚组I共有框架氨基酸序列包含下列各序列的至少一部分或整个:DIQMTQSPSSLSASVGDRVTITC(SEQ ID NO:226)-L1-WYQQKPGKAPKLLIY(SEQ ID NO:227)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC(SEQ ID NO:228)-L3-FGQGTKVEIK(SEQ ID NO:229)。
如本文中使用的,术语“细胞毒剂”指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒剂包括但不限于:放射性同位素(例如At211,I131,I125,Y90,Re186,Re188,Sm153,Bi212,P32,Pb212和Lu的放射性同位素);化疗剂;生长抑制剂;酶及其片段,诸如溶核酶;和毒素,诸如小分子毒素或者细菌,真菌,植物或动物起源的酶活性毒素,包括其片段和/或变体。例示性的细胞毒剂可选自抗微管剂,铂配位复合物,烷化剂,抗生剂,拓扑异构酶II抑制剂,抗代谢物,拓扑异构酶I抑制剂,激素和激素类似物,信号转导途径抑制剂,非受体酪氨酸激酶血管发生抑制剂,免疫治疗剂,促凋亡剂,LDH-A的抑制剂,脂肪酸生物合成的抑制剂,细胞周期信号传导抑制剂,HDAC抑制剂,蛋白酶体抑制剂,和癌代谢的抑制剂。
在一个实施方案中,细胞毒剂选自抗微管剂,铂配位复合物,烷化剂,抗生剂,拓扑异构酶II抑制剂,抗代谢物,拓扑异构酶I抑制剂,激素和激素类似物,信号转导途径抑制剂,非受体酪氨酸激酶血管发生抑制剂,免疫治疗剂,促凋亡剂,LDH-A的抑制剂,脂肪酸生物合成的抑制剂,细胞周期信号传导抑制剂,HDAC抑制剂,蛋白酶体抑制剂,和癌代谢的抑制剂。在一个实施方案中,细胞毒剂是紫杉烷(taxane)。在一个实施方案中,紫杉烷是帕利他赛(paclitaxel)或多西他赛(docetaxel)。在一个实施方案中,细胞毒剂是铂剂。在一个实施方案中,细胞毒剂是EGFR的拮抗剂。在一个实施方案中,EGFR的拮抗剂是N-(3-乙炔基苯基)-6,7-二(2-甲氧基乙氧基)喹唑啉-4-胺(例如厄洛替尼(erlotinib))。在一个实施方案中,细胞毒剂是RAF抑制剂。在一个实施方案中,RAF抑制剂是BRAF和/或CRAF抑制剂。在一个实施方案中,RAF抑制剂是维罗非尼(vemurafenib)。在一个实施方案中,细胞毒剂是PI3K抑制剂。
“化疗剂”包括在治疗癌症中有用的化学化合物。化疗剂的例子包括厄洛替尼(erlotinib)(Genentech/OSI Pharm.),硼替佐米(bortezomib)(Millennium Pharm.),双硫仑(disulfiram),没食子酸表没食子儿茶精(epigallocatechin gallate),salinosporamide A,carfilzomib,17-AAG(格尔德霉素(geldanamycin)),根赤壳菌素(radicicol),乳酸脱氢酶A(LDH-A),氟维司群(fulvestrant)(AstraZeneca),舒尼替尼(sunitib)(Pfizer/Sugen),来曲唑(letrozole)(Novartis),甲磺酸伊马替尼(imatinib mesylate)(Novartis),finasunate(Novartis),奥沙利铂(oxaliplatin)(Sanofi),5-FU(5-氟尿嘧啶),甲酰四氢叶酸(leucovorin),雷帕霉素(Rapamycin)(西罗莫司(Sirolimus),Wyeth),拉帕替尼(Lapatinib)(GSK572016,Glaxo Smith Kline),Lonafamib(SCH 66336),索拉非尼(sorafenib)(Bayer Labs),吉非替尼(gefitinib)(AstraZeneca),AG1478,烷化剂类(alkylating agents),诸如塞替派(thiotepa)和环磷酰胺(cyclophosphamide);磺酸烷基酯类(alkyl sulfonates),诸如白消安(busulfan),英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶类(aziridines),诸如苯佐替派(benzodopa),卡波醌(carboquone),美妥替派(meturedopa),和乌瑞替派(uredopa);乙撑亚胺类(ethylenimines)和甲基蜜胺类(methylamelamines),包括六甲蜜胺(altretamine),三乙撑蜜胺(triethylenemelamine),三乙撑磷酰胺(triethylenephosphoramide),三乙撑硫代磷酰胺(triethylenethiophosphoramide)和三羟甲蜜胺(trimethylomelamine);番荔枝内酯类(acetogenins)(尤其是布拉他辛(bullatacin)和布拉他辛酮(bullatacinone));喜树碱(camptothecin)(包括托泊替康(topotecan)和伊立替康(irinotecan));苔藓抑素(bryostatin);callystatin;CC-1065(包括其阿多来新(adozelesin),卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);隐藻素类(cryptophycins)(特别是隐藻素1和隐藻素8);肾上腺皮质类固醇类(adrenocorticosteroids),包括泼尼松(prednisone)和泼尼松龙(prednisolone);醋酸环丙孕酮(cyproterone acetate);5α-还原酶,包括非那雄胺(finasteride)和度他雄胺(dutasteride);vorinostat,romidepsin,panobinostat,丙戊酸(valproic acid),mocetinostat多拉司他汀(dolastatin);阿地白介素(aldesleukin),滑石(talc)duocarmycin(包括合成类似物,KW-2189和CB1-TM1);艾榴塞洛素(eleutherobin);pancratistatin;sarcodictyin;海绵抑素(spongistatin);氮芥类(nitrogen mustards),诸如苯丁酸氮芥(chlorambucil),萘氮芥(chlomaphazine),胆磷酰胺(chlorophosphamide),雌莫司汀(estramustine),异环磷酰胺(ifosfamide),双氯乙基甲胺(mechlorethamine),盐酸氧氮芥(mechlorethamine oxide hydrochloride),美法仑(melphalan),新氮芥(novembichin),苯芥胆甾醇(phenesterine),泼尼莫司汀(prednimustine),曲磷胺(trofosfamide),尿嘧啶氮芥(uracil mustard);亚硝脲类(nitrosoureas),诸如卡莫司汀(carmustine),氯脲菌素(chlorozotocin),福莫司汀(fotemustine),洛莫司汀(lomustine),尼莫司汀(nimustine),和雷莫司汀(ranimnustine);抗生素类,诸如烯二炔类抗生素(例如加利车霉素(calicheamicin),尤其是加利车霉素γ1I和加利车霉素ω1I(Angew Chem.Intl.Ed.Engl.1994,33:183-186);蒽环类抗生素(dynemicin),包括dynemicin A;二膦酸盐类(bisphosphonates),诸如氯膦酸盐(clodronate);埃斯波霉素(esperamicin);以及新制癌素(neocarzinostatin)发色团和相关色蛋白烯二炔类抗生素发色团),阿克拉霉素(aclacinomysins),放线菌素(actinomycin),氨茴霉素(authramycin),偶氮丝氨酸(azaserine),博来霉素(bleomycin),放线菌素C(cactinomycin),carabicin,洋红霉素(caminomycin),嗜癌霉素(carzinophilin),色霉素(chromomycinis),放线菌素D(dactinomycin),柔红霉素(daunorubicin),地托比星(detorubicin),6-二氮-5-氧-L-正亮氨酸,(多柔比星(doxorubicin)),吗啉代多柔比星,氰基吗啉代多柔比星,2-吡咯代多柔比星和脱氧多柔比星),表柔比星(epirubicin),依索比星(esorubicin),伊达比星(idarubicin),麻西罗霉素(marcellomycin),丝裂霉素(mitomycin)诸如丝裂霉素C,霉酚酸(mycophenolic acid),诺拉霉素(nogalamycin),橄榄霉素(olivomycin),培洛霉素(peplomycin),泊非霉素(porfiromycin),嘌呤霉素(puromycin),三铁阿霉素(quelamycin),罗多比星(rodorubicin),链黑菌素(streptonigrin),链佐星(streptozocin),杀结核菌素(tubercidin),乌苯美司(ubenimex),净司他丁(zinostatin),佐柔比星(zorubicin);抗代谢物类,诸如甲氨蝶呤(methotrexate)和5-氟尿嘧啶(fluorouracil)(5-FU);叶酸类似物,诸如二甲叶酸(denopterin),甲氨蝶呤,蝶酰三谷氨酸(pteropterin),三甲曲沙(trimetrexate);嘌呤类似物,诸如氟达拉滨(fludarabine),6-巯基嘌呤(mercaptopurine),硫咪嘌呤(thiamiprine),硫鸟嘌呤(thioguanine);嘧啶类似物,诸如安西他滨(ancitabine),阿扎胞苷(azacitidine),6-氮尿苷,卡莫氟(carmofur),阿糖胞苷(cytarabine),双脱氧尿苷(dideoxyuridine),去氧氟尿苷(doxifluridine),依诺他滨(enocitabine),氟尿苷(floxuridine);雄激素类,诸如卡鲁睾酮(calusterone),丙酸屈他雄酮(dromostanolone propionate),表硫雄醇(epitiostanol),美雄烷(mepitiostane),睾内酯(testolactone);抗肾上腺类,诸如氨鲁米特(aminoglutethimide),米托坦(mitotane),曲洛司坦(trilostane);叶酸补充剂,诸如亚叶酸(frolinic acid);醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸(aminolevulinic acid);恩尿嘧啶(eniluracil);安吖啶(amsacrine);bestrabucil;比生群(bisantrene);依达曲沙(edatraxate);地磷酰胺(defofamine);地美可辛(demecolcine);地吖醌(diaziquone);elfomithine;依利醋铵(elliptinium acetate);epothilone;依托格鲁(etoglucid);硝酸镓;羟脲(hydroxyurea);香菇多糖(lentinan);氯尼达明(lonidainine);美登木素生物碱类(maytansinoids),诸如美登素(maytansine)和安丝菌素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidamnol);二胺硝吖啶(nitraerine);喷司他丁(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸(podophyllinic acid);2-乙基酰肼(ethylhydrazide);丙卡巴肼(procarbazine);多糖复合物(JHS Natural Products,Eugene,Oreg.);雷佐生(razoxane);根霉素(rhizoxin);西索菲兰(sizofuran);螺旋锗(spirogermanium);细交链孢菌酮酸(tenuazonic acid);三亚胺醌(triaziquone);2,2',2”-三氯三乙胺;单端孢菌素类(trichothecenes)(尤其是T-2毒素,疣孢菌素(verracurin)A,杆孢菌素(roridin)A和蛇行菌素(anguidine));乌拉坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);gacytosine;阿糖胞苷(arabinoside)(“Ara-C”);环磷酰胺(cyclophosphamide);塞替派(thiotepa);类紫杉醇(taxoids),例如泰素(TAXOL)(帕利他赛(paclitaxel);Bristol-Myers Squibb Oncology,Princeton,N.J.),(无克列莫佛(Cremophor)的),帕利他赛的清蛋白改造的纳米颗粒剂型(American Pharmaceutical Partners,Schaumberg,Ill.)和泰索帝(多西他赛(docetaxel,doxetaxel);Sanofi-Aventis);苯丁酸氮芥(chloranmbucil);(吉西他滨(gemcitabine));6-硫鸟嘌呤(thioguanine);巯基嘌呤(mercaptopurine);甲氨蝶呤(methotrexate);铂类似物,诸如顺铂(cisplatin)和卡铂(carboplatin);长春碱(vinblastine);依托泊苷(etoposide)(VP-16);异环磷酰胺(ifosfamide);米托蒽醌(mitoxantrone);长春新碱(vincristine);(长春瑞滨(vinorelbine));能灭瘤(novantrone);替尼泊苷(teniposide);依达曲沙(edatrexate);道诺霉素(daunomycin);氨基蝶呤(aminopterin);卡培他滨(capecitabine)伊本膦酸盐(ibandronate);CPT-11;拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类视黄酸(retinoids),诸如视黄酸(retinoic acid);及任何上述各项的药学可接受盐,酸或衍生物。
化疗剂还包括(i)起调节或抑制激素对肿瘤作用的作用的抗激素剂,诸如抗雌激素类和选择性雌激素受体调控物类(SERM),包括例如他莫昔芬(tamoxifen)(包括柠檬酸他莫昔芬),雷洛昔芬(raloxifene),屈洛昔芬(droloxifene),iodoxyfene,4-羟基他莫昔芬,曲沃昔芬(trioxifene),那洛昔芬(keoxifene),LY117018,奥那司酮(onapristone),和(柠檬酸托瑞米芬(toremifine citrate));(ii)抑制在肾上腺中调节雌激素生成的芳香酶的芳香酶抑制剂,诸如例如4(5)-咪唑,氨鲁米特(aminoglutethimide),(醋酸甲地孕酮(megestrol acetate)),(依西美坦(exemestane);Pfizer),福美坦(formestanie),法倔唑(fadrozole),(伏罗唑(vorozole)),(来曲唑(letrozole);Novartis),和(阿那曲唑(anastrozole);AstraZeneca);(iii)抗雄激素类,诸如氟他米特(flutamide),尼鲁米特(nilutamide),比卡米特(bicalutamide),亮丙瑞林(leuprolide)和戈舍瑞林(goserelin);布舍瑞林(buserelin),曲普瑞林(tripterelin),醋酸甲羟孕酮(medroxyprogesterone acetate),己烯雌酚(diethylstilbestrol),倍美力(premarin),氟甲睾酮(fluoxymesterone),全反式视黄酸,芬维A胺(fenretinide),以及曲沙他滨(troxacitabine)(1,3-二氧戊环核苷胞嘧啶类似物);(iv)蛋白质激酶抑制剂;(v)脂质激酶抑制剂;(vi)反义寡核苷酸,特别是抑制牵涉异常细胞增殖的信号传导途经中的基因表达的反义寡核苷酸,诸如例如PKC-α,Ralf和H-Ras;(vii)核酶,诸如VEGF表达抑制剂(例如)和HER2表达抑制剂;(viii)疫苗,诸如基因疗法疫苗,例如和rIL-2;拓扑异构酶1抑制剂,诸如rmRH;和(ix)及任何上述药剂的药学可接受盐,酸和衍生物。
化疗剂还包括抗体,诸如阿仑珠单抗(alemtuzumab)(Campath),西妥昔单抗(cetuximab)(Imclone);帕尼单抗(panitumumab)(Amgen),利妥昔单抗(rituximab)(Genentech/Biogen Idec),帕妥珠单抗(pertuzumab)(2C4,Genentech),曲妥珠单抗(Genentech),托西莫单抗(tositumomab)(Bexxar,Corixia),和抗体药物缀合物,吉妥珠单抗奥佐米星(gemtuzumab ozogamicin)(Wyeth)。具有作为与本发明化合物组合的药剂的治疗潜力的别的人源化单克隆抗体包括:阿泊珠单抗(apolizumab),阿塞珠单抗(aselizumab),atlizumab,巴匹珠单抗(bapineuzumab),bivatuzumab mertansine,莫坎妥珠单抗(cantuzumab mertansine),西利珠单抗(cedelizumab),培舍珠单抗(certolizumab pegol),cidfusituzumab,cidtuzumab,达克珠单抗(daclizumab),依库珠单抗(eculizumab),依法珠单抗(efalizumab),依帕珠单抗(epratuzumab),厄利珠单抗(erlizumab),非维珠单抗(felvizumab),芳妥珠单抗(fontolizumab),吉妥珠单抗奥佐米星(gemtuzumab ozogamicin),英妥珠单抗奥佐米星(inotuzumab ozogamicin),伊匹木单抗(ipilimumab),拉贝珠单抗(labetuzumab),林妥珠单抗(lintuzumab),马妥珠单抗(matuzumab),美泊利单抗(mepolizumab),莫维珠单抗(motavizumab),motovizumab,那他珠单抗(natalizumab),尼妥珠单抗(nimotuzumab),nolovizumab,numavizumab,ocrelizumab,奥马珠单抗(omalizumab),帕利珠单抗(palivizumab),帕考珠单抗(pascolizumab),pecfusituzumab,pectuzumab,培克珠单抗(pexelizumab),ralivizumab,雷珠单抗(ranibizumab),reslivizumab,瑞利珠单抗(reslizumab),resyvizumab,罗维珠单抗(rovelizumab),卢利珠单抗(ruplizumab),西罗珠单抗(sibrotuzumab),西利珠单抗(siplizumab),索土珠单抗(sontuzumab),tacatuzumab tetraxetan,tadocizumab,他利珠单抗(talizumab),特非珠单抗(tefibazumab),托珠单抗(tocilizumab),托利珠单抗(toralizumab),tucotuzumab西莫白介素(celmoleukin),tucusituzumab,umavizumab,乌珠单抗(urtoxazumab),优特克单抗(ustekinumab),维西珠单抗(visilizumab),和抗白介素-12(ABT-874/J695,Wyeth Research and Abbott Laboratories),其为经遗传修饰以识别白介素-12p40蛋白的重组专有人序列全长IgG1λ抗体。
化疗剂还包括“EGFR抑制剂”,其指结合EGFR或以其它方式直接与EGFR相互作用并阻止或降低其信号传导活性的化合物,其另外还称作“EGFR拮抗剂”。此类药剂的例子包括结合EGFR的抗体和小分子。结合EGFR的抗体的例子包括MAb 579(ATCC CRL HB8506),MAb 455(ATCC CRL HB8507),MAb 225(ATCC CRL 8508),MAb 528(ATCC CRL 8509)(参见美国专利No.4,943,533,Mendelsohn等人)及其变体,诸如嵌合化的225(C225或西妥昔单抗;)和重构的人225(H225)(参见WO96/40210,Imclone Systerms Inc.);IMC-11F8,一种完全人的EGFR靶向抗体(Imclone);结合II型突变体EGFR的抗体(美国专利No.5,212,290);结合EGFR的人源化和嵌合抗体,如美国专利No.5,891,996中所述;和结合EGFR的人抗体,诸如ABX-EGF或帕尼单抗(Panitumumab)(参见WO98/50433,Abgenix/Amgen);EMD 55900(Stragliotto et al.,Eur.J.Cancer 32A:636-640(1996));EMD7200(matuzumab),一种针对EGFR且与EGF和TGF-α二者竞争EGFR结合的人源化EGFR抗体(EMD/Merck);人EGFR抗体,HuMax-EGFR(GenMab);称作E1.1,E2.4,E2.5,E6.2,E6.4,E2.11,E6.3和E7.6.3且描述在US 6,235,883中的完全人抗体;MDX-447(Medarex Inc);和mAb 806或人源化mAb 806(Johns et al.,J.Biol.Chem.279(29):30375-30384(2004))。抗EGFR抗体可与细胞毒剂缀合,由此产生免疫缀合物(参见例如EP 659,439 A2,Merck Patent GmbH)。EGFR拮抗剂包括小分子,诸如美国专利No.5,616,582,5,457,105,5,475,001,5,654,307,5,679,683,6,084,095,6,265,410,6,455,534,6,521,620,6,596,726,6,713,484,5,770,599,6,140,332,5,866,572,6,399,602,6,344,459,6,602,863,6,391,874,6,344,455,5,760,041,6,002,008,和5,747,498,以及PCT公开文本WO98/14451,WO98/50038,WO99/09016,和WO99/24037中描述的化合物。具体的小分子EGFR拮抗剂包括OSI-774(CP-358774,厄洛替尼(erlotinib),Genentech/OSI Pharmaceuticals);PD 183805(CI 1033,2-丙烯酰胺,N-[4-[(3-氯-4-氟苯基)氨基]-7-[3-(4-吗啉基)丙氧基]-6-喹唑啉基]-,二氢氯化物,Pfizer Inc.);ZD1839,吉非替尼(gefitinib)4-(3’-氯-4’-氟苯胺基)-7-甲氧基-6-(3-吗啉代丙氧基)喹唑啉,AstraZeneca);ZM 105180((6-氨基-4-(3-甲基苯基-氨基)-喹唑啉,Zeneca);BIBX-1382(N8-(3-氯-4-氟-苯基)-N2-(1-甲基-哌啶-4-基)-嘧啶并[5,4-d]嘧啶-2,8-二胺,Boehringer Ingelheim);PKI-166((R)-4-[4-[(1-苯基乙基)氨基]-1H-吡咯并[2,3-d]嘧啶-6-基]-苯酚);(R)-6-(4-羟基苯基)-4-[(1-苯基乙基)氨基]-7H-吡咯并[2,3-d]嘧啶);CL-387785(N-[4-[(3-溴苯基)氨基]-6-喹唑啉基]-2-丁炔酰胺);EKB-569(N-[4-[(3-氯-4-氟苯基)氨基]-3-氰基-7-乙氧基-6-喹啉基]-4-(二甲基氨基)-2-丁烯酰胺)(Wyeth);AG1478(Pfizer);AG1571(SU 5271;Pfizer);双重EGFR/HER2酪氨酸激酶抑制剂,诸如拉帕替尼(lapatinib)(GSK572016或N-[3-氯4-[(3氟苯基)甲氧基]苯基]-6[5[[[2甲基磺酰基)乙基]氨基]甲基]-2-呋喃基]-4-喹唑啉胺)。
化疗剂还包括“酪氨酸激酶抑制剂”,包括前一段中提到的EGFR靶向药物;小分子HER2酪氨酸激酶抑制剂,诸如可从Takeda获得的TAK165;CP-724,714,一种口服ErbB2受体酪氨酸激酶选择性抑制剂(Pfizer和OSI);优先结合EGFR但抑制HER2和EGFR过表达细胞二者的双重HER抑制剂,诸如EKB-569(可从Wyeth获得);拉帕替尼(lapatinib)(GSK572016;可从Glaxo-SmithKline获得),一种口服HER2和EGFR酪氨酸激酶抑制剂;PKI-166(可从Novartis获得);泛HER抑制剂,诸如卡奈替尼(canertinib)(CI-1033;Pharmacia);Raf-1抑制剂,诸如可从ISIS Pharmaceuticals获得的,抑制Raf-1信号传导的反义药剂ISIS-5132;非HER靶向TK抑制剂;多靶向酪氨酸激酶抑制剂,诸如舒尼替尼(sunitinib)(可从Pfizer获得);VEGF受体酪氨酸激酶抑制剂,诸如瓦他拉尼(vatalanib)(PTK787/ZK222584,可从Novartis/Schering AG获得);MAPK胞外调控激酶I抑制剂CI-1040(可从Pharmacia获得);喹唑啉类,诸如PD 153035,4-(3-氯苯胺基)喹唑啉;吡啶并嘧啶类;嘧啶并嘧啶类;吡咯并嘧啶类,诸如CGP 59326,CGP 60261和CGP 62706;吡唑并嘧啶类,4-(苯基氨基)-7H-吡咯并[2,3-d]嘧啶类;姜黄素(二阿魏酰甲烷,4,5-双(4-氟苯胺基)-酞酰亚胺);含有硝基噻吩模块的tyrphostine;PD-0183805(Warner-Lamber);反义分子(例如那些与编码HER的核酸结合的反义分子);喹喔啉类(美国专利No.5,804,396);tryphostins(美国专利No.5,804,396);ZD6474(AstraZeneca);PTK-787(Novartis/Schering AG);泛HER抑制剂,诸如CI-1033(Pfizer);Affinitac(ISIS 3521;Isis/Lilly);甲磺酸伊马替尼PKI 166(Novartis);GW2016(Glaxo SmithKline);CI-1033(Pfizer);EKB-569(Wyeth);Semaxinib(Pfizer);ZD6474(AstraZeneca);PTK-787(Novartis/Schering AG);INC-1C11(Imclone),雷帕霉素(西罗莫司,);或任何下列专利公开文本中描述的:美国专利No.5,804,396;WO1999/09016(American Cyanamid);WO1998/43960(American Cyanamid);WO1997/38983(Warner Lambert);WO1999/06378(Warner Lambert);WO1999/06396(WarnerLambert);WO1996/30347(Pfizer,Inc);WO1996/33978(Zeneca);WO1996/3397(Zeneca)和WO1996/33980(Zeneca)。
化疗剂还包括地塞米松(dexamethasone),干扰素,秋水仙素(colchicine),氯苯氨啶(metoprine),环孢霉素(cyclosporine),两性霉素(amphotericin),甲硝唑(metronidazole),阿仑单抗(alemtuzumab),阿利维A酸(alitretinoin),别嘌醇(allopurinol),氨磷汀(amifostine),三氧化二砷(arsenic trioxide),天冬酰胺酶(asparaginase),活的BCG,贝伐珠单抗(bevacuzimab),贝沙罗汀(bexarotene),克拉屈滨(cladribine),里本灵(clofarabine),darbepoetin alfa,地尼白介素(denileukin),右雷佐生(dexrazoxane),阿法依伯汀(epoetin alfa),厄洛替尼(elotinib),非格司亭(filgrastim),醋酸组氨瑞林(histrelin acetate),ibritumomab,干扰素α-2a,干扰素α-2b,lenalidomide,左旋咪唑(levamisole),美司钠(mesna),甲氧沙林(methoxsalen),诺龙(nandrolone),奈拉滨(nelarabine),诺非单抗(nofetumomab),奥普瑞白介素(oprelvekin),palifermin,帕米膦酸盐(pamidronate),培加酶(pegademase),培门冬酶(pegaspargase),PEG非格司亭(pegfilgrastim),培美曲塞二钠(pemetrexed disodium),普卡霉素(plicamycin),卟吩姆钠(porfimer sodium),喹纳克林(quinacrine),拉布立酶(rasburicase),沙格司亭(sargramostim),替莫唑胺(temozolomide),VM-26,6-TG,托瑞米芬(toremifene),tretinoin,ATRA,戊柔比星(valrubicin),唑来膦酸盐(zoledronate),和唑来膦酸(zoledronic acid),及其药学可接受盐。
化疗剂还包括氢化可的松(hydrocortisone),醋酸氢化可的松(hydrocortisone acetate),醋酸可的松(cortisone acetate),替可的松匹伐酯(tixocortol pivalate),曲安奈德(triamcinolone acetonide),曲安西龙醇(triamcinolone alcohol),莫米松(mometasone),安西奈德(amcinonide),布地奈德(budesonide),地奈德(desonide),fluocinonide,fluocinolone acetonide,倍他米松(betamethasone),倍他米松磷酸钠(betamethasone sodium phosphate),地塞米松(dexamethasone),地塞米松磷酸钠(dexamethasone sodium phosphate),氟可龙(fluocortolone),氢化可的松-17-丁酸盐(hydrocortisone-17-butyrate),氢化可的松-17-戊酸盐(hydrocortisone-17-valerate),aclometasone dipropionate,戊酸倍他米松(betamethasone valerate),二丙酸倍他米松(betamethasone dipropionate),泼尼卡酯(prednicarbate),氯倍他松-17-丁酸盐(clobetasone-17-butyrate),氯倍他松-17-丙酸盐(clobetasol-17-propionate),己酸氟考龙(fluocortolone caproate),特戊酸氟考龙(fluocortolone pivalate)和醋酸氟甲叉龙(fluprednidene acetate);免疫选择性抗炎肽(ImSAID),诸如苯丙氨酸-谷氨酰胺-甘氨酸(FEG)及其D-异构体形式(feG)(IMULAN BioTherapeutics,LLC);抗风湿药物,诸如硫唑嘌呤(azathioprine),环孢素(ciclosporin)(环孢霉素(cyclosporine)A),D-青霉胺,金盐,羟氯喹,来氟米特(leflunomide)米诺环素(minocycline),柳氮磺吡啶(sulfasalazine),肿瘤坏死因子α(TNFα)阻断剂,诸如依那西普(etanercept)(Enbrel),英夫利昔单抗(infliximab)(Remicade),阿达木单抗(adalimumab)(Humira),certolizumab pegol(Cimzia),golimumab(Simponi),白介素-1(IL-1)阻断剂,诸如阿那白滞素(anakinra)(Kineret),T细胞共刺激阻断剂,诸如abatacept(Orencia),白介素-6(IL-6)阻断剂,诸如tocilizumab白介素-13(IL-13)阻断剂,诸如lebrikizumab;干扰素α(IFN)阻断剂,诸如Rontalizumab;β7-整联蛋白阻断剂,诸如rhuMAb Beta7;IgE途径阻断剂,诸如抗M1prime;分泌型同三聚LTa3和膜结合型异三聚LTa1/β2阻断剂,诸如抗淋巴毒素α(LTa);放射性同位素,例如At211,I131,I125,Y90,Re186,Re188,Sm153,Bi212,P32,Pb212和Lu放射性同位素;混杂调查性药剂,诸如thioplatin,PS-341,丁酸苯酯,ET-18-OCH3,或法尼基转移酶抑制剂(L-739749,L-744832;多酚,诸如槲皮素(quercetin),白藜芦醇(resveratrol),piceatannol,没食子酸表没食子儿茶精(epigallocatechine gallate),茶黄素(theaflavin),黄烷醇(flavanol),原花青素(procyanidins),白桦脂酸(betulinic acid)及其衍生物;自噬抑制剂,诸如氯喹;δ-9-四氢大麻酚(tetrahydrocannabinol)(屈大麻酚(dronabinol),);β-拉帕醌(lapachone);拉帕醇(lapachol);秋水仙素类(colchicines);白桦脂酸(betulinic acid);乙酰喜树碱,东莨菪亭(scopolectin),和9-氨基喜树碱);鬼臼毒素(podophyllotoxin);替加氟(tegafur)贝沙罗汀(bexarotene)二膦酸盐类(bisphosphonates),诸如氯膦酸盐(clodronate)(例如或),依替膦酸钠(etidronate)NE-58095,唑来膦酸/唑来膦酸盐(zoledronic acid/zoledronate)阿伦膦酸盐(alendronate)帕米膦酸盐(pamidronate)替鲁膦酸盐(tiludronate)或利塞膦酸盐(risedronate)和表皮生长因子受体(EGF-R);疫苗,诸如疫苗;哌立福辛(perifosine),COX-2抑制剂(例如塞来考昔(celecoxib)或艾托考昔(etoricoxib)),蛋白体抑制剂(例如PS341);CCI-779;tipifarnib(R11577);orafenib,ABT510;Bcl-2抑制剂,诸如oblimersen sodiumpixantrone;法尼基转移酶抑制剂,诸如lonafarnib(SCH 6636,SARASARTM);及任何上述各项的药学可接受盐,酸或衍生物;以及两种或更多种上述各项的组合,诸如CHOP(环磷酰胺,多柔比星,长春新碱,和泼尼松龙联合疗法的缩写)和FOLFOX(奥沙利铂(ELOXATINTM)联合5-FU和亚叶酸的治疗方案的缩写)。
化疗剂还包括具有止痛,退热和消炎效果的非类固醇消炎药。NSAID包括酶环氧合酶的非选择性抑制剂。NSAID的具体例子包括阿司匹林(aspirin),丙酸衍生物诸如布洛芬(ibuprofen),非诺洛芬(fenoprofen),酮洛芬(ketoprofen),氟比洛芬(flurbiprofen),奥沙普秦(oxaprozin)和荼普生(naproxen),乙酸衍生物诸如吲哚美辛(indomethacin),舒林酸(sulindac),依托度酸(etodolac),双氯芬酸(diclofenac),烯醇酸衍生物诸如吡罗昔康(piroxicam),美洛昔康(meloxicam),替诺昔康(tenoxicam),屈恶昔康(droxicam),氯诺昔康(lornoxicam)和伊索昔康(isoxicam),灭酸衍生物诸如甲灭酸(mefenamic acid),甲氯芬那酸(meclofenamic acid),氟芬那酸(flufenamic acid),托芬那酸(tolfenamic acid),和COX-2抑制剂诸如塞来考昔(celecoxib),依托考昔(etoricoxib),罗美考昔(lumiracoxib),帕瑞考昔(parecoxib),罗非考昔(rofecoxib),罗非昔布(rofecoxib),和伐地考昔(valdecoxib)。NSAID可被指示用于诸如类风湿性关节炎,骨关节炎,炎性关节病,强直性脊柱炎,银屑病关节炎,莱特尔氏综合征,急性痛风,痛经,骨转移疼痛,头痛和偏头痛,手术后疼痛,由于炎症和组织损伤引起的轻至中度疼痛,发热,肠梗阻,和肾绞痛等疾患的症状缓解。
术语“细胞因子”是由一种细胞群释放,作为细胞间介质作用于另一细胞的蛋白质的通称。此类细胞因子的例子有淋巴因子,单核因子;白介素(IL),诸如IL-1,IL-1α,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8,IL-9,IL-11,IL-12,IL-15;肿瘤坏死因子,诸如TNF-α或TNF-β;及其它多肽因子,包括LIF和kit配体(KL)和γ-干扰素。如本文中使用的,术语细胞因子包括来自天然来源或来自重组细胞培养物的蛋白质及天然序列细胞因子的生物学活性等效物,包括通过人工合成产生的小分子实体,及其药剂学可接受的衍生物和盐。
术语“抗血管发生剂”或“血管发生抑制剂”指或是直接或是间接抑制血管发生(angiogenesis),血管生成(vasculogenesis)或不想要的血管通透性的小分子量物质,多核苷酸,多肽,分离的蛋白质,重组蛋白,抗体,或其缀合物或融合蛋白。应当理解,抗血管发生剂包括那些结合血管发生性因子或其受体并阻断其血管发生活性的药剂。例如,抗血管发生剂是说明书全文定义的或本领域已知的血管发生剂的抗体或其它拮抗剂,例如但不限于VEGF-A的抗体,VEGF-A受体(例如KDR受体或Flt-1受体)的抗体,VEGF陷阱,抗PDGFR抑制剂诸如GleevecTM(Imatinib Mesylate)。抗血管发生剂还包括天然血管发生抑制剂,例如血管他丁(angiostatin),内皮他丁(endostatin)等。参见例如Klagsbrun and D'Amore,Annu.Rev.Physiol.,53:217-39(1991);Streit and Detmar,Oncogene,22:3172-3179(2003)(例如列举恶性黑素瘤中的抗血管发生疗法的表3);Ferrara&Alitalo,Nature Medicine 5:1359-1364(1999);Tonini et al.,Oncogene,22:6549-6556(2003)(例如列举已知的抗血管发生性因子的表2);及Sato.Int.J.Clin.Oncol.,8:200-206(2003)(例如列举临床试验中所使用的抗血管发生剂的表1)。
术语“VEGF”或“VEGF-A”用于指165个氨基酸的人血管内皮细胞生长因子及相关的121个,145个,189个和206个氨基酸的人血管内皮细胞生长因子,如例如Leung et al.,Science,246:1306(1989);及Houck et al.,Mol.Endocrin.,5:1806(1991)所述,及其天然存在的等位基因形式和加工形式。VEGF-A是包括VEGF-B,VEGF-C,VEGF-D,VEGF-E,VEGF-F和PlGF在内的基因家族的一部分。VEGF-A主要结合两种高亲和力受体酪氨酸激酶,即VEGFR-1(Flt-1)和VEGFR-2(Flk-1/KDR),后者是VEGF-A血管内皮细胞有丝分裂信号的主要递质。另外,神经毡蛋白-1已经被鉴定为肝素结合VEGF-A同等型(isoform)的受体,而且可在血管发育中发挥作用。术语“VEGF”或“VEGF-A”还指来自非人物种诸如小鼠,大鼠或灵长类动物的VEGF。有时,来自特定物种的VEGF表示如下,hVEGF表示人VEGF,mVEGF表示鼠VEGF。通常,VEGF指人VEGF。术语“VEGF”还用于指包含165个氨基酸的人血管内皮细胞生长因子的氨基酸8-109或1-109的多肽的截短形式或片段。本申请中可能通过例如“VEGF(8-109)”,“VEGF(1-109)”或“VEGF165”来鉴别任何此类形式VEGF的提述。“截短的”天然VEGF的氨基酸位置如天然VEGF序列中所示编号。例如,截短的天然VEGF中的第17位氨基酸(甲硫氨酸)也是天然VEGF中的第17位(甲硫氨酸)。截短的天然VEGF具有与天然VEGF相当的对KDR和Flt-1受体的结合亲和力。
“嵌合VEGF受体蛋白”指具有衍生自至少两种不同蛋白质(其中至少一种是VEGF受体蛋白)的氨基酸序列的VEGF受体分子。在某些实施方案中,嵌合VEGF受体蛋白能够结合VEGF并抑制VEGF的生物学活性。
“VEGF拮抗剂”或“VEGF特异性拮抗剂”指能够结合VEGF,降低VEGF表达水平,或者中和,阻断,抑制,消除,降低或干扰VEGF生物学活性(包括但不限于VEGF与一种或多种VEGF受体的结合,VEGF信号传导及由VEGF介导的血管发生和内皮细胞存活或增殖)的分子。例如,能够中和,阻断,抑制,消除,降低或干扰VEGF生物学活性的分子能通过结合一种或多种VEGF受体(VEGFR)(例如VEGFR1,VEGFR2,VEGFR3,膜结合的VEGF受体(mbVEGFR),或可溶性VEGF受体(sVEGFR))来发挥其效果。在本发明的方法中有用的VEGF特异性拮抗剂包括特异性结合VEGF的多肽,抗VEGF抗体及其抗原结合片段,特异性结合VEGF由此使其隔绝与一种或多种受体结合的受体分子和衍生物,融合蛋白(例如VEGF-陷阱(Regeneron)),和VEGF121-白树毒素(Peregrine)。VEGF特异性拮抗剂还包括VEGF多肽的拮抗性变体,至少与编码VEGF多肽的核酸分子的片段互补的反义核碱基寡聚物,至少与编码VEGF多肽的核酸分子的片段互补的小RNA,靶向VEGF的核酶,针对VEGF的肽体,和VEGF适体。VEGF拮抗剂还包括结合VEGFR的多肽,抗VEGFR抗体及其抗原结合片段,和结合VEGFR由此阻断,抑制,消除,降低或干扰VEGF生物学活性(例如VEGF信号传导)的衍生物,或融合蛋白。VEGF特异性拮抗剂还包括结合VEGF或VEGFR且能够阻断,抑制,消除,降低,或干扰VEGF生物学活性的非肽小分子。如此,术语“VEGF活性”明确包括VEGF介导的VEGF生物学活性。在某些实施方案中,VEGF拮抗剂将VEGF的表达水平或生物学活性降低或抑制了至少10%,20%,30%,40%,50%,60%,70%,80%,90%或更多。在一些实施方案中,受到VEGF特异性拮抗剂抑制的VEGF是VEGF(8-109),VEGF(1-109),或VEGF165。
如本文中使用的,VEGF拮抗剂可包括但不限于抗VEGFR2抗体及相关分子(例如ramucirumab,tanibirumab,aflibercept),抗VEGFR1抗体及相关分子(例如icrucumab,aflibercept(VEGF陷阱-Eye;),和ziv-aflibercept(VEGF陷阱;),双特异性VEGF抗体(例如MP-0250,vanucizumab(VEGF-ANG2),和US 2001/0236388中公开的双特异性抗体),包含抗VEGF,抗VEGFR1,和抗VEGFR2臂中两种的组合的双特异性抗体,抗VEGFA抗体(例如贝伐珠单抗,sevacizumab),抗VEGFB抗体,抗VEGFC抗体(例如VGX-100),抗VEGFD抗体,和非肽小分子VEGF拮抗剂(例如pazopanib,axitinib,vandetanib,stivarga,cabozantinib,lenvatinib,nintedanib,orantinib,telatinib,dovitinig,cediranib,motesanib,sulfatinib,apatinib,foretinib,famitinib,和tivozanib)。
“抗VEGF抗体”指以足够亲和力和特异性结合VEGF的抗体。在某些实施方案中,抗体会具有足够高的对VEGF的结合亲和力,例如,该抗体可以以介于100nM-1pM之间的Kd值结合hVEGF。抗体亲和力可通过例如基于表面等离振子共振的测定法(诸如PCT申请公开文本No.WO2005/012359中所记载的BIAcore测定法);酶联免疫吸附测定法(ELISA);和竞争测定法(例如RIA)来测定。在某些实施方案中,抗VEGF抗体可用作治疗剂,用于靶向和干扰其中牵涉VEGF活性的疾病或疾患。还有,可对该抗体进行其它生物学活性测定法,例如为了评估其作为治疗剂的效力。此类测定法是本领域已知的,而且取决于抗体的靶抗原和预定用途。例子包括HUVEC抑制测定法;肿瘤细胞生长抑制测定法(如例如WO 89/06692中所记载的);抗体依赖性细胞的细胞毒性(ADCC)和补体介导的细胞毒性(CDC)测定法(美国专利No.5,500,362);及激动活性或造血测定法(参见WO 95/27062)。抗VEGF抗体通常不会结合其它VEGF同系物,诸如VEGF-B或VEGF-C,也不会结合其它生长因子,诸如PlGF,PDGF,或bFGF。在一个实施方案中,抗VEGF抗体是与由杂交瘤ATCC HB 10709生成的单克隆抗VEGF抗体A4.6.1结合相同表位的单克隆抗体。在另一个实施方案中,抗VEGF抗体是依照Presta et al.(1997)Cancer Res.57:4593-4599生成的重组人源化抗VEGF单克隆抗体,包括但不限于称作贝伐珠单抗(BV;)的抗体。
抗VEGF抗体“贝伐珠单抗”(BV)是依照Presta et al.(1997)Cancer Res.57:4593-4599生成的重组人源化抗VEGF单克隆抗体,也称作“rhuMAb VEGF”或它包含突变的人IgG1框架区和来自鼠抗hVEGF单克隆抗体A.4.6.1(其阻断人VEGF对其受体的结合)的抗原结合互补决定区。贝伐珠单抗大约93%的氨基酸序列,包括大部分框架区,衍生自人IgG1,而约7%的序列衍生自鼠抗体A4.6.1。贝伐珠单抗具有约149,000道尔顿的分子量且是糖基化的。贝伐珠单抗和其它人源化抗VEGF抗体进一步记载于2005年2月26日公告的美国专利No.6,884,879,通过述及明确将其完整公开内容收入本文。别的优选抗体包括G6或B20系列抗体(例如G6-31,B20-4.1),如PCT申请公开号WO2005/012359中记载的。别的优选抗体参见美国专利No.7,060,269,No.6,582,959,No.6,703,020,No.6,054,297;WO98/45332;WO 96/30046;WO94/10202;EP 0666868B1;美国专利申请公开文本No.2006009360,No.20050186208,No.20030206899,No.20030190317,No.20030203409,和No.20050112126;及Popkov et al.,Journal of Immunological Methods 288:149-164(2004)。其它优选抗体包括那些结合人VEGF上包含残基F17,M18,D19,Y21,Y25,Q89,I91,K101,E103,和C104或者包含残基F17,Y21,Q22,Y25,D63,I83和Q89的功能性表位的。
“表位A4.6.1”指受抗VEGF抗体贝伐珠单抗(参见Muller Y et al.,Structure 15 September 1998,6:1153-1167)识别的表位。在本发明的某些实施方案中,抗VEGF抗体包括但不限于与由杂交瘤ATCC HB 10709生成的单克隆抗VEGF抗体A4.6.1;依照Presta et al.(1997)Cancer Res.57:4593-4599生成的重组人源化抗VEGF单克隆抗体结合相同表位的单克隆抗体。
“标准护理”在本文中意指抗肿瘤剂或例行用于治疗特定形式癌症的药剂。例如,对于铂抗性卵巢癌,一种标注护理是托泊替康或脂质体多柔比星。
“基于铂的化疗剂”或“铂剂”指作为铂的配位络合物的抗肿瘤药物。基于铂的化疗剂的例子包括卡铂(carboplatin),顺铂(cisplatin)和奥沙利铂(oxaliplatinum)。
“基于铂的化疗”指使用一种或多种基于铂的化疗剂的疗法,任选与一种或多种其它化疗剂组合。
“化疗抗性”癌症指癌症患者在接受化疗方案时有进展(即患者是“化疗不应性”的),或者患者在完成化疗方案后12个月内(例如6个月内)(癌症)有进展。
“铂抗性”癌症指癌症患者在接受基于铂的化疗时有进展(即患者是“铂不应性”的),或者患者在完成基于铂的化疗方案后12个月内(例如6个月内)(癌症)有进展。
“放射疗法”或“放疗”指使用定向伽马射线或贝塔射线来诱发对细胞的足够损伤,以限制细胞正常发挥功能的能力或全然破坏细胞。应当领会,本领域知道许多方式来确定治疗的剂量和持续时间。典型的治疗作为一次施用来给予,而典型的剂量范围为每天10-200个单位(戈瑞(Gray))。
如本说明书和所附权利要求书中使用的,单数形式“一个”,“一种”和“该”包括复数所指物,除非另有明确说明。如此,例如,提及“一个/种分子”任选包括两个/种或更多个/种此类分子的组合,诸如此类。
如本文中使用的,术语“约”指技术领域技术人员容易知道的相应数值的常规误差范围。本文中提到“约”数值或参数包括(且描述)涉及该数值或参数本身的实施方案。
理解的是,本文所述发明的各个方面和实施方案包括“包含”,“由……组成”,和“基本上由……组成”方面和实施方案。
II.抗血管发生剂
本文中提供的是在个体中治疗癌症或延迟癌症进展的方法,其包括对该个体施用有效量的抗血管发生剂和OX40结合激动剂。
如上文描述的,抗血管发生剂可以包括化合物诸如小分子量物质,多核苷酸,多肽,分离的蛋白质,重组的蛋白质,抗体,或其缀合物或融合蛋白。在一些实施方案中,该抗血管发生剂是抗VEGFR2抗体;抗VEGFR1抗体;VEGF陷阱;双特异性VEGF抗体;包含选自抗VEGF臂,抗VEGFR1臂,和抗VEGFR2臂的两种臂的组合的双特异性抗体;抗VEGF-A抗体(例如抗KDR受体或抗Flt-1受体抗体);抗VEGFB抗体;抗VEGFC抗体;抗VEGFD抗体;非肽小分子VEGF拮抗剂;抗PDGFR抑制剂;或天然血管发生抑制剂。在某些实施方案中,该抗血管发生剂是ramucirumab,tanibirumab,aflibercept(例如VEGF陷阱-Eye;),icrucumab,ziv-aflibercept(例如VEGF陷阱;),MP-0250,vanucizumab,sevacizumab,VGX-100,pazopanib,axitinib,vandetanib,stivarga,cabozantinib,lenvatinib,nintedanib,orantinib,telatinib,dovitinig,cediranib,motesanib,sulfatinib,apatinib,foretinib,famitinib,imatinib(例如Imatinib Mesylate;GleevecTM),和tivozanib。
在一些实施方案中,该抗血管发生剂是抗血管发生抗体。下文进一步提供抗体和用于生成抗体的方法的描述。在一些实施方案中,该抗血管发生抗体是单克隆抗体。在一些实施方案中,该抗血管发生抗体是人抗体或人源化抗体(下文有更为详细的描述)。
在一些实施方案中,该抗血管发生剂是VEGF拮抗剂。例如,本公开文本的VEGF拮抗剂可包括但不限于特异性结合VEGF的多肽,抗VEGF抗体及其抗原结合片段;特异性结合VEGF由此使其隔绝与一种或多种受体结合的受体分子和衍生物;融合蛋白(例如VEGF陷阱(Regeneron)),VEGF121-白树毒素(Peregrine),VEGF多肽的拮抗性变体,至少与编码VEGF多肽的核酸分子的片段互补的反义核碱基寡聚物;至少与编码VEGF多肽的核酸分子的片段互补的小RNA(例如RNAi,siRNA,shRNA,或miRNA);靶向VEGF的核酶;针对VEGF的肽体;VEGF适体;结合VEGFR的多肽;抗VEGFR抗体及其抗原结合片段;结合VEGFR由此阻断,抑制,消除,降低或干扰VEGF生物学活性(例如VEGF信号传导)的衍生物;融合蛋白;和结合VEGF或VEGFR且能够阻断,抑制,消除,降低,或干扰VEGF生物学活性的非肽小分子。
在某些实施方案中,该VEGF拮抗剂将VEGF的表达水平或生物学活性降低或抑制至少10%,20%,30%,40%,50%,60%,70%,80%,90%或更多。例如,在一些实施方案中,该VEGF拮抗剂可以将VEGF的表达水平或生物学活性降低或抑制至少10%,至少15%,至少20%,至少25%,至少30%,至少35%,至少40%,至少45%,至少50%,至少55%,至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,或至少95%。在一些实施方案中,受到VEGF特异性拮抗剂抑制的VEGF是VEGF(8-109),VEGF(1-109),或VEGF165。
本公开文本的方法,用途和试剂盒的某些方面至少部分基于令人惊讶的发现,即抗VEGF处理能改善肿瘤树突细胞的功能性表型(例如通过引起MHC II类和/或OX40L表达升高)。不希望受理论束缚,这种特性格外可使得包括抗血管发生剂和OX40结合激动剂的组合疗法对于癌症治疗特别有益,例如通过产生增强的抗肿瘤应答,诸如抗肿瘤T细胞应答。
因此,在一些实施方案中,该VEGF拮抗剂提高肿瘤内树突细胞上的MHC II类表达,例如与来自用对照抗体(例如同种型对照)处理的肿瘤的树突细胞上的MHC II类表达相比。MHC II类已知是将抗原呈递给T细胞的相关分子(通常是含有α和β链的异二聚体)的家族。如本文中使用的,MHC II类表达可以指任何MHC II类分子或链的表达,包括但不限于由下述人基因编码的多肽:HLA-DMα(例如NCBI Gene ID No.3108),HLA-DMβ(例如NCBI Gene ID No.3109),HLA-DOα(例如NCBI Gene ID No.3111),HLA-DOβ(例如NCBI Gene ID No.3112),HLA-DPα1(例如NCBI Gene ID No.3113),HLA-DPβ1(例如NCBI Gene ID No.3115),HLA-DQα1(例如NCBI Gene ID No.3117),HLA-DQα2(例如NCBI Gene ID No.3118),HLA-DQβ1(例如NCBI Gene ID No.3119),HLA-DQβ2(例如NCBI Gene ID No.3120),HLA-DRα(例如NCBI Gene ID No.3122),HLA-DRβ1(例如NCBI Gene ID No.3123),HLA-DRβ3(例如NCBI Gene ID No.3125),HLA-DRβ4(例如NCBI Gene ID No.3126),or HLA-DRβ5(例如NCBI Gene ID No.3127)。本领域技术人员会领会,MHC基因在群体中是高度可变的,因而列出的具体基因和序列仅仅是例示性的,绝非意图是限制性的。
在一些实施方案中,该VEGF拮抗剂提高肿瘤内树突细胞上的OX40L表达,例如与来自用对照抗体(例如同种型对照)处理的肿瘤的树突细胞上的OX40L表达相比。OX40L(也称作肿瘤坏死因子配体超家族成员4或CD252)已知是OX40的结合配偶或配体。OX40L多肽的例子包括但不限于具有UniProt登录号P43488所示氨基酸序列的多肽和/或由基因TNFSF4(例如NCBI Gene ID No.7292)编码的多肽。
用于测量MHC II类或OX40L表达的方法是本领域已知的,而且可以包括但不限于:FACS,Western印迹,ELISA,免疫沉淀,免疫组织化学,免疫荧光,放射免疫测定法,点印迹,免疫检测方法,HPLC,表面等离振子共振,光谱术,质谱术,HPLC,qPCR,RT-qPCR,多重qPCR或RT-qPCR,RNA-seq,微阵列分析,SAGE,MassARRAY技术,和FISH,及其组合。
在一些实施方案中,该树突细胞是髓样树突细胞。在其它实施方案中,该树突细胞是非髓样树突细胞(例如淋巴样或浆细胞样树突细胞)。由树突细胞表达的细胞表面抗原和区分髓样和非髓样树突细胞的细胞表面抗原是本领域已知。例如,可以通过CD45,CD11c,和MHC II类的表达来鉴定树突细胞。它们可以通过缺少显著的F4/80和Gr1表达与其它细胞类型(例如巨噬细胞,嗜中性粒细胞,和粒细胞性髓样细胞)区分开。在一些实施方案中,髓样树突细胞是表达CD11b的树突细胞,而非髓样树突细胞是缺少显著CD11b表达的树突细胞。关于髓样和非髓样树突细胞的进一步描述参见例如Steinman,R.M.and Inaba,K.(1999)J.Leukoc.Biol.66:205-8。
VEGF受体分子
在一些实施方案中,该抗血管发生剂是VEGF拮抗剂。在一些实施方案中,该VEGF拮抗剂包含特异性结合VEGF的可溶性VEGF受体或可溶性VEGF受体片段。两种表征最全面的VEGF受体是VEGFR1(也称作Flt-1)和VEGFR2(鼠同系物也称作KDR和FLK-1)。每一种受体对每一种VEGF家族成员的特异性有所不同,但是VEGF-A结合Flt-1和KDR二者。Flt-1和KDR都属于受体酪氨酸激酶(RTK)家族。RTK包含具有多样生物学活性的跨膜受体的大家族。鉴定出至少十九(19)个独特RTK亚家族。受体酪氨酸激酶(RTK)家族包括对于多种细胞类型的生长和分化至关重要的受体(Yarden和Ullrich(1988)Ann.Rev.Biochem.57:433-478;Ullrich和Schlessinger(1990)Cell 61:243-254)。RTK的内在功能在配体结合后被活化,导致受体和多种细胞底物磷酸化,随后导致多种细胞应答(Ullrich和Schlessinger(1990)Cell 61:203-212)。如此,受体酪氨酸激酶介导的信号转导通过与特定生长因子(配体)的细胞外相互作用而启动,通常接着是受体二聚化,刺激内在蛋白质酪氨酸激酶活性和受体转磷酸。由此为细胞内信号转导分子创建结合位点,并导致与一系列细胞质信号传导分子的复合物形成,推动适宜细胞应答。(例如细胞分裂,分化,代谢影响,细胞外微环境的变化)参见Schlessinger和Ullrich(1992)Neuron 9:1-20。在结构上,Flt-1和KDR都具有胞外域中的七个免疫球蛋白样结构域,单个跨膜区,和被激酶插入域中断的共有酪氨酸激酶序列。Matthews等(1991)Proc.Natl.Acad.Sci.USA 88:9026-9030;Terman等(1991)Oncogene 6:1677-1683。胞外结构域涉及VEGF结合,而胞内结构域涉及信号转导。
特异性结合VEGF的VEGF受体分子或其片段可以在本发明的方法中用于结合和隔绝VEGF蛋白,由此阻止它发信号。在某些实施方案中,VEGF受体分子或其VEGF结合片段是可溶性形式,诸如sFlt-1。受体的可溶性形式发挥对VEGF蛋白生物学活性的抑制效应,其通过结合VEGF,由此阻止它结合其在靶细胞表面上存在的天然受体来实现。还包括VEGF受体融合蛋白,下文描述了它们的例子。
在一些实施方案中,VEGF拮抗剂是嵌合VEGF受体蛋白。嵌合VEGF受体蛋白指具有自至少两种不同蛋白质(其中至少一种是VEGF受体蛋白,例如flt-1或KDR受体)衍生的氨基酸序列且能够结合并抑制VEGF生物学活性的受体分子。在某些实施方案中,本发明的嵌合VEGF受体蛋白由自只有两种不同VEGF受体分子衍生的氨基酸序列组成;然而,可以将包含一个,两个,三个,四个,五个,六个,或所有七个来自flt-1和/或KDR受体胞外配体结合区的Ig样结构域的氨基酸序列连接至来自其它无关蛋白质的氨基酸序列,例如免疫球蛋白序列。与Ig样结构域组合的其它氨基酸序列对于本领域普通技术人员会是显而易见的。嵌合VEGF受体蛋白的例子包括例如可溶性Flt-1/Fc,KDR/Fc,或FLt 1/KDR/Fc(也称作VEGF Trap)(参见例如PCT申请公开文本No.WO97/44453)。
本发明的可溶性VEGF受体蛋白或嵌合VEGF受体蛋白包括没有经跨膜结构域而固定至细胞表面的VEGF受体蛋白。因此,VEGF受体(包括嵌合受体蛋白)的可溶性形式,虽然能够结合并灭活VEGF,但是不包含跨膜结构域,并如此一般不会变成与该分子在其中表达的细胞的细胞膜相结合。
在一些实施方案中,通过基因疗法施用VEGF拮抗剂(I,抗VEGF抗体,诸如贝伐珠单抗)。见例如1996年3月14日公布的WO96/07321,其关注使用基因疗法来生成胞内抗体。使核酸(任选地包含在载体中)进入患者的细胞中有两种主要办法,体内和离体。对于体内投递,通常在需要抗体的部位处,将核酸直接注射入患者。对于离体治疗,取出患者的细胞,将核酸导入这些分离的细胞中,并且将经修饰的细胞施用于直接患者或者例如在植入患者中的多孔膜内封装(见例如美国专利No.4,892,538和5,283,187)。有多种技术可用于将核酸导入活细胞中。技术随在体外入培养细胞中还是在体内入意图宿主的细胞中转移核酸而变化。适合于在体外将核酸转移入哺乳动物细胞中的技术包括使用脂质体,电穿孔,显微注射,细胞融合,DEAE-右旋糖苷,磷酸钙沉淀方法,等。用于离体投递基因的一种常用载体是逆转录病毒。目前优选的体内核酸转移技术包括用病毒载体(诸如腺病毒,单纯疱疹I病毒,或腺伴随病毒)和基于脂质的系统(例如,可用于脂质介导的基因转移的脂质是DOTMA,DOPE和DC-Chol)的转染。在一些情况中,期望给核酸来源提供靶向靶细胞的药剂,诸如对细胞表面膜蛋白或靶细胞特异性的抗体,靶细胞上的受体的配体,等。在采用脂质体的情况中,可以使用结合与胞吞有关的细胞表面膜蛋白的蛋白质进行靶向和/或促进摄取,例如对特定细胞类型向性的衣壳蛋白或其片段,针对在循环中经历内在化的蛋白质的抗体,和靶向胞内定位并增强胞内半衰期的蛋白质。受体介导的胞吞的技术例如记载于Wu et al.,J.Biol.Chem.262:4429-4432(1987);及Wagner et al.,Proc.Natl.Acad.Sci.USA 87:3410-3414(1990)。关于目前已知的基因标记和基因疗法方案的综述,见Anderson et al.,Science 256:808-813(1992)。还可见WO 93/25673及其中引用的参考文献。
抗VEGF抗体
在一些实施方案中,该抗血管发生剂是VEGF拮抗剂。在一些实施方案中,该VEGF拮抗剂是抗VEGF抗体。在一些实施方案中,该抗VEGF抗体可以是人抗体或人源化抗体。在一些实施方案中,该抗VEGF抗体可以是单克隆抗体。
要用于生成VEGF抗体的VEGF抗原可以是例如VEGF165分子以及VEGF的其它同等型或其含有期望表位的片段。在一个实施方案中,期望表位是受到贝伐珠单抗识别的表位,贝伐珠单抗与由杂交瘤ATCC HB 10709生成的单克隆抗VEGF抗体A4.6.1结合相同表位(称作本文中定义的“A.4.6.1表位”)。可用于生成本发明的抗VEGF抗体的其它形式的VEGF对于本领域技术人员会是显而易见的。
人VEGF首先是使用牛VEGF cDNA作为杂交探针筛选自人细胞制备的cDNA文库而获得的。Leung等(1989)Science,246:1306。一种由此鉴定出的cDNA编码一种165个氨基酸的蛋白质,其与牛VEGF具有超过95%的同源性;此165个氨基酸的蛋白质通常称作人VEGF(hVEGF)或VEGF165。人VEGF的促有丝分裂活性通过在哺乳动物宿主细胞中表达人VEGF cDNA得到了验证。由经人VEGF cDNA转染的细胞条件化的培养基促进毛细血管内皮细胞增殖,而对照细胞不然。Leung等(1989)Science,见上文。进行进一步努力来经重组DNA技术克隆和表达VEGF。(参见例如Ferrara,Laboratory Investigation 72:615-618(1995)及其中引用的参考文献)。
源自可变RNA剪接,VEGF在多种组织中作为多种同二聚体形式(每个单体121,145,165,189,和206个氨基酸)表达。VEGF121是一种可溶性丝裂原,不结合肝素;更长形式的VEGF以越来越高的亲和力结合肝素。肝素结合形式的VEGF可以在羧基末端被纤溶酶切割以释放可扩散形式的VEGF。纤溶酶切割后鉴定出的羧基末端肽的氨基酸测序是Arg110-Ala111。作为同二聚体分离到的氨基末端“核心”蛋白,VEGF(1-110)以与完整VEGF165同二聚体相比相似的亲和力结合中和性单克隆抗体(诸如称作4.6.1和3.2E3.1.1的抗体)和可溶性形式的VEGF受体。
最近还鉴定出数种在结构上与VEGF有关的分子,包括胎盘生长因子(PIGF),VEGF-B,VEGF-C,VEGF-D和VEGF-E。Ferrara和Davis-Smyth(1987)Endocr.Rev.,见上文;Ogawa等J.Biological Chem.273:31273-31281(1998);Meyer等EMBO J.,18:363-374(1999)。受体酪氨酸激酶Flt-4(VEGFR-3)鉴定为VEGF-C和VEGF-D的受体。Joukov等EMBO.J.15:1751(1996);Lee等PNAS USA 93:1988-1992(1996);Achen等(1998)PNAS USA 95:548-553。VEGF-C显示出涉及对淋巴管发生的调节。Jeltsch等Science 276:1423-1425(1997)。
已经鉴定出两种VEGF受体,即Flt-1(也称作VEGFR-1)和KDR(也称作VEGFR-2)。Shibuya等(1990)Oncogene 8:519-527;de Vries等(1992)Science 255:989-991;Terman等(1992)Biochem.Biophys.Res.Commun.187:1579-1586。神经毡蛋白-1显示为选择性VEGF受体,能够结合肝素结合性VEGF同等型(Soker等(1998)Cell 92:735-45)。
在本发明的方法中有用的抗VEGF抗体包括任何抗体或其抗原结合片段,它们以足够亲和力和特异性结合VEGF且能降低或抑制VEGF的生物学活性。抗VEGF抗体通常不会结合其它VEGF同源物,诸如VEGF-B或VEGF-C,也不会结合其它生长因子,诸如PlGF,PDGF,或bFGF。
在本发明的某些实施方案中,抗VEGF抗体包括但不限于与由杂交瘤ATCC HB 10709生成的单克隆抗VEGF抗体A4.6.1;依照Presta等(1997)Cancer Res.57:4593-4599生成的重组人源化抗VEGF单克隆抗体结合相同表位的单克隆抗体。在一个实施方案中,抗VEGF抗体是“贝伐珠单抗(BV)”,也称作“rhuMAb VEGF”或它包含经过突变的人IgG1框架区和来自小鼠抗hVEGF单克隆抗体A.4.6.1的抗原结合互补决定区,阻断人VEGF结合其受体。贝伐珠单抗大约93%的氨基酸序列(包括大部分框架区)是自人IgG1衍生,而且约7%的序列是自小鼠抗体A4.6.1衍生的。
贝伐珠单抗是第一种得到FDA批准的抗血管发生疗法,而且批准用于治疗转移性结直肠癌(一线和二线治疗,与基于静脉内5-FU的化疗组合),晚期非鳞状,非小细胞肺癌(NSCLC)(不可切除的,局部晚期,复发性或转移性NSCLC的一线治疗,与卡铂和帕利他赛组合)和转移性HER2阴性乳腺癌(先前未治疗的,转移性HER2阴性乳腺癌,与帕利他赛组合)。
贝伐珠单抗和其它人源化抗VEGF抗体进一步记载于2005年2月26日公告的美国专利No.6,884,879。别的抗体包括G6或B20系列抗体(例如G6-31,B20-4.1),如记载于PCT公开号WO2005/012359,PCT公开号WO2005/044853,和美国专利申请60/991,302,通过述及明确将这些专利申请的内容收入本文。对于别的抗体,参见美国专利No.7,060,269,6,582,959,6,703,020;6,054,297;WO98/45332;WO 96/30046;WO94/10202;EP 0666868B1;美国专利申请公开文本No.2006009360,20050186208,20030206899,20030190317,20030203409,和20050112126;和Popkov等,Journal of Immunological Methods 288:149-164(2004)。其它抗体包括那些结合人VEGF上包含残基F17,M18,D19,Y21,Y25,Q89,I91,K101,E103,和C104或者包含残基F17,Y21,Q22,Y25,D63,I83和Q89的功能性表位的。
在本发明的一个实施方案中,抗VEGF抗体具有包含下述氨基酸序列的轻链可变区:DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ GTKVEIKR(SEQ ID NO:214);和/或包含下述氨基酸序列的重链可变区:EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS(SEQ ID NO:215)。
在一些实施方案中,该抗VEGF抗体包含贝伐珠单抗的一个,两个,三个,四个,五个,或六个高变区(HVR)序列。在一些实施方案中,该抗VEGF抗体包含一个,两个,三个,四个,五个,或六个选自下述的高变区(HVR)序列:(a)包含氨基酸序列GYTFTNYGMN(SEQ ID NO:216)的HVR-H1;(b)包含氨基酸序列WINTYTGEPTYAADFKR(SEQ ID NO:217)的HVR-H2;(c)包含氨基酸序列YPHYYGSSHWYFDV(SEQ ID NO:218)的HVR-H3;(d)包含氨基酸序列SASQDISNYLN(SEQ ID NO:219)的HVR-L1;(e)包含氨基酸序列FTSSLHS(SEQ ID NO:220)的HVR-L2;和(f)包含氨基酸序列QQYSTVPWT(SEQ ID NO:221)的HVR-L3。在一些实施方案中,该抗VEGF抗体包含美国专利No.6,884,879中记载的抗体的一个,两个,三个,四个,五个,或六个高变区(HVR)序列。在一些实施方案中,该抗VEGF抗体包含包含下述氨基酸序列的轻链可变区的一个,两个,或三个高变区(HVR)序列:DIQMTQSPSS LSASVGDRVT ITCSASQDIS NYLNWYQQKP GKAPKVLIYF TSSLHSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQQ YSTVPWTFGQ GTKVEIKR(SEQ ID NO:214)和/或包含下述氨基酸序列的重链可变区的一个,两个,或三个高变区(HVR)序列:EVQLVESGGG LVQPGGSLRL SCAASGYTFT NYGMNWVRQA PGKGLEWVGW INTYTGEPTY AADFKRRFTF SLDTSKSTAY LQMNSLRAED TAVYYCAKYP HYYGSSHWYF DVWGQGTLVT VSS(SEQ ID NO:215)。
依照本发明的“G6系列抗体”指自G6抗体的序列衍生的抗VEGF抗体或依照PCT公开文本No.WO2005/012359的图7,24-26,和34-35之任一的G6衍生抗体,通过述及将其整个公开内容收入本文。还可参见PCT公开文本No.WO2005/044853,通过述及将这些专利申请的内容明确收入本文。在一个实施方案中,G6系列抗体结合人VEGF上的功能性表位,其包含残基F17,Y21,Q22,Y25,D63,I83和Q89。
依照本发明的“B20系列抗体”指自B20抗体的序列衍生的抗VEGF抗体或依照PCT公开文本No.WO2005/012359的图27-29之任一的B20衍生抗体,通过述及将其整个公开内容收入本文。还可参见PCT公开文本No.WO2005/044853和美国专利申请60/991,302,通过述及将这些专利申请的内容明确收入本文。在一个实施方案中,B20系列抗体结合人VEGF上的功能性表位,其包含残基F17,M18,D19,Y21,Y25,Q89,I91,K101,E103,和C104。
依照本发明的“功能性表位”指抗原中有力地促进抗体结合的氨基酸残基。抗原中贡献巨大的残基中任一个的突变(例如,丙氨酸或同系物突变对野生型VEGF的突变)会破坏抗体的结合,使得抗体的相对亲和力比(IC50突变型VEGF/IC50野生型VEGF)会大于5(参见WO2005/012359的实施例2)。在一个实施方案中,相对亲和力比是通过溶液结合噬菌体展示ELISA测定的。简言之,将96孔Maxisorp免疫板(NUNC)用Fab形式的待测试抗体以PBS中2ug/ml的浓度于4℃包被过夜,并用PBS,0.5%BSA,和0.05%Tween20(PBT)于室温封闭2小时。首先将展示hVEGF丙氨酸点突变体(残基8-109形式)或野生型hVEGF(8-109)的噬菌体在PBT中的连续稀释液在Fab包被的板上于室温温育15分钟,并用PBS,0.05%Tween20(PBST)清洗板。用在PBT中1:5000稀释的抗M13单克隆抗体辣根过氧化物酶(Amersham Pharmacia)缀合物检测所结合的噬菌体,用3,3’,5,5’-四甲基联苯胺(TMB,Kirkegaard&Perry Labs,Gaithersburg,Md.)底物显色大约5分钟,用1.0M H3PO4淬灭,并以分光光度法于450nm读数。IC50值的比(IC50,ala/IC50,wt)代表了结合亲和力的降低倍数(相对结合亲和力)。
III.OX40结合激动剂
本文中提供的是在个体中治疗癌症或延迟癌症进展的方法,其包括对该个体施用有效量的抗血管发生剂和OX40结合激动剂。
OX40结合激动剂包括例如OX40激动性抗体(例如抗人OX40激动性抗体),OX40L激动性片段,OX40寡聚受体,和OX40免疫粘附素。在一些实施方案中,该OX40结合激动剂是三聚OX40L-Fc蛋白。在一些实施方案中,该OX40结合激动剂是包含一个或多个OX40L胞外域的OX40L激动性片段。在一些实施方案中,该OX40激动性抗体是全长人IgG1抗体。本文中描述的任何OX40结合激动剂(例如抗人OX40激动性抗体)可以在本文中描述的任何方法,用途,和/或试剂盒中使用。
在一些实施方案中,与用该OX40激动性抗体治疗之前的增殖和/或细胞因子生成相比,该OX40激动性抗体提高CD4+效应T细胞增殖和/或提高该CD4+效应T细胞的细胞因子生成。在一些实施方案中,该细胞因子是IFN-γ。
在一些实施方案中,该OX40激动性抗体提高记忆T细胞增殖和/或提高该记忆细胞的细胞因子生成。在一些实施方案中,该细胞因子是IFN-γ。
在一些实施方案中,该OX40激动性抗体抑制效应T细胞功能的Treg遏制。在一些实施方案中,该效应T细胞功能是效应T细胞增殖和/或细胞因子生成。在一些实施方案中,该效应T细胞是CD4+效应T细胞。
在一些实施方案中,该OX40激动性抗体提高表达OX40的靶细胞中的OX40信号转导。在一些实施方案中,通过监测NFkB下游信号传导来检测OX40信号转导。
在一些实施方案中,该抗人OX40激动性抗体是消减性抗人OX40抗体(例如消减表达人OX40的细胞)。在一些实施方案中,该OX40激动性抗体在体外消减表达人OX40的细胞。在一些实施方案中,该表达人OX40的细胞是CD4+效应T细胞。在一些实施方案中,该表达人OX40的细胞是Treg细胞。在一些实施方案中,消减是通过ADCC和/或吞噬作用。在一些实施方案中,该抗体通过结合由人效应细胞表达的FcγR并激活该人效应细胞功能来介导ADCC。在一些实施方案中,该抗体通过结合由人效应细胞表达的FcγR并激活该人效应细胞功能来介导吞噬作用。例示性的人效应细胞包括例如巨噬细胞,天然杀伤(NK)细胞,单核细胞,嗜中性细胞。在一些实施方案中,该人效应细胞是巨噬细胞。
在一些实施方案中,该抗人OX40激动性抗体具有功能性Fc区。在一些实施方案中,功能性Fc区的效应器功能是ADCC。在一些实施方案中,功能性Fc区的效应器功能是吞噬作用。在一些实施方案中,功能性Fc区的效应器功能是ADCC和吞噬作用。在一些实施方案中,该Fc区是人IgG1。在一些实施方案中,该Fc区是人IgG4。
在一些实施方案中,该抗人OX40激动性抗体以小于或等于约0.45nM的亲和力结合人OX40。在一些实施方案中,该抗人OX40抗体以小于或等于约0.4nM的亲和力结合人OX40。在一些实施方案中,该抗人OX40抗体以小于或等于约0.5nM的亲和力结合人OX40。在一些实施方案中,结合亲和力是使用放射免疫测定法测定的。
在一些实施方案中,该OX40结合激动剂是结合人OX40的OX40激动性抗体。在一些实施方案中,该OX40激动性抗体以小于或等于约1nM的亲和力结合人OX40。在一些实施方案中,该抗人OX40激动性抗体以小于或等于约0.45nM的亲和力结合人OX40。在一些实施方案中,该抗人OX40抗体以小于或等于约0.4nM的亲和力结合人OX40。在一些实施方案中,该抗人OX40抗体以小于或等于约0.5nM的亲和力结合人OX40。在一些实施方案中,结合亲和力是使用放射免疫测定法测定的。
在一些实施方案中,该抗人OX40激动性抗体结合人OX40和食蟹猴OX40。在一些实施方案中,结合是使用FACS测定法测定的。在一些实施方案中,对人OX40的结合具有约0.2ug/ml的EC50。在一些实施方案中,对人OX40的结合具有约0.3ug/ml或更低的EC50。在一些实施方案中,对食蟹猴OX40的结合具有约1.5ug/ml的EC50。在一些实施方案中,对食蟹猴OX40的结合具有约1.4ug/ml的EC50。
在一些实施方案中,该抗人OX40激动性抗体不结合大鼠OX40或小鼠OX40。
在一些实施方案中,该抗人OX40激动性抗体是消减性抗人OX40抗体(例如消减表达人OX40的细胞)。在一些实施方案中,该表达人OX40的细胞是CD4+效应T细胞。在一些实施方案中,该表达人OX40的细胞是Treg细胞。在一些实施方案中,消减是通过ADCC和/或吞噬进行的。在一些实施方案中,该抗体通过结合由人效应细胞表达的FcγR和激活人效应细胞功能来介导ADCC。在一些实施方案中,该抗体通过结合由人效应细胞表达的FcγR和激活人效应细胞功能来介导吞噬。例示性人效应细胞包括例如巨噬细胞,天然杀伤(NK)细胞,单核细胞,嗜中性粒细胞。在一些实施方案中,该人效应细胞是巨噬细胞。在一些实施方案中,该人效应细胞是NK细胞。在一些实施方案中,消减不是通过凋亡进行的。
在一些实施方案中,该抗人OX40激动性抗体具有功能性Fc区。在一些实施方案中,功能性Fc区的效应器功能是ADCC。在一些实施方案中,功能性Fc区的效应器功能是吞噬。在一些实施方案中,功能性Fc区的效应器功能是ADCC和吞噬。在一些实施方案中,该Fc区是人IgG1。在一些实施方案中,该Fc区是人IgG4。
在一些实施方案中,该抗人OX40激动性抗体在表达OX40的细胞(例如Treg)中不诱导凋亡。在一些实施方案中,凋亡是使用抗体浓度30ug/ml测定的,例如通过使用膜联蛋白V和碘化丙啶染色的Treg测定是否发生凋亡。
在一些实施方案中,该抗人OX40激动性抗体增强CD4+效应T细胞功能,例如通过提高CD4+效应T细胞增殖和/或提高CD4+效应T细胞的γ-干扰素生成(例如与抗人OX40激动性抗体处理之前的增殖和/或细胞因子生成相比)。在一些实施方案中,该细胞因子是γ-干扰素。在一些实施方案中,该抗人OX40激动性抗体提高肿瘤内(浸润性)CD4+效应T细胞的数目(例如CD4+效应T细胞的总数,或例如CD45+细胞中CD4+细胞的百分比),例如与抗人OX40激动性抗体处理之前肿瘤内(浸润性)CD4+ T细胞的数目相比。在一些实施方案中,该抗人OX40激动性抗体提高表达γ-干扰素的肿瘤内(浸润性)CD4+效应T细胞的数目(例如表达γ-干扰素的CD4+细胞的总数,或例如总CD4+细胞中表达γ-干扰素的CD4+细胞的百分比),例如与抗人OX40激动性抗体处理之前表达γ-干扰素的肿瘤内(浸润性)CD4+ T细胞的数目相比。
在一些实施方案中,该抗人OX40激动性抗体提高肿瘤内(浸润性)CD8+效应T细胞的数目(例如CD8+效应T细胞的总数,或例如CD45+细胞中CD8+的百分比),例如与抗人OX40激动性抗体处理之前肿瘤内(浸润性)CD8+ T效应细胞的数目相比。在一些实施方案中,该抗人OX40激动性抗体提高表达γ-干扰素的肿瘤内(浸润性)CD8+效应T细胞的数目(例如总CD8+细胞中表达γ-干扰素的CD8+细胞的百分比),例如与抗人OX40激动性抗体处理之前表达γ-干扰素的肿瘤内(浸润性)CD8+ T细胞的数目相比。
在一些实施方案中,该抗人OX40激动性抗体增强记忆T细胞功能,例如通过提高记忆T细胞增殖和/或提高记忆细胞的细胞因子生成。在一些实施方案中,该细胞因子是γ-干扰素。
在一些实施方案中,该抗人OX40激动性抗体抑制Treg功能,例如通过降低效应T细胞功能(例如效应T细胞增殖和/或效应T细胞细胞因子分泌)的Treg遏制。在一些实施方案中,该效应T细胞是CD4+效应T细胞。在一些实施方案中,该抗人OX40激动性抗体降低肿瘤内(浸润性)Treg的数目(例如Treg的总数或例如CD4+细胞中Fox3p+细胞的百分比)。
在一些实施方案中,该抗人OX40激动性抗体改造成提高效应器功能(例如与野生型IgG1中的效应器功能相比)。在一些实施方案中,该抗体具有升高的对Fc受体的结合。在一些实施方案中,该抗体缺少附着(直接或间接)Fc区的岩藻糖。例如,此类抗体中岩藻糖的量可以是1%至80%,1%至65%,5%至65%或20%至40%。在一些实施方案中,该Fc区包含两分型寡糖,例如其中附着至抗体Fc区的双触角寡糖是通过GlcNAc两分的。在一些实施方案中,该抗体包含具有一处或多处提高ADCC的氨基酸替代的Fc区,例如Fc区位置298,333,和/或334(EU残基编号方式)处的替代。
在一些实施方案中,该抗人OX40激动性抗体提高表达OX40的靶细胞中的OX40信号转导。在一些实施方案中,OX40信号转导是通过监测NFkB下游信号传导而检测的。
在一些实施方案中,该抗人OX40激动性抗体于40℃处理2周后是稳定的。
在一些实施方案中,该抗人OX40激动性抗体结合人效应细胞,例如结合人效应细胞表达的FcγR(例如活化性FcγR)。在一些实施方案中,该人效应细胞实施(能够实施)ADCC效应器功能。在一些实施方案中,该人效应细胞实施(能够实施)吞噬效应器功能。
在一些实施方案中,包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变,例如DANA突变)的抗人OX40激动性抗体相对于包含天然序列IgG1 Fc部分的抗人OX40激动性抗体具有降低的活性(例如CD4+效应T细胞功能,例如增殖)。在一些实施方案中,包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变,例如DANA突变)的抗人OX40激动性抗体并不拥有实质性活性(例如CD4+效应T细胞功能,例如增殖)。
在一些实施方案中,抗人OX40激动性抗体功能需要抗体交联。在一些实施方案中,功能是刺激CD4+效应T细胞增殖。在一些实施方案中,抗体交联是通过提供粘附至固体表面(例如细胞培养板)的抗人OX40激动性抗体而测定的。在一些实施方案中,抗体交联是通过在该抗体的IgG1 Fc部分中引入突变(例如DANA突变)并测试突变体抗体的功能而测定的。
在一些实施方案中,该抗人OX40激动性抗体与OX40L竞争对人OX40的结合。在一些实施方案中,在体外测定法中添加OX40L并不增强抗人OX40抗体功能。
依照另一个实施方案,该抗人OX40激动性抗体包括任何一项下述特性,下述特性的任何组合,或所有下述特性:(1)以小于或等于约0.45nM的亲和力结合人OX40,在一些实施方案中,以小于或等于约0.4nM的亲和力结合人OX40,在一些实施方案中,以小于或等于约0.5nM的亲和力结合人OX40,在一些实施方案中,结合亲和力是使用放射免疫测定法测定的;(2)结合人OX40和食蟹猴OX40,在一些实施方案中,结合是使用FACS测定法测定的,(3)以约0.2ug/ml的EC50结合人OX40,在一些实施方案中,以约0.3ug/ml或更低的EC50结合人OX40,在一些实施方案中,以约1.5ug/ml的EC50结合食蟹猴OX40,在一些实施方案中,以约1.4ug/ml的EC50结合食蟹猴OX40,(4)并不实质性结合大鼠OX40或小鼠OX40,(6)是消减性抗人OX40抗体(例如消减表达人OX40的细胞),在一些实施方案中,该细胞是CD4+效应T细胞和/或Treg细胞,(7)增强CD4+效应T细胞功能,例如通过提高CD4+效应T细胞增殖和/或提高CD4+效应T细胞的γ-干扰素生成(例如与抗人OX40激动性抗体处理之前的增殖和/或细胞因子生成相比),(8)增强记忆T细胞功能,例如通过提高记忆T细胞增殖和/或提高记忆细胞的细胞因子生成,(9)抑制Treg功能,例如通过降低效应T细胞功能(例如效应T细胞增殖和/或效应T细胞细胞因子分泌)的Treg遏制。在一些实施方案中,该效应T细胞是CD4+效应T细胞,(10)提高表达OX40的靶细胞中的OX40信号转导(在一些实施方案中,OX40信号转导是通过监测NFkB下游信号传导检测的),(11)于40℃处理2周后是稳定的,(12)结合人效应细胞,例如结合由人效应细胞表达的FcγR,(13)包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变,例如N297G)的抗人OX40激动性抗体相对于包含天然序列IgG1 Fc部分的抗人OX40激动性抗体具有降低的活性(例如CD4+效应T细胞功能,例如增殖),在一些实施方案中,包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变,例如N297G)的抗人OX40激动性抗体并不拥有实质性活性(例如CD4+效应T细胞功能,例如增殖),(14)抗人OX40激动性抗体功能需要抗体交联(例如通过Fc受体结合)。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:7的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。在一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3。在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3和包含氨基酸序列SEQ ID NO:7的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3,包含氨基酸序列SEQ ID NO:7的HVR-L3,和包含氨基酸序列SEQ ID NO:3的HVR-H2。在又一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。
另一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。在一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。
另一方面,本发明的抗人OX40激动性抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:2的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:4的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:5的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。
另一方面,本发明提供抗人OX40激动性抗体,其包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:7的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:26的HVR-L3。
在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3和包含氨基酸序列SEQ ID NO:26的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3,包含氨基酸序列SEQ ID NO:26的HVR-L3,和包含氨基酸序列SEQ ID NO:3的HVR-H2。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:2的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:4的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:5的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:26的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:26的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:27的HVR-L3。
在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3和包含氨基酸序列SEQ ID NO:27的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4的HVR-H3,包含氨基酸序列SEQ ID NO:27的HVR-L3,和包含氨基酸序列SEQ ID NO:3的HVR-H2。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:2的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:4的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:5的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:27的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:2的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:27的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3。
一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(a)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3。在一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3。在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3和包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3,包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3,和包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2。在又一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3。
另一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3。在一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:5的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:2,8或9的HVR-H1;(b)包含氨基酸序列SEQ ID NO:3,10,11,12,13或14的HVR-H2;(c)包含氨基酸序列SEQ ID NO:4,15,或19的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:7,22,23,24,25,26,27,或28的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:172的HVR-H1;(b)包含氨基酸序列SEQ ID NO:173的HVR-H2;(c)包含氨基酸序列SEQ ID NO:174的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:175的HVR-L3。在一些实施方案中,HVR-H2不是DMYPDAAAASYNQKFRE(SEQ ID NO:230)。在一些实施方案中,HVR-H3不是APRWAAAA(SEQ ID NO:231)。在一些实施方案中,HVR-L3不是QAAAAAAAT(SEQ ID NO:232)。
一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(a)包含氨基酸序列SEQ ID NO:172的HVR-H1;(b)包含氨基酸序列SEQ ID NO:173的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:174的HVR-H3。在一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:174的HVR-H3。在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:174的HVR-H3和包含氨基酸序列SEQ ID NO:175的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:174的HVR-H3,包含氨基酸序列SEQ ID NO:175的HVR-L3,和包含氨基酸序列SEQ ID NO:173的HVR-H2。在又一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:172的HVR-H1;(b)包含氨基酸序列SEQ ID NO:173的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:174的HVR-H3。在一些实施方案中,HVR-H2不是DMYPDAAAASYNQKFRE(SEQ ID NO:230)。在一些实施方案中,HVR-H3不是APRWAAAA(SEQ ID NO:231)。在一些实施方案中,HVR-L3不是QAAAAAAAT(SEQ ID NO:232)。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:175的HVR-L3。在一些实施方案中,HVR-L3不是QAAAAAAAT(SEQ ID NO:232)。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:172的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:173的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:174的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:5的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:6的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:175的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:172的HVR-H1;(b)包含氨基酸序列SEQ ID NO:173的HVR-H2;(c)包含氨基酸序列SEQ ID NO:174的HVR-H3;(d)包含氨基酸序列SEQ ID NO:5的HVR-L1;(e)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:175的HVR-L3。在一些实施方案中,HVR-H2不是DMYPDAAAASYNQKFRE(SEQ ID NO:230)。在一些实施方案中,HVR-H3不是APRWAAAA(SEQ ID NO:231)。在一些实施方案中,HVR-L3不是QAAAAAAAT(SEQ ID NO:232)。
共有序列SEQ ID NO:172,173,174和175涵盖上述替代的所有可能组合。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:39的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:42的HVR-L3。
一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。在一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3。在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3和包含氨基酸序列SEQ ID NO:42的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3,包含氨基酸序列SEQ ID NO:42的HVR-L3,和包含氨基酸序列SEQ ID NO:30的HVR-H2。在又一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。
另一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:39的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。在一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:39的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:29的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:30的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:33的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:37的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:39的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:39的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:42的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:40的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:42的HVR-L3。
另一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:40的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。在一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:40的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:29的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:30的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:33的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:37的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:40的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:40的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:42的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30,31,或32的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:39,40或41的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3。
一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30,31,或32的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3和包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3,包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3,和包含氨基酸序列SEQ ID NO:39,40或41的HVR-H2。在又一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30,31,或32的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。
另一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:39,40或41的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3。在一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:39,40或41的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:29的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:30,31,或32的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:33的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:37的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:39,40或41的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:30,31,或32的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:39,40或41的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:42,43,或44的HVR-L3。
一方面,本发明提供抗人OX40激动性抗体,其包含至少一个,两个,三个,四个,五个,或六个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:175的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:177的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:178的HVR-L3。
一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:175的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。在另一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3和包含氨基酸序列SEQ ID NO:177的HVR-L3。在又一个实施方案中,该抗体包含包含氨基酸序列SEQ ID NO:33的HVR-H3,包含氨基酸序列SEQ ID NO:178的HVR-L3,和包含氨基酸序列SEQ ID NO:176的HVR-H2。在又一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:176的HVR-H2;和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。
另一方面,本发明提供一种抗体,其包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:177的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:177的HVR-L3。在一个实施方案中,该抗体包含(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:177的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:178的HVR-L3。
另一方面,本发明的抗体包含(a)VH域,该VH域包含至少一个,至少两个,或所有三个选自下述的VH HVR序列:(i)包含氨基酸序列SEQ ID NO:29的HVR-H1,(ii)包含氨基酸序列SEQ ID NO:176的HVR-H2,和(iii)包含氨基酸序列SEQ ID NO:33的HVR-H3;和(b)VL域,该VL域包含至少一个,至少两个,或所有三个选自下述的VL HVR序列:(i)包含氨基酸序列SEQ ID NO:37的HVR-L1,(ii)包含氨基酸序列SEQ ID NO:177的HVR-L2,和(c)包含氨基酸序列SEQ ID NO:178的HVR-L3。
另一方面,本发明提供一种抗体,其包含(a)包含氨基酸序列SEQ ID NO:29的HVR-H1;(b)包含氨基酸序列SEQ ID NO:176的HVR-H2;(c)包含氨基酸序列SEQ ID NO:33的HVR-H3;(d)包含氨基酸序列SEQ ID NO:37的HVR-L1;(e)包含氨基酸序列SEQ ID NO:177的HVR-L2;和(f)包含氨基酸序列SEQ ID NO:178的HVR-L3。
在任何上述实施方案中,抗OX40激动性抗体是人源化的。在一个实施方案中,抗OX40抗体包含任何上述实施方案或图11中任何实施方案的HVR,且进一步包含受体人框架,例如人免疫球蛋白框架或人共有框架。在另一个实施方案中,抗OX40抗体包含任何上述实施方案的HVR,且进一步包含包含图11中所示FR序列的VH和/或VL。
另一方面,抗人OX40激动性抗体包含与氨基酸序列SEQ ID NO:56,58,60,62,64,66,68,70,72,74,76,78,80,82,84,86,88,90,92,94,96,98,100,108,114,116,233,或234具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:56,58,60,62,64,66,68,70,72,74,76,78,80,82,84,86,88,90,92,94,96,98,100,108,114,116,233,或234中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:SEQ ID NO:56,58,60,62,64,66,68,70,72,74,76,78,80,82,84,86,88,90,92,94,96,98,100,108,114,116,233,或234中的VH序列,包括该序列的翻译后修饰。在特定实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含与氨基酸序列SEQ ID NO:57,59,61,63,65,67,69,71,73,75,77,79,81,83,85,87,89,91,93,95,97,99,101,109,115或117具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:57,59,61,63,65,67,69,71,73,75,77,79,81,83,85,87,89,91,93,95,97,99,101,109,115或117中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:57,59,61,63,65,67,69,71,73,75,77,79,81,83,85,87,89,91,93,95,97,99,101,109,115或117中的VL序列,包括该序列的翻译后修饰。在特定实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。
另一方面,抗人OX40激动性抗体包含与氨基酸序列SEQ ID NO:56具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:56中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:56中的VH序列,包括该序列的翻译后修饰。在特定实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含与氨基酸序列SEQ ID NO:57具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:57中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:57中的VL序列,包括该序列的翻译后修饰。在特定实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。
另一方面,抗人OX40激动性抗体包含与氨基酸序列SEQ ID NO:179具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:179中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:179中的VH序列,包括该序列的翻译后修饰。在特定实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含与氨基酸序列SEQ ID NO:180具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:180中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:180中的VL序列,包括该序列的翻译后修饰。在特定实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:7的HVR-L3。
另一方面,抗人OX40激动性抗体包含与氨基酸序列SEQ ID NO:94具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:94中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:94中的VH序列,包括该序列的翻译后修饰。在特定实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含与氨基酸序列SEQ ID NO:95具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:95中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:95中的VL序列,包括该序列的翻译后修饰。在特定实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:26的HVR-L3。
另一方面,抗人OX40激动性抗体包含与氨基酸序列SEQ ID NO:96具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:96中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:96中的VH序列,包括该序列的翻译后修饰。在特定实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:2的HVR-H1,(b)包含氨基酸序列SEQ ID NO:3的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:4的HVR-H3。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含与氨基酸序列SEQ ID NO:97具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:97中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:97中的VL序列,包括该序列的翻译后修饰。在特定实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:5的HVR-L1;(b)包含氨基酸序列SEQ ID NO:6的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:27的HVR-L3。
另一方面,抗人OX40激动性抗体包含与氨基酸序列SEQ ID NO:118,120,122,124,126,128,130,132,134,136,138,140,142,144,146,148具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重链可变域(VH)序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VH序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:118,120,122,124,126,128,130,132,134,136,138,140,142,144,146,148中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:118,120,122,124,126,128,130,132,134,136,138,140,142,144,146,148中的VH序列,包括该序列的翻译后修饰。在特定实施方案中,该VH包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:29的HVR-H1,(b)包含氨基酸序列SEQ ID NO:30的HVR-H2,和(c)包含氨基酸序列SEQ ID NO:33的HVR-H3。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含与氨基酸序列SEQ ID NO:119,121,123,125,127,129,131,133,135,137,139,141,143,145,147,149具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的轻链可变域(VL)。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的VL序列相对于参照序列含有替代(例如保守替代),插入,或删除,但是包含该序列的抗人OX40激动性抗体保留结合OX40的能力。在某些实施方案中,在SEQ ID NO:119,121,123,125,127,129,131,133,135,137,139,141,143,145,147,149中替代,插入和/或删除了总共1至10个氨基酸。在某些实施方案中,替代,插入,或删除发生在HVR以外的区域中(即在FR中)。任选地,该抗人OX40激动性抗体包含SEQ ID NO:119,121,123,125,127,129,131,133,135,137,139,141,143,145,147,149中的VL序列,包括该序列的翻译后修饰。在特定实施方案中,该VL包含一个,两个或三个选自下述的HVR:(a)包含氨基酸序列SEQ ID NO:37的HVR-L1;(b)包含氨基酸序列SEQ ID NO:39的HVR-L2;和(c)包含氨基酸序列SEQ ID NO:42的HVR-L3。
在一个实施方案中,该抗体包含分别在SEQ ID NO:56和SEQ ID NO:57中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:58和SEQ ID NO:59中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:60和SEQ ID NO:61中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:62和SEQ ID NO:63中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:64和SEQ ID NO:65中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:66和SEQ ID NO:67中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:68和SEQ ID NO:69中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:70和SEQ ID NO:71中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:72和SEQ ID NO:73中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:74和SEQ ID NO:75中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:76和SEQ ID NO:77中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:78和SEQ ID NO:79中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:80和SEQ ID NO:81中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:82和SEQ ID NO:83中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:84和SEQ ID NO:85中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:86和SEQ ID NO:87中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:88和SEQ ID NO:89中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:90和SEQ ID NO:91中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:92和SEQ ID NO:93中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:94和SEQ ID NO:95中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:96和SEQ ID NO:97中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:98和SEQ ID NO:99中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:100和SEQ ID NO:101中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:108和SEQ ID NO:109中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:114和SEQ ID NO:115中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:116和SEQ ID NO:117中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:233和SEQ ID NO:65中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:234和SEQ ID NO:69中的VH和VL序列,包括那些序列的翻译后修饰。
在一个实施方案中,该抗体包含分别在SEQ ID NO:118和SEQ ID NO:119中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:120和SEQ ID NO:121中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:122和SEQ ID NO:123中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:124和SEQ ID NO:125中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:126和SEQ ID NO:127中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:128和SEQ ID NO:129中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别SEQ ID NO:130和SEQ ID NO:131在中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:132和SEQ ID NO:133中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:134和SEQ ID NO:135中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:136和SEQ ID NO:137中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:138和SEQ ID NO:139中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:140和SEQ ID NO:141中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别SEQ ID NO:142和SEQ ID NO:143在中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:144和SEQ ID NO:145中的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,该抗体包含分别在SEQ ID NO:146和SEQ ID NO:147中的VH和VL序列,包括那些序列的翻译后修饰。
另一方面,提供抗人OX40激动性抗体,其中该抗体包含上文提供的任何实施方案中的VH和上文提供的任何实施方案中的VL。
又一方面,本发明提供与本文中提供的抗人OX40抗体结合相同表位的抗体。在一些实施方案中,该抗体是抗人OX40激动性抗体。
在一些实施方案中,该抗人OX40激动性抗体是人或人源化抗体。在一些实施方案中,该OX40结合激动剂(例如OX40激动性抗体)不是MEDI6383。在一些实施方案中,该OX40结合激动剂(例如OX40激动性抗体)不是MEDI0562。
在一些实施方案中,该OX40激动性抗体是美国专利No.7,550,140中描述的抗人OX40激动性抗体,通过援引将其完整收入本文。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYTMNWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDRYSQVHYALDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:183)的重链和/或包含序列
DIVMTQSPDSLPVTPGEPASISCRSSQSLLHSNGYNYLDWYLQKAGQSPQLLIYLGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQYYNHPTTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:184)的轻链。在一些实施方案中,该抗体包含美国专利No.7,550,140中描述的抗体008的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含美国专利No.7,550,140中描述的抗体008的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是美国专利No.7,550,140中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含序列
DIQMTQSPDSLPVTPGEPASISCRSSQSLLHSNGYNYLDWYLQKAGQSPQLLIYLGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQYYNHPTTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:185)。在一些实施方案中,该抗体包含美国专利No.7,550,140中描述的抗体SC02008的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含美国专利No.7,550,140中描述的抗体SC02008的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是美国专利No.7,550,140中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLVESGGGLVHPGGSLRLSCAGSGFTFSSYAMHWVRQAPGKGLEWVSAIGTGGGTYYADSVMGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYDNVMGLYWFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:186)的重链和/或包含序列
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPAFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:187)的轻链。在一些实施方案中,该抗体包含美国专利No.7,550,140中描述的抗体023的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含美国专利No.7,550,140中描述的抗体023的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是美国专利No.7,960,515中描述的抗人OX40激动性抗体,通过援引将其完整收入本文。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLVESGGGLVQPGGSLRLSCAASGFTFSSYSMNWVRQAPGKGLEWVSYISSSSSTIDYADSVKGRFTISRDNAKNSLYLQMNSLRDEDTAVYYCARESGWYLFDYWGQGTLVTVSS(SEQ ID NO:188)的重链可变区和/或包含序列DIQMTQSPSSLSASVGDRVTITCRASQGISSWLAWYQQKPEKAPKSLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYNSYPPTFGGGTKVEIK(SEQ ID NO:189)的轻链可变区。在一些实施方案中,该抗体包含美国专利No.7,960,515中描述的抗体11D4的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含美国专利No.7,960,515中描述的抗体11D4的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是美国专利No.7,960,515中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLVESGGGLVQPGRSLRLSCAASGFTFDDYAMHWVRQAPGKGLEWVSGISWNSGSIGYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTALYYCAKDQSTADYYFYYGMDVWGQGTTVTVSS(SEQ ID NO:190)的重链可变区和/或包含序列
EIVVTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPTFGQGTKVEIK(SEQ ID NO:191)的轻链可变区。在一些实施方案中,该抗体包含美国专利No.7,960,515中描述的抗体18D8的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含美国专利No.7,960,515中描述的抗体18D8的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2012/027328中描述的抗人OX40激动性抗体,通过援引将其完整收入本文。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGSELKKPGASVKVSCKASGYTFTDYSMHWVRQAPGQGLKWMGWINTETGEPTYADDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCANPYYDYVSYYAMDYWGQGTTVTVSS(SEQ ID NO:192)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVSTAVAWYQQKPGKAPKLLIYSASYLYTGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQHYSTPRTFGQGTKLEIK(SEQ ID NO:193)的轻链可变区。在一些实施方案中,该抗体包含WO2012/027328中描述的抗体hu106-222的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2012/027328中描述的抗体hu106-222的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2012/027328中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLVESGGGLVQPGGSLRLSCAASEYEFPSHDMSWVRQAPGKGLELVAAINSDGGSTYYPDTMERRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARHYDDYYAWFAYWGQGTMVTVSS(SEQ ID NO:194)的重链可变区和/或包含序列
EIVLTQSPATLSLSPGERATLSCRASKSVSTSGYSYMHWYQQKPGQAPRLLIYLASNLESGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQHSRELPLTFGGGTKVEIK(SEQ ID NO:195)的轻链可变区。在一些实施方案中,该抗体包含WO 2012/027328中描述的抗体Hu119-122的至少一种,两种,三种,四种,五种或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO2012/027328中描述的抗体Hu119-122的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2013/028231中描述的抗人OX40激动性抗体,通过援引将其完整收入本文。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
MYLGLNYVFIVFLLNGVQSEVKLEESGGGLVQPGGSMKLSCAASGFTFSDAWMDWVRQSPEKGLEWVAEIRSKANNHATYYAESVNGRFTISRDDSKSSVYLQMNSLRAEDTGIYYCTWGEVFYFDYWGQGTTLTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYITCNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:196)的重链和/或包含序列
MRPSIQFLGLLLFWLHGAQCDIQMTQSPSSLSASLGGKVTITCKSSQDINKYIAWYQHKPGKGPRLLIHYTSTLQPGIPSRFSGSGSGRDYSFSISNLEPEDIATYYCLQYDNLLTFGAGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:197)的轻链。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
MYLGLNYVFIVFLLNGVQSEVKLEESGGGLVQPGGSMKLSCAASGFTFSDAWMDWVRQSPEKGLEWVAEIRSKANNHATYYAESVNGRFTISRDDSKSSVYLQMNSLRAEDTGIYYCTWGEVFYFDYWGQGTTLTVSS(SEQ ID NO:198)的重链可变区和/或包含序列
MRPSIQFLGLLLFWLHGAQCDIQMTQSPSSLSASLGGKVTITCKSSQDINKYIAWYQHKPGKGPRLLIHYTSTLQPGIPSRFSGSGSGRDYSFSISNLEPEDIATYYCLQYDNLLTFGAGTKLELK(SEQ ID NO:199)的轻链可变区。在一些实施方案中,该抗体包含WO 2013/028231中描述的抗体Mab CH 119-43-1的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2013/028231中描述的抗体Mab CH 119-43-1的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2013/038191中描述的抗人OX40激动性抗体,通过援引将其完整收入本文。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLQQSGPELVKPGASVKMSCKASGYTFTSYVMHWVKQKPGQGLEWIGYINPYNDGTKYNEKFKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCANYYGSSLSMDYWGQGTSVTVSS(SEQ ID NO:200)的重链可变区和/或包含序列
DIQMTQTTSSLSASLGDRVTISCRASQDISNYLNWYQQKPDGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPWTFGGGTKLEIKR(SEQ ID NO:201)的轻链可变区。在一些实施方案中,该抗体包含WO 2013/038191中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2013/038191中描述的抗体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2013/038191中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
EVQLQQSGPELVKPGASVKISCKTSGYTFKDYTMHWVKQSHGKSLEWIGGIYPNNGGSTYNQNFKDKATLTVDKSSSTAYMEFRSLTSEDSAVYYCARMGYHGPHLDFDVWGAGTTVTVSP(SEQ ID NO:202)的重链可变区和/或包含序列
DIVMTQSHKFMSTSLGDRVSITCKASQDVGAAVAWYQQKPGQSPKLLIYWASTRHTGVPDRFTGGGSGTDFTLTISNVQSEDLTDYFCQQYINYPLTFGGGTKLEIKR(SEQ ID NO:203)的轻链可变区。在一些实施方案中,该抗体包含WO 2013/038191中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2013/038191中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体,通过援引将其完整收入本文。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWMGYINPYNDGTKYNEKFKGRVTITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS(SEQ ID NO:204)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIKR(SEQ ID NO:205)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWMGYINPYNDGTKYNEKFKGRVTITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS(SEQ ID NO:204)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYFCQQGNTLPWTFGQGTKVEIKR(SEQ ID NO:206)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS(SEQ ID NO:207)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIKR(SEQ ID NO:205)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS(SEQ ID NO:207)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYFCQQGNTLPWTFGQGTKVEIKR(SEQ ID NO:206)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATLTSDKSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS(SEQ ID NO:208)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIKR(SEQ ID NO:205)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATLTSDKSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS(SEQ ID NO:208)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYFCQQGNTLPWTFGQGTKVEIKR(SEQ ID NO:206)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆20E5的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWMGGIYPNNGGSTYNQNFKDRVTITADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS(SEQ ID NO:209)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR(SEQ ID NO:210)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWMGGIYPNNGGSTYNQNFKDRVTITADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS(SEQ ID NO:209)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVAWYQQKPGKAPKLLIYWASTRHTGVPDRFSGGGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR(SEQ ID NO:211)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRVTLTADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS(SEQ ID NO:212)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR(SEQ ID NO:210)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRVTLTADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS(SEQ ID NO:212)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVAWYQQKPGKAPKLLIYWASTRHTGVPDRFSGGGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR(SEQ ID NO:211)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRATLTVDKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS(SEQ ID NO:213)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVAWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR(SEQ ID NO:210)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是WO 2014/148895A1中描述的抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体包含包含序列
QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRATLTVDKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS(SEQ ID NO:213)的重链可变区和/或包含序列
DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVAWYQQKPGKAPKLLIYWASTRHTGVPDRFSGGGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR(SEQ ID NO:211)的轻链可变区。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含WO 2014/148895A1中描述的抗体克隆12H3的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该激动性抗人OX40抗体是L106BD(Pharmingen产品号340420)。在一些实施方案中,该抗体包含抗体L106(BD Pharmingen产品号340420)的至少一种,两种,三种,四种,五种或六种高变区(HVR)序列。在一些实施方案中,该抗体包含抗体L106(BD Pharmingen产品号340420)的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该激动性抗人OX40抗体是ACT35(Santa CruzBiotechnology,目录号20073)。在一些实施方案中,该抗体包含抗体ACT35(Santa Cruz Biotechnology,目录号20073)的至少一种,两种,三种,四种,五种或六种高变区(HVR)序列。在一些实施方案中,该抗体包含抗体ACT35(Santa Cruz Biotechnology,目录号20073)的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是MEDI6469。在一些实施方案中,该抗体包含抗体MEDI6469的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含抗体MEDI6469的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是MEDI0562。在一些实施方案中,该抗体包含抗体MEDI0562的至少一种,两种,三种,四种,五种,或六种高变区(HVR)序列。在一些实施方案中,该抗体包含抗体MEDI0562的重链可变区序列和/或轻链可变区序列。
在一些实施方案中,该OX40激动性抗体是与上文所列任一OX40激动性抗体结合相同表位的激动性抗体。
在一些实施方案中,该抗人OX40激动性抗体具有功能性Fc区。在一些实施方案中,该Fc区是人IgG1。在一些实施方案中,该Fc区是人IgG4。在一些实施方案中,该抗人OX40激动性抗体工程化改造成提高效应器功能(例如与野生型IgG1中的效应器功能相比)。在一些实施方案中,该抗体具有升高的对Fc受体的结合。在一些实施方案中,该抗体缺乏附着(直接或间接)至Fc区的岩藻糖。例如,此类抗体中岩藻糖的量可以是1%至80%,1%至65%,5%至65%或20%至40%。在一些实施方案中,该Fc区包含两分型寡糖,例如其中附着至抗体Fc区的双触角寡糖是通过GlcNAc来两分的。在一些实施方案中,该抗体包含具有一处或多处改善ADCC的氨基酸替代的Fc区,例如Fc区位置298,333,和/或334(EU残基编号方式)处的替代。
对本文所述方法有用的OX40激动剂绝非意图限于抗体。涵盖非抗体OX40激动剂,而且是本领域公知的。
如上所述,OX40L(也称作CD134L)充当OX40的配体。因此,呈现部分或整个OX40L的激动剂可充当OX40激动剂。在一些实施方案中,OX40激动剂可包括一个或多个OX40L胞外域。OX40L胞外域的例子可包括OX40结合域。在一些实施方案中,OX40激动剂可以是可溶性形式的OX40L,其包括一个或多个OX40L胞外域但缺乏该蛋白质的其它,不溶性域,例如跨膜域。在一些实施方案中,OX40激动剂是包括能够结合OX40L的一个或多个OX40L胞外域的可溶性蛋白质。在一些实施方案中,OX40激动剂可连接至另一蛋白质域,例如为了提高其有效性,半衰期,或其它期望特征。在一些实施方案中,OX40激动剂可包括连接至免疫球蛋白Fc域的一个或多个OX40L胞外域。
在一些实施方案中,OX40激动剂可以是美国专利No.7,696,175中描述的任一OX40激动剂。
在一些实施方案中,OX40激动剂可以是寡聚或多聚分子。例如,OX40激动剂可含有一个或多个容许蛋白质寡聚化的域(例如亮氨酸拉链域)。在一些实施方案中,OX40激动剂可包括连接至一个或多个亮氨酸拉链域的一个或多个OX40L胞外域。
在一些实施方案中,OX40激动剂可以是欧洲专利No.EP0672141B1中描述的任一OX40激动剂。
在一些实施方案中,OX40激动剂可以是三聚OX40L融合蛋白。例如,OX40激动剂可包括连接至免疫球蛋白Fc域和三聚化域(包括但不限于异亮氨酸拉链域)的一个或多个OX40L胞外域。
在一些实施方案中,OX40激动剂可以是国际公开文本No.WO2006/121810中描述的任一OX40激动剂,诸如OX40免疫粘附素。在一些实施方案中,该OX40免疫粘附素可以是三聚OX40-Fc蛋白。在一些实施方案中,该OX40激动剂是MEDI6383。
在本发明的又一方面,依照任何上述实施方案的抗OX40抗体是单克隆抗体,包括嵌合抗体,人源化抗体或人抗体。在一个实施方案中,抗OX40抗体是抗体片段,例如Fv,Fab,Fab’,scFv,双抗体,或F(ab’)2片段。在另一个实施方案中,该抗体是全长抗体,例如完整IgG1或其它抗体类或同种型,如本文中定义的。在一些实施方案中,该抗体是全长完整IgG4抗体。
IV.抗体制备
依照任何上述实施方案的抗血管发生抗体(例如抗VEGF抗体)和/或抗OX40抗体可单一地或组合地并入下文1-7节中描述的任何特征:
1.抗体亲和力
在某些实施方案中,本文中提供的抗体具有≤1μM,≤100nM,≤10nM,≤1nM,≤0.1nM,≤0.01nM,或≤0.001nM的解离常数(Kd)(例如10-8M或更少,例如10-8M至10-13M,例如,10-9M至10-13M)。
在一个实施方案中,Kd是通过放射性标记抗原结合测定法(RIA)来测量的。在一个实施方案中,用Fab型式的感兴趣抗体及其抗原实施RIA。例如,通过在存在未标记抗原的滴定系列的情况中用最小浓度的(125I)标记抗原平衡Fab,然后用抗Fab抗体包被板捕捉结合的抗原来测量Fab对抗原的溶液结合亲和力(见例如Chen等,J.Mol.Biol.293:865-881(1999))。为了建立测定法的条件,将多孔板(Thermo Scientific)用50 mM碳酸钠(pH 9.6)中的5μg/ml捕捉用抗Fab抗体(Cappel Labs)包被过夜,随后用PBS中的2%(w/v)牛血清清蛋白于室温(约23℃)封闭2-5小时。在非吸附板(Nunc#269620)中,将100 pM或26 pM[125I]-抗原与连续稀释的感兴趣Fab(例如与Presta等,Cancer Res.57:4593-4599(1997)中抗VEGF抗体,Fab-12的评估一致)混合。然后将感兴趣的Fab温育过夜;然而,温育可持续更长时间(例如约65小时)以确保达到平衡。此后,将混合物转移至捕捉板,于室温温育(例如1小时)。然后除去溶液,并用PBS中的0.1%聚山梨酯20(TWEEN-)洗板8次。平板干燥后,加入150μl/孔闪烁液(MICROSCINT-20TM;Packard),然后在TOPCOUNTTM伽马计数器(Packard)上对平板计数10分钟。选择各Fab给出小于或等于最大结合之20%的浓度用于竞争性结合测定法。
依照另一个实施方案,Kd是使用表面等离振子共振测定法测量的。例如,于25℃使用固定化抗原CM5芯片在约10个响应单位(RU)使用-2000或-3000(BIAcore,Inc.,Piscataway,NJ)实施测定法。在一个实施方案中,依照供应商的用法说明书用盐酸N-乙基-N’-(3-二甲氨基丙基)-碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)活化羧甲基化右旋糖苷生物传感器芯片(CM5,BIACORE,Inc.)。将抗原用10mM乙酸钠pH 4.8稀释至5μg/ml(约0.2μM),然后以5μl/分钟的流速注射以获得约10个响应单位(RU)的偶联蛋白质。注入抗原后,注入1M乙醇胺以封闭未反应基团。为了进行动力学测量,于25℃以约25μl/分钟的流速注入在含0.05%聚山梨酯20(TWEEN-20TM)表面活性剂的PBS(PBST)中两倍连续稀释的Fab(0.78nM至500nM)。使用简单一对一朗格缪尔(Langmuir)结合模型(Evaluation Software version 3.2)通过同时拟合结合和解离传感图计算结合速率(kon)和解离速率(koff)。平衡解离常数(Kd)以比率koff/kon计算。见例如Chen等,J.Mol.Biol.293:865-881(1999)。如果根据上文表面等离振子共振测定法,结合速率超过106M-1S-1,那么结合速率可使用荧光淬灭技术来测定,即根据分光计诸如配备了断流装置的分光光度计(Aviv Instruments)或8000系列SLM-AMINCOTM分光光度计(ThermoSpectronic)中用搅拌比色杯的测量,在存在浓度渐增的抗原的情况中,测量PBS pH 7.2中20nM抗抗原抗体(Fab形式)于25℃的荧光发射强度(激发=295nm;发射=340nm,16nm带通)的升高或降低。
2.抗体片段
在某些实施方案中,本文中提供的抗体是抗体片段。抗体片段包括但不限于Fab,Fab’,Fab’-SH,F(ab’)2,Fv,和scFv片段,及下文所描述的其它片段。关于某些抗体片段的综述,见Hudson等,Nat.Med.9:129-134(2003)。关于scFv片段的综述,见例如Pluckthün,于The Pharmacology of Monoclonal Antibodies,第113卷,Rosenburg和Moore编,(Springer-Verlag,New York),第269-315页(1994);还可见WO 93/16185;及美国专利No.5,571,894和5,587,458。关于包含补救受体结合表位残基,并且具有延长的体内半衰期的Fab和F(ab’)2片段的讨论,见美国专利No.5,869,046。
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价的或双特异性的。见例如EP 404,097;WO 1993/01161;Hudson等,Nat.Med.9:129-134(2003);及Hollinger等,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993)。三抗体和四抗体也记载于Hudson等,Nat.Med.9:129-134(2003)。
单域抗体是包含抗体的整个或部分重链可变域或整个或部分轻链可变域的抗体片段。在某些实施方案中,单域抗体是人单域抗体(Domantis,Inc.,Waltham,MA;见例如美国专利No.6,248,516B1)。
可以通过多种技术,包括但不限于对完整抗体的蛋白水解消化及重组宿主细胞(例如大肠杆菌或噬菌体)的生成来生成抗体片段,如本文中所描述的。
3.嵌合抗体和人源化抗体
在某些实施方案中,本文中提供的抗体是嵌合抗体。某些嵌合抗体记载于例如美国专利No.4,816,567;及Morrison等,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))。在一个例子中,嵌合抗体包含非人可变区(例如,自小鼠,大鼠,仓鼠,家兔,或非人灵长类,诸如猴衍生的可变区)和人恒定区。在又一个例子中,嵌合抗体是“类转换的”抗体,其中类或亚类已经自亲本抗体的类或亚类改变。嵌合抗体包括其抗原结合片段。
在某些实施方案中,嵌合抗体是人源化抗体。通常,将非人抗体人源化以降低对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。一般地,人源化抗体包含一个或多个可变域,其中HVR,例如CDR(或其部分)自非人抗体衍生,而FR(或其部分)自人抗体序列衍生。任选地,人源化抗体还会至少包含人恒定区的一部分。在一些实施方案中,将人源化抗体中的一些FR残基用来自非人抗体(例如衍生HVR残基的抗体)的相应残基替代,例如以恢复或改善抗体特异性或亲和力。
人源化抗体及其生成方法综述于例如Almagro和Fransson,Front.Biosci.13:1619-1633(2008),并且进一步记载于例如Riechmann等,Nature 332:323-329(1988);Queen等,Proc.Nat’l Acad.Sci.USA 86:10029-10033(1989);美国专利No.5,821,337,7,527,791,6,982,321和7,087,409;Kashmiri等,Methods 36:25-34(2005)(描述了特异性决定区(SDR)嫁接);Padlan,Mol.Immunol.28:489-498(1991)(描述了“重修表面”);Dall’Acqua等,Methods 36:43-60(2005)(描述了“FR改组”);及Osbourn等,Methods 36:61-68(2005)和Klimka等,Br.J.Cancer,83:252-260(2000)(描述了FR改组的“引导选择”方法)。
可以用于人源化的人框架区包括但不限于:使用“最佳拟合(best-fit)”方法选择的框架区(见例如Sims等,J.Immunol.151:2296(1993));自轻或重链可变区的特定亚组的人抗体的共有序列衍生的框架区(见例如Carter等,Proc.Natl.Acad.Sci.USA,89:4285(1992);及Presta等,J.Immunol.,151:2623(1993));人成熟的(体细胞突变的)框架区或人种系框架区(见例如Almagro和Fransson,Front.Biosci.13:1619-1633(2008));和通过筛选FR文库衍生的框架区(见例如Baca等,J.Biol.Chem.272:10678-10684(1997)及Rosok等,J.Biol.Chem.271:22611-22618(1996))。
4.人抗体
在某些实施方案中,本文中提供的抗体是人抗体。可以使用本领域中已知的多种技术来生成人抗体。一般地,人抗体记载于van Dijk和van de Winkel,Curr.Opin.Pharmacol.5:368-74(2001)及Lonberg,Curr.Opin.Immunol.20:450-459(2008)。
可以通过对转基因动物施用免疫原来制备人抗体,所述转基因动物已经修饰为响应抗原性攻击而生成完整人抗体或具有人可变区的完整抗体。此类动物通常含有所有或部分人免疫球蛋白基因座,其替换内源免疫球蛋白基因座,或者其在染色体外存在或随机整合入动物的染色体中。在此类转基因小鼠中,一般已经将内源免疫球蛋白基因座灭活。关于自转基因动物获得人抗体的方法的综述,见Lonberg,Nat.Biotech.23:1117-1125(2005)。还可见例如美国专利No.6,075,181和6,150,584,其描述了XENOMOUSETM技术;美国专利No.5,770,429,其描述了技术;美国专利No.7,041,870,其描述了K-M技术,和美国专利申请公开文本No.US 2007/0061900,其描述了技术)。可以例如通过与不同人恒定区组合进一步修饰来自由此类动物生成的完整抗体的人可变区。
也可以通过基于杂交瘤的方法生成人抗体。已经描述了用于生成人单克隆抗体的人骨髓瘤和小鼠-人异骨髓瘤细胞系(见例如Kozbor J.Immunol.,133:3001(1984);Brodeur等,Monoclonal Antibody Production Techniques and Applications,第51-63页(Marcel Dekker,Inc.,New York,1987);及Boerner等,J.Immunol.,147:86(1991))。经由人B细胞杂交瘤技术生成的人抗体也记载于Li等,Proc.Natl.Acad.Sci.USA,103:3557-3562(2006)。其它方法包括那些例如记载于美国专利No.7,189,826(其描述了自杂交瘤细胞系生成单克隆人IgM抗体)和Ni,Xiandai Mianyixue,26(4):265-268(2006)(其描述了人-人杂交瘤)的。人杂交瘤技术(Trioma技术)也记载于Vollmers和Brandlein,Histology and Histopathology,20(3):927-937(2005)及Vollmers和Brandlein,Methods and Findings in Experimental and Clinical Pharmacology,27(3):185-91(2005)。
也可以通过分离自人衍生的噬菌体展示文库选择的Fv克隆可变域序列生成人抗体。然后,可以将此类可变域序列与期望的人恒定域组合。下文描述了自抗体文库选择人抗体的技术。
5.文库衍生的抗体
可以通过对组合文库筛选具有期望的一种或多种活性的抗体来分离本发明的抗体。例如,用于生成噬菌体展示文库并对此类文库筛选拥有期望结合特征的抗体的多种方法是本领域中已知的。此类方法综述于例如Hoogenboom等,于Methods in Molecular Biology 178:1-37(O’Brien等编,Human Press,Totowa,NJ,2001),并且进一步记载于例如McCafferty等,Nature 348:552-554;Clackson等,Nature 352:624-628(1991);Marks等,J.Mol.Biol.222:581-597(1992);Marks和Bradbury,于Methods in Molecular Biology 248:161-175(Lo编,Human Press,Totowa,NJ,2003);Sidhu等,J.Mol.Biol.338(2):299-310(2004);Lee等,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Natl.Acad.Sci.USA 101(34):12467-12472(2004);及Lee等,J.Immunol.Methods 284(1-2):119-132(2004)。
在某些噬菌体展示方法中,将VH和VL基因的全集分别通过聚合酶链式反应(PCR)克隆,并在噬菌体文库中随机重组,然后可以对所述噬菌体文库筛选抗原结合噬菌体,如记载于Winter等,Ann.Rev.Immunol.,12:433-455(1994)的。噬菌体通常以单链Fv(scFv)片段或以Fab片段展示抗体片段。来自经免疫的来源的文库提供针对免疫原的高亲和力抗体,而不需要构建杂交瘤。或者,可以(例如自人)克隆天然全集以在没有任何免疫的情况中提供针对一大批非自身和还有自身抗原的抗体的单一来源,如由Griffiths等,EMBO J,12:725-734(1993)描述的。最后,也可以通过自干细胞克隆未重排的V基因区段,并使用含有随机序列的PCR引物编码高度可变的CDR3区并在体外实现重排来合成生成未免疫文库,如由Hoogenboom和Winter,J.Mol.Biol.,227:381-388(1992)所描述的。描述人抗体噬菌体文库的专利公开文本包括例如:美国专利No.5,750,373,和美国专利公开文本No.2005/0079574,2005/0119455,2005/0266000,2007/0117126,2007/0160598,2007/0237764,2007/0292936和2009/0002360。
认为自人抗体文库分离的抗体或抗体片段是本文中的人抗体或人抗体片段。
6.多特异性抗体
在某些实施方案中,本文中提供的抗体是多特异性抗体,例如双特异性抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。在某些实施方案中,结合特异性之一针对OX40,而另一种针对任何其它抗原。在某些实施方案中,双特异性抗体可以结合OX40的两个不同表位。也可以使用双特异性抗体来将细胞毒剂定位于表达OX40的细胞。双特异性抗体可以以全长抗体或抗体片段制备。
用于生成多特异性抗体的技术包括但不限于具有不同特异性的两对免疫球蛋白重链-轻链对的重组共表达(见Milstein和Cuello,Nature 305:537(1983)),WO 93/08829,和Traunecker等,EMBO J.10:3655(1991)),和“节-入-穴”工程化(见例如美国专利No.5,731,168)。也可以通过用于生成抗体Fc-异二聚体分子的工程化静电操纵效应(WO 2009/089004A1);交联两个或更多个抗体或片段(见例如美国专利No.4,676,980,及Brennan等,Science,229:81(1985));使用亮氨酸拉链来生成双特异性抗体(见例如Kostelny等,J.Immunol.,148(5):1547-1553(1992));使用用于生成双特异性抗体片段的“双抗体”技术(见例如Hollinger等,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993));及使用单链Fv(sFv)二聚体(见例如Gruber等,J.Immunol.,152:5368(1994));及如例如Tutt等,J.Immunol.147:60(1991)中所描述的,制备三特异性抗体来生成多特异性抗体。
本文中还包括具有三个或更多个功能性抗原结合位点的工程化改造抗体,包括“章鱼抗体”(见例如US 2006/0025576A1)。
本文中的抗体或片段还包括包含结合OX40及另一种不同抗原的抗原结合位点的“双重作用FAb”或“DAF”(见例如US 2008/0069820)。
7.抗体变体
在某些实施方案中,涵盖本文中提供的抗体的氨基酸序列变体。例如,可以期望改善抗体的结合亲和力和/或其它生物学特性。可以通过将合适的修饰引入编码抗体的核苷酸序列中,或者通过肽合成来制备抗体的氨基酸序列变体。此类修饰包括例如对抗体的氨基酸序列内的残基的删除,和/或插入和/或替代。可以进行删除,插入,和替代的任何组合以得到最终的构建体,只要最终的构建体拥有期望的特征,例如,抗原结合。
a)替代,插入,和删除变体
在某些实施方案中,提供了具有一处或多处氨基酸替代的抗体变体。替代诱变感兴趣的位点包括HVR和FR。保守替代在表A中在“优选的替代”的标题下显示。更实质的变化在表A中在“例示性替代”的标题下提供,并且如下文参照氨基酸侧链类别进一步描述的。可以将氨基酸替代引入感兴趣的抗体中,并且对产物筛选期望的活性,例如保留/改善的抗原结合,降低的免疫原性,或改善的ADCC或CDC。
表A
依照共同的侧链特性,氨基酸可以如下分组:
(1)疏水性的:正亮氨酸,Met,Ala,Val,Leu,Ile;
(2)中性,亲水性的:Cys,Ser,Thr,Asn,Gln;
(3)酸性的:Asp,Glu;
(4)碱性的:His,Lys,Arg;
(5)影响链取向的残基:Gly,Pro;
(6)芳香族的:Trp,Tyr,Phe。
非保守替代会需要用这些类别之一的成员替换另一个类别的。
一类替代变体牵涉替代亲本抗体(例如人源化或人抗体)的一个或多个高变区残基。一般地,为进一步研究选择的所得变体相对于亲本抗体会具有某些生物学特性的改变(例如改善)(例如升高的亲和力,降低的免疫原性)和/或会基本上保留亲本抗体的某些生物学特性。例示性的替代变体是亲和力成熟的抗体,其可以例如使用基于噬菌体展示的亲和力成熟技术诸如本文中所描述的那些技术来方便地生成。简言之,将一个或多个HVR残基突变,并将变体抗体在噬菌体上展示,并对其筛选特定的生物学活性(例如结合亲和力)。
可以对HVR做出变化(例如,替代),例如以改善抗体亲和力。可以对HVR“热点”,即由在体细胞成熟过程期间以高频率经历突变的密码子编码的残基(见例如Chowdhury,Methods Mol.Biol.207:179-196(2008)),和/或接触抗原的残基做出此类变化,其中对所得的变体VH或VL测试结合亲和力。通过次级文库的构建和再选择进行的亲和力成熟已经记载于例如Hoogenboom等,于Methods in Molecular Biology 178:1-37(O’Brien等编,Human Press,Totowa,NJ,(2001))。在亲和力成熟的一些实施方案中,通过多种方法(例如,易错PCR,链改组,或寡核苷酸指导的诱变)将多样性引入为成熟选择的可变基因。然后,创建次级文库。然后,筛选文库以鉴定具有期望的亲和力的任何抗体变体。另一种引入多样性的方法牵涉HVR指导的方法,其中将几个HVR残基(例如,一次4-6个残基)随机化。可以例如使用丙氨酸扫描诱变或建模来特异性鉴定牵涉抗原结合的HVR残基。特别地,经常靶向CDR-H3和CDR-L3。
在某些实施方案中,可以在一个或多个HVR内发生替代,插入,或删除,只要此类变化不实质性降低抗体结合抗原的能力。例如,可以对HVR做出保守变化(例如,保守替代,如本文中提供的),其不实质性降低结合亲和力。例如,此类变化可以在HVR中的抗原接触残基以外。在上文提供的变体VH和VL序列的某些实施方案中,每个HVR是未改变的,或者含有不超过1,2或3处氨基酸替代。
一种可用于鉴定抗体中可以作为诱变靶位的残基或区域的方法称作“丙氨酸扫描诱变”,如由Cunningham和Wells(1989)Science,244:1081-1085所描述的。在此方法中,将残基或靶残基的组(例如,带电荷的残基诸如arg,asp,his,lys,和glu)鉴定,并用中性或带负电荷的氨基酸(例如,丙氨酸或多丙氨酸)替换以测定抗体与抗原的相互作用是否受到影响。可以在对初始替代表明功能敏感性的氨基酸位置引入进一步的替代。或者/另外,利用抗原-抗体复合物的晶体结构来鉴定抗体与抗原间的接触点。作为替代的候选,可以靶向或消除此类接触残基和邻近残基。可以筛选变体以确定它们是否含有期望的特性。
氨基酸序列插入包括长度范围为1个残基至含有100或更多个残基的多肽的氨基和/或羧基端融合,及单个或多个氨基酸残基的序列内插入。末端插入的例子包括具有N端甲硫氨酰基残基的抗体。抗体分子的其它插入变体包括抗体的N或C端与酶(例如对于ADEPT)或延长抗体的血清半衰期的多肽的融合物。
b)糖基化变体
在某些实施方案中,改变本文中提供的抗体以提高或降低抗体糖基化的程度。可以通过改变氨基酸序列,使得创建或消除一个或多个糖基化位点来方便地实现对抗体的糖基化位点的添加或删除。
在抗体包含Fc区的情况中,可以改变其附着的碳水化合物。由哺乳动物细胞生成的天然抗体通常包含分支的,双触角寡糖,其一般通过N连接附着于Fc区的CH2域的Asn297。见例如Wright等,TIBTECH 15:26-32(1997)。寡糖可以包括各种碳水化合物,例如,甘露糖,N-乙酰葡糖胺(GlcNAc),半乳糖,和唾液酸,以及附着于双触角寡糖结构“主干”中的GlcNAc的岩藻糖。在一些实施方案中,可以对本发明抗体中的寡糖进行修饰以创建具有某些改善的特性的抗体变体。
在一个实施方案中,提供了抗体变体,其具有缺乏附着(直接或间接)于Fc区的岩藻糖的碳水化合物结构。例如,此类抗体中的岩藻糖量可以是1%至80%,1%至65%,5%至65%或20%至40%。通过相对于附着于Asn297的所有糖结构(例如,复合的,杂合的和高甘露糖的结构)的总和,计算Asn297处糖链内岩藻糖的平均量来测定岩藻糖量,如通过MALDI-TOF质谱术测量的,例如如记载于WO 2008/077546的。Asn297指位于Fc区中的约第297位(Fc区残基的Eu编号方式)的天冬酰胺残基;然而,Asn297也可以由于抗体中的微小序列变异而位于第297位上游或下游约±3个氨基酸,即在第294位和第300位之间。此类岩藻糖基化变体可以具有改善的ADCC功能。见例如美国专利公开文本No.US 2003/0157108(Presta,L.);US 2004/0093621(Kyowa Hakko Kogyo Co.,Ltd)。涉及“脱岩藻糖基化的”或“岩藻糖缺乏的”抗体变体的出版物的例子包括:US 2003/0157108;WO 2000/61739;WO 2001/29246;US 2003/0115614;US 2002/0164328;US 2004/0093621;US 2004/0132140;US 2004/0110704;US 2004/0110282;US 2004/0109865;WO 2003/085119;WO 2003/084570;WO 2005/035586;WO 2005/035778;WO2005/053742;WO2002/031140;Okazaki等,J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等,Biotech.Bioeng.87:614(2004)。能够生成脱岩藻糖基化抗体的细胞系的例子包括蛋白质岩藻糖基化缺陷的Lec13CHO细胞(Ripka等,Arch.Biochem.Biophys.249:533-545(1986);美国专利申请No US 2003/0157108 A1,Presta,L;及WO 2004/056312 A1,Adams等,尤其在实施例11),和敲除细胞系,诸如α-1,6-岩藻糖基转移酶基因FUT8敲除CHO细胞(见例如Yamane-Ohnuki等,Biotech.Bioeng.87:614(2004);Kanda,Y.等,Biotechnol.Bioeng.,94(4):680-688(2006);及WO2003/085107)。
进一步提供了具有两分型寡糖的抗体变体,例如其中附着于抗体Fc区的双触角寡糖是通过GlcNAc两分的。此类抗体变体可以具有降低的岩藻糖基化和/或改善的ADCC功能。此类抗体变体的例子记载于例如WO 2003/011878(Jean-Mairet等);美国专利No.6,602,684(Umana等);及US 2005/0123546(Umana等)。还提供了在附着于Fc区的寡糖中具有至少一个半乳糖残基的抗体变体。此类抗体变体可以具有改善的CDC功能。此类抗体变体记载于例如WO 1997/30087(Patel等);WO 1998/58964(Raju,S.);及WO 1999/22764(Raju,S.)。
c)Fc区变体
在某些实施方案中,可以将一处或多处氨基酸修饰引入本文中提供的抗体的Fc区中,由此生成Fc区变体。Fc区变体可以包含在一个或多个氨基酸位置包含氨基酸修饰(例如替代)的人Fc区序列(例如,人IgG1,IgG2,IgG3或IgG4 Fc区)。
在某些实施方案中,本发明涵盖拥有一些但不是所有效应器功能的抗体变体,所述效应器功能使其成为如下应用的期望候选物,其中抗体的体内半衰期是重要的,而某些效应器功能(诸如补体和ADCC)是不必要的或有害的。可以进行体外和/或体内细胞毒性测定法以确认CDC和/或ADCC活性的降低/消减。例如,可以进行Fc受体(FcR)结合测定法以确保抗体缺乏FcγR结合(因此有可能缺乏ADCC活性),但是保留FcRn结合能力。介导ADCC的主要细胞NK细胞仅表达FcγRIII,而单核细胞表达FcγRI,FcγRII和FcγRIII。在Ravetch和Kinet,Annu.Rev.Immunol.9:457-492(1991)的第464页上的表3中汇总了造血细胞上的FcR表达。评估感兴趣分子的ADCC活性的体外测定法的非限制性例子记载于美国专利No.5,500,362(见例如Hellstrom,I.等,Proc.Nat’l Acad.Sci.USA 83:7059-7063(1986))和Hellstrom,I等,Proc.Nat’l Acad.Sci.USA 82:1499-1502(1985);5,821,337(见Bruggemann,M.等,J.Exp.Med.166:1351-1361(1987))。或者,可以采用非放射性测定方法(见例如用于流式细胞术的ACTITM非放射性细胞毒性测定法(CellTechnology,Inc.Mountain View,CA;和CytoTox非放射性细胞毒性测定法(Promega,Madison,WI))。对于此类测定法有用的效应细胞包括外周血单个核细胞(PBMC)和天然杀伤(NK)细胞。或者/另外,可以在体内评估感兴趣分子的ADCC活性,例如在动物模型中,诸如披露于Clynes等,Proc.Nat’l Acad.Sci.USA 95:652-656(1998)的。也可以实施C1q结合测定法以确认抗体不能结合C1q,并且因此缺乏CDC活性。见例如WO 2006/029879和WO 2005/100402中的C1q和C3c结合ELISA。为了评估补体激活,可以实施CDC测定法(见例如Gazzano-Santoro等,J.Immunol.Methods 202:163(1996);Cragg,M.S.等,Blood 101:1045-1052(2003);及Cragg,M.S.和M.J.Glennie,Blood 103:2738-2743(2004))。也可以使用本领域中已知的方法来实施FcRn结合和体内清除/半衰期测定(见例如Petkova,S.B.等,Int’l.Immunol.18(12):1759-1769(2006))。
具有降低的效应器功能的抗体包括那些具有Fc区残基238,265,269,270,297,327和329中的一个或多个的替代的(美国专利No.6,737,056)。此类Fc突变体包括在氨基酸位置265,269,270,297和327中的两处或更多处具有替代的Fc突变体,包括残基265和297替代成丙氨酸的所谓的“DANA”Fc突变体(美国专利No.7,332,581)。
描述了具有改善的或降低的对FcR的结合的某些抗体变体(见例如美国专利No.6,737,056;WO 2004/056312,及Shields等,J.Biol.Chem.9(2):6591-6604(2001))。
在某些实施方案中,抗体变体包含具有改善ADCC的一处或多处氨基酸替代,例如Fc区的位置298,333,和/或334(残基的EU编号方式)的替代的Fc区。
在一些实施方案中,对Fc区做出改变,其导致改变的(即,改善的或降低的)C1q结合和/或补体依赖性细胞毒性(CDC),例如,如记载于美国专利No.6,194,551,WO 99/51642,及Idusogie等,J.Immunol.164:4178-4184(2000)的。
具有延长的半衰期和改善的对新生儿Fc受体(FcRn)的结合的抗体记载于US2005/0014934A1(Hinton等),新生儿Fc受体(FcRn)负责将母体IgG转移至胎儿(Guyer等,J.Immunol.117:587(1976)及Kim等,J.Immunol.24:249(1994))。那些抗体包含其中具有改善Fc区对FcRn结合的一处或多处替代的Fc区。此类Fc变体包括那些在Fc区残基238,256,265,272,286,303,305,307,311,312,317,340,356,360,362,376,378,380,382,413,424或434中的一处或多处具有替代,例如,Fc区残基434的替代的(美国专利No.7,371,826)。
还可见Duncan和Winter,Nature 322:738-40(1988);美国专利No.5,648,260;美国专利No.5,624,821;及WO 94/29351,其关注Fc区变体的其它例子。
d)经半胱氨酸工程化改造的抗体变体
在某些实施方案中,可以期望创建经半胱氨酸工程化改造的抗体,例如,“thioMAb”,其中抗体的一个或多个残基用半胱氨酸残基替代。在具体的实施方案中,替代的残基存在于抗体的可接近位点。通过用半胱氨酸替代那些残基,反应性硫醇基团由此定位于抗体的可接近位点,并且可以用于将抗体与其它模块,诸如药物模块或接头-药物模块缀合,以创建免疫缀合物,如本文中进一步描述的。在某些实施方案中,可以用半胱氨酸替代下列残基之任一个或多个:轻链的V205(Kabat编号方式);重链的A118(EU编号方式);和重链Fc区的S400(EU编号方式)。可以如例如美国专利No.7,521,541所述生成经半胱氨酸工程化改造的抗体。
e)抗体衍生物
在某些实施方案中,可以进一步修饰本文中提供的抗体以含有本领域知道的且易于获得的额外非蛋白质性质模块。适合于抗体衍生化的模块包括但不限于水溶性聚合物。水溶性聚合物的非限制性例子包括但不限于聚乙二醇(PEG),乙二醇/丙二醇共聚物,羧甲基纤维素,右旋糖苷,聚乙烯醇,聚乙烯吡咯烷酮,聚-1,3-二氧戊环,聚-1,3,6-三烷,乙烯/马来酸酐共聚物,聚氨基酸(均聚物或随机共聚物),和右旋糖苷或聚(n-乙烯吡咯烷酮)聚乙二醇,丙二醇均聚物,环氧丙烷/环氧乙烷共聚物,聚氧乙烯化多元醇(例如甘油),聚乙烯醇及其混合物。由于其在水中的稳定性,聚乙二醇丙醛在生产中可能具有优势。聚合物可以是任何分子量,而且可以是分支的或不分支的。附着到抗体上的聚合物数目可以变化,而且如果附着了超过一个聚合物,那么它们可以是相同或不同的分子。一般而言,可根据下列考虑来确定用于衍生化的聚合物的数目和/或类型,包括但不限于抗体要改进的具体特性或功能,抗体衍生物是否将用于指定条件下的治疗等。
在另一个实施方案中,提供了抗体和可以通过暴露于辐射选择性加热的非蛋白质性质模块的缀合物。在一个实施方案中,非蛋白质性质模块是碳纳米管(Kam等,Proc.Natl.Acad.Sci.USA 102:11600-11605(2005))。辐射可以是任何波长的,并且包括但不限于对普通细胞没有损害,但是将非蛋白质性质模块加热至抗体-非蛋白质性质模块附近的细胞被杀死的温度的波长。
A.重组方法和组合物
可以使用重组方法和组合物来生成抗体,例如,如记载于美国专利No.4,816,567的。在一个实施方案中,提供了编码本文中所描述的抗OX40抗体的分离的核酸。此类核酸可以编码包含抗体VL的氨基酸序列和/或包含抗体VH的氨基酸序列(例如,抗体的轻和/或重链)。在又一个实施方案中,提供了包含此类核酸的一种或多种载体(例如,表达载体)。在又一个实施方案中,提供了包含此类核酸的宿主细胞。在一个此类实施方案中,宿主细胞包含(例如,已经用下列载体转化):(1)包含核酸的载体,所述核酸编码包含抗体的VL的氨基酸序列和包含抗体的VH的氨基酸序列,或(2)第一载体和第二载体,所述第一载体包含编码包含抗体的VL的氨基酸序列的核酸,所述第二载体包含编码包含抗体的VH的氨基酸序列的核酸。在一个实施方案中,宿主细胞是真核的,例如中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0,NS0,Sp20细胞)。在一个实施方案中,提供了生成抗OX40抗体的方法,其中该方法包括在适合于表达抗体的条件下培养包含编码抗体的核酸的宿主细胞,如上文提供的,并且任选地,自宿主细胞(或宿主细胞培养液)回收抗体。
对于抗OX40抗体的重组生成,将编码抗体的核酸(例如如上文所描述的)分离,并插入一种或多种载体中,以在宿主细胞中进一步克隆和/或表达。可以使用常规规程将此类核酸容易地分离并测序(例如,通过使用寡核苷酸探针来进行,所述寡核苷酸探针能够特异性结合编码抗体的重和轻链的基因)。
适合于克隆或表达抗体编码载体的宿主细胞包括本文中所描述的原核或真核细胞。例如,可以在细菌中生成抗体,特别是在不需要糖基化和Fc效应器功能时。对于抗体片段和多肽在细菌中的表达,见例如美国专利No.5,648,237,5,789,199和5,840,523(还可见Charlton,Methods in Molecular Biology,第248卷(B.K.C.Lo编,Humana Press,Totowa,NJ,2003),第245-254页,其描述了抗体片段在大肠杆菌(E.coli.)中的表达)。表达后,可以将抗体在可溶性级分中自细菌细胞团糊分离,并可以进一步纯化。
在原核生物外,真核微生物诸如丝状真菌或酵母是适合于抗体编码载体的克隆或表达宿主,包括其糖基化途径已经“人源化”,导致生成具有部分或完全人的糖基化样式的抗体的真菌和酵母菌株。见Gerngross,Nat.Biotech.22:1409-1414(2004),及Li等,Nat.Biotech.24:210-215(2006)。
适合于表达糖基化抗体的宿主细胞也自多细胞生物体(无脊椎动物和脊椎动物)衍生。无脊椎动物细胞的例子包括植物和昆虫细胞。已经鉴定出许多杆状病毒株,其可以与昆虫细胞一起使用,特别是用于转染草地夜蛾(Spodoptera frugiperda)细胞。
也可以利用植物细胞培养物作为宿主。见例如美国专利No.5,959,177,6,040,498,6,420,548,7,125,978和6,417,429(其描述了用于在转基因植物中生成抗体的PLANTIBODIESTM技术)。
也可以使用脊椎动物细胞作为宿主。例如,适合于在悬浮液中生长的哺乳动物细胞系可以是有用的。有用的哺乳动物宿主细胞系的其它例子是经SV40转化的猴肾CV1系(COS-7);人胚肾系(293或293细胞,如记载于例如Graham等,J.Gen Virol.36:59(1977)的);幼年仓鼠肾细胞(BHK);小鼠塞托利(sertoli)细胞(TM4细胞,如记载于例如Mather,Biol.Reprod.23:243-251(1980)的);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK;牛鼠(buffalo rat)肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳房肿瘤(MMT 060562);TRI细胞,如记载于例如Mather等,Annals N.Y.Acad.Sci.383:44-68(1982)的;MRC 5细胞;和FS4细胞。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub等,Proc.Natl.Acad.Sci.USA 77:4216(1980));和骨髓瘤细胞系诸如Y0,NS0和Sp2/0。关于适合于抗体生成的某些哺乳动物宿主细胞系的综述,见例如Yazaki和Wu,Methods in Molecular Biology,第248卷(B.K.C.Lo编,Humana Press,Totowa,NJ),第255-268页(2003)。
B.测定法
可以通过本领域中已知的多种测定法对本文中提供的抗OX40抗体鉴定,筛选,或表征其物理/化学特性和/或生物学活性。
1.结合测定法和其它测定法
一方面,对本发明的抗体测试其抗原结合活性,例如通过已知的方法诸如ELISA,Western印迹,等来进行。可使用本领域已知方法来测定OX40结合,本文中公开了例示性方法。在一个实施方案中,使用放射免疫测定法测量结合。实施例中例示了一种例示性放射免疫测定法。将OX40抗体碘化,并制备含有固定浓度的碘化抗体和递减浓度的连续稀释的未标记OX40抗体的竞争反应混合物。将表达OX40的细胞(例如经人OX40稳定转染的BT474细胞)添加至反应混合物。温育后,清洗细胞将游离的碘化OX40抗体与结合至细胞的OX40抗体分开。测定结合的碘化OX40抗体的水平,例如通过对与细胞联合的放射性计数来进行,并使用标准方法测定结合亲和力。在另一个实施方案中,使用流式细胞术评估OX40抗体结合表面表达的OX40(例如在T细胞子集上)的能力。获得外周白血球(例如来自人,食蟹猴,大鼠或小鼠),并用血清封闭细胞。以连续稀释液添加经标记的OX40抗体,还对T细胞染色以鉴定T细胞子集(使用本领域已知方法)。样品温育和清洗后,使用流式细胞仪分选细胞,并使用本领域公知方法分析数据。在另一个实施方案中,可使用表面等离振子共振来分析OX40结合。实施例中例示了一种例示性表面等离振子共振方法。
另一方面,可使用竞争测定法来鉴定与本文中公开的任何抗OX40抗体竞争对OX40的结合的抗体或鉴定与本文中公开的任何抗VEGF抗体竞争对VEGF的结合的抗体。在某些实施方案中,此类竞争性抗体结合与本文中公开的任何抗OX40抗体所结合表位相同的表位(例如线性或构象表位)。在某些实施方案中,此类竞争性抗体结合与本文中公开的任何抗VEGF抗体所结合表位相同的表位(例如线性或构象表位或A4.6.1表位)。用于定位抗体所结合表位的详细例示性方法见Morris(1996)“Epitope Mapping Protocols”,Methods in Molecular Biology vol.66(Humana Press,Totowa,NJ)。实施例中例示了一种竞争测定法。
在一种例示性竞争测定法中,在包含第一经标记抗体(其分别结合OX或VEGF,例如OX40的mab 1A7.gr.1或mab 3C8.gr5或VEGF的A4.6.1)和第二未标记抗体(其分别要测试与第一抗体竞争对OX40或VEGF的结合的能力)的溶液中温育固定化OX40或VEGF。第二抗体可存在于杂交瘤上清液中。作为对照,在包含第一经标记抗体但不包含第二未标记抗体的溶液中温育固定化OX40或VEGF。在允许第一抗体结合OX40或VEGF的条件下温育后,除去过量的未结合抗体,并测量与固定化OX40或VEGF联合的标记物的量。如果测试样品中与固定化OX40或VEGF联合的标记物的量与对照样品相比实质性降低,那么这指示第二抗体与第一抗体竞争对OX40或VEGF的结合。参见Harlow and Lane(1988)Antibodies:A Laboratory Manual ch.14(Cold Spring Harbor Laboratory,Cold Spring Harbor,NY)。
2.活性测定法
一方面,提供用于鉴定具有生物学活性的抗OX40抗体的测定法。生物学活性可以包括例如结合OX40(例如结合人和/或食蟹猴OX40),提高OX40介导的信号转导(例如提高NFkB介导的转录),消减表达人OX40的细胞(例如T细胞),通过ADCC和/或吞噬消减表达人OX40的细胞,增强T效应细胞功能(例如CD4+效应T细胞)(例如通过提高效应T细胞增殖和/或提高效应T细胞的细胞因子生成(例如γ干扰素)),增强记忆T细胞功能(例如CD4+记忆T细胞)(例如通过提高记忆T细胞增殖和/或提高记忆T细胞的细胞因子生成(例如γ干扰素)),抑制调节T细胞功能(例如通过降低效应T细胞功能(例如CD4+效应T细胞功能))的Treg遏制),结合人效应细胞。还提供在体内和/或在体外具有此类生物学活性的抗体。
在某些实施方案中,对本发明的抗体测试此类生物学活性。
可以使用本领域已知的方法来测定T细胞共刺激,而且本文中公开了例示性方法。例如,可以自外周白血球获得T细胞(例如记忆或效应T细胞)(例如使用Ficoll梯度离心自人全血分离)。可以使用本领域已知的方法自PBMC分离记忆T细胞(例如CD4+记忆T细胞)或效应T细胞(例如CD4+ Teff细胞)。例如,可以使用Miltenyi CD4+记忆T细胞分离试剂盒或Miltenyi幼稚CD4+ T细胞分离试剂盒。在抗原呈递细胞(例如经过照射的表达CD32和CD80的L细胞)存在下培养分离的T细胞,并通过在OX40激动性抗体存在或缺失下添加抗CD3抗体来活化。可以使用本领域公知的方法来测量激动性OX40抗体对T细胞增殖的影响。例如,可以使用CellTiter Glo试剂盒(Promega),并在多标记物读数仪(Perkin Elmer)上读取结果。还可以通过分析由T细胞生成的细胞因子来测定激动性OX40抗体对T细胞功能的影响。在一个实施方案中,测定CD4+ T细胞的干扰素γ生成,例如通过测量细胞培养物上清液中的干扰素γ。用于测量干扰素γ的方法是本领域公知的。
可以使用本领域已知的方法来测定Treg细胞功能,而且本文中公开了例示性方法。在一个例子中,测定Treg遏制效应T细胞增殖的能力。使用本领域已知的方法自人全血分离T细胞(例如分离记忆T细胞或幼稚T细胞)。标记纯化后的CD4+幼稚T细胞(例如用CFSE),并用不同试剂标记纯化后的Treg细胞。将经过照射的抗原呈递细胞(例如表达CD32和CD80的L细胞)与经过标记的纯化后的幼稚CD4+ T细胞和纯化后的Treg共培养。使用抗CD3抗体活化共培养物,并在激动性OX40抗体存在或缺失下测试。合适时间(例如共培养6天)后,使用FACS分析通过降低的标记物染色(例如降低的CFSE标记物染色)中的染料稀释来跟踪CD4+幼稚T细胞增殖的水平。
可以使用本领域公知的方法来测定OX40信号传导,而且本文中公开了例示性方法。在一个实施方案中,生成表达人OX40和报告基因(包含融合至报告基因(例如β萤光素酶)的NFkB启动子)的转基因细胞。对细胞添加OX40激动性抗体导致NFkB转录升高,这使用针对报告基因的测定法来检测。
可以例如通过使用单核细胞衍生的巨噬细胞或U937细胞(一种具有成熟巨噬细胞的形态和特征的人组织细胞性淋巴瘤细胞系)来测定吞噬作用。在抗OX40激动性抗体存在或缺失下将表达OX40的细胞添加至单核细胞衍生的巨噬细胞或U937细胞。将细胞培养合适时间段后,通过检查针对1)巨噬细胞或U937细胞和2)表达OX40的细胞的标志物双重染色的细胞的百分比,并将此除以显示表达OX40的细胞的标志物(例如GFP)的细胞的总数来测定吞噬百分比。可以通过流式细胞术来进行分析。在另一个实施方案中,可以通过荧光显微术分析来进行分析。
可以例如使用本领域公知的方法测定ADCC。定义部分中描述了例示性方法,而且实施例中公开了例示性测定法。在一些实施方案中,表征在ADCC测定法中用于测试的表达OX40的细胞上的OX40水平。将细胞用可检测标记的抗OX40抗体(例如PE标记的)染色,然后使用流式细胞术测定荧光水平,并以中值荧光强度(MFI)呈现结果。在另一个实施方案中,可以通过CellTiter Glo测定法试剂盒来分析ADCC,而且可以通过化学发光来测定细胞存活力/细胞毒性。
可以使用相应重组Fcγ受体在基于ELISA的配体结合测定法中测量各种抗体对FcγRIA,FcγRIIA,FcγRIIB,和FcγRIIIA的两种同种异型(F158和V158)的结合亲和力。以含有连接至C端Gly/6xHis/谷胱甘肽S-转移酶(GST)多肽标签的受体γ链胞外域的融合蛋白表达纯化后的人Fcγ受体。如下测定抗体对那些人Fcγ受体的结合亲和力。对于低亲和力受体,即FcγRIIA(CD32A),FcγRIIB(CD32B),和FcγRIIIA(CD16)的两种同种异型,F-158和V-158,可以通过用山羊抗人卡帕链的F(ab’)2片段(ICN Biomedical;Irvine,CA)交联(以近似摩尔比1:3抗体:交联用F(ab’)2)作为多聚体测试抗体。将板用抗GST抗体(Genentech)包被,并用牛血清清蛋白(BSA)封闭。用含有0.05%Tween-20的磷酸盐缓冲盐水(PBS)及ELx405TM洗板仪(Biotek Instruments;Winooski,VT)清洗后,以25ng/孔将Fcγ受体添加至板,并于室温温育1小时。清洗板后,作为多聚体复合物添加测试抗体的系列稀释液,并将板于室温温育2小时。清洗板以去除未结合的抗体后,用辣根过氧化物酶(HRP)缀合的山羊抗人F(ab’)2的F(ab’)2片段(Jackson ImmunoResearch Laboratories;West Grove,PA)检测结合至Fcγ受体的抗体,接着添加底物,四甲基联苯胺(TMB)(Kirkegaard and Perry Laboratories;Gaithersburg,MD)。取决于所测试的Fcγ受体,将板于室温温育5-20分钟以容许显色。用1M H3PO4终止反应,并用微量板读数仪(190,Molecular Devices;Sunnyvale,CA)测量450nm处的吸光度。通过将来自一式两份抗体稀释液的均值吸光值针对抗体浓度绘图,生成剂量-响应结合曲线。使用SoftMax Pro(Molecular Devices)用四参数方程拟合结合曲线后确定检测到来自结合Fcγ受体的最大响应50%时的有效抗体浓度的值(EC50)。
为了选择诱导细胞死亡的抗体,可相对于对照评估通过例如碘化丙啶(PI),锥虫蓝或7AAD摄取显示的膜完整性丧失。PI摄取测定法可在补体和免疫效应细胞缺失下实施。在单独的培养基或含有浓度为例如约10μg/ml的适宜单克隆抗体的培养基中温育表达OX40的细胞。将细胞温育某个时段(例如1或3天)。每次处理后,将细胞清洗并等分。在一些实施方案中,将细胞等分到35mm盖有滤网(strainer-capped)的12x 75管中(每管1ml,每个处理组3管)以除去细胞团块。然后向管中加入PI(10μg/ml)。可以使用FACSCANTM流式细胞仪和FACSCONVERTTM CellQuest软件(Becton Dickinson)分析样品。
供任何上述体外测定法使用的细胞包括天然表达OX40或经改造而表达OX40的细胞或细胞系。此类细胞包括天然表达OX40的活化后的T细胞,Treg细胞和活化后的记忆T细胞。此类细胞还包括表达OX40的细胞系和并非正常情况下表达OX40但已经用编码OX40的核酸转染的细胞系。本文中提供的供任何上述体外测定法使用的例示性细胞系包括表达人OX40的转基因BT474细胞(一种人乳腺癌细胞系)。
理解的是,可以使用本发明的免疫缀合物替换或补充抗OX40抗体来进行任何上述测定法。
理解的是,可以使用抗OX40抗体和别的治疗剂来进行任何上述测定法。
用于鉴定抗体抗VEGF抗体的测定法是本领域已知的。例如,抗体亲和力可通过基于表面等离振子共振的测定法(诸如PCT申请公开文本No.WO2005/012359中所记载的BIAcore测定法);酶联免疫吸附测定法(ELISA);和竞争测定法(例如RIA)来测定。在某些实施方案中,本发明的抗VEGF抗体可用作治疗剂,用于靶向和干扰其中牵涉VEGF活性的疾病或疾患。还有,该抗体可进行其它生物学活性测定法,例如为了评估其作为治疗剂的有效性。此类测定法是本领域已知的,而且取决于抗体的靶抗原和预定用途。例子包括HUVEC抑制测定法;肿瘤细胞生长抑制测定法(如例如WO 89/06692中所记载的);抗体依赖性细胞的细胞毒性(ADCC)和补体介导的细胞毒性(CDC)测定法(美国专利No.5,500,362);及激动活性或造血测定法(参见WO 95/27062)。
C.免疫缀合物
本发明还提供了包含与一种或多种细胞毒剂,诸如化疗剂或药物,生长抑制剂,毒素(例如蛋白质毒素,细菌,真菌,植物或动物起源的酶活性毒素,或其片段),或放射性同位素缀合的本文中的抗OX40抗体的免疫缀合物。
在一个实施方案中,免疫缀合物是抗体-药物缀合物(ADC),其中抗体与一种或多种药物缀合,包括但不限于美登木素生物碱(见美国专利No.5,208,020,5,416,064和欧洲专利EP 0 425 235 B1);auristatin诸如单甲基auristatin药物模块DE和DF(MMAE和MMAF)(见美国专利No.5,635,483和5,780,588及7,498,298);多拉司他汀(dolastatin);加利车霉素(calicheamicin)或其衍生物(见美国专利No.5,712,374,5,714,586,5,739,116,5,767,285,5,770,701,5,770,710,5,773,001和5,877,296;Hinman等,Cancer Res.53:3336-3342(1993);及Lode等,Cancer Res.58:2925-2928(1998));蒽环类抗生素诸如道诺霉素(daunomycin)或多柔比星(doxorubicin)(见Kratz等,Current Med.Chem.13:477-523(2006);Jeffrey等,Bioorganic&Med.Chem.Letters 16:358-362(2006);Torgov等,Bioconj.Chem.16:717-721(2005);Nagy等,Proc.Natl.Acad.Sci.USA 97:829-834(2000);Dubowchik等,Bioorg.&Med.Chem.Letters 12:1529-1532(2002);King等,J.Med.Chem.45:4336-4343(2002);及美国专利No.6,630,579);甲氨蝶呤;长春地辛(vindesine);紫杉烷(taxane)诸如多西他赛(docetaxel),帕利他赛,larotaxel,tesetaxel,和ortataxel;单端孢霉素(trichothecene);和CC1065。
在另一个实施方案中,免疫缀合物包含与酶活性毒素或其片段缀合的如本文中所描述的抗体,所述酶活性毒素包括但不限于白喉A链,白喉毒素的非结合活性片段,外毒素A链(来自铜绿假单胞菌(Pseudomonas aeruginosa)),蓖麻毒蛋白(ricin)A链,相思豆毒蛋白(abrin)A链,蒴莲根毒蛋白(modeccin)A链,α-帚曲霉素(sarcin),油桐(Aleurites fordii)毒蛋白,香石竹(dianthin)毒蛋白,美洲商陆(Phytolaca americana)蛋白(PAPI,PAPII和PAP-S),苦瓜(Momordica charantia)抑制物,麻疯树毒蛋白(curcin),巴豆毒蛋白(crotin),肥皂草(sapaonaria officinalis)抑制剂,白树毒蛋白(gelonin),丝林霉素(mitogellin),局限曲菌素(restrictocin),酚霉素(phenomycin),依诺霉素(enomycin)和单端孢菌素(tricothecenes)。
在另一个实施方案中,免疫缀合物包含与放射性原子缀合以形成放射性缀合物的如本文中所描述的抗体。多种放射性同位素可用于生成放射性缀合物。例子包括At211,I131,I125,Y90,Re186,Re188,Sm153,Bi212,P32,Pb212和Lu的放射性同位素。在使用放射性缀合物进行检测时,它可以包含供闪烁法研究用的放射性原子,例如tc99m或I123,或供核磁共振(NMR)成像(又称为磁共振成像,mri)用的自旋标记物,诸如再一次的碘-123,碘-131,铟-111,氟-19,碳-13,氮-15,氧-17,钆,锰或铁。
可以使用多种双功能蛋白质偶联剂来生成抗体和细胞毒剂的缀合物,诸如N-琥珀酰亚氨基3-(2-吡啶基二硫代)丙酸酯(SPDP),琥珀酰亚氨基-4-(N-马来酰亚氨基甲基)环己烷-1-羧酸酯(SMCC),亚氨基硫烷(IT),亚氨酸酯(诸如盐酸己二酰亚氨酸二甲酯),活性酯类(诸如辛二酸二琥珀酰亚氨基酯),醛类(诸如戊二醛),双叠氮化合物(诸如双(对-叠氮苯甲酰基)己二胺),双重氮衍生物(诸如双(对-重氮苯甲酰基)-乙二胺),二异硫氰酸酯(诸如甲苯2,6-二异氰酸酯),和双活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)的双功能衍生物。例如,可以如Vitetta等,Science 238:1098(1987)中所述制备蓖麻毒蛋白免疫毒素。碳-14标记的1-异硫氰酸苄基-3-甲基二亚乙基三胺五乙酸(MX-DTPA)是用于将放射性核苷酸与抗体缀合的例示性螯合剂。参见WO94/11026。接头可以是便于在细胞中释放细胞毒性药物的“可切割接头”。例如,可使用酸不稳定接头,肽酶敏感性接头,光不稳定接头,二甲基接头或含二硫化物接头(Chari等,Cancer Res 52:127-131(1992);美国专利No.5,208,020)。
本文中的免疫缀合物或ADC明确涵盖,但不限于用交联试剂制备的此类缀合物,所述交联试剂包括但不限于BMPS,EMCS,GMBS,HBVS,LC-SMCC,MBS,MPBH,SBAP,SIA,SIAB,SMCC,SMPB,SMPH,sulfo-EMCS,sulfo-GMBS,sulfo-KMUS,sulfo-MBS,sulfo-SIAB,sulfo-SMCC,和sulfo-SMPB,及SVSB(琥珀酰亚氨基-(4-乙烯基砜)苯甲酸酯),它们是商品化的(例如,来自Pierce Biotechnology,Inc.,Rockford,IL.,U.S.A)。
OX40激动性抗体序列
IV.治疗方法
本公开文本的某些方案涉及用于在个体中治疗癌症或延迟癌症进展的方法,其包括对该个体施用有效量的本文中描述的抗血管发生剂和本文中描述的OX40结合激动剂。例如,可以在治疗方法中使用本文中提供的任何抗血管发生剂(例如抗VEGF抗体)和OX40结合激动剂(例如抗人OX40抗体)。在一些实施方案中,该个体具有癌症或已经诊断有癌症。在一些实施方案中,该治疗在该治疗停止后在该个体中导致持久响应。在一些实施方案中,该个体是人。
在一些实施方案中,该OX40结合激动剂在该抗血管发生剂之前,与该抗血管发生剂同时,或在该抗血管发生剂之后施用。
上文描述了能用抗血管发生剂(例如VEGF拮抗剂,诸如抗VEGF抗体,像贝伐珠单抗)和OX40结合激动剂治疗的各种癌症类型的例子。优选的癌症类型包括妇科癌症(例如卵巢癌,腹膜癌,输卵管癌,宫颈癌,子宫内膜癌,阴道癌,和外阴癌)。别的癌症包括上皮卵巢癌,输卵管癌,原发性腹膜癌,鳞状细胞癌,肺癌(包括小细胞肺癌,非小细胞肺癌,肺的腺癌,和肺的鳞癌),腹膜癌,肝细胞癌,胃癌(gastric or stomach cancer)(包括胃肠癌),胰腺癌,成胶质细胞瘤,宫颈癌,卵巢癌(包括铂敏感性和铂抗性卵巢癌),肝癌(liver cancer),膀胱癌,肝瘤,成神经细胞瘤,黑素瘤,乳腺癌,结肠癌,结直肠癌,输卵管,腹膜,子宫内膜癌或子宫癌,唾液腺癌,肾癌(kidney or renal cancer),肝癌(liver cancer),前列腺癌,外阴癌,甲状腺癌,软组织肉瘤,卡波西(Kaposi)氏肉瘤,类癌癌(carcinoid carcinoma),间皮瘤,多发性骨髓瘤,肝癌(hepatic carcinoma)及各种类型的头和颈癌,以及B细胞淋巴瘤(包括低级/滤泡性非霍奇金氏淋巴瘤(NHL),小淋巴细胞性(SL)NHL,中级/滤泡性NHL,中级弥漫性NHL,高级成免疫细胞性NHL,高级成淋巴细胞性NHL,高级小无核裂细胞性NHL,贮积病(bulky disease)NHL,套细胞淋巴瘤,AIDS相关淋巴瘤,和瓦尔登斯特伦氏(Waldenstrom)巨球蛋白血症),慢性淋巴细胞性白血病(CLL),急性成淋巴细胞性白血病(ALL),毛细胞性白血病,慢性成髓细胞性白血病,和移植后淋巴增殖性病症(PTLD),以及与瘢痣病(phakomatoses),水肿(诸如与脑瘤有关的),和梅格斯氏(Meigs)综合征有关的异常血管增殖。在各种实施方案中,所治疗的癌症是晚期的,顽固性的,复发性的,化疗抗性的,和/或铂抗性的癌症。
在一些实施方案中,癌症的例子进一步包括但不限于B细胞淋巴瘤(包括低级/滤泡性非霍奇金氏淋巴瘤(NHL),小淋巴细胞性(SL)NHL,中级/滤泡性NHL,中级弥漫性NHL,高级成免疫细胞性NHL,高级成淋巴细胞性NHL,高级小无核裂细胞性NHL,贮积病(bulky disease)NHL,套细胞淋巴瘤,AIDS相关淋巴瘤,和瓦尔登斯特伦氏(Waldenstrom)巨球蛋白血症),慢性淋巴细胞性白血病(CLL),急性成淋巴细胞性白血病(ALL),毛细胞性白血病,慢性成髓细胞性白血病,和移植后淋巴增殖性病症(PTLD),以及与瘢痣病(phakomatoses),水肿(诸如与脑瘤有关的),B细胞增殖性病症,和梅格斯氏(Meigs)综合征有关的异常血管增殖。更具体例子包括但不限于复发性或顽固性NHL,前线(front line)低级NHL,阶段III/IV NHL,化疗耐受性NHL,前体B成淋巴细胞性白血病和/或淋巴瘤,小淋巴细胞性淋巴瘤,B细胞慢性淋巴细胞性白血病和/或前淋巴细胞性白血病和/或小淋巴细胞性淋巴瘤,B细胞前淋巴细胞性淋巴瘤,免疫细胞瘤和/或淋巴浆细胞性(lymphoplasmacytic)淋巴瘤,淋巴浆细胞性淋巴瘤,边缘区B细胞淋巴瘤,脾边缘区淋巴瘤,节外边缘区(extranodal marginal zone)-MALT淋巴瘤,节边缘区(nodal marginal zone)淋巴瘤,毛细胞性白血病,浆细胞瘤和/或浆细胞骨髓瘤,低级/滤泡淋巴瘤,中级/滤泡NHL,套细胞淋巴瘤,滤泡中心淋巴瘤(滤泡的),中级弥漫性NHL,弥漫性大B细胞淋巴瘤,攻击性(agressive)NHL(包括攻击性前线NHL和攻击性复发性NHL),自体干细胞移植后复发性或顽固性NHL,原发性纵隔大B细胞淋巴瘤,原发性渗出性淋巴瘤,高级成免疫细胞NHL,高级成淋巴细胞NHL,高级小无核裂细胞NHL,贮积病(bulkydisease)NHL,伯基特氏(Burkitt)淋巴瘤,前体(外周)大粒状淋巴细胞白血病,蕈样肉芽肿病和/或塞扎里(Sezary)综合征,皮肤淋巴瘤,间变性大细胞淋巴瘤,血管中心性淋巴瘤。
在一些实施方案中,癌症的例子进一步包括但不限于B细胞增殖性病症,其进一步包括但不限于淋巴瘤(例如B细胞非霍奇金氏淋巴瘤(NHL))和淋巴细胞性白血病。此类淋巴瘤和淋巴细胞性白血病包括例如a)滤泡性淋巴瘤,b)小无核裂细胞淋巴瘤(Small Non-Cleaved Cell Lymphoma)/伯基特(Burkitt)氏淋巴瘤(包括地方性伯基特氏淋巴瘤,散发性伯基特氏淋巴瘤和非伯基特氏淋巴瘤),c)边缘区淋巴瘤(包括结外边缘区B细胞淋巴瘤(粘膜相关淋巴组织淋巴瘤,MALT),结边缘区B细胞淋巴瘤和脾边缘区淋巴瘤),d)套细胞淋巴瘤(MCL),e)大细胞淋巴瘤(包括B细胞弥漫性大细胞淋巴瘤(DLCL),弥漫性混合细胞淋巴瘤,免疫母细胞性淋巴瘤,原发性纵隔B细胞淋巴瘤,血管中心性淋巴瘤-肺B细胞淋巴瘤),f)毛细胞白血病,g)淋巴细胞性淋巴瘤,瓦尔登斯特伦(waldenstrom)氏巨球蛋白血症,h)急性淋巴细胞性白血病(ALL),慢性淋巴细胞性白血病(CLL)/小淋巴细胞性淋巴瘤(SLL),B细胞幼淋巴细胞白血病,i)浆细胞赘生物,浆细胞骨髓瘤,多发性骨髓瘤,浆细胞瘤,和/或j)霍奇金氏病。
在任何方法的一些实施方案中,该癌症是B细胞增殖性病症。在一些实施方案中,该B细胞增殖性病症是淋巴瘤,非霍奇金(Hodgkin)氏淋巴瘤(NHL),攻击性NHL,复发性攻击性NHL,复发性无痛性NHL,顽固性NHL,顽固性无痛性NHL,慢性淋巴细胞性白血病(CLL),小淋巴细胞淋巴瘤,白血病,毛细胞白血病(HCL),急性淋巴细胞性白血病(ALL),或套细胞淋巴瘤。在一些实施方案中,该B细胞增殖性病症是NHL,诸如无痛性NHL和/或攻击性NHL。在一些实施方案中,该B细胞增殖性病症是无痛性滤泡性淋巴瘤或弥漫性大B细胞淋巴瘤。
在一些实施方案中,该抗血管发生剂和/或该OX40结合激动剂静脉内,肌肉内,皮下,脑脊髓内,表面,口服,经皮,腹膜内,眼窝内,通过植入,通过吸入,鞘内,室内,关节内,滑膜内,或鼻内施用。依照已知的方法(诸如静脉内施用,例如通过推注或者通过在一段时间里连续输注,通过肌肉内,腹膜内,脑脊髓内,皮下,关节内,滑膜内,鞘内,口服,表面,或吸入路径)对人患者施用该VEGF拮抗剂和/或该OX40结合激动剂(例如抗VEGF抗体,诸如贝伐珠单抗),任选与一种或多种化疗剂(例如卡铂和/或帕利他赛)组合。抗体的静脉内施用是优选的。
通过混合具有期望纯度的此类抗体或其它药剂与一种或多种任选的药学可接受载剂(Remington’s Pharmaceutical Sciences第16版,Osol,A.编(1980))以冻干配制剂或水性溶液形式制备如本文中所描述的抗OX40抗体和/或抗血管发生剂的药物配制剂。一般地,药学可接受载剂在所采用的剂量和浓度对接受者是无毒的,而且包括但不限于缓冲剂,诸如磷酸盐,柠檬酸盐,和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如氯化十八烷基二甲基苄基铵;氯化己烷双胺;苯扎氯铵,苄索氯铵;酚,丁醇或苯甲醇;对羟基苯甲酸烃基酯,诸如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清清蛋白,明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸,谷氨酰胺,天冬酰胺,组氨酸,精氨酸或赖氨酸;单糖,二糖和其它碳水化合物,包括葡萄糖,甘露糖或糊精;螯合剂,诸如EDTA;糖类,诸如蔗糖,甘露醇,海藻糖或山梨醇;成盐相反离子,诸如钠;金属复合物(例如Zn-蛋白质复合物);和/或非离子表面活性剂,诸如聚乙二醇(PEG)。本文中的例示性的药学可接受载剂进一步包含间质药物分散剂诸如可溶性中性活性透明质酸酶糖蛋白(sHASEGP),例如人可溶性PH-20透明质酸酶糖蛋白,诸如rHuPH20(Baxter International,Inc.)。某些例示性的sHASEGP和使用方法,包括rHuPH20记载于美国专利公开文本No.2005/0260186和2006/0104968。在一方面,将sHASEGP与一种或多种别的糖胺聚糖酶诸如软骨素酶组合。
在一些实施方案中,“组氨酸缓冲液”为包含组氨酸离子的缓冲液。组氨酸缓冲液的例子包括组氨酸氯化物,组氨酸乙酸盐,组氨酸磷酸盐,组氨酸硫酸盐。本文中实施例中鉴定的优选组氨酸缓冲液发现是组氨酸乙酸盐。在优选实施方案中,组氨酸乙酸盐缓冲液通过用乙酸(液体)滴定L-组氨酸(游离碱,固体)来制备。在一些实施方案中,组氨酸缓冲液或组氨酸-乙酸盐缓冲液处于pH 5.0至6.0,在一些实施方案中,pH 5.3至5.8。
在一些实施方案中,本文中的“糖”包括(CH2O)n的一般组成及其衍生物,包括单糖,二糖,三糖,多糖,糖醇,还原糖,非还原糖,等。本文中的糖的例子包括葡萄糖,蔗糖,海藻糖,乳糖,果糖,麦芽糖,葡聚糖(dextran),丙三醇,右旋糖酐(dextran),赤藓醇,甘油,阿拉伯糖醇,木糖醇(sylitol),山梨糖醇,甘露糖醇,蜜二糖(mellibiose),松三糖,棉子糖,甘露三糖,水苏糖,麦芽糖,乳果糖,麦芽酮糖(maltulose),葡萄糖醇,麦芽糖醇,乳糖醇,异麦芽酮糖,等。在一些实施方案中,糖是非还原性二糖,诸如海藻糖或蔗糖。
在本文中的一些实施方案中,“表面活性剂”指表面活性物质,优选非离子型表面活性剂。本文中的表面活性剂的例子包括聚山梨酯(例如聚山梨酯20和聚山梨酯80);泊洛沙姆(例如泊洛沙姆188);Triton;十二烷基硫酸钠(SDS);月桂基硫酸钠;辛基糖苷钠;月桂基,肉豆蔻基,亚油基(linoleyl),或硬脂基磺基甜菜碱;月桂基,肉豆蔻基,亚油基或硬脂基肌氨酸;亚油基,肉豆蔻基,或鲸蜡基甜菜碱;月桂酰胺基丙基,椰油酰胺基(cocamido)丙基,亚油酰胺基丙基,肉豆蔻酰胺基丙基,棕榈酰胺基(palmido)丙基,或异硬脂酰胺基丙基甜菜碱(例如月桂酰胺基丙基);肉豆蔻酰胺基丙基,棕榈酰胺基(palmido)丙基,或异硬脂酰胺基丙基二甲胺;甲基椰油酰基牛磺酸钠或甲基油酰基牛磺酸二钠;和MONAQUATTM系列(Mona Industries,Inc.,Paterson,New Jersey);聚乙二醇,聚丙二醇,及乙二醇和丙二醇的共聚物(例如Pluronics,PF68等);等。在一些实施方案中,表面活性剂是聚山梨酯20。在一些实施方案中,表面活性剂是聚山梨酯80。
例示性的冻干抗体配制剂记载于美国专利No.6,267,958。水性抗体配制剂包括那些记载于美国专利No.6,171,586和WO2006/044908的,后一种配制剂包含组氨酸-乙酸盐缓冲液。
本文中的配制剂还可含有超过一种所治疗具体适应症所必需的活性组分,优选那些活性互补且彼此没有不利影响的。例如,可能想要进一步提供别的药物(本文中提供了例子)。合适地,此类活性组分以对于意图的目的有效的量组合存在。
活性成分可包载于例如通过凝聚技术或通过界面聚合制备的微胶囊中(例如分别是羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊),在胶状药物投递系统中(例如脂质体,清蛋白微球体,微乳剂,纳米颗粒和纳米胶囊),或在粗滴乳状液中。此类技术披露于Remington's Pharmaceutical Sciences,第16版,Osol,A.编(1980)。
可以制备持续释放制剂。持续释放制剂的合适的例子包括含有抗体的固体疏水性聚合物的半透性基质,该基质为成形商品形式,例如膜,或微胶囊。
用于体内施用的配制剂一般是无菌的。无菌性可容易地实现,例如通过穿过无菌滤膜过滤。
在一些实施方案中,本文中提供的是药物配制剂,其包含:(a)本文中描述的任何抗人OX40激动性抗体;(b)组氨酸缓冲液,处于pH 5.0-6.0。
在一些实施方案中,本文中提供的是药物配制剂,其包含:(a)本文中描述的任何抗人OX40激动性抗体;(b)组氨酸缓冲液,处于pH 5.0-6.0;(c)糖;和(d)表面活性剂。
在任何配制剂的一些实施方案中,该抗人OX40激动性抗体以介于约10mg/mL和约100mg/mL之间(例如约15mg/mL,18mg/mL,20mg/mL,60mg/mL,和75mg/mL)的浓度存在。在一些实施方案中,该抗人OX40激动性抗体以约20mg/mL的浓度存在。在一些实施方案中,该抗人OX40激动性抗体以约50mg/mL的浓度存在。在一些实施方案中,该抗人OX40激动性抗体以约60mg/mL的浓度存在。在一些实施方案中,该抗人OX40激动性抗体以约70mg/mL的浓度存在。
在任何配制剂的一些实施方案中,该糖以约75mM至约360mM(例如约100mM,约120mM,约240mM,约320mM至约360mM)的浓度存在。在一些实施方案中,该糖以约120mM的浓度存在。在一些实施方案中,该糖以约240mM的浓度存在。在一些实施方案中,该糖以约320mM的浓度存在。在一些实施方案中,该糖是二糖。在一些实施方案中,该二糖是海藻糖。在一些实施方案中,该二糖是蔗糖。
在任何配制剂的一些实施方案中,该组氨酸缓冲液处于约1mM至约50mM(例如约1mM至约25mM)的浓度。在一些实施方案中,该组氨酸缓冲液处于约10mM的浓度。在一些实施方案中,该组氨酸缓冲液处于约20mM的浓度。在一些实施方案中,该组氨酸缓冲液处于约30mM的浓度。在一些实施方案中,该组氨酸缓冲液是组氨酸乙酸酯。
在任何配制剂的一些实施方案中,该表面活性剂是聚山梨酯(例如聚山梨酯20或聚山梨酯40),poloxamer(例如poloxamer 188);Triton;十二烷基硫酸钠(SDS);月桂基硫酸钠;或辛基糖苷钠。
在任何配制剂的一些实施方案中,该表面活性剂是聚山梨酯。在一些实施方案中,该聚山梨酯以约0.005%至约0.1%的浓度存在。在一些实施方案中,该聚山梨酯以约0.005%的浓度存在。在一些实施方案中,该聚山梨酯以约0.02%的浓度存在。在一些实施方案中,该聚山梨酯以约0.04%的浓度存在。在一些实施方案中,该聚山梨酯以约0.06%的浓度存在。在一些实施方案中,该聚山梨酯是聚山梨酯20。在一些实施方案中,该聚山梨酯是聚山梨酯80。
在任何配制剂的一些实施方案中,该配制剂是用稀释剂(例如0.9%NaCl)稀释的。在一些实施方案中,该抗人OX40激动性抗体以约1mg/mL的浓度存在。
特别地,本文中提供的是药物配制剂,其包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯,其中该聚山梨酯浓度是约0.005%至约0.1%.;和(c)组氨酸缓冲液(例如处于pH 5.0和6.0之间的组氨酸缓冲液)。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯,其中该聚山梨酯浓度是约0.02%至约0.06%;(c)组氨酸缓冲液(例如处于pH 5.0和6.0之间的组氨酸缓冲液);和糖,其中该糖浓度是约120mM至约320mM。在一些实施方案中,该糖是蔗糖。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯,其中该聚山梨酯浓度是约0.02%至约0.06%,其中该聚山梨酯是聚山梨酯20或聚山梨酯40;(c)组氨酸乙酸酯缓冲液(例如处于pH 5.0和6.0之间的组氨酸乙酸酯缓冲液);和糖(例如蔗糖),其浓度为约120mM至约320mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.02%至约0.06%;(c)组氨酸乙酸酯缓冲液(例如处于pH 5.0和6.0之间的组氨酸乙酸酯缓冲液);和(d)蔗糖,其中该蔗糖浓度是约120mM至约320mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯40,其中该聚山梨酯浓度是约0.02%至约0.06%;(c)组氨酸乙酸酯缓冲液(例如处于pH 5.0和6.0之间的组氨酸乙酸酯缓冲液);和蔗糖,其中该蔗糖浓度是约120mM至约320mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.02%;(c)组氨酸乙酸酯缓冲液,处于pH 6.0;和(d)蔗糖,其中该蔗糖浓度是约320mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.02%;(c)组氨酸乙酸酯缓冲液,处于pH 5.5;和(d)蔗糖,其中该蔗糖浓度是约240mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯20,其中该聚山梨酯浓度是约0.04%;(c)组氨酸乙酸酯缓冲液,处于pH 6.0;和(d)蔗糖,其中该蔗糖浓度是约120mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯40,其中该聚山梨酯浓度是约0.04%;(c)组氨酸乙酸酯缓冲液,处于pH 5.0;和(d)蔗糖,其中该蔗糖浓度是约240mM。
在一些实施方案中,该药物配制剂包含(a)本文中描述的任何抗人OX40激动性抗体,(b)聚山梨酯40,其中该聚山梨酯浓度是约0.04%;(c)组氨酸乙酸酯缓冲液,处于pH 6.0;和(d)蔗糖,其中该蔗糖浓度是约120mM。
在一些实施方案中,该药物配制剂是液体药物配制剂。在一些实施方案中,该药物配制剂是稳定的药物配制剂。在一些实施方案中,该药物配制剂是稳定的液体药物配制剂。
在本文中描述的任何药物配制剂的一些实施方案中,该药物配制剂中的抗人OX40激动性抗体以介于约10mg/mL和约100mg/mL之间的浓度存在。在一些实施方案中,该人OX40激动性抗体的浓度介于约10mg/mL至50mg/mL,10mg/mL至75mg/mL,25mg/mL至75mg/mL,50mg/mL至100mg/mL,50mg/mL至75mg/mL,和/或75mg/mL至100mg/mL任一之间。在一些实施方案中,该人OX40激动性抗体的浓度大于约20mg/mL,30mg/mL,40mg/mL,50mg/mL,60mg/mL,70mg/mL,或100mg/mL任一。
药物配制剂优选包含聚山梨酯。一般以降低聚集物形成(诸如摇动或运输时发生的)的量包括聚山梨酯。聚山梨酯的例子包括但不限于聚山梨酯20(聚氧乙烯(20)山梨聚糖单月桂酸酯),聚山梨酯40(聚氧乙烯(20)山梨聚糖单棕榈酸酯),聚山梨酯60(聚氧乙烯(20)山梨聚糖单硬脂酸酯),和/或聚山梨酯80(聚氧乙烯(20)山梨聚糖单油酸酯)。在一些实施方案中,聚山梨酯为聚山梨酯20(聚氧乙烯(20)山梨聚糖单月桂酸酯)。在本文所述任何药物配制剂的一些实施方案中,聚山梨酯浓度足以在长期储存时和/或在施用期间(例如在IV袋中稀释之后)最小化聚集和/或维持稳定性。在一些实施方案中,聚山梨酯浓度为约0.005%w/v,约0.02%w/v,约0.04%w/v且小于约0.1%w/v。在一些实施方案中,聚山梨酯浓度大于0.01%w/v且小于约0.1%w/v。在一些实施方案中,聚山梨酯浓度为约0.005%w/v,约0.02%w/v,0.03%w/v,0.04%w/v,或0.05%w/v任一。在一些实施方案中,聚山梨酯以约0.04%w/v的浓度存在。在一些实施方案中,聚山梨酯以约0.02%w/v的浓度存在。
药物配制剂优选包含糖类。糖类包括单糖,二糖,三糖,多糖,糖醇,还原糖,非还原糖,等。糖类的别的例子包括但不限于葡萄糖,蔗糖,海藻糖,乳糖,果糖,麦芽糖,右旋糖酐,甘油(glycerin),右旋糖酐,赤藻糖醇,甘油(glycerol),阿糖醇,木糖醇(sylitol),山梨糖醇,甘露醇,蜜二糖,松三糖,棉子糖,甘露三糖,水苏糖,麦芽糖,乳果糖,麦芽酮糖,glucitol,麦芽糖醇,乳糖醇,异麦芽酮糖,等。在一些实施方案中,该糖类为二糖。在一些实施方案中,该糖类为非还原二糖。在一些实施方案中,该糖类为海藻糖。
一般以降低聚集物形成的量包括糖类。在本文所述任何药物配制剂的一些实施方案中,糖类以介于约50mM至250mM,75mM至200mM,75mM至150mM,100mM至150mM,110mM至130mM,100mM至320mM,240mM至320mM,或240mM至400mM任一之间的浓度存在。在一些实施方案中,糖类以大于约50mM,75mM,100mM,110mM,或115mM任一的浓度存在。在一些实施方案中,糖类以约100mM,110mM,120mM,130mM,或140mM任一的浓度存在。在一些实施方案中,糖类以约120mM的浓度存在。在任何配制剂的一些实施方案中,糖类以约75mM至约360mM(例如约100mM,约120mM,约240mM,约320mM至约360mM)的浓度存在。在一些实施方案中,糖类以约240mM的浓度存在。在一些实施方案中,糖类以约320mM的浓度存在。
药物配制剂优选包含组氨酸缓冲剂。组氨酸缓冲剂的例子包括但不限于组氨酸氯化物,组氨酸琥珀酸酯,组氨酸乙酸酯,组氨酸磷酸酯,组氨酸硫酸酯。在一些实施方案中,该组氨酸缓冲剂为组氨酸乙酸酯。在本文所述任何药物配制剂的一些实施方案中,该组氨酸缓冲剂浓度介于约1mM至50mM,1mM至35mM,1mM至25mM,1mM至20mM,7.5mM至12.5mM,5mM至15mM,20mM至30mM,或25mM至35mM任一之间。在一些实施方案中,该组氨酸缓冲剂浓度为约5mM,7.5mM,10mM,12.5mM,15mM,20mM,25mM,30mM,35mM或40mM任一。在一些实施方案中,该组氨酸缓冲剂浓度为约10mM。在一些实施方案中,该组氨酸缓冲剂浓度为约20mM。在一些实施方案中,该组氨酸缓冲剂浓度为约30mM。在一些实施方案中,该组氨酸缓冲剂浓度为约40mM。在本文所述任何药物配制剂的一些实施方案中,该组氨酸缓冲剂处于介于pH 5.0和6.0之间的pH,例如约pH 5.0,pH 5.1,pH 5.2,pH 5.3,pH 5.4,pH 5.5,pH 5.6,pH 5.7,pH 5.8,pH 5.9或pH 6.0任一。在一些实施方案中,该pH介于pH 4.9和pH 6.3之间。
本文中的药物配制剂还可含有超过一种所治疗具体适应症所必需的活性化合物,优选那些活性互补且彼此没有不利影响的。合适地,此类分子以对于意图的目的有效的量组合存在。
而且,本文中提供装有本文所述药物配制剂的管形瓶和填充管形瓶的方法。在一些实施方案中,在具有注射器可刺穿的塞子的管形瓶中提供该药物配制剂,优选处于含水形式。期望将管形瓶于约2-8℃以及直至30℃储存24小时,直到将它施用于需要它的受试者。管形瓶可例如为15cc管形瓶(例如用于200mg剂量)。
用于施用的药物配制剂优选为液体配制剂(未冻干)且尚未进行在先冻干。虽然该药物配制剂可以冻干,但是优选它是未冻干的。在任何药物配制剂的一些实施方案中,该药物配制剂为冻干药物配制剂。在一些实施方案中,该药物配制剂为液体配制剂。在一些实施方案中,该药物配制剂不含致张力变化(tonicifying)量的盐诸如氯化钠。在任何药物配制剂的一些实施方案中,该药物配制剂是稀释的。
例示性的冻干抗体配制剂记载于美国专利No.6,267,958。水性抗体配制剂包括那些记载于美国专利No.6,171,586和WO2006/044908的,后一种配制剂包含组氨酸-乙酸盐缓冲液。
本文中的配制剂还可含有超过一种所治疗具体适应症所必需的活性组分,优选那些活性互补且彼此没有不利影响的。例如,可能想要进一步提供别的药物(本文中提供了例子)。合适地,此类活性组分以对于意图的目的有效的量组合存在。
活性成分可包载于例如通过凝聚技术或通过界面聚合制备的微胶囊中(例如分别是羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊),在胶状药物投递系统中(例如脂质体,清蛋白微球体,微乳剂,纳米颗粒和纳米胶囊),或在粗滴乳状液中。此类技术披露于Remington's Pharmaceutical Sciences,第16版,Osol,A.编(1980)。
可以制备持续释放制剂。持续释放制剂的合适的例子包括含有抗体的固体疏水性聚合物的半透性基质,该基质为成形商品形式,例如膜,或微胶囊。
用于体内施用的配制剂一般是无菌的。无菌性可容易地实现,例如通过穿过无菌滤膜过滤。
一方面,提供OX40结合激动剂(例如抗人OX40激动性抗体)和/或抗血管发生剂(例如抗VEGF抗体),其用作药物。在一些实施方案中,提供抗血管发生剂(例如抗VEGF抗体),其用作药物,用于在个体中治疗癌症或延迟癌症进展,其中该药物包含该抗血管发生剂和任选的药学可接受载剂,且其中该治疗包括与包含OX40结合激动剂和任选的药学可接受载剂的组合物组合施用该药物。在其它实施方案中,提供OX40结合激动剂(例如抗人OX40激动性抗体),其用作药物,用于在个体中治疗癌症或延迟癌症进展,其中该药物包含该抗血管发生剂和任选的药学可接受载剂,且其中该治疗包括与包含抗血管发生剂和任选的药学可接受载剂的组合物组合施用该药物。在一些实施方案中,该方法进一步包括对该个体施用有效量的至少一种别的治疗剂,例如下文所述。
在可以与本文中描述的抗血管发生剂组合的一个方面,提供的是抗人OX40激动性抗体,其用于在具有癌症的个体中增强免疫功能(例如通过上调细胞介导的免疫应答),包括对该个体施用有效量的该抗人激动性OX40抗体。一方面,提供的是抗人OX40激动性抗体,其用于在具有癌症的个体中增强T细胞功能,包括对该个体施用有效量的该抗人激动性OX40抗体。一方面,提供的是抗人OX40激动性抗体,其用于消减表达人OX40的细胞(例如表达OX40的T细胞,例如表达OX40的Treg),包括对该个体施用有效量的该抗人激动性OX40抗体。在一些实施方案中,消减是通过ADCC进行的。在一些实施方案中,消减是通过吞噬进行的。提供的是抗人OX40激动性抗体,其用于治疗具有肿瘤免疫的个体。
又一方面,本发明提供抗OX40抗体制造或制备药物的用途。又一方面,本发明提供抗VEGF抗体制造或制备药物的用途。在一个实施方案中,该药物用于治疗癌症。在又一个实施方案中,该药物用于治疗癌症的方法,其包括对具有癌症的个体施用有效量的该药物。在一个此类实施方案中,该方法进一步包括对该个体施用有效量的至少一种别的治疗剂,例如下文所述。
一方面,该药物用于在具有癌症的个体中增强免疫功能(例如通过上调细胞介导的免疫应答),其包括对该个体施用有效量的该药物。一方面,该药物用于在具有癌症的个体中增强T细胞功能,其包括对该个体施用有效量的该药物。在一些实施方案中,该T细胞功能障碍性病症是癌症。一方面,该药物用于消减表达人OX40的细胞(例如表达高OX40的细胞,例如表达OX40的T细胞),其包括对该个体施用有效量的该药物。在一些实施方案中,消减是通过ADCC进行的。在一些实施方案中,消减是通过吞噬进行的。一方面,该药物用于治疗具有肿瘤免疫的个体。
又一方面,本发明提供药物配制剂,其包含本文中提供的任何OX40结合激动剂(例如抗OX40抗体)和/或抗血管发生剂(例如抗VEGF抗体),例如用于任何上述治疗方法。在一个实施方案中,药物配制剂包含本文中提供的任何抗OX40抗体和/或抗血管发生剂(例如抗VEGF抗体)和药学可接受载剂。在另一个实施方案中,药物配制剂包含本文中提供的任何抗OX40抗体和/或抗血管发生剂(例如抗VEGF抗体)和至少一种别的治疗剂,例如下文所述。
在本发明的任何方法的一些实施方案中,该抗人OX40激动性抗体通过抑制Treg功能(例如抑制Treg的遏制性功能),杀死表达OX40的细胞(例如表达高水平OX40的细胞),提高效应T细胞功能和/或提高记忆T细胞功能来抑制肿瘤免疫。在本发明的任何方法的一些实施方案中,该抗人OX40激动性抗体通过抑制Treg功能(例如抑制Treg的遏制性功能),杀死表达OX40的细胞(例如表达高水平OX40的细胞),提高效应T细胞功能和/或提高记忆T细胞功能来治疗癌症。在本发明的任何方法的一些实施方案中,该抗人OX40激动性抗体通过抑制Treg功能(例如抑制Treg的遏制性功能),杀死表达OX40的细胞(例如表达高水平OX40的细胞),提高效应T细胞功能和/或提高记忆T细胞功能来增强免疫功能。在本发明的任何方法的一些实施方案中,该抗人OX40激动性抗体通过抑制Treg功能(例如抑制Treg的遏制性功能),杀死表达OX40的细胞(例如表达高水平OX40的细胞),提高效应T细胞功能和/或提高记忆T细胞功能来增强T细胞功能。
在任何方法的一些实施方案中,该抗人OX40激动性抗体是消减性抗人OX40激动性抗体。在一些实施方案中,该抗人OX40激动性抗体处理导致细胞消减(例如消减表达OX40的细胞,例如消减表达高水平OX40的细胞)。在一些实施方案中,消减是通过ADCC进行的。在一些实施方案中,消减是通过吞噬进行的。
在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的Treg功能,该抗人OX40激动性抗体例如通过抑制效应和/或记忆T细胞功能(在一些实施方案中,效应T细胞和/或记忆T细胞增殖和/或细胞因子分泌)的Treg遏制来抑制Treg功能。在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的效应T细胞增殖,该抗人OX40激动性抗体提高效应T细胞增殖。在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的记忆T细胞增殖,该抗人OX40激动性抗体提高记忆T细胞增殖。在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的效应T细胞细胞因子生成,该抗人OX40激动性抗体提高效应T细胞细胞因子生成(例如γ-干扰素生成)。在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的记忆T细胞细胞因子生成,该抗人OX40激动性抗体提高记忆T细胞细胞因子生成(例如γ-干扰素生成)。在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的CD4+效应T细胞增殖和/或CD8+效应T细胞增殖,该抗人OX40激动性抗体提高CD4+效应T细胞增殖和/或CD8+效应T细胞增殖。在任何方法的一些实施方案中,相对于施用该OX40激动性抗体之前的记忆T细胞增殖,该抗人OX40激动性抗体提高记忆T细胞增殖(例如CD4+记忆T细胞增殖)。在一些实施方案中,相对于施用该抗人OX40激动性抗体的之前的增殖,细胞因子分泌和/或溶胞活性,个体中的CD4+效应T细胞具有增强的增殖,细胞因子分泌和/或溶胞活性。
在本发明的任何方法的一些实施方案中,CD4+效应T细胞的数目相对于施用该抗人OX40激动性抗体之前升高。在一些实施方案中,CD4+效应T细胞细胞因子分泌相对于施用该抗人OX40激动性抗体之前升高。在任何方法的一些实施方案中,个体中的CD8+效应T细胞具有相对于施用该抗人OX40激动性抗体之前增强的增殖,细胞因子分泌和/或溶胞活性。在一些实施方案中,CD8+效应T细胞的数目相对于施用该抗人OX40激动性抗体之前升高。在一些实施方案中,CD8+效应T细胞细胞因子分泌相对于施用该抗人OX40激动性抗体之前升高。
在本发明的任何方法的一些实施方案中,该抗人OX40激动性抗体结合人效应细胞,例如结合由人效应细胞表达的FcγR。在一些实施方案中,该人效应细胞实施ADCC效应器功能。在一些实施方案中,该人效应细胞实施吞噬效应器功能。
在本发明的任何方法的一些实施方案中,包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变,例如DANA或N297G突变)的抗人OX40激动性抗体具有相对于包含天然序列IgG1 Fc部分的抗人OX40激动性抗体降低的活性(例如CD4+效应T细胞功能,例如增殖)。在一些实施方案中,包含变异IgG1 Fc多肽(其包含消除对人效应细胞的结合的突变,例如DANA或N297G突变)的抗人OX40激动性抗体并不拥有实质性活性(例如CD4+效应T细胞功能,例如增殖)。
在本发明的任何方法的一些实施方案中,抗人OX40激动性抗体功能需要抗体交联。在一些实施方案中,功能是刺激CD4+效应T细胞增殖。在一些实施方案中,抗体交联是通过提供粘附至固体表面(例如细胞培养板)的抗人OX40激动性抗体而测定的。在一些实施方案中,抗体交联是通过在该抗体的IgG1 Fc部分中引入突变(例如DANA或N297S突变)并测试突变体抗体的功能而测定的。
在任何方法的一些实施方案中,个体中的记忆T细胞具有相对于施用该抗人OX40激动性抗体之前增强的增殖和/或细胞因子分泌。在一些实施方案中,记忆T细胞的数目相对于施用该抗人OX40激动性抗体之前升高。在一些实施方案中,记忆T细胞细胞因子分泌(水平)相对于施用该抗人OX40激动性抗体之前升高。在任何方法的一些实施方案中,个体中的Treg具有相对于施用该抗人OX40激动性抗体之前降低的效应T细胞功能(例如增殖和/或细胞因子分泌)抑制。在一些实施方案中,效应T细胞的数目相对于施用该抗人OX40激动性抗体之前升高。在一些实施方案中,效应T细胞细胞因子分泌(水平)相对于施用该抗人OX40激动性抗体之前升高。
在本发明的任何方法的一些实施方案中,肿瘤内(浸润性)CD4+效应T细胞的数目(例如CD4+效应T细胞的总数,或例如CD45+细胞中CD4+细胞的百分比)相对于施用该抗人OX40激动性抗体之前升高。在本发明的任何方法的一些实施方案中,表达γ-干扰素的肿瘤内(浸润性)CD4+效应T细胞的数目(例如总的表达γ-干扰素的CD4+细胞,或例如总的CD4+细胞中表达γ-干扰素的CD4+细胞的百分比)相对于施用抗人OX40激动性抗体之前升高。
在本发明的任何方法的一些实施方案中,肿瘤内(浸润性)CD8+效应T细胞的数目(例如CD8+效应T细胞的总数,或例如CD45+细胞中CD8+的百分比)相对于施用抗人OX40激动性抗体之前升高。在本发明的任何方法的一些实施方案中,表达γ-干扰素的肿瘤内(浸润性)CD8+效应T细胞的数目(例如总的CD8+细胞中表达γ-干扰素的CD8+细胞的百分比)相对于施用抗人OX40激动性抗体之前升高。
在本发明的任何方法的一些实施方案中,肿瘤内(浸润性)Treg的数目(例如Treg的总数或例如CD4+细胞中Fox3p+细胞的百分比)相对于施用抗人OX40激动性抗体之前降低。
在本发明的任何方法的一些实施方案中,抗人OX40激动性抗体的施用与肿瘤抗原的施用组合。在一些实施方案中,该肿瘤抗原包含蛋白质。在一些实施方案中,该肿瘤抗原包含核酸。在一些实施方案中,该肿瘤抗原是肿瘤细胞。
在本发明的任何方法的一些实施方案中,该癌症展示人效应细胞(例如受到人效应细胞浸润)。用于检测人效应细胞的是方法本领域公知的,包括例如通过IHC。在一些实施方案中,该癌症展示高水平的人效应细胞。在一些实施方案中,人效应细胞是NK细胞,巨噬细胞,单核细胞中的一项或多项。在一些实施方案中,该癌症是本文中描述的任何癌症。
在本发明的任何方法的一些实施方案中,该癌症展示表达FcR的细胞(例如受到表达FcR的细胞浸润)。用于检测FcR的方法是本领域公知的,包括例如通过IHC。在一些实施方案中,该癌症展示高水平的表达FcR的细胞。在一些实施方案中,FcR是FcγR。在一些实施方案中,FcR是活化性FcγR。
依照任何上述实施方案的“个体”优选是人。
可以单独或与疗法中的其它药剂组合使用本发明的抗体。例如,可以与至少一种别的治疗剂共施用本发明的组合疗法(例如包括OX40结合激动剂和抗血管发生剂的)。
上文记录的此类组合疗法涵盖组合施用(其中两种或更多种治疗剂包含在同一配制剂或分开的配制剂中),和分开施用,在该情况中,可以在施用别的治疗剂和/或药剂之前,同时,和/或之后发生本发明的抗体的施用。在一个实施方案中,抗OX40抗体和抗血管发生剂(例如抗VEGF抗体)的施用和别的治疗剂的施用彼此在约一个月内,或约一,两或三周内,或约1,2,3,4,5,或6天内发生。也可以与放射疗法组合使用本发明的抗体。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与化疗或化疗剂联合施用。在一些实施方案中,抗人OX40激动性抗体可以与放疗或放疗剂联合施用。在一些实施方案中,抗人OX40激动性抗体可以与靶向疗法或靶向治疗剂联合施用。在一些实施方案中,抗人OX40激动性抗体可以与免疫疗法或免疫治疗剂,例如单克隆抗体联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与PARP抑制剂(例如Olaparanib,Rucaparib,Niraparib,Cediranib,BMN673,Veliparib),Trabectedin,nab-paclitaxel(清蛋白结合的帕利他赛,ABRAXANE),Trebananib,Pazopanib,Cediranib,Palbociclib,everolimus,氟尿嘧啶(例如FOLFOX,FOLFIRI),IFL,regorafenib,Reolysin,Alimta,Zykadia,Sutent,Torisel(temsirolimus),Inlyta(axitinib,Pfizer),Afinitor(everolimus,Novartis),Nexavar(sorafenib,Onyx/Bayer),Votrient,Pazopanib,axitinib,IMA-901,AGS-003,cabozantinib,Vinflunine,Hsp90抑制剂(例如apatorsin),Ad-GM-CSF(CT-0070),Temazolomide,IL-2,IFNa,vinblastine,Thalomid,dacarbazine,cyclophosphamide,lenalidomide,azacytidine,lenalidomide,bortezomid(VELCADE),amrubicine,carfilzomib,pralatrexate,和/或enzastaurin联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与PD-1轴结合拮抗剂联合施用。PD-1轴结合拮抗剂包括但不限于PD-1结合拮抗剂,PD-L1结合拮抗剂和PD-L2结合拮抗剂。"PD-1"的备选名称包括CD279和SLEB2。"PD-L1"的备选名称包括B7-H1,B7-4,CD274,和B7-H。"PD-L2"的备选名称包括B7-DC,Btdc,和CD273。在一些实施方案中,PD-1,PD-Ll,和PD-L2是人PD-1,PD-Ll和PD-L2。在一些实施方案中,PD-1结合拮抗剂是抑制PD-1结合其配体结合配偶的分子。在一个具体方面,PD-1配体结合配偶是PD-Ll和/或PD-L2。在另一个实施方案中,PD-Ll结合拮抗剂是抑制PD-Ll结合其结合配偶的分子。在一个具体方面,PD-Ll结合配偶是PD-1和/或B7-1。在另一个实施方案中,PD-L2结合拮抗剂是抑制PD-L2结合其结合配偶的分子。在一个具体方面,PD-L2结合配偶是PD-1。拮抗剂可以是抗体,其抗原结合片段,免疫粘附素,融合蛋白,或寡肽。在一些实施方案中,PD-1结合拮抗剂是抗PD-1抗体(例如人抗体,人源化抗体,或嵌合抗体)。在一些实施方案中,抗PD-1抗体选自下组:MDX-1106(nivolumab,OPDIVO),Merck 3475(MK-3475,pembrolizumab,KEYTRUDA)和CT-011(Pidilizumab)。在一些实施方案中,PD-1结合拮抗剂是免疫粘附素(例如包含融合至恒定区(例如免疫球蛋白序列的Fc区)的,PD-L1或PD-L2的胞外或PD-1结合部分的免疫粘附素)。在一些实施方案中,PD-1结合拮抗剂是AMP-224。在一些实施方案中,PD-Ll结合拮抗剂是抗PD-Ll抗体。在一些实施方案中,抗PD-Ll结合拮抗剂选自下组:YW243.55.S70,MPDL3280A,MEDI4736和MDX-1105。MDX-1105,也称作BMS-936559,是WO2007/005874中记载的抗PD-Ll抗体。抗体YW243.55.S70(重和轻链可变区序列分别显示于SEQ ID No.20和21)是WO 2010/077634Al中记载的抗PD-L1。MDX-1106,也称作MDX-1106-04,ONO-4538,BMS-936558或nivolumab,是WO2006/121168中记载的抗PD-1抗体。Merck 3475,也称作MK-3475,SCH-900475或pembrolizumab,是WO2009/114335中记载的抗PD-1抗体。CT-011,也称作hBAT,hBAT-1或pidilizumab,是WO2009/101611中记载的抗PD-1抗体。AMP-224,也称作B7-DCIg,是WO2010/027827和WO2011/066342中记载的PD-L2-Fc融合可溶性受体。在一些实施方案中,抗PD-1抗体是MDX-1106。"MDX-1106"的备选名称包括MDX-1106-04,ONO-4538,BMS-936558或nivolumab。在一些实施方案中,抗PD-1抗体是nivolumab(CAS注册号:946414-94-4)。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对活化性共刺激分子的激动剂联合施用。在一些实施方案中,活化性共刺激分子可包括CD40,CD226,CD28,GITR,CD137,CD27,HVEM,或CD127。在一些实施方案中,针对活化性共刺激分子的激动剂是结合CD40,CD226,CD28,OX40,GITR,CD137,CD27,HVEM,或CD127的激动性抗体。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对抑制性共刺激分子的拮抗剂联合施用。在一些实施方案中,抑制性共刺激分子可包括CTLA-4(也称作CD152),PD-1,TIM-3,BTLA,VISTA,LAG-3,B7-H3,B7-H4,IDO,TIGIT,MICA/B,或精氨酸酶。在一些实施方案中,针对抑制性共刺激分子的拮抗剂是结合CTLA-4,PD-1,TIM-3,BTLA,VISTA,LAG-3(例如LAG-3-IgG融合蛋白(IMP321)),B7-H3,B7-H4,IDO,TIGIT,MICA/B,或精氨酸酶的拮抗性抗体。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CTLA-4(也称作CD152)的拮抗剂,例如阻断性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ipilimumab(也称作MDX-010,MDX-101,或)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与tremelimumab(也称作ticilimumab或CP-675,206)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对B7-H3(也称作CD276)的拮抗剂,例如阻断性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与MGA271联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对TGFβ的拮抗剂,例如metelimumab(也称作CAT-192),fresolimumab(也称作GC1008),或LY2157299联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与包含过继转移表达嵌合抗原受体(CAR)的T细胞(例如细胞毒性T细胞或CTL)的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与UCART19联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与WT128z联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与KTE-C19(Kite)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CTL019(Novartis)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与包含过继转移包含显性阴性TGFβ受体,例如,显性阴性TGFβ II型受体的T细胞的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与包含HERCREEM方案的治疗(参见例如ClinicalTrials.gov Identifier NCT00889954)联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD19的拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与MOR00208联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD38的拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与daratumumab联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD137(也称作TNFRSF9,4-1BB,或ILA)的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与urelumab(也称作BMS-663513)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD40的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CP-870893联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对OX40(也称作CD134)的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与不同的抗OX40抗体(例如AgonOX)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD27的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CDX-1127联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对吲哚胺-2,3-双加氧酶(IDO)的拮抗剂联合施用。在一些实施方案中,该IDO拮抗剂是1-甲基-D-色氨酸(也称作1-D-MT)。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD137(也称作TNFRSF9,4-1BB,或ILA)的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与urelumab(也称作BMS-663513)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD40的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CP-870893或RO7009789联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对OX40(也称作CD134)的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对CD27的激动剂,例如活化性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CDX-1127(也称作varlilumab)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对吲哚胺-2,3-双加氧酶(IDO)的拮抗剂联合施用。在一些实施方案中,该IDO拮抗剂是1-甲基-D-色氨酸(也称作1-D-MT)。在一些实施方案中,该IDO拮抗剂是WO2010/005958(通过此处记录明确收录其内容)中所示IDO拮抗剂。在一些实施方案中,该IDO拮抗剂是4-({2-[(氨基磺酰基)氨基]乙基}氨基)-N-(3-溴-4-氟苯基)-N’-羟基-1,2,5-二唑-3-甲脒(例如如WO2010/005958实施例23中记载的)。在一些实施方案中,该IDO拮抗剂是
在一些实施方案中,该IDO拮抗剂是INCB24360。在一些实施方案中,该IDO拮抗剂是Indoximod(1-甲基-色氨酸的D异构体)。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗体-药物缀合物联合施用。在一些实施方案中,该抗体-药物缀合物包含mertansine或单甲基奥瑞司他汀E(MMAE)。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗NaPi2b抗体-MMAE缀合物(也称作DNIB0600A,RG7599或lifastuzumab vedotin)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与trastuzumab emtansine(也称作T-DM1,ado-trastuzumab emtansine,或Genentech)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗MUC16抗体-MMAE缀合物,DMUC5754A联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗MUC16抗体-MMAE缀合物,DMUC4064A联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向内皮缩血管肽B受体(EDNBR)的抗体-药物缀合物,例如缀合有MMAE的针对EDNBR的抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向淋巴细胞抗原6复合物,基因座E(Ly6E)的抗体-药物缀合物,例如缀合有MMAE的针对Ly6E的抗体(也称作DLYE5953A)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与polatuzumab vedotin联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CD30的抗体-药物缀合物联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ADCETRIS(也称作brentuximab vedotin)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与polatuzumab vedotin联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与血管发生抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对VEGF,例如VEGF-A的抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗(也称作Genentech)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对血管生成素2(也称作Ang2)的抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与MEDI3617联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对VEGFR2的抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ramucirumab联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与VEGF受体融合蛋白联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与aflibercept联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ziv-aflibercept(也称作VEGF陷阱或)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与针对VEGF和Ang2的双特异性抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与RG7221(也称作vanucizumab)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与血管发生抑制剂联合和与PD-1轴结合拮抗剂(例如PD-1结合拮抗剂诸如抗PD-1抗体,PD-L1结合拮抗剂诸如抗PD-L1抗体,和PD-L2结合拮抗剂诸如抗PD-L2抗体)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和PD-1轴结合拮抗剂(例如PD-1结合拮抗剂诸如抗PD-1抗体,PD-L1结合拮抗剂诸如抗PD-L1抗体,和PD-L2结合拮抗剂诸如抗PD-L2抗体)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和MDX-1106(nivolumab,OPDIVO)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和Merck 3475(MK-3475,pembrolizumab,KEYTRUDA)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和CT-011(Pidilizumab)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和YW243.55.S70联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和MPDL3280A联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和MEDI4736联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与贝伐珠单抗和MDX-1105联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗肿瘤剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CSF-1R(也称作M-CSFR或CD115)的药剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗CSF-1R抗体(也称作IMC-CS4或LY3022855)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与抗CSF-1R抗体,RG7155(也称作RO5509554或emactuzumab)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与干扰素,例如干扰素-α或干扰素-γ联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与Roferon-A(也称作重组干扰素α-2a)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GM-CSF(也称作重组人粒细胞巨噬细胞集落刺激因子,rhu GM-CSF,sargramostim,或)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-2(也称作aldesleukin或)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-12联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL27联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-15联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ALT-803联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CD20的抗体联合施用。在一些实施方案中,靶向CD20的抗体是奥奴珠单抗(也称作GA101或)或利妥昔单抗。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向GITR的抗体联合施用。在一些实施方案中,靶向GITR的抗体是TRX518。在一些实施方案中,靶向GITR的抗体是MK04166(Merck)。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与Bruton氏酪氨酸激酶(BTK)的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ibrutinib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与疫苗脱氢酶1(IDH1)和/或疫苗脱氢酶2(IDH2)的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与AG-120(Agios)联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与奥奴珠单抗和PD-1轴结合拮抗剂(例如PD-1结合拮抗剂诸如抗PD-1抗体,PD-L1结合拮抗剂诸如抗PD-L1抗体,和PD-L2结合拮抗剂诸如抗PD-L2抗体)联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与癌症疫苗联合施用。在一些实施方案中,该癌症疫苗是肽癌症疫苗,其在一些实施方案中是个性化肽疫苗。在一些实施方案中,该肽癌症疫苗是多价长肽,多重肽,肽混合物,杂合肽,或经肽脉冲的树突细胞疫苗(参见例如Yamada et al.,Cancer Sci,104:14-21,2013)。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与佐剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与包含TLR激动剂,例如Poly-ICLC(也称作),LPS,MPL,或CpG ODN的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与肿瘤坏死因子(TNF)α联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-1联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与HMGB1联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-10拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-4拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-13拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL-17拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与HVEM拮抗剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ICOS激动剂(例如通过施用ICOS-L,或针对ICOS的激动性抗体)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CX3CL1的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CXCL9的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CXCL10的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CCL5的治疗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与LFA-1或ICAM1激动剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与选择蛋白激动剂联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与B-Raf的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与维罗非尼(也称作)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与dabrafenib(也称作)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与encorafenib(LGX818)联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与EGFR抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与erlotinib(也称作)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与EGFR-T790M的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与gefitinib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与afatinib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与西妥昔单抗(也称作)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与panitumumab(也称作)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与rociletinib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与AZD9291联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与MEK,诸如MEK1(也称作MAP2K1)和/或MEK2(也称作MAP2K2)的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与cobimetinib(也称作GDC-0973或XL-518)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与trametinib(也称作)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与binimetinib联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与B-Raf的抑制剂(例如维罗非尼或dabrafenib)和MEK(例如MEK1和/或MEK2)的抑制剂(例如cobimetinib或trametinib)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ERK(例如ERK1/2)的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GDC-0994联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与B-Raf的抑制剂,MEK的抑制剂,和ERK1/2的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与EGFR的抑制剂,MEK的抑制剂,和ERK1/2的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与一种或多种MAP激酶途径抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CK127联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与K-Ras的抑制剂联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与c-Met的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与onartuzumab(也称作MetMAb)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与anaplatic淋巴瘤激酶(ALK)的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与AF802(也称作CH5424802或alectinib)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与crizotinib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ceritinib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与磷脂酰肌醇3-激酶(PI3K)的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与buparlisib(BKM-120)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与pictilisib(也称作GDC-0941)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与buparlisib(也称作BKM-120)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与perifosine(也称作KRX-0401)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与磷脂酰肌醇3-激酶(PI3K)的δ选择性抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与idelalisib(也称作GS-1101或CAL-101)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与taselisib(也称作GDC-0032)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与BYL-719联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与Akt的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与MK2206联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GSK690693联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ipatasertib(也称作GDC-0068)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与mTOR的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与sirolimus(也称作rapamycin)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与temsirolimus(也称作CCI-779或)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与everolimus(也称作RAD001)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ridaforolimus(也称作AP-23573,MK-8669,或deforolimus)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与OSI-027联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与AZD8055联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与INK128联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与双重PI3K/mTOR抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与XL765联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GDC-0980联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与BEZ235(也称作NVP-BEZ235)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与BGT226联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GSK2126458联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与PF-04691502联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与PF-05212384(也称作PKI-587)联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与选择性降解雌激素受体的药剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GDC-0927联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与HER3的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与duligotuzumab联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与LSD1的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与MDM2的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与BCL2的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与venetoclax联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与CHK1的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与GDC-0575联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与激活的hedgehog信号传导途径的抑制剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与ERIVEDGE联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与放射疗法联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与吉西他滨联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与nab-paclitaxel(ABRAXANE)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与曲妥珠单抗联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与TVEC联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与IL27联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与环磷酰胺联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与募集T细胞至肿瘤的药剂联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与lirilumab(IPH2102/BMS-986015)联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与Idelalisib联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CD3和CD20的抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与REGN1979联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与靶向CD3和CD19的抗体联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与blinatumomab联合施用。
在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与溶瘤病毒联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与卡铂和nab-paclitaxel联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与卡铂和帕利他赛联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与顺铂和培美曲塞联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与顺铂和吉西他滨联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与FOLFOX联合施用。在一些实施方案中,抗人OX40激动性抗体和/或抗血管发生剂(例如抗VEGF抗体)可以与FOLFIRI联合施用。
上文记录的此类组合疗法涵盖组合施用(其中两种或更多种治疗剂包含在同一配制剂或分开的配制剂中),和分开施用,在该情况中,可以在施用别的治疗剂和/或佐剂之前,同时,和/或之后发生抗人OX40激动性抗体和/或抗血管发生剂的施用。也可以与放射疗法组合使用抗人OX40激动性抗体和/或抗血管发生剂。
可以通过任何合适的手段(包括胃肠外,肺内,和鼻内,及若期望用于局部治疗的话,损伤内施用)来施用抗人OX40激动性抗体和/或抗血管发生剂(和任何别的治疗剂)。胃肠外输注包括肌肉内,静脉内,动脉内,腹膜内,或皮下施用。部分根据施用是短暂的还是长期的,剂量给药可以通过任何合适的路径(例如通过注射,诸如静脉内或皮下注射)来进行。本文中涵盖各种剂量给药日程表,包括但不限于单次施用或在多个时间点里的多次施用,推注施用,和脉冲输注。
抗人OX40激动性抗体和抗血管发生剂会以一种符合优秀的医学实践的方式配制,定剂量和施用。在此背景中考虑的因素包括所治疗的特定病症,所治疗的特定哺乳动物,患者个体的临床状况,病症的起因,药剂投递部位,施用方法,施用日程表及医学从业人员知道的其它因素。抗体无需但任选与一种或多种目前用于预防或治疗所讨论病症的药剂一起配制。此类其它药物的有效量取决于配制剂中存在的抗体的量,病症或治疗的类型,及上文所述其它因素。这些通常以本文所述相同的剂量和施用途径使用,或以约1-99%的本文所述剂量使用,或以凭经验/临床上确定为适宜的任何剂量和任何途径使用。而且,下文提供抗血管发生剂(例如抗VEGF抗体)的例示性剂量。
为了预防或治疗疾病,抗人OX40激动性抗体和/或抗血管发生剂(当单独或与一种或多种其它别的治疗剂组合使用时)的适宜剂量会取决于要治疗的疾病的类型,抗体的类型,疾病的严重性和病程,施用抗体是预防还是治疗目的,之前的疗法,患者的临床史和对抗体的响应,及主治医师的斟酌。抗体适合于在一次或一系列的治疗中施用于患者。根据疾病的类型和严重性,约1μg/kg至40mg/kg的抗体可以作为初始候选剂量施用于患者,无论是例如通过一次或多次分开的施用或者是通过连续输注。根据上文所述因素,一种典型的日剂量可以在约1μg/kg至100mg/kg或更多的范围中。对于几天或更长时间上的重复施用,根据状况,治疗通常会持续直至疾病症状发生期望的阻抑。此类剂量可间歇施用,例如每周或每三周(例如使得患者接受约2至约20剂,或例如约6剂抗体)。可以施用较高的初始加载剂,接着是较低的一或多剂。然而,其它剂量方案可能是有用的。此疗法的进展易于通过常规技术和测定法来监测。
应当理解,可以使用本发明的免疫缀合物代替或补充抗人OX40激动性抗体和/或抗血管发生剂来实施任何上述配制剂或治疗性方法。
下文提供抗VEGF抗体的例示性剂量。本领域技术人员会领会,这些剂量仅仅是例示性的且基于单独的抗VEGF抗体的剂量给药。当然,本文中关于单独的抗VEGF抗体治疗描述的剂量给药和/或施用实践在与OX40结合激动剂治疗组合时可以进行修改。在一些实施方案中,在抗血管发生剂(例如抗VEGF抗体)之前,与抗血管发生剂同时,或在抗血管发生剂之后施用OX40结合激动剂。
为了预防或治疗癌症,VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗),抗人OX40激动性抗体,和/或化疗剂的剂量会取决于要治疗的癌症的类型(如上文定义的),癌症的严重性和病程,施用抗体是预防还是治疗目的,之前的疗法,患者的临床史和对药物的响应,及主治医师的斟酌。在一个实施方案中,以每两周一次给予5mg/kg体重,每两周一次给予10mg/kg体重,每三周一次给予7.5mg/kg体重,或每三周一次给予15mg/kg体重施用VEGF拮抗剂(例如贝伐珠单抗)。
关于用贝伐珠单抗治疗结直肠癌,依照EMEA的优选剂量为每两周一次给予5mg/kg或10mg/kg体重或每三周一次给予7.5mg/kg或15mg/kg体重。至于治疗NSCLC,优选剂量为每三周一次通过输注给予15mg/kg,与卡铂和帕利他赛组合。至于治疗肾细胞癌,优选剂量为每两周一次通过输注给予10mg/kg,伴有干扰素α-2a或作为单一疗法。至于治疗宫颈癌,优选剂量为每三周一次通过输注给予15mg/kg并与下述化疗方案之一组合施用:帕利他赛和顺铂或帕利他赛和托泊替康。至于治疗成胶质细胞瘤,优选剂量为每两周一次通过输注给予10mg/kg。
在一些实施方案中,施用固定剂量的VEGF拮抗剂。本文中的治疗剂的“固定”或“平坦”剂量指不管患者的重量(WT)或体表面积(BSA)施用于人患者的剂量。因此,固定或平坦剂量不是以mg/kg剂量或mg/m2剂量,而是以治疗剂的绝对量提供的。可以一次性或在一系列治疗里对患者适当施用固定剂量。在施用固定剂量的情况中,优选地,它在约20mg至约2000mg抑制剂的范围中。例如,固定剂量可以是大约420mg,大约525mg,大约840mg,或大约1050mg抑制剂(例如抗VEGF抗体,诸如贝伐珠单抗)。在施用一系列剂量的情况中,这些可以例如大约每周,大约每2周,大约每3周,或大约每4周,但是优选大约每3周施用。例如,可以继续施用固定剂量,直至疾病进展,不利事件,或由内科医生确定的其它时间。例如,可以施用自约2,3,或4直至约17或更多个固定剂量。
对需要此类治疗或医学干预的患者施用血管发生抑制剂,例如抗VEGF抗体,诸如贝伐珠单抗,和/或包含血管发生抑制剂,例如抗VEGF抗体,诸如贝伐珠单抗的药物组合物/治疗方案可以通过本领域已知的适合于施用治疗性抗体的任何手段来进行。非限制性施用路径包括通过口服,静脉内,腹膜内,皮下,肌肉内,表面,皮内,鼻内或支气管内施用(例如如通过吸入实现的)。在本发明的语境中特别优选的是胃肠外施用,例如静脉内施用。若VEGF拮抗剂作为“单一抗肿瘤剂”施用,则它是唯一施用来治疗癌症的抗肿瘤剂,即它不与另一抗肿瘤剂,诸如化疗或OX40结合激动剂组合施用。
在一个实施方案中,施用一个或多个加载剂量(loading dose)的VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗),接着是一个或多个维持剂量(maintenance dose)。“加载”剂量在本文中一般包含对患者施用的治疗剂的初始剂量,并且接着是一个或多个其维持剂量。一般地,施用一个加载剂量,但是本文中涵盖多个加载剂量。通常,施用的加载剂量的量超过施用的维持剂量的量和/或比维持剂量更频繁施用加载剂量,从而比用维持剂量可以实现的治疗剂的期望稳态浓度更早地实现治疗剂的期望稳态浓度。“维持”剂量或“延伸”剂量在本文中指在治疗期里对患者施用的一剂或多剂治疗剂。通常,以间隔的治疗间隔(诸如大约每周,大约每2周,大约每3周,大或约每4周)施用维持剂量。在另一个实施方案中,对患者施用多个相同的剂量。依照本发明的一个优选实施方案,施用一剂大约840mg(加载剂量)固定剂量的VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗),接着是一剂或多剂大约420mg(维持剂量)的拮抗剂。优选每3周施用维持剂量,总共至少2剂,直至17剂或更多剂。
依照本发明的另一个优选实施方案,施用一剂或多剂固定剂量大约1050mg VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗),例如每3周。依照这个实施方案,施用1剂,2剂或更多剂固定剂量,例如直至1年(17个周期),而且视需要可以更久。
在另一个实施方案中,施用一剂固定剂量大约1050mg VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)作为加载剂量,接着是一剂或多剂维持剂量大约525mg。依照这个实施方案每3周对患者施用约1剂,2剂,或更多剂维持剂量。
虽然VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体或化疗剂可以联合施用,但是任选用抑制剂(或化疗剂)和一种或多种(别的)化疗剂的组合治疗患者。本文中的例示性化疗剂包括:吉西他滨,卡铂,奥沙利铂,伊立替康,氟尿嘧啶(例如5-FU),帕利他赛(例如nab-paclitaxel),多西他赛,托泊替康,卡培他滨,替莫唑胺,干扰素-α,和/或脂质体多柔比星(例如PEG化脂质体多柔比星)。在一些实施方案中,化疗剂中至少一种是卡铂或帕利他赛。在一些实施方案中,化疗剂中至少一种是卡铂或吉西他滨。组合施用包括使用分开的配制剂或单一的药用配制剂的共施用或同时施用,及任一次序的连续施用,其中优选有一段时间所有活性剂同时发挥其生物学活性。如此,可以在施用VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)之前,或之后施用化疗剂。在这个实施方案中,化疗剂的至少一次施用与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)的至少一次施用间的时机优选是大约1个月或更小,且最优选地大约2周或更小。或者,可以以单一的配制剂或分开的配制剂对患者并行施用化疗剂和抑制剂。化疗剂(例如卡铂和/或帕利他赛)和VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)的组合治疗可以对患者产生协同或大于叠加的治疗益处。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于卵巢癌的疗法)的化疗剂包括:化疗剂,诸如铂化合物(例如卡铂),紫杉醇,诸如帕利他赛或多西他赛,托泊替康,或脂质体多柔比星。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于晚期上皮卵巢癌,输卵管癌,或原发性腹膜癌的疗法)的化疗剂包括:化疗剂,诸如卡铂,帕利他赛,和/或吉西他滨。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于铂敏感性上皮卵巢癌,输卵管癌,或原发性腹膜癌的疗法)的化疗剂包括:化疗剂,诸如卡铂和吉西他滨。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于铂抗性复发性上皮卵巢癌,输卵管癌,或原发性腹膜癌的疗法)的化疗剂包括:化疗剂,诸如帕利他赛,托泊替康,或PEG化脂质体多柔比星。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于乳腺癌的疗法)的化疗剂包括:化疗剂,诸如卡培他滨,和紫杉醇,诸如帕利他赛(例如nab-paclitaxel)或多西他赛。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于成胶质细胞瘤的疗法)的化疗剂包括:化疗剂,诸如替莫唑胺,任选与放射疗法组合。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于结直肠癌的疗法)的化疗剂包括:化疗剂,诸如氟尿嘧啶(例如5-FU),帕利他赛,顺铂,托泊替康,伊立替康,氟尿嘧啶-奥沙利铂,氟尿嘧啶-伊立替康,FOLFOX4(5-FU,亚叶酸,奥沙利铂),和IFL(伊立替康,5-FU,亚叶酸)。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于肾细胞癌的疗法)的化疗剂包括:化疗剂,诸如干扰素-α2a。
特别期望用于与VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)和/或抗人OX40激动性抗体组合(例如用于宫颈癌的疗法)的化疗剂包括:化疗剂,诸如帕利他赛,顺铂,托泊替康,帕利他赛与顺铂组合,和帕利他赛与托泊替康组合。
如果施用的话,化疗剂通常以其已知剂量施用,或者任选由于药物的联合作用或者由于施用化疗剂造成的不良副作用而降低。可依照制造商的说明书使用此类化疗剂的制剂和剂量给药时间表,或者由熟练从业人员凭经验确定。若化疗剂是帕利他赛,优选的是,例如每三周一次在3小时里以约130mg/m2至200mg/m2之间(例如大约175mg/m2)的剂量给药。若化疗剂是卡铂,优选的是,通过使用基于患者现有肾功能或肾功能和期望的血小板最低值的Calvert公式计算卡铂剂量来进行施用。肾排泄是卡铂消除的主要路径。与基于体表面积的经验剂量计算相比,使用这种剂量公式容许补偿患者在治疗前肾功能方面的差异,该差异在其它情况中可导致剂量过低(在具有平均以上肾功能的患者中)或剂量过高(在具有受损肾功能的患者中)。使用单一药剂卡铂的目标AUC 4-6mg/mL/min看来在先前接受过治疗的患者中提供最适宜的剂量范围。
在VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗),抗人OX40激动性抗体和化疗剂之外,还可组合其它治疗方案。例如,可施用第二(第三,第四,等)化疗剂,其中第二化疗剂或是抗代谢物化疗剂,或是非抗代谢物的化疗剂。例如,第二化疗剂可以是紫杉烷(诸如帕利他赛或多西他赛),卡培他滨,或基于铂的化疗剂(诸如卡铂,顺铂,或奥沙利铂),蒽环类抗生素(诸如多柔比星,包括脂质体多柔比星),托泊替康,培美曲塞,长春花生物碱类(诸如长春瑞滨),和TLK 286。可以施用不同化疗剂的“鸡尾酒”。
任何上述共施用药剂的合适剂量就是那些目前所使用的剂量,而且可以由于该药剂与抑制剂的联合作用(协同性)而降低。在上述治疗方案之外,还可对患者进行手术去除肿瘤和/或癌细胞和/或放射疗法。
若VEGF拮抗剂是抗体(例如贝伐珠单抗),优选的是,所施用的抗体是裸抗体。所施用的VEGF拮抗剂(例如抗VEGF抗体,诸如贝伐珠单抗)可以与细胞毒剂缀合。优选的是,所缀合的和/或其结合的抗原受到细胞的内在化,导致该缀合物杀伤其所结合的癌细胞的治疗功效提高。在一个优选的实施方案中,细胞毒剂靶向或干扰癌细胞中的核酸。此类细胞毒剂的例子包括美登木素生物碱类(maytansinoids),加利车霉素(calicheamicin),核糖核酸酶,和DNA内切核酸酶。
VI.制品或试剂盒
在本发明的另一方面,提供了一种制品或试剂盒,其含有可用于治疗,预防和/或诊断上文描述的病症的材料。制品或试剂盒包含容器和容器上或与容器联合的标签或包装插页。合适的容器包括例如瓶,管形瓶,注射器,IV溶液袋,等。容器可以自多种材料诸如玻璃或塑料形成。容器容纳单独或与另一种组合物组合有效治疗,预防和/或诊断状况的组合物,并且可以具有无菌存取口(例如,容器可以是具有由皮下注射针可刺穿的塞子的管形瓶或静脉内溶液袋)。组合物中的至少一种活性剂是本发明的抗体(例如本公开文本的抗人OX40激动性抗体或本公开文本的抗血管发生抗体,诸如抗VEGF抗体)。标签或包装插页指示使用组合物来治疗选择的状况。此外,制品或试剂盒可以包含(a)其中装有组合物的第一容器,其中组合物包含本发明的抗体;和(b)其中装有组合物的第二容器,其中组合物包含别的细胞毒性或其它方面治疗性的药剂。本发明的此实施方案中的制品可以进一步包含包装插页,其指示可以使用组合物来治疗特定的状况。或者/另外,制品或试剂盒可以进一步包含第二(或第三)容器,其包含药学可接受缓冲液,诸如抑菌性注射用水(BWFI),磷酸盐缓冲盐水,Ringer氏溶液和右旋糖溶液。它可以进一步包含从商业和用户观点看期望的其它材料,包括其它缓冲剂,稀释剂,滤器,针,和注射器。
在一些实施方案中,本文中提供的是一种试剂盒,其包含包含抗血管发生剂和任选的药学可接受载剂的药物,和包含说明书的包装插页,该说明书关于与包含OX40结合激动剂和任选的药学可接受载剂的组合物组合施用该药物用于在个体中治疗癌症或延迟癌症进展。本文中进一步提供的是一种试剂盒,其包含包含抗血管发生剂和任选的药学可接受载剂的第一药物,和包含OX40结合激动剂和任选的药学可接受载剂的第二药物。在一些实施方案中,该试剂盒进一步包含包含说明书的包装插页,该说明书关于施用该第一药物和该第二药物用于在个体中治疗癌症或延迟癌症进展。本文中仍然进一步提供的是一种试剂盒,其包含包含OX40结合激动剂和任选的药学可接受载剂的药物,和包含说明书的包装插页,该说明书关于与包含抗血管发生剂和任选的药学可接受载剂的组合物组合施用该药物用于在个体中治疗癌症或延迟癌症进展。
应当理解,任何上述制品可包括本发明的免疫缀合物来代替或补充抗OX40抗体和/或抗血管发生剂。
认为本说明书足以使得本领域技术人员实施本发明。根据上述描述,在本文所示和所述之外对本发明的各种更改对本领域技术人员会变得显然,且落在所附权利要求的范围之内。通过述及将本文中引用的所有出版物,专利,和专利申请完整收入本文,用于所有目的。
实施例
通过参考下述实施例,会更加全面地理解本发明。然而,它们不应解释为限制本发明的范围。要理解,本文中描述的实施例和实施方案只是出于例示目的,而且根据它们,本领域技术人员会想到各种变更和变化,而且它们被包括在本申请的精神和范围及所附权利要求的范围内。
实施例1:组合抗VEGF+抗OX40处理展现出比单一药剂处理更大的功效
组合癌症治疗的不同模态可对肿瘤生长导致有益效果。如下文描述的,与抗GP120(对照)处理的小鼠相比,抗VEGF处理导致降低的肿瘤生长。单独的抗OX40处理展现出很少的活性。令人惊讶地,虽然它自身的抗肿瘤活性很小,但是与单一药剂施用或抗GP120处理相比,与抗VEGF处理组合的抗OX40处理表现出卓越的肿瘤生长抑制。不希望受理论束缚,假设对组合抗VEGF+抗OX40处理观察到的活性协同增强可能是由于由抗VEGF处理诱导的升高的肿瘤内树突细胞激活。
本文中描述的结果提示顺序抗OX40处理与抗VEGF施用可提示疗法。例如,不希望受理论束缚,先施用抗VEGF(由此增强树突细胞激活),接着是抗OX40疗法,可能比处理的共施用更加有效。然而,可能的是抗VEGF处理的抗血管发生效果可消减血管系统,由此限制白细胞浸润。因此,不希望受理论束缚,在抗VEGF处理之前施用抗OX40可能是更加有益的。
材料和方法
CT26小鼠肿瘤模型
给6周龄雌性Balb/C小鼠在右后体侧中皮下接种含有1X105个CT26肿瘤细胞的100μl HBSS+matrigel(依照制造商的说明书)。容许肿瘤生长约2周。将小鼠分入4个不同实验分支,每个分支10只小鼠。选择组,它们具有相似的肿瘤体积平均值,肿瘤体积范围为100-300mm3。
小鼠接受0.1mg/kg抗OX40或同种型对照抗GP120(阴性对照)。抗OX40抗体是克隆OX-86小鼠-IgG2(通过将大鼠抗小鼠OX40激动性抗体OX-86克隆到小鼠IgG2主链上生成)。在第1天静脉内施用抗体,接着是一周三次腹膜内(i.p.)0.1mg/kg相同抗体,持续3周的总处理持续时间。这些相同处理组还一周两次i.p.接受5mg/kg抗VEGFA(B20)或同种型对照抗GP120(阴性对照),持续3周,在第1天开始。
将抗体用无菌PBS稀释至期望浓度并以100或200μl体积施用。在实验持续期间定期用测径器测量肿瘤体积。当1)小鼠变成垂死,2)肿瘤变成溃烂,或3)肿瘤体积超过2000mm3时,对小鼠处以安乐死并退出实验。
流式细胞术
对自用抗VEGF或抗GP120(对照)处理的小鼠收集的CT26肿瘤进行酶促消化以取得单细胞悬浮液。随后,将这些细胞使用针对CD45,CD11b,CD11c,F4/80(用于排除巨噬细胞),Gr1(用于排除嗜中性粒细胞和粒细胞性髓样细胞),MHC-II,OX40L,和PD-L1的抗体的混合物染色以进行流式细胞术。使用Fixable Viability Dye780自流式细胞术分析排除死细胞。髓样树突细胞以CD45+CD11b+Gr1-F4/80-CD11c+MHCII+来定义和门控。非髓样树突细胞以CD45+CD11b-Gr1-F4/80-CD11c+MHCII+来定义和门控。使用下述抗体:PeCy7缀合的抗MHC-II(Biolegend),BV421缀合的抗PD-L1(Biolegend),和PE缀合的OX-40L,通过流式细胞术均值荧光强度量化功能性标志物MHCII,PD-L1,和OX40L的表达。
结果
为了测定抗OX40和抗VEGF的组合处理对肿瘤生长的影响,使用小鼠CT26肿瘤模型。图1显示与抗GP120阴性对照施用相比,抗VEGF处理加同种型对照抑制肿瘤生长。与之对比,在这个实验中,与抗GP120阴性对照施用相比,抗OX40加同种型对照没有提供肿瘤生长抑制。这与利用相同抗体的其它实验和观察到肿瘤生长抑制的实验性肿瘤模型不一致。不希望受理论束缚,抗OX40处理为什么在这个实验中没有起作用的解释是这个组中的平均起始肿瘤体积更大且CT26肿瘤模型中的抗OX40功效受到肿瘤大小显著影响,尤其当肿瘤大于200mm3时。认为CT26肿瘤模型中的抗OX40功效可能受到肿瘤大小负面影响。图1还显示组合抗VEGF和抗OX40处理显示出胜过单独的抗VEGF或抗OX40的卓越功效。
图2提供小鼠个体的肿瘤体积测量。这些数据进一步显示组合抗VEGF和抗OX40处理胜过单独的抗VEGF或抗OX40的卓越功效。与接受对照处理的小鼠中的肿瘤生长相比,接受VEGF处理的小鼠经历53%肿瘤生长抑制。单独的抗OX40处理导致肿瘤生长超出对照处理30%。与之对比,组合抗VEGF加抗OX40处理导致与对照处理相比显著的94%肿瘤生长抑制。在这个处理组中,10只小鼠中的9只展现出肿瘤停滞或消退。这些结果证明组合抗VEGF和抗OX40处理与每一种单一处理或对照处理相比的卓越和协同效果。
接着,在CT26肿瘤模型中测试了抗VEGF处理对肿瘤内树突细胞激活的影响。首先,在图3A中,测定了肿瘤内髓样树突细胞。在CD45+CD11b+Gr1-F4/80-CD11c+MHCII+髓样树突细胞中,通过量化每一种分子的均值荧光强度测定MHC II类,OX40L,和PD-L1的表达丰度。发现来自抗VEGF处理的小鼠的髓样树突细胞具有与来自抗GP120(对照)处理的小鼠的细胞相比更高的MHC II(p=0.002)和OX40L(p=0.003)表达。T细胞应答的负调节物PD-L1表达在这两个组之间在统计学上不可区分(p=0.81)。这些结果提示与对照处理相比,抗VEGF处理促进肿瘤树突细胞成熟。升高的MHC II类和OX40L表达使得树突细胞能够更加有效地呈递抗原和引发T细胞。
图3B显示抗VEGF处理对非髓样肿瘤内树突细胞激活的影响。在CD45+CD11b-Gr1-F4/80-CD11c+MHCII+非髓样树突细胞中,通过量化每一种分子的均值荧光强度测定了MHC II类,以及PD-L1和OX40L的表达。与髓样树突细胞类似,非髓样树突细胞在用抗VEGF处理时也表达与对照处理相比显著更高水平的MHC II(p=0.03)和OX40L(p=0.002)。
这些结果提示抗VEGF处理能改善肿瘤树突细胞的功能性表型,即能导致抗肿瘤T细胞应答增强的现象。因而,组合抗VEGF处理与靶向T细胞的免疫治疗剂(例如抗OX40)可协同性加强抗肿瘤应答。
- 还没有人留言评论。精彩留言会获得点赞!