治疗多种疾病的化学消融和方法与流程
本申请要求2014年10月30日提交的美国临时专利申请号62/122,818和2015年1月5日提交的美国临时专利申请号62/124,868的优先权,其每一篇的内容通过提述并入此处。
本发明的实施方案涉及治疗高血压、肺动脉高压、糖尿病、肥胖症、心力衰竭、终末期肾病、消化性疾病、癌症、肿瘤、疼痛、哮喘或慢性阻塞性肺病(copd)的化学输注装置、制剂和方法。所述装置可包括气囊和输注导管的组合以及其他递送装置。所述制剂可包含一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。所述方法涉及通过化学输注将所述制剂递送至人体中的靶向组织。
高血压(hypertension)或高血压(highbloodpressure)是全球重大健康问题。世界上估计有30-40%的成人群体患有该病况。此外,预期其流行程度将有所增加,特别是在发展中国家。高血压的诊断和治疗仍是次优的,且大多患者都难以合理控制血压。
良性前列腺增生症是前列腺的非癌性增大,其影响大于50%百分比的年龄超过60岁的男性。在生命的早期,前列腺大约为核桃大小,重约20克。随着时间的推移,前列腺增大被认为是正常的。随着年龄的增长,前列腺逐渐增加至其原来大小的至少两倍。前列腺生长对邻近的尿道造成压力,导致后一种器官窄化,且最终导致尿路阻塞,使排尿困难。
慢性阻塞性肺病(copd)与两种主要的气流阻塞病症相关:慢性支气管炎和肺气肿。慢性支气管炎是由支气管气道炎症引起的。支气管气道将气管与肺连接。肺气肿是一种由肺泡过度膨胀或肺部气囊导致的疾病。该病况引起呼吸短促。约有1600万美国人患有copd,其中大多数(80-90%)是终身吸烟者。copd是美国的主要死亡原因。
哮喘是一种慢性呼吸性疾病,其特征在于气道过度窄化,且由气道炎症、多余粘液的生成和气道反应过度引起。该气道窄化使呼吸困难,并可以显著影响患者的生活,限制参与众多活动。在严重的情况下,哮喘发作可能危及生命。迄今为止,没有已知的治愈哮喘的方法。
慢性鼻窦炎(cs)是由一个或多个鼻旁窦中的膜内衬(membranelining)炎症引起的,且通常与显著的组织损伤有关。每年向疾病控制和预防中心(cdc)报告的cs约3700万例。
糖尿病是一种代谢病况,或病况的组合,其中个体经历高血糖浓度。该病况是由体内胰岛素产生不足或细胞不能适当响应胰岛素导致的。糖化血红蛋白(hba1c)作为血浆葡萄糖浓度的标记物发挥作用,且临床上用于诊断糖尿病。在人中,正常hba1c水平通常<6.0%,糖尿病前期(prediabetes)的hba1c水平范围为6.0-6.4%,且糖尿病的hba1c水平超过6.5%。
在美国和其他发达国家,糖尿病是死亡和残疾的主要原因之一。它与影响机体几乎每一部分的长期并发症相关。例如,它与失明、心脏和血管疾病、中风、肾衰竭、截肢和神经损伤有关。
在美国,糖尿病影响了大约8%的人口,且导致接近2500亿美元的开销。
糖尿病通常分为1型(也称为胰岛素依赖型糖尿病或青少年糖尿病)、2型(也称为非胰岛素依赖型糖尿病,成人发病型糖尿病或肥胖相关型糖尿病)或妊娠糖尿病,其中1型患者不能产生足够的胰岛素,2型患者不能对胰岛素适当响应,妊娠糖尿病是在妊娠女性晚期发展出的病况。
2型糖尿病是糖尿病最常见的形式,占总体病例的90-95%。其通常与老年、肥胖、家族史、之前的妊娠糖尿病史和不活跃的身体活动相关。其在某些种族中也更加普遍。2型糖尿病也称为胰岛素抗性糖尿病,因为胰腺通常产生足够量的胰岛素,但身体不能适当响应它。与2型糖尿病相关的症状包括疲劳、排尿频繁、增加的口渴和饥饿、体重丧失、视力模糊和伤口或疮愈合缓慢。
肥胖是另一重大健康问题,特别是在发达国家。它是一种复杂、多因素和慢性的病况,其特征在于过量的身体脂肪,这是由能量消耗与热量摄取之间的不平衡引起的。虽然这种不平衡的原因尚未完全了解,但遗传和/或获得性生理事件和环境因素被认为是有贡献的。与肥胖并且特别是病态肥胖有关的不良健康影响近年来已更加确凿。这种不良反应包括但不限于心血管疾病、糖尿病、高血压、关节炎和睡眠呼吸暂停。一般而言,随患者体重指数(bmi)升高,罹患与肥胖相关的不良作用的可能性也升高。
本发明提供用于治疗高血压、糖尿病、肥胖、心力衰竭、终末期肾病、消化系统疾病、泌尿系统疾病、癌症、肿瘤、疼痛、哮喘和慢性阻塞性肺病(copd)的新的装置和方法。所述新方法涉及化学输注制剂和递送系统及策略。该方法聚焦在将制剂递送至人体中的患病组织且可改进治疗的安全性和效力。
本发明的实施方案涉及通过将有效量的制剂递送至患病组织进行的针对高血压、糖尿病、肥胖、心力衰竭、终末期肾病、消化系统疾病、癌症、肿瘤、疼痛、哮喘和慢性阻塞性肺疾病(copd)的治疗。这种制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。方法涉及将制剂可控递送至人体内的管腔表面和组织,使得那些区域得以修饰。这些方法可导致体腔中神经和神经末梢的去神经支配。所述方法还可包括神经和神经末梢的有利切断进而中断神经交流。温度可以增强治疗制剂的安全性和效力。温度的范围可以是-40至140℃、-30至100℃或-30至80℃。在一些实施方案中,制剂包含二元、三元或四元组分之一,且可包含多于四种组分。递送方法包括侵入性较小的经皮方式和非侵入性方式。本发明的实施方案提供制剂和递送导管,其增强进入机体组织和管腔神经及神经末梢的吸收和穿透。
在一个实施方案中,制剂的至少一种成分选自:水、盐水、高渗盐水、酚类、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯、尿素、碘油、表面活性剂,及其衍生物和组合。
在一个实施方案中,至少一种制剂成分是气体。所述气体包括下述之一:氧气、氮气、氦气、氩气、空气、二氧化碳、一氧化氮、有机和无机化合物的蒸气、水、苯酚、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯,及其衍生物和组合。
在一个实施方案中,制剂的至少一种成分是表面活性剂。所述表面活性剂包括peg月桂酸酯、吐温20、吐温40、吐温60、吐温80、peg油酸酯、peg硬脂酸酯、peg月桂酸甘油酯、peg甘油油酸酯、peg甘油硬脂酸酯、聚甘油月桂酸酯、聚甘油油酸酯、聚甘油肉豆蔻酸酯、聚甘油棕榈酸酯、聚甘油-6月桂酸酯、聚甘油-6油酸酯、聚甘油-6肉豆蔻酸酯、聚甘油-6棕榈酸酯、聚甘油-10月桂酸酯、聚甘油-10油酸酯、聚甘油-10肉豆蔻酸酯、聚甘油-10棕榈酸酯、peg脱水山梨醇单月桂酸酯、peg脱水山梨醇单月桂酸酯、peg脱水山梨醇单油酸酯、peg脱水山梨糖醇硬脂酸酯、peg油基醚、peg月桂醚、有机酸、任何有机酸和有机胺的盐、聚缩水甘油、甘油、多甘油、半乳糖醇、二(乙二醇)、三(乙二醇)、四(乙二醇)、五(乙二醇)、聚(乙二醇)低聚物、二(丙二醇)、三(丙二醇)、四(丙二醇)、五(丙二醇)、聚(丙二醇)低聚物、聚乙二醇和聚丙二醇的嵌段共聚物、pluronic、pluronic85及其衍生物和组合。
在一个实施方案中,制剂至少包括油、脂肪酸和/或脂质。在一些实施方案中,制剂中的至少的油、脂肪酸和/或脂质选自丁酸(butanoicacid)、己酸(hexanoicacid)、辛酸(octanoicacid)、癸酸(decanoicacid)、十二烷酸、十四烷酸、十六烷酸、十八烷酸、十八碳三烯酸、二十烷酸、二十碳烯酸、二十碳四烯酸、二十碳五烯酸、二十二碳六烯酸、生育三烯酚、丁酸(butyricacid)、己酸(caproicacid)、辛酸(caprylicacid)、癸酸(lauricacid)、月桂酸、肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、油酸、异烟酸、亚油酸、α-亚麻酸、γ-亚麻酸、山萮酸、芥酸、二十四碳酸、天然或合成磷脂、单-、二-或三酰基甘油、心磷脂、磷脂酰甘油、磷脂酸、磷脂酰胆碱、α-生育酚、磷脂酰乙醇胺、鞘磷脂、磷脂酰丝氨酸、磷脂酰肌醇、二肉豆蔻酰磷脂酰胆碱、二油酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、鞘脂、前列腺素、神经节苷脂、neobee、泡囊(niosome)及其衍生物。
在另一实施方案中,制剂包括用于神经的去神经支配的治疗剂或药物。所述治疗剂包括下述之一:钠通道阻断剂、河豚毒素(tetrodotoxin)、海藻毒素(saxitoxin)、脱氨基甲酰海藻毒素、香草素(vanilloid)、新石房蛤毒素(neosaxitoxin)、利多卡因、芋螺毒素(conotoxin)、强心苷(cardiacglycoside)、地高辛、谷氨酸、星形孢菌素(staurosporine)、氨氯地平(amlodipine)、维拉帕米(verapamil)、磁麻苷(cymarin)、洋地黄毒苷(digitoxin)、海葱次苷(proscillaridin)、quabain、藜芦定(veratridine)、软骨藻酸(domoicacid)、乙醇、夹竹桃苷(oleandrin)、卡马西平(carbamazepine)、黄曲霉毒素(aflatoxin)、胍乙啶(guanethidine)和硫酸胍乙啶。在另一实施方案中,所述制剂包括用于对神经的去神经支配成像的造影剂。这样的造影剂包括下述之一:碘、乙基碘、碘化钠、碘油、壬苯醇醚碘、碘比醇、碘海醇、碘美普尔、碘帕醇、碘喷托、碘普胺、碘佛醇、碘昔兰、碘曲仑、碘克沙醇或碘克酸及其衍生物。
在一个实施方案中,所述制剂包含共沸物。共沸物是不能通过简单蒸馏改变的两种或多种成分的混合物。其发生是由于沸腾时产生的蒸气具有与原始混合物成比例的组分。潜在的制剂共沸物包括乙醇/水、乙醇/水/造影剂、乙醇/水/表面活性剂、乙醇/水/造影剂/表面活性剂、丙醇/水、异丙醇/水、丁醇/水、乙酸/水及其组合。
在一个实施方案中,制剂呈气体或蒸气状态且包含一种或多种成分。蒸气或气体制剂可包括下述之一:氧气、氮气、氦气、氩气、空气、二氧化碳、一氧化氮、水、苯酚、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯及其混合物。在一个实施方案中,蒸气制剂包括下述二元、三元或四元组分之一,且可包含多于四种组分。蒸气制剂可包括共沸物或造影剂,如碘油或碘,且可包括表面活性剂和/或治疗剂。蒸气制剂升高的温度范围可为0℃至140℃、15℃至100℃或20℃至85℃。
在一个实施方案中,所述制剂呈液态且包括一种或多种成分。液体制剂可包括下述之一:水、盐水、高渗盐水、苯酚、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、碘油、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯、尿素、表面活性剂和其他。液体制剂可包括共沸物、造影剂和/或治疗剂。在一个实施方案中,制剂可包括二元、三元或四元组分之一,且还可包括多于四种组分。在一些实施方案中,液体制剂的温度范围可以为-40℃至140℃、-30℃至100℃或-20℃至80℃。液体制剂可包括溶液、悬浮液和乳液。
在一个实施方案中,用于治疗疾病的方法包括将递送导管经皮和/或经口插入人体中的患病组织;使用所述导管以将治疗制剂输注进入人的机体的组织,其中递送的所述制剂的量可如例如通过降低血压、减少葡萄糖水平和减轻呼吸短促有效损伤或破坏所述组织;任选去除所述制剂;和最终从机体撤回递送导管。该治疗针对的疾病包括下述之一:高血压、肺动脉高压、糖尿病、肥胖症、心力衰竭、终末期肾病、消化性疾病、癌症、肿瘤、疼痛、哮喘或慢性阻塞性肺病(copd)。适用于该治疗的体腔包括肾动脉和静脉、肺动脉、血管腔、腹腔动脉、常见和适当的肝动脉、胃十二指肠动脉、左右肝动脉、脾动脉、左右胃动脉、非血管腔、气道、窦道、食管、呼吸腔、消化腔、胃、十二指肠、空肠、癌症、肿瘤、疼痛和泌尿腔。适于该治疗的消化腔包括食管、胃、十二指肠、空肠、小肠和大肠和结肠。适于该治疗的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果所述制剂包含一种或多种成分的蒸气,可通过在组织中将蒸气冷凝成为液体生成热。如果制剂包含液体或溶液,冷却或热可从低于或超过体温的制剂温度生成。液体制剂温度的范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。在一个实施方案中,制剂温度可等于室温。在一个实施方案中,制剂温度的范围可为-40℃至-20℃。在另一实施方案中,制剂温度的范围可为15℃至80℃。在一个实施方案中,制剂温度可等于体温。在另一实施方案中,制剂温度的范围可为50℃至80℃。在另一实施方案中,经治疗的组织的温度可低于制剂温度并高于体温。经治疗的组织的温度的范围可为-40℃至100℃、-30℃至80℃或-20℃至80℃。在一个实施方案中,经治疗的组织的温度的范围可为-40℃至-20℃。在另一实施方案中,经治疗的组织的温度的范围可为15℃至80℃。在一个实施方案中,经治疗的组织的温度可等于体温。在另一实施方案中,经治疗的组织的温度的范围可为50至80℃。适于这种治疗的递送导管包括成像导向下的针或基于针的导管。成像导向包括超声、x-射线、ct扫描、mri、oct或观察器(scope)之一。递送导管还可以是基于气囊的。这种基于气囊的导管可具有单、双或三气囊。递送导管还可以是基于输注的。气囊和输注导管的组合也可在操作中使用。在一个实施方案中,所述方法包括从导管远端尖端样线管腔(catheterdistaltiplikewirelumen)冲洗以保护并稀释迁移的化学品,并防止失控的化学品进入未治疗区域的远端部分;从输注导管冲洗;从内窥镜冲洗;治疗后从机体组织和管腔去除或撤回制剂并在治疗后使用盐水冲洗靶区域。
可以理解的是,上文的一般性描述和下文的详细说明是示例性的且仅出于解释目的,且并不限制如本发明要求保护的内容。
附图简述
图1是根据本发明的双气囊递送导管的透视图的示例性实施方案。
图2是膨胀的哑铃气囊的远端部分的侧视图的实施方案。
图3a是在气囊壁上具有用于化学剂递送的孔的输注气囊的侧视图的实施方案。
图3b是定位于具有膨胀气囊的体腔中的化学剂递送系统的侧视图的实施方案,化学剂主要局限于两个大直径区段之间。
图4a是具有与气囊附接的化学剂递送管的输注装置的侧视图的实施方案。
图4b是具有从较大到较小的直径的锥形过渡的哑铃气囊输注装置的侧视图的实施方案,以及附接的化学剂递送管。
图5a是证明使用单气囊递送导管将制剂输注进入气道的实施方案。
图5b是证明使用双气囊递送导管将制剂输注进入气道的实施方案。
图5c是证明使用双气囊递送导管将制剂输注进入肾动脉的实施方案。
图6是体腔中双气囊递送导管的局部横断面视图的实施方案。
图7是具有膨胀腔和作用剂递送腔的多腔轴上的三气囊的局部横断面视图的实施方案。
图8a是在膨胀状态中两较大直径气囊间具有减少的未占用空间的三气囊组合输注装置的局部横断面视图的实施方案。
图8b是具有用于气囊在轴上的附接的不同的气囊腰定向的三气囊输注装置的局部横断面视图的实施方案。
图9a是在气囊间具有输注端口的膨胀的双气囊输注装置的局部横断面视图的实施方案。
图9b是具有锥形直径变化和在双气囊的中间部分中的较小直径的膨胀的双气囊输注装置的局部横断面视图的实施方案。
图9c是具有组合的两阶段气囊和在双气囊组件的中间部分中的较小直径的可膨胀的双气囊输注装置的局部横断面视图的实施方案。
图10a是使用单气囊递送导管将制剂输注至左胃动脉的实施方案。
图10b是使用单气囊递送导管将制剂输注至肝动脉的实施方案。
图11是使用三气囊递送导管将制剂输注至十二指肠的实施方案。
图12是证明在乙醇-vs.对照治疗组中肾去神经支配后去甲肾上腺素(ne)减少的条形图。
图13是证明使用乙酸剂治疗十二指肠后重量变化的曲线。
图14是证明使用乙醇剂治疗十二指肠后重量变化的曲线。
图15是具有巴德三角特征(bardtrianglefeature)的金属输注管的实施方案(如通过白色箭头所示)。
图16是证明乙醇治疗后切断肾神经的组织病理学图像(如通过黑色箭头所示)。
说明
本发明的实施方案通过将有效量的制剂递送至体腔中的靶组织针对疾病的治疗。所述疾病可以是下述之一:高血压、肺动脉高压、糖尿病、肥胖症、心力衰竭、终末期肾病、消化性疾病、癌症、肿瘤、疼痛、哮喘或慢性阻塞性肺病(copd)。癌症包括肾上腺、膀胱、子宫颈、结肠、食管、胆囊、肾、肝、肺、卵巢、胰腺、前列腺、直肠、胃和子宫的癌症。制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。所述方法涉及将制剂递送至人体中的管腔表面、组织和神经进而修饰这些表面、组织和神经。所述体腔包括肾动脉和静脉、肺动脉、血管腔、腹腔动脉、肝总动脉、肝固有动脉、胃十二指肠动脉、右肝动脉、左肝动脉、脾动脉、右胃动脉、左胃动脉、血管、非血管腔、气道、窦道、食管、呼吸腔、消化腔、胃、十二指肠、空肠、癌组织、肿瘤和泌尿腔。消化腔包括食管、胃、十二指肠、空肠、小肠和大肠和结肠。温度可增强治疗制剂的安全性和效力。温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。经治疗的组织的温度可以不同于制剂温度。经治疗的组织的温度范围可为-40℃至100℃或-30℃至80℃。递送的制剂和能量的量可以有效损伤、破坏或消除患病组织,如例如通过降低血压、缩小肿瘤、缓解疼痛或缓解哮喘或copd的症状。能量或热可通过加速制剂和组织间的反应速率增强损伤/破坏/消除效果。递送的方法包括将制剂递送以消融围绕人体腔的神经。这种方法包括在治疗后从组织或管腔去除或撤回制剂。
在一个实施方案中,制剂是单化学剂或二元、三元或四元组分之一,且还可包括多于四种的组分。在一个实施方案中,递送系统可包括侵袭性较小的经皮方式或非侵袭性方式。本发明的实施方案包括含有一种或多种增强体腔的表面修饰和进入体腔的组织和神经和神经末梢的吸收和穿透的成分的制剂。
在一个实施方案中,制剂的成分选自:水、盐水、高渗盐水、苯酚、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯、尿素、碘油、表面活性剂及其衍生物和组合。
在一个实施方案中,制剂的成分包括气体。气体可选自:氧气、氮气、氦气、氩气、空气、二氧化碳、一氧化氮、有机和无机化合物的蒸气、水、苯酚、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯及其混合物。
在一个实施方案中,制剂中的成分包括表面活性剂。在一些实施方案中,表面活性剂选自:peg月桂酸酯、吐温20、吐温40、吐温60、吐温80、peg油酸酯、peg硬脂酸酯、peg月桂酸甘油酯、peg甘油油酸酯、peg甘油硬脂酸酯、聚甘油月桂酸酯、聚甘油油酸酯、聚甘油肉豆蔻酸酯、聚甘油棕榈酸酯、聚甘油-6月桂酸酯、聚甘油-6油酸酯、聚甘油-6肉豆蔻酸酯、聚甘油-6棕榈酸酯、聚甘油-10月桂酸酯、聚甘油-10油酸酯、聚甘油-10肉豆蔻酸酯、聚甘油-10棕榈酸酯、peg脱水山梨醇单月桂酸酯、peg脱水山梨醇单月桂酸酯、peg脱水山梨醇单油酸酯、peg脱水山梨糖醇硬脂酸酯、peg油基醚、peg月桂醚、有机酸、任何有机酸和有机胺的盐、聚缩水甘油、甘油、多甘油、半乳糖醇、二(乙二醇)、三(乙二醇)、四(乙二醇)、五(乙二醇)、聚(乙二醇)低聚物、二(丙二醇)、三(丙二醇)、四(丙二醇)、五(丙二醇)、聚(丙二醇)低聚物、聚乙二醇和聚丙二醇的嵌段共聚物、pluronic、pluronic85及其衍生物和组合。在一些实施方案中,制剂中表面活性剂的含量的范围可为按重量0.1%-按重量80%、按重量0.5%-按重量50%或按重量1%-按重量15%。
在一个实施方案中,制剂包括油、脂肪酸和/或脂质的至少一种。制剂中的油、脂肪酸和脂质的至少一种选自:丁酸(butanoicacid)、己酸(hexanoicacid)、辛酸(octanoicacid)、癸酸(decanoicacid)、十二烷酸、十四烷酸、十六烷酸、十八烷酸、十八碳三烯酸、二十烷酸、二十碳烯酸、二十碳四烯酸、二十碳五烯酸、二十二碳六烯酸、生育三烯酚、丁酸(butyricacid)、己酸(caproicacid)、辛酸(caprylicacid)、癸酸(lauricacid)、月桂酸、肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、油酸、异烟酸、亚油酸、α-亚麻酸、γ-亚麻酸、山萮酸、芥酸、二十四碳酸、天然或合成磷脂、单-、二-或三酰基甘油、心磷脂、磷脂酰甘油、磷脂酸、磷脂酰胆碱、α-生育酚、磷脂酰乙醇胺、鞘磷脂、磷脂酰丝氨酸、磷脂酰肌醇、二肉豆蔻酰磷脂酰胆碱、二油酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、鞘脂、前列腺素、神经节苷脂、neobee、泡囊(niosome)及其衍生物。
在另一实施方案中,制剂包括用于神经的去神经支配和表面修饰的治疗剂或药物。治疗剂为下述之一:钠通道阻断剂、河豚毒素(tetrodotoxin)、海藻毒素(saxitoxin)、脱氨基甲酰海藻毒素、香草素(vanilloid)、新石房蛤毒素(neosaxitoxin)、利多卡因、芋螺毒素(conotoxin)、强心苷(cardiacglycoside)、地高辛、谷氨酸、星形孢菌素(staurosporine)、氨氯地平(amiodipine)、维拉帕米(verapamil)、磁麻苷(cymarin)、洋地黄毒苷(digitoxin)、海葱次苷(proscillaridin)、quabain、藜芦定(veratridine)、软骨藻酸(domoicacid)、乙醇、夹竹桃苷(oleandrin)、卡马西平(carbamazepine)、黄曲霉毒素(aflatoxin)、胍乙啶(guanethidine)和硫酸胍乙啶。在另一实施方案中,制剂包括用于对神经的去神经支配成像的造影剂。这种造影剂包括碘、乙基碘、碘化钠、碘油、壬苯醇醚碘、碘比醇、碘海醇、碘美普尔、碘帕醇、碘喷托、碘普胺、碘佛醇、碘昔兰、碘曲仑、碘克沙醇、碘克酸及其衍生物。制剂中造影剂的含量范围按重量可为2-25%,或按重量为5-15%。
在一个实施方案中,所述制剂包含共沸物。共沸物是不能通过简单蒸馏改变的两种或多种成分的混合物。其发生是由于沸腾时产生的蒸气具有与原始混合物成比例的组分。共沸物选自乙醇/水、乙醇/水/造影剂、乙醇/水/表面活性剂、乙醇/水/造影剂/表面活性剂、丙醇/水、异丙醇/水、丁醇/水和乙酸/水。
在一个实施方案中,制剂呈气体或蒸气状态,包括一种或多种成分。在一个实施方案中,气体或蒸气制剂包括下述之一:氧气、氮气、氦气、氩气、空气、二氧化碳、一氧化氮和有机和无机化合物的蒸气。有机和无机化合物的蒸气包括下述之一:水、苯酚、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯及其混合物。
在一个实施方案中,所述蒸气制剂包括至少一种造影剂,如碘油或碘,或共沸物,且还可包含表面活性剂和/或治疗剂。在一个实施方案中,蒸气是二元、三元或四元组分之一,且还可包括多于四种组分。蒸气制剂的温度范围可为0℃至140℃、15℃至100℃或30℃至80℃。
在一个实施方案中,制剂呈液态,包括一种或多种成分。液体制剂包括下述之一:水、盐水、高渗盐水、酚类、甲醇、乙醇、无水酒精、异丙醇、丙醇、丁醇、异丁醇、乙二醇、甘油、乙酸、乳酸、丙基碘、异丙基碘、乙基碘、碘油、乙酸甲酯、乙酸乙酯、硝酸乙酯、乙酸异丙酯、乳酸乙酯、尿素、表面活性剂等等。在一个实施方案中,所述液体制剂包含造影剂和/或共沸物,且还可包含治疗剂。在一个实施方案中,液体制剂是二元、三元或四元组分之一,且还可包含多于四种组分。在一个实施方案中,液体制剂包括溶液、乳液或悬浮液。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-30℃至80℃。在一个实施方案中,制剂温度可以是室温。在一个实施方案中,制剂温度的范围可为-40℃至-20℃。在另一实施方案中,制剂温度的范围可为15c-80℃。在一个实施方案中,制剂温度可等于体温。在另一实施方案中,制剂温度范围可为50℃至80℃。
在一个实施方案中,用于治疗疾病的方法包括将递送导管经皮或经口插入机体;使用所述导管以将制剂输注至机体中的患病组织或管腔;任选从所述患病组织或体腔去除或撤回所述制剂;和最终从所述机体撤回递送导管。治疗的疾病包括高血压、肺动脉高压、糖尿病、肥胖症、心力衰竭、终末期肾病、消化性疾病、泌尿系疾病、癌症、肿瘤、疼痛、哮喘和慢性阻塞性肺病(copd)。癌症包括肾上腺、膀胱、子宫颈、结肠、食管、胆囊、肾、肝、肺、卵巢、胰腺、前列腺、直肠、胃和子宫的癌症。体腔包括肾动脉、血管腔、腹腔动脉、肝总动脉和固有动脉、胃十二指肠动脉、右和左肝动脉、脾动脉、右和左胃动脉、非血管腔、气道、窦道、食管、呼吸腔、消化腔、胃、十二指肠、空肠和泌尿腔。消化腔包括食管、胃、十二指肠、空肠、小肠和大肠和结肠。制剂包含一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。在其中制剂包含一种或多种成分的蒸气的情况中,热可通过在组织中将蒸气冷凝成为液体生成。在其中制剂包含液体或溶液的实施方案中,冷却或热可从低于或超过体温的制剂温度生成。液体制剂温度的范围可为-40℃至140℃、-30℃至100℃或-30℃至80℃。在一个实施方案中,经治疗的组织的温度可不同于制剂温度且低于或高于体温。经治疗的组织的温度范围可为15℃至100℃、20℃至90℃或36℃至80℃。在另一实施方案中,经治疗的组织的温度范围可为-40℃至-20℃。在一些实施方案中,递送导管是成像导向下的针或基于针的导管。成像导向是超声、x-射线、ct扫描、mri、oct或观察器之一。递送导管还可以是基于气囊或输注的。基于气囊的导管可具有单、双或三气囊。输注导管可具有哑铃气囊。通常,哑铃输注气囊存在三部分:近端、远端和中部。中部部分具有较小直径,其具有或不具有输注孔,且气囊的近端和远端部分具有较大直径而无输注孔。如果哑铃气囊的中部部分具有孔(图3a和3b)且定义为可扩张的输注方法,则输注来自可扩增的导管部分。取决于应用,初始输注压力的范围可以为0.1atm至14atm、1atm至10atm或3atm至8atm。输注时间的范围可为0.1分钟至2小时、0.5分钟至30分钟或1分钟至10分钟。初始输注压力后的输注时间过程中,气囊压力的范围可为0.1atm至3atm、0.1atm至2atm和0.3atm至1atm。制剂输注温度的范围可为-40℃至150℃、-30℃至100℃或-20℃至80℃。
在一个实施方案中,输注特征可由海波管(hypotube)/管(塑料或金属制成)制成,其附接至无孔哑铃型气囊导管。当治疗制剂通过在海波管/管上的孔递送时输注来自非可扩增导管部分且海波管/管与气囊朝血管壁运动;该输注定义为混合法,其包括非可扩张和可扩张输注方法的组合。通常,海波管/管的孔部分沿哑铃气囊的中部对齐以控制制剂流的位置。
在另一实施方案中,输注管腔可置于导管轴内,如对于非可扩张输注方法在多管腔轴内。在该情况中,孔位于轴上气囊间的非可扩张部分(图7、8a-8b、9a-9c)。装置更具体的实例如双气囊和三气囊输注导管示于下文部分。
在一个实施方案中,金属海波管可具有巴德三角特征(bardtrianglefeature),其将通过在血管壁内或在组织中生成非常小的孔增强制剂的扩散。巴德三角的高度范围可为0.25-2mm。该输注方法是混合法。
在一个实施方案中,制剂包含乙醇。该制剂可作为蒸气或液体递送至体腔的组织。蒸气或液体制剂的温度范围可为-40℃至150℃、-30℃至100℃或-20℃至80℃。组织温度的范围可为-40℃至90℃或-30℃至80℃。在一个实施方案中,制剂基本上由乙醇组成。在一个实施方案中,制剂由乙醇组成。
在一个实施方案中,制剂是乙醇和水的混合物。乙醇含量的范围按重量可为10-100%。该制剂可作为蒸气或液体递送至体腔的组织。蒸气或液体制剂的温度范围可为-40℃至150℃、-30℃至100℃或-20℃至80℃。组织的温度范围可为-40℃至90℃,-30℃至80℃。乙醇/水制剂可以是正共沸物。共沸物按重量可以是95.63%乙醇和4.37%水。乙醇在78.4℃沸腾,水在100℃沸腾且共沸物在78.2℃沸腾,低于其任一组分。78.2℃是任何乙醇/水溶液可在大气压沸腾的最小温度。
在另一实施方案中,制剂是包含水、乙醇和氧气的蒸气混合物。在另一实施方案中,制剂是包含水、乙醇和空气的蒸气混合物。在另一实施方案中,制剂是包含水、乙醇、氧气和氮气的蒸气混合物。具有氧气和空气的制剂对于治疗哮喘和copd特别有效。
在另一实施方案中,制剂是包含水、乙醇和碘的蒸气混合物,其中包括有效量的碘蒸气进而能够对在体腔壁中的蒸气混合物成像。在另一实施方案中,制剂是包含水、乙醇和表面活性剂的液体混合物。在另一实施方案中,制剂是包含水、乙醇和造影剂的液体混合物,其中包括有效量的造影剂进而能够通过x-射线追踪体腔壁中的混合物。所述造影剂是下述之一:碘、乙基碘、碘化钠、碘油、壬苯醇醚碘、碘比醇、碘海醇、碘美普尔、碘帕醇、碘喷托、碘普胺、碘佛醇、碘昔兰、碘曲仑、碘克沙醇、碘克酸及其衍生物。制剂中造影剂的含量范围按重量可为2-20%,或按重量5-15%。
在一个实施方案中,制剂是乙酸和水的混合物。制剂的乙酸含量范围可为按重量1-100%、按重量10-75%或按重量20-50%。可将制剂作为蒸气或液体递送至体腔组织。蒸气或液体制剂的温度范围可为-40℃至100℃、-30℃至100℃或-30℃至80℃。组织的温度范围可为-30℃至80℃、60℃至80℃或-30℃至-20℃。组织的温度范围可为-40℃至0℃或-30℃至-20℃。制剂中的乙酸含量范围可为按重量2%至按重量的75%,或按重量10%至按重量60%。
在另一实施方案中,制剂是包含乙醇和碘油(lipiodolultra-fluide)的液体混合物,其中包括有效量的碘油进而能够对体腔壁中的蒸气混合物成像并且还能够损伤靶神经组织。制剂的碘油含量范围可为按重量10%至按重量80%,按重量15%至按重量75%或按重量20%至按重量50%。在另一实施方案中,制剂是包含水和碘油的液体混合物。制剂的碘油含量范围可为按重量10%至按重量80%,按重量15%至按重量75%或按重量20%至按重量50%。在另一实施方案中,制剂是包含乙酸和碘油的液体混合物。制剂中的碘油含量范围可为按重量10%至按重量80%,按重量15%至按重量75%或按重量20%至按重量50%。
在一个实施方案中,在本发明中使用递送导管以将制剂输注至人体组织。递送导管是x-射线或超声成像导向下的针或基于针的导管。递送导管可基于气囊,其具有单、双或三个气囊。递送导管还可基于输注。还可在操作中使用气囊和输注导管的组合。输注系统中的气囊应该能够将制剂限制在气囊壁内并适当地控制制剂体积。
在一个实施方案中,在本发明中使用扩张气囊导管用于将活性材料递送至患者体腔中的靶位置,扩张的气囊导管包含近端、远端、导线、管腔、气囊扩张腔、制剂输注腔和/或真空腔、可扩张气囊部分和不可扩张轴部分,其中可扩张气囊部分包括至少一个部分且不可扩张轴部分包括至少一个部分,可扩张部分和/或不可扩张部分的至少一个第一部分具有多个空隙,其中所述空隙是微孔,且可扩张部分和/或不可扩张轴部分的至少一个第二部分不具有空隙。扩张气囊导管的可扩张部分或不可扩张部分具有至少一个在高于体腔的压力允许制剂穿透进入体腔壁的空隙。可扩张部分或不可扩张部分不具有在高于体腔的压力允许气囊扩张体腔的空隙。
如图1所示,递送导管10具有加长的轴11,其具有至少一个内腔、远端13和近端14。在远端13处为近端20和远端21管腔整合气囊(lumen-conformingballoon)。在任何构造中,导管轴11的管道可由塑料材料压制,例如热塑性塑料、聚酰亚胺、聚醚酰亚胺、聚乙烯、聚氨酯、聚酯、聚酰胺、pebax、尼龙、氟化聚氨酯、聚醚醚酮、聚砜等。导管轴11可以多种管腔横截面压制或形成多种管腔横截面,包括圆形或椭圆形管腔。此外,如图1所示,导管10可配备用于远端气囊21扩张的远端气囊扩张端口40和用于近端气囊20扩张的近端气囊扩张端口41,使近端20和远端21气囊能够分开扩张。管腔整合的气囊是可以在小于使管腔壁变形所需的压力下扩张的气囊。选择在高温柔韧和可用的气囊材料,进而当扩张时气囊是顺应的。在一个实施方案中,气囊材料是下述之一:聚酰胺、尼龙、pebax、聚酯、聚乙烯三苯醚或其共聚物。取决于治疗位点的直径,气囊直径的范围可为约2毫米至约40毫米。在一个实施方案中,每个气囊的直径为约2毫米("mm")。可替换地,每个气囊的直径为约3毫米,或可替换地,约4毫米,或可替换地,约5毫米,或可替换地,约6毫米,或可替换地,约7毫米,或可替换地,约8毫米,或可替换地,约9毫米,或可替换地,约10毫米,或可替换地,约12毫米,或可替换地,约15毫米,或可替换地,约20毫米,或可替换地,约25毫米,或可替换地,约30毫米,或可替换地,约35毫米,或可替换地,约40毫米。
在一个实施方案中,至少一个标记条带22b位于近端气囊20的近端且至少一个标记条带23a位于远端气囊21的远端。气囊导管可以是由任何适当的生物兼容性材料制成的快速交换或过线导管。标记条带还可位于气囊的另一末端(22a和23b)。25是气囊21和20间的区段,具有至少一个输注孔。30是非可扩张部分;31和32是微空隙或孔;24是气囊部分近端的轴。40和41分别是用于远端和近端气囊的气囊扩张的端口。42是化学制剂的输注端口。
气囊20和21的材料由下述之一制成:聚酯、聚酰胺、尼龙12、尼龙11、聚酰胺12、聚醚和聚酰胺的嵌段共聚物、pebax、聚氨酯或聚醚和聚酯的嵌段共聚物。气囊21的直径等于或小于气囊20。
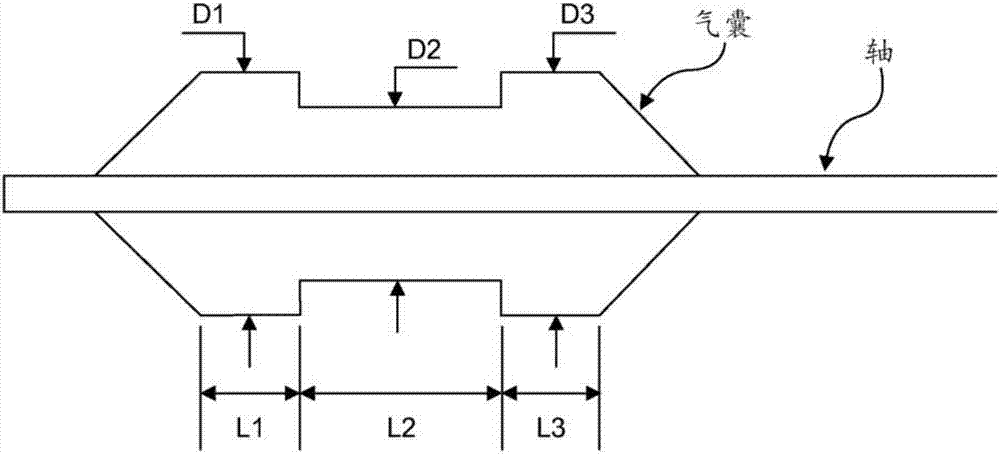
在一个实施方案中,示意的哑铃气囊示于图2。在扩张状态下,其中间直径d2小于其末端直径d1和d3两者。d1和d3在长度上可相等或不同。每个直径部分分别具有其自身的长度l1、l2和l3。为简单说明,将哑铃型气囊用于下述说明。然而,其他相似类型的气囊如多槽气囊(其中槽位于气囊中部)可实现相同的特征/功能。由于两个较大末端阻断制剂流动路径,因此哑铃型气囊形状的设计允许气囊在目标管内具有更好的输注体积控制和制剂位置控制。在一个实施方案中,递送的制剂将大多限制在较小直径的中部,如图2所示。为操作的安全性需要受控的治疗剂量,这意味着哑铃气囊上的较大和较小直径间的直径比率由临床给药需求来确定。为限定哑铃气囊上的直径组合,使用体积每表面积,且由相对较小直径中部的两个较大直径末端间的体积缺口(小直径部分上未占用的空间)计算。比率计算的等式为:
体积/表面积=(d12-d22)+(4*d1)............等式1
其中d1是较大直径气囊部分的直径且d2是较小直径气囊部分的直径。
体积/表面积的比率范围可为0.1mm-10mm、0.2mm-5mm或0.3mm-2mm。由此化学剂的剂量可以是恒定的且不依赖于气囊或血管尺寸。比率的值由临床治疗需要(给药需求)确定。哑铃气囊或多槽气囊可由涉及常规圆柱形气囊的二级热收缩方法制成或直接模塑成形。较大直径末端和中间较小直径部分间的气囊体直径差异通过体积/表面积比率的预先确定值确定,其使用等式1计算。例如,对于6mm和8mm气囊的组合,计算的体积/表面积比率将为0.88mm。
整体气囊体直径和长度的范围可分别为2-40mm和10-100mm。常规气囊的锥角或形状对于应用是可接受的,然而,优选的是圆形或圆锥形。
任何与制剂兼容的气囊材料可用于制造气囊,如聚乙烯、聚烯烃弹性体、天然橡胶、聚酯如pet和pbt及其嵌段共聚物包括热塑性弹性体如hytrel和聚酰胺如尼龙12和尼龙11及其嵌段共聚物包括热塑性弹性体如pebax。
在一个实施方案中,哑铃气囊输注导管的示意图示于图3a,其中在中间较小直径气囊部分中的4个孔呈90度分开,其从图2修改而来,在不同直径间具有锥形渐变过渡。液体制剂可从气囊扩张腔通过气囊上的孔递送;这是一种可扩张的输注方法。在该实例中,制剂以两方面的角色发挥功能:扩张气囊并作为治疗剂发挥作用。图3b是在血管内膨胀和定位的输注气囊导管的示意图。大多数递送的治疗制剂受限在通过较小的气囊体和在血管壁内的两个较大的气囊肩生成的空间。
为增强化学治疗剂的输注距离,可使用气囊外部直径(od)比血管内部直径(id)大于其中血管以特定的受控水平过渡扩张的比率。比率的范围可为1.01至10、1.10至5或1.20至1.35。
用于递送化学剂的气囊上的微孔可通过微冲孔或钻孔工艺直接在气囊体壁上生成。在气囊壁上适当的孔径范围可为5微米至500微米,或20微米至250微米。这些值适当考量气囊扩张、输注率和制剂流动控制间的平衡。如果孔大小过大,则制剂体积由于过度流动可能是不受控的。几何学上,孔通常排列在小直径区域的中间部分;然而,出于递送制剂的目的,其在气囊上可以不同方式或模式放置。气囊上的孔还可在较小直径部分的中心沿气囊体壁的周长排列。孔的数目范围可为2-10或更多且孔径范围可为25微米-100微米。
图3a中的哑铃气囊可视为具有沿圆周平均分配的4个孔的单槽气囊,上文的气囊实施方案还包括在气囊上的多个槽且每个槽具有其自身的用于输注的孔的集合。例如,三槽气囊可由80mm长的长度的气囊制成,且输注剂可限制在每个槽内。如果其相应的体积/表面积比率相等,多槽气囊的临床结果可与图3a中所示的常规哑铃气囊相同。图3a是用于可扩张输注方法的装置。
在另一实施方案中,如图4a-4b所示,化学剂通过与在远端和近端气囊处的导管附接的细管递送。在该实例中,将在气囊上没有孔的哑铃气囊导管用于输注系统。图4a-4b是用于混合输注法的装置。制剂递送管具有位于较小直径的气囊部分内的多孔。管上的孔径范围可为25微米-1mm。孔的数量取决于较小直径气囊部分的长度变化。孔间的距离范围可为2mm-5mm。
由于在图4a-4b中所示的实施方案中并入了输注管,气囊扩张和制剂输注通过分开的独立操作发生。例如气囊首先扩张至预先确定的压力,随后有效体积的化学剂通过管递送至治疗位点,同时剩余的制剂受限在较小气囊直径区域的中部。导管上使用的输注管可由热塑性塑料如聚乙烯、尼龙或pebax,或金属或金属合金如不锈钢或镍钛诺或镍钛诺海波管(由于其超弹性特性)制成。
使用金属或金属合金管超过塑料管的优势是存在额外用于制剂递送的特征。例如,巴德三角特征可添加至金属管(图15)。巴德三角的尖锐尖端可发挥作用以当气囊针对血管壁扩张时夹入组织壁。相比圆孔版,由于穿透组织,因此该递送系统将允许化学剂更深扩散入部分血管组织。如果在更宽的血管壁区域需要更深的扩散,可使气囊扩张和放气数次并在每次扩张/放气循环后旋转。这将导致在血管壁上额外的穿刺孔且将允许制剂更深且更快地扩散通过。巴德三角的高度范围可为0.25mm-2mm或0.5mm-1mm。
在一个实施方案中,用于治疗哮喘和copd的位于左侧主支气管内的气囊递送导管的示意图示于图5a和5b。图5a和5b的递送导管198可治疗主支气管21和22远端的气道。例如,递送导管198可位于肺区段中多个气道中以影响支气管树27的远程远端部分。递送系统198可通过曲折的气道导向以实施宽范围的操作,如例如肺叶的一部分、完整肺叶、多个肺叶或一侧或两侧的肺的去神经支配。在一些实施方案中,治疗肺叶支气管以去神经支配肺叶。例如,可靶向沿肺叶支气管的一个或多个治疗位点以去神经支配与肺叶支气管连接的完整肺叶。左肺叶支气管可经治疗以影响左上叶和/或左下叶。右肺叶支气管可经治疗以影响右上叶、右中叶和/或右下叶。肺叶可同时或顺序治疗。在一些实施方案中,医师可治疗肺叶。基于治疗的有效性,医师可同时或顺序治疗其他肺叶。以这种方式,可治疗支气管树的不同隔离区。
递送导管198还可在区段或亚区段支气管中使用。每个区段支气管可通过将制剂递送至沿区段支气管的单治疗位点治疗。例如,可将制剂递送至右肺的每个区段支气管。在一些操作中,制剂的一次或两次应用可治疗大部分或完整的右肺。取决于支气管树的解剖结构,区段支气管可经常使用一次或两次应用去神经支配。
递送导管198可影响神经组织,同时维持其他组织的功能或解剖特征,如粘液腺、纤毛、平滑肌、体腔(例如血管)等。神经组织包括神经细胞、神经纤维、树突和支持组织如神经胶质。神经细胞传输电脉冲,且神经纤维是执行脉冲的延长的轴突。将电脉冲转换为化学信号以与效应细胞或其他神经细胞通信。举例来说,递送导管198能够使支气管树27的气道的一部分去神经支配以减弱由神经组织传输的一种或多种神经系统信号。去神经支配可包括切断神经主干一部分的神经组织以防止信号穿过特定区域至沿支气管树的更远端位置。如果多个神经主干沿气道延伸,可切断每个神经主干。由此,可切断沿支气管树部分的神经分布(nervesupply)。当信号被切断时,远端气道平滑肌松弛,导致气道扩张。这种气道扩张减小了气流阻力,从而增加肺中的气体交换,由此减轻或消除一种或多种临床表现,如呼吸困难、喘息、胸闷等。围绕或邻近靶神经组织的组织可能受到影响,但不会永久性切断。在一些实施方案中,例如,沿着治疗的气道的支气管血管可以向支气管壁组织递送相似量的血液,且沿着治疗的气道的肺血管可以在治疗前后在支气管树27的远端区域向肺泡囊递送相似量的血液。这些血管可以继续运输血液以维持足够的气体交换。在一些实施方案中,气道平滑肌不会受到很大程度的伤害。例如,不明显影响呼吸功能的气道壁中平滑肌的相对小的部分可能可逆地改变。如果在经调节的温度采用制剂以损伤气道外的神经组织,该制剂将不会达到非靶向的平滑肌组织的大部分。
图5a和5b的递送系统198包括治疗控制器202和与控制器202连接的管腔内细长形组件200。细长形组件200可插入气管20并利用或不利于递送组件导向入并通过支气管树27。细长形组件200包括能够选择性影响组织的远端尖端203。
图5a的控制器202可包括一个或多个处理器、微处理器、数字信号处理器(dsp)、现场可编程门阵列(fieldprogrammablegatearray,fpga)、专用集成电路(asic)、存储设备、总线、电源、泵、制剂源、蒸气源、液体源、对比源(contrastresource),蒸气发生器、所需温度制剂发生器等。
图5a-5b的远端尖端203可靶向肺10中的多处位点,包括但不限于神经组织、纤维组织、患病或异常组织、肌肉组织、血液、血管和多种解剖特征(例如膜、腺体、纤毛等)。
在一个实施方案中,位于肾动脉内的双气囊递送导管的示意图示于图5c。图5c的气囊导管107可治疗高血压。制剂输注至邻近肾神经的肾动脉壁用于去神经支配。图5c中省略了肾血管系统的一些元素。在图5c中,102为肾,105为引导导管,106为主肾动脉,107为气囊导管,301为腹主动脉且502为肾外动脉。
在一个实施方案中,用于治疗高血压的方法包括将递送导管经皮插入邻近神经和神经末梢的肾动脉和/或肾外动脉;使用递送导管将上述制剂输注至邻近神经的体腔组织,其中递送的制剂的量可有效损伤神经和神经末梢,如例如通过降低血压,且最终从体腔撤回递送导管。
在一个实施方案中,例如如图3a-3b、4a-4b、7、8a-8b和9a-9c所示的气囊输注导管可用于高血压治疗。具有实施方案的临床前试验的实例在下文说明。
在一个实例中,使用异氟烷麻醉体重47kg的猪类动物,且使用气囊导管以乙醇消融其肾动脉的一侧,同时对侧肾动脉作为对照发挥作用。使用标准的肾接入操作,将气囊输注导管置于依次在导丝上的靶向的肾主要和额外分支的肾动脉。到达靶向的消融位点时,扩张气囊并经由可扩张的输注方法使无水乙醇介导的肾动脉化学消融得以发生。根据肾血管造影确定气囊直径,并采用共四个导管。消融治疗过程中,首先使用乙醇使气囊迅速扩张直至6-8atm,随后缓降至0.5-1atm并以较低的压力保持约60秒。在治疗时间结束时,使气囊放气并撤回,或如果需要下次治疗则置于另一动脉位点。
为获得更好的临床结果,气囊外径(od,较大直径部分)和动脉内径(id)可以一定比率存在。可使用稍大的气囊od比血管id,如气囊od/血管id=1.10-1.40;或=1.20-1.35。
获得消融后肾血管造影以确定是否发生了血管痉挛、狭窄或其他异常。在气囊输注治疗过程中和之后不存在显著的肾动脉痉挛。
治疗后2周将动物安乐死,并从肾皮质的颅部、中部和尾部获得肾组织样品以使用已知的hplc方法确定肾组织去甲肾上腺素(ne)含量。去甲肾上腺素是神经递质,其水平作为肾去神经支配的标准测量发挥作用。还收集肾动脉和周围组织用于组织病理学评估。肾动脉的乙醇消融导致肾去甲肾上腺素减少的72%的减少(ne含量:对照:570ng/g;肾去神经支配的,即rdn:160ng/g),如图12所示。
乙醇消融后不仅ne含量减少,组织病理学评估还证实了肾神经损伤,如图16中所示,其中在外膜外边缘内对轻度纤维化包围的神经进行拍照(黑色箭头)。
为确认来自上述研究的结果,实施了第二项研究。在该确认研究中使用了如上文所述的相同输注装置和相同的研究时期(2周的长期研究)。
将6只重44-56kg的猪类动物分为三个治疗亚组,其中两只在主肾动脉中进行了治疗,两只在肾外分支中进行了治疗,且两只在主肾动脉和肾外分支中都进行了治疗。再次,对每只动物进行了肾动脉血管的单侧治疗,同时对侧作为对照。实施了标准肾接入操作。
在治疗过程中,根据范围在1.20-1.35的气囊od/动脉id比率确定了气囊大小。为更好的治疗效果和最小的血管损伤通过调节过度扩张提供这些值。在该研究中迅速扩张循环过程中使用的扩张压力为10-12atm;压力随后缓降至0.5-1atm,且在主肾动脉位点将治疗维持在低压2分钟且在肾外分支动脉维持1分钟。在该研究中的全部6只猪类动物中,在气囊输注治疗过程中和之后,肾血管造影未显示显著的肾动脉痉挛。
仅肾主动脉的肾主动脉乙醇消融导致去甲肾上腺素(ne)平均减少约40%。肾外动脉分支乙醇消融导致去甲肾上腺素减少约80%。主肾动脉和肾外动脉分支的化学消融共同导致大于90%的去甲肾上腺素含量的减少;颅皮层去甲肾上腺素减少:93.81%、94.07%、94.43%,中部皮质组织去甲肾上腺素减少:91.98%、92.19%、93.20%,尾皮层组织去甲肾上腺素减少:73.27%、31.80%、47.06%。该研究证实了治疗过程中气囊的质量和肾动脉组织接触的程度二者都有助于高效力。
除ne中的减少,组织病理学评估证实了肾神经损伤(如图16中所示),其描述了纤维化和炎症包围的大口径血管周围神经和多灶性退化和/或坏死组织。还观察到了圆周效应。总的来说,估计在治疗的肾动脉中平均的肾神经损伤值为50%。
在一个实施方案中,本文公开的导管10(图1中)在整个治疗窗口30帮助调节制剂流和治疗剂量,如图6中所示。气囊可以通过其扩张腔进行扩张。侧向孔31的位置、直径、数量和频率导致治疗窗口30的均匀填充。图6描述了位于体腔5中的导管,其具有位于治疗窗口30内用于递送治疗剂3的两个侧向孔31。导管尖13、标记带23a和23b、可扩张气囊20和21示于图6中。如图6中所示,侧向孔31与内腔25流体连通。位于治疗窗口30内的侧向孔31可与外腔24或内腔25流体连通进而制剂均匀递送至治疗窗口30。
在一个实施方案中,如图7中所示,描述了三气囊输注导管的远端部分的横截面图。该输注装置可在治疗位点提供均匀填充。图7中的气囊以扩张状态显示,其在远端和近端具有两个较大直径的气囊d1和d3,且在中部具有一个较小直径的气囊(d2)。根据临床剂量需要使用预先确定的比率值通过等式1确定气囊直径的组合。气囊长度的组合取决于靶向血管的长度和曲度。
设计之一是作为输注导管发挥作用的四腔轴。四腔可指定用于导线(1)、气囊扩张(1)和化学治疗(2),例如如图1中所示。可替换地,可设计导管以具有更多的腔来容纳更多扩张腔,其中每个气囊可独立地扩张。
化学治疗端口位于轴上的气囊间。制剂输注孔位于可扩张气囊部分间的不可扩张轴部分上。治疗过程中,制剂可以在气囊间通过输注孔排出以填充在由较小直径气囊生成的空间中。这是不可扩张输注方法。
在一个实施方案中,任选地,治疗后在输注孔之一上可通过真空技术回收化学剂/制剂的残留物。在该情况中,可使用至少两个治疗腔:一个用于输注且另一个用于真空。制剂的输注和真空孔位于可扩张气囊部分间的不可扩张轴部分。
除撤回过量的治疗剂,也可使用盐水或水稀释剩余的治疗剂至非有效浓度。可使用导管线腔或输注腔之一或通过其他方式以盐水或水实施冲洗。使用的方法取决于保护或治疗位点。如果血管的远端部分需要免于化学治疗的保护,则可经由线腔实施冲洗。
在一个实施方案中,如图8a中所示,可应用新型的非常规气囊附接方法。新方法包括将气囊腰置于气囊锥体或气囊主体内;这发挥作用以克服围绕较小直径气囊并由气囊腰长和锥长生成的额外不想要的空间,如图7中所示。额外的空间未赋予化学治疗益处且可能由于不能控制治疗体积而导致用药过量。制剂输注和真空孔位于可扩张气囊部分间的不可扩张轴部分上。
当额外的空间最小化时,为证实新装配方法的有效性,采用了相似的气囊直径组合(图8a比图7)。图8a中所示的l(ii)为l(i)或l(ii)。在扩张状态中,邻近气囊的锥部现将更密切地彼此接触,因此最小化额外的空间。再次,制剂在气囊间递送并将填充小直径气囊部分/区域上的空间。
这种新的气囊装配方法可通过顶部装配前后气囊长度的差异描述。此处,气囊长度l(i)定义为轴装配前从远端腰/锥体的过渡点至近端锥体/腰的过渡点的长度;且气囊长度l(ii)定义为轴装配后从远端腰/锥体的过渡点至近端锥体/腰的过渡点的长度。在该新装配方法中,气囊腰置于椎体内,或在一些情况中也会在气囊主体中,如果椎体长度短的话。l(i)和l(ii)间的关系为:
(1).l(i)=l(ii);如果气囊使用常规方法装配。
(2).l(i)>l(ii);如果气囊使用新方法装配。
取决于气囊椎体的长度,该新输注导管将在椎体内至少25%处具有椎体/腰过渡点,或在椎体内50或100%处,或部分或完全在气囊主体内。
出于说明的目的,考虑包括在远侧和近侧都具有5mm椎体长度的8x20mm气囊的实例。在该情况中,l(i)=主体长度+远端锥体长度+近端锥体长度=20+5+5=30mm。情况1:如果椎体/腰过渡点50%置于椎体内,则l(ii)=20+2.5+2.5=25mm;l(i)>l(ii)。情况2:如果椎体/腰过渡点100%置于椎体内或置于椎体/主体的过渡线处,则l(ii)=20+0+0=20mm;l(i)>l(ii),如果腰进一步置于内部,则其将位于气囊主体内。
在导管上的多重气囊组件中,具有相同l(i)的气囊也可具有相同或不同的l(ii)。
在另一实施方案中,常规的锥形气囊可用于该导管。然而,由于其短锥体长度和相邻锥体之间更多接触表面积的潜力,也可使用圆形或圆锥形气囊。
在一个实施方案中,如图8b所示,气囊可通过将气囊腰置于或部分置于具有倒置的气囊腰的气囊内附接在轴上。倒置的气囊腰可使气囊锥体更自然圆润且将允许在锥体之间更多的接触表面积;此外,腰可更容易地置于气囊体内。
在一个实施方案中,当需要窄治疗带或较短整体气囊长度时,使用双气囊组合。图9a展示在扩张状态中具有接触的相邻椎体的两个气囊。化学剂可通过位于两气囊间的轴上的递送端口递送。制剂输注和/或真空孔位于可扩张气囊部分间的不可扩张轴部分上。治疗过程中化学剂可保留在两气囊的中部狭窄部分中。任选地,额外的端口可用于冲洗或真空目的。导管上的两个气囊还可具有其自身的扩张腔,且因此可独立扩张。
在另一实施方案中,在图9b-9c中显示,尽管整体气囊长度较短,可将双直径气囊用于输注导管以实现更宽的治疗长度。该气囊具有在一侧相对另一侧较小的两种直径。采用与三气囊排列相同的装配技术,将双直径气囊附接在具有头对头装配的较小直径侧的轴上以形成较小直径中部。大直径部分的两端主要将化学剂限制在中部较小直径部分以实现受控体积的递送。制剂输注和/或真空孔位于可扩张气囊部分间的不可扩增轴部分上。再次,制剂通过两个可扩增气囊部分间的不可扩张轴部分上的输注孔递送。
双直径气囊之一是图9b中所示的锥形气囊。该双气囊构造具有位于彼此头对头对面的两个气囊的中部中的较小直径末端。获得的中间部分的整体直径小于末端。另一双直径气囊由两阶段气囊装配,如图9c中所示。在一个气囊中存在两种不同的直径,即气囊一侧大于另一侧;且两直径间存在突然的直径变化。两阶段气囊可使用面对彼此(图9c)并形成整体气囊中部的较小直径侧装配。尽管具有如图9b中的相同整体气囊长度,阶段气囊可提供较宽治疗长度。
图10a和10b说明气囊输注导管365位于胃动脉360或肝动脉320中。围绕肝和胃的多种动脉以及神经支配肝和胃和其周围器官和组织的多种神经系统示于图10a和10b。肝和胃周围的动脉包括腹主动脉305、腹腔动脉310、肝总动脉315和肝固有动脉320、胃十二指肠动脉322、右肝动脉325和左肝动脉330、脾动脉335和食管分支361。神经支配肝和胃和其周围器官和组织的多种神经包括腹腔神经丛340和肝神经丛345。到肝脏的血液供给从心脏泵入主动脉且随后向下通过腹主动脉305并进入腹腔动脉310。从腹腔动脉310,血液穿过肝总动脉315,进入肝固有动脉320,随后通过右侧肝动脉325和左侧肝动脉330进入肝脏。肝总动脉315从腹腔干岔开并生成胃十二指肠动脉。神经支配肝脏的神经包括腹腔神经丛340和肝神经丛345。腹腔神经丛340围绕腹腔动脉310缠绕且继续进入肝神经丛345,其围绕肝固有动脉320和肝总动脉315缠绕,和/或延续至右侧肝动脉325和左侧肝动脉330上。在某些解剖学中,腹腔神经丛340和肝神经丛345紧密粘附至动脉壁,以血液供给肝脏,由此给予血管内至外神经调节特定的优势。在数个实施方案中,血管的中层厚度(例如肝动脉)为约0.1cm至约0.25cm。在一些实施方案中,可将制剂递送至靶血管或靶神经的内壁。可采用血管内递送,这是由于神经与动脉外壁紧密粘附,因此将血液供给至肝脏(例如,在肝动脉分支的情况中)。
胃周围的动脉包括腹主动脉305、腹腔动脉310、右胃动脉355和左胃动脉360和食管分支361。供给至胃的血液从心脏泵入主动脉且随后向下通过腹主动脉305并进入腹腔动脉310。从腹腔动脉310,血液穿透右胃动脉355和左胃动脉360、食管分支361并进入胃。
继续参考图10a和10b,肝神经丛345是来自腹腔神经丛340的最大分支。确信肝神经丛345主要携载传入和传出交感神经纤维,其刺激可通过多种机制增加血糖水平。例如,肝神经丛345中交感神经纤维的刺激可通过增强肝葡萄糖的产生,或通过减少肝葡萄糖的摄取增加血糖水平。肝神经丛345中交感神经信号传导的破坏可因此改变血糖水平。
在一个实施方案中,图10b描述了位于肝动脉内用于治疗糖尿病的气囊递送导管的示意图。在另一实施方案中,图10a描述了位于左胃动脉内用于治疗肥胖症和糖尿病的气囊递送导管的示意图。
本发明的一些实施方案包括将蒸气或液体制剂以特定的递送速率递送至体腔区段达预先确定的持续时间。递送前,可将制剂加热至至少80℃,例如,100℃或150℃。导管材料,特别是气囊和轴,应在上述温度是功能性的,因为这些材料被制造成承受高温。在一些实施方案中,递送的蒸气可经历相变至液体,导致能量释放,其被传递至组织。
在一些实施方案中,例如,用于治疗组织的安全和有效剂量范围为约2cal/g至约150cal/g,或约5cal/g至约100cal/g,且递送系统的能量流速范围为约2cal/g至约500cal/秒,或约5cal/秒至约150cal/秒。在一个实施方案中,制剂生成器生成蒸气或液体制剂,其中压力范围为约2psi至200psi且温度范围为约20℃至150℃,或约50℃至120℃。
应当应用安全和有效的量的制剂和/或能量进而令人满意地损伤组织。一般而言,剂量的量与对组织的损伤程度相关。
在一些实施方案中,有效剂量的能量范围为约1至约100cal/g和/或有效的制剂剂量范围为0.2微升至200微升。这些给药限制可随其他递送参数(例如递送速率或持续时间等)改变,可要求不同的剂量以实现最终最佳的损伤益处。
确定剂量后,应确定经由递送系统应用的能量(cal)或制剂(ml)的总量。该值通过将剂量(cal/g)乘以待治疗的组织的量(克)计算。
递送/流速或递送系统递送制剂的速率一般决定了制剂的持续时间。例如,在30cal/秒的递送速率,将必需10秒的治疗持续时间以递送300卡路里。递送速率的范围一般为约2至约200cal/秒。再次,这些限制并非是绝对的且可取决于治疗和/或递送参数变化。
治疗次数可取决于待治疗的组织的体积和对靶组织的目标损伤程度变化。治疗时间可由约2秒变化至约60分钟。在一些用于诱导损伤以缓解症状的实施方案中,安全和有效的治疗时间范围为约4秒至约30分钟。
递送速率可通过调节递送系统设置。一旦使用者确定递送速率,制剂源将确定在预期速率递送蒸气或液体所必需的压力的量。改变递送速率设定将引起制剂生成器调整递送的压力的量。蒸气生成器中的压力范围可为约5psi至约200psi,或约10psi至约50psi。
在一个实施方案中,用于治疗高血压的方法包括将递送导管经皮插入邻近神经的肾动脉;使用导管输注上述的制剂和/或热至邻近神经的体腔的组织,其中递送的制剂和/或热的量可有效损伤或破坏神经,如例如通过降低血压;且最终,从体腔撤回递送导管。热的目的是通过加速制剂和神经间的反应速率增强损伤/破坏的效果。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过在组织中将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。制剂温度的范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力的范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗哮喘的方法包括将递送导管插入邻近神经的气道;使用导管以输注上述制剂和/或热至邻近神经的气道组织,其中递送的制剂和/或热的量可有效损伤或破坏神经,如例如通过缓解呼吸短促;且最终,从体腔撤回递送导管。热的目的是通过加速制剂和神经间的反应速率增强损伤/破坏的效果。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过在组织中将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗copd的方法包括将递送导管插入邻近神经的气道;使用导管以输注上述制剂和/或热至邻近神经的体腔组织,其中递送的制剂和/或热的量可有效损伤或破坏神经,如例如通过缓解copd症状;且最终,从气道撤回递送导管。热的目的是通过加速制剂和神经间的反应速率增强损伤/破坏的效果。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过在组织中将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力和/或气囊输注压力范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗糖尿病的方法包括将递送导管经皮插入邻近神经的肝动脉,特别是肝腹腔动脉、肝固有动脉和左侧和右侧肝动脉;使用导管以输注上述制剂和/或热至邻近神经的体腔的组织,其中递送的制剂和/或热的量可有效损伤或破坏神经,如例如通过降低葡萄糖水平,且最终,从体腔撤回递送导管。热的目的是通过加速制剂和神经间的反应速率增强损伤/破坏的效果。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过在组织中将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力和/或气囊输注压力范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗肥胖症和糖尿病的方法包括将递送导管插入邻近胃和食管神经的左和/或右胃动脉;使用导管以输注上述制剂和/或热至邻近神经的胃动脉组织,其中递送的制剂和/或热的量可有效损伤或破坏神经如例如通过降低体重;且最终从胃动脉撤回递送导管。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力和/或气囊输注压力范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗肥胖症和糖尿病的方法包括将递送导管经皮插入邻近神经的肝动脉,特别是肝腹腔动脉、肝固有动脉和左侧和右侧肝动脉;使用导管以输注上述制剂和/或热至邻近神经的肝动脉的组织;从肝动脉撤回递送导管;将递送导管插入邻近胃和食管神经的左和/或右胃动脉;使用导管输注上述制剂和/或热至邻近神经的胃动脉的组织,其中递送的制剂和/或热的量可有效损伤或破坏神经,如例如通过降低体重和葡萄糖水平;且最终,从胃动脉撤回递送导管。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力和/或气囊输注压力范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗肥胖症的方法包括将递送导管插入邻近神经的消化腔;使用导管以输注上述制剂和/或热至消化腔的组织,其中递送的制剂和/或热的量可有效损伤或破坏组织,如例如通过降低体重;且最终从消化腔撤回递送导管。用于该实施方案的潜在的消化腔包括食管、胃、十二指肠、空肠、小肠和大肠和结肠。热的目的是通过加速制剂和神经间的反应速率增强损伤/破坏的效果。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。
在一个实施方案中,用于治疗肥胖症和糖尿病的方法包括将递送导管插入邻近胃和食管神经的左和/或右胃动脉;使用导管以输注上述制剂和/或热至邻近神经的胃动脉组织,其中递送的制剂和/或热的量可有效损伤或破坏神经,如例如通过降低体重;且最终从胃动脉撤回递送导管。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。
在一个实施方案中,用于治疗肥胖症和/或糖尿病的方法包括将递送导管经由口、食管和胃口服插入十二指肠和/或空肠;使用导管以输注上述制剂和/或热至十二指肠和/或空肠的表面组织达1-30分钟,其中递送的制剂和/或热的量可有效损伤或破坏表面、体腔如十二指肠或空肠的组织和神经,例如通过降低体重和葡萄糖水平;任选地去除或撤回制剂;且最终从消化腔如十二指肠或空肠撤回递送导管。潜在的制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。制剂输注压力和/或气囊扩张压力的范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。液体制剂的温度范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。治疗的组织(在此情况下为表面组织)的温度可低于制剂的温度且高于体温。治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃、36℃至80℃或60℃至80℃。治疗需要修饰十二指肠或空肠的表面。治疗益处如降低体重、葡萄糖水平和/或hba1c(a1c)水平依赖于制剂剂量和温度、治疗期的长度和治疗的十二指肠的表面积和厚度。处于安全原因,不鼓励十二指肠穿孔。治疗表面修饰十二指肠的形态、神经和食物吸收能力。
在一个实施方案中,用于治疗肥胖症和/或糖尿病的方法包括经由口、食管和胃非侵入性将输注导管口服插入十二指肠和/或空肠;使用导管以输注化学剂至十二指肠和/或空肠的表面组织达1-10分钟,其中递送的化学剂的量可有效损伤或破坏体腔的表面、组织和神经,如十二指肠或空肠,例如通过降低体重和葡萄糖水平;任选地去除或撤回作用剂;且最终从消化腔如十二指肠或空肠撤回递送导管。化学剂包括化学剂和/或无水乙醇的制剂。下文是用于治疗肥胖症和/或糖尿病的临床前试验的说明。
上述实施方案中的全部输注导管可应用于下述研究。例如,在一项研究中,具有每槽4孔的2-3槽哑铃型气囊用于肥胖症和/或糖尿病的治疗。气囊直径和长度的范围分别为12至15和55至80mm。根据上述步骤实施研究。以异氟烷麻醉两只幼年约克郡杂交猪(yorkshirecrosspig)(每只重约9kg)。将输注气囊导管经由口、胃和幽门在儿科内窥镜和荧光镜的导向下插入十二指肠。将特赖茨韧带()用作十二指肠远端的解剖标记。当递送输注气囊导管至十二指肠时,气囊快速预扩张直至1.5atm后注射1.5至2.0ml的无水乙醇。随后将气囊压力保持在0.5atm或少于1-2分钟。治疗剂在该过程中起双重作用:(1)气囊的扩张和(2)通过在气囊壁上的孔将化学品递送至靶血管组织。治疗后,气囊部分回缩且被拉回至限定距离以避免与下次治疗位置的重叠。随后重复治疗。未治疗胆管。治疗后2小时将动物安乐死。检查十二指肠组织并在三苯基四唑氯化物(ttc)溶液中悬浮30分钟。化学治疗后,坏死组织可能会显示白色斑点。
在上述研究中使用的化学剂是纯乙酸和无水乙醇。在来自两只经治疗的动物的ttc染色的十二指肠组织中均明确证实了治疗效力,因为白色斑点位于化学消融的区域。
上述短期研究成功后,实施了长期研究以证实治疗的临床益处。研究包括与在上述短期研究中的体重相似的7只猪。以无水乙醇处理7只猪中的3只,3只使用乙酸,且1只假处理猪使用盐水。采用如之前短期研究所述的相同操作用于以无水乙醇的治疗。像之前一样,输注气囊导管达到十二指肠后,以无水乙醇迅速预扩张气囊直至1.5atm的压力;随后将约1.5ml至2.0ml额外的乙醇通过气囊壁注射入十二指肠,且随后在0.5atm或以下保持压力2分钟。一旦治疗期结束,随后以约10ml的水使用内窥镜冲洗经治疗的十二指肠部分。
用乙酸处理类似于用无水乙醇处理进行。像之前一样,治疗猪十二指肠,这次以0.5ml的剂量达1分钟。每次治疗后,气囊部分回缩且拉回至预先限定的距离以避免与下次治疗位置的重叠治疗。随后重复治疗。未治疗胆管。恢复动物用于长期观察和评估。
经历使用乙酸的十二指肠治疗的猪在治疗后约5周安乐死。临床和病理评估后确定动物为健康。如图13中所证实,使用乙酸的十二指肠治疗相比假处理动物不具有显著的体重差异。葡萄糖水平波动且尚无定论。
经历使用无水乙醇的十二指肠治疗的猪在治疗后约8周安乐死。临床和病理评估后确定动物为健康。如图14中所证实,使用无水乙醇的十二指肠治疗相比假处理动物导致较少的动物重量增加。葡萄糖尚无定论。
在一个实施方案中,用于治疗巴雷特食管病(barrett'sesophagusdisease)的方法包括输注气囊装置、操作和化学剂。在该方法中,气囊输注导管在儿科内窥镜引导下经由口非侵入性地插入食管。15mm气囊通常在55至80mm范围的长度使用,在中部具有3个槽且每槽4微孔用于化学剂输注。一旦气囊位于靶食管,其在直至1.5atm的压力迅速预扩张至全尺寸。递送的剂量的实例如下:(1)对于使用无水乙醇的治疗,将1.5ml在食管的远端部分递送达4分钟且在近端部分达2分钟;(2)对于使用乙酸的治疗,将0.5ml在食管的远端部分递送达2分钟且在近端部分达1分钟。一旦治疗期结束,以约10ml的水使用内窥镜通道冲洗治疗位点。每次治疗后,部分回缩气囊并移动至用于额外治疗的其他位置。
使用上述操作,以7只幼年约克郡杂交猪实施了长期研究。使用无水乙醇治疗7只猪中的3只,使用乙酸治疗3只,并使用盐水治疗假处理动物。在治疗之前和之后实施内窥镜检查。恢复动物用于长期观察和评估。治疗后2周还对动物进行了内窥镜检查且在4周后进行了复查和安乐死。通过内窥镜检查评估了治疗效果。在乙酸治疗的食管部分,观察到了严重的狭窄现象。除乙酸治疗组外治疗部分的组织病理学分析证实了上皮增生和完全上皮化,其中上皮层有时不存在。
上述临床前发现证实了乙醇治疗有效且安全。另一方面,乙酸治疗导致经治疗的食管中的严重窄化和紧束。此外,在十二指肠治疗的动物中相比未治疗的动物未观察到重量变化的差异。已知酸腐蚀和损伤食管内膜;局部应用后乙酸在十二指肠壁中产生病灶。这些观察结果表明乙酸可能不适于十二指肠和食管治疗。
在一个实施方案中,用于治疗泌尿性疾病和/或良性前列腺增生(bph)的方法包括将递送导管插入泌尿腔;使用导管以输注上述制剂和/或热至泌尿组织例如前列腺、尿道和输尿管的管腔,其中递送的制剂和/或热的量可有效损伤或破坏组织,如例如通过控制尿流;和最终从泌尿腔撤回递送导管。热的目的是通过加速制剂和神经间的反应速率增强损伤/破坏的效果。制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。液体制剂温度的范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。邻近神经的治疗的组织的温度可低于制剂温度且高于体温。邻近神经的治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。制剂输注压力和/或气囊扩张压力的范围可为0.1atm至14atm、3atm至10atm或4atm至8atm。
在一个实施方案中,用于治疗癌症或肿瘤的方法包括在成像导向下将针或基于针的导管经皮或经口插入癌症或肿瘤;使用导管以输注上述制剂和/或热至人体的癌组织,其中递送的制剂和/或热的量可有效损伤、破坏或消除癌组织,如例如通过收缩或消除肿瘤;且最终从机体撤回递送导管。潜在的成像导向包括超声、x-射线、ct扫描、nmr成像和观察器。相关的癌症包括肾上腺、膀胱、子宫颈、结肠、食管、胆囊、肾、肝、肺、卵巢、胰腺、前列腺、直肠、胃和子宫的癌症。热的目的是通过加速制剂和癌组织间的反应速率增强损伤/破坏/消除的效果。制剂包括一种或多种成分的气体、蒸气、液体、溶液、乳液和悬浮液。如果制剂包括一种或多种成分的蒸气,热可通过在组织中将蒸气冷凝成为液体生成。如果制剂包括液体或溶液,热可从超过体温的高温制剂转移。制剂温度的范围可为-40℃至140℃、-30℃至100℃或-20℃至80℃。治疗的组织的温度可低于制剂温度且高于体温。治疗的组织的温度范围可为-40℃至100℃、-30℃至90℃或-20℃至80℃。
- 还没有人留言评论。精彩留言会获得点赞!