从生物样品的氧化还原电位测定生育力潜力的制作方法
发明领域
本发明涉及用于测量流体样品的氧化还原电位(orp)以及使用此类orp测定样品和/或受试者的生育力潜力的方法和装置。
发明背景
许多生物流体,如全血、血浆、血清、精液、子宫和阴道液具有氧化还原电位(orp)。临床上,此类流体的orp提供动物的氧化状态。更具体地,此类流体的orp与健康、疾病和生物过程的状态有关。
氧化还原系统或氧还系统涉及根据下列等式将电子从还原剂转移至氧化剂:
其中ne-等于转移的电子的数目。在平衡时,根据nernst-peters方程计算氧还电位(e),或氧化还原电位(orp):
e(orp)=eo–rt/nfln[还原剂]/[氧化剂](2)
其中r(气体常数),t(以凯氏度数(degreeskelvin)计的温度)和f(法拉第常数)是常数。eo是相对于氢电极测量的氧还系统的标准电位,其被任意分配为0伏的eo,并且n是转移的电子数。因此,orp依赖于还原剂和氧化剂的总浓度,并且orp是特定系统中总氧化剂和还原剂之间平衡的综合测量(integratedmeasure)。因此,orp提供了患者的体液或组织的整体氧化状态的测量。
氧化应激是由活性氧和活性氮类别的较高产生或内源性保护性抗氧化能力的降低引起的。氧化应激已经与各种疾病和衰老相关联,并且已经发现它在所有类型的疾病中发生,并且已经显示它影响包括受孕和妊娠在内的许多生物学过程。参见例如vegliaetal.,biomarkers,11(6):562-573(2006);rothetal.,currentopinioninclinicalnutritionandmetaboliccare,7:161-168(2004);美国专利no.5,290,519和美国专利公开文本no.2005/0142613;agarwaletal.,reproductivebiologyandendocrinology,3:28:1-21(2005);radetal.,j.caringsciences,2(4):287-294(2013)。几项调查显示了患者的氧化状态与患者的结果之间的密切相关。参见rothetal.,currentopinioninclinicalnutritionandmetaboliccare,7:161-168(2004)。
已经通过测量各种单独的标志物评估患者中的氧化应激。参见例如vegliaetal.,biomarkers,11(6):562-573(2006);rothetal.,currentopinioninclinicalnutritionandmetaboliccare,7:161-168(2004);美国专利no.5,290,519和美国专利公开文本no.2005/0142613。然而,此类测量通常是不可靠的并且提供患者的氧化状态的冲突和可变的测量。参见vegliaetal.,biomarkers,11(6):562-573(2006);rothetal.,currentopinioninclinicalnutritionandmetaboliccare,7:161-168(2004)。为了克服使用单一标志物的测量的问题,已经开发了多个标志物的测量,其然后用于提供患者的总体氧化状态的得分或其它评估。参见vegliaetal.,biomarkers,11(6):562-573(2006);rothetal.,currentopinioninclinicalnutritionandmetaboliccare,7:161-168(2004)。虽然此类复合方法比单一标志物的测量更可靠和更灵敏,但是它们是复杂且耗时的。因此,需要用于可靠地测量患者的总体氧化状态的更简单且更快速的方法。
可以电化学测量氧化/还原电位。用于测量血液、血液产品和其它生物流体的orp的电化学装置通常需要大量样品体积(即10至数百毫升)和长平衡期。此外,电化学装置具有大的、庞大的电极,其需要在样品测量之间进行清洁。此类电化学装置不太适用于常规的临床诊断测试。已经提示了使用经过处理的电极来防止生物污损。然而,此类装置必然涉及复杂的制造技术。此外,常规的电化学装置尚未提供方便在临床环境中使用的形式。
也可以在有和没有热引发的自由基产生的情况下从光化学发光(photochemiluminescent)测定生物流体(如血浆及其血液成分(如低密度脂蛋白、血清白蛋白和氨基酸))、精液(及其组分)、子宫和阴道分泌物的氧化和自由基特征。光化学发光系统通常包括自由基发生器和测量抗氧化剂存在下的化学发光变化的检测器。更具体地,为了测量抗氧化剂的存在,将含有一定量抗氧化剂的生物样品(或其组分之一)与已知量的自由基接触并起反应。以化学发光测定法测定在使生物样品接触后剩余的自由基。使用已知量的针对样品中的内源性自由基的抗氧化剂,以相似的化学发光法测量自由基。这些类型的测量和检测系统不适合用于评估或监测人或动物健康的临床环境中的生物流体样品的快速、大规模测量。
近年来,满足正常精液形态学标准的雄性比例大幅下降。从被证实的供体鉴定不育供体的精液形态学的预测值的范围为98.6%至57.9%(agarwal,a.etal.(2014).reprodbiolendocrinol,12,33;menkveld,r.,etal.(2001)humreprod,16,1165-1171.;ho,l.m.,etal.(2007),j.androl,28,158-163.)。发现形态学在鉴定不育供体方面优于精液运动性、浓度、总精液计数、仓鼠卵穿透测试(hept)或精液渗透指数的测量(ombelet,w.,etal.(1997).humreprod,12,987-993.)。更重要的是,形态学与妊娠和成功的体外受精(ivf)结果强烈相关,其中植入和妊娠的几率增加以及流产减少(vandenhoven,l.,etal.(2015).fertilsteril,103,53-58.;mortimer,d.andmenkveld,r.(2001).j.androl,22,192-205.;abuhassanabu,etal.(2012).andrologia,44suppl1,571-577)。尽管此参数的重要性,定性形态学测量比其它精液参数更具有技术、程序和主观误差。常见的精液样品可以产生变化多达30%的形态学结果(brazil,c.(2010).asianjournalofandrology,12,14-20.;auger,j.(2010).asianjournalofandrology,12,36-46)。因此,代表精液形态学的无偏差的定量测度将极大地有利于生育界。
在一些研究中,氧化应激已经与雄性的不育有关,特别是与形态学有关。(agarwal,a.,etal.(2014).systbiolreprodmed,60,206-216.;pons-rejraji,h.,etal.(2009).gynecolobstetfertil,37,529-535.;benedetti,s.etal.(2012).reprodbiomedonline,25,300-306.;zorn,b.,etal.(2003).intjandrol,26,279-285.;macanovic,b.,etal.(2015).dismarkers,2015,436236.;svobodova,m.,etal.(2009).ceskagynekol,74,399-403)。其它研究报道了更模糊的关系。(svobodova,m.,etal.(2009).ceskagynekol,74,399-403.;haghighian,h.k.,etal.(2015).fertilsteril.;beresford,m.j.,etal.(2010).clinicaloncology,22,46-55)。这些研究之间的差异在它们的方法中得到揭示。大多数研究测量单一的氧化剂家族,即活性氧类别(ros)。其它测量在氧化应激下积累的事后损伤,即脂质过氧化。最后,已经使用抗氧化剂水平或活性的变化,即总抗氧化剂容量(totalantioxidantcapacity,tac)或超氧化物歧化酶(sod)。凭借通过单一测量定义“氧化应激”的多种方式,质疑氧化应激在雄性生育力中的作用并非不合理。氧化应激是氧化剂的活性超过抗氧化剂淬灭它们的能力的状态。因此,需要将所有氧化剂活性与所有抗氧化活性进行比较作为精液形态和生育力的预测器的简单测量。本发明解决了此需要,并且也提供了其它相关的益处。
发明概述
一个实施方案是评估来自受试者的精液的生育力潜力的方法,所述方法包括测量来自所述受试者的样品的氧化还原电位(orp);比较测量的orp与参照数值;并且基于所述比较测定精液样品的生育力潜力。在一个实施方案中,测量步骤包括测量静态orp(sorp)。在一个实施方案中,测量步骤包括测量容量orp(corp)。在一个实施方案中,测量步骤包括测量sorp和corp。在一个实施方案中,参照数值是与能育精液质量参数有关的数值。在一个实施方案中,参照数值是排除参照数值(dischargereferencevalue)。在一个实施方案中,参照数值是自身参照数值(selfreferencevalue)。在一个实施方案中,若测试的样品的orp值与来自具有高生育力潜力的样品的参照数值相比显著增加,则将测试的精液样品表征为具有低生育力潜力。在一个实施方案中,若测试的样品的orp值与来自具有高生育力潜力的样品的参照数值基本上相同,则将测试的精液样品表征为具有高生育力潜力。
本发明的一个实施方案是测定来自受试者的精液样品的至少一种特征的方法,其包括:测量来自所述受试者的样品的静态氧化还原电位(sorp)和/或容量氧化还原电位(corp);比较测量的sorp和/或corp与参照数值;并且基于所述比较测定所述精液的特征。在一个实施方案中,测量步骤包括测量sorp。在一个实施方案中,测量步骤包括测量corp。在一个实施方案中,测量步骤包括测量sorp和corp。在一个实施方案中,所述至少一种特征选自下组:样品中的具有健康形态学的精子细胞的百分比、样品中能动的精子细胞的百分比、样品中的精子细胞的数目和样品中的精子细胞的浓度。在一个实施方案中,参照数值是截留值。在一个实施方案中,若测量的orp显著高于截留值,则将精液样品称为具有一种或多种选自下组的特征:样品中具有异常形态学的精子细胞的高百分比、样品中具有异常运动性(例如降低的运动性)的精子细胞的高百分比、样品中低于正常的数目的精子细胞和异常低的精子细胞浓度。在一个实施方案中,若测量的orp低于、或等于截留值,则将样品称为具有一种或多种选自下组的特征:样品中具有正常形态学的精子细胞的高百分比、样品中具有正常运动性的精子细胞的高百分比、至少正常数目的精子细胞和至少正常浓度的精子细胞。在一个实施方案中,若测量的orp小于或等于截留值,则将样品称为良好质量的或者具有高生育力潜力。
本发明的一个实施方案是评估来自受试者的卵的能力(competence)的方法,其包括:测量来自受试者的样品的静态氧化还原电位(sorp)和/或容量氧化还原电位(corp);比较测量的sorp和/或corp与参照数值;并且基于所述比较将所述卵分类为有能力的或无能力的。在一个实施方案中,测量步骤包括测量sorp。在一个实施方案中,测量步骤包括测量corp。在一个实施方案中,测量步骤包括测量sorp和corp。在一个实施方案中,参照数值是正常参照数值。在一个实施方案中,参照数值是排除参照数值。在一个实施方案中,参照数值是自身参照数值。在一个实施方案中,若测试的样品的orp值与指示有能力的卵的参照数值相比显著增加,则将测试的卵表征为无能力。在一个实施方案中,若测试的样品的orp值与指示有能力的卵的参照数值基本上相似,则将测试的卵表征为有能力。在一个实施方案中,样品选自下组:阴道样品、滤泡样品和子宫样品。
本发明的一个实施方案是评估受试者的生育力状态的方法,其包括:测量来自所述受试者的样品的静态氧化还原电位(sorp)和/或容量氧化还原电位(corp);比较测量的sorp和/或corp与参照数值;并且基于所述比较测定所述受试者的生育力状态。在一个实施方案中,测量步骤包括测量sorp.在一个实施方案中,测量步骤包括测量corp。在一个实施方案中,测量步骤包括测量sorp和corp。在一个实施方案中,参照数值是正常参照数值。在一个实施方案中,参照数值是排除参照数值。在一个实施方案中,参照数值是自身参照数值。在一个实施方案中,若测试的样品的orp值与指示降低的生育力的参照数值相比显著增加,则将所述受试者鉴定为已经具有降低的生育力。在一个实施方案中,若测试的样品的orp值与指示生育力的参照数值基本上相似,则将所述受试者鉴定为能育的,或实现正常生育力。在一个实施方案中,样品选自下组:精液样品、精液流体(seminalfluid)样品、子宫样品、阴道样品或滤泡样品。
本发明的一个实施方案是评估受精卵会建立并且维持成功妊娠的可能性的方法,其包括:测量培养所述受精卵的培养基的静态氧化还原电位(sorp)和/或容量氧化还原电位(corp);比较侧量的sorp和/或corp与参照数值;并且基于所述比较测定卵建立并且维持成功的妊娠的能力。在一个实施方案中,测量步骤包括测量sorp。在一个实施方案中,测量步骤包括测量corp。在一个实施方案中,测量步骤包括测量sorp和corp。在一个实施方案中,参照数值是正常参照数值。在一个实施方案中,参照数值是放电参照数值。在一个实施方案中,参照数值是自身参照数值。在一个实施方案中,若测试的样品的orp值与指示卵可能建立并且维持成功妊娠的参照数值相比显著增加,则将测试的受精卵鉴定为不大可能建立并且维持成功的妊娠。在一个实施方案中,若测试的样品的orp值与指示卵可能建立并且维持成功妊娠的参照数值基本上相似,则将测试的受精卵鉴定为可能建立并且维持成功的妊娠。
本发明的一个实施方案是改善受精卵会建立并且维持成功妊娠的几率的方法,其包括:测量培养所述受精卵的培养基中的静态氧化还原电位(sorp)和/或容量氧化还原电位(corp);比较测量的sorp和/或corp与参照数值;并且基于所述比较测定用于将所述受精卵转移入子宫中的最佳时间。在一个实施方案中,sorp和/或corp与阈值数值的相等指示应当将所述卵转移至子宫。在一个实施方案中,所述阈值数值代表下述sorp和/或corp值,高于所述sorp和/或corp值,建立和维持成功妊娠的几率与用具有所述阈值数值或更低数值的受精卵进行的转移相比显著降低。
在所有前述实施方案中,测量的步骤可以是测量sorp、测量corp或测量sorp和corp。另外,所有前述实施方案中的参照数值可以是下列一项或多项:正常参照数值、条件特异性参照数值和自身参照数值。
附图简述
图1描绘了根据本发明的实施方案的用于测量流体的氧化-还原电位容量的系统的组件;
图2显示了根据本公开的实施方案的读出装置的组件;
图3显示了根据本公开的实施方案的读出装置的进一步方面;
图4描绘了根据本发明的实施方案的测试条;
图5是描述根据本公开的实施方案的用于测量氧化-还原电位容量的方法的方面的流程图;和
图6是描绘随时间提供的电流和测量的电位差的图。
图7显示了基于sorp/浓度(mv/106个精子/ml),从作为精液(x轴)和再次作为精浆(y轴)测试的样品测量的sorp值之间的比较。
图8显示了精液和精浆的原始sorp值(mv)之间的比较。
图9显示了冷冻样品对精液和精液流体的sorp值的影响。
图10显示了时间对精液(10a)或精浆(10b)的sorp/浓度值的影响。x轴是0分钟时的精液(10a)或精浆(10b)的sorp浓度值。y轴是在120分钟时精液(10a)或精浆(10b)的sorp/浓度值。
图11显示了时间对精液(10a)和精浆(10b)的sorp值(mv)的影响。每个图中的左柱形是0分钟的sorp值(mv)。每个图中的右柱形是120分钟的sorp值(mv)。
图12:用于预测生育力的sorp截留值的测定。a)显示来自能育(左柱形)和不育(右柱形)样品的sorp/浓度值的比较,如根据who生育力标准确定的。b)显示了用于鉴定最好的分离能育样品与不育样品的sorp值的接收器操作特性(roc)分析。锯齿状线表示与各种灵敏度(y轴)和特异性(x轴)水平相关联的sorp值。实线直线代表基于统计几率的预测能力。两条线之间的面积代表auc。
图13显示了来自具有正常射精体积(>1.5ml)的样品和具有异常体积的样品的sorp/浓度值的比较。
图14显示了来自具有正常精子细胞数(>39×106个精子)的样品和具有异常精子细胞数的样品的sorp/浓度值的比较。
图15显示了来自具有正常精子细胞浓度(>15×106个精子/ml)的样品和具有异常精子细胞浓度的样品的sorp/浓度值的比较。
图16显示了来自具有总运动精子的正常百分比(>40%)的样品和具有异常精子细胞运动性的样品的sorp/浓度值的比较。
图17显示了来自具有上前运动(progressivelymotile)精子的正常百分比(>32%)的样品和具有异常向前运动性的样品的sorp/浓度值的比较。
图18显示了来自具有正常百分比的具有健康形态学的精子(>4%)的样品和具有异常精子细胞形态学的样品的sorp/浓度值的比较。
图19基于sorp值评估精子形态学可预测性的roc分析。曲线表示与各种灵敏度(y轴)和特异性(x轴)水平相关的sorp值,用于区分精子形态学。实线直线代表基于统计几率的预测能力。两条线之间的面积代表曲线下面积(auc)。
发明详述
本发明的实施方案提供适用于快速、常规临床诊断测试的用于测量流体的氧化-还原电位(orp)特性(即静态氧化还原电位(sorp)和/或氧化还原容量(corp))的系统和方法和使用所述系统评估或监测受试者状态的方法。系统通常包括测试条和读出装置。更具体地,本发明的实施方案可以以方便和及时的方式测定患者的体液的orp特性。可用于本发明方法的患者的生物样品可以是任何体液。合适的体液包括血液样品(例如全血、血清或血浆)、尿液、唾液、脑脊液(csf)、泪液、精液、精液流体(seminalfluid)、阴道或子宫分泌物、滤泡液、羊水和脐带血。此外,可以使用灌洗液、组织匀浆物、体液的组分(例如血细胞,精子等)和细胞裂解物,并且如本文中所用,“体液”包括此类制备物。优选地,体液是血液、血浆、精液或精液流体、阴道液、子宫液或滤泡液。在一些实施方案中,流体可以是细胞培养液,诸如例如用于精子和/或卵子培养的细胞培养基。
测试条通常包括基板(substrate)、参照槽(referencecell)、对电极、工作电极、参照电极和样品室(samplechamber)。通常,通过在样品室中放置流体样品,在参照槽、对电极、工作电极和参照电极之间建立电连接。然后,测试条可以连接到读出装置,用于测定静态orp值和orp容量值。
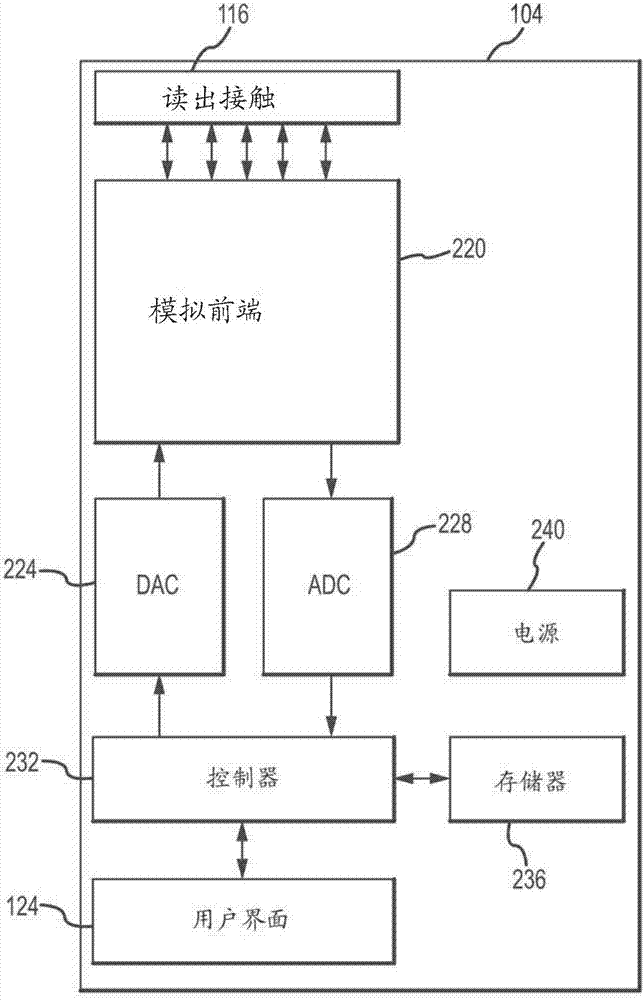
读出装置通常包括将读出装置电互连到包括在测试条中的各种电极的触点。根据本公开的实施方案,读出装置包括模拟前端(analogfrontend)。模拟前端通常发挥功能以提供受控电流,其可以通过与对电极和工作电极的电连接在样品室中的液体间发送。此外,模拟前端可操作以产生表示参照电极和工作电极之间的电位差的电压信号。提供模拟至数字(analogtodigital,adc)转换器以将表示参照电极与工作电极电位差的电压信号转换为数字信号。结合提供受控电流到测试条,提供数字至模拟转换器(dac)以将数字控制信号转换成模拟信号。控制器与adc和dac接口。此外,控制器可以包括或包含执行控制读出装置的各种功能的程序代码的处理器,包括但不限于控制向测试条的电流供应,以及处理电位差测量信号。控制器可以与存储器关联运行。另外,读出装置包括用户界面和电源。
图1描绘了根据本公开的实施方案用于测量流体样品的氧化-还原电位(orp)值(包括但不限于静态氧化-还原值(sorp)和/或氧化-还原容量值(corp))的系统100的组件。如本文中所用,sorp是流体样品间的测量电位差或电压,诸如放置在如本文中所述的包括参照槽的测试条中的流体样品间的测量电位差或电压。如本文中所用,corp是在限定的时间段内提供给流体样品的电荷量的量度,如可以在如本文所述的测试条中测量。因此,corp可以视为在某个限定的时间段内流体样品吸收作为电流提供的电荷的容量。例如,时间段可以由对应于对样品的电流供应的启动的起始点和端点诸如拐点(inflectionpoint)或第一和第二拐点之间的中点(midpoint)定义。通常,系统100包括读出装置104(其可以执行电流计)和测试条108。读出装置104包括连接器或读出孔(readoutaperture)112,用于将读出装置104的读出触点(readoutcontact)116电互连到作为测试条108的部分提供的电极触点120。读出装置104还可以整合用户界面124,其可以包括用户输出126,诸如显示器,和用户输入128诸如键盘。根据其它实施方案,用户界面124可以包括诸如触摸屏界面的集成组件(integratedcomponent)。除了提供用于将测试条108互连到读出装置104的触点120之外,测试条108还包括在测试条覆盖层(teststripoverlay)136中形成的样品室孔132,以接受流体样品且与测定该流体样品的orp值相关。
图2显示了根据本公开的实施方案的读出装置104的附加组件和特征。如所示,读出触点116互连到模拟前端220。如本文其它地方更详细描述,模拟前端220通常发挥功能以提供受控电流,该受控电流在测试条108的对电极和工作电极间通过。此外,模拟前端220发挥功能以提供表示测试条108的参照电极和工作电极之间的电位差的电压信号。根据另外的实施方案,模拟前端220可以包括条检测电路(stripdetectcircuit),以提供指示测试条108与读出装置104的互连的信号。
模拟前端220通常接收来自数字至摸拟(dac)转换器224的控制信号。模拟前端220信号输出通常提供给摸拟至数字转换器(adc)228。dac224和adc228继而与控制器232连接。控制器232可以包括处理器,其可操作以执行存储在作为控制器232的部分的存储器,或者作为单独的存储器装置236中的指令。例如,处理器(执行存储在存储器236中的指令)可以实现根据其控制提供给测试条108的电流的进程。此外,控制器232可以执行存储在存储器236中的指令,以记录提供给测试条108的电流量,以检测测试条108的电极之间的电压电位的拐点,并计算orp容量。存储器236还可以作为数据的存储发挥功能,包括但不限于中间和/或最终的orp值。控制器232例如可以包括通用可编程处理器或控制器或专门配置的应用集成电路(asic)。
用户界面124通常运行以向控制器232提供用户输入。此外,用户界面124可以运行以向用户显示信息,包括但不限于一般地读出装置104或系统100的状态、sorp值和corp值。
读出装置104还通常包括电源240。尽管图中未显示,电源240通常经由电源总线互连到功耗装置(powerconsumingdevice)。电源240可以与电池或其它能量存储装置,和/或线路电力(linepower)相关联。
现在参照图3,描绘了根据本公开的实施方案的系统100的附加特征。更具体地,描绘了模拟前端220和与测试条108相关联的电路的细节。如所示,读出触点116互连到电极导线(electrodelead)或触点120,以将模拟前端220电连接到测试条108。在例示的实施方案中,模拟前端220包括测试条感测电路(teststripsensecircuit)304。测试条感测电路304包括测试条检测供应导线308和测试条检测输入导线312。通常,当合适的测试条108可操作地连接到读出装置104时,建立测试条检测供应导线308和测试条检测输入导线312之间的连续性(continuity),,允许指示存在测试条108的测试条检测信号在供应308和输入312导线之间通过。此外,测试条108可以并入电阻器(resistor)或用于修改测试条检测信号的其它组件,以向读出装置104指示已经与读出装置104互连的特定测试条108的特性,诸如对测试条108并入的参照槽的电压值。读出装置104可以响应感测到测试条108的存在而运行,以便以受控电流的形式向测试条108提供询问信号。
通过读出装置104经由对电极导线316和工作电极导线320将电流提供给测试条108的样品室132。更具体地,可以从电流跟随器324的输出向对电极导线316提供电流,而工作电极320可以作为所述电流跟随器324的输入提供。此外,一组电流范围选择电阻器328和相关联的开关332可以由dac224控制,如由控制器232指导,例如取决于互连的测试条108的特性。此外,如由控制器232指导,dac224可以控制对电流跟随器324的输入,继而控制通过电流电极导线316提供给测试条108的电流量。如通过控制器232指导,dac224还可以操作各种开关和/或放大器来控制模拟前端220的操作模式。
另外,模拟前端220包括静电计(electrometer)336,其接收来自参照电极导线340的第一输入信号和来自工作电极导线320的第二输入信号。来自静电计336的输出通常表示参照电极导线340和工作电极导线320之间的电位差。由静电计336输出的信号可以在增益电路(gaincircuit)344中放大,并输出到adc228。
图4描绘了根据本发明的实施方案的测试条108的方面。更具体地,由图4呈现的视图显示了除去测试条覆盖层136的测试条108。通常,测试条108包括工作电极404、参照电极408和对电极412。此外,测试条108包括参照槽416。通过将流体样品放置在样品室区域420内,工作电极404、参照电极408、对电极412和参照槽416置于彼此电接触。此外,通过分别将对应于对电极412、工作电极404和参照电极408的电极触点120置于与对应于对电极导线316、工作电极导线320和参照电极导线340的读出触点116接触,测试条108可操作地连接到读出装置104。因此,提供给测试条104的供应电流可以通过读出装置104在对电极412和工作电极404之间穿过流体样品发送。此外,参照电极408和工作电极404之间的电位差可以由读出装置104感测。根据本公开的其它实施方案,测试条108可以包括测试条检测电路424,其包括输入428和输出432。除了输入428和输出432之外,测试条检测电路424还可以包括电阻器或用于修改由读出装置104提供的测试条感测信号的其它组件,以向读出装置104指示测试条108的鉴定(identification)。
为了测量corp或抗氧化剂储备(reserve),用计数器和工作电极之间的线性增加的氧化电流(oxidizingcurrent)滴定样品,以在工作电极处耗尽相关的抗氧化剂,同时监测工作电极和参照电极之间的电压。结果是时间对电压曲线和时间对电流曲线。时间对电压曲线用于寻找电压变化最快的拐点(抗氧化剂耗尽,因此系统试图寻找新的平衡)。最大速度(即拐点处)的时间称为转变时间(transitiontime)。容量或corp是从开始到转变时间的电流概貌(profile)积分,单位为uc。
转变时间的计算可以通过几种方式完成,包括噪声过滤、曲线拟合和标准数值微分技术(standardnumericaldifferentiationtechnique)。通常,未过滤的数值导数(derivative)是有噪声的,使得发现最大值是困难或不可靠的。为此,一种技术是使用多项式(5至7阶通常是足够的)并在分析上直接区分得到的多项式曲线拟合时间对电压概貌。这种方法具有非常平滑的导数的优点,使转变时间的测定变得稳健,只要拟合是良好的。
图5是显示根据本发明的实施方案的用于测定流体样品的orp(包括但不限于corp)的系统100的操作的方面的流程图。通常,方法包括获得流体样品并将流体样品置于测试条108的样品室420中(步骤504)。在步骤508,测试条108连接到读出装置104(步骤508)。通常,当读出装置104处于开机或待机模式时,测量条检测输出导线308可以输出电信号。通过将合适的测试条108连接到读出装置104,建立测试条检测输出导线308和测试条检测输入导线312之间的连续性。此外,在测试条检测输入导线312处接收的信号可以提供测试条108的特性的指示,其可以继而用于控制提供给测试条108的电流的方面(例如,电流范围)。此类特征可以包括但不限于测试条电极404、408和412的类型和组成以及参照槽416的电位。
在步骤512,读出装置104可以将电流提供给测试条108的对电极412。更具体地,可以通过对电极导线316和工作电极导线320在对电极412和工作电极404之间通过电流。根据本公开的实施方案,提供给测试条108的电流由读出装置104的控制器232控制。更具体地,可以以选择的稳态水平提供电流至少持续第一时间段。第一时间段可以是固定的时间段。或者,一旦已经确定读出装置104在参照电极408和工作电极404之间感测到的电位差具有小于某个选定量的变化率,则第一时间段可以期满。根据其它实施方案,可以应用参数的组合测定在稳定状态下提供电流的时间段。此外,根据其它实施方案,在第一时间段期间不提供电流(即,在第一时间段期间的供应电流为零)。本领域技术人员在考虑了本公开内容后可以理解,虽然不提供电流并且虽然该电位差的变化率为零或小于某个选定量,但由读出装置104在参照电极408和工作电极404之间测量的电位差等于流体样品的sorp。
在第一时间段已经期满后,可以以增加的速率提供电流(步骤516)。例如,可以根据不同概貌的组合,或以任何其它方式,以指数方式作为阶梯函数线性增加量。例如,电流可以以规定速率从0安培线性增加直到达到端点。作为另一例子,量可以从0安培步移到某个非零值,并且所述非零值可以以稳定的速率提供某个时间段,或者可以根据某种函数以增加的速率提供。在步骤520中,可以测定是否已经检测到参照电极408和工作电极404之间监测的电位差中的拐点。更具体地,参照电极导线340和工作电极导线320将参照电极408和工作电极404分别连接到静电计336,所述静电计336输出表示参照电极408和工作电极404之间的电位差的信号。然后,模拟至数字转换器228将表示参照值408和工作404电极之间的电位差的信号转换为提供给控制器232的数字信号。如果已经检测到拐点,则读出装置104,以及特别地,控制器232可以记录从第一次提供电流的时间至达到拐点的时间。此外,控制器232可以对电流信号进行积分以测定已经提供给流体样品直到达到拐点时的电荷量(步骤524)。根据本公开的实施方案,使用第一拐点(例如,当在正在供应电流时在流体样品间测量的电压处于局部最大变化率的点)作为电流积分停止的点。然而,可以在测量的电压中观察到多个拐点。因此,不是使用第一观察到的拐点作为积分的终点,可以使用随后的拐点。作为另一例子,可以使用参照多个拐点测定的时间,如两个观察到的拐点之间的中点或多个观察到的拐点的平均时间,作为积分的终点,用于测定流体样品的corp。在步骤528,可以例如通过作为读出装置104的一部分或者互连到读出装置104的用户接口124的输出装置128设施,将测定的电荷量或从测定的电荷量导出的值作为流体样品的orp容量(corp)值输出给用户124。例如,corp值可以相对于电荷量定义为1(thecorpvaluecanbedefinedasoneoverthequantityofcharge)。然后,过程可以结束。
图6描绘了由读出装置104随时间向互连的测试条108提供的电流(如线604所示)。此外,描绘了针对不同示例性样品的样品测量电位差值608a-c。如本领域技术人员在考虑了本公开内容后可以理解,尽管显示了三个电位差值608,但是在测定orp值期间仅向一个流体样品提供电流604。如本领域技术人员在考虑了本公开之后也可以理解,显示了电流604的倾斜部分(rampedportion),以向下方向倾斜,因为它描绘了氧化电流。此外,可以理解,电流曲线604与持续选定时间段的电流值零之间的面积表示提供给测试条108中保持的流体样品的电荷量。因此,此电荷量可用于提供流体样品的orp容量(corp)的测量值。此外,电压曲线608表示在不同时间点的相应流体样品的静态orp(sorp)值。用于测定corp的电流曲线604(其在曲线604之上,在该曲线和图6中的零电流之间)下的面积可以具有在第一时间点的起始点和第二时间点的终点。作为例子,可以选择用于电流604积分的起始点作为观察到的sorp信号或读数已经稳定的点。例如,在图6的例子中,经过了约50秒后电位差值已经稳定。此外,在该例子中,在第一时间段期间,读出装置104没有向样品提供电流,直到供应电流的起始点。该起始点也可对应于以增加的速率开始施加电流604的时间。根据本公开的实施方案,在曲线608达到拐点,例如测量电位差的变化率处于最大值的点(即,最大斜率点)的情况下,电流信号604的积分停止。例如,查看曲线608b,可以在约200秒时看到拐点,因此可以在从50秒开始并在200秒结束的时段内进行电流604的积分。或者,可以在某个预定的时间段后停止电流信号604的积分。作为另一个备选,可以在观察到拐点的早期或预定时间段的期满时停止电流信号604的积分。
如本领域技术人员在考虑了本公开内容后可以理解,sorp值的测量可以以伏特为单位,因此电流信号或值604的积分给出表示以库仑计的电荷量的值。作为电荷数目的度量,corp值在此相对于以库仑计的电荷数目表示为1。特别地,通过采用观察到的电荷数目的倒数,获得更正态的分布,便于将参数统计量应用于观察到的orp值。如本文中所用,术语orp容量、倒数容量水平(inversecapacitylevel)、倒数容量orp(inversecapacityorp)或icl都等同于如上定义的corp。应当理解,相对于电荷数目将corp表示为1涵盖备选的等同表示。
如上所述,高于正常值的sorp指示氧化应激,并且通常认为是评估的受试者的阴性指示。corp是受试者承受氧化损伤(oxidativeinsult)的容量的量度。因此,一般地,它是受试者具有正常或更高容量以承受氧化损伤的积极指标。由于corp定义为达到电压拐点的电荷数目的倒数,较高的corp值指示较小的容量以承受氧化损伤,同样,较低的corp值指示较大的容量以承受氧化损伤。
本发明包括通过测定患者的生物样品的orp特征来监测或评估患者就其生殖能力(例如,生育力,妊娠能力等)而言的健康的实施方案。通常,将患者的orp特征与所述患者相关的一种或多种orp特征参照数值进行比较。如本文中所用,参照数值可以是患者没有所讨论的状况(例如,当他/她是能育/孕的)的时间或从患者具有所讨论的状况的较早时间段(为了监测或评估其状况或治疗的目的)起的患者的orp特征。此类参照数值称为自身参照数值。例如,参照数值也可以包括初始值、最大值和结束参照数值,如当orp特征在时间范围内进行评估时,如当已知患者是能育(初始)时,并且在已知患者是低生育力(sub-fertile)或不育(结束)时。或者,参照数值可以是相关健康群体(例如,在物种、年龄、性别、种族等中的一个或多个特征上匹配的能育群体)的orp特征。此类参照数值称为正常参照数值。此外,参照数值可以是类似地处于患者地位的相关群体(例如,与患者具有相同或相似的正对所述患者治疗的状况(例如,低生育力或不育)的群体,并且优选地在物种、年龄、性别、种族等的一个或多个特征上也匹配的群体)的orp特征。此类参照数值称为条件特异性参照数值。例如,条件特异性参照数值可以是从低生育力或不育个体、无能力的卵或具有低生育力潜力的精液样品获得的orp值。
如本文中所用,受试者是针对orp特征测试生物样品所来自的任何个体。如果受试者是被医疗专业人员治疗的个体,则术语受试者可以包括患者。术语受试者和患者可以指任何动物,包括人和非人动物,如伴侣动物(例如猫、狗、马等)和牲畜动物(即,饲养用于食物目的的动物如牛、山羊、鸡等)。优选的受试者包括哺乳动物,最优选包括人。
如本文中所用,术语卵、卵母细胞、卵子等可以互换使用,指尚未受精的雌性生殖细胞。同样,术语精液和精子可以互换使用,指雄性生殖细胞。根据本公开,术语精液、精液样品等具有本领域中使用的标准含义。也就是说,精液是雄性生殖液,包括精子和来自精囊的流体和来自前列腺和其它生殖腺的流体。
在本发明的多个实施方案中,测量受试者的生物样品的orp特征。可以在一个或多个时间点进行生物样品的orp特征的测量。这种测量的频率将取决于所评估的状况。例如,评估雄性受试者的生育力可需要单次测试。相比之下,例如,对雌性受试者的生育力的评估可需要通过整个月经周期进行定期检测。类似地,在处理阶段期间测定卵能力或精液质量可以需要定期测试。因此,例如,可以每30分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时或18小时进行测试。或者,可以每天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或1年针对更长期的状况进行测试。
在本发明的多个实施方案中,测量受试者的生物样品的orp特征,用于评估精子质量、评估卵子质量、评估生育力、选择卵子、合子或胚胎进行植入或在转移受精卵(如合子,胚囊等)到雌性后监测妊娠的目的。在这些实施方案中,方法还可以包括在受试者中鉴定生育力的风险因素,如生活方式或遗传风险因素。
精子质量
成功妊娠的一个重要方面是样品(例如精液样品)中精子的数目和质量。因此,现行的生育力评估方法涉及计算具有正常运动性(运动)和形态学(形状)的精子细胞数目以及精液的化学和生物化学特性(如ph、颜色、浊度、液化和粘度)的评估。然而,已经变得明显的是,精液的氧化状态影响精子的质量。例如,已经显示氧化应激是dna片段化的主要原因(wright,etal.,reprodbiomedonline2014jun;(28(6):684-703);salehra,etal.2003jun;7suppl3:1597-605),并且此类片段化是生育力潜力的主要指标,甚至比常规精液参数更重要。因此,减少氧化应激可以改善精子质量,从而改善成功妊娠的几率。因此,在本发明的一个实施方案中,来自个体的精子的质量通过测量来自个体的样品的orp特征并评估orp特征是否与参照orp值的orp特征显著不同来确定。测量的orp可以是sorp和/或corp。测量的orp值也可用于测定orp/浓度(orp/浓度)值(例如,mv/106个精子/ml)。然后,从该比较中确定样品和/或个体的生育力潜力。在这种方法中,orp特征相对于已知具有高生育力潜力的样品的orp特征的显著增加指示样品或个体具有低的生育力潜力。同样,与已知具有低生育力潜力的样品(大约相同)的orp值相似的orp值指示测试的样品具有低生育力潜力。如本文中所用,并且特别是精子,生育力潜力是指个体精子使卵受精的能力。这种受精潜力可以包括涉及精子的受精的任何方面,如精子通过雌性生殖道的转运、精子穿透其已经接触的卵的能力、精子细胞进入卵和细胞分裂的启动。具有高生育力潜力的精子能够成功地穿过雌性生殖道,穿透卵子,并且启动细胞分裂和胚胎发育过程。在优选的实施方案中,样品是新鲜收集的样品。
如已经讨论的,orp可用于测定精液或精液流体样品的质量和生育力潜力。精液质量和生育力潜力可以与已知与精子细胞使卵受精和引发胚胎发育的能力有关的任何精子特征有关。这些特征的实例包括但不限于射精(即精液)的粘度、射精液化的能力、射精中的精子细胞总数、射精中精子细胞的浓度、精子细胞的总运动性、精子细胞的向前运动性和精子细胞的形态学。可以通过增加的orp值的存在来鉴定异常特征。因此,在本发明的一个实施方案中,来自个体的精液的质量通过测量来自个体的样品的orp特征并评估orp特征是否与参照orp值的orp特征显著不同来测定。如本文中关于参照orp值和截留值所使用,术语显著不同等指至少10%、至少15%或至少20%的差异。如果参照orp是特定的截留值,则舍入时大于截留值的任何值认为是显著的。例如,如果截留值为1.0,则测量的1.06的orp值将舍入1.1,并认为是显著的。此外,测量的1.04的orp值将舍入1.0,并且认为不是显著的。在一个实施方案中,通过测量来自个体的样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同测定来自个体的精子的生育力潜力。在一个实施方案中,如果测得的orp值显著高于参照orp值,则测试的精子样品称为具有低生育力潜力。在一个实施方案中,如果测量的orp值与参照orp值大致相同,则测试的精子样品称为具有高生育力潜力。
本发明的一个实施方案是测定来自受试者的样品中的精子细胞数是否在正常范围内(因此在能育范围内)的方法,所述方法包括测量样品的orp特征,将测量的orp值与一个或多个确定为预测样品中精子细胞数的参照orp值(例如,截留值)比较;使用比较结果确定测量样品中的精子细胞数是否在正常范围内。例如,可以将从精液或精液流体样品获得的orp值与确定预测精子细胞的正常数目的orp截留值或orp值的范围进行比较。如果测量值与截留值大致相同或更小,或者在确定为预测精子细胞的正常数目的orp值的范围内或与该范围大致相同,测量的样品称为具有正常数目的精子细胞。因此,认为样品是能育的,或具有良好的生育力潜力(质量好)。如果所测量的orp值显著大于截留值,或显著在确定为预测精子细胞正常数目的orp值的范围之外,则测量的样品将称为具有异常数目(例如,太少)的精子细胞。因此,认为样品是不育的,或具有差的生育力潜力(质量差)。
本发明的一个实施方案是测定来自受试者的样品中的精子细胞的浓度是否处于正常浓度范围内(因此在能育浓度范围内)的方法,所述方法包括测量样品的orp特征,将测得的orp值与一个或多个确定为预测精子细胞浓度的参照orp值(例如截留值)进行比较;使用比较结果确定测定样品中精子细胞的浓度是否在正常范围内。例如,从精液或精液流体样品获得的orp值可以与orp截留值或确定为预测精子细胞的正常浓度的orp值的范围进行比较。如果测量值与截留值大致相同或更小,或者在确定为预测精子细胞的正常浓度的orp值的范围内或与所述范围大致相同,则测量的样品称为具有正常浓度的精子细胞。因此,认为样品是能育的,或具有良好的生育力潜力(质量好)。如果测得的orp值显著大于截留值,或者显著在确定为预测精子细胞正常浓度的orp值范围之外,则测量的样品称为具有精子细胞的异常浓度。因此,认为样品是不育的,或具有差的生育力潜力(质量差)。
本发明的一个实施方案是测定精液或精液流体样品是否具有总运动精子细胞的正常百分比(并因此认为能育)的方法,该方法包括测量样品的orp特征,将测量的orp值与一个或多个确定为预测总运动精子细胞的正常百分比的参照orp值(例如,截留值)比较;使用比较结果确定测量样品中总运动精子细胞的百分比是否在正常范围内。例如,可以将从精液或精液流体样品获得的orp值与orp截留值或确定为预测总运动精子细胞的正常百分数的orp值的范围进行比较。如果测量值与截留值大致相同或小于截留值,或者在确定为预测具有总运动精子细胞的正常百分比的样品的orp值的范围内或与该范围大致相同,则测量的样品称为具有总运动精子细胞的正常百分数。因此,认为样品是能育的,或具有良好的生育力潜力(质量好)。如果测量的orp值显著大于截留值,或者显著在确定为预测具有总运动精子细胞的正常百分比的样品的orp值外,则测量的样品称为具有总运动精子细胞的异常百分比(例如太少)。因此,认为样品是不育的,或具有差的生育力潜力(质量差)。
本发明的一个实施方案是测定精液或精液流体样品是否具有向前运动的精子细胞的正常百分比(因此认为能育)的方法,该方法包括测量样品的orp特征,将测量的orp值与一个或多个确定为预测具有正常百分比的向前运动精子细胞的样品的参照orp值(例如,截留值)比较;使用比较结果确定测量样品中向前运动精子细胞的百分比是否在正常范围内。例如,从精液或精液流体样品获得的orp值可以与orp截留值,或者确定为预测具有正常百分比的向前运动精子细胞的样品的orp值范围进行比较。如果测量值与截留值大致相同或更小,或者在确定为预测具有正常百分比的向前运动精子细胞的样品的orp值的范围内或与该范围大致相同,则测量的样品称为具有正常百分比的向前运动精子细胞。因此,认为样品是能育的,或具有良好的生育力潜力(质量好)。如果测量的orp值显著大于截留值,或显著在确定为预测具有正常百分比的向前运动精子细胞的样品的orp值的范围之外,则测量的样品称为具有异常百分比(例如,太少)的向前运动精子细胞。因此,认为样品是不育的,或具有差的生育力潜力(质量差)。
本发明的一个实施方案是测定精液或精液流体样品是否具有正常百分比的具有健康形态学的精子细胞(因此认为能育)的方法,该方法包括测量样品的orp特征,将测量的orp值与确定为预测其中正常百分比的精子细胞具有健康形态学的样品的一个或多个参照orp值(例如,截留值)比较;使用比较的结果来确定在测量样品中具有健康形态学的精子细胞的百分比是否在正常范围内。例如,从精液或精液流体样品获得的orp值可以与orp截留值或确定为预测其中正常百分比的精子细胞具有健康形态学的样品的orp值的范围进行比较。如果测量值与截留值大约相同或小于截留值,或者与确定为预测其中正常百分比的精子细胞具有健康形态学的样品的orp值的范围内或与该范围大约相同,则测量的样品称为具有正常百分比的具有健康形态学的精子细胞。因此,认为样品是能育的,或具有良好的生育力潜力(质量好)。如果测量的orp值显著大于截留值,或者显著在确定为预测正常百分比的精子细胞具有健康形态学的样品的orp值范围之外,则测量的样品称为具有异常百分比(例如,太少)的具有健康形态学的精子细胞。因此,认为样品是不育的,或具有差的生育力潜力(质量差)。如本文中所用,术语健康形态学是指具有适当物理特性的精子细胞,使得精子能够对卵进行受精。这些特征的实例包括但不限于精子头的平滑度、精子头的形状、精子头的大小、顶体的大小和清晰度(definition)、头部或尾部中空泡(vacuoles)的存在或缺乏、尾部的长度、尾部缺陷(例如,分开或分叉的尾部)的存在或缺乏以及尾部充分推进精子前进的能力。允许精子细胞使卵受精的合适的物理特性是本领域技术人员已知的。
如上所述,本文中公开的方法可用于区分具有高生育力潜力的精子样品和具有低生育力潜力的样品。因此,本发明的方法也可用于测定样品是否需要额外的步骤或处理以成功受卵受精。因此,在某些实施方案中,在测定样品具有良好的生育力潜力后,可以将样品或受试者称为不需要进一步处理以使样品或受试者成功使卵受精。在某些实施方案中,在测定样品具有差的生育力潜力(由于例如精子细胞太少、精子细胞浓度太低、运动性差、不良的不健康的或异常的形态学等)后,样品或获得样品的受试者可以称为需要进一步加工或处理以便成功地使卵受精。此类指定可以由医学专业人员(例如,医生、医生助理、护士或实验室技术人员)进行,或者它可以由诸如计算机的装置来确定,所述装置在比较结果的测定或接收后编程为测定(将比较的结果关联)有用的过程或治疗过程。用于增加成功受精的可能性的有用的治疗过程和方法是本领域技术人员已知的。在某些实施方案中,对受试者(例如患者)进行测定或报告对受试者(例如,患者)测定的结果的个体或任何与个体相关的机构(例如,医院、诊所、医生办公室等)也可以实施治疗疗程的有用过程。在某些实施方案中,个体或与个体相关的任何机构(例如,医院、诊所、医生办公室等)可以将样品或受试者(例如,患者)引导到第二方或机构(例如生育力诊所)用于进一步加工或治疗。本发明的一个实施方案是一种用于测定来自受试者的精液样品对卵进行受精的能力的系统,该系统包括:
本发明的第一装置,用于测量本发明的样品的orp值;
第二装置,其包括存储在计算机可读介质上的一组计算机指令,以及中央处理单元(cpu),所述计算机指令可由cpu执行,
其中所述第一装置能够从所述第一装置接收所述orp值,并且其中当从所述第一装置接收所述orp值时,所述第二装置测定所述样品的质量或生育力潜力。在一个实施方案中,第一和第二装置通过能够将测量的orp值从第一装置转移到第二装置的电组件物理连接。在某些实施方案中,电组件是电线、电缆或总线。在一个实施方案中,通过将所测量的orp值与存储在第一或第二装置中的如本文已经公开的截留orp值或orp值范围进行比较测定质量或生育力潜力。在进一步的实施方案中,在测定样品的质量或生育力潜力之后,第二装置测定并且可选地输出用于提高样品或受试者的质量或生育力潜力的有用过程或处理。
根据本公开,参照orp值或数值的范围可以是已经凭经验测定相关的质量、生育力潜力和/或其它特定特征(例如,精子细胞数目、精子细胞浓度、运动性,形态学)的任何sorp值或数值的范围。因此,例如,参照sorp值或数值范围可以来自具有较差的质量、低生育力潜力、低精子细胞数、低精子细胞浓度、低百分比的具有正常运动性的精子细胞或低百分比的具有正常形态学的精子细胞的样品。或者,参照sorp值或数值的范围可以来自具有高质量、高生育力潜力、正常数目的精子细胞、正常浓度的精子细胞、正常百分比的具有正常运动性的精子细胞或正常百分比的具有正常形态学的精子细胞的样品。参照数值可以与测试样品的sorp值同时获得,或者它可以是历史参照sorp值(即从临床和/或实验数据的先前收集获得)。本领域技术人员能够鉴定和应用适当的参照sorp值。
参照sorp的一个例子是能够区分能育精子(在所有精液参数上实现正常值的那些样品)与非能育精子(那些通不过一项或多项参数的精子)的截留值。虽然不意图将本发明限于具体公开,但是本文中公开了此类截留值的一个例子。因此,本发明的一个实施方案是用于测定精子样品是否能育或不育的方法,所述方法包括测定样品的sorp或sorp/浓度,并将测量的sorp或sorp/浓度数值与截留值比较。在一个实施方案中,截留值约为1.635mv/106个细胞/ml。本领域技术人员将理解,按照测试间或每天为基础,此类临床值可以略有变化。因此,关于术语“约”,本领域技术人员将能够确定术语约涵盖多少变化。一般地,此类变化是1%、2%、3%、4%或5%。在一个实施方案中,将具有sorp/浓度值小于约1.635mv/106个细胞/ml的精子样品鉴定为能育的。在一个实施方案中,具有sorp/浓度值大于约1.635mv/106个细胞/ml的精子样品鉴定为不育的。
参照sorp的第二个例子是能够区分具有正常精子形态学的精液与具有异常精子形态学的精液的截留值。虽然不意图将本发明限于具体公开,但是本文中公开了此类截留值的一个例子。因此,本发明的一个实施方案是用于从具有异常形态学的精子测定精液样品是否具有有正常形态学的精子的方法,所述方法包括测定样品的sorp或sorp/浓度,并且比较测量的sorp,或sorp/浓度数值与截留值。在一个实施方案中,截留值约为3.29mv/106个精子/ml。本领域技术人员将理解,按照测试间或每天为基础,此类临床值可以略有变化。因此,关于术语“约”,本领域技术人员将能够确定术语约涵盖多少变化。一般地,此类变化是1%、2%、3%、4%或5%。在一个实施方案中,将具有sorp值小于约3.29mv/106个细胞/ml的精子样品鉴定为具有正常精子形态学。在一个实施方案中,具有sorp值大于约3.29mv//106个细胞/ml的精子样品鉴定为异常精子形态学。
可以以方便且及时的方式从受试者的任何生物样品获得个体的sorp特征,所述样品包括但不限于血液、血浆、血清、唾液、csf、尿液、阴茎分泌物(包括阴茎拭子)、精液、精液流体(例如精液减精子)或前列腺液。受试者的sorp也可以从受试者的组织获得。在样品是精液的实施方案中,样品可以但不必经受进一步处理,如除去精子,留下精浆。在一个实施方案中,精子可以与精液分离,并且测定分离细胞的orp。
为了测定个体中的sorp特征随时间的趋势,在不限制的情况下,可以以合适的间隔检查个体的orp特征,仅受产生生物样品的物理约束的限制。例如,可以每天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、或1年检查orp特征。
测试的个体可以已经确定为不育,如使用相关领域的标准定义确定。或者,测试前的个体的生育力状态可以是未知的。
在相关实施方案中,分析其生育力潜力的精子样品可以是储存的样品。此类样品在生殖生物学领域是众所周知的。此外,应当理解,精子通常是低温保存的,并且此类储存牵涉使用冷冻保护剂,如甘油和二甲亚砜。最近的证据提示,不同的冷冻保护剂对存储精子的直接环境具有不同的影响,并且储存环境可以影响储存的样品的生育力潜力。因此,在一个实施方案中,测定存储的精子样品的sorp特征,以便评估样品中精子的生育力潜力。样品可以是精液样品,或者它可以是已经在储存之前进一步处理(例如离心、清洗、添加缓冲液、冷冻保护剂、抗氧化剂等)的精液样品。在一个实施方案中,sorp特征用于测量各种储存条件对精子活力和/或生育力潜力的影响。在某些实施方案中,通过添加抗氧化剂,如例如抗坏血酸和α-生育酚来改变储存条件。
卵质量
虽然精子质量对于成功受精(妊娠)是重要的,但同样重要的是受精的卵的质量。卵质量是指卵(卵子)的物理特征及其与受精并且建立并保持成功的妊娠的能力的关系。如本文中所用,成功妊娠是指持续足够长以使胎儿能够在母亲子宫外存活的妊娠。目前,通过目视检查通过经阴道取卵(transvaginaloocyteretrieval)收集的卵母细胞测定卵质量,所述经阴道取卵涉及引起卵巢成熟和释放多个卵的激素的注射。上述视觉检查包括诸如透明带的一致性和厚度、卵质的颜色和一致性以及空泡形成程度(存在或缺乏空泡)等事情。然而,在本领域中理解卵子及其环境的氧化状态可影响使卵子受精并建立和维持成功的妊娠的能力(参见例如agarwal,reproductivebiologyandendocrinology2005,3:28)。因此,在本发明的一个实施方案中,通过测量来自个体的样品的orp特性,并评估orp特征是否与参照orp值的orp特征显著不同来测定来自个体的卵的能力。然后,从此比较中测得卵和/或个体的能力。在此类方法中,orp特征相对于已知具有高能力的样品的orp特征的增加指示样品或个体具有受精或建立或维持妊娠的低可能性。同样,与已知具有低能力的样品的orp特征类似的orp特征指示测试样品或个体具有受精或建立或维持妊娠的低可能性。此外,与已知具有高能力的样品的orp特征相似的orp特征指示测试样品或个体具有受精或建立或维持妊娠的高可能性。
根据本发明,能力是指卵被受精,或建立和维持能生育的妊娠的能力。因此,有能力的卵能够通过精子受精,能够适当分裂,维持二倍体状态,成功植入子宫内膜并至少进行到胎儿发育阶段。相比之下,无能力的卵无法完成至少一个上述步骤。无能力的卵的受精通常导致胎儿发育阶段之前自发终止妊娠。
可以以方便且及时的方式从受试者的生物样品获得个体的orp特征,所述生物样品包括但不限于血液、血浆、血清、唾液、csf、尿液、阴道分泌物或滤泡液。也可以从受试者的组织获得受试者的orp。
本领域技术人员将理解,在某些情况(例如,ivf)下,卵母细胞可以在进一步使用之前培养。因此,在某些实施方案中,获得orp的样品可以是培养卵母细胞的培养基。在此类实施方案中,可以在培养的规定时间之前、期间和之后测定培养基的orp,并且将orp与适当的参照数值比较。在此类实施方案中,相对于已知具有高能力的样品的orp特征,培养基的orp特征的增加指示卵具有受精或建立或维持妊娠的低可能性。
在相关实施方案中,测试的培养基可以来自低温储存、解冻和培养的卵。此类样品在生殖生物学领域是众所周知的。此外,应当理解,低温储存包括使用冷冻保护剂,如甘油和二甲亚砜。最近的证据表明某些冷冻保护剂可以影响储存的细胞。因此,本发明的方法也可以用于测定储存对卵能力的影响并且鉴定用于此类储存的有用的方法和组合物。在一个实施方案中,orp特征用于测量各种储存条件对卵能力的影响。在某些实施方案中,通过添加抗氧化剂,如例如抗坏血酸和α-生育酚来改变储存条件。
为了测定个体中的orp特征随时间的趋势,在不限制的情况下,可以以合适的间隔检查个体的orp特征。例如,可以每30分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时或18小时检查orp特性。或者,可以每天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7天月、8个月、9个月、10个月、11个月或者1年进行测试。
个体可以已经确定为不育,如使用相关领域的标准定义确定。同样,可以已经用其它方法测定来自个体的卵的能力。或者,个体的生育力状态,或个体的卵的能力在测试前可以是未知的。
生育力/不育的治疗
精子质量或卵质量的降低可以表现为个体生育力的总体下降。此类下降可以是低生育力或不育。本发明的一个实施方案是鉴定具有降低的生育力的个体的方法,所述方法包括测量来自个体的样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同。然后,从此比较中测定个体的生育力潜力。在此类方法中,orp相对于来自已知能育的个体的样品的orp的增加指示测试的个体具有降低的生育力。
如本文中所用,低生育力指具有使妊娠变得不太可能,但不是不可能的状况的个体。因此,低生育力是指任何形式的减少的生育力,其具有不想要的不受孕的延长时间。例如,具有多囊卵巢综合征(polycysticovarysyndrome,pcos)的女性(其中生殖激素相对于没有pcos的女性失衡)认为是低生育力的。这些女性可以变得妊娠;然而,它通常比没有pcos的女性花费更长。如本文中所用,术语不育/孕是指在12个月无保护性交后无法实现成功妊娠的个体。生殖医学领域技术人员理解此类术语。
低生育力和不育/孕可以由于多种因素而产生。如上文讨论,低生育力和不育/孕可由于质量差的精子或卵。然而,其它因素也可影响生育力。例如,在男性中,低生育力或不育的原因包括但不限于感染、垂体腺体或睾丸中的激素问题、睾丸损伤或衰竭、多血海绵瘤(hematospermia)、癌症治疗(如化疗、辐射等)、针对精子的抗体(例如输精管切除术或损伤后)或毒品使用(例如烟草,大麻等)。在女性中,低生育力和不孕的原因包括但不限于感染、子宫或输卵管瘢痕形成、子宫内膜异位症、囊肿、纤维瘤(fibroids)、对宫颈或子宫的损伤(例如,手术后如d&c后)、激素问题、宫颈粘液异常、针对精子的抗体、癌症治疗、甲状腺问题、压力或毒品使用(例如烟草,大麻等)。
本领域技术人员将理解,术语低生育力和不育/孕是基于妊娠前时间的临床定义。因此,此类诊断可以是相对量表的不同点。例如,被诊断为低生育力的个体或夫妇后来可以诊断为不育/孕。或者,诊断为不育的个体或夫妇后来可以发现是低生育力的。因此,本领域技术人员将理解,orp的相应变化也将有不同程度的。例如,预期与来自能育个体的样品中的orp相比,来自低生育力个体的样品将具有升高的orp。进一步预期来自不育个体的样品的orp不仅将高于在能育个体中观察到的orp,而且还可以高于低生育力个体中观察到的orp。因此,显而易见的是,在某些实施方案中,orp值的增加程度与生育力的水平直接反相关。因此,将测定的orp值与对应于能育、低生育力和不育个体的历史orp值的完善建立的组进行比较是重要的。
本发明的方法还可以用于测定个体能够实现妊娠(即,卵的受精)的可能性。这些信息在确定在实现妊娠中对医学辅助的需要中是有用的。因此,本发明的一个实施方案是用于测定个体能够妊娠的可能性的方法,所述方法包括测量来自个体的样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同。然后,从此比较中测定个体能够妊娠的可能性。在此类方法中,orp特征相对于已知能够在没有医疗干预的情况下妊娠的个体或个体池的orp特征的增加指示个体具有能够妊娠和维持妊娠的低可能性。因此,这些信息对于确定实现妊娠中需要医学辅助是无价的。一个实施方案是鉴定就怀孕而言将受益于医学辅助的个体的方法,该方法包括从个体测量样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同。然后,从此比较中测定就妊娠而言个体受益于医学辅助的可能性。在这种方法中,orp特征相对于已知能够在没有医疗干预的情况下怀孕的个体或个体池的orp特征的增加指示个体将受益于关于妊娠和维持妊娠的医学辅助。相比之下,与已知能够在没有医疗辅助的情况下妊娠的个体的样品中的orp特征相似的orp特征指示测试的个体将不可能受益于医学辅助。
本发明的一个实施方案是测定用于实现妊娠的治疗计划的方法,所述方法包括测量来自个体的样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同。在这种方法中,如果orp值与已知能够在没有医学辅助的情况下妊娠的个体或个体池的样品中观察到的值基本相同,则测试的个体诊断为不太可能受益于用于降低的生育力的治疗。或者,如果测试的样品的orp值显著高于来自已知能够在没有医学辅助的情况下妊娠的个体或个体池的样品的orp值,则测试的个体诊断为可能受益用于降低的生育力的治疗。
在本领域中已知存在用于治疗个体中的不育/孕的方法。例如,在本领域中理解,可以通过例如摄入抗氧化剂如白藜芦醇(reservatrol)或抗坏血酸改善差的精子质量。因此,在一个实施方案中,通过测量来自个体的样品的orp特征监测治疗个体中的精子质量、低生育力和/或不育/孕的功效。在这种实施方案中orp特征的测量可以在处理之前和处理期间和之后以合适的间隔获得。在此类实施方案中,预期导致改善的精子质量的治疗也将导致orp值的降低。因此,降低orp值的治疗失败或orp值增加将指示治疗无效,并且应重新评估。这种重新评估包括例如剂量的增加、治疗的中断、和/或施用新的或辅助的治疗。
体外受精(ivf)
以上已经描述了本发明的方法用于评估精子质量、卵质量和一般生育力的用途。对于本领域技术人员显而易见的是,这些方法也可用于与体外受精有关的具体应用。在体外受精的过程中,用激素刺激卵巢,使得多于一个卵成熟并释放。收集释放的卵(卵母细胞),在培养基中保持,最有希望(即最有能力)的卵通过使它们与从收集的样品获得的精子接触而受精。然后,受精卵(合子)通常再培养2(分裂阶段)至5(胚泡期)天,此时最有希望的合子(或胚泡)被转移到接受者的子宫,其中植入物继续生长。从该简要说明可以看出,除了评估精子的质量之外,存在有可以采用本发明的方法的ivf方法中的其它几点。例如,如先前已经描述,本发明的方法可用于测定收集的卵的能力。
本发明的一个实施方案是用于评估受精卵质量的方法,所述方法包括测量其中培养受精卵的培养基样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同。然后,从此比较中测定受精卵的质量。在这种方法中,orp特征相对于来自已知具有高质量的卵的样品的orp特征的增加指示测试的受精卵具有低质量,并且不可能建立或维持成功的妊娠。同样,与来自已知低质量的受精卵的样品的orp特征类似的orp特征指示测试的受精卵不可能建立或保持成功的妊娠。相比之下,与来自已知具有高质量的受精卵的样品的orp特征类似的orp特征指示测试的受精卵可能建立并保持成功的妊娠。在一个实施方案中,测试的受精卵是合子。在一个实施方案中,受精卵是胚泡。
为了测定培养的卵中orp特征随时间的趋势,在不限制的情况下,可以以合适的间隔检查培养基的orp特征。例如,可以每30分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时或18小时检查orp特性。或者,可以每天、每2天或每3天进行测试。
本发明的一个实施方案是改善受精卵将实现成功妊娠的可能性的方法,该方法包括测量培养受精卵的培养基样品的orp特征,评估orp特征是否与参照orp值的orp特征显著不同,并且如果orp特征与参照orp值的orp特征显著不同,则处理培养基以改善受精卵的orp特征。在此类实施方案中,培养的受精卵的处理可以包括处理培养基(例如用抗氧化剂)以改善培养基的orp特征,或用药物化合物处理卵来提高卵的质量。
由于卵质量的下降可以减少受精卵将建立并保持成功妊娠的几率,本发明的方法可用于改善受精卵将建立成功妊娠的几率。因此,本发明的一个实施方案是用于改善受精卵将建立成功妊娠的几率的方法,该方法包括测量来自个体的样品的orp特征,并评估orp特征是否与参照orp值的orp特征显著不同。然后,从此比较中测定转移受精卵的最佳时间。在这种方法中,orp特征的增加超过预定orp阈值或截留值指示它是将受精卵转移到子宫中的时间。阈值orp值代表下述orp值,高于所述orp值,建立和维持成功妊娠的几率与建立和维持在阈值或更低orp值下观察到的成功妊娠的几率相比显著降低。可以例如从在转移受精卵中的先前成功或失败获得的历史orp数据测定阈值orp。
妊娠/胎儿健康
妊娠是由增加的胎盘线粒体活性和活性氧类别生成引起的氧化应激的延长状态。可以在胎盘发育和病理性妊娠(如由于先兆子痫和/或iugr变得复杂的那些)的某些窗口发生ros的过多产生,压倒抗氧化防御,伴有有害的结果。例如,在妊娠前三个月中,建立血液流入到绒毛间空间与氧化应激的爆发有关。无法对此进行有效的抗氧化防御可能导致早期妊娠丧失。氧化应激到妊娠中三个月达到峰值,结束似乎是胎儿健康和妊娠进展的脆弱时期。在妊娠晚期,可以在由于糖尿病、iugr和先兆子痫变得复杂的妊娠中看到增加的氧化应激。
本发明的另一个实施方案是诊断、评估和/或监测受试者中的妊娠以及监测胎儿发育或风险的进展的方法,其通过测量来自此类受试者的生物样品的orp特征,然后评估orp特征与参照数值的orp特征(如来自非妊娠群体的生物样品或来自妊娠人群的生物样品)是否显著不同,以测定受试者的妊娠和/或胎儿发育状态。然后,根据妊娠和/或胎儿发育状况对受试者进行治疗。在这些方法中,受试者的orp特征相对于非妊娠受试者的orp特征的增加指示受试者中存在妊娠。或者或另外,相对于已知具有相同妊娠期的正常妊娠的妊娠受试者的参照数值的orp特征,受试者的orp特征的增加指示受试者中的潜在形成的母体或胎儿风险或高风险妊娠。
为了测定此类受试者中的orp特征随时间的趋势,在不限制的情况下,可以在初始测定后每1、2、3、4、5、6天或周检查受试者的orp特征值。以比较和测定受试者的orp特征值中的趋势。
可以从受试者的体液获得受试者的orp特征,所述体液包括但不限于血液、血浆、羊水和血清。受试者的orp特征也可以从受试者的组织获得,包括但不限于胎盘或胎儿组织。
因此,在一个实施方案中,可以评估妊娠受试者的orp特征值,其指示受试者中的异常妊娠或胎儿风险增加。与已知具有相同妊娠期的正常妊娠的受试者的orp特征值在统计学上相似或更小的受试者的orp特征值指示以正常妊娠进展的受试者。与已知具有相同妊娠期的正常妊娠的受试者的orp特征值在统计学上相似或更大的受试者的orp特征值指示不进展到正常妊娠或可能正在进展到异常妊娠,包括先兆子痫或子痫、妊娠期糖尿病,或者可以有升高的流产或胎儿死亡风险的受试者。
可以在初步确定后定期检查此类受试者的orp特征值,以重新评估正常妊娠或异常妊娠或胎儿发育或发育进展的初步评估。在相关实施方案中,与指示正常胎儿发育的orp特征值相比,可以通过评估受试者的orp特征值来定期监测妊娠受试者。受试者的orp特征值指示可能进展到非健康或异常妊娠的受试者,所述orp特征值在统计学上进展到与具有与受试者相比正常妊娠的受试者的orp特征值相似或更大的orp特征值。
可以在初始确定后每1、2、3、4、5或6周或每1、2、3、4、5或6个月检查此类受试者的orp特征值以便评估受试者的妊娠进展和/或疾病预后。
在一些实施方案中,对发现具有指示异常或高危妊娠的orp特征升高的受试者施用抗氧化剂方案和/或避免铁过量以改善母体和早期胎儿损伤的方案。
尽管上述方法已经聚焦于测定orp特征,但是在某些实施方案中,orp特征测量与其它患者诊断标准一起采用,诸如例如下列一项或多项:生命体征、ecg、血糖水平、ct扫描(cat扫描,计算轴向断层摄影术(computedaxialtomography))、mri(磁共振成像,mr),mra(磁共振血管造影片)、脑动脉造影片(cerebralarteriogram)(脑血管造影片(cerebralangiogram)、数字减法血管造影术(digitalsubtractionangiography))、pt(凝血酶原时间)或ptt(部分促凝血酶原激酶时间)。另外,orp特征测量可以单独使用或与上述其它诊断标准结合使用以评估各种干预疗法的使用。
实施例
提出以下实施例以便为本领域普通技术人员提供如何制作和使用实施方案的完整公开和描述,而不意图限制发明人视为其发明的范围,也不意图它们表示以下实验是进行的所有或唯一的实验。已经努力确保使用的数字(例如数目,温度等)的准确性,但是应该考虑一些实验误差和偏差。
实施例1:在精液和精浆中建立氧化-还原电位
本实施例证明可以在精液和精浆样品中测量orp。
从单一国际男科学实验室(临床研究)或国家泌尿学实验室(技术研究)招募担心不育的夫妇的男性合作者。每个参与者捐赠了单一精液样品。根据关于液化的who指南(2010年第5版)让精液样品在室温下液化约30分钟。液化后,将样品分成两个级份。将一个级分在300g下离心7分钟以分离精浆。
精液分析
液化后,使用who精液质量指南(2010年第5版)测定射精体积、精子细胞数、精子浓度、形态学、总向前运动性。用diff-quik试剂盒染色涂片以评估精子形态学。当圆形细胞浓度>1x106时,也测试样品的白细胞精子症(leukocytospermia),即>1x106wbc/ml,并通过过氧化物酶或endtz测试证实,。手动评估精子计数和运动性。
氧化-还原(orp)测量
使用由redoxsys分析仪mioxsys(aytubiosience)传感器(mioxsys,aytubioscience)组成的redoxsys测试,在两个级分中测量sorp(mv/106个精子/ml)。传感器面朝上插入,并且传感器电极面向mioxsys分析仪。使用微量移液管,将30μl样品(精液或精浆)释放到传感器的应用口上。一旦样品达到传感器的参照槽,测试自动开始,并听得见的哔哔声指示测试完成。记录sorp(以毫伏或mv计)。进行一式三份分析,并且校正精子浓度的平均值并且表示为sorp(mv/106个精子)。数值以平均值±sem报告。spearman相关性和接受者操作特征曲线(receiveroperatingcharacteristiccurves,roc)用于统计分析。
统计分析
spearman相关性检验用于统计学分析以比较定性变量。认为p值<0.05是统计学显著的。
在图7和8中显示这些分析的结果。结果证明了mioxsys测试可以准确测量精液和精浆水平中的orp,并且sorp值精液与在精浆流体中测量的sorp值相匹配。
实施例2:使用新鲜和冷冻样品的sorp/浓度测量的比较
如实施例1所述获得并处理精液样品。然后,将样品在-80℃保存120分钟,然后将其解冻,使其达到室温并测量sorp。图9中显示了分析的结果。
结果证明了冷冻样品(无论作为精液还是精浆)不改变sorp值,并且进一步证实了精液和精浆样品之间缺乏差异。
实施例3:时间对精液和精浆中的氧化-还原电位的影响
如实施例1所述获得并处理精液样品。液化后立即(0分钟)测量sorp。然后将样品在室温下放置120分钟并重新测试(120分钟)。图10和11中显示了结果。
结果证明了在立即测试的样品中和在稍后时间点测量的样品中sorp值没有差异。
实施例4:区分能育精子与非能育精子的sorp截留值
如实施例1中所述分析了三个数据集间收集的来自398名参与者的样品的精液参数。根据who指南(2010年第5版),35份样品满足能育精子的所有6项标准。363份样品未能满足一个或多个标准,将它们标记为“不育”。测定每个样品的sorp/浓度值,并且比较能育和不育样品的平均sorp/浓度值。该比较的结果示于图12a中。使用接受者操作特征(roc)分析来鉴定最佳预测能育样品与不育样品的sorp标准。这些分析的结果示于图12b和下表1中。
表1:生育力的sorp/浓度截留值
结果证明了与不育的样品相比,在满足生育力的所有who标准的精液样品中sorp值(sorp/浓度)更低。结果还证明了截留值1.635准确地鉴定出所有能育样品的91.4%。因此,具有sorp/浓度值大于1.635的精液样品将是不育的,具有98.6%的置信度。
实施例5:sorp值和精子形态学
本实施例证明了用于区分具有正常形态学的精子与具有异常形态学的精子的sorp截留值的鉴定。
收集了总共400名参与者的疑似不育的男性的精液样品。入选标准是寻求生育力评估的男性。排除标准是具有精子缺乏(azoospermic)样品的男性。每个参与者捐献单一精液样品,自此使用who精子质量准则(2010年第5版)测量射精体积、精子细胞数、精子浓度、形态学、总体和向前运动性,其在下文表2中显示。
表2:正常精液参数参照(who,第5版,2010)
具体地,使用makler室来定量细胞数。通过quik-diff染色方案使用制备的载玻片评估形态。
sorp测量
通过使用mioxsystm系统(aytubioscience,inc)测量净(neat)液化精液样品的静态氧化-还原电位(sorp)来评估氧化应激。mioxsys系统由mioxsys分析仪和一次性测试传感器组成。这是在稳定的低电压降低电流下从还原剂(抗氧化剂)到氧化剂的电子转移的恒电流测量(galvanostaticmeasure);因此它提供了样品中所有电流氧化剂活性和抗氧化活性的总体测量。较高的sopr值(毫伏,mv)指示相对于抗氧化活性的较高的氧化剂活性;氧化应激状态较大。
简言之,将30μl室温净精液添加到预先插入分析仪中的测试传感器中。当传感器的参照电极检测样品时,测试自动开始。每次运行两分钟,并且样品一式两份运行。如果重复的差异超过10mv,则运行第三个样品,并使用两个最接近的值。百分之十的样品一式三份运行。最佳匹配重复之间的相关性为0.98(r2=0.95),平均值±sem差异为4.3±0.16mv。
统计分析
最初在三个数据集(数据集1n=107;数据集2=197;数据集3=96)中接收数据。数据集1用于所有初始分析。数据集2-3用作单独的确认数据集。为了控制精子数目的差异,相对于每个样品中精子浓度标准化(normed)sorp值。sorp值以sorp/浓度(mv/106精子/ml)呈现。对于组比较,根据who正常参数参照,将样品对于每个参数分组为“正常”或“异常”。此外,仅使用浓度大于0.999×106精子/ml的样品,因为这些较低浓度升高了sorp/浓度平均值,并导致人为显著的结果。对于组差异使用studentt检验测定sorp与精子质量测量之间的关系。接受者操作特征(roc)分析用于鉴定最佳预测异常形态学与正常的sorp标准,如who精子形态学标准所定义。在此分析中,无论精子浓度如何,均使用所有数据点。显著性在p<0.05建立。图表示平均值±sem。
结果显示了参照参与者人口统计学、激素水平或精液参数,三个数据集之间没有显著差异,确认了所有数据集彼此相当。下文表3中显示了所有数据集的描述性统计。
表3:研究参与者的人口统计学和描述性统计
基于数据集1的分析,正常和异常精液参数之间有显著的差异(图13-18)。与正常的样品相比在异常的样品中在以下方面测量到显著更高的sorp值:总细胞数目(t(98)=7.64,p<0.05)(图14)、浓度(t(98)=7.74,p<0.05)(图15)、总运动性(t(98)=3.52,p<0.05)(图16)、和形态学(t(98)=4.43,p<0.05)(图18)。在精液体积(t(98)=1.24,p>0.05)(图13)或向前运动精子的百分比(t(98)=1.08,p>0.05)(图17)中没有发现显著差异。在数据集2和3中确认了总细胞数目(图14)、浓度(图15)、总运动性(图16)、和形态学(图18)的差异(对于全部为p<0.05)。另外,作为向前运动函数的sorp(图17)在两个剩余数据集中作为显著效应出现(p<0.05)。体积继续是不显著的。
使用roc分析来测定sorp是否可以可靠地用于预测具有异常形态学的样品,从而强调高特异性和正预测值(ppv)。基于数据集1,在3.29mv/106精子/ml下鉴定出sorp/浓度截留值。曲线下面积(auc)的相当大的比例由sorp值(auc=0.90(95%ci0.83-0.95),p<0.05)说明。在截留值3.29mv/106精子/ml,特异性为96.2%(95%ci86.8-99.5),ppv为94.1%(95%ci为80.3-99.3)。因此,正确鉴定96.2%的异常形态学样品,并且具有比3.29mv/浓度大的sorp值的精液可以以94.1%确信标记为异常。如下表4所示,使用数据集2和3确认此截留值,尽管预测值略低。
表4:从sorp值预测精子形态学的roc分析总结
组合三组数据,特异度为89.1%,并且ppv为85.7%。图13显示了roc分析图,其显示曲线下面积。图19中的auc是显著的(p<0.05),指示sorp值的预测能力显著大于几率。
结果显示了sorp值在具有异常精液参数的样品中显著更高。结果还证明了从数据集1测定的3.29mv/106精子/ml的sorp截留值准确地鉴定出具有正常形态学的所有样品的96.2%。因此,具有sorp/浓度大于3.29的样品具有85.7%的具有异常精液形态的几率。
- 还没有人留言评论。精彩留言会获得点赞!