厚壁菌类益生菌在治疗和预防肥胖及其相关疾病中的应用的制作方法
本发明属于微生物学领域,具体地,本发明涉及厚壁菌类益生菌在治疗和预防肥胖及其相关疾病中的应用,也涉及包含厚壁菌类益生菌的组合物及其应用。
背景技术:
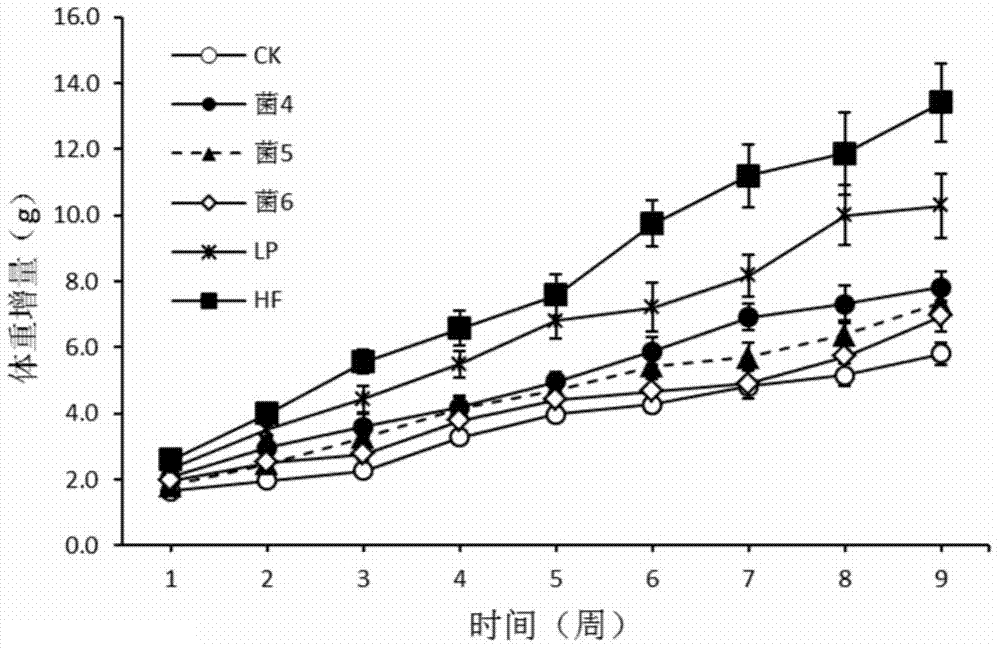
:人体内存在大量共生微生物,它们大部分寄居在人的肠道中,数量超过1000万亿(1014数量级),是人体细胞总数的10倍以上。在漫长的进化过程中,肠道微生物与人类达成了良好的合作,对人体的营养、代谢和免疫都起着至关重要的作用,许多研究者更多地是将人体肠道微生物群落看作是人体的一个“器官”,或者是人体第二基因组,其中蕴含的海量遗传信息与人类健康密切相关。通过对糖尿病、冠心病、肥胖、结肠癌等数百种疾病近万种样品的研究发现,某些特定的物种与疾病呈现出显著的关联,这些结果在疾病的临床评定和诊断以及后期的干预治疗提供了一个全新的方向。肥胖症是一种慢性疾病,许多因素都会导致肥胖,其发病起源至今未研究清楚。肥胖同时也是一系列疾病的诱导因子,如高血压、糖尿病、冠心病、胆囊病、骨关节炎、睡眠中呼吸窒息、呼吸失调、子宫瘤、前列腺癌、乳腺癌和结肠癌等。根据nih的报告,目前约有9700万美国人超重和过度肥胖,其中与过度肥胖相关的ii型糖尿病人数达到约1510万人,每年约有20万人死于与肥胖症相关的疾病。肥胖通常是由于生理或生物化学功能改变而导致的体脂肪过剩。脂肪通常包括中性脂、磷脂和胆固醇。脂肪的增加是由于能量摄入大于能量的消耗。从发病原理上讲,肥胖有两种类型:(a)单纯性肥胖(simpleobesity)和(b)继发性肥胖(secondobesity)。单纯性肥胖可划分为先天性肥胖(idiopamicobesity)和后天性肥胖(acquiredobesity),单纯性肥胖患者数量可占95%以上的总肥胖数目。先天性肥胖是由大量的脂肪细胞所致,且常见于儿童期肥胖。后天性肥胖是由更大尺寸的脂肪细胞所致,且常见于成年期肥胖。继发性肥胖又被称为症状性肥胖,其通常是由内分泌或新陈代谢疾病所致。目前有五种治疗肥胖的策略:节食、锻炼、行为治疗、药物治疗和康复手术(therapetlticoperation)。采取哪种策略主要视病人的健康危险因子和体重减轻的速度和效果而定,可选择或组合这些策略对肥胖病人进行治疗。其体重减轻的速度和效果受诸如年龄、身高、家族史和危险因子等多个因素的影响。饮食—锻炼疗法,即吃低热量、低脂肪食物和进行有氧锻炼,但这种方法一般认为对普通大众不成功,且需要长期经常性地坚持;去除体内脂肪手术能达到立竿见影的效果,但存在诸多限制,如手术风险、除脂效果难以持久和花费过于昂贵等。药物治疗是目前主要的临床治疗肥胖及其肥胖相关疾病(如糖尿病)的方法。药物治疗的机制包括抑制食欲、增加能量消耗、刺激脂肪移动、降低甘油三酯合成和抑制脂肪吸收。目前主要的药物为:苯丙醇胺(phenylpropanolamine,ppa)、罗氏鲜(orlistat,xenicalⅲ)和诺美婷(sibutramine,reductiltm)。某些糖尿病人的高血糖通过饮食和/或锻炼疗法或使用上述治疗化合物仍然不能得到适当控制。对于这些病人,应使用外源胰岛素。对病人来说,使用外源胰岛素是很昂贵和痛苦的方法,还会给病人带来多种并发症。例如,由于没有吃饭或不正常锻炼,胰岛素剂量的计算错误会导致胰岛素响应(低血糖)。此外,使用药物还可能发生对药物的局部或全身过敏或免疫抗性。目前本领域还没有一种有效的、副作用小的治疗和预防肥胖及其相关疾病的方法和药物。因此本领域迫切需要开发一种的新的,无毒副作用的,用于治疗和预防肥胖及其相关疾病的药物。技术实现要素:本发明的一个目的是提供厚壁菌类益生菌在治疗和预防肥胖及其相关疾病方面的用途。本发明的另一目的是提供一种有效的无毒副作用的,用于治疗和预防肥胖及其相关疾病的药品、饮料、食品组合物,或动物饲料组合物。本发明的另一目的是提供一种降低体重和/或血糖的方法及其应用。本发明第一方面提供了一种厚壁菌类益生菌的用途,用于制备组合物或制剂,所述组合物或制剂用于选自下组的一种或多种用途:(a)预防和/或治疗肥胖;(b)降低血脂;(c)预防或治疗心血管疾病;和/或(d)预防和/或治疗糖尿病,其中,所述厚壁菌类益生菌选自下组:伴生粪球菌(coprococcuseutactus)、浑浊戴阿利斯特菌(dialisterinvisus)、或其组合。在另一优选例中,所述厚壁菌类益生菌包括伴生粪球菌(coprococcuseutactus)。在另一优选例中,所述伴生粪球菌(coprococcuseutactus)选自下组:coprococcuseutactusatcc27759、coprococcuseutactusatcc51897、coprococcuseutactusl2‐50、或其组合。在另一优选例中,所述厚壁菌类益生菌包括浑浊戴阿利斯特菌(dialisterinvisus)。在另一优选例中,所述浑浊戴阿利斯特菌(dialisterinvisus)选自下组:dialisterinvisusdsm15470、dialisterinvisuse2.20、dialisterinvisuse9.48、或其组合。在另一优选例中,所述厚壁菌类益生菌包括选自表3中的一种或多种。在另一优选例中,所述厚壁菌类益生菌选自表3,且来自相同或不同的属。在另一优选例中,所述组合物选自下组:食品组合物、保健组合物、药物组合物、饮料组合物、饲料组合物、或其组合。在另一优选例中,所述的组合物为口服制剂。在另一优选例中,所述的组合物为液态制剂、固态制剂、半固态制剂。在另一优选例中,所述的组合物的剂型选自下组:粉末剂、散剂、片剂、糖衣剂、胶囊剂、颗粒剂、悬浮剂、溶液剂、糖浆剂、滴剂、和舌下含片。在另一优选例中,所述的食品组合物包括乳液制品、溶液制品、粉末制品、或悬浮液制品。在另一优选例中,所述的食品组合物包括乳品、乳粉、或乳液。在另一优选例中,所述的液态制剂选自下组:溶液制品或悬浮液制品。本发明第二方面提供了一种厚壁菌类益生菌的用途,用于制备组合物或制剂,所述组合物或制剂用于选自下组的一种或多种用途:(i)降低哺乳动物中单核细胞趋化蛋白-1(mcp-1)的水平;和/或(ii)改善瘦素抵抗,提高体内对leptin的敏感性,其中,所述厚壁菌类益生菌选自下组:伴生粪球菌(coprococcuseutactus)、浑浊戴阿利斯特菌(dialisterinvisus)、或其组合。在另一优选例中,所述组合物或制剂还独立地或额外地用于选自下组的一种或多种用途:(iii)抑制哺乳动物的体重增长;(iv)降低哺乳动物的体脂比(脂肪重量/体重之比);(v)降低哺乳动物的血脂水平;(vi)提高哺乳动物中的高密度脂蛋白(hdlc)的水平;(vii)降低哺乳动物中的低密度脂蛋白(ldlc)水平。在另一优选例中,所述哺乳动物包括人、啮齿动物(如大鼠、小鼠)。在另一优选例中,所述降低哺乳动物的血脂水平包括降低总胆固醇(tc)水平和/或甘油三酯水平。本发明第三方面提供了一种用于治疗和/或预防肥胖的组合物,所述组合物包括:(i)安全有效量的厚壁菌类益生菌;和(ii)食品上或药学上可接受的载体;其中,所述厚壁菌类益生菌选自下组:伴生粪球菌(coprococcuseutactus)、浑浊戴阿利斯特菌(dialisterinvisus)、或其组合。在另一优选例中,所述厚壁菌类益生菌包括伴生粪球菌(coprococcuseutactus)。在另一优选例中,所述伴生粪球菌(coprococcuseutactus)选自下组:coprococcuseutactusatcc27759、coprococcuseutactusatcc51897、coprococcuseutactusl2‐50、或其组合。在另一优选例中,所述厚壁菌类益生菌包括浑浊戴阿利斯特菌(dialisterinvisus)。在另一优选例中,所述浑浊戴阿利斯特菌(dialisterinvisus)选自下组:dialisterinvisusdsm15470、dialisterinvisuse2.20、dialisterinvisuse9.48、或其组合。在另一优选例中,所述组合物选自下组:食品组合物、保健组合物、药物组合物、饮料组合物、饲料组合物、或其组合。在另一优选例中,所述组合物含有1×10-1×1020cfu/ml或cfu/g的厚壁菌类益生菌,较佳地1×104-1×1015cfu/ml或cfu/g的厚壁菌类益生菌,按所述组合物的总体积或总重量计。在另一优选例中,所述的组合物中,含有0.0001-99wt%,较佳地0.1-90wt%所述的厚壁菌类益生菌,以所述组合物的总重量计。在另一优选例中,所述的组合物为单元剂型(一片、一粒胶囊或一小瓶),每个单元剂型中所述组合物的质量为0.05-5g,较佳地为0.1-1g。另一优选例中,所述的组合物还含有其他益生菌和/或益生元。在另一优选例中,所述的其他益生菌选自下组:乳酸菌、双歧杆菌、嗜酸乳杆菌、或其组合。在另一优选例中,所述的益生元选自下组:低聚果糖(fos)、低聚半乳糖(gos)、低聚木糖(xos)、低聚乳果糖(lact)、大豆低聚糖(sos)、菊粉(inulin)、或其组合。本发明第四方面提供了一种本发明第三方面所述组合物的制法,包括步骤:将(i)厚壁菌类益生菌、与(ii)食品上可接受的载体或药学上可接受的载体混合,从而形成本发明第三方面所述的组合物。在另一优选例中,所述的组合物为口服制剂。本发明第五方面提供了一种降低体重和/或血脂的方法,给所述对象施用(i)厚壁菌类益生菌或本发明第三方面所述的组合物。在另一优选例中,所述的施用包括口服。在另一优选例中,所述的施用剂量为0.01-5g/50kg体重/天,较佳地,0.1-2g/50kg体重/天。在另一优选例中,所述的对象包括哺乳动物,如人。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示了灌胃伴生粪球菌后各组小鼠与灌胃前相比的体重增长情况。图2显示了灌胃浑浊戴阿利斯特菌后各组小鼠与灌胃前相比的体重增长情况。图3显示了灌胃组合菌后各组小鼠与灌胃前相比的体重增长情况。图4显示了灌胃伴生粪球菌9周后各组小鼠的体脂比。图5显示了灌胃浑浊戴阿利斯特菌9周后各组小鼠的体脂比。图6显示了灌胃组合菌9周后各组小鼠的体脂比。图7显示了灌胃伴生粪球菌对血脂的影响。图8显示了灌胃浑浊戴阿利斯特菌对血脂的影响。图9显示了灌胃组合菌对血脂的影响。图10显示了灌胃伴生粪球菌对单核细胞趋化蛋白-1(mcp-1)的影响。图11显示了灌胃浑浊戴阿利斯特菌对单核细胞趋化蛋白-1(mcp-1)的影响。图12显示了灌胃组合菌对单核细胞趋化蛋白-1(mcp-1)的影响。图13显示了灌胃伴生粪球菌对瘦素(leptin,lep)的影响。图14显示了灌胃浑浊戴阿利斯特菌对瘦素(leptin,lep)的影响。图15显示了灌胃组合菌对瘦素(leptin,lep)的影响。具体实施方式本发明人经过广泛而深入的研究和实验,意外地发现,伴生粪球菌(coprococcuseutactus)和/或浑浊戴阿利斯特菌(dialisterinvisus)具有预防和治疗肥胖及其相关疾病(如心血管疾病)的作用,将含有上述厚壁菌类益生菌的活性组合物饲喂食实验对象,发现该组合物能够抑制体重增加,降低体脂比,降低血脂,有效减轻心血管及肥胖等病症。在此基础上完成本发明。如本文所用,术语“含有”表示各种成分可一起应用于本发明的混合物或组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。如本文所用,所述“体脂比”是指脂肪重量/体重的比值。本发明的厚壁菌类益生菌及其应用如本文所用,所述“本发明的厚壁菌类益生菌”指肠道中共栖的一类厚壁菌门的菌,革兰氏染色呈阳性,杆状,如梭菌xiva簇和iv簇(clostridiumclusterxivaandiv),包括梭菌属(clostridium)、真杆菌属(eubacterium),瘤胃球菌属(ruminococcus)和硫酸盐还原菌属(anaerofilum)等的一些种。通过与肠道其他微生物相互作用,此类益生菌在肠道菌群平衡中发挥重要作用,同时,也发挥其他特定的或必需的功能。在本发明中,所述“本发明的厚壁菌类益生菌”指伴生粪球菌(coprococcuseutactus)、浑浊戴阿利斯特菌(dialisterinvisus)2种菌属的一个或多个菌属的混合或每个菌属中多个菌的一个或多个混合。其中,伴生粪球菌(coprococcuseutactus)是一种专性厌氧菌,不能运动,当呈现出成对或链状成对状态时革兰氏染色呈阳性,但可很快退色。在含有可发酵碳水化合物的培养基里,呈现略微细长的形状。但该菌通常为圆形,直径为0.7-1.3μm。浑浊戴阿利斯特菌(dialisterinvisus)是一种专性厌氧菌、不能运动的球杆菌(0.3‐0.4×0.3‐0.6μm),革兰氏染色呈阴性。可呈现单个分散形态,也可呈现成对、短链、小簇等形态。本发明提供了厚壁菌类益生菌在治疗和预防肥胖及其相关疾病(如心血管疾病)方面的应用。受验者摄入高脂肪的食物,厚壁菌类益生菌具有(i)抑制该受验者体重增加;(ii)降低血脂;和(iii)降低体脂比的能力。根据本发明的一个优选例,经本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)来治疗的被喂以可导致肥胖的高脂肪的食物的c57bl/6j雄性小鼠,与未接受治疗的对照组相比,其体重增加幅度减缓且血脂下降,并且各种与肥胖或心血管疾病相关的指标也下降,如瘦素(lep)以及单核细胞趋化蛋白-1(mcp-1)。因此,本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够用以预防和治疗肥胖及由肥胖引起的疾病,如心血管疾病等。组合物及其应用本发明还提供了一种组合物,优选地,为药物组合物。所述组合物包括有效量的本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合),在一个优选例中,所述组合物还包括选自下组的益生菌:乳酸菌、双歧杆菌、嗜酸乳杆菌、或其组合;和/或选自下组的益生元:低聚果糖(fos)、低聚半乳糖(gos)、低聚木糖(xos)、低聚乳果糖(lact)、大豆低聚糖(sos)、菊粉(inulin)、或其组合。在一优选例中,所述的组合物为液态制剂、固态制剂、半固态制剂。在一优选例中,所述的液态制剂选自下组:溶液制品或悬浮液制品。在一优选例中,所述的组合物的剂型选自下组:粉末剂、散剂、片剂、糖衣剂、胶囊剂、颗粒剂、悬浮剂、溶液剂、糖浆剂、滴剂、和舌下含片。本发明药物组合物可以以药物片剂,针剂或胶囊的任一种形式给药,所述药物制剂包括赋形剂、药物允许的媒介和载体,这些物质可根据给药途径进行选择。本发明中药物制剂可进一步包含辅助的活性组份。乳糖、葡萄糖、蔗糖、山梨糖醇、甘露糖、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、细结晶纤维素、聚乙烯吡咯烷酮(pvp)、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁或矿物油等都可用作本发明中药物组合物的载体、赋形剂或稀释剂等。此外,本发明的药物组合物可进一步包括润滑剂、润湿剂、乳化剂、悬浮液稳定剂、防腐剂、甜味剂和香料等。本发明的药物组合物可通过多种公知的方法以肠衣制剂生产,以便于药物组合物的活性成分即微生物能顺利通过胃而不被胃酸所破坏。另外,本发明的微生物可以常规方法制备的胶囊形式使用。例如,标准赋形剂和本发明的冷干微生物混合制成小球药丸,然后将药丸装填入明胶胶囊中。此外,本发明的微生物和药物允许使用的赋形剂如液体胶、纤维素、硅酸盐或矿物油等混合制作悬浮液或分散液,这种悬浮液或分散液可装入软的明胶胶囊中。本发明的药物组合物可制成肠衣片供口服使用。本申请中的术语—“肠衣”,包括所有常规药物允许使用的包衣,这些包衣不被胃酸降解,但在小肠中能充分分解并快速释放出本发明的微生物。木发明的肠衣能在合成胃酸如ph=1的hcl溶液中在36-38℃维持2小时以上,并优选在合成肠液如ph=7.0的缓冲液中在1.0小时内分解。本发明的肠衣为以每片约16-30mg进行包衣,较佳地16-25mg,更佳地16-20mg进行包衣。本发明中肠衣厚度为5-100μm,理想的厚度为20-80μm。肠衣成分选自己公开知晓的常规聚合物。本发明优选的肠衣由纤维素乙酸邻苯二甲酸酯聚合物或偏苯三酸酯聚合物以及异丁烯酸的共聚物(例如,含有40%以上异丁烯酸和含有甲基纤维素邻苯二甲酸羟丙酯或其酯类衍生物的异丁烯酸的共聚物)制备。本发明中肠衣所使用的纤维素乙酸邻苯二甲酸酯的粘度为约45-90cp,乙酰含量17-26%,邻苯二甲酸含量30-40%。用于肠衣中的纤维素乙酸偏苯二酸酯粘度为约5-21cp,乙酞含量17-26%。纤维素乙酸偏苯三酸酯由eastman科达公司生产,可用于本发明中的肠衣材料。用于本发明肠衣中的羟丙基甲基纤维素邻苯二甲酸酷,分子量一般为20,000-130,000道尔顿,理想分子量为80,000-100,000道尔顿,羟丙基含量为5-10%,甲氧基含量为18-24%,邻苯二甲酰基含量为21-35%。用于本发明肠衣中的羟丙基甲基纤维素邻苯二甲酸酷为hp50,由日本shin-etsuchemidnlco.ltd.生产。hp50含有6-10%羟丙基,20-24%甲氧基,21-27%的丙基,其分子量为84,000道尔顿。另一种肠衣物质为hp55,hp55含有5-9%的羟丙基甲基纤维素邻苯二甲酸酯,18-22%甲氧基,27-35%的邻苯二甲酸,其分子量为78,000道尔顿。本发明肠衣如下制备:使用常规方法将肠衣溶液喷雾到核心上。该肠包衣方法中所有溶剂为醇类(如乙醇)、酮类(如丙酮)、卤代烃化合物(如二氯甲烷)、或其组合物。将软化剂如二-正丁基邻苯二甲酸酯和三乙酸甘油酯加入到肠衣溶液中,其比例为1份包衣物对约0.05份或约0.3份软化剂。喷雾方法优选连续执行,所喷雾的料量可根据包衣所采用的条件进行控制。喷雾压力可随意调节,一般而言,能在平均1-1.5帕压力下获得理想的结果。说明书中“药物有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。比如,在本发明中,可制备含有1×10-1×1020cfu/ml或cfu/g(特别的,可含有1×104-1×1015cfu/ml或cfu/g;更特别地,可含有1×106-1×1011cfu/ml或cfu/g)的本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的制剂。当用于制备药物组合物时,所用的本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的有效剂量可随施用的模式和待治疗的疾病的严重程度而变化。适用于内服的剂量形式,包含与固态或液态药学上可接受的载体密切混合的约1×10-1×1020cfu/ml或cfu/g(特别的,可含有1×104-1×1015cfu/ml或cfu/g;更特别地,可含有1×106-1×1011cfu/ml或cfu/g)的活性厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的活性成分。可调节此剂量方案以提供最佳治疗应答。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。所述的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)可通过口服等途径给予。固态载体包括:淀粉、乳糖、磷酸二钙、微晶纤维素、蔗糖和白陶土,而液态载体包括:培养基、聚乙二醇、非离子型表面活性剂和食用油(如玉米油、花生油和芝麻油),只要适合厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)特性和所需的特定给药方式。在制备药物组合物中通常使用的佐剂也可有利地被包括,例如调味剂、色素、防腐剂和抗氧化剂如维生素e、维生素c、bht和bha。从易于制备和给药的立场看,优选的药物组合物是固态组合物,尤其是片剂和固体填充或液体填充的胶囊。口服给药是优选的。将本发明组合物施用给所述个体,每天给药1次或多次。给药剂量单位表示其形式上能分开且适用于人类或其他所有哺乳动物个体的剂量。每一单位含有药物允许的载体和有效治疗量的本发明微生物。给药量随病人的体重和肥胖严重程度、所包括的补充活性组份和所使用的微生物而变化。此外如可能,可分开给药,并且如需要可连续给药。因此,所述给药量不会对本发明造成限制。此外,本发明中的“组合物”不仅意味着药品而且表示可作为功能性食品和健康补充食品。在一个优选例中,所述组合物包括:饮料、食品、药品、动物饲料等。在本发明的一个优选例中,还提供了一种食品组合物,它含有有效量的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合),以及余量的食品上可接受的载体,所述的食物组合物的剂型选自固体、乳品、溶液制品、粉末制品、或悬浮液制品。在一优选例中,所述组合物的配方如下:1×10-1×1020cfu/ml的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合);以及食品上或药学上可接受的载体,和/或赋形剂。在另一优选例中,所述组合物的配方如下:1×106-1×1011cfu/ml的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合);以及食品上或药学上可接受的载体,和/或赋形剂。降低体重和/或血脂的方法在另一优选例中,所述方法包括:摄取本发明的药物组合物、食品组合物、饮料组合物、或其组合。所述实验对象为人。在另一优选例中,所述方法包括:摄取本发明的药物组合物、食品组合物、或动物饲料,或其组合。所述实验对象为动物,较佳地为鼠类,兔类。本发明的主要优点包括:(a)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够显著降低体重、降低血脂、降低体脂比。(b)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够显著降低与肥胖及其相关疾病(如心血管疾病)相关的指标(如胆固醇和甘油三酯)。(c)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够显著降低总胆固醇、甘油三酯、低密度脂蛋白的水平。(d)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够显著提高高密度脂蛋白的水平。(e)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够改善胰岛素抵抗,还可降低动脉粥样硬化和心血管疾病发生的风险。(f)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够显著降低单核细胞趋化蛋白-1(mcp-1)水平。(g)本发明的厚壁菌类益生菌(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)能够有效地改善肥胖症伴随的瘦素抵抗,提高体内对leptin的敏感性。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照《微生物:实验手册》(jamescappuccino和nataliesherman编,pearsoneducation出版社)中所述的条件,或按照制造厂商所建议的条件。实施例1含菌组分(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的食品组合物原料配比如表1。表1食品组合物配方原料质量百分比(%)菌组分0.5牛奶90.0白糖9.5配方1-6中的菌组分为单细菌组分,分别含有coprococcuseutactusatcc27759、coprococcuseutactusatcc51897、coprococcuseutactusl2-50、dialisterinvisusdsm15470、dialisterinvisuse2.20、dialisterinvisuse9.48。配方7中的菌组分为上述6种菌的任意两种或两种以上(优选2种或3种)的混合物(重量比为1:1或1:1:1)。按照上述配方比例混合牛奶、白糖,搅拌至完全混合,预热,20mpa压力均质,90℃左右杀菌5-10分钟,冷却至40-43℃,接种1-100×106cfu/g的菌组分,即制成含菌组分(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的食品组合物。实施例2含菌组分(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的药物组合物原料配比见表2。表2药物组合物配方原料质量百分比(%)菌组分1.0%乳糖2.0%酵母粉2.0%蛋白胨1.0%纯净水94.0%配方1-6中的菌组分为单细菌组分,分别含有coprococcuseutactusatcc27759、coprococcuseutactusatcc51897、coprococcuseutactusl2-50、dialisterinvisusdsm15470、dialisterinvisuse2.20、dialisterinvisuse9.48。配方7中的菌组分为上述6种菌的任意两种或两种以上(优选2种或3种)的混合物(重量比为1:1或1:1:1)。按照比例将乳糖、酵母粉、蛋白胨以纯净水混合均匀,预热到60-65℃,20mpa压力均质,90℃左右杀菌20-30分钟,冷却至36-38℃,接入菌组分(1-50×106cfu/ml),36-38℃发酵至ph值为6.0,离心,冷冻干燥至水份含量小于3%,即制备成含菌组分的冷冻干燥物。称取0.5克含菌组分的冷冻干燥物与麦芽糊精等量混合后装入胶囊中,即制成含菌组分(如伴生粪球菌、浑浊戴阿利斯特菌或其组合)的药物组合物。实施例3对于肥胖模型小鼠的治疗作用实验材料:小鼠:购买c57bl/6j雄性小鼠(购自广东省医学实验动物中心),为正常饲养小鼠,6周龄。小鼠生长过程处于同一环境,且喂养同样的食物。从保藏机构获得6株厚壁菌类益生菌,并保存于深圳华大基因研究院。同时,选取植物乳杆菌(lactobacillusplantarum),来自中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号cgmccno.8198,作为对照组(lp组),于mrs培养液中,37℃培养24-48h。其中,上述6株厚壁菌类益生菌的来源信息如表3所示。所有菌株经16srdna测序鉴定无误后开始实验。菌株信息见表3。表3菌株信息其中,coprococcuseutactusl2-50(菌3)来源于英国罗威特研究所(rowettresearchinstitute)(barcenillaa,prydese,martinjcetal.phylogeneticrelationshipsofbutyrate-producingbacteriafromthehumangut.appliedandenvironmentalmicrobiology2000;66:1654-1661.)。dialisterinvisuse2.20(菌5)和dialisterinvisuse9.48(菌6)均来源于英国伦敦国王学院盖氏医院牙科研究所微生物科(departmentofmicrobiology,dentalinstitute,guy'stower,guy'shospital,king'scollegelondon,uk;j.downes,m.munsonandw.g.wade,dialisterinvisussp.nov.,isolatedfromthehumanoralcavity,internationaljournalofsystematicandevolutionarymicrobiology(2003),53,1937–1940)。高脂饲料(hf):含78.8%基础饲料、1%胆固醇、10%蛋黄粉、10%猪油和0.2%胆盐,购自南通特洛菲饲料科技有限公司。普通维持饲料:购自广东省医学实验动物中心。实验方法:选取正常喂养的c57bl/6j成年雄性小鼠,随机分组,分别为对照组(ck),菌剂组(菌1组,菌2组,菌3组,菌4组,菌5组,菌6组,菌1+菌5组,菌2+菌6组,菌3+菌4组),对照菌剂组(lp,lactobacillusplantarumcgmccno.8198)和肥胖模型组(hf),每组10只,在spf(无特定病原体(specificpathogenfree))环境下自由进食和饮水。lp组、hf组和菌剂组喂食高脂饲料,ck组喂食普通维持饲料。喂养4周后,菌剂组和lp组开始灌胃相应菌株菌液;hf组和ck组灌胃等量培养基,灌胃9周。灌喂菌量定为0.15ml/10g体重,菌浓为1×107cfu/ml,浓缩后浓度为1×108cfu/ml,频率为隔天一次。菌液需提前培养,每周活化保证新鲜,分别测定浓度,并调整至1×108cfu/ml。对于单一菌剂组,取相应菌液按上述剂量灌胃;对于混合菌剂组,将各单菌菌液等比例混合后按上述剂量灌胃。实验期中,每周记录小鼠体重、状态、进食量等数据。实验最后一周各组小鼠进行葡萄糖耐量(ogtt)试验。实验结束后处死小鼠,记录脂肪重量,并取血清,用elisa试剂盒检测血脂和蛋白因子含量。实验结果:(1)伴生粪球菌、浑浊戴阿利斯特菌或其组合菌对鼠体重的影响。表4灌胃伴生粪球菌后各组小鼠与灌胃前相比的体重增长情况(图1)注:表中数据为平均值±标准差,对于每一列的任意两组数据,数字后面没有相同字母表示差异显著(p<0.05),表5-15与此相同。表5灌胃浑浊戴阿利斯特菌后各组小鼠与灌胃前相比的体重增长情况(图2)表6灌胃组合菌后各组小鼠与灌胃前相比的体重增长情况(图3)结果如表4-6和图1-3所示。结果表明,伴生粪球菌、浑浊戴阿利斯特菌、或其组合可有效减缓肥胖模型小鼠的体重的增长(p<0.05)。(2)伴生粪球菌、浑浊戴阿利斯特菌或其组合菌对体脂比的影响。表7灌胃伴生粪球菌9周后各组小鼠的体脂比(图4)分组脂肪重量/体重×100%ck2.83±0.13e菌14.11±0.10c菌24.00±0.26cd菌33.85±0.19dlp5.39±0.34bhf7.48±0.46a表8灌胃浑浊戴阿利斯特菌9周后各组小鼠的体脂比(图5)分组脂肪重量/体重×100%ck2.91±0.14e菌43.97±0.22cd菌54.16±0.23c菌63.76±0.20dlp5.21±0.24bhf746±064a表9灌胃组合菌9周后各组小鼠的体脂比(图6)分组脂肪重量/体重×100%ck2.90±0.13d菌1+53.73±0.19c菌2+63.87±0.23c菌3+43.93±0.22clp5.42±0.17bhf756±055a结果如表7-9和图4-6所示。结果表明,伴生粪球菌、浑浊戴阿利斯特菌或其组合菌能显著降低肥胖模型小鼠的体脂比(p<0.05)。(3)伴生粪球菌、浑浊戴阿利斯特菌或其组合菌对血脂的影响。表10灌胃伴生粪球菌9周后各组小鼠血脂含量(图7)分组tc(mmol/l)tg(mmol/l)ldlc(mmol/l)hdlc(mmol/l)ck3.811±0.144d0.914±0.048d1.260±0.057e3.354±0.166a菌14.819±0.198c1.041±0.080c1.516±0.084c3.529±0.123a菌24.790±0.226c1.052±0.059c1.479±0.083cd3.510±0.160a菌34.823±0.251c1.073±0.057c1.457±0.102d3.479±0.158alp5.385±0.253b1.234±0.094b1.872±0.124b2.743±0.139bhf6299±0257a1303±0076a2381±0157a2193±0104c表11灌胃浑浊戴阿利斯特菌9周后各组小鼠血脂含量(图8)分组tc(mmol/l)tg(mmol/l)ldlc(mmol/l)hdlc(mmol/l)ck3.892±0.154d0.983±0.047c1.250±0.036d3.376±0.202a菌44.896±0.230c1.012±0.072c1.395±0.082c3.497±0.093a菌54.906±0.247c1.014±0.054c1.353±0.076c3.439±0.160a菌64.917±0.201c1.069±0.070c1.364±0.071c3.421±0.195alp5.258±0.302b1.216±0.088b1.831±0.131b2.741±0.100bhf6.390±0.290a1.295±0.064a2.357±0.126a2.153±0.105c表12灌胃组合菌9周后各组小鼠血脂含量(图9)分组tc(mmol/l)tg(mmol/l)ldlc(mmol/l)hdlc(mmol/l)ck3.902±0.111d0.964±0.046d1.213±0.060d3.287±0.239a菌1+54.822±0.139c1.019±0.067c1.369±0.077c3.324±0.177a菌2+64.904±0.182c1.017±0.061c1.367±0.077c3.249±0.215a菌3+44.834±0.192c1.009±0.060c1.381±0.082c3.252±0.140alp5.498±0.280b1.213±0.061b1.742±0.105b2.621±0.106bhf6.511±0.252a1.304±0.094a2.357±0.166a2.196±0.096c结果如图7-9和表10-12所示。血脂中的主要成份是胆固醇和甘油三酯,血浆中胆固醇和甘油三脂水平的升高与动脉粥样硬化的发生有关。结果表明,伴生粪球菌、浑浊戴阿利斯特菌或其组合菌可降低血脂,降低动脉粥样硬化相关疾病(如心血管疾病)的相关指标。并且,伴生粪球菌、浑浊戴阿利斯特菌或其组合菌降低总胆固醇(tc)、总甘油三酯(tg)和低密度脂蛋白(ldlc),以及增加高密度脂蛋白(hdlc)的作用尤为明显(p<0.05)。(4)伴生粪球菌、浑浊戴阿利斯特菌或其组合菌对瘦素(leptin,lep)、单核细胞趋化蛋白-1(mcp-1)的影响。表13灌胃伴生粪球菌9周后各组小鼠瘦素(leptin,lep)、单核细胞趋化蛋白-1(mcp-1)含量(图10、图13)表14灌胃浑浊戴阿利斯特菌9周后各组小鼠瘦素(leptin,lep)、单核细胞趋化蛋白-1(mcp-1)含量(图11、图14)分组mcp-1(pg/ml)lep(pg/ml)ck343.07±44.17c1162.93±96.41c菌4339.99±39.03c1158.48±130.63c菌5338.79±31.89c1166.22±136.26c菌6336.81±38.48c1158.43±111.51clp365.95±48.92b1264.09±158.29bhf383.04±45.92a1401.25±147.52a表15灌胃组合菌9周后各组小鼠瘦素(leptin,lep)、单核细胞趋化蛋白-1(mcp-1)含量(图12、图15)分组mcp-1(pg/ml)lep(pg/ml)ck336.55±38.88c1164.35±106.96c菌1+5335.85±31.27c1173.25±114.83c菌2+6333.48±31.21c1169.25±132.61c菌3+4330.36±35.21c1176.85±109.40clp366.47±24.75b1259.06±144.03bhf384.12±44.29a1401.18±179.66a结果如图10-15及表13-15所示。结果显示,伴生粪球菌、浑浊戴阿利斯特菌或其组合菌能明显降低肥胖模型小鼠血清中的瘦素(lep)和单核细胞趋化蛋白-1(mcp-1)的含量(p<0.05)。结果表明,伴生粪球菌、浑浊戴阿利斯特菌或其组合菌能够改善瘦素抵抗,提高体内对瘦素(lep)的敏感性;并且,经过伴生粪球菌、浑浊戴阿利斯特菌或其组合菌治疗后血清mcp-1水平降低,有利于改善胰岛素抵抗,可降低动脉粥样硬化和心血管疾病发生的风险。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1