泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法与流程
本发明涉及泡型包虫病动物模型技术领域,是一种泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法。
背景技术:
1.泡型包虫病危害性及合适模型的需求
在世界范围内,包虫病是严重的公共卫生问题。该病在中东、南欧、拉丁美洲、中亚、澳大利亚和非洲部分国家流行,在我国以甘肃、新疆、宁夏、内蒙、青海等省(区)流行最为严重,人群发病率可高达5%至10%。其中,泡型包虫病(Alveolar Echinococcoisis,AE)是由多房棘球绦虫(Echinococcus multilocularis,E.m,泡球蚴)的幼虫(六钩蚴)寄生于人体所致的一种“类肝癌样”致死性寄生虫病,几乎原发于肝脏,本病呈隐袭进行性的特点,WHO资料显示未经治疗的泡型包虫病病人10年病死率高达94%。泡球蚴感染宿主后,在病人肝脏中不形成完整囊壁,囊体与周围组织间没有纤维膜形成的明显界限,囊液与肝细胞可以长期直接接触对宿主肝脏造成慢性损害,泡球蚴生发层本身以芽生方式无限制向外增殖,破坏肝实质,形成占位性病变,引起局部肝组织病变、增生、肝纤维化、萎缩、变性和坏死,晚期时,病灶中心为凝固性坏死组织,边缘则似癌样呈浸润性扩散,可侵犯邻近的肝外组织器官:如肝门、胰腺或下腔静脉等,成为肝AE不能手术完全切除的主要原因。
目前,泡型包虫病患者就医时多属晚期,临床治疗时,一般采取以手术切除病灶为主。对于术后预防或者无法实施手术的患者临床多采用口服阿苯达唑片剂或脂质体进行治疗,但是由于临床上使用阿苯达唑片剂或脂质体存在吸收差、病灶区药物浓度低,常出现多种不良的毒、副反应等缺陷,导致其使用受限。因此,制备合适的泡球蚴感染动物模型,对于泡型包虫病的防治,探索新的治疗药物及其作用靶点和非手术治疗方法具有重要的意义。
2.泡型包虫病动物模型的研究现状
动物模型的制备,尤其是模拟自然感染途径,是进行包虫病研究的基础。约90%以上的泡型包虫病患者均寄生于肝脏,并且药物的分解代谢亦位于肝脏,因此,模拟出泡球蚴感染宿主肝脏原发性病理模型,有利于我们更准确地进行药物筛选、药物疗效的判定及肝移植等基础实验研究。目前泡球蚴感染小鼠模型有四种造模方式:(1)开腹直视肝脏穿刺接种;(2)经皮肝穿刺接种;(3)门静脉系侧枝血管(回盲部静脉)穿刺接种;(4)腹腔穿刺接种。针对这四种造模方式,开腹直视肝脏穿刺接种是较为成熟的方法,感染率约60%,但对肝脏有一定损伤,出血较多,无法精确计算注射入肝脏的泡球蚴数量,并且注射的虫体非常容易发生肝脏外溢漏,造成腹腔感染。经皮肝脏穿刺是一种相对简便易行的获得肝泡型包虫病模型的方法,感染率约62.5%,但容易发生注射点肝脏出血,以及虫体发生肝脏外溢漏,造成腹腔感染。腹腔穿刺接种具有一定的局限性,模拟的是泡球蚴继发感染的情况,其病灶主要寄生在腹腔和盆腔部位,不能很好的反映肝脏原发病灶的生长情况,感染率相对较高,约90.9%。门静脉系侧枝血管(回盲部静脉)穿刺接种最接近自然感染的途径,但感染率相对较低,约6.4%。因此,需要建立一种更接近自然感染途径、感染率高,以及病灶原发于肝脏的泡型包虫病动物模型。
3.泡球蚴感染剂量的重要性
临床及流行病学调查资料显示泡型包虫病患者存在较高的自愈现象,B超检查会发现很多病人中存在钙化的包虫病灶,Gottstein等报道泡球蚴特异性诊断抗原Em2+血清检测阳性的人群中,最终仅有1%人得病,说明肝脏具有一定的免疫应答能力,可以清除或杀伤一定剂量的泡球蚴虫体。因此,需要能够精确控制注入肝脏的泡球蚴数量的泡型包虫病动物模型。
技术实现要素:
本发明提供了一种泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法,克服了上述现有技术之不足,其能有效解决现有泡型包虫病动物模型构建方法存在不能兼具接近自然感染途径和感染率高的问题;本发明首次公开泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法,其不仅更好的接近自然感染途径,而且感染率较高,感染率达到90%以上,同时能精确接种的泡球蚴数量,为研究不同时间和泡球蚴剂量小鼠感染率、免疫耐受的机制、泡球蚴感染所致宿主肝脏损伤机制,以及为筛选治疗泡型包虫病新的药物提供一个很好的动物模型。
本发明的技术方案是通过以下措施来实现的:一种泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法,按下述方法进行:将小鼠麻醉固定,小鼠腹部消毒,开腹暴露肝门静脉,经肝门静脉穿刺接种泡球蚴,按压穿刺点直至止血后关腹,穿刺接种并关腹后的小鼠苏醒后,正常饲养得到泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型。
下面是对上述发明技术方案的进一步优化或/和改进:
上述穿刺肝门静脉时,在远离第一肝门位置并包绕门静脉的脂肪垫处进针。
上述穿刺接种之前,泡球蚴头节清洗干净。
上述穿刺接种并关腹后的小鼠放置于温度为30℃的加热台直至小鼠苏醒。
上述泡球蚴按下述方法得到:取腹腔感染泡球蚴12个月以上的Balb/c小鼠,在无菌条件下断颈处死Balb/c小鼠,取出Balb/c小鼠腹腔内新鲜泡球蚴组织,新鲜泡球蚴组织依序经过碾碎、反复冲洗和分离后得到泡球蚴。
本发明所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法得到的泡型包虫病动物模型兼具接近自然感染途径和感染率高的优点;而目前所用的泡球蚴感染模型多为腹腔注射和肝穿刺,腹腔注射模型模拟肝外形成泡球蚴组织的继发感染,很少能感染肝脏,而自然感染泡球蚴的宿主,虫体主要寄生在血供较为丰富的肝脏,所以本发明所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法接种泡球蚴模型时,能更好的模拟自然感染的方式,感染部位存在于肝脏;另外,现有肝穿刺模型虽然能模拟肝内感染,但由于肝脏是血供非常丰富的器官,穿刺后出血较多,接种的泡球蚴可能会随着出血流失,造成接种的剂量不精确,并且病灶仅局限于穿刺点,而本发明所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法构建的泡球蚴动物模型可以保证接种的泡球蚴在肝内均匀分布,出血少,同时能精确接种的泡球蚴数量;从而为研究不同时间和剂量小鼠感染率、免疫耐受的机制、泡球蚴感染所致宿主肝脏损伤机制,以及为筛选治疗泡型包虫病新的药物提供一个很好的动物模型。
附图说明
附图1为本发明得到的小鼠模型的HE染色图。
附图2为本发明得到的小鼠模型的天狼星红染色图。
附图3为本发明空白对照组以及本发明得到的小鼠模型小鼠肝脏单个核细胞数(Liver MNC number)。
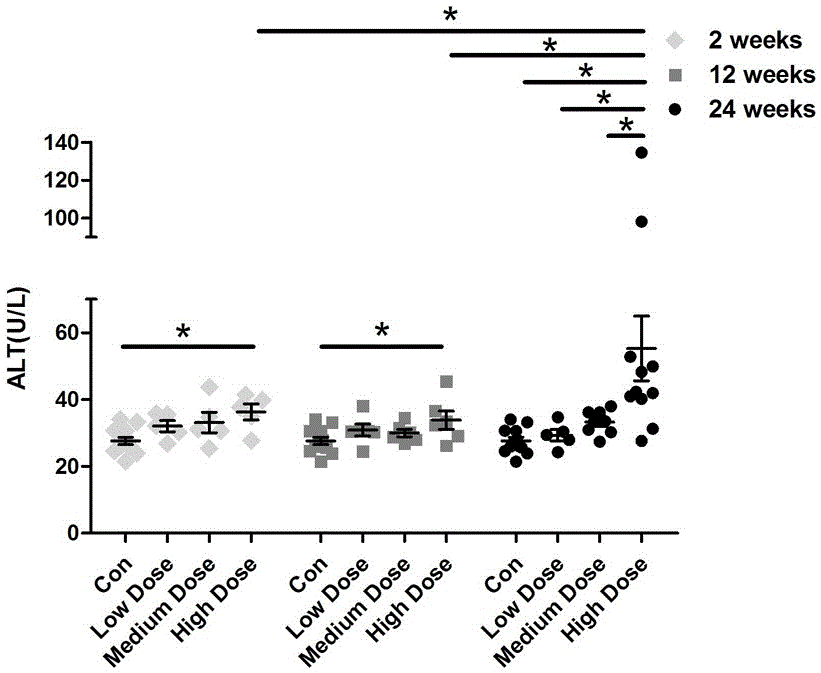
附图4为本发明空白对照组以及本发明得到的小鼠模型ALT变化。
附图5为本发明得到的小鼠模型小鼠肝脏单个核细胞数与ALT的关系图。
附图6为本发明空白对照组以及本发明得到的小鼠模型肝脏NK细胞数目。
附图7为本发明空白对照组以及本发明得到的小鼠模型肝脏NK细胞CD69+分子数目。
附图8为本发明空白对照组以及本发明得到的小鼠模型CD4+T细胞在肝脏核细胞的百分比。
附图9为本发明空白对照组以及本发明得到的小鼠模型肝脏CD4+T细胞数量。
附图10为本发明空白对照组以及本发明得到的小鼠模型CD8+T细胞在肝脏核细胞的百分比。
附图11为本发明空白对照组以及本发明得到的小鼠模型肝脏CD8+T细胞数目。
附图12为本发明空白对照组以及本发明得到的小鼠模型CD4/CD8比率。
附图13为本发明空白对照组以及本发明得到的小鼠模型肝脏的CD4+T细胞的幼稚亚群。
附图14为本发明空白对照组以及本发明得到的小鼠模型肝脏的CD4+T细胞的中枢记忆亚群比例。
附图15为本发明空白对照组以及本发明得到的小鼠模型肝脏的CD4+T细胞的效应记忆亚群比例。
附图16为本发明空白对照组以及本发明得到的小鼠模型肝脏的CD8+T细胞的幼稚亚群比例。
附图17为本发明空白对照组以及本发明得到的小鼠模型肝脏的CD8+T细胞的中枢记忆亚群比例。
附图18为本发明空白对照组以及本发明得到的小鼠模型肝脏的CD8+T细胞的效应记忆亚群比例。
附图19为本发明24周空白对照组以及本发明不同剂量(50,500,2000个)得到的小鼠模型的T细胞比例。
具体实施方式
本发明不受下述实施例的限制,可根据本发明的技术方案与实际情况来确定具体的实施方式。
本领域技术人员应该理解,如果没有特别说明,下述实施例中所用的化学试剂均为市售分析纯级别的试剂。下述动物均购自北京维通利华实验动物技术有限公司,动物实验遵照新疆医科大学第一附属医院实验动物使用与管理委员会(ICUC)的批准,样本取材程序符合新疆医科大学第一附属医院实验动物伦理委员会标准,实验严格遵循动物实验的相关伦理学标准执行,在实验过程中使用麻醉剂,最大限度的减少小动物的术后疼痛。
下面结合实施例对本发明作进一步描述:
实施例1:该泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法,按下述方法进行:将小鼠麻醉固定,小鼠腹部消毒,开腹暴露肝门静脉,经肝门静脉穿刺接种泡球蚴,按压穿刺点直至止血后关腹,穿刺接种并关腹后的小鼠苏醒后正常饲养得到泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型。
根据本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法构建感染肝脏的泡型包虫病动物模型时,其感染率达到90%以上,并且更好的接近自然感染途径。使根据本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法得到的泡型包虫病动物模型兼具接近自然感染途径和感染率高的优点;而目前所用的泡球蚴感染模型多为腹腔注射和肝穿刺,腹腔注射模型模拟肝外形成泡球蚴组织的继发感染,很少能感染肝脏,而自然感染泡球蚴的宿主,虫体主要寄生在血供较为丰富的肝脏,所以本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法接种泡球蚴时,能更好的模拟自然感染的方式,感染部位存在于肝脏;另外,肝穿刺模型虽然能模拟肝内感染,但由于肝脏是血供非常丰富的器官,穿刺后出血较多,接种的泡球蚴可能会随着出血流失,造成接种的剂量不精确,并且病灶仅局限于穿刺点,而本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法构建的泡型包虫病动物模型可以保证接种的泡球蚴在肝内均匀分布,出血少,同时能精确接种的泡球蚴数量;从而为研究不同时间和剂量小鼠感染率、免疫耐受的机制、泡球蚴感染所致宿主肝脏损伤机制,以及为筛选治疗泡型包虫病新的药物提供一个很好的动物模型。
实施例2:作为上述实施例的优化,穿刺肝门静脉时,在远离第一肝门位置并包绕肝门静脉的脂肪垫处进针。从脂肪垫处进针时,能够减少出血,从而避免腹腔黏连。进一步精确接种的泡球蚴数量。
实施例3:作为上述实施例的优化,在穿刺接种之前,泡球蚴头节清洗干净。
如不将泡球蚴头节清洗干净的话,可致机体过敏性休克,造成动物死亡。
穿刺接种之前,必须测定泡球蚴头节的活力。接种时,采用活力为90%以上的泡球蚴头节,使采用本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法能够进一步提高感染率。
实施例4:作为上述实施例的优化,穿刺接种并关腹后的小鼠放置于温度为30℃的加热台直至小鼠苏醒。
实施例5:作为上述实施例的优化,泡球蚴按下述方法得到:取腹腔感染泡球蚴12个月以上的Balb/c小鼠(种鼠),在无菌条件下断颈处死Balb/c小鼠,取出Balb/c小鼠腹腔内新鲜泡球蚴组织,新鲜泡球蚴组织依序经过碾碎、反复冲洗和分离后得到泡球蚴。在取泡球蚴头节时,如发现Balb/c小鼠腹腔感染化脓,应废弃,以保证泡球蚴头节的质量。
实施例6:作为上述实施例5的优化,泡球蚴按下述方法得到:
(1)取腹腔感染泡球蚴12个月以上的种鼠(Balb/c小鼠)一只,采用颈椎脱臼法处死后,将其完全浸入75%乙醇中体表灭菌3分钟;
转移入生物安全柜中,取出小鼠置于无菌培养皿,夹起腹部皮肤,剪开腹腔;
用无菌眼科剪和镊子取出腹腔内的泡球蚴组织,置于无菌的含磷酸盐缓冲液(PBS)溶液的平皿中,并用PBS溶液洗涤2次至3次,用眼科剪剪成1厘米(cm)×1cm×1cm的组织块;
取出已灭菌的100目的钢制细胞筛网,置于无菌的含PBS溶液的平皿中,将剪碎的泡球蚴组织置于钢网上,用5毫升(mL)注射器的黑色橡胶头在钢网上充分碾磨,加PBS溶液至钢网上,不断搅动碾磨碎的泡球蚴组织,过滤收集原头蚴虫体;
将残留在钢网上的组织弃去,过滤收集含有泡球蚴的液体转入50mL无菌离心管;
(6)将离心管中的溶液静置5min至10min,弃上清,用含有1%青霉素和链霉素的PBS溶液洗涤6次,收集沉淀,并将沉淀转移至新的无菌的含PBS溶液的平皿中,轻轻旋转晃动,静置片刻后将平皿倾斜,用无菌巴氏吸管小心吸取泡球蚴至新培养皿中,最后获取相对较纯的原头蚴虫体沉淀;用一定体积的无菌生理盐水重悬;
(7)取一定量的洗涤后的泡球蚴于1.5mL EP管中,用0.4%台盼蓝染色3min后弃去染液,用PBS液洗1遍至2遍后涂于载玻片上,于倒置显微镜下观察泡球蚴的活性和形态,并分别计算虫体数量和活力,为泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建提供虫体。
实施例7:该泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法,按下述方法进行:
(1)按照不同剂量(50,250,500,1000,2000个)调整泡球蚴的浓度,使总体系为200微升至300微升,为了精确接种的泡球蚴数量及液体总体积,可将不同剂量泡球蚴先放入含有少量生理盐水的培养皿中,通过轻微旋转的力量聚集泡球蚴原头蚴,用带4.5#头皮针的1mL注射器预先吸取300μL生理盐水,排除空气,然后缓缓吸取泡球蚴至头皮针软管内,倒挂2min,使吸入的泡球蚴尽量分散于离头皮针针头5cm至10cm的位置;
(2)取0.1g/mL水合氯醛与无菌生理盐水1:1稀释,根据小鼠体重0.5mL/100g腹腔注射麻醉小鼠,约10min后在超净工作台内仰卧,固定小鼠四肢,用医用碘伏消毒腹部,腹部正中剪开1.5cm,内腹膜从腹白线剪开,避开血管,暴露腹腔,在切口右侧放置一块生理盐水的润湿纱布,将肠管用棉签拨至右侧,掀开肝脏暴露肝门静脉;
(3)远离第一肝门位置有一块脂肪垫包绕门静脉,从该部位(脂肪垫)进针穿刺,注射总体积约100μ至300μL,用干棉签按压穿刺点约2min,直至止血,轻轻将肠管拨回腹腔,腹部全层用5-0的可吸收线缝合约3针至4针,再次用碘伏消毒切口;
(4)将术后的小鼠置于30℃加热台,直至苏醒,放回鼠笼正常饲养。
通过本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法造模成功后,不同时间点(2,4,8,12,16,20,24周)处死小鼠,打开腹腔大体观察肝脏泡球蚴寄生部位和感染情况。感染早期(2,4周),不同剂量的感染小鼠,病灶均匀分布各肝叶;感染中晚期(8,12,16,20,24周),低中剂量(50,250,500个)感染小鼠,病灶逐渐被宿主清除,而高剂量(2000个)感染小鼠,病灶在肝脏稳定寄生,呈膨大侵蚀性生长,感染率≥90%,见表1,而现有泡型包虫病动物模型造模方式在相同剂量的感染率:(1)开腹直视肝脏穿刺接种:感染率约60%;(2)经皮肝穿刺接种:感染率约62.5%;(3)门静脉系侧枝血管(回盲部静脉)穿刺接种:感染率约6.4%;(4)腹腔穿刺接种:感染率约90.9%。
将通过本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法得到的小鼠的肝脏组织块固定于4%的中性甲醛中1天至2天后,经脱水并包埋于石蜡当中,石蜡包埋的肝脏组织切成4μm的薄片,所有的薄片脱蜡后进行H&E染色,HE染色图如图1所示;肝脏组织通过天狼星红染色来显示纤维化,天狼星红染色图如2所示。
在图1中,以相同时间段和相同剂量的两幅小图为一组图,例如剂量为2000PSCs、时间为2周(2weeks)的两幅小图为一组图,在该组图中,右图为左图的局部放大图;图1中的其它组图同理。
图1和图2显示,低中剂量(50,250,500个)虫体感染的小鼠模型,肝脏病灶周围炎性细胞浸润较轻,随着感染持续,病灶逐渐发生肝纤维化,虫体被清除;高剂量(1000,2000个)虫体感染的小鼠模型,肝脏病灶周围炎性反应较重,炎性细胞大量浸润,肝脏损伤严重,随着感染持续,病灶逐渐扩大,肝纤维化程度加重。
以未感染泡球蚴的肝脏为空白对照组(con),将本实施例得到的小鼠肝脏(实验组)和空白对照组的肝脏均按下述方法处理:用含0.2%BSA的PBS进行研磨,经钢丝网过滤后1500rpm离心5min,取沉淀,用6mL 40%Percoll(GE Healthcare公司)溶液重悬肝脏沉淀,通过密度梯度离心20min,收集下层细胞沉淀,通过血细胞计数器在显微镜下进行细胞计数,实验组和空白对照组的小鼠肝脏单个核细胞数(Liver MNC number)如图3所示,实验组和空白对照组的外周血谷氨酸丙酮酸转氨酶(ALT)变化如图4所示。
在图3中,低剂量(Low Dose,50个)感染,小鼠肝脏单个核细胞数在不同阶段无显著变化;中剂量(Medium Dose,500个)感染,小鼠肝脏单个核细胞数在感染早期(2周)有一定程度的增加,但无显著差异;高剂量(High Dose,2000个)感染,小鼠肝脏单个核细胞数在感染早中晚期均显著高于空白对照组小鼠,同时,我们发现根据本实施例所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法得到的泡型包虫病小鼠模型肝脏单个核细胞数与肝损伤(ALT,谷氨酸丙酮酸转氨酶)和肝纤维化程度呈正相关性,表明泡球蚴不同感染剂量与小鼠肝脏损伤有着密切的关系,如图5所示。
取1×106个分离的肝脏单个核细胞,用纯化CD16/32抗体(Biolegend公司)进行封闭,然后标记抗NK1.1、CD3、CD4、CD8α、CD44、CD62L(Biolegend公司)的荧光抗体。从图6至图12可以看出,高剂量(2000个)感染小鼠肝脏NK细胞数量明显增多(见图6);且表达CD69+分子的NK细胞数也明显增加(见图7);T细胞数也明显增加,包括CD4+T细胞与CD8+T细胞,感染晚期(24周),以CD8+T细胞占优势。
此外,图13至图18显示在肝脏中,不同阶段(2,12,24周)和剂量(50,500,2000个)本发明的泡球蚴感染小鼠模型肝脏的CD4+与CD8+T细胞的幼稚(naive)(CD44loCD62Lhi)、中枢记忆(central memory)(CD44hiCD62Lhi)与效应记忆(effector memory)(CD44hiCD62Llo)三个亚群;图19中,发现高剂量(2000个)感染晚期(24周),小鼠肝脏CD4+T细胞形成以效应记忆细胞(effector memory cells)为主;随着感染剂量的增加,不同阶段小鼠肝脏CD8+T细胞以中枢记忆细胞(central memory cells)和效应记忆细胞为主,其中中枢记忆细胞的比例较高。
综上所述,本发明所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法,得到的泡型包虫病动物模型兼具接近自然感染途径和感染率高的优点;而目前所用的泡球蚴感染模型多为腹腔注射和肝穿刺,腹腔注射模型模拟肝外形成泡球蚴组织的继发感染,很少能感染肝脏,而自然感染泡球蚴的宿主,虫体主要寄生在血供较为丰富的肝脏,所以本发明所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法接种泡球蚴模型时,能更好的模拟自然感染的方式,感染部位存在于肝脏;另外,现有肝穿刺模型虽然能模拟肝内感染,但由于肝脏是血供非常丰富的器官,穿刺后出血较多,接种的泡球蚴可能会随着出血流失,造成接种的剂量不精确,并且病灶仅局限于穿刺点,而本发明所述的泡球蚴经肝门静脉途径感染肝脏的泡型包虫病动物模型的构建方法构建的泡球蚴动物模型可以保证接种的泡球蚴在肝内均匀分布,出血少,同时能精确接种的泡球蚴数量;从而为研究不同时间和剂量小鼠感染率、免疫耐受的机制、泡球蚴感染所致宿主肝脏损伤机制,以及为筛选治疗泡型包虫病新的药物提供一个很好的动物模型。
以上技术特征构成了本发明的实施例,其具有较强的适应性和实施效果,可根据实际需要增减非必要的技术特征,来满足不同情况的需求。
表1
- 还没有人留言评论。精彩留言会获得点赞!