PFBT‑空心金铜纳米粒胶体溶液及制备方法及用途与流程
本发明属于肿瘤治疗及成像药物制备领域,具体涉及一种PFBT-空心金铜纳米粒胶体溶液及制备方法和应用。
背景技术:
光热治疗是一种新兴的抗肿瘤治疗手段,通过光热吸收剂有效地吸收近红外光并将一部分能量转化为肿瘤细胞不耐受的43℃以上的过高热,而正常细胞由于对该温度耐受可有效避免伤害。将光热材料应用于肿瘤部位并配合局部近红外照射,即可达到治疗局部肿瘤并减少全身毒性的目的。
作为光热治疗的基本因素,光热物质能否在近红外光区域(650-950nm)有较强光吸收光热治疗的效果有很强的影响。金纳米材料由于具有局部表面等离子共振吸收及其吸收的可调控性,而被作为光热材料广泛用于肿瘤的光热治疗研究中。近年来有一系列将金和其它金属制成合金的报道,制得的合金可显著调节金纳米材料的光吸收特性并有效提高材料的光热转换特性。空心金纳米球作为一种特殊的纳米金材料,由于具有载药量高,比表面积大以及在近红外区吸收可控等优点,受到研究者的广泛关注。目前关于将空心金纳米球与其他金属形成纳米粒及其光热效果的研究尚未报道。
高分子材料聚[(9,9-二辛基芴基-2,7-二基)-交替-共-(1,4-苯并-{2,1’,3}-噻二唑)](PFBT,分子量10000-100000)(实施例用上述范围表示)是一类具有发光性质的π-共轭物质,由于其具有发光能力强以及良好的光稳定性和生物相容性等优点,近年来有将其应用于近红外成像指导的肿瘤治疗中的报道。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种PFBT-空心金铜纳米粒胶体溶液。
本发明的第二个目的是提供一种PFBT-空心金铜纳米粒胶体溶液的制备方法。
本发明的第三个目的是提供一种PFBT-空心金铜纳米粒胶体溶液在制备抗肿瘤药物的应用。
本发明的技术方案概述如下:
一种PFBT-空心金铜纳米粒胶体溶液的制备方法,包括如下步骤:
(1)制备钴单质胶体溶液;
(2)将步骤(1)获得的钴单质胶体溶液和HAuCl4溶于水中,在氮气流保护下搅拌1-2h,加入CuCl2,在氮气流保护下搅拌反应1-2h,通空气,获得深蓝色的含空心金铜纳米粒的液体,8000-12000rpm离心10-15min,冷冻干燥即得空心金铜纳米粒粉末;
(3)将0.75-1.25μmol空心金铜纳米粒粉末溶于5-10mL 20%-50%的氯仿甲醇溶液中,加入20-100μg PFBT,室温下12000-14000rpm搅拌10-12h,离心15-20min,除去上层甲醇和氯仿溶剂,沉淀在真空状态下静置6-12小时除去残余溶剂,用5mL水超声分散5min,即得到PFBT-空心金铜纳米粒胶体溶液;
所述PFBT为聚[(9,9-二辛基芴基-2,7-二基)-交替-共-(1,4-苯并-{2,1’,3}-噻二唑)]的缩写。
所述步骤(2)优选为:按比例,将3mL 4×10-4M钴单质胶体溶液和0.75-1.25μmol HAuCl4溶于10mL水中,在氮气流保护下搅拌1-2h,加入0.3-7.5μmol CuCl2,在氮气流保护下搅拌反应1-2h,通空气,获得深蓝色的含空心金铜纳米粒的液体,8000-12000rpm离心10-15min,冷冻干燥即得空心金铜纳米粒粉末。
上述方法制备的PFBT-空心金铜纳米粒胶体溶液。
PFBT-空心金铜纳米粒胶体溶液在制备抗肿瘤药物中的应用。
有益效果
(1)本制备方法简单易行,容易操控,所需原料方便易得,实验重现性好。
(2)本发明通过将疏水性PFBT结合于空心金铜纳米粒上,可克服其生物利用度差的问题并将其应用于肿瘤近红外实时成像治疗。
(3)本发明制备的PFBT-空心金铜纳米粒胶体溶液具有相对于空心金纳米粒增强的近红外吸收特性和热转换效应,可应用于对肿瘤的光热治疗。
(4)本发明制备的PFBT-空心金铜纳米粒胶体溶液具有良好的生物利用度和生物相容性,光可调控的荧光特性,可用于近红外肿瘤实时追踪成像指导的可视化光热治疗。
附图说明
图1(a)HGNs和HGCNs胶体溶液的紫外可见光谱图;(b)PFBT-HGCNs和HGCNs胶体溶液的紫外可见光谱图;
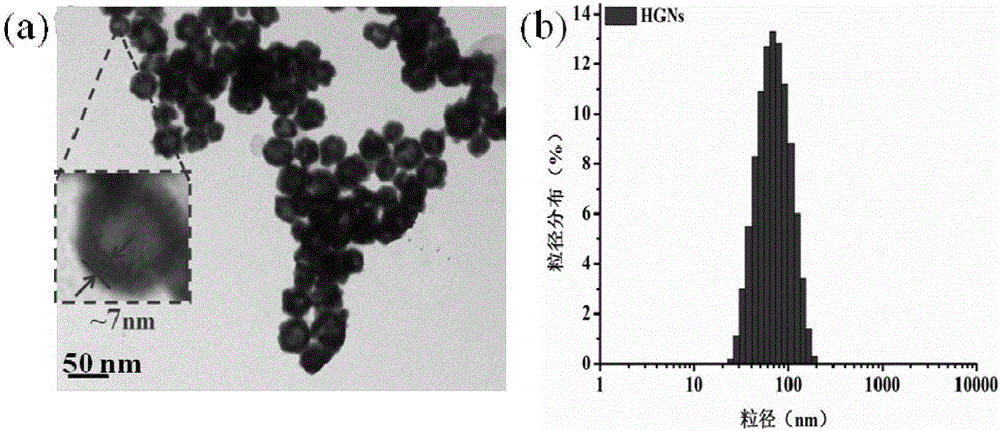
图2(a)为HGNs的电镜图;(b)为HGNs的粒径分布图;
图3(a)为HGCNs的电镜图;(b)为HGCNs的粒径分布图;
图4(a)为PFBT-HGCNs的电镜图;(b)为PFBT-HGCNs的粒径分布图。
图5为HGCNs和PFBT-HGCNs胶体溶液的光热升温曲线;
图6为PFBT-HGCNs在光照和不光照的情况下在不同时间点的细胞内的摄取荧光分布以及近红外成像性能;
图7为图6为MTT法测试的小鼠乳腺癌细胞(4T1)经过磷酸缓冲液(PBS,pH=7.4,对照)以及HGNs加NIR光照,HGCNs加NIR光照,PFBT-HGCNs(给予或不给予NIR光照)处理24小时后的细胞活力;
图8为PBS,HGNs,HGCNs和PFBT-HGCNs胶体溶液经小鼠静脉注射6小时后,于肿瘤局部施加NIR光照5分钟后的近红外热成像图;
图9为实施例9中不同样品处理后的治疗效果图。
具体实施方式
下面通过具体实施例对本发明作进一步的描述。除特别标明外,所用试剂和测试设备均为市售。
PFBT-空心金铜纳米粒胶体溶液简称:PFBT-HGCNs。
空心金铜纳米粒胶体溶液简称:HGCNs。
空心金纳米粒胶体溶液简称:HGNs。
实施例1
一种钴单质胶体溶液的制备,(采用氧化还原法,本方法是文献中报道过的)包括以下步骤:
取4×10-3mmol氯化钴与1.6×10-2mmol柠檬酸钠溶于10mL水中,通氮气并混合均匀得混合液;取1×10-4mmol硼氢化钠加入到上述混合液中,混合均匀,静置1h,溶液由浅红色变为深褐色即得到4×10-4M钴单质胶体溶液。
实施例2
一种PFBT-空心金铜纳米粒胶体溶液的制备方法,包括如下步骤:
(1)制备钴单质胶体溶液,见实施例1;
(2)将3mL 4×10-4M钴单质胶体溶液和0.75μmol HAuCl4溶于10mL水中,在氮气流保护下搅拌1h,加入0.3μmol CuCl2,在氮气流保护下搅拌反应1h,通空气,获得深蓝色的含空心金铜纳米粒的液体,8000rpm离心10min,冷冻干燥即得空心金铜纳米粒粉末;
(3)将0.75μmol空心金铜纳米粒粉末溶于5mL 20%的氯仿甲醇溶液中,加入20μg PFBT,室温下12000rpm搅拌10h,离心15min,除去上层甲醇和氯仿溶剂,沉淀在真空状态下静置6小时除去残余溶剂,用5mL水超声分散5min,即得PFBT-空心金铜纳米粒胶体溶液;所述PFBT为聚[(9,9-二辛基芴基-2,7-二基)-交替-共-(1,4-苯并-{2,1’,3}-噻二唑)]的缩写。
实施例3
一种PFBT-空心金铜纳米粒胶体溶液的制备方法,包括如下步骤:
(1)制备钴单质胶体溶液,见实施例1;
(2)将3mL 4×10-4M钴单质胶体溶液和1μmol HAuCl4溶于10mL水中,在氮气流保护下搅拌1.5h,加入4μmol CuCl2,在氮气流保护下搅拌反应1.5h,通空气,获得深蓝色的含空心金铜纳米粒的液体,10000rpm离心13min,冷冻干燥即得空心金铜纳米粒粉末;
(3)将1μmol空心金铜纳米粒粉末溶于7mL 30%的氯仿甲醇溶液中,加入60μg PFBT,室温下13000rpm搅拌11h,离心18min,除去上层甲醇和氯仿溶剂,沉淀在真空状态下静置10小时除去残余溶剂,用5mL水超声分散5min,即得PFBT-空心金铜纳米粒胶体溶液。
实施例4
一种PFBT-空心金铜纳米粒胶体溶液的制备方法,包括如下步骤:
(1)制备钴单质胶体溶液,见实施例1;
(2)将3mL 4×10-4M钴单质胶体溶液和1.25μmol HAuCl4溶于10mL水中,在氮气流保护下搅拌2h,加入7.5μmol CuCl2,在氮气流保护下搅拌反应2h,通空气,获得深蓝色的含空心金铜纳米粒的液体(胶体溶液,命名为HGCNs),12000rpm离心15min,冷冻干燥即得空心金铜纳米粒粉末;
(3)将1.25μmol空心金铜纳米粒粉末溶于10mL 50%的氯仿甲醇溶液中,加入100μg PFBT,室温下14000rpm搅拌12h,离心20min,除去上层甲醇和氯仿溶剂,沉淀在真空状态下静置12小时除去残余溶剂,用5mL水超声分散5min,即得PFBT-空心金铜纳米粒胶体溶液(PFBT-HGCNs)。
实施例5(对照)
一种PFBT-空心金纳米粒胶体溶液的制备方法,包括如下步骤:
(1)制备钴单质胶体溶液,见实施例1;
(2)将3mL 4×10-4M钴单质胶体溶液和1.25μmol HAuCl4溶于10mL水中,在氮气流保护下搅拌2h,通空气,获得浅蓝色的含空心金纳米粒的胶体溶液,命名为HGNs。
实施例4制备的PFBT-HGCNs表征:
HGCNs和PFBT-HGCNs的紫外-可见分光光度计测得的吸收图谱见图1a和图1b,HGCNs的吸收峰相对于HGNs右移15nm左右,这有利于增加其在近红外区的光吸收并增加其光热转换特性,从PFBT-HGCNs紫外图谱中可观察到PFBT和HGCNs的特征吸收峰;用马尔文激光粒度仪和透射电镜测得的粒径分布和微观形态见于图2(HGNs),图3(HGCNs)和图4(PFBT-HGCNs),电镜图表明HGCNs呈空心完整球形且分布均一,相对于HGNs,金壳增厚4nm左右,PFBT-HGCNs电镜图还可看到外观嵌胶状PFBT的存在。马尔文激光粒度仪测得的HGNs,HGCNs和PFBT-HGCNs的粒径分别为61nm,75nm和91nm。.
实施例6
测试空心金铜纳米粒胶体溶液和PFBT-空心金铜纳米粒胶体溶液的光热升温曲线:
取0.5ml实施例4中制备的空心金铜纳米粒胶体溶液和PFBT-空心金铜纳米粒胶体溶液放在5mL离心管中(光程1cm,面积1cm2),使用670nm激光(激光功率为1W/cm2)连续照射5分钟,用一台配有热电偶微探针的温度监测器,每隔0.5分钟记录一次溶液的温度变化。
图5为空心金铜纳米粒胶体溶液和PFBT-空心金铜纳米粒胶体溶液的光热升温曲线。可见空心金铜纳米粒胶体溶液和PFBT-空心金铜纳米粒胶体溶液均可在NIR照射下快速升温,有望将其应用于光热治疗。
实施例7
测试PFBT-空心金铜纳米粒在细胞内的摄取情况以及近红外成像性能:
将实施例4制得的PFBT-空心金铜纳米粒胶体溶液以最佳的给药浓度加入到培养好小鼠乳腺癌细胞(4T1)的六孔板中,肿瘤细胞的个数为每孔1×106个。培养0.5,1,2h后吸出培养基并用PBS清洗3遍。并用激光共聚焦显微镜分别考察PFBT-金铜纳米粒在NIR照射和不照射情况下的近红外成像性能。
图6为实施例4制得的PFBT-空心金铜纳米粒在细胞内的摄取情况以及近红外成像图。可见NIR照射可显著增加PFBT-空心金铜纳米粒在细胞内的荧光强度,有望将PFBT-空心金铜纳米粒应用于近红外肿瘤实时追踪成像。
实施例8
测定不同浓度下的PFBT-空心金铜纳米粒对于小鼠乳腺癌细胞(4T1)的毒性:
采用MTT的方法对HGNs加NIR光照,HGCNs加NIR光照,PFBT-HGCNs(给予或不给予NIR光照)(实施例4制备)的体外细胞毒性进行表征。
取对数生长期细胞以1×104个/孔接种于96孔板,每组设6个复孔。将不同浓度的HGNs,HGCNs和PFBT-HGCNs胶体溶液分别与4T1细胞孵育6h后,对于需要激光处理的样品组在给药4个小时后进行(1W/cm2,1.5min),另三个复孔不做处理。继续孵育18h后,加入20μL四甲基偶氮唑盐溶液(MTT,5mg/mL)继续孵育3.5-4h后,吸出孔内培养液,每孔加入150μL二甲基亚砜(DMSO),置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪在490nm处测量各孔的吸光值。
实验证明(图7),本发明PFBT-HGCNs胶体溶液可直接影响4T1细胞的增殖,NIR光照组的PFBT-HGCNs比无光照组细胞增殖抑制率约增加55%左右。相比于HGNs,本发明的HGCNs和PFBT-HGCNs在NIR光照下表现出很好的抑制肿瘤细胞的功效。
实施例9
PFBT-空心金铜纳米粒对于体内肿瘤细胞的热疗作用:
200μL HGNs,HGCNs和实施例4中所制备的PFBT-HGCNs胶体溶液通过尾静脉注射到接种小鼠乳腺癌细胞(类型为BALB/C,体重20g)体内,并在注射6h后在小鼠肿瘤部位给予NIR(670nm,5min)照射处理,用近红外成像仪观察肿瘤局部的升温情况。结果显示,在同样的金浓度下,PFBT-HGCNs和HGCNs组比对照材料PBS和HGNs具有更好的升温效果(图8)。以上结果表明PFBT-HGCNs胶体溶液能够有效用于对肿瘤的光热治疗。
实施例10
负荷肿瘤的裸鼠(类型为BALB/C,体重20g)被分为两组(每组4只),然后分别经过不同方式处理:
(a)静脉注射生理盐水(saline)但不经过激光照射;
(b)静脉注射实施例4制备的PFBT-HGCNs胶体溶液;注射6小时后施加NIR光照5分钟,随后观察并记录各组老鼠的肿瘤治愈情况。从图9可以看出,经过21天治疗后,对照组裸鼠的肿瘤体积显著增大,而PFBT-HGCNs治疗组组裸鼠的肿瘤肉眼基本上看不到了。因此表明,实施例4制备的PFBT-HGCNs胶体溶液对肿瘤的光热治疗效果良好,能有效抑制肿瘤的生长。
实验证明,用实施例2、3制备的PFBT-HGCNs分别替代实施例4制备的PFBT-HGCNs所进行的实施例6、7、8、9、10的实验,其效果与实施例4相似。
- 还没有人留言评论。精彩留言会获得点赞!