一种兼具促进骨形成和抑制骨吸收作用的二氧化钛纳米管及其制备方法与流程
本发明提供一种兼具促进骨形成和抑制骨吸收作用的二氧化钛纳米管及其制备方法。属于生物医学材料领域,涉及一种利用旋转涂布层层自组装技术在负载辛伐他汀的二氧化钛纳米管表面构建壳聚糖/明胶多层膜的方法,属于钛材表面功能化的方法。
背景技术:
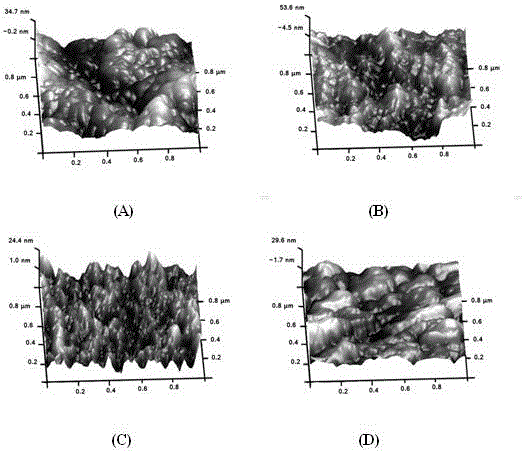
:钛材由于具有良好的机械性能和生物相容性,而被广泛作为骨组织植入材料应用于生物医学领域。但在植入初期,因其存在生物惰性,缺乏诱导骨生成潜能,导致钛基植入体与周边自然骨组织的整合性差,植入体容易松动并引发骨溶症。尤其对于患有骨质疏松症的老年患者,骨移植手术是一个巨大的挑战。Park和Oh等通过模拟自然骨的纳米结构,在钛材表面构建二氧化钛纳米管结构并证实具有良好的促成骨作用(Park,2009,Small&Oh,2009,ProceedingsoftheNationalAcademyofSciences)。二氧化钛纳米管因重复性好、简单易行且具有独特的纳米拓扑结构,可作为负载药物、生长因子等的载体在生物医学工程领域得到广泛应用。辛伐他汀作为他汀类药物已被广泛应用于临床领域,可有效降低血浆胆固醇水平,治疗心血管疾病。近年,研究表明辛伐他汀可促进骨形成和抑制骨吸收,成为临床常见的骨类病症治疗药物,并且有很大的开发潜力。目前,Jegal和Pullisaar等研究发现负载辛伐他汀的支架材料能促进成骨分化,进而提高骨整合性(Jegal,2016,MacromolecularResearch&Pullisaar,2009,Biochemical&BiophysicalResearchCommunications)。但是如何有效地控制辛伐他汀药物释放,避免浓度不适引起炎症反应,仍是一大挑战。层层自组装技术是基于聚阳离子和聚阴离子交替沉积制备聚电解质自组装多层膜的技术。壳聚糖和明胶因具有良好的生物相容性而分别作为多聚阳离子和多聚阴离子。随着多层膜结构的不断降解,所负载的药物释放,进而引起细胞生物学反应。技术实现要素:本发明的目的是要提供一种兼具促进骨形成和抑制骨吸收作用的二氧化钛纳米管及其制备方法,其利用二氧化钛纳米管的管状结构装载辛伐他汀,并在其表面构建多层膜,随着多层膜结构的物理降解控制二氧化钛纳米管中辛伐他汀药物释放性能。本发明的目的是这样实现的:利用阳极氧化法合成二氧化钛纳米管,进一步利用滴加法在二氧化钛纳米管里装载药物辛伐他汀,最后利用旋转涂布层层自组装技术在负载辛伐他汀的二氧化钛纳米管上构建壳聚糖/明胶多层膜。为达到上述目的,本发明提供如下技术方案:a、将钛材按照常规方法进行预处理;b、利用阳极氧化法在步骤a预处理后的钛材表面制备管径约30-100nm的二氧化钛纳米管;c、采用直接滴加法在步骤b制得的二氧化钛纳米管上负载辛伐他汀;d、利用旋转涂布层层自组装技术在步骤c制得的负载辛伐他汀的二氧化钛纳米管上构建壳聚糖/明胶多层膜。进一步,所述步骤a是将钛材剪切成(1-2)cm×(1-2)cm钛片,依次利用丙酮、无水乙醇和双蒸水超声清洗10-30min,置于37-40℃烘箱干燥备用。进一步,所述步骤b是以步骤a预处理后的钛片为阳极,铂片为阴极,以体积分数为50%的丙三醇溶液配制的0.27mol/L氟化铵溶液为电解质,在10-30V的恒定电压下电解1-3h,将氧化后的钛片超声清洗2-5min,干燥,最后放置于马弗炉中400-600℃条件下加热1-3h,制得管径为30-100nm的二氧化钛纳米管。进一步,所述步骤c是以体积分数为50%的乙醇溶液配制的10-15mmol/L辛伐他汀溶液。进一步,所述步骤d是以体积分数为0.3-0.5%的醋酸溶液配制5-10mg/mL的壳聚糖,常温搅拌并溶解;以三蒸水配制5-10mg/mL的明胶溶液,40-50℃水浴加热使其溶解;用旋转涂布法在负载辛伐他汀的二氧化钛纳米管表面构建壳聚糖/明胶多层膜,共6-10个循环,旋转速度为2000-4000rpm,每层旋转时间为20-40s。本发明的有益效果在于:本发明利用二氧化钛纳米管的管状结构装载辛伐他汀,并通过多层膜结构的物理降解控制辛伐他汀药物释放。实现药物缓释的目的。优点:该方法简单易行、周期短、成本较低,具有良好的应用前景。附图说明图1是扫描电子显微镜图像:未处理钛材(a),管径为70nm的二氧化钛纳米管(b),负载辛伐他汀的二氧化钛纳米管(c),负载辛伐他汀并被壳聚糖/明胶多层膜覆盖的二氧化钛纳米管(d)。图2是原子力显微镜图像:未处理钛材(a),管径为70nm的二氧化钛纳米管(b),负载辛伐他汀的二氧化钛纳米管(c),负载辛伐他汀并被壳聚糖/明胶多层膜覆盖的二氧化钛纳米管(d)。图3是接触角检测:除第0层的TiO2纳米管、第1层辛伐他汀外,奇数层为明胶,偶数层为壳聚糖(n=3)。图4是辛伐他汀分别从负载辛伐他汀的二氧化钛纳米管,负载辛伐他汀并被壳聚糖/明胶多层膜覆盖的二氧化钛纳米管中释放的曲线。图5是成骨细胞在经过不同处理的钛材表面的碱性磷酸酶含量,其中*表示两组间p<0.05,**表示两组间p<0.01。图6是破骨细胞在经过不同处理的钛材表面的酸性磷酸酶含量,其中*表示两组间p<0.05,**表示两组间p<0.01。具体实施方式实施例1.兼具促进骨形成和抑制骨吸收作用二氧化钛纳米管的制备a、将钛材剪切成1cm×1cm的钛片,依次利用丙酮、无水乙醇和双蒸水超声清洗20min,并于37℃烘箱中烘干备用;b、以步骤a所准备的钛片为阳极,铂片为阴极,以体积分数为50%的丙三醇溶液配制的0.27mol/L的氟化铵溶液为电解质,在15V的恒定电压下电解1h,将氧化后的钛片超声清洗2min,干燥,最后放置于马弗炉中400℃条件下加热2h,制得管径为70nm的二氧化钛纳米管;c、以体积分数为50%的乙醇溶液配制10mmol/L的辛伐他汀溶液,利用滴加法在步骤b所制得的1cm×1cm钛片表面的二氧化钛纳米管上滴加4μL辛伐他汀溶液;d、以体积分数为0.3%的醋酸溶液配制10mg/mL的壳聚糖,常温搅拌并溶解;以三蒸水配制10mg/mL的明胶溶液,50℃水浴加热使其溶解;用旋转涂布法在步骤c所制得的负载辛伐他汀的二氧化钛纳米管表面构建壳聚糖/明胶多层膜,共6个循环,旋转速度为3000rpm,每层旋转时间为30s。实施例2.兼具促进骨形成和抑制骨吸收作用二氧化钛纳米管的制备a、将钛材剪切成1cm×1cm的钛片,依次利用丙酮、无水乙醇和双蒸水超声清洗20min,并于37℃烘箱中烘干备用;b、以步骤a所准备的钛片为阳极,铂片为阴极,以体积分数为50%的丙三醇溶液配制的0.27mol/L的氟化铵溶液为电解质,在20V的恒定电压下电解1h,将氧化后的钛片超声清洗2min,干燥,最后放置于马弗炉中400℃条件下加热2h,制得管径为70nm的二氧化钛纳米管;c、以体积分数为50%的乙醇溶液配制10mmol/L的辛伐他汀溶液,利用滴加法在步骤b所制得的1cm×1cm钛片表面的二氧化钛纳米管上滴加4μL辛伐他汀溶液;d、以体积分数为0.3%的醋酸溶液配制10mg/mL的壳聚糖,常温搅拌并溶解;以三蒸水配制10mg/mL的明胶溶液,50℃水浴加热使其溶解;用旋转涂布法在步骤c所制得的负载辛伐他汀的二氧化钛纳米管表面构建壳聚糖/明胶多层膜,共6个循环,旋转速度为3000rpm,每层旋转时间为30s。结果如表1所示,对其表面化学元素进行XPS分析,C元素的逐步提高,Ti元素的消失,说明已成功将负载辛伐他汀并覆盖壳聚糖/明胶多层膜在二氧化钛纳米管表面。表1、各组样品表面化学元素组成(按质量百分含量计算)底物C%O%N%Ti%二氧化钛纳米管16.5058.75024.75负载辛伐他汀的二氧化钛纳米管19.4856.11024.40负载辛伐他汀并被壳聚糖/明胶多层膜覆盖的二氧化钛纳米管64.7021.9213.380由图1结果可见,经过阳极氧化在钛材表面形成了直径为70nm的二氧化钛纳米管,通过直接滴加法负载辛伐他汀后,表面纳米管结构仍清晰可见,表明药物已进入纳米管,最后通过旋转涂布壳聚糖/明胶多层膜后,纳米管状结构被完全覆盖。由图2结果可见,负载辛伐他汀后,表面仍可观察到山谷样结构,这与二氧化钛纳米管结构相关。相反,多层膜覆盖后在表面变得较平整。由图3结果可见,二氧化钛纳米管接触角为小于15°,说明其具有很强的亲水性。当负载辛伐他汀药物后,接触角升高至大于40°小于50°。第二层壳聚糖沉积后,接触角变为30-35°。从第七层开始,接触角在30°与45°的之间产生规律性的波动,说明从第六层开始在TiO2纳米管表面已经形成单层、全覆盖的壳聚糖和明胶层。由图4结果可见,为了证实壳聚糖/明胶多层膜可控制辛伐他汀缓慢释放,在不同时间点收集0.5mLPBS检测辛伐他汀活性,从未铺膜的二氧化钛纳米管中释放出的辛伐他汀,24h内释放很快,在48h基本达到最高值,24h到48h间释放速率有一定缓解,说明纳米管一定的缓释作用,但这种作用维持时间有限。经过壳聚糖/明胶多层膜修饰后,药物释放缓慢,直到120h达到最高。说明壳聚糖/明胶多层膜起到了控制辛伐他汀缓慢释放的作用。实施例3.兼具促进骨形成和抑制骨吸收作用二氧化钛纳米管的制备a、将钛材剪切成1cm×1cm的钛片,依次利用丙酮、无水乙醇和双蒸水超声清洗20min,并于37℃烘箱中烘干备用;b、以步骤a所准备的钛片为阳极,铂片为阴极,以体积分数为50%的丙三醇溶液配制的0.27mol/L的氟化铵溶液为电解质,在30V的恒定电压下电解1h,将氧化后的钛片超声清洗2min,干燥,最后放置于马弗炉中400℃条件下加热2h,制得管径为70nm的二氧化钛纳米管;c、以体积分数为50%的乙醇溶液配制10mmol/L的辛伐他汀溶液,利用滴加法在步骤b所制得的1cm×1cm钛片表面的二氧化钛纳米管上滴加4μL辛伐他汀溶液;d、以体积分数为0.3%的醋酸溶液配制10mg/mL的壳聚糖,常温搅拌并溶解;以三蒸水配制10mg/mL的明胶溶液,50℃水浴加热使其溶解;用旋转涂布法在步骤c所制得的负载辛伐他汀的二氧化钛纳米管表面构建壳聚糖/明胶多层膜,共6个循环,旋转速度为3000rpm,每层旋转时间为30s。实验例1.兼具促进骨形成和抑制骨吸收作用的二氧化钛纳米管对成骨细胞分化的促进能力取实施例2经过不同处理后得到的“二氧化钛纳米管”、“二氧化钛纳米管-辛伐他汀”和“二氧化钛纳米管-辛伐他汀-壳聚糖/明胶多层膜”材料以及未处理纯钛(简称为“钛材”),在不同材料表面接种新生大鼠头盖骨的成骨细胞,接种密度为1×104/cm2,用含体积分数为10%胎牛血清的高糖DMEM培养基进行培养,每隔2天进行换液。分别培养4天和7天后,用200μL1%的TritonX-100溶液收集细胞,2500转离心5min,利用试剂盒检测细胞上清液中的碱性磷酸酶和蛋白质含量,最后用酶标仪分别于波长520nm和562nm处测定吸光度。结果如图5所示,不论在第4天还是7天,与其他组相比,在负载辛伐他汀并被壳聚糖/明胶多层膜覆盖的二氧化钛纳米管上生长的成骨细胞表达最高的碱性磷酸酶含量(p<0.05或p<0.01),说明辛伐他汀的不断释放促进成骨细胞早期分化。实验例2.兼具促进骨形成和抑制骨吸收作用的二氧化钛纳米管对破骨细胞形成的抑制能力取实施例2经过不同处理后得到的“二氧化钛纳米管”、“二氧化钛纳米管-辛伐他汀”和“二氧化钛纳米管-辛伐他汀-壳聚糖/明胶多层膜”材料以及未处理纯钛(简称为“钛材”),在不同材料表面接种RAW264.7细胞,接种密度为6×104/cm2,用含有10%胎牛血清,20ng/mL巨噬细胞集落刺激因子(m-CSF)及50ng/mL重组核转录因子kappa-B的配体(RANKL)的条件培养基进行培养。每隔2天换液。培养7天后,用200μL1%的TritonX-100溶液收集细胞,2500转离心5min,利用试剂盒对上清液中的抗酒石酸酸性磷酸酶的活性进行检测。最后用酶标仪于波长405nm处测定吸光度。结果如图6所示,与未处理钛与二氧化碳纳米管组相比,在负载辛伐他汀的二氧化钛纳米管和负载辛伐他汀并被壳聚糖/明胶多层膜覆盖的二氧化钛纳米管上生长的破骨细胞表达较低的抗酒石酸酸性磷酸酶的活性(p<0.05或p<0.01),说明辛伐他汀的不断释放抑制破骨细胞形成。经过上述实验步骤,可以获得一种药物缓释系统,该系统利用二氧化钛纳米管的管状结构装载辛伐他汀,进而在其表面构建多层膜,随着多层膜结构的物理降解控制二氧化钛纳米管中辛伐他汀药物释放性能。此外,该系统能有效促进成骨分化,抑制破骨细胞形成。上述实施方案中需要注意的问题是:所有与细胞接触的实验用具和试剂都必须是无菌的。最后说明的是,以上实施例仅用于说明本发明的技术方案而非限制。尽管通过上述实施例已经对本发明做了较为详细的描述,但本领域技术人员仍可以根据
发明内容和实施例部分所描述的技术内容,在形式上和细节上对其作出各种各样的改变,而不偏离所附权利要求书所限定的本发明的精神和范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1