一种右兰索拉唑钠的缓释胶囊及其制备方法与流程
本发明属于药物制剂技术领域,具体涉及一种右兰索拉唑钠的缓释胶囊及其制备方法。
背景技术:
右兰索拉唑(Dexlansoprazole,R-(+)-Lansoprazole),化学名称是(R)-(+)-2-([3-甲基 -4-(2,2,2-三氟乙氧基)吡啶-2-基]甲基亚磺酰基)-1H-苯并咪唑,其结构式如下,
。
右兰索拉唑是日本武田制药公司研发的食管炎治疗新药,2009年1月30日经美国FDA批准上市。该药是质子泵抑制剂兰索拉唑的单对映体,用于治疗与非糜烂性胃食管反流病相关的胃灼热及不同程度糜烂性食道炎,比兰索拉唑具有更高的生物利用度和更少副作用。
右兰索拉唑属于拉唑类 PPIs 抗溃疡药,右兰索拉唑结构中存在亚磺酰基苯并咪唑的化学结构,理化性质极不稳定,易受光线、重金属离子、氧化性和还原性成分等多种因素的影响。尤其在酸性条件时,右兰索拉唑的化学结构可发生破坏性变化,出现变色和聚合现象,因而右兰索拉唑在偏酸性的稀释剂中不稳定,制成口服制剂后,药物吸收需经过药物崩解释放过程,且由于胃中胃酸导致右兰索拉唑破坏分解,而降低药物起效速度和生物利用度,如何使右兰索拉唑胶囊主要在胃酸中不被破坏甚至可以发挥药效,且如何保证在肠道环境下的控速释放是关键技术点之一。
目前避免活性成分在胃酸中释放的制剂技术大多采用在外层包一层肠溶衣的方式,武田制药的右兰索拉唑缓释胶囊(商品名DEXILANT),其中每粒胶囊中含有两种不同肠溶包衣的微丸1和微丸2。为避免活性成分在胃酸中释放及控制在肠道的两次释放,DEXILANT采用三种不同肠溶包衣材料,尤特奇L30D-55,尤特奇L100,尤特奇S100,这无疑增加了成本。此外还用到了乙醇作为包衣液溶剂,额外降低了生产安全性,这就要求生产车间及设备须具备防爆装置,不符合现代绿色环保要求,也容易产生乙醇溶剂超标等质量问题。
专利CN2001410367285.2涉及一种右旋兰索拉唑组合物,包括如下重量比的组分:右旋兰索拉唑0.5~2份,抗酸剂0.6份,抗氧化剂0.5份,崩解剂0.3份,未提及隔离层和肠溶层。
专利CN2013100457614,涉及右旋兰索拉唑的多层包衣体系肠溶制剂,所述制剂由药物层I和药物层II,肠溶包衣层IV和隔离层III组成,所述隔离层III置于药物层I或II和肠溶包衣层IV的中间,所述药物层I和药物层II分别有右旋兰索拉唑,填充剂,粘合剂,稳定剂和润滑剂组成,所述制剂从内到外依次为药物层I,隔离层III-1,肠溶包衣层IV-1,隔离层III-2,药物层II,隔离层III-3和肠溶包衣层IV-2。所述隔离层的聚合物为羧甲基纤维素钠,羟丙甲纤维素或羟丙纤维素,肠溶层聚合物为丙烯酸树脂,乙酸邻苯二甲酸纤维素,邻苯二甲酸羟丙基甲基纤维素,乙酸琥珀酸羟丙甲基纤维素等。
专利CN2012101077872公开了一种右旋兰索拉唑肠溶胶囊剂的制备方法,该方法采用常规的流化床底喷技术。首先采用底喷混悬液上药,依次包衣隔离上不同的肠溶层,最后按照一定比例混合灌装,该专利采用一般的肠溶微丸工艺,其存在一定弊端。右旋兰索拉唑在水中微融,在乙醇中可溶,将其配成溶液很容易凝结成稠状胶体,工艺可行性低,且右旋兰索拉唑本身不稳定,对湿热都很敏感,如果采用流化床底喷工艺,主药需要配置在水溶液中搅拌经流化床上入微丸上,工艺周期长,其他水溶液中长时间搅拌状态下稳定性降低。
热熔挤出技术(Hot-Melt Extrusion,HME)又称熔融挤出技术,是指应用单/双螺杆挤出设备,使物料经历固体输送、熔融、熔体输送三个阶段,在捏制器和螺杆元件的强力剪切作用下获得高度混合分散的成型产品。热熔挤出过程可以在一台设备上实现混合,造粒和成型制品,具有工序少、能耗低、成本低、产率高、连续化、可封闭式生产等优点。该技术在提高难溶性药物溶出度,制备缓释、定位释放制剂、掩味制剂以及局部给药制剂方面具有突破性的优势,以成为制剂技术药物传递系统中的一个新热点,难能可贵的是制备工艺易于实现工业化大生产。
经初步检索,现有技术中采用热熔挤出技术制备右兰索拉唑钠的缓释胶囊,尚未见文献报道。
技术实现要素:
针对现有技术的不足,对于现有右兰索拉唑稳定性差,对温度湿度敏感,应用于制剂工艺中操作难度大,生产成本高,其制剂产品稳定性不高等缺点,特别是一些不适用于热熔挤出工艺的缺陷,如热熔过程中药物降解明显等,本发明提供了一种右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A及其制备方法,该新晶型A的理化性质更好,熔点适宜,稳定性强,十分方便制成各类药物剂型,也方便适用热熔挤出工艺加工。
本发明的另一个目的在于提供该右兰索拉唑钠的新晶型A在制备治疗胃溃疡、十二指肠溃疡和反流性食管炎及根除幽门螺旋杆菌药物中的应用。
同时,针对右兰索拉唑钠的该新晶型A,本发明人还旨在提供一种顺应性好,质量稳定,能够适时小肠近端和远端发挥功效的,生物利用度更高的右兰索拉唑钠缓释胶囊,以便更好地服务于该病症的患者。
为了实现上述右兰索拉唑钠缓释胶囊的技术目标,本发明采用如下技术方案。
本发明提供了一种右兰索拉唑钠的缓释胶囊,该胶囊包含肠溶速释微丸A,肠溶缓释微丸B;其中,右兰索拉唑钠的新晶型A的化学结构是右兰索拉唑钠的二甲基乙酰胺溶剂合物,结构式如下所示,
;
肠溶速释微丸A是以右兰索拉唑钠的新晶型A为原料药,采用热熔挤出工艺制备速释丸芯A,再包覆肠溶包衣A即得,该肠溶衣在pH值大于等于5.5的条件下分解;
肠溶缓释微丸B是以右兰索拉唑钠的新晶型A为原料药,采用热熔挤出工艺制备缓释丸芯B,再包覆肠溶包衣B即得,该肠溶衣在pH值大于等于6.8的条件下分解。
优选地,微丸A中右兰索拉唑的含量:微丸B中右兰索拉唑的含量的比值为1:2.5~4.0,优选为1:3。
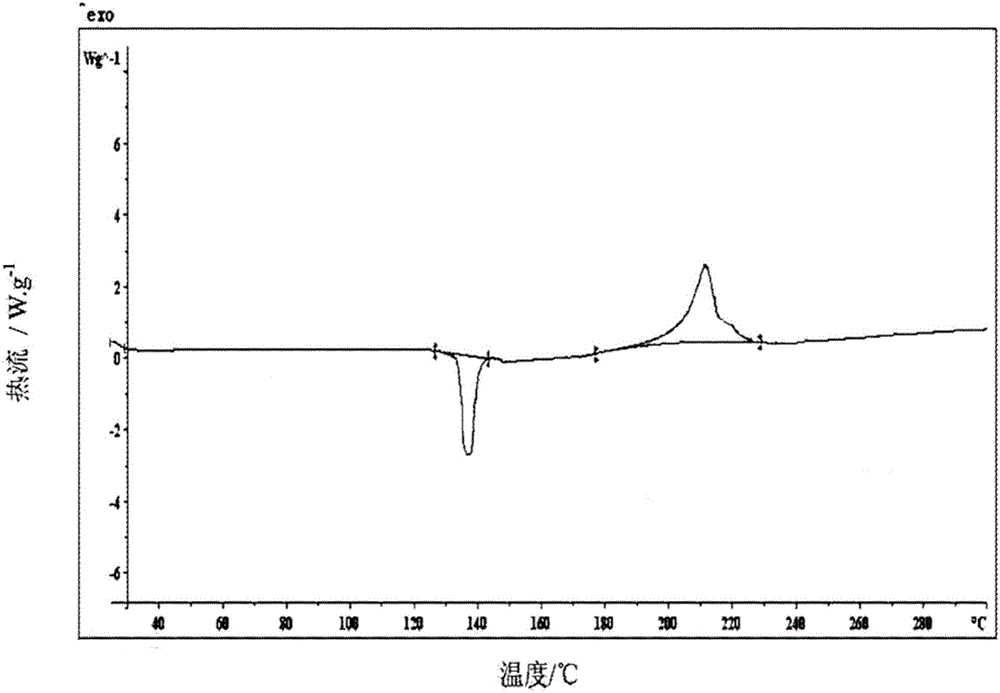
进一步优选地,所述新晶型A的粉末X射线衍射图谱在衍射角2θ为5.9,7.6,12.2,12.7,16.6,18.4,20.5,25.8,26.8,31.4度处有特征衍射峰,其中2θ值误差范围为±0.2,该图谱如说明书附图1所示;其DSC图谱在132.4±1℃有吸热特征峰,在204.6±1℃有放热特征峰,该图谱如说明书附图2所示。
进一步优选地,所述新晶型A的傅里叶变换红外光谱在波数为3383±2, 3134±2, 3072±2, 2975±2, 1646±2,1583±2, 1475±2, 1441±2, 1316±2,1265±2,1198±2,1168±2, 1111±2, 1036±2, 972±2, 915±2, 857±2,745±2,662±2 cm-1处有特征吸收峰,该图谱如说明书附图3所示;且上述右兰索拉唑钠的新晶型A的热重分析TG图谱如说明书附图4所示。
优选地,肠溶速释丸芯A的处方及质量份如下,
右兰索拉唑钠晶型A:10~20份;
碳酸镁:10~20份;
水溶性载体:40~80份,所述水溶性载体包括聚维酮类、聚丙烯酸树脂类、纤维素类,具体选自Plasdone K29,Plasdone K32,Kollidon VA64,Plasdone S630,Eudragit E100,Eudragit EPO,Klucel EF,Klucel ELF,泊洛沙姆188,PEG4000,PEG6000中的一种或几种;
增塑剂:2~10份,选自山梨醇,甘露醇,木糖醇,单硬脂酸甘油酯,山嵛酸甘油酯中的一种或几种;
稳定剂:10~20份,选自聚山梨酯80,Soluplus,月桂酸聚乙二醇甘油酯Gelucire 44/14,聚氧乙烯40氢化蓖麻油KolliphorRH40中的一种或几种;
抗老化剂:2~5份,选自氨丁三醇,丙三醇,没食子酸丙酯中的一种或几种;
崩解剂:0.2~1份,选自交联羧甲基纤维素钠,交联聚维酮,低取代羟丙纤维素,羧甲基淀粉钠中的一种或几种。
优选地,肠溶缓释丸芯B的处方及质量份如下,
右兰索拉唑钠晶型A:10~20份;
碳酸镁:10~20份;
肠溶性载体:40~80份,选自醋酸邻苯二甲酸纤维素,醋酸琥珀酸纤维素,邻苯二甲酸羟丙基甲基纤维素HPMCP,醋酸琥珀酸羟丙基甲基纤维素HPMCAS,醋酸马来酸羟丙基甲基纤维素,羧甲基乙基纤维素,尤特奇L100-55,尤特奇S100,尤特奇RL100,尤特奇RS100中的一种或几种;
增塑剂:2~10份,选自山梨醇,甘露醇,木糖醇,单硬脂酸甘油酯,山嵛酸甘油酯中的一种或几种;
稳定剂:10~20份,选自聚山梨酯80,Soluplus,月桂酸聚乙二醇甘油酯Gelucire 44/14,聚氧乙烯40氢化蓖麻油KolliphorRH40中的一种或几种;
抗老化剂2~5份,选自氨丁三醇,丙三醇,没食子酸丙酯中的一种或几种;
释放调节剂:0~1份,选自十二烷基硫酸钠,牛黄胆酸钠,黄原胶,卡波姆中的一种或几种。
优选地,肠溶包衣A或肠溶包衣B是采用如下质量份的组分构成均一溶液或混悬液,对上述速释丸芯A或缓释丸芯B进行包衣,包衣增重10~20%,
肠溶包衣材料:10份;
碱化剂:1~6份;
抗黏剂:0.5~1份;
增塑剂:1~3份;
水:适量;
其中,肠溶包衣材料选自Kollicoat MAE100P,Kollicoat MAE30DP,雅克宜,尤特奇L100-55,尤特奇S100,尤特奇L100,尤特奇L30D-55,尤特奇S12.5,尤特奇FS30D中的一种或几种;
碱化剂选自碳酸钠,碳酸镁,碳酸氢钠,精氨酸,赖氨酸,组氨酸中的一种或几种;
抗黏剂选自硬脂酸镁,滑石粉或微粉硅胶中的一种或几种;
增塑剂选自邻苯二甲酸二乙酯,邻苯二甲酚二丁酯,柠檬酸三乙酯,柠檬酸三丁酯,丙二醇,聚乙二醇4000,聚乙二醇6000中的一种或几种。
进一步优选地,肠溶速释微丸A的包衣处方及质量份如下,
Kollicoat MAE100P :20份;
精氨酸:11~12份;
滑石粉:5份;
柠檬酸三乙酯:3份;
水:适量;
包衣增重10~20%;
并且,肠溶缓释微丸B的包衣处方及质量份如下,
Kollicoat MAE100P :20份;
精氨酸:3~4份;
滑石粉:5份;
聚乙二醇4000:4份;
水:适量;
包衣增重10~20%。
优选地,本发明提供的缓释胶囊在中国药典的释放度实验中具有如下释放特性:
该胶囊在0.1mol/l盐酸中2h的释放量为标示量的0.2~0.4%;该胶囊在pH6.8的磷酸盐缓冲液中1h的释放量为标示量的20~25%;该胶囊在pH为7.0 的磷酸盐缓冲液中,1h释放量为标示量的25~30%,2h的释放量为35~40%,3h的释放量为85~90% ,4h的释放量为98.5~100%。
本发明还提供了一种制备上述任一种缓释胶囊的方法,包含如下步骤:
1)肠溶速释微丸A的制备:将右兰索拉唑新晶型A,水溶性载体,增塑剂,稳定剂,抗老化剂,崩解剂,混合均匀后加入到双螺杆挤出机的加料斗中,设定加料速度为2kg/h,转速为200rpm,设定熔融挤出温度为80~120℃,待挤出10min后开始收集物料,通过末端的切刀切割成直径为0.3~0.8mm的小丸备用;将肠溶包衣液A中的各组分混合均匀,利用流化床包衣机在下述条件下包衣,进口温度45℃,包衣溶液喷雾速率3.8g/分钟,喷雾压力1.0kg/㎝2,干燥得到肠溶速释微丸A;
2)肠溶缓释微丸B的制备:将右兰索拉唑钠新晶型A,肠溶性载体,增塑剂,稳定剂,抗老化剂,释放调节剂,混合均匀后加入到双螺杆挤出机的加料斗中,设定加料速度为2kg/h,转速为200rpm,设定熔融挤出温度为80~120℃,待挤出10min后开始收集物料,通过末端的切刀切割成直径为0.3~0.8mm的小丸备用;将肠溶包衣液B中的各组分混合均匀,利用流化床包衣机在下述条件下包衣,进口温度45℃,包衣溶液喷雾速率3.8g/分钟,喷雾压力1.0kg/㎝2,干燥得到肠溶缓释微丸B;
3)按照微丸A中右兰素拉唑含量:微丸B中右兰素拉唑含量的比例为1:3,各自称取适当重量的肠溶速释微丸A和肠溶缓释微丸B,混合均匀后装入明胶胶囊中。
通过本发明人的深入探究,发现本发明的缓释胶囊中,速释微丸A和缓释微丸B其中包含的主药成分是采用右兰素拉唑钠新晶型A为原料药制备的,经过热熔挤出工艺后,最终状态可以是无定形态,可以是微晶态,也可以是两者的混合物,可能与熔融挤出温度和其他技术指标有关。如果是微晶状态或是混有微晶态,则保持原有的晶型特征,即在粉末X射线衍射图谱在衍射角2θ为5.9,7.6,12.2,12.7,16.6,18.4,20.5,25.8,26.8,31.4度处有特征衍射峰。
本发明取得了以下有益的技术效果:
(1)本发明提供的右兰索拉唑钠新晶型A的氧化杂质含量显著降低,并且随着贮存时间延长,杂质变化很小,具有优良的流动性和显著改善的溶出度,利用新晶型A制成的右兰索拉唑钠的缓释胶囊的稳定性好,杂质含量低。
(2)因右兰索拉唑易在胃酸中降解,因此国内目前上市的兰索拉唑制剂主要为肠溶制剂。本发明提供的缓释胶囊按照约1:3的配方比例包含不同的速释和缓释微丸,可在不同pH值的释放介质中释药速度稳定,保证了右兰索拉唑双相肠溶胶囊在胃环境中基本不释放,从而降低活性成分在胃内的降解和药物快速释放引起的副作用,使其主要在肠道中缓慢释放,增加了生物利用度。
(3)本发明的速释微丸A和缓释微丸B的处方中都含有碳酸镁,而不是碳酸氢钠,是由于本发明人经过反复试验发现,碳酸镁的使用维持了主药在固体分散体中的碱性环境,保持主药的理化性质稳定,同时可使得在固体分散体表面直接包覆肠溶包衣成为可能,避免使用隔离层,简化操作工序。本发明含有两种不同类型的具有定位释放功能的微丸,肠溶速释微丸A在小肠近端 开始脱去包衣层,通过水溶性固体分散体快速释放出药物;肠溶缓释微丸B在小肠远端开始脱去包衣层,通过肠溶性固体分散体缓慢释放药物,能够维持平稳持续的血药浓度,保证治疗效果,同时避免了频繁给药。
(4)本发明中两种微丸的丸芯采用热熔挤出技术完成,技术先进,工艺简单,不使用有机溶剂,安全无污染,混合无死角,分散效果好,药物损失少,集多种单元操作于一体,节省空间和降低成本,适于工业化大生产。
(5)目前避免活性成分在胃酸中释放的制剂技术大多采用在外层包一层肠溶衣的方法,而由于肠溶衣材料一般为酸性的高分子材料,其弱酸性会对右兰索拉唑的稳定性产生不利影响,因此需要在肠溶衣于活性成分之间包覆一层隔离衣,从而避免肠溶材料与右兰索拉唑的接触,提高制剂的稳定性。武田制药生产的右兰索拉唑缓释胶囊,商品名DEXILANT,其中每粒胶囊中含有肠溶微丸1和肠溶微丸2,肠溶微丸1采用尤特奇L30D-55水分散体包衣,肠溶微丸2采用尤特奇S100和尤特奇L100的乙醇溶液包衣制得。为避免活性成分在胃酸中释放即控制活性成分在体内的两次释放,DEXILANT采用三种不同肠溶材料,这无疑增加了生产成本,是生产操作更加复杂。另外,由于采用乙醇作为肠溶微丸2的包衣溶剂,额外降低了生产安全性,生产车间及设备均须具备防爆装置,间接增加生产成本,也不符合现代绿色环保的要求。中国药典规定生产中采用乙醇的制剂,需要控制乙醇残留量不高于0.5%,经检测,武田公司60mg规格的缓释胶囊中乙醇残留量大于中国药典规定(0.5%)。
对比之下,本发明含有两种不同类型的肠溶微丸,相对于上市产品DEXILANT采用三种肠溶包衣材料,本发明中的肠溶层均采用巴斯夫辅料的Kollicoat MAE100P,通过在配置包衣液过程中加入不同量的精氨酸,中和聚合物中不同摩尔数的羧基,控制肠溶材料在不同的pH下溶解,从而实现了两次式样的双重控释效果,降低了生产成本,简化了生产工艺。由于本发明采用水溶液包衣,极大提高了生产的安全性,降低了对环境的污染,有效避免了乙醇残留问题。
(6)本发明的缓释胶囊可实现在胃肠道分布均匀,不易产生突释,稳定性好,方便分割剂量,加水冲服,吸收好,起效快,生物利用度好,口感好,能提高病人的顺应性,制备方法简单,适于工业化生产和应用。
附图说明
图1是右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A的粉末X射线衍射PXRD图谱。
图2是右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A的DSC图谱。
图3是右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A的红外图谱。
图4是右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A的TG图谱。
具体实施方式
以下将通过实施例形式的具体实施方式,对本发明的上述内容进一步的详细说明,但不应该将此理解为本发明上述主体的范围仅局限于以下实施例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
实施例1 本发明的右兰索拉唑钠二甲基乙酰胺的新晶型A的制备
本发明提供的一种右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A,每摩尔的该新晶型A中包含1摩尔的二甲基乙酰胺溶剂分子,结构式如下,
。
本发明所述右兰索拉唑钠的新晶型A,粉末X射线衍射图谱在衍射角2θ为5.9,7.6,12.2,12.7,16.6,18.4,20.5,25.8,26.8,31.4度处有特征衍射峰,其中2θ值误差范围为±0.2,该图谱如说明书附图1所示。
本发明所述右兰索拉唑钠的新晶型A,其DSC图谱在132.4±1℃有吸热特征峰,在204.6±1℃有放热特征峰,该图谱如说明书附图2所示。
本发明所述右兰索拉唑钠的新晶型A,其傅里叶变换红外光谱在波数为3383±2, 3134±2, 3072±2, 2975±2,1646±2,1583±2, 1475±2, 1441±2, 1316±2, 1265±2, 1198±2,1168±2, 1111±2, 1036±2, 972±2, 915±2, 857±2,745±2, 662±2 cm-1处有特征吸收峰,该图谱如说明书附图3所示;并且上述右兰索拉唑钠的新晶型A的热重分析TG图谱如说明书附图4所示。
制备方法:将右兰索拉唑钠50g加入二甲基乙酰胺200mL和纯化水100mL的混合溶剂中,加入0.1g共聚维酮S630,以及0.1g没食子酸丙酯,在35~40℃下搅拌溶解,在施加超声波作用的条件下,超声波作用频率为20~50KHz,功率为50~100W,向上述溶液中缓慢的滴加甲基叔丁基醚900mL,维持降温速率是0.3~1℃/min的条件下,降温至0~5℃,继续搅拌1-3h,将所形成的悬浮液抽滤压干,在温度35~45℃和真空度0~0.1Mpa的条件下干燥,得到右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A约57g,收率93%。
本发明所述的右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A的主粒度为90μm左右,使得晶体粒度适中,流动性好,不易聚集和降解,方便制剂过程中的操作。
实施例2 对比晶型1的制备
参照PCT专利WO2012095859A1中说明书第15页Example5进行制备。右兰索拉唑25g溶于无水乙醇250mL中,加入32.5g异辛酸钠,搅拌反应30min,减压除去溶剂,在剩余物中加入250mL 正庚烷,室温搅拌3h,过滤,干燥,获得对比晶型1约18.5g。
实施例3 对比晶型2的制备
参照PCT专利WO2012095859A1中说明书第16页Example8进行制备。
右兰素拉唑10g溶于无水乙醇100mL和水5mL的混合溶剂中,降温至-5℃,加入2.2g氢氧化钠,-5℃搅拌30min,向反应液中再加入80mL正庚烷,继续搅拌30min,收集固体,干燥,获得对比晶型2约6g。
实施例4 右兰索拉唑钠二甲基乙酰胺溶剂化物的新晶型A的稳定性评价
将制得的对比晶型1和对比晶型2,与本发明的右兰索拉唑钠新晶型A开展影响因素试验、加速稳定性试验,试验方法参见中国药典附录中原料药与药物制剂稳定性试验指导原则。
(一)、影响因素试验:
1)高温试验:取对比晶型1和对比晶型2,与本发明的右兰索拉唑钠新晶型A,于60℃温度下放置10天,于第5天和第10天取样,测定各项指标与0天样品进行比较,试验结果见表。
2)高湿试验:取原对比晶型1和对比晶型2,与本发明的右兰索拉唑钠新晶型A,于RH75%下放置10天,于第5天和第10天取样,测定各项指标与0天样品进行比较,试验结果见表。
3)强光照射试验:取对比晶型1和对比晶型2,与本发明的右兰索拉唑钠新晶型A,于照度为(4500±500)lx的条件下放置10天,于第5天和第10天取样,测定各项指标与0天样品进行比较,试验结果见下表。
(二)加速稳定性试验:
将对比晶型1和对比晶型2,与本发明的右兰索拉唑钠新晶型A在恒温恒湿箱中进行6个月的加速稳定性试验。试验条件是:40℃/75%相对湿度(RH),分别于0、1、2、3、6个月取样,进行纯度和杂质检验(高效液相色谱法),结果见下表。
由上可知,右兰索拉唑钠新晶型A的稳定性强于现有技术中的对比晶型1和晶型2。尤其在高温、高湿和光照条件下,右兰索拉唑钠新晶型A的稳定性有了较明显的提高。
实施例5 吸湿性试验
将对比晶型1和对比晶型2,与本发明的右兰索拉唑钠新晶型A置于动态蒸汽吸附仪中,温度40℃以下,记录3小时内质量变化小于0.01g时的重量。
实施例6 不同晶型应用于热熔挤出工艺的适用性考察
本发明人称取等重量的对比晶型1(有关物质为0.11%),对比晶型2(有关物质为0.12%),新晶型A(有关物质为0.10%),选取水溶性载体材料PEG6000和肠溶性载体材料醋酸琥珀酸羟丙基甲基纤维素HPMCAS为代表,以山嵛酸甘油酯为增塑剂,均按照如下重量份的处方进行热熔挤出制备固体分散体颗粒:原料药1份,载体材料10份,山嵛酸甘油酯2份。结果如下。
实施例7 速释微丸A的制备
处方如下,
右兰索拉唑钠新晶型A:8g;
碳酸镁:10g;
Plasdone S630:24g;
Klucel EF:8g;
山嵛酸甘油酯:4g;
Soluplus:8g;
氨丁三醇:3g;
交联聚维酮:0.8g;
肠溶衣液A的处方如下,
Kollicoat MAE100P :20份;
精氨酸 11~12份;
滑石粉:5份;
柠檬酸三乙酯:3份;
水:适量;
包衣增重10%;
微丸制备如下,
将右兰索拉唑新晶型A,碳酸镁,Plasdone S630,Klucel EF,山嵛酸甘油酯,Soluplus,氨丁三醇,交联聚维酮,混合均匀后加入到双螺杆挤出机的加料斗中,设定加料速度为2kg/h,转速为200rpm,设定熔融挤出温度为80~90℃,待挤出10min后开始收集物料,通过末端的切刀切割成直径为0.5~0.7mm的小丸备用;将肠溶包衣液A中的各组分混合均匀,利用流化床包衣机在下述条件下包衣,进口温度45℃,包衣溶液喷雾速率3.8g/分钟,喷雾压力1.0kg/㎝2,干燥得到肠溶速释微丸A。
实施例8 缓释微丸B的制备
右兰索拉唑钠新晶型A:20g;
碳酸镁:25g;
HPMCAS:60g;
尤特奇RS100:20g;
山嵛酸甘油酯:5g;
月桂酸聚乙二醇甘油酯Gelucire 44/14:15g;
没食子酸丙酯:5g;
卡波姆:1g;
肠溶衣B的处方如下,
Kollicoat MAE100P :20份;
精氨酸:3~4份;
滑石粉:5份;
聚乙二醇4000:4份;
水:适量;
包衣增重15%;
微丸制备如下,
将右兰索拉唑钠新晶型A,碳酸镁,HPMCAS,尤特奇RS100,山嵛酸甘油酯,月桂酸聚乙二醇甘油酯Gelucire 44/14,没食子酸丙酯,卡波姆混合均匀后加入到双螺杆挤出机的加料斗中,设定加料速度为2kg/h,转速为200rpm,设定熔融挤出温度为85~95℃,待挤出10min后开始收集物料,通过末端的切刀切割成直径为0.5~0.7mm的小丸备用;将肠溶包衣液B中的各组分混合均匀,利用流化床包衣机在下述条件下包衣,进口温度45℃,包衣溶液喷雾速率3.8g/分钟,喷雾压力1.0kg/㎝2,干燥得到肠溶缓释微丸B。
实施例9 速释微丸A的制备
丸芯A处方如下,
右兰索拉唑钠新晶型A:8g;
碳酸镁:11g;
Kollidon VA64:25g;
PEG6000:9g;
山嵛酸甘油酯:5g;
聚山梨酯80:8g;
氨丁三醇:3g;
交联羧甲基纤维素钠:0.5g;
肠溶衣液A的处方如下,
Kollicoat MAE100P:20份;
精氨酸:11~12份;
滑石粉:5份;
柠檬酸三乙酯:3份;
水:适量;
包衣增重10%;
微丸制备如下,
将右兰索拉唑新晶型A,碳酸镁,Kollidon VA64,Klucel EF,PEG6000,山嵛酸甘油酯,氨丁三醇,交联羧甲基纤维素钠,混合均匀后加入到双螺杆挤出机的加料斗中,设定加料速度为2kg/h,转速为200rpm,设定熔融挤出温度为80~90℃,待挤出10min后开始收集物料,通过末端的切刀切割成直径为0.5~0.7mm的小丸备用;将肠溶包衣液A中的各组分混合均匀,利用流化床包衣机在下述条件下包衣,进口温度45℃,包衣溶液喷雾速率3.8g/分钟,喷雾压力1.0kg/㎝2,干燥得到肠溶速释微丸A。
实施例10 缓释微丸B的制备
右兰索拉唑钠新晶型A:20g;
碳酸镁:30g;
HPMCP:65g;
尤特奇S100:25g;
单硬脂酸甘油酯:5g;
聚氧乙烯40氢化蓖麻油KolliphorRH40:17g;
丙三醇:6g;
牛磺胆酸钠:1.5g;
肠溶衣B的处方如下,
Kollicoat MAE100P :20份;
精氨酸:3~4份;
滑石粉:5份;
聚乙二醇4000:4份;
水:适量;
包衣增重15%;
微丸制备如下,
将右兰索拉唑钠新晶型A,碳酸镁,HPMCP,尤特奇S100,单硬脂酸甘油酯,聚氧乙烯40氢化蓖麻油KolliphorRH40,丙三醇,牛磺胆酸钠混合均匀后加入到双螺杆挤出机的加料斗中,设定加料速度为2kg/h,转速为200rpm,设定熔融挤出温度为85~95℃,待挤出10min后开始收集物料,通过末端的切刀切割成直径为0.5~0.7mm的小丸备用;将肠溶包衣液B中的各组分混合均匀,利用流化床包衣机在下述条件下包衣,进口温度45℃,包衣溶液喷雾速率3.8g/分钟,喷雾压力1.0kg/㎝2,干燥得到肠溶缓释微丸B。
实施例11 本发明缓释胶囊的制备,以1000粒计算,规格30mg
肠溶速释微丸A按照实施例7进行制备,肠溶缓释微丸B按照实施例8进行制备,在此不再赘述。
称取适当重量的肠溶速释微丸A,使其中右兰索拉唑的重量为7.5g,接着称取适当重量的肠溶缓释微丸B,使其中右兰索拉唑的重量为22.5g,也就是使得微丸A中右兰索拉唑重量:微丸B中右兰索拉唑重量的比例为1:3,混合均匀,装入明胶胶囊中。
实施例12 本发明缓释胶囊的制备,以1000粒计算,规格60mg
肠溶速释微丸A按照实施例7进行制备,肠溶缓释微丸B按照实施例8进行制备,在此不再赘述。
称取适当重量的肠溶速释微丸A,使其中右兰索拉唑的重量为15g,接着称取适当重量的肠溶缓释微丸B,使其中右兰索拉唑的重量为45g也就是使得微丸A中右兰索拉唑重量:微丸B中右兰索拉唑重量的比例为1:3,混合均匀,装入明胶胶囊中。
实施例13 本发明缓释胶囊的制备,以1000粒计算,规格30mg
肠溶速释微丸A按照实施例9进行制备,肠溶缓释微丸B按照实施例10进行制备,在此不再赘述。
称取适当重量的肠溶速释微丸A,使其中右兰索拉唑的重量为7.5g,接着称取适当重量的肠溶缓释微丸B,使其中右兰索拉唑的重量为12.5g,也就是使得微丸A中右兰索拉唑重量:微丸B中右兰索拉唑重量的比例为1:3,混合均匀,装入明胶胶囊中。
实施例14 三种不同工艺制备的微丸在pH6.8~7.0环境下的释放度试验
1)微丸制备
本发明人尝试称取同样重量份的右兰索拉唑钠新晶型A和碳酸镁,分别采用不同的工艺制备了三种微丸,微丸大小控制在550~600um。一种是按照本发明实施例7中速释丸芯A的制法,一种是按照本发明实施例8中缓释丸芯B的制法,一种是按照现有技术中最常用的制法,即将主药,碳酸镁,蔗糖,低取代羟丙基纤维素混合均匀得固体撒粉,羟丙基甲基纤维素分散于水中得到3%粘合剂溶液,将空白微晶纤维素丸芯(28~32目)填入离心式包衣造粒机中,进行喷雾操作,所得微丸颗粒在40℃烘箱干燥12h,再将所得载药丸用欧巴代包衣液进行包隔离层。上述三种微丸再包覆相同的肠溶衣膜。原则是考察不同制法所得微丸的溶出速率,其他因素尽量保持一致。
2)溶出度测定
按照中国药典的溶出度方法进行考察,以pH6.8磷酸盐缓冲液900mL为溶出介质,温度为37℃,转速为75转每分钟,每个待测样品中的药物量为30mg,采用紫外分光光度法分别于各个时间点取样进行溶出度的测定,结果见下表。
实施例15 本发明缓释胶囊的稳定性数据
以市售的右兰索拉唑缓释胶囊为对照组,考察自制胶囊的稳定性,如下所示。
由上述稳定性数据可知,实施例11至13的样品经过加速6个月有关物质,异构体略有增加,其他各指标无明显变化,长期12个月各指标变化不明显,而对照组经加速6个月有关物质增加较明显,长期12个月有关物质也有所增加。说明本发明实施例的稳定性得有提高和优化了。
实施例16 溶出度对比试验
将本发明实施例11至13这三个样品与市售右兰索拉唑肠溶胶囊进行溶出度的对比试验。试验条件为先在0.1mol/l盐酸释放2h,然后在含有5mmol/L的SLS的pH7.0的缓冲盐释放4h,每隔1h取样监测,汇总数据如下。
从以上结果可见,自制样品与市售对照品的释放度一致,耐酸性良好,在pH7.0环境中能实现双重释放效果,且制备工艺避免了使用乙醇溶剂,完全不含乙醇残留溶剂,环保安全性强。
实施例17 右兰索拉唑钠肠溶胶囊在大鼠体内的药代动力学
试验方法:取SD大鼠12只,体重约200±10克,雄性,随机等分为两组,以市售的右兰索拉唑缓释胶囊为对照片组,考察本发明自制组(以实施例11为例)的药代特征,规格同为30mg。右兰索拉唑给药剂量为6mg每公斤,给药后于1h、2h、4h、6h、7h、8h,10h,24h取样,经HPLC法检测,记录数据,计算药代动力学参数。
试验结果:大鼠分别口服对照胶囊和自制胶囊后,相关药代动力学参数如下表所示。
在相同规格条件下,与上市右兰索拉唑肠溶缓释胶囊相比,本发明组的达峰时间有所延长,AUC面积增大,峰值浓度提高,消除速率放缓,这表明本发明缓释胶囊组的作用时间较长,生物利用度较高,具有较明显的临床优势。
- 还没有人留言评论。精彩留言会获得点赞!