利用光学形状感测反馈对血管内部署设备的机器人控制的制作方法
本发明总体上涉及微创血管内介入流程,包括腹主动脉瘤(“aaa”)的血管内动脉瘤修复(“evar”)和开窗式evar(“fevar”)。本发明具体涉及血管内介入流程的机器人控制,包括机器人控制腹主动脉内的血管内支架移植物(“腔内移植物”)的evar/fevar部署,以阻止沿着aaa的壁的血流。
背景技术:
主动脉是身体的主要动脉,其携带富氧的血液从心脏通过身体。腹主动脉瘤(“aaa”)是在身体的腹部区域内的主动脉的损坏节段的隆起/膨胀,其中,主动脉可能破裂并引起腹部内的过度内出血,其会迅速导致死亡。
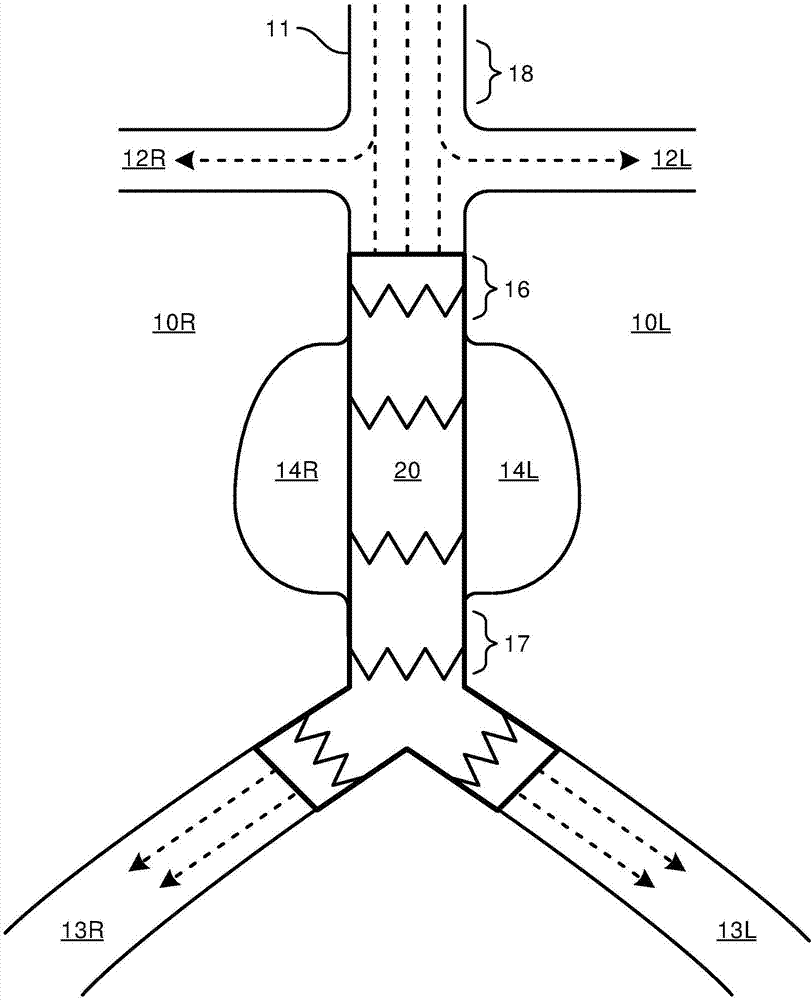
例如,图1a-图1c图示了腹部10r、10l内的主动脉11,包括从腹主动脉11分支的右肾动脉12r、左肾动脉12l、右髂动脉13r和左髂动脉13l。在腹主动脉11内的动脉分支12与13之间示出的是可能由包括高血压,动脉粥状硬化和老化在内的各种因素引起的动脉瘤14r、14l。如通过虚线箭头标示的通过主动脉11到主动脉分支12和13的典型血流,使动脉瘤14的壁受到应力,这可能引起主动脉11膨胀,最终导致破裂,这能够导致腹部10内的过度内出血,其会迅速导致死亡。
已经提出了修复aaa的各种流程,其中,血管内动脉瘤修复(“evar”)和开窗式evar(“fevar”是当前用于修复aaa的最常用技术。evar/fevar流程通常在x射线荧光透视引导下执行,并使用大量的造影剂和辐射来对在腹主动脉内血管内的支架移植物(“腔内移植物”)进行正确的定位和定向,从而部署腔内移植物以控制通过aaa的血液的流量。
例如,图1b图示了在x射线荧光透视引导下在腹主动脉11中部署的腔内移植物20,以维持到主动脉分支12和13的连续的血流,同时减少沿着动脉瘤14的壁的压力。
通过进一步的范例,图1c图示了具有分支移植物22的开窗式腔内移植物21,其在x射线荧光透视引导下在腹主动脉11中部署,以维持到主动脉分支12和13的连续的血流,同时阻止血液沿着动脉瘤14的壁流走。
存在与evar/fevar流程相关联的各种并发症。
首先,在evar/fevar流程期间平均使用50-100ml的造影剂,其在~7%的病例中可能导致急性肾衰竭。
其次,来自evar/fevar流程的最常见的并发症是由腔内移植物到腹主动脉的不充分密封而引起的内漏,其中,内漏涉及腔内移植物附近的血液不正确地流入动脉瘤。
例如,参考图1b,在腔内移植物20到主动脉11的不充分密封附近的血流可能导致在近端附接部位16处和/或在远端附接部位17处的内漏。内漏还可能源于通过腔内移植物20的壁进入动脉瘤14的血流或侧分支的逆行血流。
类似地,例如,参考图1c,在腔内移植物21到主动脉11的不充分密封附近的血流的情况下,可能在近端附接部位16处和/或在远端附接部位17处和/或在近端附接部位18处发生内漏。内漏还可能源于通过腔内移植物21的壁进入动脉瘤14的血流或来自主动脉分支的逆行血流。
第三,关于evar/fevar流程的另一并发症涉及主动脉侧分支(包括结肠动脉、肾动脉和盆腔动脉)的缺血。这可能由于以下原因而发生:腔内移植物的错误放置使得腔内移植物部分地或完全地覆盖侧分支中的一个。
例如,参考图1b,附接部位18处的腔内移植物20的附接将覆盖肾动脉12,这可能造成肾动脉堵塞。
更具体地,关于针对evar/fevar流程的x射线荧光透视引导,腔内移植物被包含在部署系统内,所述部署系统用于将腔内移植物导航到用于在主动脉内部署的位置和/或取向。这样的部署系统倾向于是相对较大且较硬的血管内设备。它们通常涉及在设备的近端处的手柄或一组旋钮和拨盘,以控制在设备的远端处的支架部署周围的各种步骤。具体地,腔内移植物位于设备的远端部分内,并且只有在设备被导航到主动脉内的适当位置和/或取向时才被释放。在一些情况下,腔内移植物在一个步骤中完全部署,而在其他情况下,腔内移植物能够被部分地部署以允许在最终部署步骤之前校正定位和/或取向,所述最终部署步骤通过保持/密封环将腔内移植物牢固地附接到脉管系统。
腔内移植物要求足够量的健康脉管系统,其中,保持/密封环能够被适当地附接到脉管系统。如果健康的近端附接部位在肾动脉下方可用,则腔内移植物将不覆盖肾动脉,并且可以经由对部署设备进行正确的定位和/或定向而附接到肾动脉之下的脉管系统。
例如,参考图1b,经由x射线荧光透视引导而手动地操作部署设备,以将腔内移植物20导航到肾动脉12之下的健康附接部位16,其中,肾动脉12不被在所示出的腔内移植物20到主动脉11的附接之上的腔内移植物20覆盖或阻挡。
相反,如果健康的近端附接位点在肾动脉下方不可用,则备选方法是必须维持到那些动脉的血流。一种方法是使用开窗式腔内移植物。在这种情况下,开窗式腔内移植物的开窗必须与肾动脉正确排列,并且在肾动脉内放置额外的支架以将肾动脉连接到主腔内移植物。
例如,参考图1c,经由x射线荧光透视引导而手动地适当操作部署设备,以将主腔内移植物21导航到肾动脉12之上的健康附接部位18,并将主腔内移植物21的开窗与肾动脉12对齐,其中,额外的腔内移植物22r、22l被放置在肾动脉12内。
在x射线荧光透视引导下,通过x射线可见标记物来对腔内移植物进行可视化,所述x射线可见标记物被定位在腔内移植物的关键位置中,包括(一个或多个)保持/密封环和开窗(如果有的话)。尽管如此,在x射线荧光透视引导下手动操作部署设备有几个缺点,包括:实现腔内移植物的精确定位和定向的固有的困难程度、在部署期间腔内移植物的实际的不稳定程度(尤其是对于主动脉侧分支的延伸和插管),以及缺乏对腔内移植物和x射线设备的c型臂的直观的同时控制。
技术实现要素:
本领域已知的血管内手术通常是微创介入,其涉及通过主要血管进入包括心脏和所有血管的心血管系统的目标区。血管内手术的范例包括但不限于evar、fevar、冠状动脉支架植入术、外周血管球囊和支架植入术、二尖瓣置换术、二尖瓣夹合放置术、主动脉瓣置换术、左心耳闭合术、瓣周漏闭合术等。
本发明提出了一种用于对处置设备在心血管系统内的导航的光学形状感测与机器人控制的新颖且独特的集成方案,更具体而言,一种用于在evar或fevar期间对腔内移植物在腹主动脉内进行导航的光学形状感测与机器人控制的新颖且独特的集成方案。
本发明的一种形式是一种用于操作血管内部署设备的机器人系统,所述血管内部署设备包括被安装到递送工具的处置设备,所述递送工具被连接到近端控件,并且所述血管内部署设备还包括光学形状传感器(例如,并入光学形状传感器的腔内移植物部署设备)。所述机器人系统采用能附接到所述近端控件和/或所述递送工具的机器人(例如,控制被安装到腹主动脉内的护套导管的腔内移植物的轴向旋转和/或轴向平移的机器人),以用于对所述处置设备在心血管系统内进行导航。所述机器人系统还采用机器人控制器,以用于控制由所述机器人对所述处置设备在所述心血管系统内的导航,所述导航是根据由所述光学形状传感器对所述血管内部署设备的部分或整体的形状感测与所述心血管系统的医学图像之间的空间配准(例如,形状感测数据与腹主动脉的x射线/重建图像的空间配准)来导出的。
为了本发明的目的,本发明的技术领域的术语包括但不限于“光学形状传感器”、“腔内移植物”、“部署设备”、“机器人”、“进行导航/导航”、“控制/进行控制”、“空间配准”、“形状感测”以及“心血管系统”应当被解读为如在本发明的技术领域中并且如在本文中示范性地描述的那样的理解。
为了本发明的目的,术语“血管内部署设备”广义地涵盖并描述性地标识用于部署内部处置设备的所有已知的部署设备,包括但不限于,
为了本发明的目的,术语“近端控件”广义地涵盖并描述性地标识被定位在已知的血管内部署设备的近端处的部署控件,包括但不限于,旋钮、轮、螺钉、注射通道、拉线、滑块、杆等。
为了本发明的目的,术语“递送工具”广义地涵盖并描述性地标识用于安装处置设备的、从近端控件向远端延伸的工具,包括但不限于,部署设备、护套导管、球囊导管、导丝等。
为了本发明的目的,术语“处置设备”广义地涵盖并描述性地标识从近端控件向远端延伸并且用于安装处置设备的工具,包括但不限于,腔内移植物(非开窗式和开窗式)、支架、夹子、瓣膜、闭合设备、瓣环成形术环等。
为了本发明的目的,术语“医学图像”广义地包括用于血管介入程序的诊断、规划和引导的所有已知的图像形式,包括但不限于,模态图像(例如,x射线图像)、重建的图像、绘制的图像、分割的图像、建模的图像等。
为了本发明的目的,术语“控制器”广义地涵盖容纳在计算机或另一指令执行设备/系统内或链接到计算机或另一指令执行设备/系统的专用主板或专用集成电路以用于控制在本文中随后描述的本发明的各种创造性原理的应用的所有结构配置。控制器的结构配置可以包括但不限于,(一个或多个)处理器、(一个或多个)计算机可用/计算机可读存储介质、操作系统、(一个或多个)应用模块、(一个或多个)外围设备控制器、(一个或多个)槽以及(一个或多个)端口。计算机的范例包括但不限于服务器计算机、客户端计算机、工作站以及平板电脑。
为了本发明的目的,术语“模块”广义地涵盖成像质量控制器的部件,其包括用于执行特定应用的电子电路或可执行程序(例如,可执行软件和/固件)。
在结合附图阅读本发明的各个实施例的下列详细描述之后,本发明的前述形式和其它形式以及本发明的各个特征和优点将变得更加明显。详细的描述和附图仅出于图示本发明的目的而非限制,本发明的范围由权利要求和其等价方案来限定。
附图说明
图1a-1c图示了如本领域中已知的用于修复腹主动脉动脉瘤的示范性腔内移植物部署。
图2图示了根据本发明的发明原理的机器人腔内移植物部署系统的示范性实施例。
图3图示了根据本发明的发明原理的机器人的示范性实施例。
图4图示了根据本发明的发明原理的x射线系统的示范性控制。
图5图示了根据本发明的发明原理的用于修复腹主动脉动脉瘤的腔内移植物部署的示范性图像。
具体实施方式
为了便于理解本发明,现在将结合图2-6描述用于执行evar流程和fevar流程的系统的范例。根据对图2-6的说明,本领域普通技术人员将理解如何根据本发明的发明原理对额外类型的血管内介入流程进行本发明并使用本发明,包括但不限于,针对外周脉管系统、胸主动脉的血管内介入流程以及经导管心脏流程。
为了本发明的目的,本发明的技术领域中的术语,包括但不限于,“光学形状传感器”、“护套导管”、“导丝”、“导管球囊”、“监视器”、“接口”以及“工作站”将被解读为在本发明的技术领域中已知的并且在本文中示范性描述的。
参考图2,本发明的evar/fevar系统采用:
(1)腔内移植物部署设备40,包括:(a)近端控件41,
(b)护套导管42sc、导丝42gw和/或球囊导管42bc形式的递送工具,
(c)非开窗式腔内移植物43nf或开窗式腔内移植物43f形式的处置设备,以及
(d)一个或多个光学形状传感器44;以及
(2)机器人(50);
(3)医学成像模态60;
(4)机器人控制工作站70。
光学形状传感器(“oss”)44在evar/fevar流程期间使用沿着一根或多根光纤的光进行设备定位和导航。oss传感器30的工作原理涉及对光纤中的分布式应变测量的使用,包括但不限于,使用特征瑞利反向散射或使用受控的光栅图案。沿着光纤的形状在沿着与oss坐标系45的原点相关联的oss44的特定点处开始,其中,oss44的随后的形状位置和取向是相对于oss坐标系45的原点的。
为了将对oss44的使用引入到evar/fevar流程中以提供对腔内移植物43nf或开窗式腔内移植物43f的图像引导,在实践中,oss44可以根据各种方法被集成到腔内移植物开发中,包括但不限于:
(1)将oss44集成到腔内移植物43nf中或开窗式腔内移植物43f中;
(2)用离散点将oss44附接到腔内移植物43nf上或开窗式腔内移植物43f上;
(3)将oss44集成到导管42sc和42bc的壁中;
(4)将oss44附接到近端控件41的手柄;以及
(5)将oss44集成到导丝42gw中。
如在本文中进一步描述的,可以基于根据集成方法的光学形状感测信息来生成医学成像,例如,腔内移植物43nf或开窗式腔内移植物43f的图像绘制和图像建模。
机器人50被附接到近端控件41和/或递送工具42,以用于在腹主动脉内导航腔内移植物43nf或开窗式腔内移植物43f。在实践中,将机器人50附接到近端控件41和/或递送工具42包括但不限于:
(1)机器人夹持到被耦合到递送工具42(例如,近端控件41的手柄)的腔内移植物部署设备40的扭转部件上;
(2)使用腔内移植物部署设备40与机器人50之间的配合件;以及
(3)护套导管42sc经过被附接到机器人50的夹头。
在机器人50的一个实施例(图2、图4)中,如图3所示,部署致动器53夹紧在近端控件41的手柄上,其中,轴向平移致动器52可以在机器人控制工作站70的命令下经由能平移的传动装置55轴向平移递送工具(未示出)以用于腔内移植物定位目的,并且其中,轴向旋转致动器53可以在机器人控制工作站70的命令下经由能旋转的传动装置56轴向旋转递送工具(未示出)以用于腔内移植物定向目的。对于该实施例,oss坐标系45可以在空间上被配准到机器人坐标系51,或者反之亦然。
机器人50的一个关键特征是能够将腔内移植物部署设备40并且因此将腔内移植物43nf/开窗式腔内移植物43f保持在稳定的位置/取向中,其减少了对操作者来说一直将近端控件40的手柄保持在位置/取向中的需要。在设备40并且因此腔内移植物43nf/开窗式腔内移植物43f确实滑动的情况下,机器人50可以自动地尝试对腔内移植物43nf/开窗式移植物43f在腹主动脉40内进行重新定位/重新定向,或者能够警告用户。另外,通过并入如图所示的(一个或多个)力传感器57,可以测量将设备40插入腹主动脉所要求的力,并且也可以测量在血管插管等期间保持腔内移植物43nf/开窗式腔内移植物43f所要求的(一个或多个)力。如果对患者施加了过大的力量,则这种力读数能够用于警告操作者。
返回参考图2,医学成像模态60可以是本领域包括的已知的任何已知的成像模态。优选地,如图4所示。成像模态60是具有c型臂的x射线机,其被定位和定向用于对患者80的腹主动脉进行成像。对于成像,oss坐标系45在空间上与图像坐标系61进行配准,或者被配准到在x射线图像中可识别的界标/目标,其中,oss30的形状感测数据在空间上被配准到根据x射线成像所产生的任何医学图像,以用于机器人控制目的。在实践中,oss坐标系45可以在空间上被配准到图像坐标系61,或者反之亦然,并且oss坐标系45可以在空间上被配准到界标/目标,或者反之亦然。
值得注意的是,将oss44与机器人50集成到evar/fevar流程中降低了针对机器人监视器50和工作站操作者70的x射线暴露。
返回参考图2,机器人控制工作站70采用监视器71、接口平台72、工作站计算机73、被安装在工作站计算机73内的机器人控制器74以及被安装在工作站计算机73内的成像控制器76。
工作站计算机73被连接/耦合到oss44和成像模态60,以分别输入形状感测数据和成像数据。更具体地,对于输入形状感测数据,如本领域已知的用于检测由oss44反射和/或透射通过oss44的光的光探测器(未示出)可以在工作站计算机73的内部或外部。
机器人控制器74和成像控制器76包括本领域已知的操作系统(未示出)和/或可由本领域已知的操作系统(未示出)访问,以用于通过如由工作站操作者经由接口平台72的键盘、按钮、拨盘、操纵杆等所指导地控制监视器78上的各种图形用户接口、数据和图像,并且用于如由接口平台72的工作站操作者所编程和/或指导地存储/读取数据。
在实践中,机器人控制器74和成像控制器76可以是分开的或者可以被集成在工作站计算机73内,或者被安装在不同工作站70的工作站计算机上。额外地,机器人控制器74可以被并入机器人50,和/或成像控制器76可以被并入成像模态60,其中,工作站计算机73提供了用于访问机器人控制器74和/或成像控制器76的用户接口。
通常,机器人控制器74被连接到机器人50的致动器控件,以用于机器人50与机器人控制器75之间的数据/命令通信75,包括但不限于,从机器人控制器74到机器人50的致动命令以及从机器人50到机器人控制器74的致动数据(例如,设备40的轴向平移和/或轴向旋转的程度以及任何力反馈)。同时,成像控制器76被连接到成像模态60,以用于成像模态60与成像控制器76之间的数据/命令通信77,包括但不限于,从成像模态60到成像控制器76的成像数据以及从成像控制器76到成像模态60的致动命令。
具体地,机器人控制器74执行用于腔内移植物43nf/开窗式腔内移植物43f到腹主动脉中的定位、定向和部署的各种控制方案,并且成像控制器76执行用于由成像模态60对腹主动脉成像的自动控制的控制方案。
为此,根据由成像模态60生成的成像数据,成像控制器76生成用于在监视器71上显示的(一幅或多幅)evar/fevar医学图像78,包括但不限于:解剖结构的术前图像或术中图像(例如,x射线、ct、mri、ivus、oct或超声)以及腔内移植物43nf/开窗式腔内移植物43f和所利用的递送工具(例如,护套导管42sc、导丝42gw和球囊导管42bc)的图像模型。根据(一幅或多幅)图像78,工作站操作者经由接口平台72来实施控制方案。
在本文中,现在将在如图5所示的二维(“2d”)医学图像79的背景中描述对主腔内移植物部署设备40(m)、插管腔内移植物部署设备40(c)和开窗式腔内移植物部署设备40(f)在腹主动脉11内的预部署插入的控制方案。
为了本发明的目的,术语“递送位置目标”和“递送取向目标”分别广义地涵盖在部署之前或在部署期间对递送工具或处置设备的特定特征的位置和取向在心血管系统内的导航目标,并且术语“递送位置限制”和“递送取向限制”分别广义地涵盖在在部署之前或在部署期间对递送工具或处置设备的特定特征的位置和取向在心血管系统内的导航边界。
将关于“腔内移植物位置目标”和“腔内移植物取向目标”以及术语“护套位置限制”来描述以下控制方案,所述“腔内移植物位置目标”和“腔内移植物取向目标”分别广义地涵盖在部署之前对腔内移植物的位置和密封/保持环的位置和取向在腹部主动脉内的导航目标,并且所述“护套位置限制”分别广义地涵盖在部署期间对护套导管的位置在腹主动脉内的导航边界。
根据对控制方案的这些描述,本领域普通技术人员将意识到如何根据本发明的发明原理来实施所描述的控制方案的变型。
机器人位置控制方案。对于该控制方案,机器人控制器76通过使用关于被配准到对腹主动脉的成像的腔内移植物43nf/开窗式腔内移植物43f和设备40的关键特征的光学形状感测信息来控制对腔内移植物43nf/开窗式腔内移植物43f的定位。更具体地,机器人控制器74确定如何通过使用以下操作来命令机器人50对腔内移植物43nf/开窗式腔内移植物43f进行平移(例如,经由轴向平移):
(1)由工作站操作者经由接口平台73在两(2)幅2d荧光透视图像(例如,ap和lao30)或由成像控制器76生成的腹主动脉的三维(“3d”)图像重建内勾画的腔内移植物43nf/开窗式腔内移植物43f的腔内移植物位置目标;
(2)由工作站操作者经由接口平台73的编程量的轴向平移;
(3)由工作站操作者经由接口平台73在腹主动脉的图像重建或绘制上对腔内移植物模型的平移交互;并且
(4)通过接口平台73的用户输入设备(例如,操纵杆)对腔内移植物43nf/开窗式腔内移植物43f的平移的直接平移控制。
例如,参考图5,可以由工作站操作者经由接口平台73来勾画针对邻近主设备40(m)的远端端部的腔内移植物43nf的光学感测的密封/保持环(未示出)的肾动脉12下方的腔内移植物位置目标90。响应于与对腔内移植物位置目标90的勾画相关联的、来自机器人控制器74的致动命令,机器人50将轴向平移主设备40(m),直到光学形状感测反馈指示密封/保持环被定位在腔内移植物位置目标90处。
备选地,对于涉及在对腔内移植物43nf的部署期间或在对腔内移植物43nf的部署之后创建腔内移植物43nf中的开窗的实施例,针对邻近主设备40(m)的远端端部的腔内移植物43nf的光学感测密封/保持环(未示出)的肾动脉12上方的腔内移植物位置目标91可以由工作站操作者经由接口平台73来勾画。响应于与对腔内移植物位置目标91的勾画相关联的、来自机器人控制器74的致动命令,机器人50将轴向平移主设备40(m),直到光学形状感测反馈指示密封/保持环被定位在腔内移植物位置目标91处。
通过进一步的范例,仍然参考图5,可以利用如由单向线性箭头所标识的主设备40(m)的平移交互或直接平移控制来如所期望地将腔内移植物43nf的光学感测的密封/保持环(未示出)定位在肾动脉12下方或上方。响应于与平移交互或直接平移控制相关联的、来自机器人控制器74的致动命令,机器人50将轴向平移主设备40(m),直到光学形状感测反馈指示密封/保持环已经被相应地平移。
该控制方案可以用于如图5所示的对设备40的引入,并且用于在部署期间对腔内移植物43nf/开窗式腔内移植物43f的精细定位。在该控制方案期间,机器人控制器74可以通过使用光学形状感测信息作为反馈经由控件来控制由机器人施加的力。光学形状感测信息还提供对于检测(一个或多个)设备40的扭结或潜在的危险弯曲所必要的信息,所述扭结或潜在的危险弯曲可能损坏腔内移植物43nf/开窗式腔内移植物43f和/或损坏设备40,在这种情况下,机器人控制器74警报能够发出警报。
机器人取向控制方案。对于该控制方案,机器人控制器74通过使用关于被配准到对腹主动脉的成像的腔内移植物43nf/开窗式腔内移植物43f的关键特征的光学形状感测信息来控制对腔内移植物43nf/开窗式腔内移植物43f的定向。更具体地,机器人控制器74确定如何通过使用以下操作来命令机器人50对腔内移植物43nf/开窗式腔内移植物43f进行定向(例如,经由轴向旋转):
(1)由工作站操作者经由接口平台73在两(2)幅2d荧光透视图像(例如,ap和lao30)或由成像控制器76生成的腹主动脉的3d图像重建内勾画的腔内移植物43nf/开窗式腔内移植物43f的腔内移植物取向目标;
(2)由工作站操作者经由接口平台73的编程量的轴向旋转;
(3)由工作站操作者经由接口平台73在腹主动脉的图像重建或绘制上对腔内移植物模型的旋转交互;并且
(4)通过接口平台73的用户输入设备(例如,操纵杆)对腔内移植物43nf/开窗式腔内移植物43f的平移的直接旋转控制。
例如,参考图5,可以由工作站操作者经由接口平台73来勾画针对肾动脉12r的腔内移植物取向目标92或针对肾动脉12l的腔内移植物取向目标93,以用于开窗式腔内移植物43f的光学感测的开窗。响应于与腔内移植物取向目标92或腔内移植物取向目标93的勾画相关联的、来自机器人控制器74的致动命令,机器人50将轴向旋转主设备40(m),直到光学形状感测反馈指示利用腔内移植物位置目标92或腔内移植物取向目标93对光学感测的开窗进行取向。
通过进一步的范例,仍然参考图5,可以利用如由单向角箭头所标识的主设备40(m)的旋转交互或直接旋转控制来对开窗式腔内移植物43f的光学感测的开窗(未示出)进行定向。响应于与旋转交互或直接旋转控制相关联的、来自机器人控制器74的致动命令,机器人50将轴向旋转主设备40(m),直到光学形状感测反馈指示开窗已经被相应地定向。
腔内移植物部署控制方案。对于该控制方案,机器人控制器74将致动命令传达给机器人50,以用于对腔内移植物43nf/开窗式腔内移植物43f的部署的机器人控制。
例如,在图2的主设备40是
通过其中图2的设备40是针对aaa的
最后,通过其中图2的设备40是
在支架部署过程的任何这样的机器人致动期间,关于来自机器人50的致动器/编码器的腔内移植物的部署的阶段的信息以及关于来自oss44的设备40的形状的信息可以用于在可视化框架内向工作站操作者提供腔内移植物43nf/开窗式腔内移植物43fis如何部署的视觉表示。
虚拟固定控制方案。对于该控制方案,可以在患者解剖结构或机器人空间内限定针对腔内移植物部署设备的运动的虚拟边界。例如,如图5所示,腔内移植物取向目标93(这里是护套位置限制)描绘了主设备40(m)的护套取回的虚拟边界,以允许对控制侧动脉支13l的插管。
为此,机器人系统可以施加力反馈以防止工作站操作者将腔内移植物部署设备推入不期望的位置。这种“力反馈”能够被表达为阻力,在物理上限制工作站操作者将腔内移植物部署设备移动到不想要的区,或者简单地作为给工作站操作者的信号。在实践中,这样的系统不要求主动的自由度,而是可以仅以阻力自由度操作,这可以被认为是与能够主动运动的机器人相比对工作站操作者具有较小侵入性。可以进一步使用虚拟固定,例如,通过限制插入深度来防止工作站操作者在腔内移植物部署期间堵塞肾分叉。
自动成像控制。对于该控制方案,参考图2和图4,成像控制器76根据光学形状感测数据知晓腔内移植物43nf/开窗式腔内移植物43f的位置和取向,并且使用该知识来控制x射线的c型臂,包括但不限于:
(1)移动c型臂62或建议针对c型臂62的最优位置以对腔内移植物43nf/开窗式腔内移植物43f特定特征进行可视化(例如,在某个开窗的插管期间,工作站操作者83可指导成像控制器76移动c型臂62以跟随腔内移植物43nf/开窗式腔内移植物43f或设备40的平移、旋转和/或部署);
(2)调节楔子以将视场限制在腔内移植物43nf/开窗式腔内移植物43f所驻留的位置,从而限制对患者81和机器人操作者82的辐射剂量;并且
(3)移动台面81以自动跟踪腔内移植物或部署系统的位置。
综上所述,参考图2-6,本发明提出了一种用于对处置设备在心脏的脉管系统内进行导航的光学形状感测与机器人控制的新颖且独特的集成方案,更具体地,本发明提出了一种用于对腔内移植物在腹主动脉内进行导航的光学形状感测与机器人控制的新颖且独特的集成方案。
根据在本文中的图2-6中所示的示范性实施例的描述,本领域普通技术人员将意识到本发明的众多益处,包括但不限于:
(1)减少与成像相关联的放射剂量和造影剂的使用;
(2)稳定和保持腔内移植物部署设备;
(3)对腔内移植物部署设备的位置和取向控制;并且
(4)对x射线系统的c型臂进行自动或建议定位以跟随腔内移植物的相关特征(例如,开窗)。
此外,鉴于在本文中提供的教导,本领域普通技术人员将意识到,在本公开内容/说明书中描述的和/或在图2-6中描绘的特征、元件、部件等可以以电子部件/电路、硬件、可执行软件以及可执行固件的各种组合来实施,尤其是作为在本文中所描述的机器人控制器和成像控制器的应用模块,并且提供可以被组合在单个元件或多个元件中的功能。例如,能够通过使用专用硬件以及能够执行与适当的软件相关联的软件的硬件来提供在附图1-6中示出/图示/描绘的各种特征、元件、部件等的功能。当由处理器提供时,所述功能能够由单个专用处理器、由单个共享处理器或由多个个体处理器(它们中的一些能够被共享和/或被多路复用)来提供。此外,对术语“处理器”的明确使用不应被解释为专指能够执行软件的硬件,并且能够隐含地包括而不限于数字信号处理器(“dsp”)硬件、用于存储软件的只读存储器(“rom”)、随机存取存储器(“ram”)、非易失性存储器等以及能够(和/或能被配置为)执行和/或控制过程的任何虚拟模块和/或机器(包括硬件、软件、固件、电路、它们的组合等)。
此外,在本文中记载本发明的原理、各方面和实施例以及其特定范例的所有陈述,旨在涵盖其结构和功能上的等价物。额外地,这样的等价物旨在包括当前已知的等价物以及未来发展的等价物(即,能够执行相同功能或基本上类似的功能的所发展的任何元件而无论其结构如何)。因此,例如,本领域普通技术人员鉴于在本文中提供的教导将意识到,在本文中提出的任何方框图能够表示实施本发明的原理的图示性系统部件和/或电路的概念视图。类似地,本领域普通技术人员鉴于在本文中提供的教导将意识到,任何流程图表、流程图等能够表示基本上可以被表示在计算机可读存储媒介中并且因此可以由计算机、处理器或具有处理能力的其他设备来执行的各种过程,无论这样的计算机或处理器是否被明确示出。
此外,本发明的示范性实施例能够采取计算机程序产品或应用模块的形式,所述计算机程序产品或应用模块可从计算机可用存储介质或计算机可读存储介质存取,所述计算机可用存储介质或计算机可读存储介质提供用于由计算机或任何指令执行系统使用或者与计算机或任何指令执行系统结合使用的程序代码和/或指令。根据本公开内容,计算机可用存储介质或计算机可读存储介质能够是能够例如包括、存储、通信、传播或输送用于由指令执行系统、装置或设备使用或与指令执行系统、装置或设备结合使用的程序的任何装置。这样的示范性介质能够例如是电子、磁性、光学、电磁、红外或半导体系统(或装置或设备)或传播介质。计算机可读介质的范例包括例如半导体或固态存储器、磁带、可移动计算机软盘、随机存取存储器(ram)、只读存储器(rom)、闪盘(驱动器)、硬磁盘以及光盘。光盘的当前范例包括压缩盘-只读存储器(cd-rom)、压缩盘-读/写(cd-r/w)以及dvd。此外,应当理解,此后可以被开发的任何新的计算机可读介质也应当被认为是根据本发明和公开内容的示范性实施例可以使用或参考的计算机可读介质。
已经描述了用于基于光学形状感测对腔内移植物部署的机器人控制的新颖性和创造性系统和方法的优选和示范性实施例(这些实施例旨在是图示性的而非限制性的),应当注意,按照本文中提供的教导,包括附图2-6,本领域普通技术人员能够做出修改和变型。因此,应当理解,能够在/对本公开内容的优选和示范性实施例中做出在本文中公开的实施例的范围之内的改变。
此外,应预想到,包括和/或实施根据本公开内容的设备或诸如能够在所述设备中使用/实施的对应的和/或有关的系统也被预想到并且被认为在本发明的范围之内。而且,用于制造和/或使用根据本公开内容的设备和/或系统的对应的和/或有关的方法也被预想到并且被认为在本发明的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!