根据热生成估算器官的局部代谢率及估算用于灌注组织体积的局部血流量的装置的制作方法
背景技术:
本申请涉及用于在血管内介入期间估算受试者器官的局部代谢率和血流量的系统和方法。
更特别地,本申请描述了在外科手术中连续、实用地估算典型血管生理变量(局部脑血流(rcbf)、局部脑代谢率(rcmr)、局部脑血管阻力(rcvr)、局部脑灌注体积(rcpv));并由其计算已识别的(脑血流自主调节)或新的关键病理-生理阈值(灌注保留阈值(pst)(特别是温度、动脉血氧分压(pao2)、平均动脉压(map))和/或新血管生物标记(再灌注严重程度指数(rsi)、再灌注充血指数(rhi))的估算值的有效新方法。这些值也可以用于确定以及被操纵用于最优动脉内低温和药物输送。本申请重点关注大脑,但所述方法也可以用于心脏和肾等其它器官。
代谢率是指活的生物体内代谢发生的速度。器官如大脑的代谢率通常是指器官消耗燃料、氧气、葡萄糖等的速度。虽然大脑占全部体重的大约2%,但其消耗输送到身体其它部位的总氧气量的10%~20%。此外,与其它器官不同,大脑整体并不具有“休息”状态。而是被认为一直是“活跃的”。
正常、清醒个体的大脑氧代谢率(cmro2)是普遍已知的。正常、清醒个体的rcbf也是普遍已知的。与正常或基准速度的偏差可以表明大脑的相对健康状况。对此,已经提出许多程序来利用成像系统估算大脑的代谢率和/或rcbf,所述成像系统如正电子发射计算机断层扫描系统(pet)、单光子发射计算机断层扫描系统(spect)及磁共振成像系统(mri)。标题为“systemsandmethodsfordeterminingmetabolicrateusingtemperaturesensitivemagneticresonanceimaging”的美国专利公开no.20090198122讨论了其中一种程序,此公开以引用形式并入本文。但是,在确定代谢率和血流量时,成像系统有其缺点。特别地,成像系统一般只提供给定时间的器官代谢率“快照”。重复扫描通常既不实用也不经济,因而无法提供充分的解决方案。而且,在血管内介入期间,这些成像系统无法在不显著延迟或不中断治疗的情况下使用。
此外,几乎所有药物都是通过口服、静脉注射或皮肤途径给药。已经付出了大量经验、专业知识、惊人的知识产权、以及大量努力来有效解决各种问题以精确制造可以以这种方式给药的药物和载体。不管给药方式如何,血管内皮毒性都是许多药物所面临的问题,并且被认为是引发与药物治疗相关的大量短期和长期病症的原因。因此,需要药物管理系统及相应的程序来控制药物毒性及其对非目标组织的影响。此外,在不知道局部血流量、被灌注组织体积及能量代谢的情况下,动脉内药物输送期间正确的药物剂量也是一大挑战。因此,需要系统及使用此类系统的相应程序,其不限于以这种和/或其它方式解决上述一个或多个问题。
技术实现要素:
本文公开的系统及使用此系统的相应程序致力于解决与急性缺血性脑卒中的当前诊断模式相关的下述一个或多个问题:(1)成像系统只提供缺血性组织损伤所涉及过程的不完整“快照”;(2)再灌注治疗过程中反复脑成像或监测既不实用也不经济;以及(3)在选定的接受血管内再通治疗(ert)的患者体内,无法在整个干预期间进行器官生理状态和缺血性损伤的进一步评估。
而且,值得注意的是,从来没有基于测量或估算的代谢率(利用这些系统或其它方式)来评估组织死亡或存活。因此,本文所述的系统及相应程序可以提供实用且经济的监测方法,例如,在血管造影中监测局部血流量变化和局部器官代谢变化。这样可以改善患者选择、帮助引导治疗、减少继发性损伤(出血、再灌注损伤、炎症)、支持个性化护理,并且/或产生更有效的干预及更好的治疗效果。此外,从可以操纵局部器官血流量和局部代谢这一点来说,所述系统及相应程序可以用于影响动脉内药物输送相关变量,包括摄取分数、药物代谢和局部药物毒性。
因此,在至少一个方面,提供一种系统,所述系统包括:控制器;插入装置,其上设置有至少一个温度传感器,所述插入装置功能性地联接至所述控制器,以向所述控制器提供受试者器官的至少一个温度测量值;泵,其功能性地联接至所述控制器,从而使所述控制器改变注入液流量,以引发至少部分所述受试者器官内的温度变化;以及存储装置,其功能性地联接至所述控制器,所述控制器能够操作以在至少部分所述受试者器官内的灌注引发温度变化期间,将器官的所述至少一个温度测量值储存在控制器中,并且能够进一步操作以根据灌注引发温度变化期间获取的所述至少一个温度测量值来估算至少部分所述受试者器官的至少一个血流动力特征。
在至少一个实施例中,至少一个血流动力特征包括至少部分受试者器官的代谢率。
在至少一个实施例中,至少一个血流动力特征包括与至少部分受试者器官相关的组织血流量。
在至少一个实施例中,至少一个血流动力特征包括与至少部分受试者器官相关的产热量。
在至少一个实施例中,控制器能够操作以改变注入液流量从而降低至少部分受试者器官内的温度。
在至少一个实施例中,控制器能够操作以改变注入液流量从而将至少部分受试者器官维持在正常温度以下的平衡温度。
在至少一个实施例中,控制器能够操作以改变注入液流量从而将至少部分受试者器官的温度渐进地降低并减小至多个不同的平衡温度,并将至少部分受试者器官的温度保持在所述多个平衡温度。
在至少一个实施例中,根据灌注引发温度变化期间的多个温度测量值估算至少一个血流动力特征,所述灌注引发温度变化包括至少一个洗入(wash-in)、平衡、洗出(wash-out)循环。
在至少一个实施例中,至少一个血流动力特征包括至少部分受试者器官的代谢率、组织血流量、产热量中的至少一个。
在至少一个实施例中,至少一个血流动力特征包括组织灌注体积。
在至少一个实施例中,至少一个血流动力特征包括半影组织灌注体积。
在至少一个实施例中,将半影组织灌注体积作为初始时间平衡状态下注入速度和温度乘积的函数进行估算。
在至少一个实施例中,至少一个血流动力特征包括与组织灌注体积相关的血流量。
在至少一个实施例中,至少一个血流动力特征包括与半影组织灌注体积相关的血流量。
在至少一个实施例中,至少一个血流动力特征包括半影保留阈值温度。
在至少一个实施例中,至少一个血流动力特征包括再灌注充血指数。
在至少一个实施例中,至少一个血流动力特征包括再灌注严重程度指数。
在至少一个实施例中,控制器能够进一步操作以显示界面屏幕,所述界面屏幕包括与至少部分受试者器官相关的至少一个血流动力特征。
在至少一个实施例中,界面屏幕包括正常组织灌注体积和半影组织灌注体积中至少一个的实时显示。
结合以下说明,本发明的其它方面会更明显。
附图说明
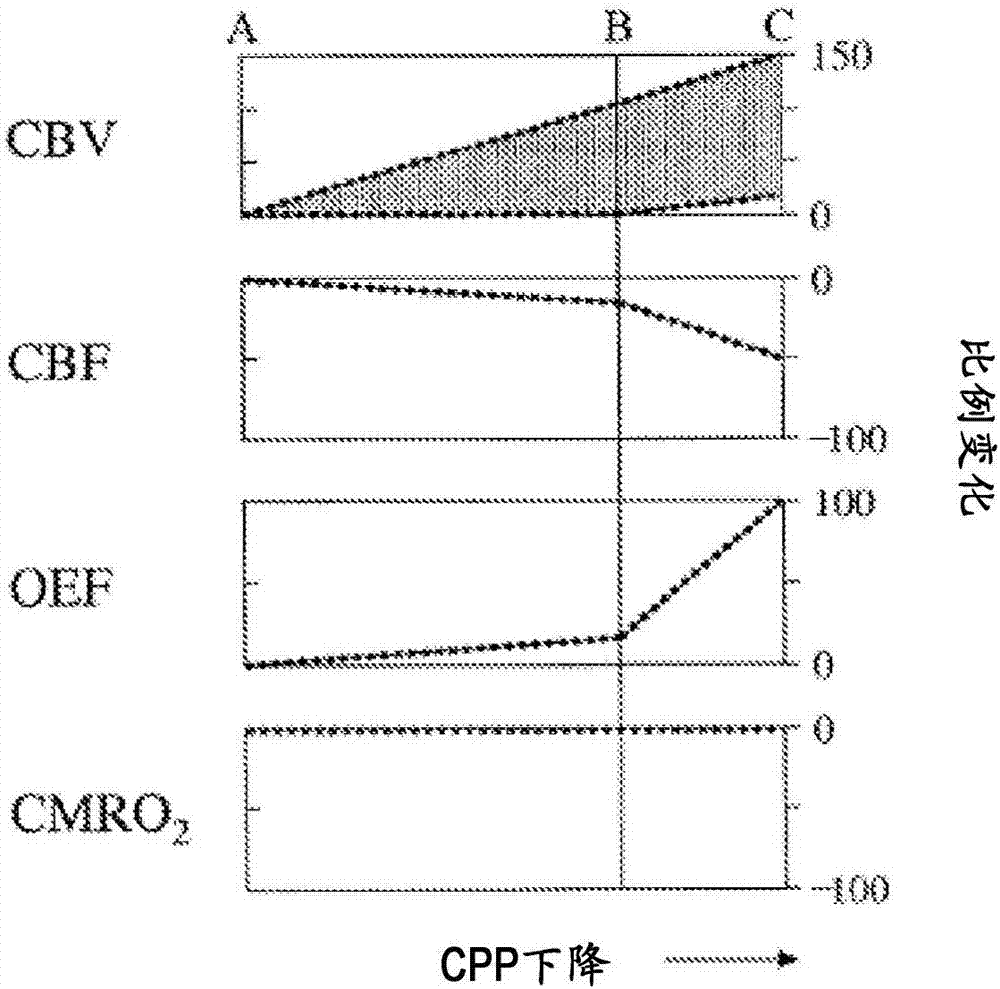
图1a和1b示出大脑生理变量与脑灌注压(cpp)的对比图。
图2示出根据本文公开系统的至少一个实施例的用于估算器官代谢率的系统。
图3示出根据本文公开过程的至少一个实施例的用于估算器官代谢率的过程流程图。
图4a-4b示出用于估算器官代谢率的双隔室模型的框图。
图4c-4x示出来自模拟温血试验模型(benchmodel)测试及具有选择性大脑冷却的人体研究的,在电脑模拟的大脑冷却期间的大脑半球温度变化图。
图5a-f示出正常组织和缺血性组织中脑血流量和代谢率与温度的对比图。
图6示出根据本文公开系统的至少一个实施例的,由系统生成的或用于估算器官代谢率、血流量和血管阻力的显示屏。
具体实施方式
本申请总体提供用于估算和/或操纵一个或多个受试者器官,如受试者大脑或其任意部分内的典型血管生理变量,如代谢率以及其它生理变量的系统及相应程序。更特别地,本申请提供用于在例如动脉血管内介入期间,确定受试者器官灌注组织的局部组织产热量及组织血流量,并由其计算/估算已识别的和新的关键病理-生理阈值的系统和程序。此外,本申请提供用于控制动脉内药物输送相关变量,如血流、药物浓度和代谢率,从而影响摄取分数、药物代谢和局部药物毒性的系统和程序。
术语血管内介入表示涉及进入受试者脉管系统管腔内的任意医疗或外科程序。因此,血管内介入包括在管腔内操作的程序,如低温治疗、血管内溶栓、再通、栓塞、血管成形、支架等,以及需要至少一定程度的管腔内活动的程序,如治疗药剂的靶向输送,以及涉及管腔内导向以接近介入目标位置的程序。而且,介入不限于治疗程序,也可以包括诊断程序。虽然本公开的系统和程序可以以与某些器官如大脑相关的示例性方式进行讨论,但应当理解的是,这些系统和程序可以与其它器官或其任意部分结合使用。
在好氧条件下,大脑代谢氧(o2)和葡萄糖(glu)从而产生足够的用于细胞进程的atp(三磷酸腺苷)形式的能量。该过程可以描述为:glu+6o2→6co2+6h2o。该过程中产生的焓的三分之一耗散为热量,三分之二用于形成38个atp分子。由于养分承载在血液中,血流、动脉血氧含量和氧摄取是确保向细胞供应足够养分的一些基本因素。在大脑中,可以通过脑血流(cbf)和氧摄取分数(oef)确定脑氧代谢(cmro2)。在结束阶段流量限制的情况下,这些变量,cbf、oef,确定cmr。cbf不仅向大脑供应养分,还可以排出其能量代谢产生的热量。这是cbf的一个重要功能,因为由于周围有头骨围绕,大脑无法很好地将热量耗散至外部环境中。表a提供了人类大脑这些及其它生理变量的正常值。
表a
当为部分大脑供血的动脉例如被血凝块堵塞时,可能会引发缺血性脑卒中。在患有慢性疾病的情况下,例如,患有颈动脉疾病,已经示出大脑中存在两个补偿机制,用于维持生理能量代谢并防止缺血性损伤。第一个是患部的动脉扩张(脑血管阻力即cvr降低)以改善cbf(阶段i)。由此,将增加脑血液体积(cbv)。随着cbf因脑灌注压(cpp)降低而进一步减小,第二机制被激活,即oef增加(阶段ii)。阶段ii的长期失效会导致缺血性损伤(阶段iii)。图1a和1b以图形形式示出这些生理变量随着灌注压逐步增大/减小而发生的变化。相应地,测量和/或监测一个或多个这些变量可以提供关于,例如,受试者经历过急性缺血性脑卒中后的大脑血流动力阶段的有价值的见解。此外,一个或多个这些变量可以有目的地操纵以影响动脉内药物输送,包括摄取分数、药物代谢和局部药物毒性。
因此,本申请提供用于根据特定器官,如大脑,在给定温度下产生的热量估算该器官的一个或多个血管生理变量的系统及相应程序。更特别地,本申请提供用于根据大脑的产热量,估算局部或其它部分的代谢率,如cmro2、cmrglu、和cmrdrug(统称为“cmr”)、cbf、cbv、cpp、cvr、rpv、pst、pao2、map、rsi、rhi等,并用于操纵这些变量以影响动脉内药物输送的系统和程序。本申请还提供基于控制药物剂量、注入液温度、cbf和血细胞比容(hct)中的至少一个,用于控制特定器官的血流量、药物浓度和组织代谢率中至少一个的系统及相应程序。
大脑或其任意部分产生的热量可以以多种方式估算。在至少一个实施例中,使用本文公开的系统,根据灌注引发温度变化期间传递至大脑和/或从大脑传递出的热量的测量,及/或其时序估算产热量。灌注引发温度变化包括:大脑灌注引发温度下降(冷却),优选为渐进下降;将大脑保持在恒定温度(平衡),优选正常或基准温度以下的温度;以及/或引发或允许大脑温度上升(加热),优选为渐进上升。灌注可以使用任意生物相容性流体(注入液)进行,包括血液、盐水、药物或一般任意治疗剂等或其任意组合。
灌注过程中传递至大脑和从大脑传递出的热量可以使用各种系统测量/操纵,包括标题为“systemandmethodforintravascularcooling”的美国专利公开no.20090018504所公开的系统,该专利公开并入本文。参见图2,在至少一个实施例中,所述系统包括插入装置2,如导管,其具有远端6和近端8。插入装置2一般为远端6首先插入受试者体内,如受试者股动脉内的细长部件。插入装置2包括沿其内表面20(在插入装置2为导管的情况下)和/或外表面40的一个或多个传感器10a、10b、10c、10d,所述传感器通过电线14电联接至控制器22。
各种传感器可以结合到插入装置2上或以其它方式与插入装置2相关联,所述传感器包括一个或多个温度传感器、流量传感器、hct传感器等。在插入装置2为导管的情况下,插入装置2包括纵向延伸的管状部件4,其具有近端8处的开口和远端6处的开口。远端6处的开口代表注入液的出口。在至少一个实施例中,插入装置2为具有多个温度传感器的导管,所述多个温度传感器包括导管腔体内的传感器10b和导管外的至少一个温度传感器,如导管远端处的传感器10a或相对于传感器10b位于近侧的传感器10b、10c。传感器10b主要提供注入液在导管内的温度,10c和10d提供动脉温度,10a提供注入液温度及导管2远端处的动脉血液混合物温度。因此,可以根据提供本文所述的提供温度t1-t4的一个或多个传感器的温度读数来确定产热量。导管2优选为绝热导管,以限制动脉血液和注入液之间直到导管2的远端6的热传递。
控制器22优选进一步联接至输入装置和输出装置,输入装置例如开关、旋转拨号盘、按键或键盘、触摸屏等,输出装置例如监视器、打印机等。输入装置主要提供界面供用户指定并调整系统操作参数,如注入液温度、注入液流量、时间、药物剂量、hct等,输出装置提供一个或多个界面,用于向用户展示例如从一个或多个传感器10a、10b、10c、10d获得的数据,以及/或系统根据所获得的数据计算得出的数据。计算得出的数据优选包括对本文所述生理变量的估算,这些变量可以以表格形式单独展示,并且/或例如以随时间变化的数据图形的形式展示。输出装置可以是显示器,如lcd监视器、打印机等。系统可以进一步在计算机存储装置中存储关于温度、流量、时间、药物剂量、血细胞比容等的一个或多个预设指令集,这些指令集可以在用户选择时由系统执行。如本文所述,系统可以根据灌注引发温度变化期间和/或平衡期间传递至器官和从器官传递出的热量估算器官的产热量。为此,指令集可以包括用于操作系统参数的序列和时序,例如逐渐冷却、保持温度、引发或允许器官温度上升、控制hct和流量等。存储器可以将系统收集和/或估算的数据进一步存储在例如数据库中。
控制器22进一步例如通过一个或多个电线26联接至泵24和/或至少一个注入液容器30,以针对例如注入液流量、温度、药物剂量、hct等控制泵24和/或容器30的操作。任何具有宽动态范围如约2cc/min~约360cc/min的泵,如血液泵,均可以用作泵24。类似地,任何容器30均可以用于供应注入液,例如,用于本文所述的灌注引发温度变化;但是,容器30优选以控制温度供应注入液,其可以由控制器22冷却、加热和/或保持为约-10℃~约40℃范围内的任意所需温度。如图2所示,泵24主要经由入口32从容器30吸入冷却和/或加热的注入液,并经由出口34将注入液以所需流量排出至插入装置2的腔体38内。流量和/或温度可以由控制器22根据从一个或多个传感器10a、10b、10c、10d获取的数据,和/或由系统根据这些获取的数据计算得出的数据进行控制。也就是说,控制器22可以在任意给定时间改变泵24和/或容器30的操作以保持所需温度、流量、生理变量等。
如上所述,可以使用本文公开的系统,根据灌注引发温度变化期间传递至大脑和/或从大脑传递出的热量的测量,及/或其时序来估算产热量。对此,系统能够操作以引发并测量以下至少一个过程中的热传递:1)大脑温度降低(冷却),优选为渐进降低;2)将大脑保持在恒定温度(平衡),优选正常或基准温度以下的温度;以及3)大脑温度上升,优选为渐进上升。参见图3,在一个实施例中,系统引发一个或多个序列的温度变化,所述序列在冷却和复温过程中分别被称为“洗入”和“洗出”技术,而平衡是指大脑保持在恒定温度,冷却变化最小的时间。洗入技术通常从将插入装置2如导管放入待询问区域的血管中开始(102)。例如,导管可以插入受试者的股动脉内,并导向至用于受试者大脑询问的颈动脉之一。一旦放置就位,可以设置系统操作参数及任意安全变量(104)(例如,以防止身体温度下降超过1~1.5℃,全身血细胞比容下降至25以下,以及/或防止流体过载)。在一个实施例中,设置的操作参数包括注入液温度、动脉血液/注入液混合物温度和注入液流量中的至少一个。设定温度一般低于受试者体温,优选足够低以收集足够的数据组,从而为随后的生理变量估算提供更优的分辨率。例如,温度可以设定为低于体温5℃。一旦设定了温度,可以以设定注入速度进行局部冷却,直到大脑达到用于原生血管流量的新温度平衡(106)。平衡温度可以保持任意时间段。而且,平衡可以根据新的固定注入速度设定,新注入速度为之前平衡状态下注入速度的分数(约1/3)。如本文所述,器官内的引发温度变化可以影响摄取分数、药物代谢和局部药物毒性中的至少一个。对此,系统可以设置为降低器官温度以达到这些动脉内药物输送变量所需的变化,随后进行动脉内药物输送。
“洗出”技术一般包括“洗入”技术的冷却及上文所述的为大脑保持新的温度平衡,以及大脑加温(108)。可以通过灌注高于平衡温度的注入液,和/或简单地减少注入液流量,使动脉血流足以自己加温大脑来引发加温。洗入和洗出步骤可以在各阶段重复,例如,以实现在平衡温度下逐渐增加/减少。系统主要收集(介入过程中的)实时相关数据(110),如混合物(动脉血和注入液)和注入液流量、温度、体积等,并将信息储存在计算器存储器中以进行处理,其优选也是实时进行的。最后,收集的数据可以被处理以计算或以其它方式估算脑血流动力和代谢特征(如本文所述)(112),并且计算/估算的特征可以显示在界面屏幕上(114),如图6所示的界面屏幕。
如上所述,系统记录的温度变化和温度变化速度提供关于大脑生理状况的数据。也就是说,传递至大脑组织和从大脑组织传递出的热量的重要因素是主血流(bulkbloodflow),其可以通过pennes的“热通量”或“生物-热”方程有效建模:hb=vρbcb(l-κ)(ta-t),其中,hb表示每单位体积组织的热传递速度,v表示每单位体积组织的灌注速度,ρb为血液浓度,cb为特定血液热量,κ为表示血液和组织之间不完全热平衡的因子,ta为动脉血温度,t为局部组织温度。针对本公开的目的,从其它源的热传递已省略。此外,ρb、cb和κ一般是恒定的。因此,系统可以计算hb的估算值和hb在洗入、平衡和洗出整个循环中的变化率。脑温度(t)与代谢率(cmr)之间密切相关。也就是说,cmr通常会随着t的下降而变慢。此外,大脑产生的热量与cmr成正比。因此,hb和cmr(包括药物代谢率)在第一时间tt1的温度低于hb和cmr在第二时间tt2的温度,其中tt2大于tt1。之后,系统可以根据热量hb、灌注速度v和/或温度ta和/或t中的至少一个计算关键脑血流动力特征(如cbf、cbv、cvr、cpp、rpv、pst、pao2、map、rsi、rhi等)和/或代谢特征(如cmr等)(112),其中,ta是从稳定状态循环中的洗入和洗出过程中的一个或多个温度传感器的读数确定的,并且维持大脑组织温度所需的热量hb是从测量的平衡状态下原生血管流量确定的。此外,可以通过控制药物输送过程中的热量hb、灌注速度v和/或温度ta和/或t中的一个或多个来操纵摄取分数、cmrdrug和局部药物毒性。
平衡中的大脑产热量和散热量也可以用以下方程建模:
其中,c组织为特定大脑热量,
在休眠状态下,大脑温度略高于动脉温度,大约为37.3℃对37.0℃。在大多数身体系统中(皮肤和末端除外),这种温度平衡可以保持在非常小的范围内。显然,散热量随着cbf升高和动脉输入温度降低(冷却)而增加。cmro2和cbf均随着温度变化而变化,并且cbf在大温度范围内与cmro2相关联,也就是说,cbf将随着cmro2的变化而变化:q=q0·αβ(t-37)且ω=ω0·αβ(t-37),其中,q为最终cmro2,q0为37℃时的基准cmro2,α和β为回归系数,(t-37)为新大脑温度,ω为最终cbf,ω0为基准cbf。
脑血流动力和代谢特征可以根据双隔室模型,利用将缺血性组织从非缺血性组织分离的冷却洗入和洗出过程中收集和/或估算的数据进行计算。也就是说,在使用动脉导管的程序中收集的信息可以由系统用于计算以下估算值:与计算得出的血流量相关的脑代谢率(estcmr含热)、被灌注的正常组织脑血流(estcbf正常)、被灌注的半影组织脑血流(estcbf半影)以及被灌注的正常、半影和死亡脑组织体积(分别为estcv正常、estcv半影和estcv死亡),并且优选无需组织或静脉测量装置即可记录/用图形表示这些估算值。半影通常是指没有出现不可逆转损伤的缺血性组织。对此,系统既可以计算组织的血流,也可以计算该血流相关的组织的体积。在达到新温度平衡的控制冷却或复温过程(洗入和洗出)中,脑血流(ml/min)-时间图的坡度表示血流,而图下方区域示出组织体积或质量(ml,g)。这些数值的比表示脑血流(mm/100gr/min)。如本文所述,估算值可以从局部冷却中得到。因此,与局部冷却相关的组织体积可以是灌注组织体积(cv)。
cv可以作为(∫ir*t2-(ir平衡*t2平衡*平衡所需时间))/t1初始-tl平衡)的函数计算,直到δnvfr/δt=0,其中,ir为注入速度,规范到1℃的温度变化。也就是说,选出目标温度,之后冷却并计算所有ir*t2的总和,减去维持剂量ir平衡*t2平衡,直到δnvfr/δ时间达到0。这表示代表ir*t2随时间变化图曲线下方的面积,之后修正到1℃的温度变化。这是被灌注组织体积的热含量,并且,由于1ml组织每度含有1卡路里热量,该热含量接近被灌注组织的体积。t1是混合物温度,t2是注入液温度,t4是体温(℃),nvfr是原生血管流量,t是时间。cbf总可以通过在平衡状态下用admfr除以cv来计算。从器官(皮肤除外)传递热量几乎毫无例外地通过血流进行。此外,由于动脉和静脉之间密切关联,动脉温度、组织温度和静脉温度之间的关系几乎是不变的。因此,血流量约等于热传递量。高流量的大脑区域将迅速达到温度平衡,而低流量的大脑区域则相对较慢。达到新平衡温度的热传递是血流量的指数函数。
参见图4a-4b,双隔室模型(缺血性组织vs正常组织(或肿瘤组织vs正常组织)(黑框))表示以下假设:1)大脑与外部组织接近完全热隔离,2)动脉输入与静脉输出之间接近完全热流通,3)缺血性组织与正常组织之间只有微小的热流通,4)所有正常组织具有一个流量,所有缺血性组织具有第二流量,5)冷却阶段,与组织温度变化相关联的血流和热传递变化可以忽略,因为它们对系统的所有部分具有同等影响,以及6)死亡组织,即缺血性核心,对测量的影响最小化。应当注意,大多数类型的肿瘤具有与周围正常组织明显不同的血流,并且大多具有更高的血流。此外,与ia药物剂量密切相关,肿瘤通常具有与正常组织不同的分配系数,以及正常组织/血液屏障的破坏。
系统可以以多种方式计算estcbf正常、estcbf半影、estcbf缺血和estcv正常、estcv半影和estcv死亡,包括使用曲线剥离法和双隔室分析第一微分方程法。
曲线剥离法假设血管流量可以建模为两个指数之和,如c=c1exp(-λ1t)+czexp(-λzt)。具有下标z的值可以从曲线的末段部分计算,c是在任意特定时间t实际测得的流量。通过确定c1和λ1,可以通过分别计算c1和cz在t上的积分然后计算两个值的和,从而得出曲线(auc)下方的整个面积。
一般地,计算正常组织和半影组织特征的过程如下:i)可以使用大数值t处的梯度绘制流量的半对数图以确定末段消除常数λz;ii)末段直线可以投射回t=0,利用该线来计算真实数据存在的时间点的理论实际流量(即不录入);iii)可以计算c1=c-cz的值,其中,c为任意给定时间处的实际流量,cz为从末段计算得出的流量;iv)可以构造c1和t的半对数图,并从该线在小数值t处的梯度确定消除常数;以及v)可以利用auc=c1(t=0)/λ1+cz(t=0)/λz得出总auc。
此外,大脑产生的热量(cmr热量)等于:平衡状态下,离开大脑的热量-进入大脑的大脑热量。进入大脑的热量一般等于与动脉血流(adfr*t1)相关的热传递,根据连续性规律,进入大脑的血液体积等于从静脉侧离开大脑的血液体积。此外,从实验数据和pennes热量方程可知,静脉血温度基本恒定高于动脉血温度0.2~0.3℃。而且,有了之前计算得出的被灌注组织体积,可以估算被灌注组织体积的cmr:cmr热量=((adfr*(t1+.25))/cv)。
此外,已知cmr为常数,并且与温度和血流密切相关。在不同温度下的重复测量和/或与期望值的方差可以用于估算额外的有效度量,如estcmr热量-正常、estcmr热量-半影、(estcmr热量-肿瘤)等。
也可以得到温度的半影保留阈值(pst)(即降低半影代谢需求,从而使半影组织内的低血流(cbf半影)可以满足代谢需求的半影组织温度)——可以用参照表根据单个测量得出pst,也可以根据大脑目标温度反复逐渐降低(或升高)得到的测量得出。也就是说,可以选出目标温度,然后冷却并计算所有ir*t2的总和,直到δnvfr/δ时间达到0。在不同温度重复该过程,并确定每个温度的cbf。指数曲线与水平线之间的拐点为组织的半影保留阈值(pstmap)。
pst温度为估算半影组织体积为0时的温度。这是满足了代谢需求和组织血流的温度。具体地:当cv半影≥0时,pst温度=t1温度。(优选被estcv正常的明显增长抵消)。此外,也可以计算动脉压的半影保留阈值(pstmap)。为此,可以首先计算/测量半影组织的脑血管阻力(cvr半影)和正常组织的脑血管阻力。可以确定使cbf半影达到正常水平所需的map(pstmap)。实现这一点的一种方法是:cbf正常=map/cvr正常,并且cbf半影=map/cvr半影;而解出两边的map则得到:cbf正常*cvr正常=cbf半影*cvr半影;那么,cbf正常/cbf半影=cvr半影/cvr正常;cbf正常/cbf半影的比值(均如前所述确定)表示达到cbf正常必需的map变化百分比。由此,map优选调整用于icp,如果没有以其它方式主动监控或已知,正常组织中的icp约为10mmhg。在这一计算中,脑前阻力(进入大脑的插入血管)和脑血管阻力均为组织水平。pstmap测量值为一系列阻力的集合,第一个非常高,例如近侧阻塞,第二个最大程度地降低,作为缺血性毛细血管床。本文所述的pst温度的重复测量或药理测量可以在实验上支持pstmap的估算。在map确认计算以及引导治疗中,map可以在药理上操纵为增加。此外,氧气分压的psto2需要保持半影存活,本领域技术人员可以使用血氧含量方程计算psto2。之后,计算向组织输送必需量的氧气所需要的氧气分压增加。如果将高压氧视为治疗方法,这一测量预计是有效的。
优选如本文所述的大脑温度变化迅速发生,并且在不大量影响其它身体系统的情况下维持。例如,这可以通过直接将冷生理流体(如盐溶液)与血液在颈内动脉,即ica中混合,从而改变动脉输入温度(t动脉)有效实现。图4c-d示出大脑半球温度随着局部冷盐水灌注至身体同侧的ica内而变化的图形模拟。在该数学模拟中:绝热导管模型以5种不同的流速灌注冷流体。图4e示出人体研究的温度变化,其使用常规非绝热导管,冷流体注入速度为30ml/min,身体同侧的颈内静脉中发生温度变化。图4f示出猪的安全研究中,双侧大脑半球温度和体温随着每次人工控制,单侧、局部冷盐水注入ica中而变化。绝热导管以及流体通过导管的输送时间短可以仅允许与逆流主动脉血的最小热传递,并且使低温流体可以与ica中的血液混合。这样也可以使注入流体的体积最小化。这样,可以在几分钟内达到轻度至中度范围的任意大脑选择性低温温度。
由于运载“冷”血和“温”大脑组织的毛细血管之间的热传递迅速发生,优选精确控制动脉输入温度,使得大脑温度可以在几分钟内与其保持平衡。血管试验台模型试验的结果显示,虽然在37℃时模拟ica血流(原生血管流量,即nvfr)的变化范围较大,为80~250ml/min,本创新算法可以迅速达到目标动脉输入温度(t动脉)33℃,并将其精确地维持在平均32.95+0.36℃,如图4g-i所示。因此,控制器优选根据导管特定位置的温度测量值连续计算nvfr,并修改冷流体泵速,从而达到并维持t动脉。此外,动脉输入血细胞比容(局部血液稀释测量)保持在正常范围内,以确保保持足够氧化。图4g-i示出控制器用模拟血液循环(nvfr=ica为37℃时的原生血管流量)测试血管试验台模型的结果。在2-3分钟内达到33℃的目标动脉输入温度(t1)并精确保持。控制器算法根据图4h中测量的nvfr自动调节冷流体泵速。动脉输入血细胞比容(hct)保持在生理范围内(40%及以上)。如图4i所示的t1趋势显示,体温(t4)保持为几乎恒定。
参见图4j-o,人体大约10-15%的心脏输出用于脑循环(~800ml)。两个ica向脑前循环供血(每个250~300ml/min),并且两个椎动脉(va)连接至较小的脑后循环。虽然脑脉管系统通过willis环相互连接,但血管区域通常互不相同。整体上,脑灌注不会改变,虽然特定区域的局部水平活跃会导致rcmro2和rcbf暂时上升。因此,正常情况下,不管大脑活动状态如何,ica或va内的血流是恒定不变的。
但是,系统性的血气变化会改变脑灌注,例如,高碳酸血症或低氧血症会增加灌注,反之亦然。类似地,脑中动脉(mca)阻塞会导致身体同侧半球灌注减少,从而导致身体同侧ica血流减少(图4l-m)。可以计算氧代谢和热量洗出的对应值(图4j-o)。而且,对于动脉内冷却,进入所研究半球的侧支血流可以导致平衡持续时间延长,成比例的侧支血流(加上具有正常动脉血温度的另一散热项并乘以总流量分数)越大,持续时间越长(图4p-x)。总体来说,这意味着追踪ica血流(nvfr)会提供关于身体同侧脑前循环灌注的见解。每条曲线的坡度、时序和积分值可以互不相同。
图4j-o模拟了不同选择水平的大脑冷却状态下,大脑氧代谢的变化(j/k)、灌注变化(l/m)和热量洗出变化(n/o)。进行模拟的过程如下:500g大脑被灌注5个不同动脉输入温度(37.3℃~32.3℃)的血液;基准输入温度为37.0℃;10分钟内达到平稳阶段,这表示动脉血和大脑之间实现温度平衡。图c、e、g表示500克正常大脑;图d、f、g表示具有300克正常隔室和200克缺血性隔室的缺血性大脑;基准cmro2和缺血性cmro2分别为150μmolo2/100g/min和45μmolo2/100g/min,灌注分别为50ml/100g/min和5ml/100g/min。以下图表b示出正常大脑和缺血性大脑之间的直到平衡点的时间趋势差异。
图4p-x模拟示出选择性大脑不同冷却水平和不同血流侧支水平,30%(顶行)、70%(中行)和90%(底行)的大脑氧代谢的变化(p/q/r)、灌注变化(s/t/u)和热量洗出变化(v/w/x)。进行模拟的过程如下:500g大脑在5个不同动脉输入温度(37.3℃~32.3℃)下灌注血液;基准输入温度为37.0℃;达到平稳阶段,表示动脉血和大脑之间实现温度平衡。基准cmro2为150μmol/100g/min,灌注为50ml/100g/min。
来自缺血性脑半球的灌注数据包含来自两个主要隔室的信息;一个为正常隔室(pn),第二个为缺血性隔室(pi)。这两个指数阶段可以用对数图以线性方式曲线拟合。之后,快组份的y轴截距将给出pn的灌注值。总基准灌注与pn之间的差值表示缺血性灌注pi。可以计算灌注组织的体积(通过脑密度)和重量(pi/cbfi)。可以通过插入趋向于[r重量=正常大脑/缺血性大脑的极端重量比而变高的校正系数提高计算体积的精确度。
参见图5a,正常脑半球中的温度和脑血流量图示出,随着组织温度下降,脑血流以指数方式下降。在图5b中,缺血性半影组织温度和脑血流图示出,血管保持最大程度地扩张,直到温度下降至新温度调节的代谢和血流可以满足氧气需求的点。直到此时,血流保持不变(水平线部分)。该拐点(*)为温度的半影保留阈值pst。在该点之后,cbf再次随着温度下降呈指数下降。在图5c中,正常组织和半影组织的组合图示出同时具有正常组织和半影缺血性组织的大脑,曲线为两个图(5a和5b)的合成曲线。
因此,本申请允许根据实际代谢率和血流量确定抢救半影或缺血性大脑组织的温度阈值。组织温度进一步下降至阈值以下将提供图5d-e所示的低温保护,图5d-e示出半影/缺血性大脑组织的模拟温度阈值,其中【d】cmro2为75μmolo2/100g/min、【e】cbf为25ml/100g/min时是30℃,在温度阈值以下组织需求逐渐下降。缺血性大脑组织可以要求大脑冷却至深低温水平。本申请将允许基于图5f所示的实际生理组织参数安全地实现这一点,图5f示出cbf为25ml/100g/min,在温度阈值以下组织需求逐渐下降时的半影/缺血性脑组织的模拟温度阈值和cbf变化。
本专利公开的两个新生物标记用于以下状态:1)再灌注损伤和2)再灌注充血。两种状态都是在再灌注后出现血管阻塞的情况下出现。在临床上,这两种状态过去一直难以研究,因此整个范围及其相关内容均未充分理解。在实验上,虽然已经知道很多,但准确的机制仍然没有完全理解。它们被认为与功能障碍及随后引起损伤的血管内膜损伤相关,血管内膜损伤甚至会引起缺血性事件后的大多数损伤。人们一直在探索其治疗方法,包括降低体温。两种状态彼此关联。前者,再灌注损伤是血管和组织的累积损伤,其发生在导致缺血、水肿和细胞死亡增加的再灌注之后。高灌注(再灌注充血和过度灌注)和低灌注(灌注不足)阶段均在缺血性状态下再灌注后观察到。充血是血管流的初始短暂增加,之后回到更低、更正常的血流。这种状态可能有正常和病理型,并且与自动调节的变化相关。两个指标均与再灌注后立即测得的血流及之后一段时间的血流相关。均用于本专利所述的要计算的原生血管流nvfr,以计算再灌注充血指数和/或再灌注严重程度指数。再灌注充血指数可以通过再灌注后随后的峰值nvfr与即刻峰值的比来计算。结果越大,高灌注指数越严重。结果小于1表示错过再灌注测量或严重的再灌注损伤和无流量状态。再灌注严重程度指数可以通过即刻峰值nvfr与再灌注后随后的随时间调整的最低nvfr的比来计算。结果越大,高灌注严重指数越严重。第二次测量延迟的时间越长,就越可靠。当测量之间只有较短的时间间隔时,可以预计附加指数用于调节初始充血。
应当注意的是,虽然这些计算用于缺血性组织vs正常组织,但其同样可以用于肿瘤vs正常组织。此外,这些方法的用途可以应用于使用该装置和方法以类似方式确定脑血管储备(增加温度、降低hct等)。
血管相关的其它缺血性指数或一般情况可以用这一信息和实时评估进行推导。例如,t2中看到的振幅高度可变的短脉冲可以与之前直列式气泡检测器错过的air-emboli相关联。高频瞬变或峰值与热传导、蒸发、运动的变化及因微热电偶的微热惯性而识别的电解变化相关。独立微热电偶(0.003"x2)对此类扰动比较敏感,并且取决于液体,裸热电偶显著更敏感。热电偶越小,敏感度越高。
例如图6所示,本文中测量和/或估算的变量可以由系统收集并例如实时显示在显示器屏幕上。参见图6,界面屏幕可以显示各种变量,如日期、时间、病人编号(id)和名字。例如,利用插入装置上的一个或多个传感器或以其它方式,屏幕可以进一步显示所获取的病人的生理变量,如平均动脉压(map)、动脉管路压(a-line压)、体温、器官(大脑)温度等。显示器也可以包括,例如,用箭头表示大脑温度和/或体温随时间升高或降低的示出变量趋势的图形。系统优选显示目标设置和操作参数。例如,可以设定/确定目标温度和达到目标温度的时间,以及与灌注体积、持续时间和速度相关的参数,并显示在界面屏幕上。重要的是,系统实时显示计算的变量,如cbf、cvr、cmr或本文公开的任意其它变量。在局部冷却正在进行的情况下,如图6所示,可以用高亮的大脑半球表示器官和被灌注的部分器官图。在优选实施例中,系统计算estcv半影、estcv正常和/或estcv死亡,并将这些变量实时显示在显示器上。如上所述,随着大脑温度接近pst,estcv半影将接近0。例如,当estcv正常接近最大值550ml时,显示器上显示的150ml会实时下降至低至0ml。示出正常和半影相对体积的图会优选自动调整以反映上述灌注引发温度变化期间的成比例变化。最后,收集的数据可以由系统用于自动识别具体状态和这些状态在显示器屏幕中的图,如改变。
如上所述,本文公开的系统可以在动脉内药物输送期间以最终控制药物效果vs毒性。可以由此控制多个变量,包括药物剂量、血液灌注温度和hct,这接着又会影响血流、药物浓度和组织代谢率。也就是说,冷却导管可以放置在血管区域将要给药的血管内。使用上述系统询问所述区域以获得血管血流、温度、cbf总(如果可以,cbf正常vscbf病理)、cmr和混合物hct的基准值。
药物有效性vs毒性由目标的药物剂量部分确定,这接着又会受许多变量影响,包括药物输送半衰期、摄取分数和具体组织药物毒性。通过引发动脉内药物管理之前器官生理特征的期望变化,本文所公开的系统可以解决动脉内药物输送期间的这三个问题。具体地,可以根据药物瞬变时间、tt、表膜渗透性(smp)、动脉到静脉的药物浓度差(△av)和分配系数(pc)通过下述方式确定摄取分数(ef):
ef=∫0ttt(smp)(δav)(pc)
因此,本文所述的系统可以通过操纵tt和△av中的至少一个来控制ef。此外,也可以通过由组织温度的相应降低而引起的器官代谢率降低来缓解药物毒性。最后,可以操纵药物剂量、血液灌注温度和hct,从而操纵血流、药物浓度和组织代谢率。
通过以下实例描述本发明,提出这些实例的目的在于帮助理解本发明,且这些实例不应被理解为以任何方式限制由所附权利要求书限定的本发明的范围。
实例1
在一个实施例中,一旦导管放置就位,如放置在颈内动脉(ica)中,所述系统将必要地立即提供以下信息:t1(冷却灌注前的局部血液温度);t4(核心体温);ap(与a-line压监测器相关联的动脉血压);map(随时间变化从ap计算得到的平均ap:map=[(2x心脏舒张压)+心脏收缩压]/3)。
以下信息可以在冷却灌注的很短时间(几秒)内得到:冷却灌注温度(t输入);冷却灌注流量(ir)和体积(infv);t1(混合物温度);t2(远侧冷却灌注温度);t4(核心体温);ap(与a-line压监测器相关联的动脉血压);map(随时间变化从ap计算得到的平均ap:map=[(2×心脏舒张压)+心脏收缩压]/3);nvfr(例如ica、mca、aca、pca等的原生血管流量,热稀释法);以及nvr(原生血管阻力:nvr=map/nvfr)。
为了诊断,如果基准为37.5℃,器官,如大脑的目标温度将设置为下降2℃,即35.5℃。之后,控制器可以将冷却流体注入大脑中,从而冷却器官组织。目标温度不会一步达到,而是分成几步,例如每次0.5℃。在每一步中,控制器根据测得的nvfr调整inffr,直到nvfr在达到器官目标温度的点保持恒定(混合物和目标器官之间达到温度平衡)。在该点处可以确定总冷却量(负卡路里)。
潜在的生理原则是:cbf(脑血流)由cmro2(脑氧代谢)确定,cmro2由温度确定。x=时间(分或秒)并且y=估算器官温度(℃)的图是由cmro2、cbf和脑灌注部分(组织体积)的温度确定的指数衰减函数。cmro2、cbf和大脑温度的正常值是已知的。混合物温度和体积也是已知的。以下附加信息可以在冷却灌注至器官-血管区域如大脑的短时间(<1-3分钟)内获得:将组织冷却至已知温度所需要的总冷却量((-)cal);灌注体积的组织热含量(hc组织);灌注组织体积(v组织);估算cbf组织;灌注组织的估算cmro2组织和cmrglu组织(脑葡萄糖代谢);以及粗略估算的cvr(脑血管阻力):cvr=cbf/map。
对于治疗程序,例如急性缺血性脑卒中的治疗程序,这些信息可以在一个序列中获取。如果基准为37.5℃,目标温度将设置为下降5℃,即32.5℃。之后,控制器将冷却流体注入大脑中,从而冷却器官组织。目标温度可以一步达到:将t1保持在目标温度,直到nvfr恒定并在达到器官目标温度的点处保持恒定(混合物和目标器官之间达到温度平衡)。这遵循以下生理原则:cbf(脑血流)由cmro2(脑氧代谢)确定,而类似地,cmro2由温度确定。x=时间(分或秒)并且y=估算器官温度(℃)的图是由cmro2、cbf和脑灌注部分(组织体积)的温度确定的指数衰减函数。cmro2、cbf和大脑温度的正常值是已知的。混合物温度和体积也是已知的。以下附加信息可以在冷却灌注至器官-血管区域,如大脑的短时间(<1-3分钟)内获得:灌注体积的组织热含量(hc组织);估算组织体积(v组织);估算cbf组织;灌注组织的估算cmro2组织和cmrglu组织(脑葡萄糖代谢);以及粗略估算的cvr(脑血管阻力):cvr=cbf/map。
在治疗结束时,可以在顺序步骤中允许大脑回到基准。如果基准为32.5℃,大脑目标温度可以设置为例如增加1℃,即33.5℃。之后,控制器可以将冷却流体注入大脑中,并允许大脑复温。目标温度不会一步达到,而是分成几步,例如每次0.5℃。在每一步中,控制器根据测得的nvfr调整inffr,直到nvfr在达到器官目标温度的点保持恒定(混合物和目标器官之间达到温度平衡)。在该点处,确定所需的总冷却量。这遵循以下生理原则:cbf(脑血流)由cmro2(脑氧代谢)确定,而cmro2由温度确定。x=时间(分或秒)并且y=估算器官温度(℃)的图是由cmro2、cbf和脑灌注部分(组织体积)的温度确定的指数衰减函数。cmro2、cbf和大脑温度的正常值是已知的。可以从这一数据中确定半影保留阈值pst。这是基于以下原则:随着温度下降,代谢率下降,血液需求成比例下降。在温度足够低的情况下,形成足够低的血液代谢需求——供应的血液足够维持生理代谢——从而使代谢半影免受缺血性损伤。
虽然为了清晰和理解起见对上述发明进行了一些详细描述,但本领域技术人员应当理解,通过阅读本公开,可以进行各种形式和细节的改变而不脱离本发明的实质范围。
- 还没有人留言评论。精彩留言会获得点赞!