用于治疗自闭症谱系障碍及相关症状的方法与流程
本申请要求于2015年5月22日提交的美国临时专利申请nos.62/165,556的优先权,其全部内容通过引用合并于此。
背景技术:
本公开涉及治疗自闭症谱系障碍(asd)的方法。自闭症谱系障碍(asd)是一种复杂的神经发育状态,其特征是广泛存在的社会交往和交往异常,以及受限的兴趣和重复行为。asd通常出现在生命的头三年,表现为特征性症状或行为特征。现在asd的诊断包括以前被单独诊断的几种情况:自闭症障碍、待分类的广泛性发育障碍(pdd-nos)和阿斯伯格症。如美国精神病学会精神障碍诊断与统计手册第五版(dsm-v)中提出的自闭症谱系障碍的诊断标准现在涵盖了所有这些情况。
除了这些主要诊断标准中所见的一系列症状外,asd患者还表现出各种各样的神经系统合并症,包括智力障碍、癫痫、焦虑和情绪障碍,以及非神经系统合并症,包括血液高胆固醇血症、免疫失调和gi功能障碍(例如,慢性便秘、腹泻、腹痛和胃食管反流)。
迄今为止,还没有fda批准的减少或消除自闭症谱系障碍症状的方法。只有fda批准用于治疗自闭症的两种药物,利培酮(以
附图简述
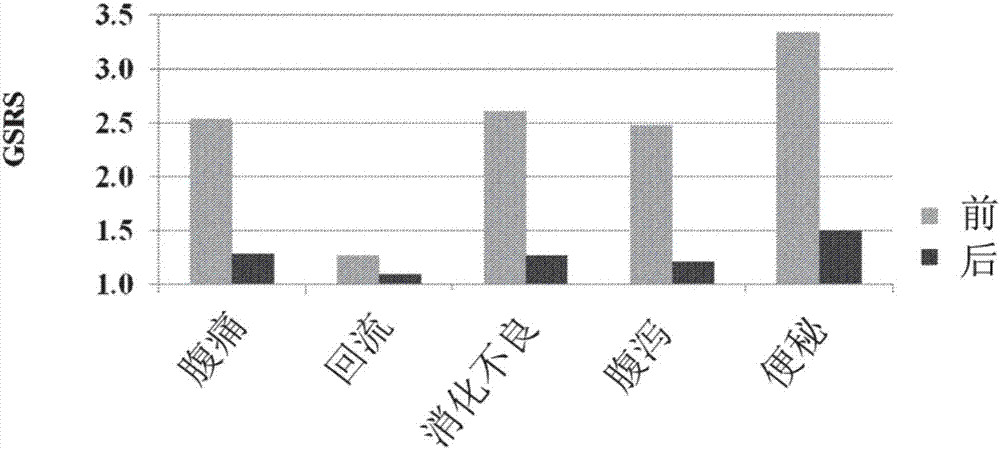
图1呈现试验参与者的胃肠道症状评定量表(gsrs)数据。
图2展示了在mtt治疗之前(“之前”)和之后(“之后”)收集的gsrs子量表数据。
图3显示参与者的平均gsrs分数和平均pgi-r分数的连续改进。
图4给出mtt试验参与者的异常行为清单(abc)数据。
图5呈现治疗后8周收集的gsrs评分。
图6是显示了年龄与cars评分改善程度之间缺乏相关性的图。
图7是表明治疗结束pgi-r评分与年龄几乎没有关系的图。
图8是显示了cars改善程度与初始gsrs评分之间缺乏相关性的图。
图9(包括图a到e)描述了用mtt治疗的18名asd患儿的gi-和核心asd-相关症状的改善。患儿接受万古霉素治疗2周,随后给予粪便菌组合物治疗8周,治疗结束后8周进行一次随访评估。帕尼拉、gsrs评分改变。gsrs得分从1(无症状)到7(非常严重的不适)的李克特量表得分。panelb、pgi-r评分的变化(整体孤独症/相关症状)。与基线比较,pgi-r从-3(更差)、-2(差)、-1(稍差)、0(不变)、1(稍好)、2(好)到3(好得多)。panelc、cars评估治疗前、治疗后和治疗8周后。paneld、总srs评估治疗前、治疗后和治疗8周后。panele、总abc评估治疗前、治疗后和治疗8周后。数据点代表18个人的参与者,一些数据点在箱形图中重叠。星号(位于方块的顶部)表示个人(在每个时间点)自治疗前(第0周)是否显着减少。ns:不显着,*:p<0.05,**:p<0.01,***:p<0.001(双尾配对t检验)。定义gsrs评分改善少于50%的两个参与者作为无应答者,并以灰色进行颜色编码。
图10(包括图a至c)提供了gsrs组成部分的分类和患者的改善。a:gsrs分值在基线,mtt治疗结束和治疗8周后。b:每日大便记录结果,平均2周以上。c:abc与时间的分量。*:p<0.05,**:p<0.01,***:p<0.001(双尾配对t检验)。
图11显示了gsrs和pgi-r之间的相关性(基于图10中小组a和b所示的数据)。pearson相关性检验显示r=-0.56和p<0.001。
图12显示了不同分量表的vineland发育年龄(以年为单位)和所有分量表的平均值,在基线和4个月后的观察结束时测量。请注意,治疗开始时的平均年龄为10.9岁,所以在基线时,所有领域都有延迟,特别是在语言和社交(人际)能力的核心自闭症领域。*:p<0.05,**:p<0.01,***:p<0.001(双尾配对t检验)。
图13显示治疗结束时(第10周)pgi-r的分数。规模从3(更好)到2(更好)到1(稍好)到0(没有改变)到-3(更差)。在没有治疗8周后(第18周),评分相似。数据点代表18个人的参与者,一些数据点在箱形图中重叠。
发明概述
本申请提供了一种在需要的受试者中治疗自闭症谱系障碍(asd)的方法,该方法包括给受试者施用有效治疗asd的量的药物组合物,其中药物组合物包含粪便微生物制剂,其中与试验开始前相比,受试者显示出治疗后严重程度降低至少10%,并基于选自由儿童孤独症评定量表(cars)、儿童孤独症评定量表2-标准格式(cars2-st)、儿童孤独症评定量表2-高功能(cars2-hf)、异常行为清单(abc)、社会响应量表(srs)和文兰适应行为量表ii(vabs-ii)组成的组中的评估系统。
本发明还提供了一种在自闭症人类受试者中减少自闭症严重程度的方法,该方法包括或基本由以下步骤组成:向自闭症人类受试者施用抗生素;受试者将自闭症人类受试者送到清肠;和向所述人类受试者施用粪便微生物群制剂,其中与所述方法之前相比,所述人类受试者在所述方法之后严重程度显着降低。
本文进一步提供了用于治疗有需要的人类受试者中的自闭症谱系障碍(asd)的方法,其中所述方法包括或基本上由向人类受试者施用包含粪便微生物或粪便微生物群的治疗性组合物组成,其中所述人类受试者表现出由cars、cars2-st、cars2-hf、abc、srs或vabs-ii评估的至少10%或20%的自闭症症状严重程度减少(相对于开始治疗之前评估的严重程度),其中人类受试者进一步表现出胃肠道(gi)症状,并且通过胃肠道症状评定量表(gsrs)评估,胃肠道症状严重程度降低至少40%(相对于开始治疗之前评估的严重程度)。
本发明还提供了一种在需要的人类受试者中治疗自闭症谱系障碍(asd)的方法,该方法包括或基本上由以下步骤组成:向人类受试者口服抗生素;受试者将人类受试者改为清肠;和向人类受试者施用包含粪便微生物或粪便微生物群的治疗组合物,其中所述人类受试者表现出由cars、cars2-st、cars2-hf、abc、srs或vabs-ii评估的至少10%或20%的自闭症症状严重程度减少(相对于开始治疗之前评估的严重程度),其中人类受试者进一步表现出胃肠道(gi)症状,并且通过胃肠道症状评定量表(gsrs)评估,胃肠道症状严重程度降低至少40%(相对于开始治疗之前评估的严重程度)。
另一方面,本公开还公开了粪便微生物或粪便微生物群制剂在制备用于治疗有需要的受试者中的自闭症谱系障碍(asd)的药物中的用途,其中与试验开始前相比,受试者在治疗之后严重程度减少了至少10%,并且基于从由儿童孤独症评定量表(cars)、儿童孤独症评定量表2-标准格式(cars2-st)、儿童孤独症评定量表2-高功能(cars2-hf)、异常行为清单(abc)、社会响应量表(srs)和文兰适应行为量表ii(vabs-ii)组成的组中选择的评估系统。
本发明还公开了粪便微生物或粪便微生物群制剂在人类受试者需要治疗自闭症谱系障碍(asd)中的用途,其中所述人类受试者还表现出胃肠道(gi)症状,其中治疗包括或主要由以下组成:向人类受试者施用抗生素;受试者将人类受试者改为清肠;和向人类受试者施用包含粪便微生物或粪便微生物群的治疗组合物,其中所述人类受试者表现出由cars、cars2-st、cars2-hf、abc、srs或vabs-ii评估的经过不到12周的治疗的至少10%或20%的自闭症症状严重程度减少(相对于开始治疗之前评估的严重程度),其中胃肠道(gi)症状通过gsrs评估,经过不到12周的治疗,胃肠道症状严重程度降低至少40%(相对于开始治疗之前评估的严重程度)。
发明详述
除非另外定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同的含义。
本说明书中提及的所有出版物、专利和专利申请通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请被明确地和单独地指出以引用的方式并入。
如本文和所附权利要求书中所使用的,除非上下文另外明确指出,否则单数形式“一”、“一个”和“该”包括复数指示物。如本文所用,术语“基本上”如例如短语“基本上所有阵列肽”是指至少90%、优选至少95%、更优选至少99%、并且最优选在至少99.9%的阵列的肽。术语“基本”的其他用途涉及类似的定义。
在提供一定范围的值的情况下,可以理解的是,在该范围的上限和下限之间的每个中间值以及在该范围内的任何其他规定值或中间值被涵盖在本公开内。这些较小范围的上限和下限可以独立地包括在较小的范围内,并且也包括在本公开内,受试者在所述范围内的任何具体排除的限制。在所述范围包括一个或两个限制的情况下,排除这两个限制的范围也包括在本公开内容中。
如本文所用,术语“治疗”是指(i)完全或部分抑制疾病、障碍或病症,例如阻止其发展;(ii)完全或部分缓解疾病、障碍或病症,例如引起疾病、障碍和/或病症的消退;或(iii)完全或部分地预防可能易患疾病、障碍和/或病症但尚未诊断出患有疾病、障碍或病症的患者。类似地,“治疗”是指治疗性治疗和预防性或预防性措施。在自主谱障碍的情况下,“治疗”包括与自闭症谱系障碍相关的一种或多种症状的缓解、改善、延迟发作、抑制进展或减轻严重程度。
如本文所用,“受试者”可以是人或动物,包括但不限于狗、猫、马、牛、猪、绵羊、山羊、鸡、啮齿动物,例如大鼠和小鼠,以及灵长类动物,例如猴子。首选受试者是人类受试者。人类受试者可能是儿童、成人或老年受试者。
如本文所用,“微生物群”和“菌群”是指可持续地和暂时地存在于受试者身体内或上的微生物群落,包括真核生物、古细菌、细菌和病毒(包括细菌病毒(即噬菌体))。“粪便微生物群”或“粪便微生物群的准备”是指受试者的粪便中存在或准备的微生物群落。非选择性粪便微生物群是指粪便微生物来源于供体粪便样本的群落或混合物,其没有选择,并且基本上类似于粪便样本中发现的微生物成分和种群结构。
如本文所用,“治疗有效量”或“药学活性剂量”是指有效治疗所述疾病、障碍或病症的组合物的量。
如本文所用,“分离的”或“经纯化的”是指已经(1)从最初产生时与其相关的至少一些组分分离的细菌或其他实体或物质(无论是在自然界还是在实验环境中),和/或(2)由人工制造、制备、经纯化和/或制造。分离的或经纯化的细菌可以从与他们最初关联的至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或更多的其他组件分离。
如本文所用,关于细菌或任何其他生物体或实体的术语“非致病性的”包括不能够引起或影响包含该生物体或实体的宿主生物体的疾病、障碍或病症的任何此类生物体或实体。
如本文所用,“孢子”或“孢子”群体包括通常可行的细菌(或其他单细胞生物体),比相同细菌的营养形式更耐环境影响,例如热和杀菌剂,并且通常能够发芽和向外生长。“孢子形成者”或能够形成孢子的细菌是那些含有在合适的环境条件下产生孢子的基因和其他必需的能力的细菌。
如本文所用,“集落形成单位”(cfu)是指估计给定样品中活微生物细胞的数目。可通过计数琼脂平板上的集落数来评估cfu的数目,与用标准方法确定样品中活细菌细胞的数量一样。
如在此使用的,“可行的”是指具有繁殖能力。细菌种群的生存能力可以作为细胞膜完整性的函数来监测。膜损伤的细胞被认为是死亡或死亡,而具有完整膜的细胞被认为是活的。例如,syto9和碘化丙啶被用来染色和分化活的和死的细菌。参考stocks,cytometrya.2004oct;61(2):189-95。还可以通过分子活力分析来评估细胞活力,例如基于pcr的方法,其可以将与活细胞相关的核酸与与失活细胞相关的核酸区分开。参考cangelosi和mescheke,applenvironmicrobiol.2014oct;80(19):5884-5891。
如本文所用,“香农多样性指数”是指考虑到存在于给定群落中的物种的丰度和均匀性的多样性指数,使用公式
如本文所用,“抗生素”是指用于通过杀死细菌来治疗和/或预防细菌感染、抑制细菌生长或降低细菌存活力的物质。
自闭症谱系障碍(asd)是一种神经发育障碍,其特征是社会交往和沟通障碍、兴趣受限和重复行为。孤独症谱系的个体经历了从轻微到严重不同程度和类型的损伤。尽管鼓励早期发现和干预以最大限度地获益并减轻症状的严重程度,但任何年龄的个体都可以从可以减轻症状、提高技能和能力的干预和治疗中受益。本文所述方法的适当受试者包括但不限于诊断为患有或怀疑患有自闭症谱系障碍的人。在一些情况下,本文提供的方法的适当的受试者被认为处于发展asd的风险增加(例如中等或高风险)。在某些情况下,受试者被诊断为符合dsm-v中规定的asd诊断标准。在其他情况下,受试者对自闭症障碍、阿斯伯格障碍或待分类的广泛性发育障碍(pdd-nos)具有完善的dsm-iv诊断。
本文提供的方法导致或旨在实现asd的包括但不限于一种或多种指标或症状的可检测的改善,包括但不限于眼动追踪、皮肤电导和/或响应视觉刺激的eeg测量、参与和应对社会交往的困难、言语和非言语交流问题、重复行为、智力障碍、运动协调困难、注意力问题、睡眠障碍和胃肠道干扰等身体健康问题。
本领域已知用于评估受试者的社交和交流发展的一些筛选工具,因此可用作筛选和检测交流技能、社交互动以及自闭症谱系障碍的行为特征的受限的、重复的、刻板的模式的严重程度的变化。评估可以包括神经和遗传评估,以及深入的认知和语言测试。为诊断和评估孤独症而特别制定的其他措施包括自闭症诊断面试-修订(adi-r)、自闭症诊断观察时间表(ados-g)和儿童自闭症评定量表(cars)。
根据cars的资料,评估人员对受试者的评分从1到4分为15个等级:与人有关;仿制品;情绪反应;身体使用;对象使用;适应变化;视觉响应;听力反应;味觉、嗅觉和触觉反应和使用;恐惧;口头交流;非口头交流;活动;智力反应的水平和一致性;和一般印象。
schopler等人开发了cars的第二版,称为儿童孤独症评定量表-2或cars-2(childhoodautismratingscale-secondedition(cars2):manual.losangeles:westernpsychologicalservices,2010)。原来的cars主要是与具有合作病态智力功能的个体共同开发的,并且因为没有准确地识别具有asd的高功能个体而受到批评。cars-2保留了原来的cars表格,供年轻或功能较低的个人使用(现在更名为“标准表格”cars2-st),还包括一个单独的评估量表,用于较高功能的个人(称为“高功能”的cars2-hf)和一个判定cars2st和cars2-hf等级的无用的信息收集量表(“家长或照顾者问卷”或cars2-qpc)。
根据本文提供的方法,在治疗之前、之中或之后评估症状严重程度变化的另一症状评级工具是异常行为清单(abc)。参考aman等人的psychometriccharacteristicsoftheaberrantbehaviorchecklist.amjmentdefic.1985mar;89(5):492-502。abc是一个症状评估清单,用于评估和分类各种环境中儿童和成人的问题行为。abc包括58个项目,分解成五个分量表:(1)烦躁/激动、(2)嗜睡/社交退缩、(3)刻板行为、(4)多动/不依从、(5)不恰当的言语。
本发明人观察到,与神经型个体相比,自闭症个体不论是否存在合并胃肠道窘迫,都具有较少的肠道细菌种类。本发明人还发现恢复肠道细菌的物种多样性有助于治疗有需要的患者的自闭症症状。在一个方面,本申请提供了用于治疗有需要的受试者中的自闭症谱系障碍(asd)的方法,所述方法包括向受试者施用有效治疗asd的量的药物组合物,其中所述药物组合物包含粪便微生物制剂,其中所述受试者在治疗后与治疗前相比表现出asd症状严重程度减轻至少10%。在一方面,用儿童孤独症评定量表(cars)评估asd症状严重程度。另一方面,asd症状严重程度通过儿童孤独症评定量表2-标准表(cars2-st)评估。另一方面,asd症状严重程度通过儿童孤独症评定量表2-高功能(cars2-hf)来评估。一方面,asd症状严重程度由异常行为清单(abc)评估。另一方面,asd症状严重程度由社会响应量表(srs)评估。另一方面,asd症状严重程度是由文兰适应行为量表ii(vabs-ii)评估。在一个方面,基于莱特国际性能量表(leiterinternaticnalperformancescale)(参考roid,g.h.,&miller,l.j.(1997).leiterinternationalperformancescale-revised.wooddale,il:stoelting),在一个asd患者中治疗导致至少10%、20%、30%、40%、50%、60%、70%、80%或90%的改善。另一方面,在治疗至少8、16、24、32、40、50、60或80周后测量莱特得分改善,并与治疗前的莱特得分进行比较。
本领域的普通技术人员理解,前述评估系统仅仅是用于评估asd相关的社交和认知症状的示例性工具。可以使用或设计其他类似的工具来评估核心asd相关症状。例如,在一个方面,基于孤独症治疗评估清单(atec),治疗导致至少10%、20%、30%、40%、50%、60%、70%、80%或90%的改善。参见rimland和edelson的autismtreatmentevaluationchecklist:statisticalanalyses.autismresearchinstitute2000。另一方面,根据广泛的发展障碍行为量表(pdd-bi),治疗导致至少10%、20%、30%、40%、50%、60%、70%、80%或90%的改善。参考cohenet等人的thepddbehaviorinventory:aratingscaleforassessingresponsetointerventioninchildrenwithpervasivedevelopmentaldisorder.jautismdevdisord.200333(1):31-45。在另一方面,基于自闭症量表(sas)的严重程度,治疗导致至少10%、20%、30%、40%、50%、60%、70%、80%或90%的改善。参考adams等人的theseverityofautismisassociatedwithtoxicmetalbodyburdenandredbloodcellglutathionelevels.jtoxicol.2009,2009:532640。另一方面,基于aman等人在outcomemeasuresforclinicaldrugtrialsinautism,cnsspectr.9(1):36-47(2004)所述的任何一种系统或量表评估自闭症相关症状或症状严重程度降低的改善。在另一方面,基于表1中列出的任何一种症状表征系统评估自闭症相关症状的改善或严重程度减轻的症状。在一个方面,在任何一种前述系统中的症状改善是在治疗至少8、16、24、32、40、50、60或80周测得,并与治疗前的莱特得分进行比较。在一个方面,在停止治疗至少2、4、6、8、10或更多周后,测量任何一种前述系统的症状改善,并与治疗前的测量值进行比较。
表1:可用于监测核心asd相关社会和认知症状的选定结局指标。
在一个方面,与起始治疗之前相比,在治疗2周或更多周后,治疗达到asd症状严重程度降低至少10%、20%、30%、40%、50%、60%、70%、80%或90%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。在一个方面,与起始治疗之前相比,在治疗4周或更多周后,治疗达到asd症状严重程度降低至少10%、20%、30%、40%、50%、60%、70%、80%或90%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。在一个方面,与起始治疗之前相比,在治疗6周或更多周后,治疗达到asd症状严重程度降低至少10%、20%、30%、40%、50%、60%、70%、80%或90%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。在一个方面,与起始治疗之前相比,在治疗8周或更多周后,治疗达到asd症状严重程度降低至少10%、20%、30%、40%、50%、60%、70%、80%或90%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。
另一方面,与起始治疗之前相比,在治疗8周或更多周后,治疗达到asd症状严重程度降低10%至20%、10%至30%、10%至40%、10%至50%、10%至60%、10%至70%、10%和80%、10%和90%、20%至30%、20%至40%、20%至50%、20%至60%、20%至70%、20%至80%、20%至90%、30%至40%、30%至50%、30%至60%、30%至70%、30%至80%、30%至90%、40%至50%、40%至60%、40%至70%、40%至80%、40%至90%、50%至60%、50%70%、50%-80%、或50%-90%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。另一方面,与起始治疗之前相比,在治疗8周或更多周后,治疗达到asd症状严重程度降低10%至90%、20%至80%、30%至70%、或40%至60%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。另一方面,与起始治疗之前相比,在治疗12周或更多周后,治疗达到asd症状严重程度降低10%至90%、20%至80%、30%至70%、或40%至60%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。另一方面,与起始治疗之前相比,在治疗18周或更多周后,治疗达到asd症状严重程度降低10%至90%、20%至80%、30%至70%、或40%至60%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。另一方面,与起始治疗之前相比,在治疗24周或更多周后,治疗达到asd症状严重程度降低10%至90%、20%至80%、30%至70%、或40%至60%,其中通过选自由cars、cars2-st、cars2-hf、abc、srs和vabs-ii组成的方法评估asd症状严重程度。
在一个方面,治疗实现了asd症状严重程度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的减少,并且在中止治疗后至少8、12、16、20、24或28周基本上保持症状严重程度降低,其中通过cars评估asd症状严重程度。在一个方面,治疗实现了asd症状严重程度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的减少,并且在停止治疗后至少8、12、16、20、24或28周基本上保持症状严重程度降低,由cars2-st评估asd症状严重程度。在一个方面,治疗实现了asd症状严重程度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的减少,并且在停止治疗后至少8、12、16、20、24或28周基本上保持症状严重程度降低,其中通过cars2-hf评估asd症状严重程度。在一个方面,治疗实现了asd症状严重程度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的减少,并且在中止治疗后至少8、12、16、20、24或28周基本上保持症状严重程度降低,其中通过abc评估asd症状严重程度。在一个方面,治疗实现了asd症状严重程度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的减少,并且在中断治疗后至少8、12、16、20、24或28周基本上保持症状严重程度降低,其中通过srs评估asd症状严重程度。在一个方面,治疗实现了asd症状严重程度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%的减少,并且在中止治疗后至少8、12、16、20、24或28周基本上保持症状严重程度降低,其中通过vabs-ii评估asd症状严重程度。
一方面,正在治疗的asd受试者在起始治疗之前没有表现出胃肠道(gi)症状。另一方面,正在治疗的asd受试者在治疗开始之前表现出一种或多种胃肠道症状。一方面,与起始治疗之前相比,正在治疗的asd受试者表现出治疗后gi症状严重程度减少至少20%、30%、40%、50%、60%、70%、80%或90%。一方面,gi症状严重程度由胃肠道症状评分量表(gsrs)评估。另一方面,与起始治疗之前相比,在治疗8周或更多周后,治疗达到asd患者的gi症状严重程度降低20%至30%、20%至40%、20%至50%、20%至60%、20%至70%、20%至80%、20%至90%、30%至40%、30%至50%、30%至60%、30%至70%、30%至80%、30%至90%、40%至50%、40%至60%、40%至70%、40%至80%、40%至90%、50%至60%、50%70%、50%-80%、或50%-90%,其中gi症状严重程度由胃肠道症状评分量表(gsrs)评估。
在一个方面,严重程度症状的减轻(例如,对于asd症状、gi症状或两者)在治疗期间持续性或在完成或中断治疗后维持。在一个方面,在治疗期间或治疗后的特定时间点评估严重程度症状的减轻(例如,对于asd症状、gi症状或两者),例如治疗开始后约2、4、6、8、12、18、24、32、40、48周,或治疗结束或停止后约2、4、6、8、12、18、24、32、40、48周。
在一个方面,一种方法进一步包括在施用包含粪便微生物制剂的药物组合物之前向受试者施用抗生素。另一方面,一种方法进一步包括将受试者受试者送至清肠。
另一方面,本文使用的药物组合物包含非选择性且基本上完全的粪便微生物群,所述粪便微生物群补充有一种或多种选自以下的活的非致病性微生物:普氏菌(prevotella)、脱硫弧菌(desulfovibrio)、粪球菌(copprococcus)和梭菌(clostridium)。另一方面,本文使用的药物组合物包含预定菌群的合成粪便组合物。另一方面,本文中使用的药物组合物包含预定菌群,其包含一种类似于正常的健康人粪便菌群的活菌群比例含量的制备并且不包含抗生素抗性群体。另一方面,本文使用的药物组合物以选自胶囊、片剂、粉末和颗粒的固体剂型给药。另一方面,本文使用的药物组合物被配制为耐酸性胶囊。
另一方面,本文提供了一种治疗人类受试者自闭症谱系障碍的方法。在示例性方面,该方法包括或基本由以下步骤组成:向人类受试者施用抗生素;受试者将人类受试者改为清肠;并将经纯化的粪便微生物群施用于人类受试者,其中人类受试者处理自闭症谱系障碍。
在示例性的方面,治疗asd包括减轻、改善、延缓一个或多个、两个或更多、三个或更多、四个或更多、五个或更多、六个或更多、7个或更多、8个或更多的asd特征症状的严重程度。在一个方面,治疗减轻、改善、延迟一种或多种社交和认知核心asd相关症状的严重程度的发作,抑制其发展,或降低严重程度。在一些方面,症状选自由以下组成的组:(i)坚持相同或抵制改变;(ii)难以表达需求;(iii)重复单词或短语以取代正常的、反应敏捷的语言;(iv)大笑、哭闹、以其他原因不明显的原因表示痛苦;(v)喜欢单独或超然的态度;(vi)发脾气;(vii)难以与他人混合;(viii)可能不想拥抱或拥抱;(ix)很少或没有眼神接触;(x)对正常的教学方法没有反应;(xi)持续奇怪的表演;(xii)明显的过度敏感或对疼痛不敏感;(xiii)很少或没有真正的危险担心;(xiv)明显的身体过度活动或极度活动不足;(xv)粗糙/精细运动技能不均匀;和/或(xvi)对口头提示的不响应。在一些方面,症状选自强迫行为、仪式行为、受限行为、刻板印象、同一性或自我伤害。这里描述的方法可以导致前述症状的任何组合的改善。
在示例性方面,人类受试者表现出根据asd评定量表评估的严重程度的显着降低。在某些情况下,例如,人类受试者表现出自严重症状严重程度至少降低10%或20%,如儿童自闭症评定量表(cars)相对于严重程度而言在开始该方法起始之前评估。
根据本文提供的方法适合于治疗的受试者在本文提供的方法开始之前可能不存在或报告胃肠道窘迫症状。在一些情况下,例如,根据本文提供的方法适合于治疗的人类受试者在治疗开始之前或之时没有表现出胃肠道症状。在一个方面,本文治疗的asd受试者表现出选自腹痛、反流、消化不良、肠易激综合征、慢性持续性腹泻、腹泻、肠胃气胀、便秘、便秘/腹泻交替的一种或多种或两种或多种胃肠道症状。
无论存在或不存在胃肠道窘迫症状,与神经型人相比,适用于本文提供的方法的人类受试者通常在所述治疗方法之前具有明显更少的肠道细菌种类。在一些情况下,与神经型人相比,通过该方法处理的人类受试者在施用经纯化的粪便微生物群剂量前表现出至少约20%、30%、40%、50%、60%、70%,80%或90%较少种类肠道细菌。
本文还提供了用于减少自闭症人类受试者中的自闭症严重程度的方法。在示例性方面,该方法包括或基本上由以下步骤组成:向自闭症人类受试者口服施用不可吸收的抗生素;受试者将自闭症人类受试者送到清肠;并且将经纯化的粪便微生物群从神经型人类供体输送到人类受试者,其中相比于之前的方法,人类受试者在之后的方法显示出根据儿童自闭症评定量表(cars)评估的严重程度显着降低。在某些情况下,人类受试者表现出的自闭症症状严重程度至少减少了10%或20%,如儿童自闭症评分量表(cars)所评估的那样(相对于用之前起始的方法评估的严重程度)。
一方面,本文所述方法中使用的粪便微生物群制剂包含供体的完整或基本完整的微生物群。一方面,粪便微生物群制剂包含非选择性粪便微生物群。另一方面,粪便微生物群制剂包含分离的或经纯化的活的非致病性粪便细菌群体。另一方面,粪便微生物群制剂包含来自单一供体的非选择性且基本上完全的粪便微生物群制剂。另一方面,本文使用的治疗组合物包含活的、非致病的、合成的细菌或活的、非致病的、经纯化的或提取的粪便微生物群的混合物。
在一个方面,粪便微生物群制剂的制备涉及选自乙醇处理、去污剂处理、热处理、辐照和超声处理或其组合的处理。一方面,粪便微生物群制剂的制备不包括选自乙醇处理、洗涤剂处理、热处理、辐照和超声处理的处理。一方面,粪便微生物群制剂的制备涉及选自过滤、筛分、密度梯度、过滤、色谱法及其组合的分离步骤。一方面,粪便微生物群制剂的制备不需要选自过滤、筛分、密度梯度、过滤和色谱的一个或多个分离步骤。一方面,粪便微生物群制剂基本上不含非生物物质。在一个方面,粪便微生物群制剂基本上不含选自残留纤维、dna、病毒包衣材料和不存活材料的无细胞材料。一方面,粪便微生物群制剂基本上不含来自粪便微生物群供体的真核细胞。
在一个方面,本公开内容提供了用于在有需要的受试者中治疗asd的方法,其中所述方法包括向受试者施用药学活性剂量的本文所述的治疗组合物。在一个方面,本公开内容提供了用于在有需要的受试者中治疗asd的方法,其中所述方法包括每日向受试者施用药学活性剂量的本文所述的治疗组合物。在一个方面,治疗性组合物每天至少一次施用于有此需要的患者至少连续两天。在一个方面,治疗性组合物每天施用至少一次,持续至少3、4、5、6、7、8、9、10、11、12、13、14或15天。另一方面,治疗性组合物每天至少施用一次持续至少1、2、3、4、5、6、7、8、9、10、11或12周。在一个方面,治疗性组合物每天施用至少一次至多连续4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20几天或几周。另一方面,治疗性组合物每天至少施用一次,持续至多1、2、3、4、5、6、7、8、9、10、11或12个连续的周或月。另一方面,对于受试者,治疗组合物至少连续给药一次,持续至少1、2、3、4、5、6、7、8、9、10、11或12个月或数年、长期受试者的整个寿命或无限期的时间。
在一个方面,治疗性组合物每天至少两次施用于有此需要的患者至少连续两天。在一个方面,治疗性组合物每天至少施用两次持续至少3、4、5、6、7、8、9、10、11、12、13、14或15天。另一方面,治疗性组合物每天至少两次施用至少1、2、3、4、5、6、7、8、9、10、11或12个星期。在一个方面,治疗性组合物每天施用至少两次至多4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20连续的天或周。另一方面,治疗性组合物每天至少两次施用至多1、2、3、4、5、6、7、8、9、10、11或12个连续的周或月。在进一步的方面,对于受试者,治疗性组合物至少连续两次施用持续至少1、2、3、4、5、6、7、8、9、10、11或12个月或数年、长期受试者的整个寿命或无限期的时间。
在一个方面,治疗性组合物每天至少三次施用于有此需要的患者,连续至少两天。在一个方面,治疗性组合物每天至少施用三次持续至少3、4、5、6、7、8、9、10、11、12、13、14或15天。另一方面,治疗性组合物每天至少两次施用至少1、2、3、4、5、6、7、8、9、10、11或12个星期。在一个方面,治疗性组合物每天施用至少三次至多4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20连续的天或周。另一方面,治疗性组合物每天至少三次施用至多1、2、3、4、5、6、7、8、9、10、11或12个连续的周或月。在进一步的方面,对于受试者,治疗性组合物至少连续三次施用持续至少1、2、3、4、5、6、7、8、9、10、11或12个月或数年、长期受试者的整个寿命或无限期的时间。
在一个方面,本公开内容提供了用于在有需要的受试者中治疗asd的方法,其中所述方法包括向受试者口服施用药学活性剂量的包含活的、非病原性的合成细菌混合物或活的、非致病的、经纯化的或提取的粪便微生物群,其中所述剂量以每天至少一次或两次的给药方案给药连续至少三天或几周。另一方面,给药剂量每日至少一次、两次或三次给药1至12周、2至12周、3至12周、4至12周、5至12周、6至12周、7至12周、8至12周、9至12周、10至12周、1至2周、2至3周、3至4周、4至5周、5至6周、6至7周、7至8周、8至9周、9至10周或10至11周。
在一个方面,本公开提供了通过施用本文所述的药物组合物来治疗有需要的受试者中的asd的方法,其中所述方法包括第一给药方案,随后是第二给药方案。一方面,第一给药方案包括治疗或诱导剂量。在一个方面,第一给药方案包括连续给药方案。另一方面,第二给药方案包括低于或等于第一给药方案的药物活性剂量的维持剂量。另一方面,第二给药方案持续至少约2、4、6、8、10、12、18、24、36、48、72或96个月。在一个方面,第二次给药时间表针对治疗的受试者的整个寿命或无限期的持续时间持续。在一个方面,第二给药方案是连续给药方案。另一方面,第二给药方案是间歇给药方案。另一方面,第二给药方案是间歇给药方案,其包括至少1、2、3、4、5、6、7、8、9、10、11、12、13或14天的治疗期,接着是至少1、2、3、4、5、6、7、8、9、10、11、12、13或14天的休息期。在另一方面,第二给药方案包括每隔一天、每两天或每隔3、4、5、6、7、8天施用第二剂量(例如维持剂量)。另一方面,维持剂量在滴定或不滴定的情况下(或以其他方式改变剂量或给药方案)延长的时间段施用。在一个方面,第一和第二给药方案之间的时间间隔至少约为1、2、3、4、5、6、7、8、9、10、11或12周。在另一方面,第二给药方案(例如维持剂量)包含比第一给药方案(例如,初始治疗剂量)中使用的剂量低约2、5、10、50、100、200、400、800、1000、5000或更多倍的剂量。另一方面,第二给药方案(例如,维持给药方案)具有与第一给药方案(例如初始治疗给药方案)相等或更低的给药频率。另一方面,第二给药方案(例如,维持给药方案)具有比第一给药方案(例如初始治疗给药方案)更高的给药间隔。
在一个方面,方法中使用的第一或第二给药方案可以是每周一次,每周两次或每周三次。术语“每周一次”是指一周一次施用剂量,优选在每周的同一天施用。“每周两次”是指一周两次给药,优选在每周周期的相同两天给药。“每周三次”是指每周给药三次,优选每周每周三天给药。
在一个方面,正在接受治疗的受试者是已经具有障碍(例如,asd)的受试者。将公开的治疗组合物施用于临床上具有遗传倾向或易患障碍(例如,asd)的无症状人类受试者也可用于预防临床症状的发作。人类受试者具有遗传倾向或倾向于asd的人类受试者可能是亲密的家庭成员或亲属表现或遭受障碍(例如asd)的人类受试者。在另一个方面,正在接受治疗的受试者是要阻止asd的受试者。在另一方面,正被治疗的受试者易患障碍(例如,asd)。在另一方面,正被治疗的受试者是被诊断为患有障碍(例如,asd)的受试者。在一个方面,正在接受治疗的受试者是有此需要的患者。
在一个方面,正在接受治疗的受试者是人类患者。一方面,患者是男性患者。一方面,患者是女性患者。一方面,患者是早产新生儿。一方面,患者是新生儿的名词。在一个方面,患者是新生儿。一方面,患者是婴儿。一方面,患者是幼儿。一方面,患者是年幼的孩子。一方面,患者是儿童。一方面,患者是青少年。一方面,患者是儿科患者。一方面,患者是老年患者。一方面,人类患者是约18、15、12、10、8、6、4、3、2或1岁以下的儿童患者。另一方面,人类患者是成年患者。另一方面,人类患者是老年患者。另一方面,人类患者是高于约30、35、40、45、50、55、60、65、70、75、80、85、90或95岁的患者。另一方面,患者年龄为1至5、2至10、3至18、21至50、21至40、21至30、50至90、60至90、70至90岁、60至80、65至75。一方面,患者是年轻的老年患者(65-74岁)。一方面,患者是中年老患者(75-84岁)。一方面,患者是一位老年患者(>85岁)。
在一个方面,一种方法包括口服、灌肠或直肠栓剂给予治疗组合物。在一个方面,药物组合物被配制成凝胶剂、丸剂、微胶囊、胶囊剂或片剂。在一个方面,治疗性组合物被配制为肠溶包衣胶囊或微胶囊、耐酸胶囊或微胶囊、或配制为食品、食品添加剂、基于乳品的产品、基于大豆的产品或其衍生物、果冻或酸奶的一部分或与其一起施用。另一方面,治疗组合物被配制成耐酸肠溶包衣胶囊。治疗组合物可以作为与食物或饮料组合销售的粉末提供。食物或饮料可以是乳制品或大豆制品。另一方面,食物或食物补充物包含含有治疗组合物的肠溶衣和/或抗酸微胶囊。
一方面,治疗组合物包含液体培养物。另一方面,治疗组合物被冻干、粉碎和粉末化。然后将其灌注、溶解,如生理盐水,作为灌肠剂。或者,粉末可以被封装成用于口服给药的肠溶衣和/或耐酸的胶囊。这些胶囊可以采取肠溶包衣和/或耐酸微胶囊的形式。粉末可以优选以可口的形式提供用于重建饮用或作为食品添加剂复原。另一方面,食物是酸奶。在一个方面,粉末可以被重构以通过鼻-十二指肠输注来输注。
另一方面,治疗组合物为液体、冷冻、冷冻干燥、喷雾干燥、冻干或粉末制剂。另一方面,治疗组合物被配制成延迟或渐进的肠释放形式。另一方面,治疗组合物包含赋形剂、盐水、缓冲剂、缓冲剂或流体-葡萄糖-纤维二糖琼脂(rgca)培养基。
一方面,治疗组合物还包含酸抑制剂、抗酸剂、h2拮抗剂、质子泵抑制剂或其组合。一方面,治疗组合物基本上不含非生物物质。另一方面,基本上不含选自残留纤维、dna、病毒包衣材料和非存活材料的无细胞材料的治疗组合物。
一方面,治疗组合物包含冷冻保护剂。另一方面,冷冻保护剂包含聚乙二醇、脱脂乳、赤藓糖醇、阿拉伯糖醇、山梨糖醇、葡萄糖、果糖、丙氨酸、甘氨酸、脯氨酸、蔗糖、乳糖、核糖、海藻糖、二甲基亚砜(dmso)、甘油或其组合。
另一方面,治疗组合物包含冻干保护剂。一方面,相同的物质或相同的物质组合同时用作冷冻保护剂和冻干保护剂。示例性的冻干保护剂包括糖如蔗糖或海藻糖、氨基酸如谷氨酸一钠或组氨酸、甲胺如甜菜碱、感胶离子盐如硫酸镁、多元醇如三元以上的糖醇、甘油、赤藓糖醇、甘油、阿拉伯糖醇、木糖醇、山梨醇和甘露糖醇、丙二醇、聚乙二醇、普朗尼克、及其组合。一方面,冻干保护剂是非还原糖,如海藻糖或蔗糖。在一个方面,一种基本上由或由本段和上述段落中提及的一种或多种物质组成的防冻剂或冻干保护剂。
在一个方面,冻干制剂包含海藻糖。在一个方面,冻干制剂包含2%至30%、3%至25%、4%至20%、5%至15%、6%至10%、2%至30%、2%至25%、2%至20%、2%至15%或2%至10%的海藻糖。在一个方面,冻干制剂包含至少3%、4%、5%、6%、7%、8%、9%、10%或15%的海藻糖。在一个方面,冻干制剂包含至多2%、3%、4%、5%、6%、7%、8%、9%、10%或15%的海藻糖。一方面,冻干制剂包含约5%海藻糖。在一个方面,冻干制剂包含海藻糖和蔗糖。在一个方面,冻干制剂包含约8%至12%的海藻糖与约1.5%至3.5%的蔗糖和约0.5%至1.5%的nacl。
在一个方面,治疗组合物还包含选自以下的益生元营养素或者被补充益生元营养素:多元醇、低聚果糖(fos)、低聚果糖、菊糖、低聚半乳糖(gos)、低聚木糖(xos)、聚葡萄糖、单糖、塔格糖和/或甘露寡糖。
一方面,方法进一步包括在施用治疗性细菌或微生物群组合物之前用抗生素组合物预处理受试者。一方面,抗生素组合物包含选自利福布汀、克拉霉素、氯法齐明、万古霉素、利福平、硝基咪唑、氯霉素及其组合的抗生素。另一方面,抗生素组合物包含选自利福昔明、利福霉素衍生物、利福平、利福布丁、利福喷丁、利福拉齐、比卡他霉素、氨基糖苷、庆大霉素、新霉素、链霉素、巴龙霉素、维米丁、转氨霉素、西索米星、奈替米星、卡那霉素、氨曲南、氨曲南大环内酯、克拉霉素、地红霉素、罗红霉素、秦利霉素、阿奇霉素、碱式水杨酸铋、万古霉素、链霉素、非达霉素、阿米卡星、阿贝卡星、新霉素、奈替米星、巴龙霉素、rhodo链霉素、妥布霉素、阿泊拉霉素及其组合。另一方面,一种方法还包括在施用治疗性细菌或微生物群组合物之前用抗炎药对受试者进行预处理。
在一个方面,每个约200mg的药物组合物包含药理学活性剂量。在一个方面,每个约75、100、125、150、175、200、250、300、350、400、450、500、750、1000、1500或2000mg包含药理学活性剂量的药物组合物。
在一个方面,药物活性或治疗有效剂量包含至少约105、106、107、108、109、1010、1011、1012或1013cfu。另一方面,药物活性治疗有效剂量包含至多约105、106、107、108、109、1010、1011、1012或1013cfu。另一方面,药理学活性治疗有效剂量选自下列组成:108cfu至1014cfu、109cfu至1013cfu、1010cfu至1012cfu、109cfu至1014cfu、109cfu至1012cfu、109cfu至1011cfu、109cfu至1010cfu、1010cfu至1014cfu、1010cfu至1013cfu、1011cfu至1014cfu、1011cfu至1013cfu、1012cfu至1014cfu以及1013cfu至1014cfu。在一个方面,药物组合物包含以约0.2、0.4、0.6、0.8或1.0克的单位重量或约0.2、0.4、0.6、0.8或1.0毫升的单位体积的上述药物活性或治疗有效剂量。
在一个方面,药物活性或治疗有效剂量包含至少约105、106、107、108、109、1010、1011、1012或1013个细胞或孢子。另一方面,药学活性或治疗有效剂量包含至多约105、106、107、108、109、1010、1011、1012或1013个细胞或孢子。另一方面,药理学活性或治疗有效剂量选自108至1014、109至1013、1010至1012、109至1014、109至1012、109至1011、109至1010、1010至1014、1010至1013、1011至1014、1011至1013、1012至1014以及1013至1014个细胞或孢子。一方面,药物活性或治疗有效剂量细胞计数针对活细胞。在一个方面,药物组合物包含以约0.2、0.4、0.6、0.8或1.0克的单位重量或约0.2、0.4、0.6、0.8或1.0毫升的单位体积的上述药物活性或治疗有效剂量。
在一个方面,本文描述和使用的治疗组合物包含一种或多种、两种或更多种、三种或更多种、四种或更多种、或五种或更多种分离的、经纯化的或培养的微生物,所述微生物选自梭菌、bacillus、collinsella、拟杆菌|真细菌、梭杆菌属、丙酸杆菌属、乳酸杆菌属、瘤胃球菌属、大肠杆菌、gemmiger、脱硫单胞菌属、消化链球菌属、双歧杆菌属、球菌属、多雷菌属和念珠菌属。
一方面,本文所述的粪便微生物群制剂包含经纯化的或重构的粪便细菌混合物。在一个方面,本文描述和使用的粪便微生物群制剂包含一种或多种、一种或多种、两种或更多种、三种或更多种、四种或更多种、或五种或更多种活的粪便微生物,其选自酸性氨基酸、akkermansia、alistipes、anaerotruncus、拟杆菌|双歧杆菌、布劳恩氏菌、丁螺弧菌、梭菌、collinsella、coprococcus、corynebacterium、dorea、enterococcus、埃希氏菌属、真杆菌属、faecalibacterium、haemophilus、holdemania、乳杆菌属、莫拉菌属、para拟杆菌|普氏菌、丙酸杆菌属、拉乌尔菌属、roseburia、ruminococcus、葡萄球菌、链球菌属、subdoligranulum和veillonella。一方面,粪便微生物群制剂包含一种或多种、一种或多种、两种或更多种、三种或更多种、四种或更多种、或五种或更多种活的粪便微生物,其选自bacteroidesfragilisssp.vulgatus、collinsellaaerofaciens、bacteroidesfragilisssp.thetaiotaomicron、peptostreptococcusproductusii、parabacteroidesdistasonis、faecalibacteriumprausnitzii、coprococcuseutactus、peptostreptococcusproductusi、ruminococcusbromii、bifidobacteriumadolescentis、gemmigerformicilis、bifidobacteriumlongum、eubacteriumsiraeum、ruminococcustorques、eubacteriumrectale、eubacteriumeligens、bacteroideseggerthii、柔嫩梭菌(clostridiumleptum)、bacteroidesfragilisssp.a、eubacteriumbiforme、bifidobacteriuminfantis、eubacteriumrectale、coprococcuscomes、pseudoflavonifractorcapillosus、ruminococcusalbus、doreaformicigenerans、eubacteriumhallii、eubacteriumventriosumi、fusobacteriumrussi、ruminococcusobeum、eubacteriumrectale、多枝梭菌(clostridiumramosum)、lactobacillusleichmannii、ruminococcuscallidus、butyrivibriocrossotus、acidaminococcusfermentans、eubacteriumventriosum、bacteroidesfragilisssp.fragilis、coprococcuscatus、aerostipeshadrus、eubacteriumcylindroides、eubacteriumruminantium、、staphylococcusepidermidis、eubacteriumlimosum、tissirellapraeacuta、fusobacteriummortiferumi、fusobacteriumnaviforme、无害梭菌(clostridiuminnocuum)、多枝梭菌、propionibacteriumacnes、ruminococcusflavefaciens、bacteroidesfragilisssp.ovatus、fusobacteriumnucleatum、fusobacteriummortiferum、escherichiacoli、gemellamorbillorum、finegoldiamagnus、streptococcusintermedius、ruminococcuslactaris、eubacteriumtenue、eubacteriumramulus、bacteroidesclostridiiformisssp.clostridliformis、bacteroidescoagulans、口腔普氏菌(prevotellaoralis)、瘤胃普氏菌(prevotellaruminicola)、odoribactersplanchnicus以及desuifomonaspigra。
在一个方面,本文描述和使用的粪便微生物群制剂缺乏或基本上没有选自一种或多种,一种或多种,两种或更多种,三种或更多种,四种或更多种,或五种或更多种由下列组成的活的粪便微生物:acidaminococcus、akkermansia、alistipes、anaerotruncus、拟杆菌|bifidobacterium、blautia、butyrivibrio、梭菌、collinsella、coprococcus、corynebacterium、dorea、enterococcus、escherichia、eubacterium、faecalibacterium、haemophilus、holdemania、lactobacillus、moraxella、para拟杆菌|普氏菌、propionibacterium、raoultella、roseburia、ruminococcus、staphylococcus、streptococcus、subdoligranulum以及veillonella。在一个方面,粪便微生物群制剂缺少或基本上不含选自一种或多种、一种或多种、两种或更多种、三种或更多种、四种或更多种或五种或更多种由下列组成的活的粪便微生物:bacteroidesfragilisssp.vulgatus、collinsellaaerofaciens、bacteroidesfragilisssp.thetaiotaomicron、peptostreptococcusproductusii、parabacteroidesdistasonis、faecalibacteriumprausnitzii、coprococcuseutactus、peptostreptococcusproductusi、ruminococcusbromii、bifidobacteriumadolescentis、gemmigerformicilis、bifidobacteriumlongum、eubacteriumsiraeum、ruminococcustorques、eubacteriumrectale、eubacteriumeligens、bacteroideseggerthii、柔嫩梭菌、bacteroidesfragilisssp.a、eubacteriumbiforme、bifidobacteriuminfantis、eubacteriumrectale、coprococcuscomes、pseudoflavonifractorcapillosus、ruminococcusalbus、doreaformicigenerans、eubacteriumhallii、eubacteriumventriosumi、fusobacteriumrussi、ruminococcusobeum、eubacteriumrectale、多枝梭菌、lactobacillusleichmannii、ruminococcuscallidus、butyrivibriocrossotus、acidaminococcusfermentans、eubacteriumventriosum、bacteroidesfragilisssp.fragilis、coprococcuscatus、aerostipeshadrus、eubacteriumcylindroides、eubacteriumruminantium、staphylococcusepidermidis、eubacteriumlimosum、tissirellapraeacuta、fusobacteriummortiferumi、fusobacteriumnaviforme、无害梭菌、多枝梭菌、propionibacteriumacnes、ruminococcusflavefaciens、bacteroidesfragilisssp.ovatus、fusobacteriumnucleatum、fusobacteriummortiferum、escherichiacoli、gemellamorbillorum、finegoldiamagnus、streptococcusintermedius、ruminococcuslactaris、eubacteriumtenue、eubacteriumramulus、bacteroidesclostridiiformisssp.clostridliformis、bacteroidescoagulans、口腔普氏菌、瘤胃普氏菌、odoribactersplanchnicus以及desuifomonaspigra。
另一方面,治疗组合物包含粪便微生物群,其进一步补充、加标或用粪便微生物增强。在一个方面,粪便微生物群补充有非致病性(或具有致弱性)细菌的梭菌、collinsella、dorea、ruminococcus、coprococcus、普氏菌、veillonella、拟杆菌|芽孢杆菌或其组合。另一方面,治疗性组合物包含粪便微生物群,所述粪便微生物群进一步补充、加标或增强有veillonellaceae、firmicutes、γ-变形菌属、拟杆菌属或其组合。另一方面,治疗组合物包含进一步补充有粪便细菌孢子的粪便微生物群。一方面,粪便细菌孢子是梭菌孢子、芽孢杆菌孢子或两者。在另一方面,治疗组合物包含粪便微生物群,所述粪便微生物群进一步补充、掺入或增强,其选自以下的拟杆菌属:bacteroidescoprocola、bacteroidesplebeius、bacteroidesmassiliensis、bacteroidesvulgatus、bacteroideshelcogenes、bacteroidespyogenes、bacteroidestectus、bacteroidesuniformis、bacteroidesstercoris、bacteroideseggerthii、bacteroidesfinegoldii、bacteroidesthetaiotaomicron、bacteroidesovatus、bacteroidesacidifaciens、bacteroidescaccae、bacteroidesnordii、bacteroidessalyersiae、bacteroidesfragilis、bacteroidesintestinalis、bacteroidescoprosuis、bacteroidesdistasonis、bacteroidesgoldsteinii、bacteroidesmerdae、bacteroidesforsythus、bacteroidessplanchnicus、bacteroidescapillosus、bacteroidescellulosolvens、andbacteroidesureolyticus。
在一个方面,治疗组合物包含来自受试者的粪便微生物群,其选自人、牛、奶牛、反刍动物、绵羊、山羊或者鹿茸。另一方面,可以将治疗组合物施用于选自人、牛、奶牛、反刍动物、绵羊、山羊或鹿茸的受试者。一方面,治疗组合物基本上或几乎无气味。
一方面,本文提供的治疗组合物包含粪便微生物群制剂,所述粪便微生物群的香农多样性指数大于或等于0.3、大于或等于0.4、大于或等于0.5、大于或等于0.6、大于或等于0.7、大于或等于0.8、大于或等于0.9、大于或等于1.0、大于或等于1.1、大于或等于1.2、大于或等于1.3、大于或等于1.4、大于或等于1.5、大于或等于1.6、大于或等于1.7、大于或等于1.8、大于或等于1.9、大于或等于2.0、大于或等于2.1、大于或等于2.2、大于或等于2.3、大于或等于2.4、大于或等于2.5、大于或等于3.0、大于或等于3.1、大于或等于3.2、大于或等于3.3、大于或等于3.4、大于或等于3.5、大于或等于3.6、大于或等于3.7、大于或等于3.8、大于或等于3.9、大于或等于4.0、大于或等于4.1、大于或等于4.1、大于或等于4.2、大于或等于4.3、大于或等于4.4、大于或等于4.5或大于或等于5.0。另一方面,治疗组合物包含粪便微生物群,所述粪便微生物群的香农多样性指数为0.1至3.0、0.1至2.5、0.1至2.4、0.1至2.3、0.1至2.2、0.1至2.1、0.1至2.0、0.4至2.5、0.4至3.0、0.5至5.0、0.7至5.0、0.9至5.0、1.1至5.0、1.3至5.0、1.5至5.0、1.7至5.0、1.9至5.0、2.1至5.0、2.3至5.0、2.5至5.0、2.7至5.0、2.9至5.0、3.1至5.0、3.3至5.0、3.5至5.0、3.7至5.0、3.9至5.0、或4.1至5.0。在一个方面,香农多样性指数在门层级计算。另一方面,香农多样性指数是在家庭层面计算的。在一个方面,香农多样性指数是在属水平上计算的。另一方面,香农多样性指数是在物种水平上计算的。另一方面,治疗组合物包含类似于正常健康人粪便菌群的菌群比例含量的制剂。
另一方面,治疗组合物包含来自至少1、2、3、4、5、6、7、8、9或10个不同家族的粪便细菌。在一个方面,本文提供的治疗组合物包含粪便微生物群,所述粪便微生物群包含不大于0.05%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、3%、4%、5%、6%、7%、8%、9%或10%的粪便衍生的非生命材料与粪便衍生的生物材料之间的重量比。另一方面,本文提供的治疗组合物包含粪便微生物群,所述粪便微生物群包含不大于20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的粪便衍生的非生命材料与粪便衍生的生物材料之间的重量比。另一方面,本文提供的治疗组合物包含粪便样品的非生命材料颗粒和/或生物材料颗粒、由粪便样品的非生命材料颗粒和/或生物材料颗粒组成、或基本上由粪便样品的非生命材料颗粒和/或生物材料颗粒组成,所述粪便样品的颗粒通过筛、柱或类似的过滤装置,所述筛、柱或类似的过滤装置具有2.0毫米、1.0毫米、0.5毫米、0.25毫米、0.212毫米、0.180毫米、0.150毫米、0.125毫米、0.106毫米、0.090毫米、0.075毫米、0.063毫米、0.053毫米、0.045毫米、0.038毫米、0.032毫米、0.025毫米、0.020毫米、0.01毫米或0.2毫米的筛、排除或颗粒过滤器尺寸。“非生命材料”不包括赋形剂,例如加入到加工后的粪便材料中的非药学活性物质,如冷冻保护剂。“生物材料”是指粪便材料中的生物材料,包括原生细胞、如细菌和古细菌(如活的原核细胞和可形成活的原核细胞的孢子)、真核细胞如原生动物、真菌和病毒。一方面,“生物材料”是指存在于正常健康人的结肠中的活体材料,例如微生物、真核细胞和病毒。一方面,治疗组合物提供或包含人粪便提取物,其中所述组合物基本上无臭。一方面,治疗组合物在冻干、粗制、半经纯化的或经纯化的制剂中提供或包含粪便物质或粪便菌群制剂。
在一个方面,治疗组合物中的粪便微生物群包含高度精制或经纯化的粪便菌群,例如基本上不含非菌群粪便物质。在一个方面,粪便微生物群可以被进一步处理,例如在筛分之前\之后或之前和之后进行微滤。另一方面,高度经纯化的粪便微生物群产品被超滤以除去大分子但保留治疗性微菌群,例如细菌。
另一方面,本文使用的治疗组合物中的粪便微生物群包含或基本上由基本上分离的或经纯化的粪便菌群或为(或包含)粪便菌群分离物的整个(或基本上完整的)微生物,其为至少约90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,99.5%,99.6%,99.7%,99.8%或99.9%分离的或纯的,或具有不超过约0.1%,0.2%,0.3%,0.4%,0.5%,0.6%,0.7%,0.8%,0.9%或1.0%或更多的非粪便便菌物质;或者基本上分离的、经纯化的或基本上完整的微生物群,如sadowsky等人在wo2012/122478a1所述的或borody等人在wo2012/016287a2所述的。在一个方面,粪便微生物群制剂包含不大于约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、2%、5%、8%、10%、15%、20%、30%,40%或50%的粪便衍生的非生命材料与粪便衍生生物材料之间的重量比。
在一个方面,治疗组合物中的粪便微生物群包含供体的基本上全部或非选择性粪便微生物群、重构的粪便物质或合成粪便物质。另一方面,治疗组合物中的粪便微生物群不包含抗生素抗性群体。另一方面,治疗组合物包含粪便微生物群并且基本上不含外来物质(例如残留纤维、dna、rna等非细胞物质、病毒包衣材料、非存活物质等非活体物质、来自粪便物质的供体等的真核细胞等生物体)。
在一个方面,本文使用的治疗组合物中的粪便微生物群来源于疾病筛选的新鲜同源粪便或相当的冷冻干燥和复原的粪便。一方面,新鲜的同源粪便不包括抗生素抗性群体。另一方面,治疗组合物中的粪便微生物群来源于合成粪便组合物。一方面,合成粪便组合物包含优选比例含量的活菌群的制备物,类似于不包含抗生素抗性群体的正常健康人粪便菌群。合适的微生物可以选自下列:拟杆菌\真细菌、梭杆菌属、propionibacterium、lactobacillus、ruminococcus、escherichiacoli、gemmiger、梭菌、desulfomonas、peptostreptococcus、bifidobacterium、collinsella、coprococcus、dorea、andruminococcus。
在一个方面,治疗性组合物与其他佐剂如抗酸剂组合以抑制胃中的细菌失活。(例如,mylanta、mucaine、gastrogel)。另一方面,使用h2拮抗剂或质子泵抑制剂也可以药理学抑制胃中的酸分泌。h2-拮抗剂的例子是雷尼替丁。质子泵抑制剂的一个例子是奥关拉唑。在一个方面,酸性抑制剂在施用治疗性组合物或与其共同施用之前施用。
在一个方面,治疗性组合物以下列形式施用:灌肠组合物,其可以用合适的稀释剂重构;肠溶胶囊;肠溶微胶囊;耐酸片;耐酸胶囊;耐酸微胶囊;用于用于鼻肠内输注或结肠内输注的适当稀释剂重构的粉末;用适当稀释剂复原的粉剂、调味剂和口服胃酸抑制剂;用食物或饮料重新配制的粉末;或包含组合物的肠溶包衣和/或耐酸微胶囊的食物或食物补充剂、粉末、果冻或液体。
一方面,治疗方法可以治愈、减轻症状、或者减轻障碍(例如asd)症状的百分比。菌群的变化最好是尽可能“接近完全”,菌群被能够挤出剩余的原始菌群的活菌所取代。通常,肠菌群的改变包括将预定菌群阵列引入胃肠系统,因此,优选的治疗方法包括在需要这种治疗的患者中基本或完全置换致病性肠道菌群。
另一方面,治疗组合物可与药学上可接受的载体一起提供。如本文所用,“药学上可接受的载体”是指与活性细菌混合以便形成药物组合物的无毒溶剂、分散剂、赋形剂、佐剂或其它物质,例如能够给予患者的剂量形式。药学上可接受的载体可以是液体(例如盐水)、凝胶或固体形式的稀释剂、佐剂、赋形剂或耐酸包囊成分。合适的稀释剂和赋形剂包括药用等级的生理盐水、右旋糖、甘油、甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等、以及它们的组合。另一方面,治疗组合物可含有辅助物质,如润湿剂或乳化剂、稳定剂或ph缓冲剂。一方面,治疗组合物含有约1%-5%、5%-10%、10%-15%、15-20%、20%-25%、25-30%、30-35%、40-45%、50%-55%、1%-95%、2%-95%、5%-95%、10%-95%、15%-95%、20%-95%、25%-95%、30%-95%、35%-95%、40%-95%、45%-95%、50%-95%、55%-95%、60%-95%、65%-95%、70%-95%、45%-95%、80%-95%或85%-95%的活性成分。一方面,治疗组合物含有约2%-70%、5%-60%、10%-50%、15%-40%、20%-30%、25%-60%、30%-60%、或35%-60%的活性成分。
在一个方面,治疗组合物可以掺入片剂、淋巴剂、大丸剂、胶囊剂或预混剂中。将这些活性成分配制成这种剂型可以通过药物制剂领域公知的方法完成。参见,例如,美国专利号4,394,377。用任何所需形式的活性成分填充明胶胶囊容易地产生胶囊。如果需要,可以用惰性粉状稀释剂如糖、淀粉、奶粉、经纯化的结晶纤维素等稀释这些材料以增加容积以便于填充胶囊。
一方面,常规配制方法可用于制备含有治疗组合物的片剂。除了活性成分之外,片剂还可以含有基质、崩解剂、吸收剂、粘合剂和润滑剂。典型的基质包括乳糖、糖、氯化钠、淀粉和甘露糖醇。淀粉也是海藻酸的良好崩解剂。有时也使用表面活性剂如十二烷基硫酸钠和二辛基磺基琥珀酸钠。常用的吸收剂包括淀粉和乳糖。碳酸镁也可用于油性物质。作为粘合剂,可以使用例如明胶、树胶、淀粉、糊精、聚乙烯吡咯烷酮和各种纤维素衍生物。常用的润滑剂有硬脂酸镁、滑石粉、石蜡、各种金属皂和聚乙二醇。
在一个方面,为了制备固体组合物如片剂,将活性成分与药物载体混合,例如常规压片成分如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石粉、硬脂酸、硬脂酸镁、磷酸二钙或树胶或其他药物稀释剂,例如,以形成含有本发明组合物的均匀混合物的固体预制剂组合物。当将这些预配制组合物称为均匀时,意思是活性成分均匀地分散在整个组合物中,使得组合物可以容易地再分成等效的单位剂型,例如片剂、丸剂和胶囊剂。然后将该固体预制剂组合物分成上述类型的单位剂型,其包含期望量的活性成分(例如,至少约105、106、107、108、109、1010、1011、1012或1013cfu)。本文使用的治疗组合物可以调味。
一方面,治疗组合物可以是片剂或丸剂。在一个方面,片剂或丸剂可以被包衣或以其它方式配制以提供提供延长作用的优点的剂型。例如,片剂或丸剂可以包含内部剂量和外部剂量组分,后者以前者的包膜的形式。这两种组分可以通过肠溶层分开,该肠溶层用来抵抗胃中的崩解,并允许内部组分完整地进入十二指肠或延迟释放。多种材料可以用于这样的肠溶层或包衣,这样的材料包括许多聚合酸和聚合酸与诸如虫胶\鲸蜡醇和醋酸纤维素的材料的混合物。
一方面,治疗组合物被配制成延迟或渐进的肠释放形式。在一个方面,延迟或渐进的肠释放制剂包含使用乙酸纤维素、聚乙二醇甘油或两者。在一个方面,延迟的或逐渐的肠溶释放制剂包含使用羟丙基甲基纤维素(hpmc)、微晶纤维素(mcc)、硬脂酸镁或其组合。在一个方面,延迟或渐进的肠释放制剂包括使用聚(甲基)丙烯酸酯、甲基丙烯酸共聚物b、甲基丙烯酸甲酯、甲基丙烯酸酯、聚乙烯吡咯烷酮(pvp)、pvp-k90或它们的组合。一方面,延迟或渐进的肠释放制剂包括使用夹在两个外层之间的固体内层;其中所述固体内层包含药物组合物和选自崩解剂、爆炸剂、泡腾剂或其任何组合的另一种组分;其中外层包含基本上水溶性的、结晶聚合物或两者。一方面,延迟或渐进的肠溶释放制剂包含使用不可溶胀的扩散基质。
另一方面,延迟或渐进的肠释放制剂包括使用包含第一层和第二渗透推进层的双层片剂或胶囊,所述第一层包含聚环氧烷、聚乙烯吡咯烷酮、润滑剂或其混合物,所述第二渗透推进层包含聚环氧乙烷、羧甲基纤维素或两者。在一个方面,延迟或渐进的肠释放制剂包括使用选自丙烯酸类聚合物、纤维素、蜡、脂肪酸、虫胶、玉米醇溶蛋白、氢化植物油、氢化植物油蓖麻油、聚乙烯吡咯烷酮、乙酸乙烯酯共聚物、乙烯醇共聚物、聚环氧乙烷、丙烯酸和甲基丙烯酸共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸乙氧基乙酯聚合物、甲基丙烯酸氰乙酯聚合物、氨基烷基甲基丙烯酸酯共聚物、聚丙烯酸、聚甲基丙烯酸、甲基丙烯酸烷基酰胺共聚物、聚甲基丙烯酸甲酯、聚甲基丙烯酸酐、甲基丙烯酸甲酯聚合物、聚甲基丙烯酸酯、聚甲基丙烯酸甲酯共聚物、聚丙烯酰胺、甲基丙烯酸氨基烷基酯共聚物、甲基丙烯酸缩水甘油酯共聚物、甲基纤维素、乙基纤维素、羧甲基纤维素、羟丙基甲基纤维素、羟甲基纤维素、羟乙基纤维素、羟丙基纤维素、交联羧甲基纤维素钠、交联羟丙基纤维素、天然蜡、合成蜡、脂肪醇、脂肪酸、脂肪酸酯、酸甘油酯、氢化脂肪、烃蜡、硬脂酸、硬脂醇、蜂蜡、糖蜡、蓖麻蜡、巴西棕榈蜡、聚乳酸、聚乙醇酸、乳酸和乙醇酸的共聚物、羧甲基淀粉、甲基丙烯酸钾/二乙烯基苯共聚物、交联聚乙烯吡咯烷酮、聚异戊醇、聚乙烯醇共聚物、聚乙二醇、非交联聚乙烯吡咯烷酮、聚乙酸乙烯酯、聚乙酸乙烯酯共聚物或其任何组合。在一个方面,延迟或渐进的肠释放制剂包含使用微环境ph调节剂。
一方面,治疗组合物可以是淋水剂。在一个方面,通过选择治疗组合物的盐水悬浮形式来制备淋巴液。一种成分的水溶性形式可以与另一种成分的水不溶性形式一起使用,通过制备另一种成分与另一种成分的水溶液的混悬液。不溶于水的形式的活性成分可以制备成悬浮液或在某些生理上可接受的溶剂如聚乙二醇中。不溶于水的形式的活性成分悬浮液可以在油如花生、玉米,芝麻油等中制备;在诸如丙二醇或聚乙二醇的二醇中;或在水中取决于特定活性成分的溶解度。合适的生理上可接受的佐剂可能是必要的,以保持活性成分悬浮。佐剂可以包括和选自增稠剂,如羧甲基纤维素、聚乙烯吡咯烷酮、明胶和藻酸盐。表面活性剂通常将起到悬浮活性成分,特别是脂溶性丙酸增强化合物的作用。在液体非溶剂中制备悬浮液最有用的是烷基酚聚环氧乙烷加合物、萘磺酸盐、烷基苯磺酸盐和聚氧乙烯脱水山梨糖醇酯。另外,影响液体的亲水性、密度和表面张力的许多物质可以有助于在各种情况下制备悬浮液。例如,有机硅消泡剂、二元醇、山梨糖醇和糖可以是有用的悬浮剂。
一方面,治疗组合物包含非致病性孢子,所述非致病性孢子选自一种或多种、两种或更多种、三种或更多种、或四种或更多种以下组成的梭菌种:clostridiumabsonum、clostridiumargentinense、clostridiumbaratii、clostridiumbotulinum、clostridiumcadaveris、clostridiumcarnis、clostridiumcelatum、clostridiumchauvoei、clostridiumclostridioforme、clostridiumcochlearium、clostridiumfallax、clostridiumfelsineum、clostridiumghonii、clostridiumglycolicum、clostridiumhaemolyticum、clostridiumhastiforme、clostridiumhistolyticum、clostridiumindolis、clostridiumirregulare、clostridiumlimosum、clostridiummalenominatum、clostridiumnovyi、clostridiumoroticum、clostridiumparaputrificum、clostridiumperfringens、clostridiumpiliforme、clostridiumputrefaciens、clostridiumputrificum、clostridiumsardiniense、clostridiumsartagoforme、clostridiumscindens、clostridiumsepticum、clostridiumsordellii、clostridiumsphenoides、clostridiumspiroforme、clostridiumsporogenes、clostridiumsubterminale、clostridiumsymbiosum、clostridiumtertium、clostridiumtetani、clostridiumwelchii以及clostridiumvillosum。在一个方面,治疗组合物包含一种或多种、两种或更多种、三种或更多种、或四种或更多种选自以下的非病原性拟杆菌种类:bacteroidescoprocola、bacteroidesplebeius、bacteroidesmassiliensis、bacteroidesvulgatus、bacteroideshelcogenes、bacteroidespyogenes、bacteroidestectus、bacteroidesuniformis、bacteroidesstercoris、bacteroideseggerthii、bacteroidesfinegoldii、bacteroidesthetaiotaomicron、bacteroidesovatus、bacteroidesacidifaciens、bacteroidescaccae、bacteroidesnordii、bacteroidessalyersiae、bacteroidesfragilis、bacteroidesintestinalis、bacteroidescoprosuis、bacteroidesdistasonis、bacteroidesgoldsteinii、bacteroidesmerdae、bacteroidesforsythus、bacteroidessplanchnicus、bacteroidescapillosus、bacteroidescellulosolvens以及bacteroidesureolyticus。上述的梭菌和拟杆菌可以是培养的或经纯化的,并且可以以单一组合联合使用以达到协同效应。
在一个方面,治疗组合物包含经纯化的、分离的或培养的活的非致病性梭菌和多种经纯化的、分离的或培养的活的非病原微生物,所述一种或多种属选自collinsella、coprococcus、dorea、eubacterium和ruminococcus。在另一方面,治疗组合物包含来自选自梭状芽孢杆菌、弯曲菌属、球菌属、多雷阿氏菌、真杆菌属和瘤胃球菌属的一种或多种属的多种经纯化的、分离的或培养的活的非病原微生物。
在一个方面,治疗组合物包含选自collinsella、coprococcus、dorea、eubacterium和ruminococcus的两个或更多个属。另一方面,治疗组合物包含选自巨球菌属、多雷阿氏菌、真杆菌属和瘤胃球菌属的两个或更多个属。另一方面,治疗组合物包含一种或多种、两种或更多种、三种或更多种、四种或更多种、或五种或更多种物质,其选自由下列组成的组:coprococcuscatus、coprococcuscome、dorealongicatena、eubacteriumeligens、eubacteriumhadrum、霍氏真细菌(eubacteriumhallii)、直肠细菌(eubacteriumrectale)和瘤胃球菌(ruminococcustorques)。
一方面,药物组合物处于无氧包装或容器中。另一方面,药物组合物还包含除氧剂。在一个方面,可以通过例如在容器中装入内置或夹持的除氧机构例如美国专利7,541,091中所述的除氧小球,来使容器不含氧气。另一方面,容器本身由氧清除材料制成,例如氧清除铁(如02blocktm所述)或等同物(其使用经纯化的和改性的层状粘土作为除氧铁的性能增强载体);活性铁直接分散在聚合物中。在一个方面,除氧聚合物被用于制造容器本身或者涂覆容器,或者作为要加入的粒料;例如,如在美国专利公开号为20110045222中所述,描述了具有一种或多种不饱和烯属均聚物或共聚物的聚合物共混物、一种或多种聚酰胺均聚物或共聚物、一种或多种聚对苯二甲酸乙二醇酯均聚物或共聚物,其表现出除氧活性。在一个方面,除氧聚合物被用于制造容器本身或者涂覆容器,或者作为要加入的粒料;例如,如在美国专利公开号为20110008554中所述,描述了包含聚酯、共聚酯醚和氧化催化剂的组合物,其中所述共聚酯醚包含含聚(四亚甲基-共-亚烷基醚)的聚醚链段。在一个方面,除氧聚合物被用于制造容器本身或者涂覆容器,或者作为要加入的粒料;例如在美国专利公开号为201000255231中所述,描述在聚合物基质中的分散的铁/盐颗粒,以及具有除氧颗粒的除氧膜。
在优选的方面,经纯化的粪便微生物群是从经过仔细筛选、健康的神经型人类供体获得的。从健康供体收集的粪便材料中分离微生物菌,与冷冻保存剂混合,用冷冻保存剂作为冷冻液体混悬液保存,并在以液体形式给药之前解冻。根据施用途径,经纯化的粪便微生物群可以作为新鲜的、冷冻-解冻的或冻干的活的微生物群提供。在某些情况下,经纯化的粪便微生物群以口服剂量给予人类受试者。在其他情况下,经纯化的粪便微生物群以直肠给药的形式给药。
在一些情况下,剂型包含任何适合形式的活微生物群(新鲜的、冷冻的、冻干的等),并配制成口服给药至人类受试者,通过鼻胃管、结肠镜检查或肛门给药。在一些情况下,剂量以溶液的形式给药。在其它情况下,剂量以固体剂型如胶囊、片剂,粉剂和颗粒剂的形式给药。在这样的固体剂型中,将经纯化的粪便微生物群与至少一种惰性赋形剂(或载体)、填充剂或填充剂(例如淀粉、乳糖、蔗糖、甘露醇或硅酸)、粘合剂(例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖或阿拉伯胶)、湿润剂(例如甘油)、崩解剂(例如琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、硅酸盐、碳酸钠)、吸收促进剂、润湿剂(例如鲸蜡醇或甘油单硬脂酸酯)、吸附剂(例如高岭土或膨润土)和/或润滑剂(例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠、或其混合物)。在胶囊和片剂的情况下,剂型还可以包含缓冲剂。
包含经纯化的粪便微生物群的片剂可以例如通过压制或模制活性成分,任选地用一种或多种另外的成分来制备。压制的片剂可以通过在合适的装置中压制自由流动形式的活性成分如粉末或颗粒制剂,任选地与一种或多种粘合剂、润滑剂、赋形剂、表面活性剂和分散剂来制备。模制片剂可以通过在合适的装置中模制活性成分、药学上可接受的载体和至少足够的液体混合物来模制混合物来制备。在示例性方面,剂型包含通过冻干(“冷冻干燥”)制备的粉末,由此该方法涉及在极低的压力下从经纯化的冷冻的粪便微生物群中除去水。
可以使用的具体剂量和剂量范围取决于许多因素,考虑到本公开,对于特定患者的剂量范围和最佳剂量的确定完全在本领域普通技术人员的范围内。然而,应该进一步理解的是,对于任何特定的人的具体剂量水平将取决于多种因素,包括所使用的特定化合物的活性、年龄、体重、一般健康状况、性别和人类的饮食、施用时间、施用途径、排泄率、任何药物组合、以及正在治疗的任何障碍的严重程度。
在示例性方面,经纯化的粪便微生物群以多剂量给予受试者。例如,经纯化的粪便微生物群可以按照本文提供的方法在约2天至约8周的时间内以多剂量给予受试者。
在施用经纯化的粪便微生物群之前,可将任何合适的抗生素施用给受试者。在示例性方面,抗生素是未吸收的或最低限度吸收的抗生素,例如万古霉素或利福昔明。通过任何适当的递送途径将抗生素施用给受试者。本领域技术人员可以开发适当的剂量递送方法。优选地,抗生素口服施用给受试者。另一方面,asd治疗方法不需要抗生素预处理。另一方面,asd治疗方法不需要肠制剂或肠清洁。另一方面,asd治疗方法在施用包含粪便微生物群制剂的药物组合物之前既不需要抗生素预处理也不需要清洁肠道。
在一些情况下,抗生素在进行清肠之前以多剂量施用。在一些情况下,抗生素的施用在清肠前至少七天(例如,至少7、9、10、12、14、18或21天)开始。在优选的方面,清肠之前是人类受试者的禁食。
受试者服用抗生素后,接受清肠。在示例性方面,清肠包括向受试者施用产品,例如用于结肠镜检查的商业肠制剂
在示例性方面,该方法进一步包括向受试者施用胃酸抑制剂。适用于本文提供的方法的胃酸抑制剂(也称为胃酸抑制剂)包括但不限于质子泵抑制剂(ppi)和组胺阻断剂。在某些情况下,胃酸抑制剂是prilosec,并且在口服经纯化的粪便微生物群之前一天或多天施用给受试者。在一些情况下,在经纯化的粪便微生物群口服前一周施用胃酸抑制剂。
另一方面,本文提供了包含经纯化的粪便微生物群的单位剂型。在一些情况下,本文所述的单位剂型是作为试剂盒的一部分提供的。这样的试剂盒可以包括经纯化的粪便微生物群剂量,并且任选地,将组合物施用给受试者的递送装置或者通过适当的递送途径向受试者施用剂量的说明书。在一些情况下,剂型包含任何适合形式的活微生物群(新鲜的、冷冻的、冻干的等),并配制用于口服施用于人类受试者,通过鼻胃管、结肠镜检查或肛门施用。如本文所述,适用于本文提供的试剂盒的剂型包括但不限于液体溶液剂、胶囊剂、片剂、散剂、颗粒剂和冻干剂。
另一方面,本发明提供经纯化的组合物用于制备用于治疗自闭症谱系障碍或用于降低自闭症谱系障碍的一种或多种症状的严重程度的药物的用途。
需要理解的是,本文所述的组合物、剂型和药物包括药物组合物,其中将一种或多种另外的化合物或药物加入经纯化的粪便微生物组合物中或以其他方式与其共同施用。
在此使用冠词“一”和“一个”来指代冠词的一个或多于一个(即,至少一个)语法对象。举例来说,“一个元素”意味着至少一个元素并且可以包括多于一个的元素。
以下段落列出了示例性实施例的子集。
实施例1:一种治疗人类受试者的自闭症谱系障碍的方法,包括:
(a)向人类受试者施用抗生素;
(b)受试者将人类受试者送予清肠;以及
(c)将经纯化的粪便微生物群管理至人类受试者;其中在人类受试者中处理自闭症谱系障碍。
实施例2:实施例1的方法,其中所述抗生素是口服给人类受试者的非吸收性抗生素。
实施例3:实施例1或2的方法,其中抗生素是万古霉素。
实施例4:根据前述实施例1-3中任一项所述的方法,其中所述抗生素在清肠前以多剂量施用。
实施例5:前述实施例1-4中任一项的方法,其中抗生素的施用在清肠前至少七天开始。
实施例6:如前述实施例1-4中任一项所述的方法,其中在清肠前至少十四天开始施用抗生素。
实施例7:根据前述实施例1-6中任一项所述的方法,其中所述清肠之前是人类受试者的禁食。
实施例8:根据前述实施例1-7中任一项所述的方法,其中所述经纯化的粪便微生物群是从神经型人类供体获得的。
实施例9:前述实施例1-8中任一项的方法,其中所述经纯化的粪便微生物群以口服剂量的形式施用于所述人类受试者。
实施例10:实施例9的方法,其中所述方法包括在施用经纯化的粪便微生物群之前施用酸抑制剂的步骤。
实施例11:前述实施例1-8中任一项的方法,其中所述经纯化的粪便微生物群以直肠剂量的形式施用于人类受试者。
实施例12:前述实施例1-11中任一项的方法,其中所述经纯化的粪便微生物群以多剂量施用。
实施例13:根据前述实施例12中任一项所述的方法,其中所述经纯化的粪便微生物群在约两天至约八周的时间段内以多剂量施用。
实施例14:根据前述实施例1-13中任一项所述的方法,其中所述经纯化的粪便微生物群为新鲜、冷冻-融化或冻干的活微生物群的形式。
实施例15:根据前述实施例1-14中任一项所述的方法,其中所述人类受试者显示出与方法起始之前相比,所述方法之后由儿童孤独症评定量表(cars)评估的自闭症症状严重程度显着降低。
实施例16:根据前述实施例1-14中任一项所述的方法,其中所述人类受试者显示出与方法起始之前相比,所述方法之后由儿童孤独症评定量表(cars)评估的自闭症症状严重程度至少降低10%。
实施例17:根据前述实施例1-14中任一项所述的方法,其中所述人类受试者显示出与方法起始之前相比,所述方法之后由儿童孤独症评定量表(cars)评估的自闭症症状严重程度至少降低20%。
实施例18:根据前述实施例1-17中任一项所述的方法,其中由所述方法治疗的人类受试者的特征在于与所述神经型人相比所述治疗方法之前的肠道细菌种类明显更少。
实施例19:根据前述实施例1-17中任一项所述的方法,其中与所述神经型人类相比,通过所述方法治疗的人类受试者的特征为在所述治疗方法之前少于约20%的肠道细菌种类。
实施例20:前述实施例1-19中任一项的方法,其中所述人类受试者在开始所述方法之前不呈现胃肠道不适症状。
实施例21:一种降低人类受试者的自闭症谱系严重程度的方法,包括:
(a)向自闭症人类受试者口服一种不可吸收的抗生素;
(b)受试者将自闭症人类受试者送往清肠;以及
(c)将经纯化的粪便微生物群由神经型人类供体管理至人类受试者;其中所述人类受试者在所述方法之后与在所述方法开始之前相比,通过儿童自闭症评定量表(cars)评估的症状严重程度显着减少。
实施例22:如实施例21所述的方法,其中人类受试者在所述方法之后与在所述方法开始之前相比,通过儿童自闭症评定量表(cars)评估的自闭症症状严重程度减少至少10%。
实施例23:如实施例21所述的方法,其中人类受试者在所述方法之后与在所述方法开始之前相比,通过儿童自闭症评定量表(cars)评估的自闭症症状严重程度减少至少20%。
实施方式24:根据实施方式20-22中任一项所述的方法,其中人类受试者在开始所述方法之前不呈现胃肠道不适症状。
实施例25:根据实施例1-20中任一项的方法用于治疗人类受试者中的自闭症谱系障碍的经纯化的粪便微生物群剂量。
实施例26:一种经纯化的粪便微生物群剂量,用于根据实施例21-24中任一项的方法在人类受试者中减轻自闭症谱系障碍症状的严重程度。
通过参考作为本公开的示例提供的以下非限制性实施例可以更好地理解本公开。给出以下实施例是为了更全面地说明本公开的优选方面,但决不应将其解释为限制本公开的宽范围。因此,所附权利要求的范围不应被限制于本文包含的方面的描述。
实施例
实施例1:使用微生物转移疗法(mtt)治疗自闭症儿童
fda和asu的人类受试者委员会批准了一项针对20名自闭症儿童(年龄7-17岁)的试验性研究,参与一项评估基于粪便微生物群的治疗方案的安全性和耐受性的试验,旨在通过改善胃肠道微生物的功能减少孤独症的症状。如本文所述,该治疗包括将经纯化的肠道细菌从健康人转移至被诊断为患有自闭症谱系障碍的儿童。
一般的研究设计是一项开放标签的临床试验,涉及18名自闭症诊断性面诊(adi-r)诊断为asd且有中度至重度胃肠道问题的儿童(7-17岁)。每个小孩共参加了18周的研究,治疗10周,随访8周后观察期停止。对于粪便物质移植(fmt)治疗,我们比较了两种给药途径,口服与直肠给药,然后口服维持剂量较低的给药,持续7-8周。
该协议得到了美国食品及药物管理局(调查新药号15886)和亚利桑那州立大学的机构审查委员会(asuirbprotocol#:00001053)的批准。这项研究通过电子邮件广告给亚利桑那大约2500个asd家庭,使用大风凰自闭症协会和亚利桑那州立大学自闭症/阿斯伯格研究计划的联系人名单。符合研究入选标准和排除标准的儿童有1小时的个人电话来讨论研究。打完电话后,签署家长许可表和子女同意书的家庭,都有初步问卷调查完成。我们还给他们发了一封私人医生的信,要仔细检查他们的药物,让医生知道万古霉素、prilosec和粪便移植。
从供体粪便中制备有益菌(非选择性粪便微生物群制剂)。粪便样本从仔细筛选的健康捐献者(90%的普通人群被拒绝)和广泛的经纯化收集只保留细菌。具体而言,将微生物群与从经仔细筛选的健康供体收集的粪便物质分离,以冷冻保存剂储存在具有冷冻保存剂的冷冻液体混悬液中,并在以液体形式给药之前解冻。每个经纯化的有益菌样本含有1000个或更多的细菌种类。相比之下,标准的市售益生菌包括1至10个细菌物种。
实施例2:受试者招募
该研究开始于使用自闭症诊断性面试-修订版(adi-r)的自闭症谱诊断的验证,其中adi-r评估者对父母进行了电话访问。研究医生通过与参与者的最初30分钟会议和参与者的最近2年的医疗记录和身高/体重/增长图表的广泛审查评估一般身体健康,以检查排除标准。参与者排除标准包括最近6个月和最近3个月益生菌、单基因障碍、主要脑畸形、管饲、需要立即治疗(危及生命)的严重gi问题、溃疡性结肠炎、克罗恩氏病、诊断为乳糜泻、嗜酸性粒细胞性肠胃炎、严重体重不足/营养不良、以及近期/计划的手术。神经型儿童无asd、adhd、抑郁、焦虑等精神障碍、神经型儿童无一级asd亲属。从参与者中,我们收集了最初的血液、尿液和粪便样本,父母被要求在研究开始时填写孩子的饮食日记一周。参与者主要来自亚利桑那州凤凰城地区,但有三名参与者来自该地区以外。神经型家庭是从asd家庭的朋友和asd家庭的专业人士招募的。
实施例3:试用参与者:
年龄在7-17岁之间的十八名自闭症患者(每一个来自不同的家庭)有中度至重度胃肠道疾病、中度至高度认知功能障碍。招募了20名参与者参加了这项研究,但是两名参与者在治疗开始之前没有进入研究的治疗阶段。一名参与者由于药物改变而被取消资格,一名参与者决定不参加。表2中列出了18名研究参与者的特征及其病史。进入治疗阶段的所有18名参与者完成了19周的试验。本文介绍的治疗后数据是为这18位参与者中的13位收集的。此外,还招募了来自13个家庭的20名年龄和性别匹配的神经型儿童(6个家庭中有1个神经型参与者,7个家庭中有2个神经型参与者)。这20位神经型儿童监测了18周对待。
表2.研究参与者的特征和他们的病史
实施例4:试验协议
参与者口服万古霉素(非吸收性广谱抗生素,停留在胃肠道)2周,以降低病原菌的水平,然后1天的小容量结肠镜准备
万古霉素治疗和清肠后,参与者接受2天的高剂量口服微生物转移疗法(mtt,混合在巧克力牛奶、牛奶代用品或果汁中)(剂量为2.5×1012cfu/天)或单剂量的直肠mtt剂量为2.5×1012cfu,给予类似于灌肠的剂量)。直肠给药在研究医师的直接监督下给药,第一次口服给药在医师在场的情况下同样给药。参与者被随机分配到口服或直肠给药途径。如果一个给药途径不被允许,或者如果家庭偏好另一个途径,则参与者可以选择尝试其他途径。对于初始口服剂量的参与者,口服维持剂量较低(2.5×109cfu)随后在主要口服初始剂量后8周。然而,主要直肠初始剂量之后是1周的等待期,接着是口服维持剂量(2.5×109cfu),持续7周。shgm的维持剂量是在第10周时每天口服给药。在停止治疗后,再监测参与者8周。
在口服万古霉素治疗的第12天开始每日给予普罗麦尔(奥关拉唑)以减少胃酸,从而增加mtt的存活力,并持续至维持剂量结束。表3提供了一般的治疗时间表。
表3.mtt治疗时间表总结
*万古霉素:40毫克/公斤p.0.每天分三次服用,每天不超过2克;prilosec:20mgpoqd;moviprep:使用标准试剂盒,在大约上午10点施用一半剂量,另一半在第15天下午4点施用,以净化万古霉素和粪便。剂量根据体重按比例变化。
**最初的口服途径:仅在第16和17天,第一个2天的剂量为8.3×1011个细胞,t.i.d,总日剂量为2.5×1012个细胞/天;初始直肠途径:2.5×1012个细胞,1×(仅第16天)
***维持剂量:2.5×109个细胞,1次/天p.0.
实施例5:用于mtt的粪便微生物群制剂
使用了包含高度经纯化的人粪便标准化提取物(也称为标准化人肠道微生物群(shgm))的人微生物群制剂。这是一个全谱产品,包含非常健康的捐助者的肠道中存在的所有细菌。首先,使用广泛的健康问卷和广泛的医学检测来仔细筛查捐献者,以确保最佳的gi和整体健康;筛选过程非常严格,90%的捐助者被淘汰,只留下人口中最健康的10%。捐赠的材料,然后广泛过滤和标准化,遵循fda良好生产流程(gmp)。最终产品是可以冷冻的液体形式,并被证明对治疗艰难梭菌非常有效(hamilton等人,amjgastroenterol.2012年5月;107(5):761-7)。shgm被储存在-80℃冷冻机中,然后在研究期间每周在干冰上送到家庭。指示家属将shgm保存在干冰容器中,在使用前尽快解冻。
使用两种不同剂量的shgm;高的主要剂量和较低的维持剂量。高剂量shgm的日剂量为2.5×1012个细胞。高剂量两天的基本原理是,moviprep和1天禁食大概是提供新的有益菌的最关键的时间。低剂量shgm的剂量为2.5×109个细胞。
实施例6:研究药物的耐受性
万古霉素:万古霉素与两种轻微不良事件有关。一名儿童在服用口服万古霉素后出现过敏性皮疹,但转为万古霉素而没有橙味,皮疹消失。在万古霉素开始后1-4天开始,18名儿童中的12名对万古霉素有行为反应,大多数情况下持续1-3天,尽管1名参与者出现持续3周的症状。其中7例症状轻微至中度升高,5例症状轻度至中度增高。这些行为症状消失后,胃肠道症状和孤独症症状开始好转。以前的研究报告也有类似的结果(sandler,2000),受试者的研究对象的父母已经被告知预期这一点。该反应可能是由于万古霉素杀死有害细菌而释放细菌毒素。
prilosec:这通常是很好容忍的。
微生物转移疗法(mtt)的直肠给药:6名接受者中的6名得到令人惊讶的耐受。
高剂量mtt的口服给药:13名受试者中的12名被良好耐受,但是1名参与者经历了呕吐,并且被转换到直肠途径。
维持剂量mtt的口服给药:所有参与者都很容易接受。
cbc/chempanel:对于全血细胞计数(cbc)或血液化学评估小组(cbc)的变化没有主要的担忧。观察到以下轻微变化。钾从治疗开始到结束时减少了5%(p=0.01),但是所有的水平都保持在正常范围。万古霉素(第二周研究)后,血小板增加8%(p=0.03)。四名受试者在开始时水平升高,而万古霉素后只有2名受试者升高。血尿素氮(bun)下降26%(p=0.002),但均维持在正常范围。白蛋白与球蛋白(a/g)比值增加了6%(p=0.03),其中1个略有升高。天冬氨酸氨基转移酶(ast)增加了17%(p=0.01),但都保持在正常范围。丙氨酸氨基转移酶(alt)增加了24%(p=0.003),其中1个升高,2个升高。所有这些值(血小板、bun、a/g、ast、alt)在第3次和第4次测试中恢复到与基线相似。观察红细胞指数(平均红细胞体积(mcv)、平均红细胞血红蛋白(mch)、平均红细胞血红蛋白浓度(mchc)和红细胞分布宽度(rdw))的轻微变化(1-2%)。
实施例7:不利影响
asd患儿在万古霉素治疗开始时就会出现暂时的不良反应。如表4所示,18名asd患儿(5%)中有一名参与者出现大面积皮疹,但当万古霉素从天然橙味改为无味形式时,皮疹消失。在万古霉素开始后的1-4天内,12名asd儿童对万古霉素有临时行为反应,包括活动过度(12例中7例,39%)或tantrums/aggression(12例中5例,28%)。大多数情况下症状持续1-3天,除了一个症状持续3周的参与者。症状消失后,gi症状和行为症状开始改善,类似于sandler等人的journalofchildneurology15,429-35,(2000)报道口服万古霉素治疗孤独症儿童。只有一个参与者不能耐受最初的高剂量口服shgm(恶心/呕吐),并改用初始直肠给药。
表4.不利影响
*严重的症状程度从轻到中
实施例8:胃肠道症状的评估
胃肠道症状评分量表(gsrs)是根据15个问题对前一周胃肠道症状进行评估,然后在5个领域进行评分:腹痛、反流、消化不良、腹泻和便秘。每个领域的基础上平均的问题在该领域。原来的gsrs使用了4分制的规模,但我们使用了一个修订版,其中包括7点李克特量表,也有更简单的语言。在第0、7、14、21、28、35、42、56、74和130天评估gsrs。本领域普通技术人员理解gsrs只是评估胃肠道症状的一种方式。可以使用或设计其他类似的工具来评估胃肠道症状。
在基线收集每日大便记录(dsr)两周,在治疗阶段每天和观察期的最后两周收集。这些记录包括使用布里斯托尔凳子形式规模(1=非常硬,7=液体)的凳子评级。
实施例9:孤独症和相关症状的评估
自闭症诊断性面试-修订(adi-r)是一项2小时的结构式面试,是自闭症临床诊断和自闭症谱系障碍的主要工具之一。它并不是衡量自闭症严重程度的指标,但分数越高,症状越严重。adi-r被用来验证asd入组的诊断。
parentglobalimpressions-iii作为pgi-r的扩展版本在这里介绍。参见adams等人的effectofavitamin/mineralsupplementonchildrenwithautism,bmcpediatrics,11:111(2011)。pgi-iii评估了17个地区的变化(见图13),总体而言,使用了从“更糟糕”到“好得多”的7分制。通过计算pgi-2-final的所有18个分数的平均值来计算“平均变化”。选择此工具是因为发现直接询问父母关于观察到的变化比让他们在开始和结束时估计症状更加可靠,然后计算差异。此外,使用7分制来检测变化似乎对变化具有高度的敏感性。
儿童孤独症评定量表(cars)是一个15项量表,可用于诊断孤独症和asd,并评估症状的总体严重程度。cars评估是在同一评估者进行adir评估之后完成的。
异常行为清单(abc)评估asd患儿常见的五个问题行为,包括烦躁不安、嗜睡、刻板、多动和不适当的言语。
社会响应量表(srs)是一个评估社会障碍的65项量表,它是自闭症的一个核心问题,包括社会意识、社交信息处理、互惠社交沟通能力、社交焦虑/回避、自闭症的专注和特征。参见constantino等人的validationofabriefquantitativemeasureofautistictraits:comparisonofthesocialresponsivenessscalewiththeautismdiagnosticinterview-revised.jautismdevdisord.2003aug;33(4):427-33。
文兰适应行为量表ii(vabs-ii)是衡量四个不同领域的功能水平:沟通、日常生活技能、社会化和运动技能,以及11个子领域。原始分数转换成年龄相当分数。它补充了评估问题行为的abc。参见sara等人的vinelandadaptivebehaviorscales,secondedition(vinelandtm-ii),pearsonpublishing,2005。
在第0、7、14、21、28、35、42、56、74和130天评估gsrs和pgi-r3。在治疗期间每天评估大便记录。cars、abc和srs在基线,治疗结束时和观察期结束时进行评估。vabs-ii仅在基线和观察期结束时进行评估,因为它很长,我们相信它对短时间内不那么敏感,因为它评估了具体适应技能的变化。cars由专业评估员评估,gsrs、pgi-r2、abc、srs和vabs-ii由家长评估。
实施例10:初始观察
胃肠道症状:万古霉素治疗2周、益菌8周后,大多数儿童胃肠道症状得到迅速改善。治疗结束时,胃肠道症状评分量表(gsrs)的平均评分减少82%(图1和图3)。如图所示。在图2和图5中,所有4个gsrs子量表面积(腹痛、消化不良、腹泻、便秘)大致相同。回流分量表没有变化,因为没有一个孩子有明显的反流问题。18名儿童中有16名减少了70%或更多,1名减少了30%,1名没有变化。对于直肠给药组和口服给药组都获得了类似的结果。
自闭症症状:在治疗阶段结束时,父母对孩子的自闭症状进行评分,总体评分为:更好-4;更好-8;略好-5;很少/没有变化-1。最大的改进是地理标志、言语、社交、接受语言、认知、烦躁/情绪、焦虑和游戏技巧(图3)。对于由我们的经验丰富的评估员评估的儿童孤独症评定量表(cars),cars评分下降了22%,p<0.001,这与父母的观察一致。对于异常行为清单(abc),总分减少了27%,p=0.001(图4)。对于直肠给药组和口服给药组都获得了类似的结果。
后处理:在完成8周治疗后观察期的前5位参与者中,在接受不治疗2个月后,平均观察不到改善的胃肠道症状改变(治疗结束时gsrs比开始减少73%,不治疗8周后比开始减少71%)。在治疗后孤独症症状方面,pgi评分在治疗结束时持续改善,3名参与者大改善,2名参与者没有检测到改变(图7)。在治疗后cars评分方面,这5名儿童在治疗结束时cars评分下降了16%,与未治疗(观察)结束时的基线相比下降了25%。所以,即使治疗停止后,症状仍然出现令人惊讶的持续改善。
这些数据表明,在联合治疗仅10周后,使用儿童孤独症评定量表(cars)分配的孤独症严重程度评分减少了22%(图3)。cars的改善程度似乎与年龄无关(图6)。这表明治疗对于年幼的儿童和成年人都是有用的。此外,cars的改善程度与最初的gsrs评分不相关(图8)。这表明治疗对轻度胃肠道症状患者以及没有胃肠道症状的患者有帮助。换句话说,无论是否存在胃肠道症状,治疗似乎都能有效地减少自闭症状。这一观察结果与我们以前的研究(kang等人,plosone8(7):e68322(2013))报道的数据一致,从中我们得出结论:asd患儿的肠道细菌多样性低,这与他们的胃肠道症状无关。
实施例11:最终结果和分析
临床上,这项研究取得了广泛的成功。首先,所有asd参与者完成了为期18周的研究。其次,根据胃肠道症状评定量表(gsrs)评估的胃肠道症状在腹痛、消化不良、腹泻和便秘方面显着改善,平均gsrs评分从治疗开始到结束下降了82%,停药8周后仍有改善(比基线下降77%)(双尾t检验,分别为t=-9.45,p<0.001;t=-7.64,p<0.001)(图9,图a)。在gsrs评估的大部分区域(包括腹痛、消化不良、腹泻和便秘)中观察到稳定且大程度的改善(图10,图a)。由于没有儿童在研究开始时有明显的反流,因此反流几乎没有变化。值得注意的是,两种表面上相反的胃肠症状-腹泻和便秘-有效地对mtt治疗作出了响应。
类似地,每日便便记录(dsr)显示有异常或没有粪便的天数显着减少,并且在不治疗8周后保持这些改善(表5、图10、图b)。为了评估研究期间粪便硬度/软度的变化,收集每日粪便记录(dsr)并平均两周以上。总的来说,在10周的mtt治疗期间,我们观察到“硬、软/液、无粪便%天”明显减少62%至34%(p=0.001)(表5、图10、图b)。在观察期间的后8周内,这些改善保持稳定。详细地说,在10周的mtt治疗期间,“硬粪便百分比”(类型1或2)和“软/液体粪便%天数”(类型6或7)显着降低,但是“%天数没有大便”没有意义。(表5)。
表5:基于每日粪便记录(dsr)和布里斯托尔粪便形态量表的无粪便百分比,粪便硬度和软度
第三,万古霉素治疗仅有暂时的不良反应(主要是轻度到中度的过度活跃和发脾气/攻击)(表4),但血液化学或长期副作用没有大的变化。
除了这些胃肠道改善之外,随着mtt的改善,与asd相关的行为也有所改善。首先,评估17种asd相关症状的父母全局印象(pgi-r)评估显示治疗期间显着改善,治疗结束后8周未恢复(图9,图b)。此外,gsrs和pgi-r之间的显着负相关(spearman相关性检验显示r=-0.59和p<0.001,图11)表明gi症状影响asd行为,并且这些可以通过mtt改变。在第10周的mtt治疗结束时,父母用pgi-r评估了他们的儿童自闭症症状的改变,在gi分数中最大的改善是在17个分量表和pgi-r的“整体自闭症/相关症状”(图12)。具体而言,pgi-r的总体评分为:好得多:n=4(22%);更好:n=8(44%);略好:n=5(28%);很少/没有变化:n=1(6%)。其他分量表的改进如图12所示。
其次,评估核心asd症状的儿童孤独症评定量表(cars)治疗开始至治疗结束时降低了22%,未治疗8周后降低了24%(p<0.001、图9、图c)。
第三,asd患儿在社会响应量表(srs)-评估社交能力缺陷(图9,d)和异常行为清单(abc)-评估烦躁不安、活动过度、嗜睡、刻板和异常言语(图9、图e)中的分数有所提高。在图10中,图c还显示了abc分析的更详细的分类,以评估对asd儿童中常见行为的治疗效果:易怒、嗜睡、刻板、活动过度和不适当的言语。在所有五个分量表中,观察到治疗结束时显着减少。
第四,文兰适应行为量表ii(vabs-li)评分发现平均发育年龄在mtt期间增加了1.4年(p<0.001,vabs-ii)并跨越所有子领域(图13);尽管最终的vabs-ii评分仍然低于其年龄。vabs-ii是基于11个子领域的四个不同领域的功能水平的量度:沟通、日常生活技能、社会化和运动技能。在11个分量表中,排除了精细运动技能和大运动技能,因为vineland的这两个分量表只计算了6.8年,大多数asd患儿接近评分极限。比较基线和研究结束时的其他9个分量表及其平均值。mtt治疗导致平均发育年龄显着增加,从基线5.4岁到研究结束时的6.8岁(p<0.001)。在研究的18周内增加1.4年是一个大幅增加,但仍低于10.9岁的年龄。人际交往能力(2.2年)、个人生活技能(1.8年)和应对技能(1.7年)增幅最大的所有9个分量表领域都有显着改善(图13)。值得注意的是,asd的主要障碍,即接受性语言、表达性语言和人际交往能力是初始评分最低的,初始发育年龄分别为3.1岁、4.5岁和2.9岁;三个领域分别有1.3、1.1和2.2年的实质性改善。
最后,mtt似乎对年轻人和老年人(年龄与gsrs或cars改善之间没有显着的相关性)以及最初的mtt是否是口服或直肠给药都有益。根据我们的样本量,mtt最初是直肠给药还是口服给药,在治疗效果或临床结果方面没有观察到差异。
这些研究结果表明,在18个asd患儿中,mtt是安全的、耐受性良好。mtt也是有效的,因为它导致治疗后持续至少8周的gi和行为相关症状的显着改善。
- 还没有人留言评论。精彩留言会获得点赞!