一种防治脂肪肝和肥胖的药物及其在制药中的应用的制作方法
本发明属于医药技术领域,具体涉及化合物borapetoside E及以该化合物作为活性成分的药物组合物在制备防治脂肪肝和肥胖方面的药物中的新用途。
技术背景:
2008年,世界卫生组织估计,成人中超重人数已经有14亿,其中有5亿为肥胖患者,2030年,肥胖患者人数将达到10亿。肥胖是导致脂肪肝、2型糖尿病、心血管疾病及高血压等代谢性疾病的主要原因,这些疾病严重影响了人们的生活质量并造成了大量的医疗花费。近年来的研究发现,固醇调节元件结合蛋白(SREBPs,Sterol regulatory element binding proteins transcription factors)对维持机体能量代谢平衡具有重要影响。SREBP主要包括SREPB‐1和SREBP‐2两个家族,其中SREBP‐1主要与甘油三酯和脂肪酸的合成有关,而SREBP‐2主要与胆固醇合成有关。近年来,大量研究证实,通过基因敲出或小分子化合物的手段抑制SREBP的表达或激活都能够起到防治代谢性疾病的作用,如糖尿病、肥胖、脂肪肝及动脉粥样硬化等。因此,SREBP已经成为治疗该类代谢性疾病的潜在靶点。
防己科植物波叶青牛胆是一种传统的药用植物,在古代就被广泛运用于治疗发热、骨折及疥疮等多种疾病。波叶青牛胆主要分布于中国南方以及柬埔寨、印度、印度尼西亚、老挝、马来西亚、缅甸、菲律宾以及泰国等东南亚地区。20世纪80年代,人们首次从该植物的茎中提取到了一类克罗烷二萜糖苷类化合物,其为该植物茎的主要成分,包括borapetoside A‐H 8个单体化合物。关于borapetoside E治疗脂肪肝以及肥胖的药理作用未见报道。本发明发现borapetoside E具有显著改善脂肪肝和肥胖的作用,其作用机制是与抑制肝脏SREBP蛋白的表达有关。
技术实现要素:
:
本发明的目的在于提供一种化合物borapetoside E或含有该化合物为主要活性成分的药物组合物在制备防治脂肪肝和肥胖的药物、保健品和功能食品中的新用途,以及该化合物作为SREBP抑制剂的工具药物的新用途。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
如下结构式所示的化合物borapetoside E在制备治疗和预防脂肪肝和肥胖的药物、保健品或功能食品中的应用,
本发明同时提供了一种用于治疗和预防脂肪肝和肥胖的药物组合物、保健品或功能食品,其中含有治疗有效量的化合物borapetoside E及其在药学上可接受的盐及其载体。
本发明还提供了化合物borapetoside E在制备SREBP抑制剂的工具药物中的应用。
本发明另外提供了所述的药物组合物在制备治疗和预防脂肪肝和肥胖的药物、保健品或功能食品中的应用;
以及,所述的药物组合物在制备SREBP抑制剂的工具药物中的应用。
经过大量多次的独立重复试验,本发明发现borapetoside E能够显著改善HFGD小鼠的的脂肪肝、肥胖症状及能量代谢。其作用机制可能与下调固醇调节元件结合蛋白(SREBP)有关。
本发明化合物用作药物时,可以直接使用,或者以药物组合物的形式使用。也可以与其他药物组成复方的形式使用,该药物组合物含有0.1~99%,优选为0.5~90%的本发明化合物,其余为药物学上可接受的,对人和动物无毒和惰性的药物制剂常用的药用载体和/或赋形剂。将本发明的药物组合物以单位体重服用量的形式使用。可以使用不同的药用辅料,制成固体制剂(片剂、胶囊剂、颗粒剂、散剂等)或液体制剂(注射剂、溶液剂、混悬剂、乳剂、糖浆剂等)。本发明的药物可经口服和注射(静脉注射、静脉滴注、肌肉注射、皮下注射、腹腔注射等)形式给药。
附图说明
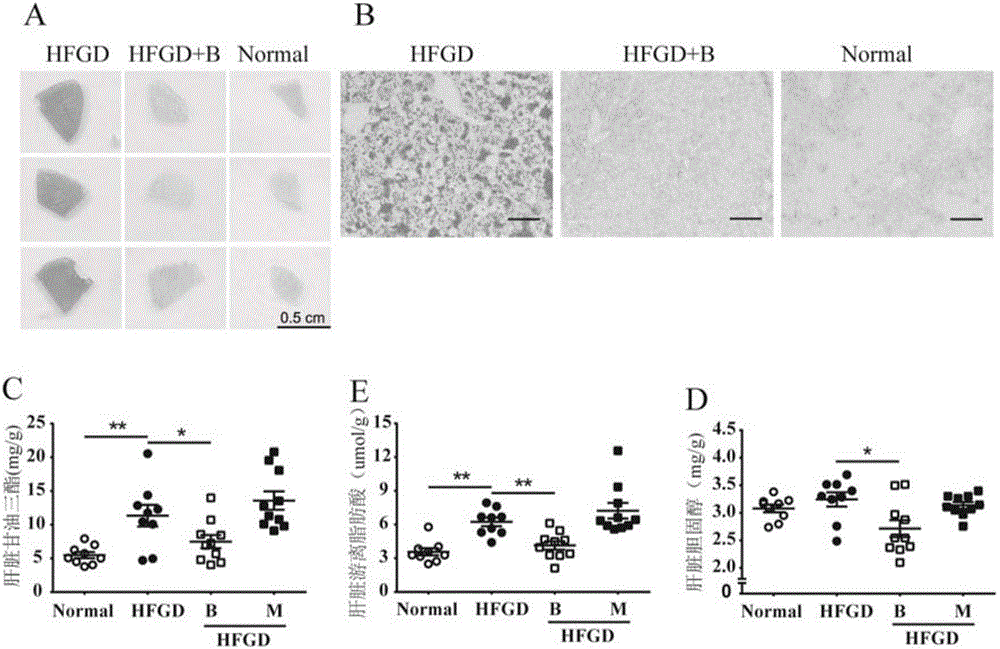
图1为Borapetoside E对高脂高糖饮食(HFGD)诱导小鼠脂肪肝的影响;
图1中,(A和B)肝脏冰冻切片油红O染色,标尺长度分别为0.5cm(A)和100μm(B),n=6。(C‐E)分别为肝脏TG,CHO和FFA的含量n=9‐10。Normal,正常饮食对照组;HFGD,高脂高糖饮食组;B,40mg/kg borapetoside E;M,200mg/kg二甲双胍。组间比较使用独立样本T检验,*P<0.05,**P<0.01,误差线为标准误。
图2为Borapetoside E对小鼠体重和饮食的影响;
图2中A平均每只小鼠饮食量,n=6。(B)小鼠体重变化,n=6。Normal,正常饮食对照组;HFGD,高脂高糖饮食组;B,40mg/kg borapetoside E。组间比较使用独立样本本T检验,*P<0.05,**P<0.01,误差线为标准误。
图3为Borapetoside E对小鼠脂肪组织中脂肪细胞大小及脂含量影响;
图3.(A)脂肪组织HE染色,标尺为100μm,n=6。(B‐D)分别为脂肪组织中TG,CHO和FFA的含量,n=9‐10。Normal,正常饮食对照组;HFGD,高脂高糖饮食组;B,40mg/kg borapetoside E;M,200mg/kg二甲双胍。组间比较使用独立样本T检验,*P<0.05,**P<0.01,误差线为标准误。
图4为Borapetoside E对小鼠能量消耗的影响;
图4中.(A和B)分别为小鼠夜晚和白天的氧气消耗量,n=6。(C和D)分别为小鼠夜晚和白天的能量消耗量,n=6。HFGD,高脂高糖饮食组;B,40mg/kg borapetoside E;Dark,夜间;Light,白天;EE,能量消耗。组间比较使用独立样本T检验,**P<0.01,误差线为标准误。
图5为Borapetoside E抑制高脂饮食(HFD)诱导小鼠SREBP的表达;
图5.(A)SREBP‐1及其下游靶基因mRNA表达量。(B)SREBP‐2及其下游靶基因mRNA表达量。(C)肝脏SREBP蛋白表达量;下左:前体SREBP的表达量;下右:剪切后的SREBP表达量。Normal,正常饮食对照组;HFD,高脂饮食组;B,40mg/kg borapetoside E;M,200mg/kg二甲双胍;组间比较使用独立样本T检验,n=6‐7,*P<0.05,**P<0.01,误差线为标准误,各组均与HFD组比较。
具体实施方式:
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1:
波叶青牛胆藤采集于2012年采于云南思茅,干重15千克,粉碎,用95%乙醇室温下冷浸提取三次(每次25升),每次5天。减压回收浓缩得到提取物1100克,进行硅胶柱层析,用石油醚/丙酮混合溶剂梯度洗脱(99:1至0:100),得到A‐G 7个组分。组分E(180克)再进行硅胶柱层析,用氯仿/甲醇混合溶剂梯度洗脱(40:1至5:1)得到三个组分E1‐E3。组分E1通过Sephadex LH‐20柱反复层析,甲醇洗脱,得到5.3克纯化合物borapetoside E。化合物结构的鉴定通过波谱数据的比较和解析确定。
1、Borapetoside E对高脂高糖饮食(HFGD)诱导小鼠脂肪肝的影响:
3‐4周健康雄性C57BL/6J小鼠,购于中国医学科学院医学实验动物研究所,实验动物生产许可证号:SCXK 2014‐0004。动物饲养于无菌条件:室温为22‐25℃,相对湿度60~70%,动物自由饮水摄食。其中模型组动物给予45%高脂饲料喂养20周,并于第13周至20周给予10%果糖水,正常组给予普通饲料和正常饮用水。20周后动物按照血糖均匀分为正常组,模型组,40mg/kg borapetoside E组。动物前2.5天每天给药2次,后面每天1次,持续至第16天。第16天给药两小时后,处死动物,取部分肝脏保存于4%多聚甲醛,用蔗糖梯度脱水后,使用冰冻切片机切10μm厚片,使用0.3%油红O进行染色观察。
另取部分肝脏,按照1:9加入相应体积的无水乙醇(100mg:0.9ml),匀浆后于4℃离心6000转/分,10min后取上清,使用试剂盒(南京建成)检测甘油三酯(TG),总胆固醇(CHO)以及游离脂肪酸(FFA)的含量。
结果显示borapetoside E处理后HFGD小鼠的脂肪肝得到显著缓解(图1.A和B);同时borapetoside E显著降低了小鼠肝脏中TG、CHO以及FFA的含量(图1.C‐D),而二甲双胍对肝脏组织中的脂含量无显著影响。
2、Borapetoside E对高脂高糖(HFGD)饮食诱导小鼠肥胖的影响
(1)Borapetoside E对小鼠体重饮食的影响
HFGD小鼠给药处理方式同前所述,小鼠按体重均等分组。给药期间检测小鼠饮食量和体重变化,持续至第16天,平均饮食摄入量=整笼动物总饮食量/小鼠只数。结果显示,虽然小鼠饮食不受影响,但borapetoside E显著降低了肥胖动物的体重(图2A和B),其可能与增加小鼠的能量消耗有关(图4.A‐D)。
(2)Borapetoside E对小鼠脂肪组织中脂含量影响
动物为(1)中的同批小鼠,于第16天给药后取脂肪组织保存于4%多聚甲醛,脱水后进行石蜡切片,切片厚度为5μm,脱蜡后使用苏木素‐伊红(HE)对切片进行染色,显微镜下观察拍照。另取部分脂肪组织,按检测肝脏脂含量的方法检测组织内甘油三酯(TG),总胆固醇(CHO)以及游离脂肪酸(FFA)的含量。结果如图3所示,borapetoside E处理后,HFGD小鼠腹部的脂肪细胞显著缩小至正常对照组水平,脂肪组织中TG和FFA水平也显著降低。
(3)Borapetoside E对小鼠能量消耗的影响
另取一批HFGD小鼠,按相同给药方式和剂量给药5次后使用TSE PhenoMaster/LabMaster系统(购于德国TSE公司)检测小鼠夜间氧气消耗量VO2及能量消耗(EE,Energy expenditure),检测时间为29个循环(每个循环检测时间为27分钟),取第2至第29个循环进行统计分析。结束后动物取出饲养休息一天,并在该天继续给药两次,末次给药(第7次)后检测小鼠白天氧气消耗量VO2及能量代谢,检测方法与之相同。为减少饮食对小鼠代谢影响,检测期间对小鼠进行禁食不禁水。结果显示,borapetoside E显著增加HFGD小鼠氧气和能量的消耗(图4.A‐D)。
4、Borapetoside E抑制高脂饮食(HFD)诱导小鼠SREBP的表达
3‐4周健康雄性C57BL/6J小鼠,来源及饲养与实施方式1相同,其中模型组动物给予45%高脂饲料喂养20周,正常组给予普通饲料和正常饮用水。小鼠按相同方式给药5次,末次给药2h后处死小鼠,取肝脏组织,按照试剂盒(天根生物科技有限公司)要求提取总RNA,并进行荧光定量PCR实验,检测SREBP及其下游靶基因的表达量。
另取一部分肝脏组织,使用9倍体积的蛋白裂解液(碧云天生物科技有限公司)充分匀浆后于4℃12000转/分离心15分钟,取上清裂解液进行蛋白免疫印记(western blot)实验,检测SREBP‐1蛋白表达量。
结果显示borapetoside E显著抑制了SREBP‐1及其下游有关脂肪酸和甘油三酯合成的靶基因(图5.A);同时显著抑制了SREBP‐2及其下游有关胆固醇合成的靶基因(图5.B)。与此结果一致,肝脏中SREBP蛋白的前体形式(pre‐SREBP‐1)及激活形式(n‐SREBP‐1)都受到了borapetoside E的显著抑制(图5.C)。
实施例2:
保健食品的制备:
取borapetoside E 15.5毫克,加入淀粉200毫克,乳糖66.6毫克,薄荷醇1毫克,羧甲基淀粉钠50.6毫克,制成含片,作为保健食品。
实施例3:
注射液制剂的制备:
按实施例1的方法先得到本发明的化合物borapetoside E 50mg,将其溶解于2毫升丙二醇中,过滤所得溶液在无菌条件下装入安瓿瓶中。
实施例4:
粉剂的制备:
按实施例1的方法先得到本发明的化合物borapetoside E,与赋形剂重量比为9:1的比例加入赋形剂,制成粉剂。
实施例5:
片剂的制备:
按实施例1的方法先得到本发明的化合物borapetoside E,按其与赋形剂重量比为1:5‐1:10的比例加入赋形剂,制粒压片。
实施例6:
口服液制剂的制备:
按实施例1的方法先得到本发明的化合物borapetoside E,按常规口服液制法制成口服液。
实施例7:
胶囊剂、颗粒剂、或冲剂的制备:
按实施例1的方法先得到本发明的化合物borapetoside E,按其与赋形剂重量比为5:1的比例加入赋形剂,制成胶囊或颗粒剂或冲剂。
- 还没有人留言评论。精彩留言会获得点赞!