山奈酚在制备用于预防和/或治疗由睾酮水平过高引起的疾病的药物中的用途的制作方法
本发明涉及医药技术领域,特别涉及山奈酚在制备用于预防和/或治疗由睾酮水平过高引起的疾病的药物中的用途。
背景技术:
睾酮(testosterone,T)作为最主要的雄激素在人体尤其是男性机体中发挥着至关重要的作用。睾酮水平过高,会引起痤疮、男性脱发、前列腺增生、前列腺癌等病变。另外,睾酮在前列腺的发生中起着重要作用,高于正常水平的睾酮是引发和促进前列腺增生的重要因素。
山奈酚(Kaempferol,Kae)又名山柰酚-3、山柰素、山柰黄酮醇、四羟基黄酮、百蕊草素Ⅲ,分子结构式为C15H10O6,是一个自然存在的黄酮类化合物。山奈酚广泛存在于各种普通植物种属中,如翠雀属、山茶属、小檗属、柑橘属、芸苔属、葱属、苹果属等等,也存在于很多药用植物中,如芦荟、藏红花、大戟、银杏、贯叶连翘、余甘子、黑加仑、迷迭香等,还存在于很多可食用的植物中,如洋葱、香葱、芥末、花椰菜、芹菜等。研究发现长期通过膳食摄取山奈酚这种很常见的黄酮类化合物,可以降低晚期大肠腺瘤的复发率,可以明显降低患胰腺癌的风险。此外,山奈酚对胶质母细胞瘤、肺癌、胰腺癌都有很好的抑制作用。
技术实现要素:
本发明人通过广泛研究发现,山奈酚能够降低血清睾酮含量,并基于此完成了本发明。
本发明提供了山奈酚在制备用于预防和/或治疗由睾酮水平过高引起的疾病的药物中的用途。
在本发明的一个具体实施方式中,所述山奈酚通过降低血清睾酮含量来预防和/或治疗所述由睾酮水平过高引起的疾病。
在本发明的一个优选的实施方式中,所述山奈酚进一步通过将LNCaP细胞、BPH-1细胞和/或WPMY-1细胞阻滞于细胞分裂的G2/M期来预防和/或治疗所述由睾酮水平过高引起的疾病。
本文所说的“LNCaP细胞”是前列腺癌细胞系的一种,是从前列腺癌患者的淋巴结转移灶标本中建立起来的,保留了前列腺癌肿瘤细胞学及其早期分化功能的特征。
本文中,BPH-1细胞是人前列腺增生细胞(上皮细胞),WPMY-1细胞是人前列腺间质细胞,上皮细胞和间质细胞是前列腺的主要组成成分。
本文所说的“细胞分裂的G2/M期”是指细胞分裂间期的G2期和分裂期(M期)。细胞周期分为间期与分裂期两个阶段。间期又分为三期,即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期),其中G2期是有丝分裂的准备期,在这一时期,DNA合成终止,大量合成RNA及蛋白质,包括微管蛋白和促成熟因子等。分裂期又包括前、中、后,末期,是一个连续变化过程,由一个母细胞分裂成为两个子细胞。细胞通过M期一分为二,有的可继续分裂进行周期循环,有的转入G0期。G0期是脱离细胞周期暂时停止分裂的一个阶段,但在一定适宜刺激下,又可进入分裂周期。
在本发明的另一个优选的实施方式中,所述山奈酚进一步通过促进细胞凋亡相关蛋白Bax、Bid和/或Caspase-3蛋白的表达来预防和/或治疗所述由睾酮水平过高引起的疾病。
在本发明的另一个具体实施方式中,所述由睾酮水平过高引起的疾病选自痤疮、男性脱发、良性前列腺增生和前列腺癌。
在本发明的一个优选的实施方式中,所述药物给予有需要的对象的每日剂量以山奈酚计为10-150mg/kg体重,优选为30-120mg/kg体重,更优选为50-100mg/kg体重。
在本发明的另一个优选的实施方式中,所述药物给予有需要的对象的有效浓度以山奈酚计为0.5-25μM,优选1-20μM。
在本发明的另一个优选的实施方式中,所述药物给予有需要的对象的有效浓度以山奈酚计为5-20μM,优选10-20μM,更优选15-20μM。
在本发明的又一个优选的实施方式中,所述药物给予有需要的对象的有效浓度以山奈酚计为20μM。
发明人发现,山奈酚通过降低血清睾酮含量,和/或通过将LNCaP细胞、BPH-1细胞和/或WPMY-1细胞阻滞于细胞分裂的G2/M期,和/或通过促进细胞凋亡相关蛋白Bax、Bid和/或Caspase-3蛋白的表达,和/或通过促进AR核转位来预防和/或治疗由睾酮水平过高引起的疾病,特别是良性前列腺增生和前列腺癌。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1显示了山奈酚对BPH-1(左图)和WPMY-1细胞(右图)增殖的影响(MTT法);其中C=Control(对照组),与对照组比较*P<0.05,**P<0.01,***P<0.001;
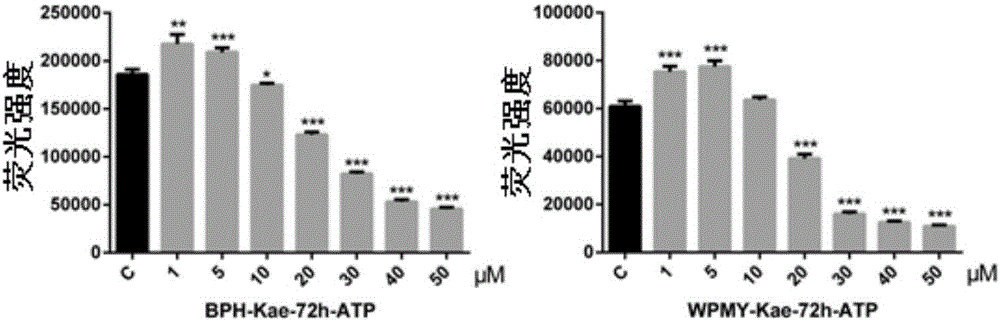
图2显示了山奈酚对BPH-1(左图)和WPMY-1细胞(右图)增殖的影响(细胞活力);其中C=Control(对照组),与对照组比较*P<0.05,**P<0.01,***P<0.001;
图3显示了不同浓度山奈酚对BPH-1细胞周期的影响;
图4显示了不同浓度山奈酚对LNCaP细胞周期的影响;
图5显示了不同浓度山奈酚对LNCaP细胞凋亡蛋白的影响;
图6显示了山奈酚对大鼠饮水的影响,其中,A:各组大鼠每日饮水量;B:各组大鼠每日平均饮水量;与假手术组(Sham组)比较#P<0.05,##P<0.01,###P<0.001;与模型组(Model组)比较*P<0.05,**P<0.01,***P<0.001;
图7显示了山奈酚对大鼠良性前列腺增生的影响。其中,A:各组大鼠前列腺形态;B:前列腺指数;C:各组大鼠前列腺组织病理形态。与假手术组(Sham组)比较#P<0.05,##P<0.01,###P<0.001;与模型组(Model组)比较*P<0.05,**P<0.01,***P<0.001;
图8显示了山奈酚对良性前列腺增生大鼠血清中睾酮含量的影响,其中,A:给药两周后的血清睾酮含量,B:给药四周后的血清睾酮含量;其中与假手术组(Sham组)比较#P<0.05,##P<0.01,###P<0.001;与模型组(Model组)比较*P<0.05,**P<0.01,***P<0.001。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1山奈酚对BPH-1和WPMY-1细胞增殖的影响
(1)MTT实验
BPH-1细胞用10%FBS RPMI 1640培养。实验前换用2%活性炭过滤的FBS RPMI 1640接种到96孔细胞培养板,接种5×103个细胞/孔。细胞种板24小时贴壁后,换液,加药,药物分别作用72小时。组别设置分别为:对照组;Kae(1μM、5μM、10μM、20μM、30μM、40μM、50μM)组。
WPMY-1细胞用10%FBS DMEM培养。实验前换用2%活性炭过滤的FBS DMEM接种到96孔细胞培养板,接种5×103个细胞/孔。细胞种板24小时贴壁后,换液,加药,药物分别作用72小时。组别设置分别为:对照组;Kae(1μM、5μM、10μM、20μM、30μM、40μM、50μM)组。
药物作用72小时后从培养箱取出细胞,每孔加入10μl MTT溶液,37℃孵育4小时。然后吸弃细胞孔里的液体,每孔加入100μl DMSO溶液,检测570nm波长处OD值。
如表1和图1所示,MTT检测结果显示,Kae在20μM-50μM浓度下显著抑制了BPH-1细胞增殖(P<0.01,P<0.001);在10μM-50μM浓度下显著抑制了WPMY-1细胞增殖(P<0.05,P<0.01,P<0.001)。
表1山奈酚对BPH-1和WPMY-1细胞增殖的影响(MTT)
注:与对照组比较*P<0.05,**P<0.01,***P<0.001。
(2)细胞活力实验
BPH-1细胞用10%FBS RPMI 1640培养。实验前换用2%活性炭过滤的FBS RPMI 1640接种到96孔细胞培养板,接种1×104个细胞/孔。细胞种板24小时贴壁后,换液,加药,药物作用72小时。组别设置分别为:培养液对照组、未加药对照组;Kae(1μM、5μM、10μM、20μM、30μM、40μM、50μM)组。
WPMY-1细胞用10%FBS DMEM培养。实验前换用2%活性炭过滤的FBS DMEM接种到96孔细胞培养板,接种1×104个细胞/孔。细胞种板24小时贴壁后,换液,加药,药物作用72小时。组别设置分别为:培养液对照组、未加药对照组;Kae(1μM、5μM、10μM、20μM、30μM、40μM、50μM)组。
从冰箱拿出CellTiter-Buffer、CellTiter-Substrate放置至室温。将11ml缓冲液加到底物的瓶子里配制CellTiter-Glo试剂。轻轻旋转或翻转混匀。药物作用72小时后从孵箱中取出96孔黑色细胞培养板,室温下放置30分钟。从每孔吸出50μl培养液,加入50μl CellTiter-Glo试剂。在摇床上混匀2分钟。室温下放置10分钟稳定荧光信号,读取荧光值。
如表2和图2所示,细胞活力检测结果显示,Kae在10μM-50μM浓度下显著抑制了BPH-1细胞增殖P<0.05,P<0.001);在20μM-50μM浓度下,显著抑制了WPMY-1细胞增殖P<0.001)。
表2山奈酚对BPH-1和WPMY-1细胞增殖的影响(细胞活力)
注:与对照组比较*P<0.05,**P<0.01,***P<0.001。
实施例2山奈酚对BPH-1细胞周期的影响
BPH-1细胞用10%FBS RPMI 1640培养。实验前,换用2%活性炭过滤的FBS RPMI 1640接种到6孔细胞培养板,接种1.5×105个细胞/孔。细胞种板24小时贴壁后,换液,加药,药物作用48小时。组别设置分别为对照组(DMSO);Kae(5μM,10μM,20μM)组。
药物作用一定时间后,从细胞培养箱取出细胞,吸弃培养液,用预冷的PBS溶液洗细胞一次,每孔加入300μl不含EDTA和酚红0.25%胰蛋白酶消化液,消化细胞2分钟左右,待细胞松动脱落加入300μl 5%活性炭过滤的FBS RPMI 1640中和胰酶。然后将细胞收集到1.5ml离心管里,4℃离心1000rpm,5分钟,吸弃上清,收集细胞。每管加入1ml预冷的PBS溶液再洗细胞一次。4℃离心1000rpm,5分钟,吸弃上清,收集细胞,每管加入1ml 70%乙醇(提前置于-20℃冰箱预冷过夜)轻轻混匀,4℃固定过夜。4℃离心1000rpm,5分钟,吸弃上清,加入1ml预冷的PBS溶液再洗细胞一次。4℃离心1000rpm,5分钟,吸弃上清,每管加入500μl FxCycleTMPI/Rnase染色溶液,室温避光孵育15-30分钟。然后上机检测。
实验数据以均数±标准差表示,采用SPSS17.0统计软件对进行数据统计分析。采用单因素方差分析(one-way ANOVA)进行多组间两两比较,当*P<0.05认为检验结果有差异显著性,当**P<0.01被认为检验结果有极显著差异。
如表3和图3所示,流式细胞检测结果显示在10μM和20μM浓度下,Kae能够提高G2/M期DNA含量。
表3山奈酚对BPH-1细胞周期的影响
实施例3山奈酚对LNCaP细胞周期的影响
LNCaP细胞用10%FBS RPMI 1640培养。实验前,换用5%活性炭过滤的FBS RPMI 1640培养72小时,然后用1%活性炭过滤的FBS RPMI 1640接种到6孔细胞培养板,接种1.5×105个细胞/孔。细胞种板48小时贴壁后,换液,加药,药物作用72小时。组别设置分别为对照组(DMSO),Kae(5μM,10μM,20μM)组。
药物作用一定时间后,从细胞培养箱取出细胞,吸弃培养液,用预冷的PBS溶液洗细胞一次,每孔加入300μl不含EDTA和酚红0.25%胰蛋白酶消化液,消化细胞2分钟左右,待细胞松动脱落加入300μl 5%活性炭过滤的FBS RPMI 1640中和胰酶。然后将细胞收集到1.5ml离心管里,4℃离心1000rpm,5分钟,吸弃上清,收集细胞。每管加入1ml预冷的PBS溶液再洗细胞一次。4℃离心1000rpm,5分钟,吸弃上清,收集细胞,每管加入1ml 70%乙醇(提前置于-20℃冰箱预冷过夜)轻轻混匀,4℃固定过夜。4℃离心1000rpm,5分钟,吸弃上清,加入1ml预冷的PBS溶液再洗细胞一次。4℃离心1000rpm,5分钟,吸弃上清,每管加入500μl FxCycleTMPI/Rnase染色溶液,室温避光孵育15-30分钟。然后上机检测。
如表4和图4所示,流式细胞检测结果显示在5-20μM浓度下,Kae能够提高G2/M期DNA表达量。
表4山奈酚对LNCaP细胞周期的影响
实施例4山奈酚对LNCaP细胞凋亡蛋白表达的影响
(1)细胞培养及给药
LNCaP细胞用10%FBS RPMI 1640培养。实验前,换用5%活性炭过滤的FBS RPMI 1640培养72小时,然后用1%活性炭过滤的FBS RPMI 1640接种到6孔细胞培养板,接种3.0×105个细胞/孔。细胞种板48小时贴壁后,换液,加药,药物作用48小时。组别设置分别为:对照组、DHT(10nM)、Bic(10μM)、Kae(20μM);对照组、DHT(10nM)、Bic(10μM)+DHT(10nM)、Kae(20μM)+DHT(10nM),其中,Bic是bicalutamide(比卡鲁胺)的缩写,是临床上用于治疗前列腺癌和良性前列腺增生的药物,在本发明用作阳性对照。
(3)Western Blot法检测蛋白表达
吸弃6孔板里的培养液,用PBS溶液洗,用细胞刮将细胞刮下,收集于1.5ml EP管,离心收集细胞。加入预先配好的细胞裂解液(RIPA:PMSF=100:1),冰浴30分钟,涡旋几次使细胞充分裂解,4℃14.2×103g离心30分钟收集上清。测定蛋白质含量的具体步骤参照Micro BCATM Protein Assay Kit说明书。Western Blot方法是本领域的常规方法,本领域技术人员在得知了本发明的蛋白质(Bax蛋白、Bid蛋白、Caspase-3蛋白)及其对应的抗体(见表5和表6)的基础上完全可以完成本实验,本发明在此不再赘述。
表5一抗稀释比例
表6二抗稀释比例
如图5所示,Western Blot结果显示20μM Kae单独作用下明显上调了Bax蛋白的表达量,在和10nM DHT共同作用下仍然明显上调了Bax蛋白的表达量。20μM Kae单独作用下明显上调了Bid蛋白的表达量,在和10nM DHT共同作用下对Bid蛋白表达影响不明显。20μM Kae对Caspase-3蛋白的表达有上调趋势。
实施例5山奈酚对大鼠饮水的影响
8周龄SPF级Wistar雄性大鼠,体重220±20g,由北京维通利华实验动物技术有限公司提供。实验动物饲养在中国医学院放射医学研究所,实验动物房的温度和湿度分别为23±2℃和58-65%。实验动物适应性饲养一周后行双侧睾丸摘除术。
手术后三周,假手术组(Sham operation)剩余大鼠11只,手术组剩余大鼠30只(其中4只大鼠腹部肿大不纳入实验)。将双侧睾丸摘除术后一般情况良好的24只大鼠分为4组,每组6只。分别为前列腺增生模型组(BPH Model)、非那雄胺组(Fin)、山奈酚低剂量组(Kae-L)、山奈酚高剂量组(Kae-H)。
假手术组大鼠每日皮下注射0.1ml玉米油,其余各组大鼠每日皮下注射0.1ml丙酸睾酮(TP)。各组大鼠采用灌胃给药,连续给药28天,末次给药24小时后麻醉处死动物取材。具体处理见表8。
表7分组以及给药处理情况
如表8和图6所示,在给药2周之后,与Sham组比较,Kae-L组和Kae-H组大鼠每日饮水量有了提高,与Model组比较,Kae-L组和Kae-H组大鼠每日饮水量也提高了;如图7所示,给药的第14天到第28天之间,Kae-L组和Kae-H组大鼠的平均每日饮水量明显高于Sham组和Model组(P<0.001)。
表8山奈酚对大鼠饮水的影响(n=6)
注:与Sham组比较#P<0.05,##P<0.01,###P<0.001;与Model组比较*P<0.05,**P<0.01,***P<0.001。
实施例6山奈酚对大鼠前列腺组织形态的影响
按照表7的方法处理大鼠,取材前称重,每组取出一只体重在320±10g区间的大鼠,麻醉处死,解剖大鼠取出前列腺拍照。如图7A所示,与假手术组(Sham)比较,BPH模型组(Model)大鼠的前列腺体积明显增大,给予药物处理后,大鼠前列腺的体积有不同程度的减少。
用电子天平精确称量前列腺的湿重,用来计算各组实验动物的前列腺指数,按照公式:前列腺的湿重/大鼠体重×100%,计算前列腺前列腺指数(PI)。如表9和图7B所示,与Sham组比较,Model的PI明显升高(P<0.001);给药处理后,PI不同程度降低,非那雄胺组(Fin)、山奈酚低剂量组(Kae-L)、山奈酚高剂量组(Kae-H)与Model组比较都有显著性差异(P<0.001,P<0.01,P<0.05)。
将上述取出的前列腺放于4%多聚甲醛中进行固定,待石蜡包埋,用于做病理片和免疫组化。用切片机将石蜡包埋的前列腺组织蜡块切至4μm/片。二甲苯使石蜡切片脱蜡,经各级乙醇后至水洗,苏木素染色5分钟,大量自来水冲洗。盐酸乙醇分化30秒。自来水浸泡15分钟。置伊红液染色2分钟。脱水,透明,中性树脂封片。显微镜下镜检结果见图7C。可以看出,Sham组腺泡形状平滑,腺泡壁薄而规整,上皮细胞排列紧密整齐,间质细胞少;Model组腺泡皱褶较多,腺泡壁明显增厚,上皮细胞排列疏松紊乱,腺泡内出现了复层上皮,间质细胞明显增多,结缔组织增生较为明显;各给药组与Model组相比,间质成分有所减少,腺上皮细胞排列紊乱的现象均得到不同程度的缓解,局部腺泡排列较为密集,不同程度地接近正常对照组。
表9山奈酚对良性前列腺增生大鼠PI的影响(n=6)
注:与假手术组比较#P<0.05,##P<0.01,###P<0.001;与模型组比较*P<0.05,**P<0.01,***P<0.001。
实施例7山奈酚对大鼠血清中睾酮含量的影响
血清中睾酮含量采用T酶联免疫吸附测定试剂盒(购自于天津安诺瑞康生物技术公司)通过酶联免疫吸附测定法(ELISA)检测,具体方法参照试剂盒说明书。
表10和图8所示,与Sham组比较,Model组大鼠血清中的睾酮(T)明显提高(P<0.01);给药2周,如图8中A所示,各给药组大鼠血清中的T水平有不同程度降低,其中Fin组、Kae-L组与Model组比较都有显著性差异(P<0.05),与Sham组比较,Model组大鼠血清中的睾酮(T)明显提高(P<0.001);给药4周,如图8中B所示,各给药组大鼠血清中的T水平也有不同程度降低,其中Fin组、Kae-L组与Model组比较都有显著性差异(P<0.01,P<0.05)。
表10山奈酚对良性前列腺增生大鼠血清中T含量的影响(n=6)
注:与Sham组比较#P<0.05,##P<0.01,###P<0.001;与Model组比较*P<0.05,**P<0.01,***P<0.001。
以上对本发明所提供的山奈酚在制备用于预防和/或治疗由睾酮水平过高引起的疾病的药物中的用途进行了详细介绍。本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
- 还没有人留言评论。精彩留言会获得点赞!