一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用的制作方法
本发明涉及药物用途技术领域,具体地,涉及一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用。
背景技术:
骨质疏松症(Osteoprosis简称OP)是以骨量减少,骨组织微细结构破坏导致骨脆性增加和骨折危险性增加为特征的一种系统性、全身性骨骼疾病。临床表现和体征主要是疼痛,其次为身长缩短、驼背、骨折及呼吸系统障碍。流行病学调研显示,50岁以上的人群中,约有50%的女性和20%的男性有骨折的风险(Rachner,Khosla et al.2011)。国家统计局数据显示:到2050年,我国50岁以上的人口将近全国人口的一半(49%),约6.36亿,预计到2050年我国骨质疏松患者数目约为3亿人。
破骨细胞(Osteoclast)和成骨细胞(Osteoblast)之间的比例失衡是骨质疏松产生的病理基础(Rachner,Khosla et al.2011)。破骨细胞分化相对增多或成骨细胞分化相对减少,都会造成骨量流失,引起骨质疏松。降低骨吸收、促进骨合成是当前临床上治疗骨质疏松的主要治疗手段。骨吸收抑制剂主要有雌激素受体调控剂如他莫昔芬,托瑞米芬,屈洛昔芬,雷洛昔芬,阿佐昔芬,巴多昔芬,依普黄酮等、双磷酸酯/盐类如乙醇酸膦酸盐,氯膦酸盐,帕米膦酸,卤素磷酸盐,磷酸艾伦,利塞膦酸钠,磷酸唑来膦,伊班膦酸钠等、以及降钙素等。促进骨合成药物主要有Wnt信号调控剂(AMG785,BHQ880)、甲状旁腺激素Parathyroid hormone(PTH)、钙敏感受体拮抗剂(如:ATF936),和他汀类药物。还有既抑制骨吸收又促成骨的制剂,如阿法骨化醇,骨化三醇(Alfacalcidol,Calcitriol,RO-26-9228,ED-71)等。然而,上述药物虽然能在一定程度上阻止骨密度下降,但不能显著降低非典型性骨折的风险,而且存在着不同程度的副作用,尚未能满足抗骨质疏松治疗的要求(Siris,Selby et al.2009)。因此,目前迫切需要开发一种新的抗骨质疏松的特效药,以解决当前临床用药无法满足治疗需求的问题。
破骨细胞是来源于骨髓巨噬细胞系的一种终末分化细胞,是目前所知唯一具有骨吸收作用的细胞。核受体活化因子配体(Receptor activator of nuclear factor kappa B ligand,RANKL)是破骨细胞维持其结构、功能和存活所必需的一种跨膜的可溶性蛋白。RANK与其配体结合,激活下游NF-κB、Akt,丝裂原激活蛋白激酶(MAPK),激活T细胞核受体(NFAT),钙离子通道,和钙/钙调蛋白依赖性激酶信号通路,使得未分化的骨髓巨噬细胞向破骨细胞分化,进而引起骨质疏松(Boyle,Simonet et al.2003)。大量的研究证实,干扰RANKL信号通路可抑制破骨细胞分化,产生抗骨质疏松的药理作用(Kim and Kim 2016)。近年来,通过干扰RANKL信号通路研发新型抗骨质疏松药物成为热点。寻找具有抑制由RANKL诱导产生的破骨细胞抑制活性的药物,将有望解决当前骨质疏松治疗药物存在的问题。
技术实现要素:
本发明基于新靶标RANKL信号通路发现新的抗骨质疏松药物,以克服现有骨质疏松治疗药物不能降低非典型性骨折的风险的问题,提供一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用。
本发明通过以下技术方案予以实现上述目的:
本发明的设计思路是根据三维结构相似度筛选的方法,以已知具有抗骨质疏松或破骨细胞分化抑制剂为模板,对本实验室现有化合物进行筛选,获得一系列化合物可能具有抗骨质疏松作用的潜在活性化合物,然后在细胞水平对筛选获得的化合物进行破骨细胞分化抑制实验,发现其中一类抑制活性高、细胞毒性低的苯內酰烯酯酰胺类衍生物可以有效抑制破骨细胞分化。所以,此类苯內酰烯酯酰胺类衍生物可安全用于制备治疗和/或预防骨质疏松药物。
本发明所选取的化合物均为现有的化合物。计算机筛选指的是运用计算机辅助药物设计相关软件,采用相似度检索等技术手段对现有的化合物库进行筛选,筛选得到的化合物进行生物活性测试。
一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用,所述苯內酰烯酯酰胺类衍生物的结构式如式(I)或式(II)所示:
其中,X为碳原子、氧原子、氮原子或硫原子,Y为碳原子、氧原子、氮原子或硫原子,R1为氢、羟基、烷基、不饱和烷基、烷氧基或酯基,R2为氢、羟基、烷基、不饱和烷基、烷氧基或酯基,R3为氢、羟基、烷基、不饱和烷基、烷氧基、酰胺基或酯基,R4为氢、烷基,烷氧基或酯基,R5为氢、烷基、烷氧基和或酯基,R1、R2可以成环,n=0、1、2、或3。
优选地,R1为氢、羟基、C1~C6烷基,C1~C6烷氧基或酯基,R2为氢、羟基、C1~C6烷基、C1~C6不饱和烷基、C1~C6烷氧基或酯基,R3为氢、羟基、C1~C6烷基、C1~C6不饱和烷基、C1~C6烷氧基、酰胺基或酯基,R4为氢、C1~C6烷基、C1~C6不饱和烷基、C1~C6烷氧基或酯基,R5为氢、C1~C6烷基、C1~C6烷氧基或酯基。
优选地,所述X为碳原子或硫原子,Y为氧原子、氮原子或硫原子。
优选地,R1为氢或酯基,R2为氢或烷基,R3为氢、酰胺基或酯基,R4为氢或酯基,R5为氢或酯基。
优选地,R1为氢或酯基,R2为氢或C1~C6的烷基,R3为氢、酰胺基或酯基,R4为酯基,R5为酯基。
优选地,R1、R2成环形成六元饱和环烷基或六元不饱和芳香基。
最优选地,所述苯內酰烯酯酰胺类衍生物的结构式为
术语“烷基”是用于表示饱和烷烃,C1~C6的烷基是指含有1~6个碳原子的饱和烃基。“不饱和烷基”表示是用于表示碳、氢两种原子的官能团,可以看作是相应的烷基失去1~4氢原子(H)后剩下的自由基。
进一步地,所述药学上可接受的盐为结构式如式(I)或式(II)所示苯內酰烯酯酰胺类衍生物与酸或碱形成的药学上可接受的盐。
最为优选地,所述苯內酰烯酯酰胺类衍生物的结构式为:
代码为C-001的或
代码为C-004的
本发明同时保护结构式如式(I)或式(II)所示苯內酰烯酯酰胺类衍生物、其药学上可接受的盐或酯或含有它们中任一种的药物组合物在制备抑制破骨细胞分化药物中的应用。
本发明提及的药物包括药学上可接受的盐、载体和/或赋形剂。
进一步地,本发明所述苯內酰烯酯酰胺类衍生物是作为破骨细胞分化抑制剂在制备抗骨质疏松药物中的应用。
与现有技术相比,本发明的有益效果是:
本发明提供了一种新的以苯內酰烯酯酰胺作为母体的衍生物作为破骨细胞分化抑制剂在制备抗骨质疏松药物中的应用,且本发明提供的化合物均能在一定程度上抑制破骨细胞分化,尤其以化合物C-001和C-004对破骨细胞分化抑制活性最佳。本发明提供的苯內酰烯酯酰胺类衍生物结构简单、易合成;而且此类化合物毒性小,可安全用于制备治疗和/或预防骨质疏松药物。
附图说明
图1为C-0001破骨细胞分化抑制及C-001细胞毒性曲线图。
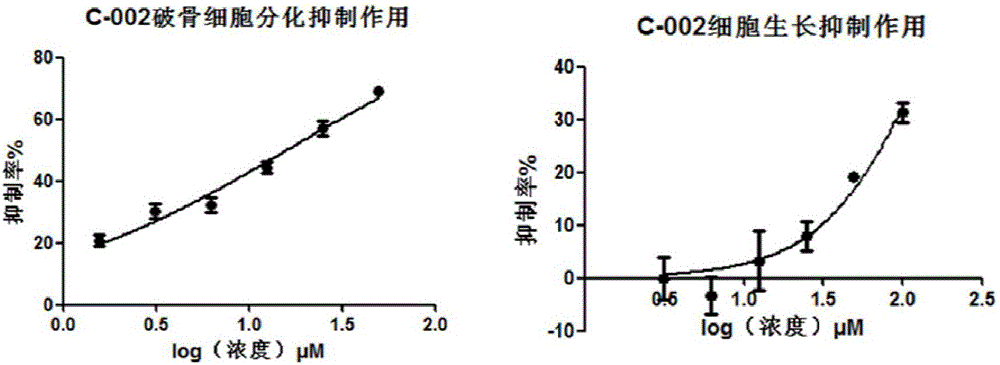
图2为C-0002破骨细胞分化抑制及C-0002细胞毒性曲线图。
图3为C-0003破骨细胞分化抑制及C-0003细胞毒性曲线图。
图4为C-0004破骨细胞分化抑制及C-0004细胞毒性曲线图。
图5为C-0005破骨细胞分化抑制及C-0005细胞毒性曲线图。
图6为C-0006破骨细胞分化抑制及C-0006细胞毒性曲线图。
图7为C-0007破骨细胞分化抑制及C-0007细胞毒性曲线图。
图8为C-0008破骨细胞分化抑制及C-0008细胞毒性曲线图。
具体实施方式
下面结合说明书附图和具体实施例进一步详细说明本发明,但实施例并不对本发明做任何形式的限定。
实施例1:计算机药物筛选
化合物库预处理:化合物库为自备化合物数据库。化合物库作如下处理:去除离子及络合水分子、加电荷、质子化、产生三维构象。这些流程均在药物设计软件包Discovery Studio 2.5中完成。其中质子化在pH 6.5~8.5条件下进行。准备好的小分子库用于虚拟筛选。
以已知抗骨质疏松药物和破骨细胞分化抑制剂进行三维相似度检索,找出相似度高于80%的化合物。本发明通过计算机药物筛选程序为本实验室自主研发程序WEGA,预测出本实验室化合物储备库拥有44个潜在活性的化合物。对该44个化合物进行细胞水平的抑制骨质疏松分化活性筛选,发现其中8个化合物(C-001~C-008)具有抑制破骨细胞分化的作用。这8个化合物均属苯內酰烯酯酰胺类衍生物,各个活性化合物的结构式及活性见表1。
实施例2:化合物细胞的毒性测定
S1.细胞培养。
体外培养RAW264.7细胞。使用含有10%胎牛血清,DMEM高糖培养基,在37℃,5%二氧化碳浓度条件下进行常规维持培养和传代。
S2.化合物干预。
收集对数期细胞,将细胞悬液浓度配成1×105个/ml,加入96孔细胞培养板中。于二氧化碳培养箱中培养24h后,将培养液换成含有不同化合物浓度的培养基,连续培养2天,于第3天检测细胞毒性。使用DMSO将待测化合物配置为不同浓度的溶液。每个浓度设3个平行复孔,并设不经化合物处理的对照组进行比较。
S3.测试方法。
采用MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]法测定经化合物处理6天之后的细胞。应用酶标仪(检测波长570nm,参考波长630nm)测定个孔吸光值(OD值)。
S4.结果处理。
按下面的公式计算各个药物对RAW264.7细胞的生长抑制率:
以RAW264.7细胞生长抑制率为纵坐标,化合物浓度得log值为横坐标绘制各化合物对细胞生长的抑制曲线图,根据各化合物对细胞抑制率,求出半数毒性浓度CC50,即抑制细胞生长达50%时药物浓度。
另按照公式:选择抑制常数(SI)=CC50/IC50计算各化合物的选择抑制常数,以评价各化合物的用药安全性。C-001~C-008八个化合物的选择抑制常数结果见表1。C-001~C-008八个化合物对RAW264.7细胞的毒性测定结果分别见图1~图8。
实施例3:破骨细胞分化抑制实验
S1.细胞培养。
体外培养RAW264.7细胞。使用含有10%胎牛血清,DMEM高糖培养基,在37℃,5%二氧化碳浓度条件下进行常规维持培养和传代。
S2.化合物干预。
收集对数期细胞,将细胞悬液浓度配成2×104个/ml,加入96孔细胞培养板中。于二氧化碳培养箱中培养24h后,将培养液换成含有100ng/ml RANKL及不同化合物浓度的培养基,连续培养5天,每2天换上相同RANKL浓度和化合物浓度的培养基,于第5天检测采用TRAP染色法对破骨细胞进行染色。每个浓度设3个平行复孔,并设不经化合物处理的对照组进行比较。
S3.测试方法。
采用TRAP试剂盒对分化形成的破骨细胞进行染色,计数≧3个细胞核融合的破骨细胞数目。
S4.结果处理。
按下面的公式计算各药物对RANKL诱导的破骨细胞分化抑制率:
以破骨细胞分化抑制率为纵坐标,化合物浓度的log值为横坐标绘制各化合物对破骨细胞分化抑制曲线图,根据各化合物对破骨细胞分化的抑制率,求出半数有效率IC50,即抑制破骨细胞分化达50%时药物浓度。
另按照公式:选择抑制常数(SI)=CC50/IC50计算各化合物的选择抑制常数,以评价各化合物的用药安全性。C-001~C-008八个化合物的选择抑制常数结果见表1。C-001~C-008八个化合物对宿主细胞的毒性测定结果分别见图1~图8。
根据选择性指数SI=CC50/IC50值,按以下标准评价化合物的抗骨质疏松分化的效果。SI<1.0表明化合物有毒无效,1.0≤SI≤2.0表明化合物低效有毒即弱阳性,2.0<SI<10.0表明化合物有效低毒即阳性,SI≥10.0表明化合物高效低毒即强阳性。
由表1和图1~8的结果可见,本发明通过破骨细胞分化抑制实验,发现8个化合物对破骨细胞分化均有不同程度的抑制作用,其中C-001、C-002、C-003、C-004、C-005、C-007选择性高(SI为10.64~200.66),C-001抑制破骨细胞分化活性最好、选择性最高,IC50为12.5μM、SI为200.66(见图1、表1)。
表1 药物筛选获得的化合物结构及其对破骨细胞分化的抑制作用
本发明通过破骨细胞分化抑制实验,发现C-001、C-004对破骨细胞分化抑制活性最高,均小于10μM,并且细胞毒性低。C-001对破骨细胞分化半数抑制剂量(IC50)为4.24μM,细胞半致死剂量(CC50)为850.80μM,选择抑制常数(SI)为220.66(表1,图1)。C-005对破骨细胞分化半数抑制剂量(IC50)为5.13μM,细胞半致死剂量(CC50)为279.20μM,选择抑制常数(SI)为54.42(表1,图4)。
- 还没有人留言评论。精彩留言会获得点赞!
- 一类苯內酰烯酯酰胺类衍生物在制备抗骨质疏松药物中的应用的制作方法与工艺
- 一种丹参酮类化合物17位酯化衍生物及其制备工艺和应用的制作方法与工艺
- 用于治疗癌症的异喹啉酮衍生物的制作方法与工艺
- 二氢碟啶酮衍生物及其用途的制作方法与工艺
- 一种酞嗪酮衍生物、该衍生物的制备方法及其制备用催化剂与流程
- 环烃基取代的甲磺酰基苯甲酰胺衍生物、其制法与医药上的用途的制作方法与工艺
- 一种以喹唑啉酮衍生物为核心的化合物及其在OLED上的应用的制作方法与工艺
- 一种母核为喹唑啉酮衍生物的化合物及其在OLED上的应用的制作方法与工艺
- 一种母核为喹唑啉酮衍生物的化合物及其应用的制作方法与工艺
- 蝶啶酮衍生物作为EGFR抑制剂的应用的制作方法与工艺