表达TRAIL的溶瘤腺病毒联合槲皮素在抑制肝癌癌细胞增殖中的用途的制作方法
本发明属于生物制药领域,具体涉及表达TRAIL的溶瘤腺病毒联合槲皮素在抑制肝癌癌细胞增殖中的用途。
背景技术:
肝细胞癌(HCC)是最常见的恶性肿瘤之一,其被列为全球第五最常见的癌症,年死亡率超过50万。
PCT/US2014/033675公开了用于治疗包括原发性和继发性肝癌的各种癌症的方法和组合物,同时涉及奎纳克林在用于难治性肝癌的药剂的制造中的用途。
PCT/US2008/081645提供用于治疗肝癌的方法。这些方法包括给予包含修饰寡核苷酸的化合物,其中所述修饰寡核苷酸靶向miRNA。该发明还提供用于治疗肝癌的组合物。这类组合物包括包含修饰寡核苷酸的化合物,其中所述修饰寡核苷酸靶向miRNA。该发明发现某些miRNA在肝癌(例如肝细胞癌)中过量表达,因此被选择为由修饰寡核苷酸靶向。此外,该发明还发现某些miRNA在暴露于二恶英的肝细胞癌细胞中过量表达,进而被选择为由修饰寡核苷酸靶向。
201080047449.3公开了通过给药有效量的命名为ITE的对于芳基烃(Ah)受体(AhR)的内源性配体或其类似物之一(活性成分)至患有癌症的受试者,介入治疗或根除癌症的方法。通过测量给药后受试者中所述活性成分的血液水平,确定其有效剂量和给药频率。将采用载体系统配制的活性成分局部地、肠内地或肠胃外地施加至受试者。所述配制的药物也可以与一种或多种其他癌症治疗药一起给药。在所述受试者摆脱癌症后,提供维持给药以确保根除癌症。其中患有肝癌等癌症的受试者优选地接受治疗。
腺病毒(Ad)首先由Wallace Rowe及其同事在1953年发现。由于在组织培养中Ad的致细胞病变效应,于1956年该病毒用于在临床试验研究中治疗子宫颈癌。在过去二十年中,应用溶瘤病毒用已经产生优异的治疗功效。大多数临床和临床前研究集中于溶瘤病毒修饰,以改进肿瘤转导靶向、肿瘤特异性复制、肿瘤内传播、和抗病毒和抗肿瘤免疫应答的调节以及转入外源基因。溶瘤病毒的修饰和溶瘤病毒的杂交工程是癌症治疗的特别有前景的新方法。使用溶瘤性Ad的病毒疗法由于其高滴度,插入较大尺寸的治疗基因的能力和在分裂和非分裂细胞中的高转导效率而具有广泛的临床应用。重要的是,当溶瘤性Ad复制时,它们不将其基因组整合到宿主中;因此,它们不诱导致癌相关诱变。这些独特的功能使得溶瘤Ad可以成为有效的基因载体,在基因传递方面具有最佳的安全性(和相关的溶瘤病毒,如溶瘤性逆转录病毒、慢病毒和腺相关病毒相比)。
目前,超过12种不同的溶瘤病毒正在进行针对不同类型癌症的I期临床试验。溶瘤性Ad是迄今为止首次且最集中研究的溶瘤病毒,H101(缺失E1B55K基因的突变体)现已由中国食品和药物管理局(CFDA)批准用于治疗头颈癌(Oncorine,上海双威Biotech)。在以前的研究中,我们使用病毒疗法策略开发了癌靶向基因(CTGVT),并产生了一个新的E1B55K基因缺失溶瘤腺病毒ZD55-TRAIL,其携带肿瘤坏死因子相关凋亡诱导配体(TRAIL),该配体是肿瘤坏死因子超家族的成员并认为它是抗癌治疗的新候选物。TRAIL可以选择性诱导各种肿瘤细胞的凋亡,对周围正常细胞的毒性可忽略不计。TRAIL在抑制肿瘤生长中的选择性已经在体外和体内显示。相比之下,TRAIL可以激活转录因子NF-κB,导致拮抗死亡信号通路的基因的转录。不幸的是,由于TRAIL发挥的这种相反或调节作用,尽管其具有引人注目的抗肿瘤活性,但许多癌细胞也显示对TRAIL的抗性。TRAIL参与通过NF-κB的凋亡信号的这种负反馈调节的实际机制尚未完全阐明。幸运的是,最近的研究表明,通过抑制存活信号和增殖基因的表达同时激活凋亡相关基因表达,与TRAIL和其他药物或化学物质的联合治疗可以协同增加各种肿瘤细胞中的细胞死亡或凋亡机制。
槲皮素(3,3',4',5,7-五羟基黄酮)是在多种水果和蔬菜中发现的主要膳食黄酮醇,包括洋葱、苹果皮、莴苣、花椰菜、辣椒、芹菜和未加糖的可可。槲皮素具有抗氧化、抗炎、抗血管生成、抗增殖和促凋亡性质,因此,可对抗癌症的形成和进展。根据这些效应,通过其选择性修饰与癌发生相关的信号传导途径以引起癌细胞死亡的能力,槲皮素导致细胞活力的降低,并且,诱导许多癌细胞(包括乳腺、结肠、肺、卵巢和前列腺癌)凋亡。
技术实现要素:
本发明的发明人首次证明ZD55-TRAIL和槲皮素可以在体外和体内协同作用杀死HCC细胞。此外,我们的研究结果表明槲皮素显著抑制由ZD55-TRAIL激活的NFκB通路,使得凋亡信号占优势。我们目前的研究表明,ZD55-TRAIL和槲皮素的联合治疗是一个新的实用治疗策略。
为了更好的治愈肝癌或为治疗肝癌提供另一种可行的选择,提高患者的预后或者生活质量,本发明的发明人发现,表达TRAIL的溶瘤腺病毒和槲皮素的组合对肝癌或肝癌细胞的增殖具有协同的治疗或者抑制作用,进而为治疗肝癌或抑制肝癌细胞的增殖提供了新的疗法或手段。
本发明采用表达TRAIL的溶瘤腺病毒和槲皮素联合抑制肝癌细胞增殖作用影响进行体外和体外实验,结果显示在表达TRAIL的溶瘤腺病毒和槲皮素两者联合应用具有协同抑制肝癌细胞增殖的作用。
本发明所述的表达TRAIL的溶瘤腺病毒可为携带TRAIL基因的复制型溶瘤腺病毒ZD55-TRAIL(Han,X.,et al.,Synergistic combination of histone deacetylase inhibitor suberoylanilide hydroxamic acid and oncolytic adenovirus ZD55-TRAIL as a therapy against cervical cancer.Mol Med Rep,2015.12(1):p.435-41.),其具有肿瘤复制特异性,对正常细胞无毒性。表达TRAIL的溶瘤腺病毒基因组结构见图1A。
因此,本发明一方面提供了表达TRAIL的溶瘤腺病毒在制备用于在受试者中治疗肝癌或抑制肝癌细胞增殖的药物组合物或药盒中的用途,其中所述药物组合物或药盒含有表达TRAIL的溶瘤腺病毒和槲皮素,任选地,所述药物组合物或药盒还含有用于治疗肝癌或抑制肝癌细胞增殖的其他药物活性成分,例如吉西他滨、普乐沙福(AMD3100)或紫杉醇等。任选地,所述的药物组合物或药盒中的表达TRAIL的溶瘤腺病毒和槲皮素分别在分开的容器中存放或者表达TRAIL的溶瘤腺病毒和槲皮素在同一容器中存放。
本发明提供了在受试者中治疗肝癌或抑制肝癌细胞增殖的方法,其包括向所述受试者同时或依次施用表达TRAIL的溶瘤腺病毒和槲皮素。任选地,在本发明的方法中,可以同时或者依次施用其他的治疗肝癌或抑制肝癌细胞增殖的药物活性成分,例如吉西他滨、普乐沙福(AMD3100)或紫杉醇等;或者同时或者依次施用奎尼丁。
对于本发明所述的受试者,其优选为哺乳动物,更优选为人。
对于本发明的表达TRAIL的溶瘤腺病毒和槲皮素,本领域技术人员可以对其作出任何修饰,前提是所述修饰不负面影响其活性。例如,可以对化合物进行修饰或装载在其他载体上,以提高其在体内的半衰期;或者可以与已知的穿透肽连接,以促进本发明化合物的透皮吸收或者越过血脑屏障等。总之,本领域技术人员可对本发明的化合物进行各种修饰以提高递送效率或用于其他目的并保持其活性。对于病毒的修饰,例如,本领域技术人员可以进行基因修饰,以使其表达其他的抵抗癌症的活性成分。这类修饰也是在本发明的范围之内的。
本发明的作为活性成分的表达TRAIL的溶瘤腺病毒和槲皮素可以连同药学上可接受的载体一起使用。除活性成分外,本发明的方法、用途和产品还可以包含合适的药学上可接受的载体,包括促进活性成分加工成制剂(例如适于注射或输注的制剂)的赋形剂和助剂。
适于注射或输注的制剂可包括水性和非水性无菌注射液和水性和非水性无菌混悬剂,所述无菌注射液可任选地包含抗氧化剂、缓冲剂、抑菌剂和能使制剂与目的接收者的血液等压的溶质,所述无菌混悬剂可包括悬浮剂和增稠剂。所述制剂可存在于单位剂量或多剂量容器中,例如密封的安瓿,并且可以保存在冻结干燥的(冻干)条件,在立即使用前仅需要加入无菌液体载体,例如注射用水。
本发明的活性成分任选地可与固体赋形剂相组合,且任选地磨碎所得到的混合物,并且需要时,在加入合适的助剂后,加工颗粒的混合物,以获得所需剂型。合适的赋形剂特别是填充剂例如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纤维素或淀粉制剂、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。需要时,可以加入崩解剂,例如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐例如海藻酸钠。
在本发明中施用表达TRAIL的溶瘤腺病毒和槲皮素的量可为能协同治疗受试者中肝癌或抑制肝癌细胞增殖的任何量,其可以是相当于约0.2-25mg槲皮素,优选0.02-30mg槲皮素和1-100MOI表达TRAIL的溶瘤腺病毒的剂量。更优选地,剂量单位包括约1-5mg的槲皮素和20-60MOI表达TRAIL的溶瘤腺病毒。最优选地,剂量单位包括约2-3mg的槲皮素和40-50MOI表达TRAIL的溶瘤腺病毒。有效量的测定在本领域技术人员的能力内,特别是根据本文提供的公开内容的启示下。
根据本发明,本发明的药学产品(药物、药剂)或药物组合物可以以任意有效剂量施用给药受试者。优选地,本发明的药学产品(药物、药剂或药盒)或药物组合物可以以多次剂量给药,例如从约2至约15次剂量,更优选从约4-10次剂量,最优选约6次剂量。在特别优选的实施方案,在给药过程中,以每三周给药约一次的频率将本发明的药学产品(药物、药剂)或药物组合物给药至受试者,例如注射、输注或口服。在特别优选的实施方案,给药为通过静脉注射施用槲皮素,通过腹腔注射表达TRAIL的溶瘤腺病毒。
应当理解本发明的药学产品(药物、药剂或药盒)或药物组合物可以按用于通过任意适宜的途径给药的任意适宜的方式配制。
本发明的药学产品(药物、药剂)或药物组合物的剂量单位是基于常规进行给药受试者。例如,剂量单位可以给药多于每日一次、每周一次、每月一次等。剂量单位可以是以两次/周为基础给药,即每周两次,例如每三天一次。
如本文所使用的,“包含”与“包括”、“含有”或“特征在于”同义,并且是包括在内的或开放性的,并且不排除另外的未陈述的元件或方法步骤。术语“包含”在本文中的任何表述,特别是在描述本发明的方法、用途或产品时,应理解为包括基本上由所述组分或元件或步骤组成和由所述组分或元件或步骤组成的那些产品、方法和用途。本文示例性描述的本发明适当地可以在不存在本文未具体公开的任何一种或多种元件、一种或多种限制的情况下进行实践。
本发明的药学产品(例如药物组合物或药盒)中可包含涉及该药学产品的说明书,且该说明书可以含有如下内容:适应症(例如肝癌)、施用剂量(例如上述所示例性说明的)以及可能产生的副作用等等。
本文已采用的术语和表述用作描述性而不是限制性术语,并且在此种术语和表述的使用中不预期排除所示和所述特征或其部分的任何等价物,但应认识到各种修饰在请求保护的本发明的范围内是可能的。因此,应当理解尽管本发明已通过优选实施方案和任选特征具体公开,但本领域技术人员可以采用本文公开的概念的修饰和变化,并且此类修饰和变化被视为在如由附加权利要求定义的本发明的范围内。
为更清楚地说明本发明,现结合如下实施例进行详细说明,但这些实施例仅仅是对本发明的示例性描述,并不能解释为对本申请的限制。
附图说明
图1:ZD55-TRAIL的表征。(A)ZD55-TRAIL的示意性结构。在ZD55-TRAIL中,E1B 55-kDa基因被SV40polyA和TRAIL的表达盒代替。(B)通过western印迹分析鉴定ZD55-TRAIL。分别用槲皮素(10μM)、ZD55-TRAIL(2MOI)、或槲皮素(10μM)和ZD55-TRAIL(2MOI)处理HuH-7细胞。48小时后,制备细胞裂解物用于分析TRAIL和E1A蛋白的表达。模拟感染的细胞作为对照。GAPDH用作蛋白质上样对照。
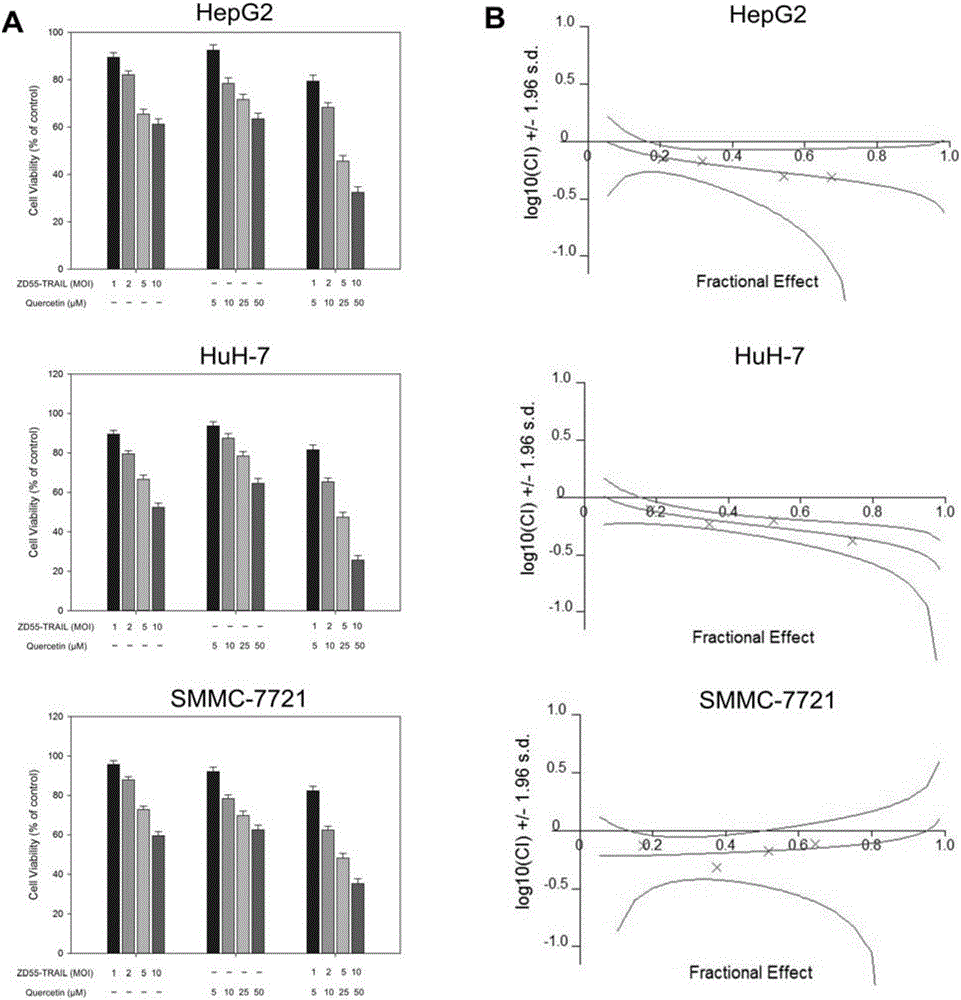
图2:槲皮素增强ZD55-TRAIL介导的HCC细胞生长抑制。(A)HCC细胞系HepG2、HuH-7和SMMC-7721分别用ZD55-TRAIL(1,2,5,10MOI)、槲皮素(5,10,25,50μM)或组合处理48小时。该图显示了三次独立实验的示例性结果。通过MTT测定评价细胞存活力。(B)ZD55-TRAIL联合槲皮素对HCC细胞的协同效应。通过组合指数(CIN)分析进行定量,并表示为1g(CIN)对受影响的比例。在可能进行计算的情况下,显示95%的置信区间。
图3:槲皮素增强ZD55-TRAILα诱导的HCC细胞凋亡。(A)使用Hoechst 33342染色来检测凋亡。将HuH-7铺板在96孔板中并用ZD55-TRAIL(2MOI)、槲皮素(10μM)或ZD55-TRAIL(2MOI)加槲皮素(10μM)感染。为了确定凋亡程度,处理后72小时用Hoechst 33342处理HuH-7细胞30分钟,然后在倒置荧光显微镜下观察。红色箭头表示阳性凋亡细胞。原始放大倍数为400。(B)HuH-7细胞如下处理:ZD55-TRAIL(2MOI),槲皮素(10μM)或ZD55-TRAIL(2MOI)加槲皮素(10μM)。未处理的细胞作为对照。48小时后,通过流式细胞术测定凋亡。(C)用ZD55-TRAIL(2MOI),槲皮素(10μM)或ZD55-TRAIL(2MOI)加槲皮素(10μM)感染HuH-7细胞48小时。制备全细胞提取物,并进行Western免疫印迹以检测caspase途径的活化。使用表达的GAPDH作为加样对照。
图4:槲皮素抑制ZD55-TRAIL诱导的HCC细胞中NF-κB的活化。用ZD55-TRAIL(2MOI)、槲皮素(10μM)或ZD55-TRAIL(2MOI)加槲皮素(10μM)处理HuH-7细胞。48小时后,收集细胞裂解物并进行Western印迹测定以检查IκBα、p65和p50的变化。使用表达的GAPDH作为加样对照。
图5:ZD55-TRAIL和槲皮素的体内协同效应。(A)在治疗后不同时间测量肿瘤体积。数据表示为平均值±SD(n=6)。**,P<0.01。(B)该图显示了在处死小鼠的最后时间点(第55天)各组对肿瘤生长的抑制作用。
具体实施方式
本发明结合附图和实施例作进一步的说明。
在本申请的发明的实施例中所用的材料和方法如下。
细胞系和病毒
人类肝癌细胞系SMMC-7721,HepG2和HuH-7购自中国科学院细胞培养物保藏中心细胞库(CBTCCAS,中国上海),并培养在Dulbecco改良的Eagle培养基(DMEM,GIBCO,Carlsbad,CA),其补充有10%热灭活的胎牛血清(FBS,GIBCO,Carlsbad,CA)。将细胞在37℃下在5%CO2潮湿培养箱中温育。重组溶瘤腺病毒ZD55-TRAIL的构建和生产如前所述。通过感染HEK293细胞进行重组腺病毒的扩增。
体外协同作用的细胞毒性测定和定量分析
3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)购自Sigma-Aldrich(St Louis,MO)。如前所述通过MTT测定来获得细胞活力。简言之,将1×104个SMMC-7721,HepG2或HuH-7细胞接种在96孔板中,并用指定浓度的ZD55-TRAIL和槲皮素处理。处理后48小时,向每个孔中加入10μL MTT溶液(5g/L),并在37℃下孵育4小时。使用DNA酶标仪(Tecan,Maennedorf,Switzerland)测量570nm处的吸光度。
Hoechst 33342染色
Hoechst 33342染色用于检测凋亡变化。HuH-7细胞分别用ZD55-TRAIL,槲皮素或ZD55-TRAIL和槲皮素的组合处理。处理72小时后,将5μL的Hoechst 33342(1mg/ml,Sigma-Aldrich,St Louis,MO)加入细胞30分钟,并在倒置荧光显微镜下观察结果。未处理的细胞用作对照。
流式细胞术分析
用ZD55-TRAIL(2MOI)、槲皮素(10μM)、或ZD55-TRAIL(2MOI)和槲皮素(10μM)处理HuH-7细胞。48小时后,根据说明书,使用Annexin V-FITC和PI双染色或PI染色单独检测凋亡细胞。使用流式细胞术(FACStar cytofluorometer,BD Biosciences)检查细胞凋亡和细胞周期进展。
蛋白质印迹分析
收集HuH-7细胞并用PBS洗涤两次,然后在RIPA缓冲液中裂解。通过将细胞提取物装载在12%SDS-聚丙烯酰胺凝胶上并随后转移到PVDF(聚偏二氟乙烯)膜来分离蛋白质。然后将膜与针对以下因子的一抗和稀释液孵育:腺病毒-5E1A(1:1000),TRAIL(1:1000),capase-9(1:1000),caspase-3(1:1000),PARP(1:1000),GAPDH(1:1000),p65(1:500),p60(1:500)和IκBα(1:500)。所用的二抗及其稀释液为抗兔(1:5000)和抗小鼠(1:5000)。抗腺病毒-5E1A,Capase-9,Caspase-3,PARP和GAPDH的抗体购自Santa Cruz Biotechnology(Santa Cruz,CA)。针对p65,p60和IκBα的抗体获自Cell Signaling(Danvers,MA)。
动物实验
动物实验的许可由中国的动物保护和使用委员会授予。动物和实验根据上述机构的标准进行。5周龄的雄性BALB/C裸鼠购自中国上海中国科学院上海实验动物中心。将HuH-7细胞皮下注射到雄性裸鼠的右胁腹中。每周检查小鼠三次以观察肿瘤发展。一旦皮下肿瘤发展并达到约100-150mm3,将裸鼠随机分成四组(每组6只小鼠)。随后,分别用ZD55-TRAIL、槲皮素,和所述病毒和所述药物的组合或PBS注射小鼠。以肿瘤内注射方式施用ZD55-TRAIL(1×109噬菌斑形成单位-PFU,每只小鼠),同时通过以150mg/kg体重的剂量向小鼠胃内施用槲皮素或通过注射或通过胃内施用给向平行对照施用100μlPBS媒介物。使用游标卡尺每3天测量肿瘤长度和宽度(mm),并使用下式计算肿瘤体积:肿瘤体积(mm3)=(A×B2)/2,其中A和B分别表示长度和宽度。然后根据体积测量获得肿瘤生长曲线。
统计分析
实验统计学显着性表示为平均值±标准偏差(SD),并通过Graph Pad 6.0软件(GraphPad Software,San Diego,CA)分析。进行学生t检验以确定统计学显着性。P值<0.05被认为具有统计学意义。
实施例1:槲皮素增强ZD55-TRAIL介导的HCC细胞生长抑制。
通过缺失腺病毒5的E1B 55-kDa基因构建溶瘤腺病毒载体ZD55;它可以在许多肿瘤细胞中选择性复制。基于癌症靶向基因-Viro-Therapy,我们使用ZD55包装治疗基因TRAIL并获得新的重组溶瘤腺病毒ZD55-TRAIL(图1A)。为了验证ZD55-TRAIL的表征,我们使用western印迹分析来检测腺病毒E1A和治疗基因TRAIL的蛋白质表达。与没有ZD55-TRAIL处理的对照细胞相比,在用ZD55-TRAIL和ZD55-TRAIL加槲皮素感染的HuH-7细胞中存在E1A和TRAIL的强表达,表明ZD55-TRAIL可以在HCC细胞中高水平选择性复制图1B)。
为了评估槲皮素是否增强ZD55-TRAIL诱导的HCC细胞的细胞死亡,如材料和方法中所述进行MTT测定。用单独的ZD55-TRAIL、单独的槲皮素或两者的组合感染HCC细胞系SMMC-7721,HepG2和HuH-7。结果显示,与对照细胞系相比,ZD55-TRAIL和槲皮素的组合处理导致对HCC的增强的肿瘤杀伤作用(图2)。
实施例2:槲皮素增强ZD55-TRAIL诱导HCC细胞凋亡。
随后进行Hoechst 33342染色以测定用ZD55-TRAIL加槲皮素、ZD55-TRAIL或单独的槲皮素处理的HuH-7细胞的形态学改变。结果示于图3A。这证明,与ZD55-TRAIL单独处理相比,用槲皮素的共处理导致明显的凋亡,其特征在于观察到染色质浓缩,核碎裂和凋亡小体。为了定量槲皮素和ZD55-TRAIL诱导的凋亡的作用,使用膜联蛋白-V-荧光素异硫氰酸酯(FITC)/PI双染色来分析细胞凋亡(图3B)。结果表明,与ZD55-TRAIL和槲皮素共同处理的HuH-7细胞凋亡率为58.9%,几乎是ZD55-TRAIL单独处理的两倍(27.4%)。
Western印迹分析证明ZD55-TRAIL具有激活caspase依赖性通路的能力,包括caspase-9,caspase-3的激活和PARP的切割。这种独特的效果可以通过用槲皮素和ZD55-TRAIL共同治疗进一步增强(图3C)。
实施例3:槲皮素抑制ZD55-TRAIL诱导的HCC细胞中NF-κB的活化
为了证明槲皮素具有抑制NF-κB依赖性转录并继而使HCC细胞对ZD55-TRAIL敏感的能力,我们使用蛋白质印迹确定所述处理引起的IκBα、p65和p50的表达变化。如图4所示,在槲皮素和ZD55-TRAIL的联合治疗中IkBa、p65和p50的降低的表达比ZD55-TRAIL单独诱导的更显着,其表明槲皮素确实可以减少ZD55-TRAIL介导的NF-κB激活,并通过促进ZD55-TRAIL诱导的凋亡来降低其转录活性(图4)。
实施例4:槲皮素增强体内ZD55-TRAIL-介导的HCC肿瘤生长抑制
为了在体内测试组合的槲皮素和ZD55-TRAIL处理的治疗效果,使用用HuH-7细胞建立的HCC肿瘤异种移植模型具有单一和联合治疗处理的进行动物实验。绘制肿瘤生长曲线以比较在49天观察期间其抗肿瘤功效的差异。如图所示。如图5A所示,与接受PBS注射的那些相比,接受单独槲皮素,ZD55-TRAIL和联合治疗的肿瘤内注射的动物的平均肿瘤体积显着减少。如预期的,组合治疗比槲皮素(P=0.001)和单独的ZD55-TRAIL(P=0.002)治疗更有效。此外,与载体,槲皮素或ZD55-TRAIL单独处理相比,槲皮素和ZD55-TRAIL的联合治疗导致改善的动物存活率(图5B)。
实施例5:ZD55-TRAIL、槲皮素和奎尼丁三者在体内显著抑制肝癌细胞生长
4-5周龄的雌性BALB/c裸鼠购自中国科学院上海实验动物中心(上海,中国)。所有的实验操作均符合实验动物在福利和伦理的要求。将HuH-7细胞细胞(2X106,在PBS中)在裸鼠的右侧皮下注射。一旦皮下肿瘤大小到达100-150mm3,将裸鼠随机分为3组(每组8只)。然后施用槲皮素和ZD55-TRAIL的组合、和槲皮素、ZD55-TRAIL和奎尼丁(quinidine,Quin)三者的组合。ZD55-TRAIL(1X109PFU/鼠)采用肿瘤内注射的方式,而槲皮素和奎尼丁均以5mg/Kg体重的量腹膜内注射,100μl PBS作为对照,连续注射三次,隔天注射。从注射开始,每5天测量肿瘤大小并在75天的时间内统计裸鼠的存活。
结果证实,在第50天的时候槲皮素和ZD55-TRAIL的组合以及槲皮素、ZD55-TRAIL和奎尼丁的组合均能基本消除裸鼠的荷瘤块,但是在实验结束时的第75天,槲皮素和ZD55-TRAIL的组合使得裸鼠的存活率是62.5%(3只裸鼠死亡),而槲皮素、ZD55-TRAIL和奎尼丁三者的组合的裸鼠存活率为87.5%(1只裸鼠死亡)。
虽然用上述实施方式描述了本发明,应当理解的是,在不背离本发明的精神的前提下,本发明可进行进一步的修饰和变动,且这些修饰和变动均属于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!