一种治疗癌症的联合用药物的制作方法
本发明涉及一种治疗癌症的联合用药物。
背景技术:
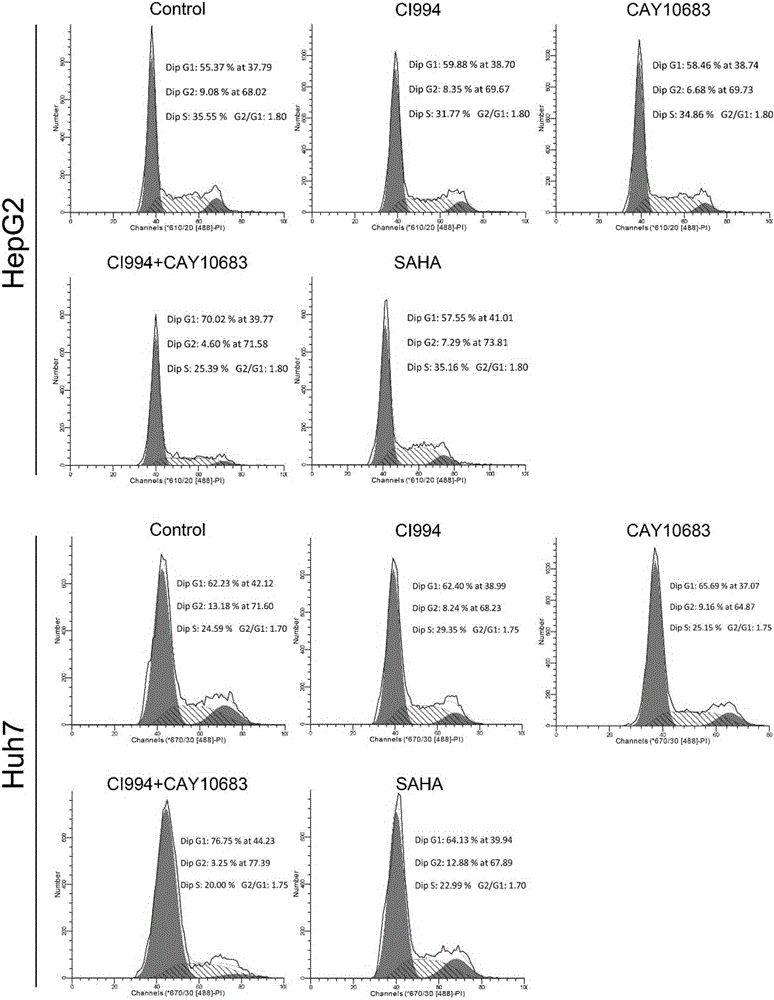
:随着生活节奏的加快,癌症的病发率越来越高,严重威胁着人类的生命健康。癌症是指机体在各种致瘤因素作用下,局部细胞异常增生而形成的局部肿块,细胞生长失控和细胞周期的失调是所有癌症共有的特征。目前发现的癌症包括肝癌、乳腺癌、肺癌、前列腺癌等等。肝癌即肝脏恶性肿瘤,可分为原发性和继发性两大类。原发性肝脏恶性肿瘤起源于肝脏的上皮或间叶组织,前者称为原发性肝癌,是我国高发的,危害极大的恶性肿瘤;后者称为肉瘤,与原发性肝癌相比较较为少见。CI994,Tacedinaline,其结构式为CAS号为112522-64-2,是一种新型的具有广泛抗肿瘤活性的化合物,其作用机制可能涉及抑制组蛋白脱乙酰作用和细胞周期阻滞。CAY10683,SantacruzamateA,其结构式为CAS号为1477949-42-0,是一种组蛋白脱乙酰化酶抑制剂,具有抑制结肠癌的作用。未见将二者联合使用的报道。技术实现要素:本发明的目的在于提供一种治疗癌症的联合用药物,以克服单独使用CI994药效不佳的缺陷。本发明治疗癌症的联合用药物,它含有不同规格的单位制剂,用于同时或者分别给CI994和CAY10683,以及药学上可接受的载体。CI994,Tacedinaline,其结构式为CAS号为112522-64-2。CAY10683,SantacruzamateA,其结构式为CAS号为1477949-42-0。优选地,所述CI994和CAY10683的摩尔配比为:CI9940.25~600份,CAY106830.0001~30份;进一步优选地,CI9940.25~2份,CAY106830.0001~0.1份;再进一步优选地,所述CI994和CAY10683的摩尔配比为:CI9942份,CAY106830.1份。其中,所述制剂为注射制剂。本发明还提供了CI994和CAY10683在制备治疗癌症的联合用药物中的用途。优选地,所述CI994和CAY10683的摩尔配比为:CI9940.25~600份,CAY106830.0001~30份;进一步优选地,CI9940.25~2份,CAY106830.0001~0.1份;再进一步优选地,所述CI994和CAY10683的摩尔配比为:CI9942份,CAY106830.1份。其中,所述治疗癌症的药物是治疗肝癌的药物。本发明联合用药物可以有效治疗癌症,效果明显优于CAY10683和CI994单独使用,特别是治疗肝癌的疗效明确,说明二者在本发明特定配比下配合使用后具有协同增效的作用,临床应用前景良好。下面通过具体实施方式对本发明做进一步详细说明,但是并不是对本发明的限制,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。附图说明图1细胞形态图图2细胞周期分布图图3细胞凋亡率图具体实施方式本发明各种材料和试剂均为市售品。实验例1本发明联合用药物治疗肝癌的作用1、实验材料细胞株:HepG2细胞、Huh7细胞抑制剂:CI994(Tacedinaline)(IC50=0.57μM,设置实验浓度为2μM),HDAC2特异性抑制剂SantacruzamateA(CAY10683)(IC50=119pM,设置实验浓度为100nM),广谱性HDAC抑制剂Vorinostat(SAHA)(IC50<86nM,设置实验浓度为5μM)。细胞培养相关试剂:1640培养基,DMEM高糖培养基,进口胎牛血清,胰酶。检测试剂:细胞凋亡检测试剂Anexin-V、细胞周期检测试剂PI。2、实验方法实验分组:对照组;CI994组;CAY10683组;CI994+CAY10683组和SAHA组。(1)肝癌细胞株HepG2细胞和Huh7细胞的培养将HepG2细胞、Huh7细胞分别复苏接种在10mm培养皿中,接种密度为3×107个。HepG2细胞培养基为含10%胎牛血清的RPI1640培养基,Huh7细胞培养基为含10%胎牛血清的DMEM高糖培养基。接种后37℃、5%CO2环境下孵箱培养8小时让细胞贴壁。(2)HDAC1特异性抑制剂CI994和HDAC2特异性抑制剂CAY10683对肝癌细胞的诱导对照组:不作处理;CI994组:在培养第3天时加入CI994,加入时的浓度为2μMCAY10683组:在第2天时加入CAY10683,加入时的浓度为100nM;CI994+CAY10683组:在培养第2天时加入CAY10683,加入时的浓度为100nM;在培养第3天时加入CI994,加入时的浓度为2μM;加入CI994时和CAY10683时的体积相同。SAHA组:在培养第3天时加入SAHA,加入时的浓度为5μM;培养5天后,进行检测;(3)使用倒置显微镜对肝癌细胞形态的观察;(4)使用碘化丙啶(propidiumiodide,PI)标记细胞DNA并通过流式细胞术分析细胞周期分布;(5)使用AnnexinV-FITC/PI双染细胞并通过流式细胞术检测细胞凋亡。3、实验结果3.1联合用药CI994+CAY10683导致细胞形态改变按照相应浓度加入HDAC抑制剂并培养3天后,首先观察了抑制剂对肝癌细胞形态的影响。结果由图1可见,CI994或者CAY10683均不影响HepG2细胞的成团重叠生长的特性,广谱性HDAC抑制剂SAHA也不影响HepG2细胞的成团重叠生长的特性;而联合用药CI994+CAY10683则导致HepG2细胞无法成团生长,且明显可见死亡漂浮细胞。在Huh7细胞中,单一性的CI994或者单一性的CAY10683培养的细胞形态和对照相比无任何差别;广谱性HDAC抑制剂SAHA使得部分细胞形态稍有变化;而联合用药CI994+CAY10683则导致Huh7细胞形态显著性改变。3.2联合用药CI994+CAY10683导致细胞周期分布改变由于肿瘤细胞具有高增殖活性,我们通过流式检测了细胞周期分布。结果如图2所示,在HepG2细胞中,对照组细胞的G1期细胞比例为55.37%、S期细胞比例为35.55%、G2期细胞比例为9.08%。CI994抑制组的G1:S:G2=59.88%:31.77%:8.35%,CAY10683组的G1:S:G2=58.46%:34.86%:6.68%,SAHA抑制组G1:S:G2=57.55%:35.16%:7.29%,以上几组抑制剂对HepG2细胞周期的影响均无显著性差异。而CI994+CAY10683抑制组的G1:S:G2=70.02%:25.39%:4.6%。同样的,在Huh7细胞中相应的细胞比例为:对照组G1:S:G2=62.23%:24.59%:13.18%;CI994抑制组G1:S:G2=62.4%:29.35%:8.24%;CAY10683抑制组G1:S:G2=65.69%:25.15%:9.16%;SAHA抑制组G1:S:G2=64.13%:22.99%:12.88%;而CI994+CAY10683抑制组G1:S:G2=76.75%:20%:3.25%。细胞周期中处于增殖周期的细胞(S期+G2期)显示细胞增殖活性,在我们的实验中,单一性抑制剂均未使肝癌细胞的S期+G2期比例出现较大下降,而联合用药CI994+CAY10683使S期+G2期细胞比例降低了约15%,可见联合用药CI994+CAY10683能显著性抑制HepG2细胞的增殖,从而起到治疗肝癌的作用。3.3联合用药CI994+CAY10683导致细胞凋亡率上升我们进一步检测了细胞凋亡比例。通过AnexinV染色,流式分析,结果显示如图3,HepG2细胞对照组的凋亡比例为8.16%,CI994抑制组为6.35%,CAY10683抑制组为8.09%,SAHA抑制组为4.5%,而CI994+CAY10683抑制组则上升到21.48%;Huh7细胞对照组的凋亡比例为11.34%,CI994抑制组为18.05%,CAY10683抑制组为14.44%,SAHA抑制组为24.39%,而CI994+CAY10683抑制组则上升到28.44%。从以上结果可见联合运用CI994+CAY10683可显著性提高肝癌细胞的凋亡,从而起到治疗肝癌的作用。根据以上结果可以看出,本发明将CI994+CAY10683联合使用,可以有效抑制肝癌细胞、治疗肝癌的作用,而且联合使用的效果优于CI994、CAY10683单独使用效果的总和,说明二者联合使用发挥了协同增效的作用。实验例2本发明联合用药物治疗肝癌的作用1、实验材料细胞株:HepG2细胞抑制剂:CI994(Tacedinaline),HDAC2特异性抑制剂SantacruzamateA(CAY10683),广谱性HDAC抑制剂Vorinostat(SAHA)。细胞培养相关试剂:1640培养基,DMEM高糖培养基,进口胎牛血清,胰酶。检测试剂:细胞凋亡检测试剂Anexin-V、细胞周期检测试剂PI。2、实验方法实验分组:对照组;不同浓度的CI994组;不同浓度的CAY10683组;不同浓度的CI994+CAY10683组、不同浓度的SAHA组。(1)肝癌细胞株HepG2细胞的培养将HepG2细胞复苏接种在10mm培养皿中,接种密度为3×107个。HepG2细胞培养基为含10%胎牛血清的RPI1640培养基。接种后37℃、5%CO2环境下孵箱培养8小时让细胞贴壁。(2)HDAC1特异性抑制剂CI994和HDAC2特异性抑制剂CAY10683对肝癌细胞的诱导对照组:不作处理;CI994组:在培养第3天时加入CI994,加入时的浓度分别为0.25μM、0.5μM、1μM和2μM;CAY10683组:在第2天时加入CAY10683,加入时的浓度分别为0.1nM、1nM、10nM、100nM;CI994+CAY10683组1:在培养第2天时加入CAY10683,加入时的浓度分别为0.25μM、0.5μM、1μM和2μM;在培养第3天时加入CI994,加入时的浓度分别为0.1nM、1nM、10nM、100nM;SAHA组:在培养第3天时加入SAHA,加入时的浓度为100nM,500nM,1μM和5μM;培养5天后,进行检测;使用AnnexinV-FITC/PI双染细胞并通过流式细胞术检测细胞凋亡。3、实验结果本实验在HepG2细胞株中进行了浓度梯度摸索实验检测,结果如下表所示:组别凋亡率对照组8.16%CI994(0.25μM)7.37%CI994(0.5μM)6.03%CI994(1μM)7.93%CI994(2μM)6.35%CAY10683(0.1nM)7.59%CAY10683(1nM)6.51%CAY10683(10nM)7.61%CAY10683(100nM)8.09%CI994(0.25μM)+CAY10683(0.1nM)8.13%CI994(0.5μM)+CAY10683(1nM)12.72%CI994(1μM)+CAY10683(10nM)13.47%CI994(2μM)+CAY10683(100nM)21.48%SAHA(100nM)8.77%SAHA(500nM)8.36%SAHA(1μM)7.35%SAHA(5μM)4.5%实验结果说明,本发明将CI994(0.25~600μM)+CAY10683(0.0001~30μM)联合使用,可以有效抑制肝癌细胞、治疗肝癌的作用,并且在CI994(2μM)+CAY10683(0.1μM)时,联合使用的效果优于CI994、CAY10683单独使用效果的总和,说明二者联合使用发挥了协同增效的作用。综上,本发明联合用药物可以有效治疗癌症,特别是对肝癌的疗效明确,而且效果明显优于CAY10683和CI994单独使用,说明二者在本发明特定配比下配合使用后具有协同增效的作用,临床应用前景良好。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1