表皮中肽基精氨酸脱亚胺酶1和/或3的活化剂化合物及其用途的制作方法
本申请是申请号为201280024244.2,申请日为2012年04月11日,发明名称为“表皮中肽基精氨酸脱亚胺酶1和/或3的活化剂化合物及其用途”的中国专利申请的分案申请。本发明涉及能够激活i型肽基-精氨酸脱亚胺酶(或pad1)和/或iii型肽基-精氨酸脱亚胺酶(或pad3)的分子的领域,所述分子包含茶碱乙酸(acéfylline)或其盐;并且涉及所述分子在化妆品和治疗剂领域中的所有应用。更特别地,本发明涉及茶碱乙酸或其盐作为皮肤保湿剂的化妆品用途。本发明进一步涉及包含茶碱乙酸或其盐的皮肤病学组合物在治疗患有皮肤疾病如干燥病、鱼鳞癣、牛皮癣、过敏性皮炎、角化过度和先天性大疱性鱼鳞病样红皮病的干燥皮肤中的用途。
背景技术:
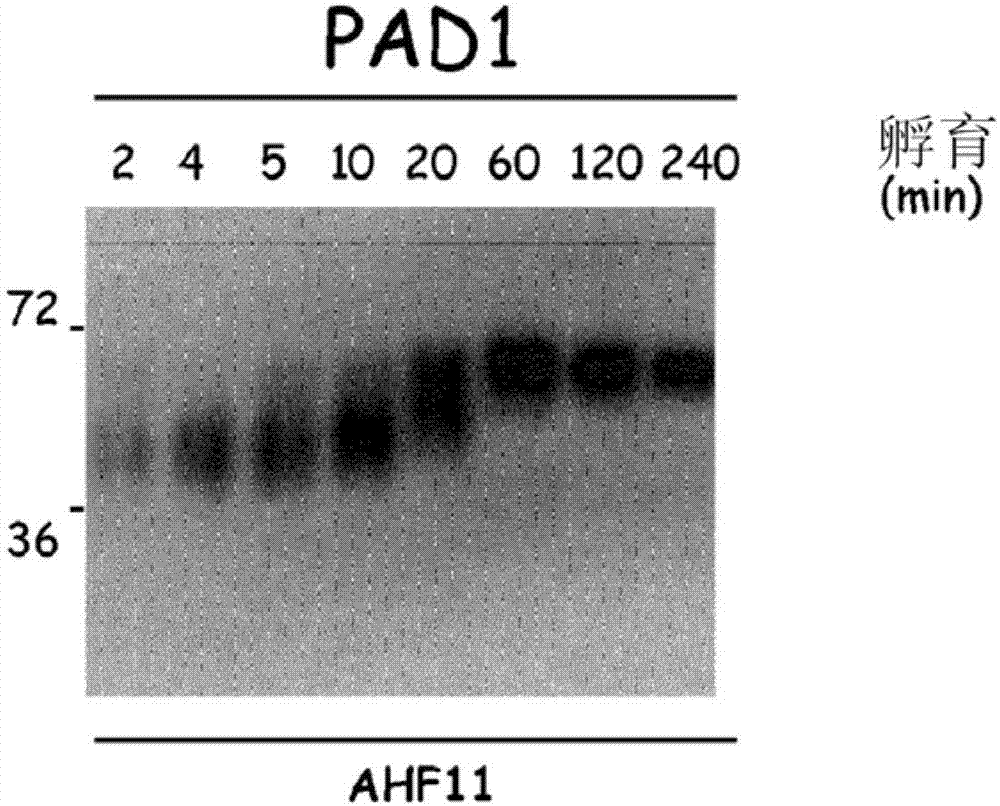
:皮肤由三个隔层组成,皮下组织(其为最深层的)、真皮和表皮。表皮层是一种角质化的马耳皮基氏(malpighien)上皮,其保护身体免受机械的、化学的和生物学的伤害,通过限制皮肤中含有的水分的蒸发来防止水分损失,并且通过吸收一部分紫外线来参与光保护。这些生命机能被统称为“表皮屏障功能”。表皮主要由角质细胞组成。这些角质细胞在基底层增殖,然后经历矢量分化程序以相继构成棘层,然后是颗粒层。最后,在角质化过程中,它们死亡并被转化为角化细胞。角化细胞的累积形成表皮的最外侧细胞层,其被称为角质层(couchecornée)或角质层(stratumcorneum)。由于角质层的机械抵抗力、水密性及其抗菌肽和尿刊酸的含量,其对表皮屏障功能负有主要责任。角化细胞缺少细胞核和其它细胞器。它们由纤维基质组成,所述纤维基质主要包含角蛋白和丝聚蛋白并由替代质膜的抗消化蛋白壳(角质化包膜)包围。角化细胞通过新型连接结构角化细胞间桥(cornéodesmosomes)彼此连接。在脱皮过程(一个由许多蛋白酶和蛋白酶抑制剂非常精细地控制的过程)中,在角化细胞间桥的蛋白质水解之后,最表面的角化细胞从皮肤上脱离。从生理学上讲,角质层包含10%至15%的水。这种保湿作用(hydratation)对于表皮屏障和脱皮是必不可少的,无论外部的水分条件如何,都必须被维持所述保湿作用。事实上,其能够使得角化细胞内部(蛋白酶、转谷氨酰胺酶、pad等)和外部(蛋白酶、脂酶、糖苷酶等)的许多酶具有活性。其还具有增塑作用,所述增塑作用能够在机械应力之后使得角质层保持其弹性及其完整性。角质层保湿作用的下降(其特征在于“干燥”皮肤或干燥病)表现为紧绷感、令人不快的触感、鳞状外观和持久性表面裂纹和鳞片状外观。在分子水平上,其诱导a)桥粒成分(角膜锁链蛋白、桥粒钙粘蛋白和斑块蛋白质)降解的降低和在整个角化细胞表面上以及贯穿于表皮角质层顶层的角化细胞间桥的保留,导致角化过度和b)细胞间脂质和角膜包膜的成熟的改变。干燥病能够发生在任何解剖学区域内和高度变化的情况下,例如,在某些气候条件下(寒冷、刮风、干燥、迅速和反复地从空气寒冷和干燥的空调大楼通向炎热和潮湿的外界),在心理压力和化学因素(酒精、有机溶剂、清洁剂等;例如采用某些肥皂重复清洗)或物理因素(紫外线)的作用下。其也能够在新生儿(其是由于突然从水性介质的羊水到空气中)和老年人(由于季节变化)中出现。但是其也能够由于暴露于阳光而诱导。许多皮肤疾病还引起皮肤屏障的干扰和角质层的干燥:鱼鳞癣,特别是寻常型鱼鳞癣(omim146700)、过敏性皮炎(omim605803)、牛皮癣(omim177900)。天然保湿因子(fnh)确保角质层的保湿作用,所述天然保湿因子通过对抗环境的干燥作用使得角化细胞的最外层能够保留水分。fnh(其能够代表高达20%的角质层干重)的组成如下:这些成分的50%以上对应于游离氨基酸及其某些衍生物。特别地,吡咯烷酮羧酸(能够代表高达12%的fnh的谷氨酰胺的自发衍生物)发挥主要的吸湿作用。(通过组氨酸酶由组氨酸形成的)尿酸吸收一部分紫外线-b的辐射。所有这些氨基酸直接产生于丝聚蛋白的降解,所述丝聚蛋白是37kda大小的碱性蛋白,由颗粒状角质细胞以较大的(400kda)前体形式(丝聚蛋白原)合成。这种透明角质颗粒的必要成分通过重复10至12个丝聚蛋白亚单元(取决于个体差异)而形成,各自具有327个氨基酸长度并且通过7-氨基酸结合肽结合在一起。在角化过程中,丝聚蛋白原被裂解为碱性丝聚蛋白亚单元。这些丝聚蛋白亚单元组合成角蛋白的中间纤维(k1和k10)并促进它们的聚集和角化细胞内纤维基质的形成。然后,在角质层中,丝聚蛋白被脱亚胺,这导致其从中间纤维中解离。然后,它能够被钙蛋白酶i、半胱天冬酶14和博来霉素水解酶彻底降解,由此产生fnh的氨基酸构成要素。因此,在维持角质层的保湿作用和表皮屏障功能中,丝聚蛋白的脱亚胺是必要的,甚至是限制性的步骤。脱亚胺(或瓜氨酸化)是由钙依赖酶家族,pad(e.c.3.5.3.15)催化的翻译后修饰。它相当于精氨酰残基(带正电荷)向瓜氨酰残基(电中性)的转化。存在五种同种型的pad,由五种截然不同的基因(称为padi)编码,重新集结在人染色体1的短臂上的位点1p35–36处。它们是pad1、pad2、pad3、pad4和pad6。然而,pad2是普遍存在的,其它同种型以一种更加受限制的方式表达,这取决于所分析的组织。特别地,在正常人表皮中仅检测出pad1、pad2和pad3。基于生物化学和物理化学参数,并且由于它们与丝聚蛋白共同集中在角化细胞内纤维基质中,已经证明pad1和pad3是负责丝聚蛋白脱亚胺的同种型。因此,如果人们希望作用于fnh的氨基酸的生产,则必须以这些同种型为靶点。此外,根据适应机制,根据外界湿度比率,通过丝聚蛋白的分解代谢来调节fnh的生产。例如,在大鼠胚胎发育的最后几天,丝聚蛋白在角质层的整体高度中积累。出生之后几小时,根据与在成人皮肤中观察到的相同的模式,其在外侧部分中被蛋白水解。将新生大鼠保持在相对湿度为80%以上的环境中防止了该降解过程的活化,而不启动蛋白质的合成。相似地,当将无毛小鼠从潮湿环境转移至正常环境中时,游离氨基酸的比率和皮肤表面的电导(保湿作用的反映)在3天内被修复。为了降低皮肤干燥,改善角质层的保湿作用和治疗干燥病或鱼鳞癣,使用包含吸湿活化剂的化妆品制剂或药物制剂在皮肤上的外部应用。这些制剂(例如)包含脲或乳酸(fnh的其它成分)。通常,由于羟基酸的保湿和“抗老化”属性,其已经成为用于化妆品工业的最大类别的化合物之一,但是最受欢迎的和最普遍使用的保湿剂无疑是甘油。无论制剂已经被如何开发,显然有必要提出用于化妆品工业和/或药典的新型活性剂以改善干燥皮肤的症状。本发明的目的恰好是通过使用能够作用于pad1和pad3的新型化合物来促进fnh的产生,以促进角质层的天然保湿作用。这能够特别有利地应用于身体或脸部的皮肤、嘴唇、睫毛、眉毛、头发、头皮或指甲的护理和/或化妆产品领域;防晒或仿晒产品领域;头发产品尤其是头发的染色、调理和/或护理的产品领域。技术实现要素:事实上,在重大研究之后,本申请人以一种令人惊奇的且意想不到的方式发现:(单独或组合使用的)茶碱乙酸或其盐、咖啡因和可可碱具有增加pad1和/或pad3的活性的能力,特别是将它们的生理学底物丝聚蛋白脱亚胺的能力,以促进角质层的天然保湿作用。这些分子的化学式指定如下:2-(1,3-二甲基-2,6-二氧代-2,3-二氢-1h-嘌呤-7(6h)-基)乙酸1,3,7-三甲基-1h-嘌呤-2,6(3h,7h)-二酮3,7-二甲基-1h-嘌呤-2,6(3h,7h)-二酮业已证明,脱亚胺反应被分为5个连续的步骤:i)通过酶的活性位点的cys的巯基基团亲核进攻肽基-l-精氨酸的cζ;ii)活性位点的asp与底物之间的(氢和盐)键的形成;iii)肽基-l-精氨酸的cζ和νη2之间的键的裂解和氨的释放;iv)第二次亲核进攻,这次是通过水分子;和v)在前述反应结束时形成的加合物的水解和最终脱亚胺产物(肽基-l-瓜氨酸)的释放。因此,本发明涉及通过单独或组合使用如上所述的活性剂非此即彼地活化由pad1或pad3催化的反应的这5个步骤。数种病症从临床水平上的特征在于脱亚胺的缺失,如牛皮癣和先天性大疱性鱼鳞病样红皮病(omim113800)。相似地,我们注意到在患有过敏性皮炎的患者的角质层中脱亚胺蛋白质的检测的下降(参见以下实施例3)。然而,在患有牛皮癣如过敏性皮炎的患者的角质层中,在损伤和未损伤的区域中,pad以类似于对照的水平表达。因此,本发明涉及包含pad1和/或pad3的活化剂化合物的组合物作为皮肤保湿剂的化妆品用途,所述活化剂化合物选自茶碱乙酸或其盐、咖啡因、可可碱及其混合物。更特别地,所述组合物旨在促进表皮中丝聚蛋白的脱亚胺。根据本发明的化合物还旨在促进角质层中fnh(天然保湿因子)的产生。因此,选择这些pad1和/或pad3的活化剂用于促进角质层中fnh的产生以及用于它们在表皮(特别是角质层)的保湿作用方面、在改善任何形式的皮肤干燥方面,或者在增强表皮屏障功能并预防皮肤老化标志方面的用途。本发明的活性剂能够是任何来源的,即从植物如咖啡树或可可树中分离;即使它们不是通过所述任何来源的生物体天然产生,也可以通过微生物产生;或者通过化学合成获得。在本发明的上下文中,表述“茶碱乙酸的盐”指茶碱乙酸的有机盐或无机盐。作为根据本发明能够使用的有机盐,可以提及在现有技术fr2639541中描述的那些有机盐。优选地,它将是三乙醇胺盐。作为茶碱乙酸的无机盐,可以提及钠盐、钾盐或锂盐。在本发明的一个特别的实施方案中,通过向包含茶碱乙酸的组合物中添加作为中和剂的有机碱或无机碱来形成茶碱乙酸盐。优选地,所述有机碱是三乙醇胺且所述无机碱是naoh。本发明还涉及药物组合物和/或化妆品组合物,其包含至少一种如上所定义的pad1和/或pad3活化剂并且特别是茶碱乙酸或其盐(单独或与咖啡因和/或可可碱组合)和至少一种药学上或化妆品学上可接受的赋形剂的组合。优选地,该组合物可以是天然来源或合成来源,更优选合成来源。优选地,在药物组合物的情况下,存在于组合物中的茶碱乙酸占组合物总重量的0.5重量%至3重量%,并且在化妆品组合物的情况下,存在于组合物中的茶碱乙酸占组合物总重量的0.1重量%至1重量%。优选地,所使用的pad1和/或pad3活化剂化合物将是茶碱乙酸或其盐。在本发明的一个特别的实施方案中,茶碱乙酸或其盐与咖啡因和/或可可碱组合。考虑到茶碱乙酸或其盐对pad1和/或pad3酶的活化剂作用,其能够增加角质层中丝聚蛋白的降解,并且因此增加包含fnh的氨基酸,特别是谷氨酰胺衍生的吡咯烷酮羧酸(pca)的产生。该酸的分析量的增加显示出这些化合物的保湿活性。优选地,根据本发明的组合物将被外部施用。优选地,根据本发明的组合物将包含至少一个液体脂肪相,所述液体脂肪相能够包含至少一种包含碳、烃、氟和/或硅酮的,挥发的或不挥发的,单独或混合的,选自矿物、动物、植物或合成来源的油和/或溶剂的化合物。在一个优选的实施方案中,根据本发明的组合物将优选以用于身体或脸部的皮肤、嘴唇、睫毛、眉毛、头发、头皮或指甲的护理和/或化妆产品的形式提供;以防晒或仿晒产品的形式提供;以头发产品尤其是用于头发的染色、调理和/或护理产品的形式提供。因此,本发明的另一方面涉及单独或组合使用的如上所述的活性剂的治疗用途,以预防和/或治疗这些脱亚胺异常和/或促进角质层的保湿作用和改善任何形式的病理性皮肤干燥的症状。在本发明的上下文中,“病理性皮肤干燥”指任何类型的皮肤干燥,其或者直接涉及皮肤病症,或者归因于皮肤病症的皮肤病学治疗。在本发明的一个特别的实施方案中,咖啡因将用作组合物中唯一的治疗活性成分。在本发明的另一个优选的实施方案中,可可碱将用作组合物中唯一的治疗活性成分。根据本发明的组合物将能够确保表皮(特别是角质层)的保湿作用,任何形式的皮肤干燥的改善,表皮屏障功能的增强和皮肤老化标志的预防。表皮的保湿作用指表皮的水平衡的改善或维持。任何形式的皮肤干燥的改善指表皮保湿作用的任何改善,尤其是其特征在于角质层中水分的缺乏,位于表面上的水脂膜(unfilmhydrolipidique)太薄并且不再保护皮肤,皮脂的缺乏。皮肤老化指除了对真皮的作用和组织弹性损失以外的屏障功能的减弱。尽管感觉不到的水分损失几乎没有增加,临床经验已经显示出年长者比健康状况良好的年轻人更容易患上皮肤干燥。首先,这通过脂质屏障的改变而得到解释。表皮屏障也更容易被改变并且修复的过程更慢。拉曼光谱技术已经能够显示出角质层保持水分的能力和fnh随着年龄增长而减少的量(主要是在最表面的层中)。由于紫外线b诱导的dna(法文公开为adn)损伤及其显著的致突变能力,其为皮肤癌发病的主要诱因之一。它们当中的大部分被黑色素吸收,但是fnh的一种成分(反式尿刊酸,其在皮肤中的平均比率约为5μg/cm2)确保了第一道光保护屏障。这是一种相对有效的天然遮光剂,其在20世纪七八十年代被添加到许多化妆品中。在角质层中,如同大多数fnh的氨基酸一样,反式尿刊酸衍生自丝聚蛋白的分解代谢。因此,本发明还涉及单独或组合使用的如上所述的活性剂的化妆品用途,其用于表皮的保湿作用,以促进反式尿刊酸的天然产生并保护皮肤抵抗紫外线。优选地,本发明涉及一种组合物,其用于治疗和预防皮肤疾病;其用于治疗干燥病、鱼鳞癣、牛皮癣、过敏性皮炎、角化过度和先天性大疱性鱼鳞病样红皮病。在本发明的一个特别的实施方案中,根据本发明的药物组合物包含至少一种由茶碱乙酸或其盐与咖啡因和/或可可碱的组合组成的pad1和/或pad3活化剂化合物和至少一种药学上或化妆品学上可接受的赋形剂,其治疗用途用于治疗和预防皮肤疾病;用于治疗干燥病、鱼鳞癣、角化过度和先天性大疱性鱼鳞病样红皮病。本发明还涉及一种角质材料,尤其是身体或脸部的皮肤、嘴唇、指甲、头发和/或睫毛的化妆品治疗方法,其包括将根据本发明的化妆品组合物应用在所述材料上。附图说明在本发明的上下文中,各种生物化学分析方法已经有可能选择数个调节pad1和pad3的催化活性的分子,所述选择基于所述分子使丝聚蛋白脱亚胺的特殊能力。这些结果将在附图中阐明,所述附图表示:图1:纯化的重组蛋白的分析。如文中所述,在纯化之后,通过在sds存在下的聚丙烯酰胺凝胶电泳(page-sds),分离pad1、pad3和重组人丝聚蛋白(fil-his),采用考马斯蓝染色或免疫检测。ahf11(一种抗丝聚蛋白单克隆抗体)检测到约45kda的未脱亚胺的fil-his。在左侧以kda表示表观分子量。图2:通过pad1的重组人丝聚蛋白(fil-his)的脱亚胺的动力学。在采用pad1孵育之后,采用ahf11(一种抗丝聚蛋白单克隆抗体)免疫检测fil-his。在左侧以kda表示表观分子量,并且在插图的顶端以分钟(min)表示孵育时间。注意的是,通过pad1的fil-his的脱亚胺诱导其从45至66kda的迁移的进行性变化。图3:在链霉素存在或缺失下,通过pad1的重组人丝聚蛋白(fil-his)的脱亚胺。如文中所述,在5mm链霉素(str)存在下或者在1%二甲基亚砜(d)(溶剂)存在下,在采用pad1孵育之后,通过ahf11(一种抗丝聚蛋白单克隆抗体)或者通过amc(一种抗瓜氨酸抗体)免疫检测fil-his。在左侧以kda表示表观分子量,并且在插图的顶端以分钟(min)表示孵育时间。注意的是,pad1被链霉素抑制,因为与溶剂单独存在下进行的孵育相比,当在该分子存在下发生孵育时,通过amc的免疫检测强度更低。图4:在咖啡因存在或缺失下,通过pad1的重组人丝聚蛋白(fil-his)的脱亚胺。如文中所述,在50μm咖啡因(caf)存在下或者在1%二甲基亚砜(d)(溶剂)存在下,在采用pad1孵育之后,通过ahf11(一种抗丝聚蛋白单克隆抗体)或者通过amc(一种抗瓜氨酸抗体)免疫检测fil-his。在左侧以kda表示表观分子量,并且在插图的顶端以分钟(min)表示孵育时间。注意的是,pad1被咖啡因活化,因为与溶剂单独存在下相比,fil-his在该分子存在下被更加强烈地脱亚胺。图5:在可可碱存在或缺失下,通过pad3的重组人丝聚蛋白(fil-his)的脱亚胺。如文中所述,在200μm可可碱(théo)存在下或者在1%二甲基亚砜(d)(溶剂)存在下,在采用pad3孵育之后,通过ahf11(一种抗丝聚蛋白单克隆抗体)或者通过amc(一种抗瓜氨酸抗体)免疫检测fil-his。在左侧以kda表示表观分子量,并且在插图的顶端以分钟(min)表示孵育时间。注意的是,pad3被可可碱活化。图6:在茶碱乙酸存在或缺失下,通过pad3的重组人丝聚蛋白(fil-his)的脱亚胺。如文中所述,在最终浓度为50μm(顶部)或200□μm(底部)的茶碱乙酸(acé)存在下或者在1%二甲基亚砜(d)(溶剂)存在下,在采用pad3孵育之后,通过ahf11(一种抗丝聚蛋白单克隆抗体)或者通过amc(一种抗瓜氨酸抗体)免疫检测fil-his。在左侧以kda表示表观分子量,并且在插图的顶端以分钟(min)表示孵育时间。注意的是,pad3被茶碱乙酸活化(在最高浓度下特别明显)。图7a-7d:在咖啡因、可可碱和/或茶碱乙酸单独或组合存在下,通过pad1或pad3的重组人丝聚蛋白的脱亚胺。将fil-his在pad1存在下孵育5分钟(图7a-7b)或在pad3存在下孵育60分钟(图7c-图7d)。如文中所述,在孵育前,向反应混合物中单独地(图7a和7c)或组合地(图7b和7d)加入312.5μμ咖啡因(caf)、茶碱乙酸(acé)或可可碱(théo)。在孵育之后,通过抗瓜氨酸抗体(amc)免疫检测fil-his,并使用imagej软件定量免疫检测强度。以柱状图的形式表示数据,作为每一种酶相对于在活性剂缺失下进行的对照(-)的活性相对百分比。图8:在正常人皮肤或患有过敏性皮炎的患者的皮肤的切片上通过免疫组织学分析的pad1、pad3和脱亚胺的蛋白质。在瓜氨酸的化学修饰之后,通过抗瓜氨酸(amc)免疫检测脱亚胺的蛋白质。平行进行阴性对照(neg)。如上所述(实施例3),通过抗-pad1和抗-pad3抗体免疫检测pad1和pad3。图像呈现出针对八名患者(da1、2和3)和三名对照(nor1)所获得的结果[横杠=150μm]。图9:在重建表皮的表面上外部应用三乙醇胺盐或钠盐形式的茶碱乙酸之后,脱亚胺蛋白质的westernblot分析。采用对照凝胶(1)或包含浓度为3%(2和3)的三乙醇胺盐(2)或钠盐(3)形式的茶碱乙酸外部处理重建表皮24小时。图9a、将总蛋白通过电泳分离,并通过抗瓜氨酸抗体(amc)和抗肌动蛋白抗体免疫检测。一式三份(i、ii和iii)地进行实验。在左侧以kda表示表观分子量。图9b、使用imagej软件定量免疫检测强度。相对于肌动蛋白归一化所获得的数值。将它们以柱状图的形式表示,作为相对于在茶碱乙酸缺失下进行的对照的相对百分比。注意的是,与采用对照凝胶处理的表皮相比,采用包含盐形式的茶碱乙酸的凝胶处理的表皮的瓜氨酸化蛋白质的免疫检测强度更高。图10,其中的a-f:在重建表皮的表面上外部应用钠盐形式的茶碱乙酸之后,脱亚胺蛋白质的免疫组织学分析。采用经过(a-c)或未经过(d-f;阴性对照)瓜氨酸修饰的抗瓜氨酸抗体(amc)对未经处理的正常皮肤(a和d)和采用对照凝胶(b和e)或包含浓度为3%的钠盐形式的茶碱乙酸的凝胶(c和f)处理的重建表皮的冰冻切片进行免疫组织学分析[横杠=150μm]。注意的是,与用对照凝胶(b)处理的重建表皮相比,采用钠盐形式的茶碱乙酸(c)处理的重建表皮的角质层染色强度增加。具体实施方式药理学评估a/使用重组人丝聚蛋白的pad1和/或pad3的活性测定方法:1、重组人丝聚蛋白的产生和纯化通过在大肠杆菌bl21codonplus(de3+)-ril菌株(stratagene,lajolla,ca)中使用pet-41b载体(merck,kgaa,darmstardt,germany)与6-组氨酸标记在cooh末端融合来产生324个氨基酸亚单位的重组人丝聚蛋白(“基因银行”数据库登录号:af043380)。为此,首先使用以下寡核苷酸对:5'-catatgctataccaggtgagcactcatg-3'和5'-ctcgagccctgaacgtccagaccgtcc-3',由提取自人表皮的mrna通过pcr扩增cdna,然后纯化并克隆到pcrii–topo载体(invitrogen,carlsbad,ca)中。因此,pcr产物的两侧为ndei位点和xhoi位点,这两个额外的限制性酶切位点能够从pcrii-topo载体向pet-41b表达载体亚克隆。通过测序确认之后,产生丝聚蛋白亚单元(后文中被称为fil-his),并根据本领域技术人员熟知的方案,通过镍亲和色谱法纯化。通过page-sds(10%凝胶)分析由此纯化的fil-his重组蛋白,并采用ahf11抗丝聚蛋白单克隆抗体免疫检测。通过采用考马斯蓝的染色监测纯度,fil-his蛋白具有约45kda的表观分子量(参见图1)。使用牛血清白蛋白的标准范围,采用nanodrop1000(fisherscientific,illkirch,france)测定所获得的纯化部分的浓度(以mg/ml计)。2、活性重组人pad1和pad3的制备根据本领域技术人员熟知的方案产生和纯化的pad1和pad3购自hidenaritakahara教授(universitéd’ibaraki,japon)。所述纯化的活性人重组pad1和pad3的特征示于下表:*一个单位被规定为于55℃在1小时内由bz-l-arg-o-et催化形成1μmolbz-l-cit-o-et的pad的量。在通过page-sds的分离之后,通过采用考马斯蓝的染色来评估每一种酶的纯度(参见图1)。3、通过pad1和pad3的fil-his的脱亚胺于50℃,在40mu的pad1或pad3存在下,在脱亚胺缓冲液(cacl210mm、二硫苏糖醇5mm、tris-hcl50mmph7.4)中孵育25ngfil-his。在根据pad的同种型的可变孵育时间之后(通常,对于pad1为2至5分钟,并且对于pad3为60至180分钟),通过添加样品缓冲液淬灭反应。然后,通过将蛋白质通过page-sds分离,并通过(稀释至1/5000的)ahf11抗丝聚蛋白单克隆抗体和amc修饰的抗瓜氨酸抗体(millipore,mollsheim,france)免疫检测。结果:1、fil-his的脱亚胺的评估当fil-his没有被脱亚胺时,其在变性凝胶中的表观分子量约为45kda。在采用考马斯蓝染色或采用ahf11抗体免疫检测之后,其以单一蛋白质的形式迁移(参见图1)。fil-his的脱亚胺诱导其表观分子量从45到~66kda的进行性增加(参见图2)。~66kda的形式对应于完全脱亚胺的形式,而中间的形式对应于或多或少脱亚胺的形式。因此,fil-his的脱亚胺程度与其通过page-sds分离之后的表观分子量相关。仅在采用活性pad孵育之后,通过amc抗体免疫检测fil-his。其免疫检测强度越高,则其脱亚胺的程度越高(见图3)。2、链霉素抑制pad1在脱亚胺反应开始之前,丝聚蛋白迁移的变化和/或通过amc抗体的检测强度的变化有可能评估向反应混合物中添加的分子对pad的作用(活化剂或抑制剂)。例如,通过该方法能够证明链霉素对pad1的抑制(参见图3)。与在溶剂(1%二甲基亚砜)单独存在下所有相同时间点的孵育相比,当在5mm链霉素存在下采用pad1孵育fil-his3或5分钟时,通过amc抗体条带的免疫检测强度较低,所述amc抗体条带的质量为~66kda或者在45至~60kda之间。b/pad1和/或pad3活化剂方法:在活性剂或活性剂组合存在下,通过pad1或pad3的fil-his的脱亚胺如上所述(a.3段),于50℃,在40mu的pad1或pad3存在下,在脱亚胺缓冲液(cacl210mm、二硫苏糖醇5mm、tris–hcl50mmph7.4)中进行fil-his(25ng)的脱亚胺0、3、5、60和180分钟。在加入酶之前,将获得最终浓度为50、200和312.5μμ的在1%二甲基亚砜溶液中的活性剂,或者1%二甲基亚砜单独(对照),或者将每一个在1%二甲基亚砜中稀释至312.5μμ的数个活性剂的混合物加入到反应混合物中。在某些情况下,将活性剂稀释于水中。在孵育之后,采用amc抗体免疫检测反应混合物的蛋白质。通过采用nihimagej软件的测密度术来定量免疫检测强度。结果:1、通过咖啡因的pad1的活化在脱亚胺之前,通过作为约45kda的条带的ahf11抗体而不是通过amc抗体来免疫检测fil-his(参见图4)。在pad1和二甲基亚砜(最终1%)存在下孵育3和5分钟之后,fil-his部分被pad1脱亚胺:然后其用amc抗体免疫检测为45至~60kda之间大小的条带。在pad1和咖啡因(最终在1%二甲基亚砜中为50μm)存在下孵育3和5分钟之后,该条带的免疫检测强度更强,并且采用amc抗体检测到额外的条带(迁移至66kda)(参见图4)。该~66kda的蛋白质对应于完全脱亚胺的fil-his。定量分析确证了该结果并显示在咖啡因存在下孵育之后,与对照相比,45至~66kda之间的条带的免疫检测强度增加了151%。在采用溶解和稀释于超纯水中的咖啡因进行试验期间获得对比结果。因此,咖啡因活化pad1。2、通过可可碱的pad3的活化在脱亚胺之前,fil-his具有约45kda的表观分子量;通过ahf11抗体而不是通过amc抗体免疫检测fil-his(参见图5)。在pad3和二甲基亚砜(1%)存在下孵育180分钟之后,fil-his被pad3部分脱亚胺:然后其通过amc抗体免疫检测,作为45至~66kda之间大小的条带。在pad3和可可碱(在1%二甲基亚砜中200μm)的存在下孵育180分钟之后,用amc抗体免疫检测的带的强度更强(见图5)。免疫检测强度的定量显示出182%的增加。在用溶解和稀释于超纯水中的可可碱进行试验期间获得对比结果。因此可可碱活化pad3。3、通过茶碱乙酸的pad3的活化。在脱亚胺之前,通过接近45kda的ahf11抗体免疫检测fil-his但不是通过amc抗体检测(参见图6)。在pad3和二甲基亚砜(1%)存在下孵育180分钟之后,fil-his部分被pad1脱亚胺:然后其用amc抗体免疫检测为45至~60kda之间大小的条带和~66kda的条带。在pad3和茶碱乙酸(在1%二甲基亚砜中为200μm)存在下孵育180分钟之后,通过amc抗体免疫检测的条带的强度明显更强(参见图6)。免疫检测强度的定量确证了该结果并显示出225%的增加。在采用溶解和稀释于超纯水中的茶碱乙酸进行试验期间获得对比结果。因此,茶碱乙酸活化pad3。4、咖啡因、可可碱和/或茶碱乙酸的混合物对pad1和pad3活性的作用的评估在三种活性剂(咖啡因、可可碱和茶碱乙酸)中的每一种或者这些活性剂中的两种或三种的混合物存在下,进行通过pad1(孵育5分钟)和pad3(孵育60分钟)的fil-his脱亚胺的相似试验。将活性剂溶解,然后稀释于超纯水中。将其以312.5μμ的最终浓度用于试验。如前定量通过amc抗体的免疫检测强度(参见图7a-7d)。获得的结果确证了咖啡因活化pad1并且可可碱和茶碱乙酸活化pad3。此外,它们证实单独使用的三种活性剂以可比较的活化水平活化pad1和pad3(参见图7a和7c)。活性剂成对的或三种在一起的添加没有诱导抑制作用。观察到相同水平的pad1活化(参见图7b)。两种或三种活性剂的添加似乎更加明显地活化了pad3(参见图7d)。因此,单独或组合使用咖啡因、可可碱和茶碱乙酸活化pad1和pad3。c/患有过敏性皮炎的患者的皮肤的受损表皮的角质层的脱亚胺蛋白质的检测的减少方法:1、皮肤切片对(由图卢兹医院皮肤科医生确诊的)8名患有过敏性皮炎的患者的受损皮肤和3名对照的健康皮肤进行直径为3mm的活组织检查,所述皮肤被固定在甲醛中并封闭于石蜡中。对每个活组织检查进行连续切片(6μm),存放在superfrost载玻片上,用连续的二甲苯和乙醇浴脱蜡,然后再水化并用苏木精-曙红染色或通过免疫组织学分析。2、通过免疫组织学的脱亚胺蛋白质的检测为了免疫检测脱亚胺蛋白质,于37℃,在改良的缓冲液:0.0125%的fecl3、2.3m的h2so4、1.5m的h3po4、0.25%的二乙酰单肟和0.125%的安替比林中孵育皮肤切片3小时。通过省略二乙酰单肟和安替比林系统性地制备阴性对照。用水洗涤之后,采用稀释至1/500的amc参照抗体孵育切片,然后采用“impressreagentantirabbitigpo”试剂盒,根据制造商的说明(vectorlaboratories,burlingame,ca),在作为过氧化物酶显色底物的二氨基联苯胺存在下熟化切片。最后,用苏木精进行反向染色。3、通过免疫组织学的pad1和pad3的检测根据如上所述的方案,分别使用稀释至1/80和1/100的特异性抗pad1和抗pad3(b3)抗肽抗体免疫检测pad1和pad3。用苏木精进行反向染色。通过省略第一抗体制备阴性对照。结果:1、患有过敏性皮炎的患者的表皮中脱亚胺蛋白质的减少所有没有经历化学修饰的样品都是阴性的。来自于对照个体的皮肤样品展现出非常强的和连续的染色,其中amc抗体贯穿于表皮角质层并在所有角化细胞层上。相反,来自于患有过敏性皮炎的患者的皮肤样品展现出明显较弱的且通常是不连续的角质层染色(参见图8)。总之,与健康对照相比,患有过敏性皮炎的患者的受损表皮的蛋白质的脱亚胺明显被减少。2、患有过敏性皮炎的患者的表皮中pad1和3的表达对于所有采集的过敏性皮肤的样品而言,在所有表皮的活跃层的胶质细胞的细胞质中检测到pad1,其中在最分化的角质细胞中有较高的强度。对于正常皮肤样品观察到相同的免疫检测属性,正如本领域技术人员所熟知的那样。在过敏性皮肤和正常皮肤上获得的染色强度是相同的。在正常表皮中,主要在颗粒角质细胞的细胞质中检测到pad3,正如本领域技术人员所熟知的。在所有患者的过敏性皮肤中,在最分化的角质细胞的数个细胞层的细胞质中检测到pad3。通常来说,染色强度与正常表皮的染色强度相当(参见图8)。因此,pad1和pad3在患有过敏性皮炎的患者的表皮中被广泛表达。因此,并不是这些酶的缺失解释了之前观察到的蛋白质脱亚胺的减少,反而可能是更低的活性所致。d/在采用包含茶碱乙酸的凝胶处理之后,角质层的脱亚胺蛋白质的增加方法:1、重建表皮重建人表皮在气-液界面处以0.33cm2的大小的生长14天。然后用刷子将5mg/cm2的包含各种活性剂的预配方均一地应用到它们的表面。于37℃,一式三份地进行24小时的处理时间。然后将表皮分割:一半冷冻在tissuetek中,然后进行6μm的冷沉淀-切片用于免疫组织学;另一半于-80℃冻干用于在westernblot分析前制备总蛋白提取物。通过在样品缓冲液(0.175mtris-hclph6.8;12.5%β-巯基乙醇,7.5%sds,25%甘油)中煮沸来提取总蛋白并通过sds-page(在4-15%梯度凝胶中)来分离。2、通过免疫组织学的脱亚胺蛋白质的检测在改良的缓冲液中孵育之后,如上所述地免疫检测脱亚胺蛋白质。通过省略改良来系统性地制备阴性对照。在采用水洗涤之后,采用稀释至1/1000的amc抗瓜氨酸抗体孵育切片。最后,用苏木精进行反向染色。3、通过westernblot的脱亚胺蛋白质的检测通过如上所述的amc抗瓜氨酸抗体或通过抗肌动蛋白抗体(millipore,clonemab1501)免疫检测通过离心澄清并通过page-sds分离的蛋白提取物。如上所述地定量免疫检测强度。结果:1、采用三乙醇胺盐或钠盐形式的茶碱乙酸处理的重建表皮中脱亚胺蛋白质的增加。在所有的提取物中都检测到表观分子量在90至30kda之间的脱亚胺蛋白质(参见图9a)。其中之一是丝聚蛋白(箭头)。在相当于采用包含三乙醇胺盐或钠盐形式的茶碱乙酸的水性凝胶处理的表皮的泳道中的免疫检测强度比相当于采用水性凝胶单独处理的表皮的泳道中的免疫检测强度更强(约2.5倍)(图9a和9b)。2、采用钠盐形式的茶碱乙酸处理的重建表皮的角质层中脱亚胺蛋白质的增加。所有没有经历化学修改的样品均为阴性(参见图10中的d、e和f)。采用amc抗体的重建表皮的样品展示出贯穿于角质层的不连续的染色。在采用钠盐形式的茶碱乙酸处理之后,免疫检测强度更强(参见图10)。总之,在水性凝胶中以盐形式应用于重建表皮的表面的茶碱乙酸增加了角质层的蛋白质并且特别是丝聚蛋白的脱亚胺。e、包含3%钠盐形式的茶碱乙酸的水性凝胶的制备例操作模式步骤a:在预先加热至70℃的水中,在搅拌下(1300转/分)分散茶碱乙酸+添加naoh:70℃步骤b:在搅拌下(500转/分)添加苯氧乙醇+缓慢洒入纤维素羟乙基醚,然后增加剪切力。然后在搅拌下(在10分钟内1300转/分)将b加入a中。冷却并均质化(在900转/分下1小时)最终ph=7.16宏观观察:粘稠的、透明的、无色的凝胶。组合物的实例以霜剂形式的根据本发明的数个制剂具有以下组成(以相对于组合物总重量的质量百分比给出用量)。有利地,根据本发明的制剂具有0.5%至3%之间的茶碱乙酸或其盐,根据所需的湿润能力调整所述百分比。实施例1:名称质量%功能茶碱乙酸0.5至3保湿剂甘油15湿润剂凡士林8润肤剂液体石蜡2润肤剂硬脂酸1.5乳化剂单硬脂酸甘油酯5乳化剂环甲硅油1.5润肤剂二甲硅油0.5润肤剂聚乙二醇6005.0湿润剂三乙醇胺适量中和剂ph=6.5对羟基苯甲酸丙酯适量防腐剂水适量至100.0实施例2:当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1