一种纤维增强的可注射原位固化和成孔的骨组织工程支架材料及其制备方法与流程
本发明属于医用材料领域,尤其涉及一种纤维增强的可注射原位固化和成孔的骨组织工程支架材料及其制备方法。
背景技术:
据统计,我国每年因疾病、创伤、肿瘤等造成的骨缺损病人超过100万,且呈上升趋势。自体骨移植和同种异体骨移植是目前治疗骨缺损的主要方法。然而,自体骨来源有限,且对供体部位造成新的缺损,应用受到限制。同种异体骨骨诱导能力较自体骨差,且存在排斥反应和疾病传播的危险性。近年来,越来越多的无机合成材料或有机合成高分子材料被研究和开发作为骨组织工程支架或骨修复材料逐步应用于临床。
目前,临床上常用的骨组织工程支架或骨修复材料主要为体外制备的已塑形的硬性移植材料,如脱钙骨(dbm)/胶原复合物等。然而,临床上在使用已塑形的硬性移植材料治疗骨缺损时常常遇到以下问题:①缺损腔隙往往不规则,移植材料与宿主骨不能紧密贴附,影响成骨细胞的爬行和骨组织的应力性生长,而且材料极易从缺损部位脱落;②创伤大,骨缺损部位周围软组织包括血管、肌肉等往往受损比较严重,常规手术切开骨缺损修补术又会导致软组织的进一步损伤,最终影响骨的桥接和融合。③手术时间较长,增加了术后感染的风险和手术成本。
为解决硬性移植材料治疗骨缺损时遇到的问题,可注射骨组织工程支架材料被开发出来。可注射骨组织工程支架材料主要由高分子聚合物和有机溶剂组成,常用的高分子聚合物包括聚乳酸(pla)或聚丙交酯-乙交酯(plga)等可生物降解高分子材料,常用的有机溶剂包括n-甲基-2-吡咯烷酮(nmp)等。可注射骨组织工程支架材料在注射入到骨缺损部位后,有机溶剂迅速被骨组织中的水置换,高分子聚合物原位固化成形,可迅速完全填充骨缺损部位,实现移植材料与宿主骨缺损的完全匹配,有效引导或刺激骨组织的应力生长。此外,由于可注射骨组织工程支架材料在治疗骨缺损时并不会造成大的创口,避免了骨缺损部位周围软组织的再次损伤,手术时间短。但现有的可注射骨组织工程支架材料在固化后的力学强度普遍偏低,严重制约了其在骨缺损治疗中的应用。
技术实现要素:
有鉴于此,本发明的目的在于提供一种纤维增强的可注射原位固化和成孔的骨组织工程支架材料及其制备方法,本发明提供的可注射骨组织工程支架材料固化后具有较高的力学强度。
本发明提供了一种可注射骨组织工程支架材料,包括:聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂;
所述聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维总质量与有机溶剂体积的比为(5~10)g:(10~50)ml。
优选的,所述聚丙交酯-乙交酯的重均分子量为50000~500000。
优选的,所述聚丙交酯-乙交酯中丙交酯链段与乙交酯链段的摩尔比为(50~90):(50~10)。
优选的,所述羟基磷灰石为羟基磷灰石颗粒,所述羟基磷灰石颗粒的长为50~200nm;所述羟基磷灰石颗粒的宽为10~50nm。
优选的,所述聚乙交酯纤维的平均长度为10~1000μm;所述聚乙交酯纤维的平均直径为1~100μm。
优选的,所述有机溶剂包括n-甲基-2-吡咯烷酮、二甲基亚砜、四甘醇和乙酸乙酯中的一种或多种。
优选的,所述聚丙交酯-乙交酯和羟基磷灰石的质量比为1:(5~15);所述聚丙交酯-乙交酯和羟基磷灰石总质量与有机溶剂体积的比为1g:(1~10)ml;所述聚丙交酯-乙交酯和羟基磷灰石总量与聚乙交酯纤维的质量比(1~9):(9~1)。
本发明提供了一种上述技术方案所述可注射骨组织工程支架材料的制备方法,包括以下步骤:
a)、聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂进行混合,得到可注射骨组织工程支架材料。
优选的,所述步骤a)具体包括:
a1)、羟基磷灰石和有机溶剂进行混合后,再与聚丙交酯-乙交酯混合,得到混合液;
a2)、所述混合液与聚乙交酯纤维混合,得到可注射骨组织工程支架材料。
与现有技术相比,本发明提供了一种纤维增强的可注射原位固化和成孔的骨组织工程支架材料及其制备方法。本发明提供的可注射骨组织工程支架材料包括:聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂;所述聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维总质量与有机溶剂体积的比为(5~10)g:(10~50)ml。本发明以聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维作为可注射骨组织工程支架材料的溶质成分,显著提升了注射剂固化后的力学强度。实验结果表明,本发明提供的可注射骨组织工程支架材料固化成型后的抗压强度≥15mpa,弹性模量≥15mpa。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1是本发明实施例1提供的pga纤维线扫描电镜图;
图2是本发明实施例1提供的pga短纤维扫描电镜图;
图3是本发明实施例1提供的骨组织工程支架扫描电镜图;
图4是本发明实施例4提供的抗压强度柱状图;
图5是本发明实施例4提供的弹性模量柱状图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种可注射骨组织工程支架材料,包括:聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂;
所述聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维总质量与有机溶剂体积的比为(5~10)g:(10~50)ml。
本发明提供的可注射骨组织工程支架材料包括聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂。其中,所述聚丙交酯-乙交酯又称聚乳酸-羟基乙酸共聚物,英文简称为plga。本发明对所述聚丙交酯-乙交酯的重均分子量(mw)没有特别限定,可选择但不限于50000~500000,具体可选择为100000、150000、200000、250000、300000、350000、400000、450000或500000。本发明对所述聚丙交酯-乙交酯中丙交酯链段(英文缩写la)与乙交酯链段(英文缩写ga)的摩尔比没有特别限定,可选择但不限于(50~90):(50~10),具体可选择为(60~80):(40~20)或70:30。
在本发明中,所述羟基磷灰石简称ha,其为骨骼和牙齿的主要无机成分。在本发明提供的一个实施例中,所述羟基磷灰石为羟基磷灰石颗粒。本发明对所述羟基磷灰石颗粒的长度没有特别限定,可选择但不限于50~200nm,具体可选择60nm、70nm、80nm、90nm、100nm、110nm、120nm、130nm、140nm、150nm、160nm、170nm、180nm或190nm。本发明对所述羟基磷灰石颗粒的宽度没有特别限定,可选择但不限于10~50nm,具体可选择15nm、20nm、25nm、30nm、35nm、40nm或45nm。
在本发明中,所述聚乙交酯纤维简称pga纤维。本发明对所述聚乙交酯纤维的长度没有特别限定,所述聚乙交酯纤维的平均长度可选择但不限于10~1000μm、具体可选择50μm、60μm、70μm、80μm、90μm、95μm、100μm、105μm、110μm、115μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm、200μm、210μm、220μm、230μm、240μm、250μm、300μm、350μm、400μm、450μm、500μm、550μm、600μm、650μm、700μm、750μm、800μm、850μm、900μm或950μm。本发明对所述聚乙交酯纤维的宽度没有特别限定,所述聚乙交酯纤维的平均宽度可选择但不限于1~100μm、具体可选择1μm、2μm、3μm、4μm、5μm、5.5μm、6μm、6.5μm、7μm、7.5μm、8μm、8.5μm、9μm、9.5μm、10μm、10.5μm、11μm、11.5μm、12μm、12.5μm、13μm、13.5μm、14μm、14.5μm、15μm、15.5μm、16μm、16.5μm、17μm、17.5μm、18μm、18.5μm、19μm、19.5μm、20μm、21μm、22μm、23μm、24μm、25μm、26μm、27μm、28μm、29μm、30μm、35μm、40μm、45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm或95μm。在本发明提供的一个实施例中,所述聚乙交酯纤维长度的极小-极大值为9.64~694.42μm,四分位数(q1~q3)为46.18~131.85μm,中间值为76.36μm,平均值为103.16μm,标准差为92.41μm。在本发明提供的一个实施例中,所述聚乙交酯纤维直径的极小-极大值为0.07~191.11μm,四分位数(q1~q3)为6.13~12.56μm,中间值为9.48μm,平均值为12.69μm,标准差为18.85μm。本发明对所述聚乙交酯纤维的来源没有特别限定,优选采用以下方法制备得到:
i)、聚乙交酯原料进行熔融纺丝,得到聚乙交酯纤维线;
ii)、所述聚乙交酯纤维线进行机械断裂,得到聚乙交酯纤维。
在本发明提供的上述制备聚乙交酯纤维的方式中,所述聚乙交酯原料优选为聚乙交酯颗粒料。所述熔融纺丝在熔融纺丝机中进行,所述熔融纺丝机的纺丝盘转速优选为500~2000转/分,具体可选择1000转/分;所述熔融纺丝机的纺丝盘温度优选为200~300℃,具体可选择为250℃。在本发明中,所述聚乙交酯原料在进行熔融纺丝之前,优选在进行干燥处理,以去除聚乙交酯原料中所含的水分。所述干燥的温度有限为40~70℃,具体可选择50℃或60℃;所述干燥的时间优选为0.5~5h,具体可选择1h、2h或3h。
在本发明中,所述有机溶剂为可与水互溶的有机溶剂,包括但不限于n-甲基-2-吡咯烷酮、二甲基亚砜、四甘醇和乙酸乙酯中的一种或多种。
在本发明中,所述聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维总质量与有机溶剂体积的比为(5~10)g:(10~50)ml,优选为10g:(12~30)ml,具体可选择为10g:20ml或10g:28ml。在本发明提供的一个实施例中,所述聚丙交酯-乙交酯和羟基磷灰石的质量比为1:(5~15),具体可选为1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13或1:14。在本发明提供的一个实施例中,所述聚丙交酯-乙交酯和羟基磷灰石总质量与有机溶剂体积的比为1g:(1~10)ml,具体可选为1g:2ml、1g:3ml、1g:4ml、1g:5ml、1g:6ml、1g:7ml、1g:8ml或1g:9ml。在本发明提供的一个实施例中,所述聚丙交酯-乙交酯和羟基磷灰石总量与聚乙交酯纤维的质量比(1~9):(9~1),优选为(2~8):(8~2),更优选为(3~7):(7~3),具体可选择为4:6、5:5或6:4。
本发明以聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维作为可注射骨组织工程支架材料的溶质成分,显著提升了注射剂固化后的力学性能。实验结果表明,本发明提供的可注射骨组织工程支架材料固化成型后的抗压强度≥15mpa,弹性模量≥15mpa。
本发明提供了一种上述技术方案所述可注射骨组织工程支架材料的制备方法,包括以下步骤:
a)、聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂进行混合,得到可注射骨组织工程支架材料。
在本发明提供的制备方法中,直接将聚丙交酯-乙交酯、羟基磷灰石、聚乙交酯纤维和有机溶剂混合均匀,即可得到可注射骨组织工程支架材料。该过程具体包括:
a1)、羟基磷灰石和有机溶剂进行混合后,再与聚丙交酯-乙交酯混合,得到混合液;
a2)、所述混合液与聚乙交酯纤维混合,得到可注射骨组织工程支架材料。
在本发明提供的上述制备方法中,首先将羟基磷灰石和有机溶剂进行混合。其中,所述混合的方式优选为超声混合,所述超声的频率优选为20~60khz,具体可选择为40khz;所述混合的时间优选为10min~2h,具体可选择为20min、30min、40min、1h或1.5h。混合完毕后,得到悬浊液。
得到所述悬浊液后,将所述悬浊液和聚丙交酯-乙交酯混合。其中,所述悬浊液和聚丙交酯-乙交酯进行混合的方式优选为机械搅拌;所述混合温度优选为60~80℃,具体可为70℃。待聚丙交酯-乙交酯完全溶解到悬浊液中后,混合完毕,得到混合液。
得到混合液后,将所述混合液与聚乙交酯纤维混合。其中,所述聚乙交酯纤维的来源在上文中已经介绍,在此不再赘述。在本发明中,所述混合液与聚乙交酯纤维进行混合的方式优选为先进行机械搅拌,搅拌均匀后再进行乳化。在本发明中所述机械搅拌时混合体系的温度优选控制在60~80℃,具体可控制在70℃;所述乳化的时间优选为3~5min;所述乳化的乳化器转速优选为5000~10000rpm,具体可选择为8000rpm。混合液与聚乙交酯纤维混合均匀后,得到本发明提供的可注射骨组织工程支架材料。
本发明以聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维作为可注射骨组织工程支架材料的溶质成分,显著提升了制成的注射剂固化后的力学性能。实验结果表明,采用本发明提供的方法制成的可注射骨组织工程支架材料固化成型后的抗压强度≥15mpa,弹性模量≥15mpa。
本发明提供了一种骨组织工程支架,由上述技术方案所述的可注射骨组织工程支架材料固化后形成。
在本发明中,所述可注射骨组织工程支架材料注射到水中后,注射剂中的有机溶剂迅速被水置换,注射剂中的高分子聚合物在上述置换的过程中逐渐固化,待完全固化后,形成骨组织工程支架。
在本发明提供的一个实施例中,所述可注射骨组织工程支架材料注射到组织内后,注射剂中的有机溶剂迅速被组织内的水置换,注射剂中的高分子聚合物在上述置换的过程中逐渐固化,待完全固化后,形成骨组织工程支架。
本发明提供的骨组织工程支架包括聚丙交酯-乙交酯、羟基磷灰石和聚乙交酯纤维,具有优异的力学性能。实验结果表明,本发明提供的骨组织工程支架的抗压强度≥15mpa,弹性模量≥15mpa。
为更清楚起见,下面通过以下实施例进行详细说明。
实施例1
1)、配制plga/ha溶液:将1gha颗粒(长约100nm,宽约20nm)加入到40mlnmp溶剂中,充分搅匀后超声(超声频率:40khz)30min,向悬浊液中加入9gplga(la:ga=80:20(摩尔比),mw=200000),置于70℃水浴搅拌,至plga完全溶解。
2)、制备pga纤维:pga颗粒50℃烘干2h,然后将烘干的pga颗粒加入至熔融纺丝机的旋转金属盘中,并通过测温仪测量旋转金属盘的温度。当金属盘加热到250℃时,保持此温度5分钟获得熔融的液态pga。调节金属盘的转速为1000转/分,融化的pga材料因离心力的作用从旋转的金属盘边的孔隙中喷出,由于外界温度下降形成连续的pga纤维线,并被转速为100转/分的外围收集单元所接收。
3)、将pga纤维通过粉碎机机械断裂,获得粉碎的pga短纤维,将pga短纤维按照pga:(plga+ha)=3:7的质量比加入到plga/ha溶液中,70℃水浴搅拌均匀后,乳化器乳化3~5min(乳化器转速8000rpm),得到可注射骨组织工程支架材料。
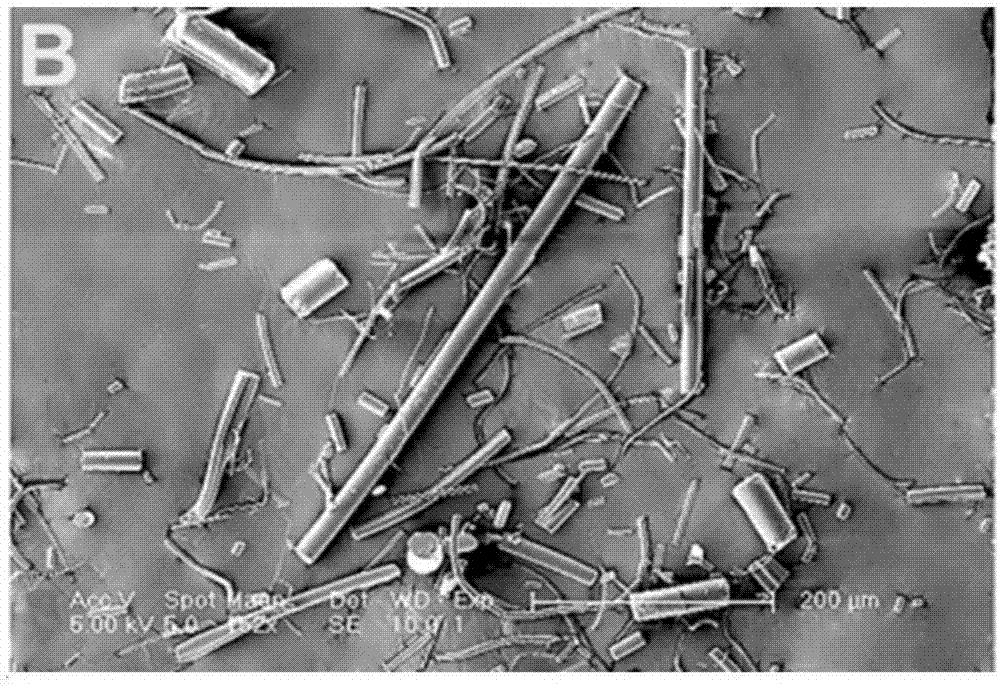
对步骤2)获得的pga纤维线进行扫描电镜观察,结果如图1所示。图1是本发明实施例1提供的pga纤维线扫描电镜图。
对步骤3)获得的pga短纤维进行扫描电镜观察,结果如图2所示。图2是本发明实施例1提供的pga短纤维扫描电镜图。
用imagej软件在扫描电镜图上测量500根pga短纤维,结果如表1所示:
表1pga短纤维尺寸分布表
通过表1可以看出,本实施例制取的pga短纤维的长度平均值为103.16μm,直径平均值为12.69μm。
将步骤3)获得的可注射骨组织工程支架材料注射到水中,固化成型,得到骨组织工程支架,对该骨组织工程支架进行扫描电镜观察,结果如图3所示。图3是本发明实施例1提供的骨组织工程支架扫描电镜图。
实施例2
1)、配制plga/ha溶液:将1gha颗粒(长约100nm,宽约20nm)加入到40mlnmp溶剂中,充分搅匀后超声(超声频率:40khz)30min,向悬浊液中加入9gplga(la:ga=80:20(摩尔比),mw=200000),置于70℃水浴搅拌,至plga完全溶解。
2)、制备pga纤维:pga颗粒50℃烘干2h,然后将烘干的pga颗粒加入至熔融纺丝机的旋转金属盘中,并通过测温仪测量旋转金属盘的温度。当金属盘加热到250℃时,保持此温度5分钟获得熔融的液态pga。调节金属盘的转速为1000转/分,融化的pga材料因离心力的作用从旋转的金属盘边的孔隙中喷出,由于外界温度下降形成连续的pga纤维线,并被转速为100转/分的外围收集单元所接收。
3)、将pga纤维通过粉碎机机械断裂,获得粉碎的pga短纤维,将pga短纤维按照pga:(plga+ha)=5:5的质量比加入到plga/ha溶液中,70℃水浴搅拌均匀后,乳化器乳化3~5min(乳化器转速8000rpm),得到可注射骨组织工程支架材料。
实施例3
1)、配制plga/ha溶液:将1gha颗粒(长约100nm,宽约20nm)加入到40mlnmp溶剂中,充分搅匀后超声(超声频率:40khz)30min,向悬浊液中加入9gplga(la:ga=80:20(摩尔比),mw=200000),置于70℃水浴搅拌,至plga完全溶解。
2)、制备pga纤维:pga颗粒50℃烘干2h,然后将烘干的pga颗粒加入至熔融纺丝机的旋转金属盘中,并通过测温仪测量旋转金属盘的温度。当金属盘加热到250℃时,保持此温度5分钟获得熔融的液态pga。调节金属盘的转速为1000转/分,融化的pga材料因离心力的作用从旋转的金属盘边的孔隙中喷出,由于外界温度下降形成连续的pga纤维线,并被转速为100转/分的外围收集单元所接收。
3)、将pga纤维通过粉碎机机械断裂,获得粉碎的pga短纤维,将pga短纤维按照pga:(plga+ha)=7:3的质量比加入到plga/ha溶液中,70℃水浴搅拌均匀后,乳化器乳化3~5min(乳化器转速8000rpm),得到可注射骨组织工程支架材料。
对比例
1)、配制plga/ha溶液:将1gha颗粒(长约100nm,宽约20nm)加入到40mlnmp溶剂中,充分搅匀后超声(超声频率:40khz)30min,向悬浊液中加入9gplga(la:ga=80:20(摩尔比),mw=200000),置于70℃水浴搅拌,至plga完全溶解,得到可注射骨组织工程支架材料。
实施例4
力学性能测试
将实施例1~3和对比例制得的可注射骨组织工程支架材料注射到水中,注射剂中的有机溶剂迅速被水置换,注射剂中的高分子聚合物在上述置换的过程中逐渐固化,待完全固化后,形成骨组织工程支架。其中,对比例形成的骨组织工程支架标号为1,实施例1~3形成的骨组织工程支架依次标号为2~4。
用电子式万能试验机(instron1121英国),在室温(20℃)及47%湿度的环境下,依据标准gb/t1041-1992,分别测试骨组织工程支架1、2、3和4的抗压强度和弹性模量,加载速度为2mm/min,结果图4和图5所示。图4是本发明实施例4提供的抗压强度柱状图,图5是本发明实施例4提供的弹性模量柱状图。图4中,4个柱条对应的具体数值分别为7.81±0.25,15.20±1.04,22.14±1.44,30.92±2.16mpa;图5中,4个柱条对应的具体数值分别为10.05±3.61,15.30±2.72,27.35±2.37,69.62±8.98mpa。通过图4和图5可以看出,本发明实施例提供的骨组织工程支架的力学性能优异,其抗压强度≥15mpa,弹性模量≥15mpa。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!