PGC‑1α在制备治疗血管性痴呆药物中的用途的制作方法
本发明涉及生物化学领域,具体是一种pgc-1α蛋白在制备治疗血管性痴呆药物中的用途。
背景技术:
血管性痴呆是由于缺血或出血性脑血管病及全脑缺血、缺氧引起的认知障碍,以记忆、认知功能缺损为主,可伴有语言、运动、视空间技能及人格障碍等。血管性痴呆已经成为我国人民精神和躯体残疾的主要因素之一。随着人口老龄化,其发病率日益增加。血管性痴呆严重影响老年人的社会适应能力、生活能力和身心健康,给社会和家人带来沉重的负担。
血管性痴呆由于其发病机制尚未明确,目前缺乏有效的治疗手段。目前研究表明血管性痴呆的发病机制与缺血缺氧诱导的线粒体功能障碍、氧化应激反应、神经炎症、胆碱能系统紊乱等有关。现有的治疗原则为治疗原发病等高危因素、改善认知的药物治疗、预防复发性卒中。《中国痴呆与认知障碍诊疗指南》中建议应用的药物为胆碱酯酶抑制剂多奈哌齐,可应用于轻中度血管性痴呆的治疗;兴奋性氨基酸受体拮抗剂美金刚,可能对轻中度血管性痴呆有效。目前研究表明该两种药物治疗血管性痴呆有一定效果,但疗效不显著,并没有确切针对血管性痴呆发病机制,当前临床对于血管性痴呆的诊疗尚未有可针对性药物。
鉴于血管性痴呆发病率越来越高,针对该疾病的有效治疗药物的研发非常重要。所以,在药物治疗方面找到一种全新作用途径的药物十分迫切。
技术实现要素:
本发明就是为了解决现有的治疗血管性痴呆的药物无确切的针对性,疗效不显著的问题,所提出的一种pgc-1α在制备治疗血管性痴呆药物中的用途。
本发明采用了如下的技术方案。
一种pgc-1α在制备治疗血管性痴呆药物中的应用。
所述pgc-1α同时参与线粒体功能障碍、氧化应激反应、胆碱能系统紊乱和神经炎症的血管痴呆发病机制。
所述pgc-1α的过表达能够同时诱发脑源性神经营养因子表达、增强胆碱能系统分子的表达、上调线粒体抗氧化物及解偶联蛋白的表达、减少ros的产生、抑制海马区神经炎症。
本发明获得了如下有益效果。
本发明有效的解决了现阶段血管性痴呆发病机制涉及环节繁多、具体分子机制不明、发病机制各环节之间关系不明等原因导致的治疗该病的药物无确切针对性的问题。本发明的pgc-1α(peroxisomeproliferator-activatedreceptor-γco-activator-1α,过氧化物酶体增殖物激活受体γ辅激活因子1α)通过诱发脑源性神经营养因子表达、增强胆碱能系统分子的表达、上调线粒体抗氧化物及解偶联蛋白的表达、减少ros的产生,同时抑制海马区神经炎症,进而对血管性痴呆起到治疗作用,其将研究机制中各种环节相互联系在一起,为研制具有针对性的治疗血管性痴呆药物提供了新的方向。
附图说明
图1是本发明慢性脑缺血小鼠与假手术组小鼠海马中pgc-1α、抗氧化剂mrna和解偶联蛋白表达量对比图;
图2是本发明神经元pgc-1α过表达对慢性脑灌注不足引起的认知功能障碍的影响图;
图3是本发明pgc-1α过表达对脑源性神经营养因子bdnf表达的影响图;
图4是本发明pgc-1α对慢性脑低灌注小鼠海马区胆碱能分子表达的影响图;
图5是本发明pgc-1α对慢性脑灌注不足诱导的胶质细胞活性的影响图;
图6是本发明pgc-1α对慢性脑灌注不足中的氧化应激反应的影响图。
具体实施方式
以下参照附图及实施例对本发明进行进一步的说明。
实施例1慢性脑缺血的小鼠学习记忆能力受损,其海马中pgc-1α表达减少,抗氧化剂mrna也减少
野生型c57bl/6j小鼠通过双侧颈总动脉狭窄手术(bcas)诱导形成慢性脑灌注不足,制作并证实血管性痴呆模型建立成功。
图1a为实验组和假手术组小鼠在水迷宫中进行学习,随着试验天数的增加手术组小鼠的平均逃逸时间较假手术组显著增加,表明实验组小鼠空间学习能力显著受损。图1b为手术组小鼠同假手术组小鼠相比,qrt-pcr分析显示海马区线粒体抗氧化剂mrna(sod2、prx3、trx2、gpx)表达水平显著下调。图1c为与假手术组相比,实验组小鼠海马中解偶联蛋白(ucp2、ucp4、ucp5)的表达显著下降。图1d/e为与假手术组相比,实验组小鼠海马区pgc-1αmrna蛋白的表达水平下降。图1f为典型的海马ca1区pgc-1α组织免疫荧光染色示:实验组和假手术组对比,pgc-1α表达水平下降。
结论:在认知功能障碍的小鼠的海马中,pgc-1α水平显著减少,这成为线粒体抗氧化酶和解偶联蛋白表达减少的基础。
实施例2神经元pgc-1α过表达可减轻慢性脑灌注不足引起的认知功能障碍
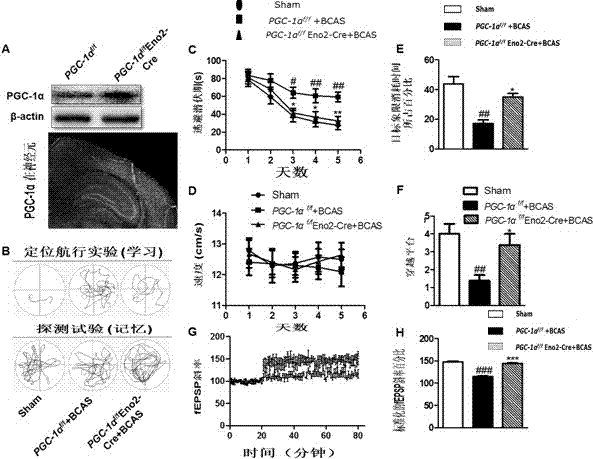
评估小鼠在水迷宫的表现,ltp试验测量海马突触可塑性。为了检测pgc-1α过表达的有效性,通过蛋白印迹实验量化pgc-1α蛋白的表达。另外,在荧光显微镜下观察脑组织冰冻切片,观察到ires-egfp神经元的表达,表明pgc-1α在神经元的存在(图2a)。测试pgc-1α过表达的小鼠在水迷宫实验中的表现来判断是否pgc-1α的特异性神经元过表达与空间学习记忆能力相关。假手术组、pgc-1αf/f+bcas组、pgc-1αf/feno2-cre+bcas小鼠的典型游泳路线展示在图2b。图2c显示,pgc-1αf/f+bcas组与pgc-1αf/feno2-cre+bcas组小鼠相比较,前者寻找隐藏逃生平台的平均逃避潜伏期更长。由此表明,在pgc-1αf/f+bcas组中,由于缺乏pgc-1α其学习和记忆能力显著恶化。pgc-1αf/f+bcas组小鼠与假手术组对比,其在第3天(p<0.05)、第4天(p<0.01)、第5天(p<0.01)表现出更长的延迟时间。而与pgc-1αf/feno2-cre+bcas对比,其小鼠在第3天(p<0.05)、第4天(p<0.05)、第5天(p<0.01)也表现出更长的延迟时间。在假手术组和pgc-1αf/feno2-cre+bcas相对比,两组小鼠的表现没有显著的差异性。三组小鼠展现出相似的游泳速度(图2d),这表明pgc-1α缺乏并不能引起运动的损伤。在空间探测试验中,pgc-1αf/f+bcas同假手术组小鼠相比较,其在目标象限停留的时间更少,几乎没有跨越平台(p<0.01)。在pgc-1αf/feno2-cre+bcas组中上述参数却大大提高(p<0.05)(图2e、f)。
图2a上图是应用蛋白印迹实验分析了pgc-1αf/f+bcas组及pgc-1αf/feno2-cre+bcas组小鼠海马中pgc-1α超表达。图2a下图是pgc-1αf/feno2-cre+bcas小鼠具有代表性的大脑冠状位的显微荧光成像。ires-egfp神经元的表达很明显(放大10倍)。图2b上图是三组小鼠在水迷宫学习期间典型的游泳路线图。图2b下图是小鼠在水迷宫记忆测试中典型的游泳路线图。图2c中pgc-1αf/f+bcas组与假手术组和pgc-1αf/feno2-cre+bcas相比,其逃生潜伏期显著增长。图2d是在空间训练中,三组的平均游泳速度相似,显示游泳速度可能不会导致逃生潜伏期的差异。图2e是三组小鼠在目标象限培训花费的时间百分比。图2f是在空间探测试验中,三组小鼠穿越平台的次数。图2g是三组小鼠电刺激诱导ltp(数据用方差呈现),在pgc-1αf/f+bcas组小鼠中,表现出极少的ltp,而在其他两组小鼠中,表现出持续的ltp。图2h是对图2g的统计说明。
结论:这些结果表明神经元pgc-1α过表达缓和了由慢性脑灌注不足引起的认知功能障碍。
实施例3pgc-1α防止慢性脑低灌注中神经损伤
免疫组织化学和蛋白印迹分析显示:pgc-1αf/f+bcas组与假手术组小鼠相比,pgc-1αf/f+bcas组小鼠海马中脑源性神经营养因子bdnf的表达显著减少(p<0.05)。相比之下,pgc-1αf/feno2-cre+bcas组小鼠与pgc-1αf/f+bcas组小鼠相对比,脑源性神经营养因子的表达显著增强(p<0.05)(图3a-c,图3a、b是脑组织切片免疫组化染色bdnf图(放大200倍);图3c是蛋白印迹法检测脑源性神经营养因子)。实验结果表明:pgc-1α过表达提高脑源性神经营养因子bdnf的表达。海马神经元的数量似乎也受pgc-1α过表达的影响。同假手术组相比,pgc-1αf/f+bcas组小鼠海马中ca1区域神经元数量明显减少(p<0.01)(图3d、e,图3d、e是定量海马区抗neun的免疫组化染色(放大200倍))。然而,pgc-1αf/feno2-cre+bcas组小鼠中海马区神经元数量增加,尽管与其他两组相比没有显著差异性(p>0.05)。
结论:pgc-1α表现出的神经保护作用归因于脑源性神经营养因子bdnf表达的修复。
实施例4pgc-1α改善慢性脑低灌注小鼠中海马区胆碱能紊乱
在血管性痴呆小鼠模型的海马区,量化胆碱能组分的水平,这些胆碱能系统分子包括:cha,vacht,cht1和ache。chat直接合成乙酰胆碱的酶,pgc-1αf/f+bcas组小鼠与假手术组小鼠相比较,在小鼠海马ca1区chat的表达显著降低(p<0.05)。相比之下,pgc-1αf/feno2-cre+bcas组小鼠与pgc-1αf/f+bcas组小鼠相比,改善了胆碱能系统紊乱(p<0.05)(图4a、b)。可在vacht和cht1的免疫荧光染色中看到相似的结果。囊泡型乙酰胆碱转运体vacht负责乙酰胆碱ach的储存和转运,高亲和力胆碱转运体cht1是乙酰胆碱合成中的限速酶。然而,乙酰胆碱酯酶ache是乙酰胆碱的降解酶,其表达在三组试验中没有显著性差异(p>0.05)(图4a-c,图4a、b是蛋白印迹描述pgc-1αf/f+bcas组小鼠海马中chat,vacht,和cht1的表达量图。图4c是胆碱能系统chat,vacht,cht1,和ache分子免疫荧光染色图(放大200倍),数据以平均数±sem方式呈现)。
结论:pgc-1α过表达通过改善胆碱能系统对慢性脑灌注不足引起的认知功能障碍起保护性作用。
实施例5pgc-1α减低慢性脑灌注不足中诱导的胶质细胞的活性
pgc-1αf/f+bcas组与假手术对照组的小鼠相比较,小胶质细胞和星型胶质细胞的数量在小鼠的海马区是增加的(p<0.05)。同时,pgc-1α过表达降低了小胶质细胞和星型胶质细胞的数量(p<0.05)(图5a-d,图5a、b是三组小鼠慢性脑缺血后海马ca1区iba-1阳性的小胶质细胞免疫荧光染色图,并量化了小胶质细胞中iba-1染色的数量(放大200倍);图5c、d是星形胶质细胞活化的补充实验,通过gfap免疫组化和定量证明(放大200倍))。
结论:pgc-1α抑制血管性痴呆中神经炎症。
实施例6pgc-1α上调线粒体抗氧化物及解偶联蛋白的表达,减少脑灌注不足中的氧化应激反应
pgc-1α在神经元的过表达影响了线粒体抗氧化剂和解偶联蛋白的基因表达,减少慢性脑灌注不足中的氧化应激反应。图6a是由qrt-pcr检测线粒体抗氧化剂的表达水平,包括sod2,prx3,trx2andgpx,mrna的表达。图6b是评估三组模型中小鼠海马区解偶联蛋白的表达,包括解偶联蛋白2、解偶联蛋白4、解偶联蛋白5。图6c是三组小鼠海马区活性氧ros(reactiveoxygenspecies)水平的dhe染色片子。实验表明pgc-1α减少ros的产生(放大200倍)。图6d是量化dhe的荧光强度(用柱形图表示)。
结论:pgc-1α在小鼠慢性脑灌注不足中,调节ros的产生。
- 还没有人留言评论。精彩留言会获得点赞!