米托蒽醌的抗肿瘤淋巴转移作用及其药物制剂的制作方法
本发明涉及医药技术领域,尤其涉及米托蒽醌的抗肿瘤淋巴转移作用及其药物制剂。
背景技术:
肿瘤转移是某些实体肿瘤患者死亡的关键因素,乳腺癌发生转移的机率更高。通常转移的初始部位是瘤周淋巴结。对于绝大多数的肿瘤来说,淋巴系统是肿瘤转移的主要和唯一途径。淋巴结可以将所有脱落的肿瘤细胞集中到边缘窦的网状纤维中并随后在原位增殖。越来越多的临床和实验数据表明肿瘤的转移比肉瘤更常见。癌细胞扩散的第一个指标是淋巴结中肿瘤细胞的存在。因此,防止肿瘤细胞的淋巴转移是非常重要的。当前临床上用于治疗肿瘤淋巴转移的方法为使用传统小分子药物进行全身化疗。这些小分子药物淋巴亲和性差,全身给药后引发强烈的毒副作用,治疗效果不尽人意。临床上将肿瘤前哨淋巴结切除是另外一种常规的治疗方法,但是随着肿瘤淋巴管生成和癌症免疫理论的出现,这种前哨淋巴结切除术的有效性又遭到了质疑。截至目前,对于肿瘤淋巴转移,我们尚未开发出满意的治疗方法。
新辅助化疗,又称术前化疗、诱导化疗、初始化疗等,是指在手术前给予全身的化疗药物治疗。新辅助化疗能够缩小肿瘤便于手术,提高不可手术局部晚期肿瘤的切除率。新辅助化疗并不是一种新的治疗方法,而是指在全身治疗的时间点上与辅助化疗不同。
米托蒽醌是一种成功的抗肿瘤药,能够抑制肿瘤拓扑异构酶的活性,目前多用于全身给药。和许多其他抗肿瘤药物一样,米托蒽醌用于全身给药会产生严重的毒副作用。
技术实现要素:
本发明的目的在于提供米托蒽醌的抗肿瘤淋巴转移作用。
本发明是通过如下技术方案实现的:
其中,本发明所述的米托蒽醌采用局部给药,如肿瘤瘤内给药、肿瘤瘤周皮下给药。
进一步地,本发明中的米托蒽醌可以与药学上可接受的载体制备成临床上可接受的药物制剂。
所述的药物制剂为非肠道给药制剂。
所述的非肠道给药制剂选自溶液剂、脂质体、树状大分子、纳米粒、纳米晶、微晶、微球、凝胶剂。
其中,所述的凝胶剂选自包载脂质体的凝胶剂、包载纳米粒的凝胶剂、包载树状大分子的凝胶剂、包载纳米晶的凝胶剂、包载微晶的凝胶剂以及包载微球的凝胶剂中的一种。
本发明提供的药物制剂含有99%-1%的米托蒽醌和1%-99%的药用赋形剂,优选含有40%-60%的米托蒽醌和60%-40%的药用赋形剂,最好含有10%-20%的米托蒽醌和90%-80%的药用赋形剂。
本发明中的抗肿瘤淋巴转移药物中的辅料为常规的赋形剂,如溶剂、磷脂、胆固醇、树状大分子、人血白蛋白、泊洛沙姆、壳聚糖等。
进一步,本发明所述的米托蒽醌与药学上可接受的赋形剂制成微晶凝胶剂。
所述的微晶凝胶包含如下重量组成的成分:米托蒽醌0.1mg-1000mg、米托蒽醌盐酸盐0.1mg-1000mg、泊洛沙姆4071.5g-25g、泊洛沙姆1880.1g-8g,蒸馏水10ml-100ml。其中不同米托蒽醌及赋形剂比例将产生不同的制剂特性,其制剂特性主要表现为凝胶胶凝特性,可以根据实际情况进行选择适合的处方。
本发明将米托蒽醌用于局部化疗能够提高其抗肿瘤活性,降低毒副作用,靶向淋巴系统,抑制肿瘤淋巴转移。将米托蒽醌用于新辅助化疗不仅能够缩小肿瘤体积便于后续手术切除,还能杀死淋巴管中已经转移的肿瘤细胞,降低术后肿瘤复发的风险、提高患者的生活质量。
附图说明
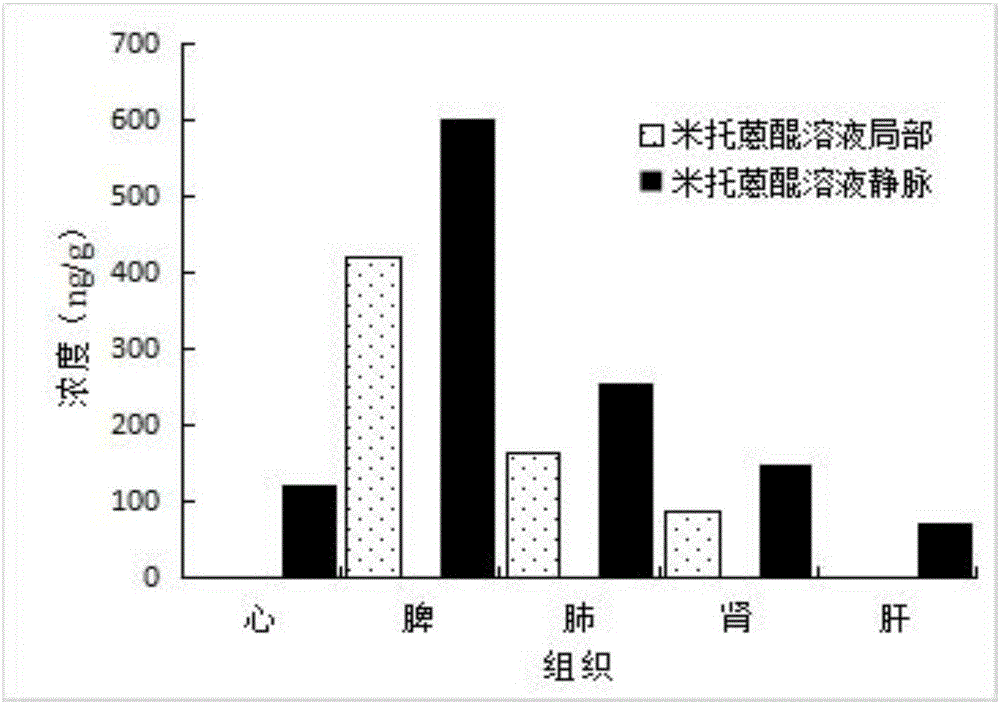
图1为本发明实施例1的荷瘤鼠静脉或局部给药后药物组织分布情况。
图2为本发明实施例1的荷瘤鼠给药后腘淋巴结相对重量变化情况。
图3为本发明实施例1的荷瘤鼠给药后腰椎淋巴结相对重量变化情况。
图4为本发明实施例1的荷瘤鼠肿瘤局部或静脉给药后淋巴结中药物浓度。
图5为本发明实施例1的荷瘤鼠肿瘤术前局化疗或术后全身化疗后淋巴结中药物浓度。
图6为本发明实施例1的荷瘤鼠肿瘤术前局化疗或术后全身化疗后小鼠饮水量、摄食量及体重的变化情况。
具体实施方式
为使本发明的目的、技术方案及效果更加清楚、明确,以下参照附图并举实施例对本发明进一步详细说明。应当理解,此处描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例1、溶液剂的制备
本实施例提供一种米托蒽醌溶液剂,每100ml的药物各原料配比如下:米托蒽醌0.5%、醋酸钠0.01%、焦亚硫酸钠0.02%、醋酸0.092%、氯化钠0.8%。制备过程如下:将0.01%醋酸钠、0.02%焦亚硫酸钠、0.092%醋酸、0.8%氯化钠溶解于100ml纯净水中,得到注射用溶液。向注射用溶液中加入0.5%米托蒽醌,室温下50rpm磁力搅拌,搅拌25min,随后加入药用炭,于50℃、50rpm磁力搅拌20min,得到米托蒽醌溶液剂。将米托蒽醌溶液剂用0.22μm微孔滤膜过滤,121℃灭菌15min,得到灭菌后的米托蒽醌溶液剂。
在本实施例1中,为了进一步验证本发明的有益效果,提供以下试验例。
1、米托蒽醌溶液剂肿瘤局部给药的淋巴结药动学及组织分布考察。
肿瘤淋巴转移型动物模型的建立:雄性昆明小鼠(18-22g)左脚皮下荷瘤(s180腹水瘤悬液)。7天后,取出荷瘤鼠的腘淋巴结(popliteallymphnode,pln)、腰椎淋巴结(lumbaraorticlymphnode,iln)和肾淋巴结(renallymphnode,rln)并迅速浸泡到10%福尔马林中,包埋进石蜡块中,切成5mm厚的切片,he染色进行病理学分析,观察肿瘤淋巴转移模型是否构建成功。
米托蒽醌溶液剂的体内淋巴靶向能力:向上述所述的荷瘤鼠肿瘤局部注射米托蒽醌溶液剂,给药剂量为5mg/kg。对照组小鼠尾静脉注射相同剂量的米托蒽醌溶液剂。给药后于特定的时间点手术摘除腘淋巴结、腰椎淋巴结和肾淋巴结、心、肝、脾、肺、肾等组织。生物样品经处理后,采用高效液相法分析组织样品中药物的含量。
测定结果为:由病理学切片结果可知,本试验例1成功构建了肿瘤淋巴转移模型。将本实施例制得的米托蒽醌溶液瘤内给药后淋巴结药动学结果见表1。
表1
由表1可知,米托蒽醌溶液经瘤内给药后,能够在腘淋巴结、腰椎淋巴结和肾淋巴结中检测到药物,也就是说米托蒽醌溶液经瘤内给药后可以靶向淋巴结。
米托蒽醌溶液经静脉或瘤内注射后,药物在心、肝、脾、肺、肾中蓄积的浓度见图1。由结果可知,经局部给药后米托蒽醌在心和肝中的药物浓度低于检测限,在脾、肺及肾中的药物浓度也低于经静脉米托蒽醌组。与传统静脉全身给药相比,米托蒽醌局部给药后能够减少药物在正常组织中的蓄积、降低药物的全身毒性。
2、米托蒽醌溶液剂应用在新辅助化疗中的有效性考察。
肿瘤淋巴转移型动物模型的建立:雄性昆明小鼠(18-22g)左脚皮下荷瘤(s180腹水瘤悬液)。7天后,取出荷瘤鼠的腘淋巴结(popliteallymphnode,pln)、腰椎淋巴结(lumbaraorticlymphnode,iln)和肾淋巴结(renallymphnode,rln)并迅速浸泡到10%福尔马林中,包埋进石蜡块中,切成5mm厚的切片,he染色进行病理学分析,观察肿瘤淋巴转移模型是否构建成功。
动物给药方案:将上述成功建立的肿瘤淋巴转移小鼠模型分为6组,每组24只。(1)c-sc组:荷瘤鼠小脚肿瘤局部注射米托蒽醌溶液,给药剂量为5mg/kg,每七天给一次药。(2)c-iv组:荷瘤鼠小脚肿瘤静脉注射米托蒽醌溶液,给药剂量为5mg/kg,每七天给一次药。(3)s组:手术切除腘淋巴结,不给药。(4)s+c组:术后全身化疗,即手术摘除腘淋巴结后将米托蒽醌静脉给药,给药剂量为5mg/kg,每七天给一次药。(5)c+s组:术前局部化疗,即先将米托蒽醌溶液进行小脚肿瘤局部给药,给药剂量为5mg/kg,每七天给一次药,给药两次后于第14天摘除淋巴结,不再给药。(6)control组:对照组,小脚肿瘤局部注射等剂量的生理盐水。记录所有小鼠的饮水量、摄食量及体重情况。所有组别于给药后第7、14、21、28天随机选出8只小鼠处死,取出c-sc组、c-iv组及control组取出腘淋巴结和腰椎淋巴结其余组别只取出腰椎淋巴结。将各时间点淋巴结称重,计算相对淋巴结重量wr(wr=wi/wc,wi为肿瘤同侧淋巴结重量,wc为肿瘤对侧淋巴结重量),然后对淋巴结进行处理,高效液相法测定其中的药物浓度。
由图2可知,c-sc组的腘淋巴结相对重量明显低于c-iv组以及control组,结果表明米托蒽醌溶液肿瘤局部给药后的治疗效果明显优于全身给药。
由图3可知,腰椎淋巴结相对重量高低顺序为:control组>s组>s+c组>c-iv组>c-sc组>c+s组,在不同的给药方式及不同的手术摘除时间中,术前局部化疗明显优于术后全身化疗,能够明显抑制肿瘤转移。
由图4可知,米托蒽醌溶液经肿瘤局部给药后在腘淋巴结和腰椎淋巴结中的浓度均高于静脉给药组。结果表明米托蒽醌溶液肿瘤局部给药后具有一定的淋巴靶向性。
由图5可知,术前应用米托蒽醌溶液进行肿瘤局部化疗后其腰椎淋巴结浓度明显高于术后全身化疗。结果表明米托蒽醌溶液应用术前局部化疗具有很好的效果。
由图6可知,c+s组小鼠的饮水量、摄食量并未同control组及s组一样减小,而且该组的小鼠体重并未下降。综合来说,接受米托蒽醌溶液局部给药后的小鼠并没有产生严重的不良反应。米托蒽醌溶液局部给药后其毒性小,是一种安全的药物。
在本实施例中,我们通过两个试验例证明了米托蒽醌溶液剂肿瘤局部给药后能够靶向至淋巴系统,术前局部化疗的治疗效果优于术后全身化疗的治疗效果,还能够降低米托蒽醌全身给药的系统毒性,受试动物没有产生严重的不良反应,因此米托蒽醌局部给药后表现出增效降毒的优势。近年来,人们对新辅助化疗的研究越来越多,加快了人们对新辅助化疗所能应用的药物进行研究。本发明提供的实施例能够应用至新辅助化疗并达到有益效果,而且也扩大了米托蒽醌类的药物的临床应用范围,具有很高的实用价值,将为癌症患者带来福音。
实施例2、微晶凝胶的制备
本实施例提供一种米托蒽醌微晶凝胶,每10g的药物各原料配比如下:米托蒽醌10mg、米托蒽醌盐酸盐5mg、泊洛沙姆4072g、泊洛沙姆1880.5g、7.49ml蒸馏水。制备过程如下:精密称取研磨过筛后(200目)的米托蒽醌10mg、米托蒽醌盐酸盐5mg,加入泊洛沙姆4072g、泊洛沙姆1880.5g、蒸馏水7.49ml,冰水浴下30rpm磁力搅拌6h至颗粒全部溶解,4℃下放置24h,即得米托蒽醌微晶凝胶。
为验证本实施例2的微晶凝胶经局部给药后能够降低米托蒽醌全身给药的药物毒性,本实施例考察了瘤内注射微晶凝胶后的小鼠组织分布情况。同实施例1项下的试验例1试验方法相似,选取静脉注射米托蒽醌溶液作为对照组,瘤内注射米托蒽醌微晶凝胶作为实验组。实验结果显示实验组各组织的药物蓄积浓度均低于对照组,结果表明米托蒽醌微晶凝胶经肿瘤局部给药后可以降低药物毒性。
实施例3、脂质体的制备
本实施例提供一种米托蒽醌脂质体,每10ml的药物各原料配比如下:米托蒽醌10mg、大豆磷脂0.4g、胆固醇0.04g、葡萄糖1.5g。制备过程如下:将10mg米托蒽醌、0.4g大豆磷脂、0.04g胆固醇溶液适量的无水乙醇,得到澄清的溶液。向澄清溶液中加入1.5g葡萄糖粉末,摇匀,超声至乳白色混悬液。将乳白色混悬液于50℃旋转蒸发除去乙醇,得到脂质体薄膜。向脂质体薄膜中加入10ml蒸馏水于50℃下水化,至固体全部溶解,探头超声10min,过0.45μm滤膜即得米托蒽醌脂质体。
为验证本实施例3的脂质体经局部给药后能够降低米托蒽醌全身给药的药物毒性,本实施例考察了瘤内注射脂质体后的小鼠组织分布情况。与实施例1项下的试验例1试验方法相似,选取静脉注射米托蒽醌溶液作为对照组,瘤内注射米托蒽醌脂质体作为实验组。实验结果表明实验组蓄积在各健康组织(心、肝、脾、肺、肾)中的药物浓度均低于对照组,结果表明米托蒽醌脂质体经肿瘤局部给药后可以降低药物毒性。
实施例4、微球制备
本实施例提供一种米托蒽醌微球,每110mg的药物各原料配比如下:米托蒽醌10mg、plga100mg。制备过程如下:精密称取plga100mg,溶于2ml二氯甲烷中,加入10mg米托蒽醌,超声溶解,得到有机相。水相为5%pva的水溶液,水相保持于冰水浴中。在800rpm下,将有机相缓慢注入水相得到混合液,继续搅拌混合液至有机相完全挥发,将混合液过0.45μm滤膜,收集微球,将收集到的微球用200ml蒸馏水洗涤,至干燥器中干燥48h,即得米托蒽醌微球。
为验证本实施例4的微球经局部给药后能够降低米托蒽醌全身给药的药物毒性,本实施例考察了瘤内注射微球后的小鼠组织分布情况。与实施例1项下的试验例1试验方法相似,选取静脉注射米托蒽醌溶液作为对照组,瘤内注射米托蒽醌微球作为实验组。实验结果表明实验组各组织的药物蓄积浓度均低于对照组,结果表明米托蒽醌微球经肿瘤局部给药后能够降低药物毒性、提高米托蒽醌用药的安全性。
可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及其发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!