天然小分子化合物在抑制泛素链合成反应中的应用的制作方法
本发明涉及生物技术和医学领域,尤其涉及天然小分子化合物在抑制泛素 链合成反应中的应用。
背景技术:
泛素化是由泛素蛋白本身作为信号分子,经由泛素激活酶(Ubiquitin-
activating Enzyme)E1、泛素结合酶(Ubiquitin-conjugating Enzyme)E2和泛素连接 酶(Ubiquitin Ligase)E3的级联反应共价修饰到底物蛋白质的赖氨酸残基上,由 此实现蛋白质的泛素化修饰。
单个泛素分子修饰底物蛋白上的单个赖氨酸残基,可形成单泛素化修饰。 多个泛素分子修饰底物蛋白上的多个赖氨酸残基,可形成多泛素化修饰。泛素 蛋白体身有K48、K63、K11、K6、K29、K27、K33共7个赖氨酸残基,已经 共价修饰到底物蛋白上的泛素分子的这些赖氨酸残基还可继续发生泛素化修 饰,形成泛素链。此外,泛素分子N端的自由氨基可与另一泛素分子的C端羧 基通过泛素化反应连接,形成线性泛素链。
因此,细胞中可存在单泛素化、多泛素化以及8类不同形式的同质泛素链 修饰。如果一个泛素链上结合泛素本身不同的赖氨酸残基,形成混合或分支泛 素链,则进一步增加泛素链的复杂性。
大多数情况下,合成K63连接的多聚泛素链需要另一个蛋白亚基Uev与泛 素结合酶Ubc13形成异源二聚体。E1催化转硫酯反应将供体泛素共价连接到 Ubc13活性位点的半胱氨酸巯基上,此后第二个泛素单体非共价结合到Uev上, 其第63位的赖氨酸(K63)侧链靠近供体泛素与Ubc13之间形成的硫酯键。K63 因此能够攻击硫酯键使供体泛素从Ubc13的活性位点上转移到受体泛素的第63 位赖氨酸侧链上,形成异肽键连接两个泛素分子,经过多个循环可形成K63连 接的泛素链。K63泛素链在哺乳动物细胞中主要参与调节DNA损伤修复、线粒 体遗传、核糖体和NF-κB信号通路的调控等非蛋白水解信号途径,并与遗传性 帕金森病相关。K63泛素链的调控异常可引起多种疾病的发生。
近年来,泛素化修饰在生命活动中的重要性得到了越来越多的关注和证明。 但随着研究的深入,更多的泛素生物学问题逐渐显现,有待多学科的科学家去 探索。未来有望鉴定所有的泛素修饰酶,揭示泛素化参与的分子信号及其生物 学功能,建立泛素化与其他翻译后修饰的串联相互作用网络,从而发现与某些 疾病相关的关键蛋白的泛素化靶点,开发单靶点或多靶点药物,为人类战胜现 今无法治疗的疾病作出贡献。
目前,只有蛋白酶体抑制剂PS34(Valcade)和E3泛素连接酶CRL4CRBN 的抑制剂lenalidomide或thalidomide进入临床应用,但是这些药物影响的细胞 信号通路较多,特异性并不理想,细胞毒性较大。
因而,开发针对泛素化系统的高效临床药物是当前的难点。
技术实现要素:
本发明提供了一种天然小分子化合物在抑制泛素链合成反应中的应用,该 天然小分子化合物能够抑制泛素链合成反应,且该天然小分子化合物具有IC50 值低,效能高,特异性好的特点。
本发明提供了一种天然小分子化合物在抑制泛素链合成反应中的应用,所 述天然小分子化合物的结构式如下所示:
其中,R1为H或OH;R2为H或OH;R3为H或OH;R4为H或OH;R5为H或OH;
或者,
其中,R6为H或OH;R7为H或OH;R8为H或OH;R9为H或OH;R10为H或OH;
或者,
其中,R11为H或OH;R12为H或OH;
或者,
作为优选,所述天然小分子化合物为槲皮素、木犀草素、杨梅素、漆黄素、 桑色素、山奈酚、芹菜素、紫铆花素、金鸡菊查耳酮、花青素或表没食子儿茶 素没食子酸酯。
其中,槲皮素、木犀草素、杨梅素、漆黄素、桑色素、山奈酚和芹菜素的 结构式属于式(I);紫铆花素和金鸡菊查耳酮的结构式属于式(II);花青素的 结构式属于式(III);表没食子儿茶素没食子酸酯的结构式为式(IV)。 具体的,槲皮素的结构式为:木犀草素的结构式为:
杨梅素的结构式为:
漆黄素的结构式为:
桑色素的结构式为:
山奈酚的结构式为:
芹菜素的结构式为:
紫铆花素的结构式为:
金鸡菊查耳酮的结构式为:
花青素的结构式为:
表没食子儿茶素没食子酸酯的结构式为:
经试验发现,上述天然小分子化合物通过抑制泛素结合酶Ubc13的活性来 实现对泛素结合酶Ubc13介导的K63泛素链合成反应的抑制。
故,进一步地,所述泛素链合成反应为泛素结合酶Ubc13介导的K63泛素 链合成反应。
进一步地,泛素链合成反应体系中,所述泛素结合酶Ubc13的浓度为 0.1~1μM;所述天然小分子化合物的浓度为0.1~100μM。
具体的,属于式(I~III)的天然小分子化合物的浓度为1~100μM;而属于 式(IV)的天然小分子化合物的浓度为0.1~3μM。
进一步地,所述天然小分子化合物通过抑制泛素结合酶Ubc13介导的氨解 反应来抑制K63泛素链合成反应。
本发明通过体外分步解析泛素化反应以及胞内泛素化反应实验,证明天然 小分子化合物能够抑制泛素结合酶Ubc13的活性进而抑制结合酶Ubc13介导的 泛素氨解反应。
本发明还提供了一种天然小分子化合物在抑制泛素结合酶Ubc13活性中的 应用,所述天然小分子化合物的结构式如下所示:
其中,R1为H或OH;R2为H或OH;R3为H或OH;R4为H或OH;R5为H或OH;
或者,
其中,R6为H或OH;R7为H或OH;R8为H或OH;R9为H或OH;R10为H或OH;
或者,
其中,R11为H或OH;R12为H或OH;
或者,
进一步地,所述天然小分子化合物为槲皮素、木犀草素、杨梅素、漆黄素、 桑色素、山奈酚、芹菜素、紫铆花素、金鸡菊查耳酮、花青素或表没食子儿茶 素没食子酸酯。该天然小分子化合物的结构式在上述内容中已呈现。
与现有技术相比,本发明具有以下有益效果:
本发明首次发现特定结构的天然小分子化合物能够抑制泛素链合成反应, 该天然小分子化合物具有IC50值低,效能高,特异性好的特点;此外,本发明 还通过体外分步解析泛素化反应以及胞内泛素化反应实验证明天然小分子化合 物能够通过抑制泛素结合酶Ubc13的活性进而抑制结合酶Ubc13介导的泛素氨 解反应。
附图说明
图1为实施例2中泛素链合成反应检测泛素蛋白的电泳图。
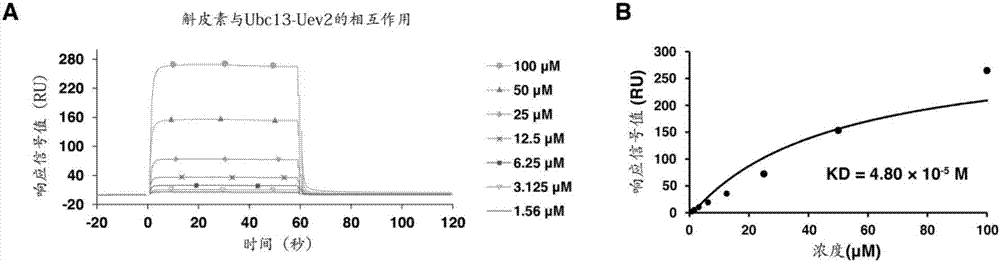
图2为实施例2中表面等离子体共振(SPR)检测槲皮素与泛素结合酶相互 作用的结果图;
其中,A为SPR仪器测定的相互作用曲线;B为采用单点读数进行非线性 拟合的曲线及相应得到的结合解离平衡常数KD。
图3为实施例2中表面等离子体共振(SPR)检测木犀草素与泛素结合酶相 互作用的结果图;
其中,A为SPR仪器测定的相互作用曲线;B为采用单点读数进行非线性 拟合的曲线及相应得到的结合解离平衡常数KD。
图4为实施例2中表面等离子体共振(SPR)检测桑色素与泛素结合酶相互 作用的结果图。
图5为实施例2中表面等离子体共振(SPR)检测表没食子儿茶素没食子酸 酯与泛素结合酶相互作用的结果图。
图6为实施例2中结合体外泛素化反应测定斛皮素的半抑制浓度(IC50) 的结果图;
其中,A为用Western Blot检测泛素化反应产物的结果;B为对Western Blot 结果图进行定量分析后,拟合计算得到的曲线及相应的IC50值。
图7为实施例2中结合体外泛素化反应测定木犀草素的半抑制浓度(IC50) 的结果图;
其中,A为用Western Blot检测泛素化反应产物的结果;B为对Western Blot 结果图进行定量分析后,拟合计算得到的曲线及相应的IC50值。
图8为实施例2中结合体外泛素化反应测定表没食子儿茶素没食子酸酯的 半抑制浓度(IC50)的结果图;
其中,A为用Western Blot检测泛素化反应产物的结果;B为对Western Blot 结果图进行定量分析后,拟合计算得到的曲线及相应的IC50值。
图9为实施例3中添加斛皮素后氨解反应产物经Western Blot检测的结果 图;
其中,A为仅由Ubc13催化的氨解反应产物经Western Blot检测的结果;B 为E3泛素连接酶TRAF6存在的条件下,由Ubc13催化的氨解反应产物经 Western Blot检测的结果。
图10为实施例3中添加木犀草素后氨解反应产物经Western Blot检测的结 果图;
其中,A为仅由Ubc13催化的氨解反应产物经Western Blot检测的结果;B 为E3泛素连接酶TRAF6存在的条件下,由Ubc13催化的氨解反应产物经 Western Blot检测的结果。
图11为实施例3中E3泛素连接酶TRAF6存在的条件下,添加表没食子儿 茶素没食子酸酯后由Ubc13催化的氨解反应产物经Western Blot检测的结果。
图12为实施例3中经斛皮素处理后利用非还原SDS-PAGE进行Western Blot 检测的结果图。
图13为实施例3中经表没食子儿茶素没食子酸酯处理后利用非还原 SDS-PAGE进行Western Blot检测的结果图。
具体实施方式
实施例1泛素链合成反应中各原料的制备
1、泛素(Ub)的纯化
无标签的泛素cDNA构建在原核表达载体pET14b上。在转化大肠杆菌
(BL21(DE3)/pJY2菌株)后,在37℃用0.5mM IPTG诱导表达4小时。将1L 大肠杆菌收集离心弃上清后,用20ml缓冲液(50mM Tris-Cl pH7.6,1mM PMSF, 0.02%(v/v)NP-40,0.4mg/ml溶菌酶)重悬,并进行超声裂解。20000g离心20分 钟后,将上清转移至干净容器中,在4℃搅拌的情况缓慢滴入70%的高氯酸,此 时大部分杂蛋白会变性沉淀,待pH达到4.0左右并继续搅拌。30分钟后,20000g 离心20分钟,取上清。在100倍体积的pH4.5醋酸铵缓冲液中透析两次。然后, 用pH4.5的醋酸铵缓冲液将阳离子交换柱平衡好后,使透析后的蛋白上清流过 并结合到柱子上,随后用含0-500mM NaCl的pH4.5醋酸铵缓冲液进行梯度洗脱。 收集含有泛素蛋白的组分,在100倍体积的去离子水中透析2-3次,最后超滤浓 缩至合适体积后分装,于-20℃保存。
2、E2泛素结合酶Ubc13-Uev2的纯化
带有His标签的Ubc13,Uev2蛋白cDNA构建在pET15b原核表达载体上。 分别转化大肠杆菌(BL21(DE3)/pLys菌株)后,在室温用0.2mM IPTG诱导表 达过夜。将1L大肠杆菌离心收集弃上清后,用20ml缓冲液I(20mM Tris-Cl pH8.0, 300mM NaCl,1mM PMSF,0.5%(V/V)NP-40,20mM咪唑)重悬,并进行超声裂 解。20000g离心20分钟后,将上清转移至新的50ml离心管中。加入1mL Ni-NTA 微珠(购自Thermo Fisher Scientific),4℃翻转摇床结合1-2小时,将含微珠的 混合液装入大小合适的空层析柱中,待细胞裂解液流出后,微珠则留在柱中, 接着用缓冲液I、缓冲液II(20mM Tris-Cl pH8.0,300mM NaCl,1mM PMSF,20mM 咪唑)依次洗涤30个柱体积,最后用洗脱液(20mM Tris-Cl pH8.0,300mM NaCl, 1mM PMSF,250mM咪唑)洗脱。
将等摩尔量的His-Ubc13和His-Uev2蛋白混合,4℃放置1小时。用缓冲液 III(20mM HEPES pH7.4,10%(v/v)甘油)将阳离子交换柱平衡好后,使Ubc13- Uev2蛋白混合液流过并结合到柱子上,随后用含0-300mM NaCl的缓冲液III 进行梯度洗脱。收集含有Ubc13-Uev2二元蛋白复合物的组分。最后,超滤浓缩 至合适体积后分装,于-80℃保存。
3、E1泛素活化酶和E3泛素连接酶TRAF6的纯化
带有His标签的E1和TRAF6蛋白cDNA构建在pFastBac-HT-A载体上。 通过杆状病毒表达系统(baculoviral protein expression system)在SF-9细胞中进 行蛋白表达。将100mlL SF-9细胞离心收集弃上清后,用20ml缓冲液I(20mM Tris-Cl pH8.0,300mM NaCl,1mM PMSF,0.5%(V/V)NP-40,20mM咪唑)重悬, 并进行超声裂解。20000g离心20分钟后,将上清经0.45μm孔径的滤膜过滤 后转移至新的50ml离心管中。加入1mL Ni-NTA微珠(购自Thermo Fisher Scientific),4℃翻转摇床结合1-2小时,将含微珠的混合液装入大小合适的空层 析柱中,待细胞裂解液流出后,微珠则留在柱中,接着用缓冲液I、缓冲液II(20mM Tris-Cl pH8.0,300mM NaCl,1mM PMSF,20mM咪唑)依次洗涤30个柱体积,然 后用洗脱液(20mM Tris-Cl pH8.0,300mM NaCl,1mM PMSF,250mM咪唑)洗脱。 含蛋白洗脱液经过超滤替换到保存缓冲液(20mM HEPES pH7.4,10%(v/v)甘油) 中,使原洗脱缓冲液成分稀释200倍以上,最后超滤浓缩至合适体积后分装, 于-80℃保存。
4、反应中间体Ub~Ubc13/Uev2的纯化
配置1ml的反应混合液(20mM HEPES pH7.4、5mM氯化镁、2mM ATP、 0.5mM DTT、0.2μM E1、5μM Ubc13/Uev2、10μM Ub),按200μl分装到1.5ml 离子管中置于30℃反应10min后,加入5倍体积4℃预冷的缓冲液A(20mM HEPES pH7.4、10%甘油),20000g离心20min去沉淀,合并上清。于4℃冷室 中,在GEPurifier常规快速蛋白质液相色谱仪的程序控制下,使反应产 物结合到1ml规格的HiTrap Q HP阴离子交换柱上,接着使用缓冲液A和缓冲 液B(20mM HEPES pH7.4、10%甘油、1M氯化纳)进行连续梯度洗脱,收集 包含反应中间体Ub~Ubc13/Uev2的组分,在4℃超滤浓缩后分装,于-80℃保存。
实施例2
1、泛素链合成反应
配制如下反应体系:
设置对照组和11组样品组;其中,对照组还含有5%DMSO,样品组还含 有天然小分子化合物(购自Selleck公司,溶解在DMSO中),该天然小分子化 合物分别为槲皮素(样品组1)、木犀草素(样品组2)、杨梅素(样品组3)、漆 黄素(样品组4)、桑色素(样品组5)、山奈酚(样品组6)、芹菜素(样品组7)、 花青素(样品组8)、紫铆花素(样品组9)、金鸡菊查耳酮(样品组10)和表没 食子儿茶素没食子酸酯(样品组11)。
将样品组和对照组置于30℃下反应30分钟后,加入SDS-PAGE样品缓冲 液终止反应,接着,进行电泳和Western Blot检测泛素蛋白,检测结果如图1所 示。
2、表面等离子体共振(SPR)检测天然小分子化合物与泛素结合酶的相互作用 25℃环境下在GE公司Biacore T200仪器中检测。Ubc13-Uev2复合物蛋白 首先根据GE公司提供的技术方案固相化在配套的CM7芯片上。
天然小分子化合物(该实验)溶解在工作缓冲液(10mM HEPES pH7.4,150 mM NaCl,3mM EDTA,0.05%Surfactant P20and 5%DMSO)中,配制按2倍稀 释梯度从100μM到0.78μ共8个浓度的缓冲液。含有不同浓度小分子化合物 的缓冲液以30μl/分钟的流速,按照60秒预跑、60秒结合、180秒解离的时间 程序流经检测池。
每个循环结束后,用再生缓冲液(Glycine-HCl pH 2.2)进行再生。检测结 果由配套的软件记录并进行数据处理。天然小分子化合物槲皮素、木犀草素、 桑色素和表没食子儿茶素没食子酸酯的检测结果如图2~图5所示。
3、结合体外泛素化反应测定天然小分子化合物的半抑制浓度IC50
参照本实施例第一部分泛素链合成反应的实施步骤。其中,对照组还含有 5%DMSO,样品组还含有一系列浓度梯度的天然小分子化合物(购自Selleck公 司,溶解在DMSO中),该天然小分子化合物为槲皮素(样品组1)、木犀草素 (样品组2)或表没食子儿茶素没食子酸酯(样品组3)。
将样品组和对照组置于30℃下反应30分钟后,加入SDS-PAGE样品缓冲 液终止反应,接着,进行电泳和Western Blot检测泛素蛋白。Western blot的结 果用Image J软件对免疫印迹的信号强弱进行定量,接着用GraphPad Prism软件 以化合物浓度为横轴,免疫印迹信号的强度为纵轴进行非线性拟合(log(inhibitor) vs.normalized response--Variable slope选项),由此计算得到各组天然小分子化 合物样品的半抑制浓度。结果如图6~8所示。
实施例3
1、利用体外泛素氨解反应合成泛素链的实验说明天然小分子化合物抑制 Ubc13的酶活
配制如下反应体系:
设置对照组和样品组;其中,对照组还含有5%DMSO,样品组还含有天然 小分子化合物(溶在DMSO中),该天然小分子化合物为槲皮素(样品组1)、 木犀草素(样品组2)、表没食子儿茶素没食子酸酯(样品组3)。同一组样品设 置加入或不加入10nM TRAF6蛋白的两种条件,置于30℃反应5分钟至4小时 不等,反应产物经SDS-PAGE电泳分离后,用Western Blot检测泛素蛋白。结果 如图9~图11所示。
由图9~11所示,说明斛皮素、木犀草素和表没食子儿茶素没食子酸酯都能 够抑制Ubc13的酶活。
2、利用非还原SDS-PAGE说明天然小分子化合物抑制胞内Ubc13泛素氨 解反应活性
贴壁培养的细胞接种到培养板上。在培养基中加入100μM斛皮素或150μM 表没食子儿茶素没食子酸酯,并维持0至12小时。在指定时间点收集小分子化 合物处理过后的细胞,用细胞裂解液(50mM Tris-Cl pH7.4、150mM氯化内、10% 甘油、1%NP-40)将细胞裂解,于20000g离心10分钟后,收集上清,加入 SDS-PAGE样品缓冲液(不含还原剂)。样品经SDS-PAGE电泳分离后,用Western Blot检测Ubc13、UbcH7、UbcH5c和beta-Actin。结果如图12和图13所示。
由图12和13所示,斛皮素和表没食子儿茶素没食子酸酯都能特异地抑制 胞内Ubc13的泛素氨解反应活性,而其它E2泛素结合酶如UbcH7和UbcH5c 则不受影响。
- 还没有人留言评论。精彩留言会获得点赞!