艾塞那肽类似物的缓释偶联物的制作方法
本发明涉及药物递送和缓释制剂领域。更具体地,其涉及在一个月或更多的一段时间递送glp-1激动剂稳定形式的缓释组合物。
背景技术:
艾塞那肽(exenatide)是一种具有39个氨基酸肽的glp-1受体的强效激动剂,这使其成为具有葡萄糖调节作用的胰岛素促分泌素。其在ii型糖尿病的治疗中被广泛地用作游离肽,以
传统上通过下述多种方法中的一种或组合延长肽半衰期:(i)化学修饰肽以延缓代谢;(ii)包封以提供缓慢释放储库(depot)制剂;和(iii)与大分子偶联以缓慢清除。参见例如,cai,等,drugdesign,development,andtherapy(2013)7:963-970。
对肽进行化学修饰以增加半衰期生成每日一次的glp-1激动剂,例如,利西拉肽(lixisenatide)
在理解给药要求中便于考虑血浆半衰期,即从系统中丧失一半药物所需的时间。给药频率通过将药物水平维持在特定有效水平或之上的需要而确定。如果每个半衰期将进行一次给药,那么给药必需以有效水平2倍的初始药物水平给予;相似地,如果每两个半衰期进行一次给药,那么给药必需以有效水平4倍的初始药物水平给予。理论上,无论半衰期如何,仅通过增加各剂量给予的药物量,可以如所需进行不频繁的给药。然而,许多药物显示与高初始浓度相关的毒性,对作为半衰期函数的给药频率产生了实际的限制。大约1-2个半衰期的给药间隔是典型的。尽管已经公开了具有适合每月一次给药有效半衰期的几种glp-1激动剂肽制剂,但是它们具有几点不足。包封微球和相变脂质制剂可能存在初始突释相(burst-phase)释放肽的缺陷,将患者暴露于最初不希望的高药物水平。可移植泵需要手术来移植和移除。
药物释放的初始突释可以通过使用共价连接的偶联物避免。尽管可溶、循环偶联物通常本身不具有足够的半衰期来支持每月一次的药物给予(人体中聚(乙二醇)的最大半衰期是约1周),但是不可溶偶联植入物如水凝胶是合适的。之前已经公开了具有可控速率的药物释放的组合物,其中药物如艾塞那肽与各种基质通过接头共价连接,例如在美国专利8,680,315;u.s.8,754,190;u.s.8,703,907中,包括公开于u.s.8,946,405的不可溶基质以及公开于us2014/0288190中的水凝胶(‘190)。在‘190公开的一个实施方式中,艾塞那肽与水凝胶基质连接,其中在注射入皮下空间后,水凝胶提供储库,艾塞那肽通过β-消除性切割接头从其中释放以提供药物的长期作用来源。根据定义,这类水凝胶主要由水组成,并且艾塞那肽因此在储库期间暴露于水性环境。尽管该水性环境被认为有利于维持蛋白质的复合结构,但是某些肽序列在这样的长期条件下可能会存在不稳定的缺陷。
已经发现生理状态下艾塞那肽在水凝胶中的降解速率使得每月一次或者甚至更低频率给予这类制剂不切实际。已经报道艾塞那肽在应力条件(ph7.9,40℃下6天)显示出化学不稳定性,其源于m14和w25处的氧化以及q13和n28处的侧链氨基水解作用(美国专利申请2006/0194719;西兰岛),并未公开该不稳定性的详细动力学。尽管并未描述肽中asm残基脱酰胺基作用的详细模型(geiger和clarke,j.biol.chem.(1987)262:785-794),但是肽和蛋白质在生理条件下脱酰胺基作用的速率已知是高度可变的(robinson和robinson,procnatlacadsci(2010)98:12409-12413)。艾塞那肽本身对于每日两次给药
已经公开了艾塞那肽的稳定形式。例如,pct申请wo2008/116294(matregen)公开了在3个位置进行修饰的稳定化的艾塞那肽类似物:q13、m14和n28。尽管可以忍受艾塞那肽序列中多个氨基酸取代,但是现在已经发现通过更稳定的残基替代n28将满足在ph7.4、37℃下有效稳定肽。艾塞那肽脱酰胺基作用的多个产物,例如n28d和n29-异d已经在上述引用的美国专利申请2006/0194719(西兰岛)中公开,并且发现其保持对glp-1受体活性的功效。然而,这些产物形成互换系统,并且对于平衡至产物的原始混合物是不稳定的。
对ph7.4、37℃(即,生理ph和温度)水性缓冲液中艾塞那肽命运的详细研究显示,取决于缓冲液,其在asn28(n28)处以8-14天之间的半衰期进行脱酰胺基作用。设计用于每月一次给药的水凝胶偶联物将因此在8-14天后主要释放艾塞那肽的降解产物。因此,稳定化的glp-1激动剂具有对化学降解的充分抗性是必要的,从而使在给药阶段结束释放时降解形式的量最小化。当glp-1激动剂在ph7.4、37℃一个月后生成少于10%的降解产物时实现该目标,优选在ph7.4、37℃一个月后生成少于5%的降解产物。
技术实现要素:
本发明涉及提供缓释稳定化的glp-1激动剂肽的偶联物,所述稳定的glp-1激动剂肽支持以每月一次或更少的频率给予这些肽并且能够用于治疗代谢疾病和病症如代谢综合征、糖尿病和肥胖症。偶联物将glp-1激动剂延长的稳定性与合适接头提供的受控释放时间组合至储器基质,其作为用于释放的储器。
在一方面中,本发明提供了缓释偶联物,其包括具有多个共价连接的接头-肽的不可溶基质,其中接头在生理条件的ph和温度下切割以释放游离的肽,并且其中所述肽是稳定化的glp-1激动剂,其在ph7.4、37℃下超过一个月显示出少于10%的降解。本发明的偶联物可以式(1)示例性地说明:
m-(l-e)x(1)
其中m是通过可切割接头l连接多个(x)glp-1激动剂肽e的不可溶基质。e是对于生理条件的ph和温度下发生的降解而经稳定化以在超过一个月显示少于10%降解的glp-1激动剂。x是表示在基质的体积中实现合适浓度的l-e部分数量的整数。合适的浓度是每ml基质1-1000mg肽。接头l释放游离肽,其具有适合所需给药周期的半衰期。
在第二方面中,本发明提供了具有式(4)的接头-肽l-e:
其中r1和r2中至少一个或两者独立地是cn;no2;
任选被取代的芳基;
任选被取代的杂芳基;
任选被取代的烯基;
任选被取代的炔基;
cor3或sor3或so2r3,其中
r3是h或任选被取代的烷基;
芳基或芳烷基,各自任选被取代;
杂芳基或杂芳烷基,各自任选被取代;或者r3是
or9或nr92,其中r各自独立地是h或任选被取代的烷基,或两个r9基团和与其连接的氮一同形成杂环;
sr4,其中
r4是任选被取代的烷基;
芳基或芳烷基,各自任选被取代;或
杂芳基或杂芳烷基,各自任选被取代;
其中r1和r2可接合形成3-8元环;且
其中r1和r2中有且只有一个可以是h或烷基、芳烷基或杂芳烷基,各自任选被取代;且
其中r5中的一个是(ch2)yz、(ch2ch2o)xch2ch2z或(ch2)ynh-co-(ch2ch2o)xch2ch2z,其中x是1-100,y=1-6,且另一r5是h、烷基、烯基烷基、炔基烷基、芳基、芳烷基、杂芳基或杂芳烷基,各自任选被取代;
z是功能性基团,用于介导与不可溶基质的偶联,而nh是glp-1激动剂e的氨基基团的残基。
在一实施方式中,r1是cn或r3so2,其中r3是烷基或r92n,其中各r9是h、烷基或经取代的烷基,一个r5是h,而另一r5是(ch2)nz,其中n=1-6并且z是功能性基团,通过该功能性基团接头-肽可以与m连接。
在一实施方式中,e是[n28q]艾塞那肽(seqidno:2)。本发明还包括该肽和其任何药学可接受的盐和药物组合物,以及glp-1激动剂的给药方案,其包括向具有受益于glp-1激动剂的病症的对象给予组合物,所述组合物以盐的形式使用该肽。
在第三方面,本发明涉及式(i)偶联物的给药方案。在一实施方式中,以适用于使用窄号针头皮下注射的水凝胶微球制备偶联物。预期的是本发明的偶联物能够在人和动物中用于治疗代谢疾病和病症。实现了1-3个月的延长的剂量。
附图说明
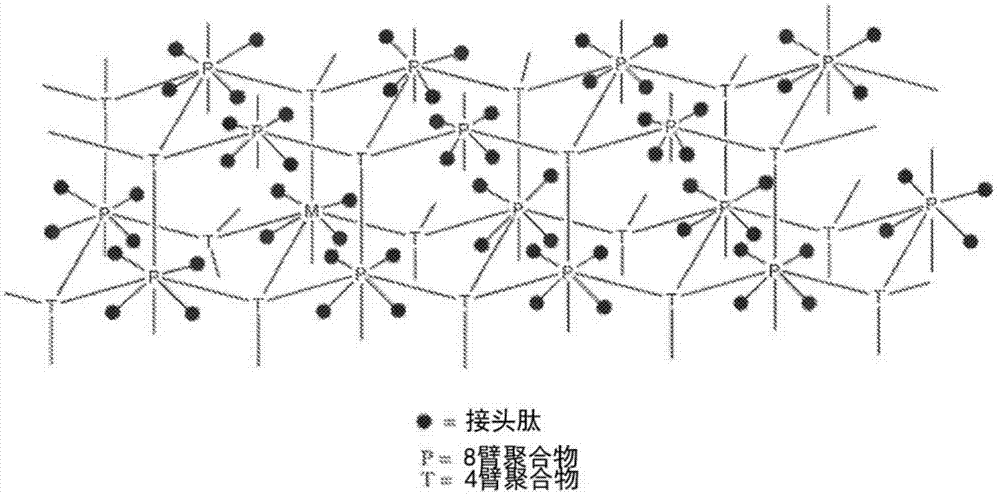
图1-6是表示本发明缓释偶联物的各种实施方式的示意图。
图1a和1b显示了概括形式的偶联物的透视图。在图1a中,其中一个部分是8臂大分子单体,而另一个是4臂大分子单体,并且其中连接glp-1激动剂的接头与8臂大分子单体的臂偶联。在图1b中,结构提供了接头-激动剂与交联剂本身的连接。
图2示出图1a中连接的更多细节。
图3是这样的实施方式的示意图,所述实施方式中提供了与不同大分子单体偶联的交联部分,其具有用于连接接头相关激动剂的反应基团。
图4示出连接有接头肽的图3的基质。
图5和6示出本文实施例4所示具体实施方式。
图7a-7b示出来自偶联物储库的药物相对于给药频率的释放速率和实现设定最终浓度(c分钟)所需相对剂量之间的关系。
图8a-8c示出艾塞那肽和[n28q]艾塞那肽在200mm磷酸缓冲液中ph7.4、37℃下的稳定性。
图9示出来自图8a和8b中所示65天艾塞那肽降解反应的分离峰中异-天冬氨酸(异asp)成分的肽异天冬氨酸甲基转移酶(pimt)试验的结果。异asp测定在t=0和56天确定艾塞那肽反应混合物,并在56天确定降解混合物的分离部分。含肽的l-asp-和d-异asp的值针对通过hplc在样品中检测到的少量l-异asp-肽进行调节。位于rv9.9和10.4的残留pimt-正峰是由于分离的hplc组分中低水平的[l-异asp28]艾塞那肽杂质。误差线是±sd。
图10示出以水凝胶-连接的未修饰的艾塞那肽(r1=cn;r2=h)给药后,艾塞那肽在大鼠中的药代动力学。基于体外释放动力学(t1/2=1400小时)以及已知的艾塞那肽药代动力学参数,生成预期浓度与时间曲线(虚线)。实验数据(方块)与考虑了艾塞那肽在水凝胶(实线)上降解的模型更加拟合,其中总体t1/2=190小时。
图11示出以水凝胶-连接的[n28q]艾塞那肽皮下(s.c.)给药后,[n28q]艾塞那肽在大鼠中的药代动力学。组图a示出水凝胶,其中,肽使用具有r1=meso2的l连接并且得到t1/2=350小时。组图b示出水凝胶,其中,肽使用具有r1=cn的l连接并且得到t1/2=760小时。因此,在单次剂量后,[n28q]艾塞那肽的血浆水平可以维持至少一个月。
图12示出艾塞那肽和[n28q]艾塞那肽在口服葡萄糖耐受测试中的比较结果。
图13示出对于图7中示出的口服葡萄糖耐受测试数据的auc分析。
图14a-14e示出糖尿病zdf大鼠中包括[n28q]艾塞那肽的水凝胶微球制剂(“pl-cmpd”)每月一次给药的结果。
图15a-15b示出将包括实施例8a中所述的[n28q]艾塞那肽的水凝胶微球制剂皮下给药后,[n28q]艾塞那肽在大鼠血清中的药代动力学。
图16a-16b示出用实施例8b所述微球偶联物皮下注射小鼠后,血清[n28q]艾塞那肽水平。
本发明的实施方式
为了实现每月一次给予肽,肽必须以不循环但是作为药物释放储库操作的不可溶基质的形式提供。药物的循环大分子偶联物并不符合要求,因为偶联物自身将从系统清除,例如,血浆本身。因此,肽必需在大尺度的基质内提供,并且其中肽(或其它药物)在基质的体积中以1-1000mg肽/ml基质的浓度存在,优选1-100mg肽/ml基质,或更优选1-50mg肽/ml基质。因此,基质具有可辨识的体积,并且可以容易且共同地以微球的形式给予。(“基质的体积”是提供的剂量的总体积,包括微球的剂量)。
为了显示本发明所涉及的结构的性质,申请人提供了图1-6,其提供了落入本发明范围的典型实施方式的概况。
图1a示出对于包括根据本发明连接的肽的典型的不可溶水凝胶基质的视图。这是通过8臂大分子单体p与4臂大分子单体t以这样的化学剂量交联形成的基质的理想结构,所述化学剂量使得p的一半臂与t的臂交联。p剩下的未交联臂与接头-肽连接。这类水凝胶的制备述于pct公开wo2013/036847,并且在下述制备方案e中详述。
图1b示出另一种方案,其中可释放接头-药物与可降解交联剂偶联。图1b示出通过4臂大分子单体a与第二4臂大分子单体b交联形成的基质的理想示例性结构,4臂大分子单体a中a的各臂通过包括正交的第一和第二功能性基团的基团封端,第二4臂大分子单体b中b的各臂由这样的功能性基团封端,所述功能性基团仅与大分子单体a的第一或第二功能性基团中的一个反应。大分子单体a的剩余功能性基团能够用于与接头-肽反应,所述接头-肽包括与大分子单体剩余功能性基团反应的功能性基团。进行接头-肽的连接可以在凝胶形成之前通过大分子单体a与接头-肽反应,然后与大分子单体b交联,或者在凝胶形成之后通过将a和b进行交联以形成水凝胶,然后与接头-肽反应。如上所述,形成不可溶水凝胶基质的交联反应可以批量料进行或者在悬浮液或乳液中进行,从而形成细分的微粒聚合物,例如本文实施例2所述的微球。
图2示出基质中8臂大分子单体p和4臂大分子单体t之间交联的一般结构,所述基质还包括各p的接头肽,如图1a所概述。另一方案,其中接头-激动剂与图1b和下述实施例4中所示水凝胶的交联剂部分偶联。
图3和4提供了该替代方案的一般描述。图3示出用试剂引入环辛炔基团衍生具有可及的胺基的不可溶基质的示例。在该示例中,用于按照本文下述制备方案d所示制备基质的大分子单体a包括赖氨酸残基。通过与大分子单体b交联形成基质后,所得基质具有适合进一步功能化的可及的胺基,例如,通过与引入环辛炔的试剂反应而功能化。
图4示出包括可切割接头-肽的可降解水凝胶的一般结构。将两个大分子单体a和b(例如,如本文下述制备方案b所述),从而使各交联包括可释放的接头-肽。在该图中,各a和b通过示出的交联进行偶联以形成不可溶基质。y和z是连接官能团。
图5和6示出实施例4中制备的缓释偶联物中的连接的结构。在图5中,水凝胶基质包括交联,具有通过调节剂双(2-乙氧基)氨基磺酰基控制的降解,而由水凝胶释放seqidno:2的肽是通过调节剂cn来控制。连接功能团是三唑,其来自向环辛炔mfco添加叠氮化物。
图6示出与图5相同的结构,除了水凝胶交联和由水凝胶释放肽两者的降解都通过调节剂cn进行调节,并且连接功能团是来自叠氮基团与5-羟基环辛炔反应的三唑。
基质m:
基质m是与接头-肽l-e连接的不可溶支持物,其作为治疗持续期间释放e的储器。m必需适合用于连接接头-肽l-e,或者还包括可以进行衍生化从而允许这样连接的功能性基团。m必需允许肽e的自由扩散,一旦其通过切割接头l释放。此外,m必需对可溶性产物是生物可降解的,并且足够缓慢地降解以允许在不形成过多数量可溶性m-l-e片段的情况下释放e,但在多重剂量情况中释放e后足够迅速地减轻不含药物的m-l残留物的负担。
在一实施方式中,m是如pct专利公开wo2013/036847和us2014/0288190所公开制备的生物可降解水凝胶,上文文献通过引用其对于这类水凝胶的描述纳入本文。这些水凝胶包括β-消除性交联剂,其提供对降解速率的控制。因此,在一些实施方式中,交联剂是如下的式(1)或(2)。
其中,m是0或1,并且
其中r5、r2和r1之一和x各自包括用于偶联至聚合物的功能性基团,并且
前提是:r1和r2中的至少一个是cn;no2;
任选被取代的芳基;
任选被取代的杂芳基;
任选被取代的烯基;
任选被取代的炔基;
cor3或sor3或so2r3,其中
r3是h或任选被取代的烷基;
芳基或芳烷基,各自任选被取代;
杂芳基或杂芳烷基,各自任选被取代;或
or9或nr92,其中r9各自独立地是h或任选被取代的烷基,或两个r9基团和与其连接的氮一同形成杂环;
sr4,其中
r4是任选被取代的烷基;
芳基或芳烷基,各自任选被取代;或
杂芳基或杂芳烷基,各自任选被取代;
其中r1和r2可接合形成3-8元环;且
其中任何剩余的r1和r2是h或是烷基、芳烷基或杂芳烷基,各自任选被取代;并且
任何剩余r5独立地是h或是烷基、烯基烷基、炔基烷基、(och2ch2)po-烷基(其中p=1-1000)、芳基、芳烷基、杂芳基或杂芳烷基,各自任选被取代;或者
所述交联剂是式(2)
其中r5、r2和r1中的两个包括用于结合聚合物的功能性基团;
m是0-1;
n是1-1000;
s是0-2;
t是2、4、8、16或32;
q是具有价态t的核心基团;
w是o(c=o)o、o(c=o)nh、o(c=o)s、
其中r6是h,任选被取代的烷基,任选被取代的芳基,任选被取代的杂芳基,任选被取代的芳烷基或任选被取代的杂芳烷基;并且
前提是:r1和r2中的至少一个是cn;no2;
任选被取代的芳基;
任选被取代的杂芳基;
任选被取代的烯基;
任选被取代的炔基;
cor3或sor3或so2r3,其中
r3是h或任选被取代的烷基;
芳基或芳烷基,各自任选被取代;
杂芳基或杂芳烷基,各自任选被取代;或
or9或nr92,其中r9各自独立地是h或任选被取代的烷基,或两个r9基团和与其连接的氮一同形成杂环;
sr4,其中
r4是任选被取代的烷基;
芳基或芳烷基,各自任选被取代;或
杂芳基或杂芳烷基,各自任选被取代;
其中r1和r2可接合形成3-8元环;且
其中任何剩余的r1和r2是h或是烷基、芳烷基或杂芳烷基,各自任选被取代;并且
任何剩余r5独立地是h或是烷基、烯基烷基、炔基烷基、(och2ch2)po-烷基(其中p=1-1000)、芳基、芳烷基、杂芳基或杂芳烷基,各自任选被取代。
用于将这些交联剂偶联至基质的功能性基团包括:n3、nh2、nh-co2tbu、sh、stbu、马来酰亚胺、co2h、co2tbu、1,3-二烯、环戊二烯、呋喃、炔烃、环辛炔、丙烯酸盐/酯、氨基氧基、酮基和丙烯酰胺。式(1)和(2)上的两种功能性基团彼此之间不同,但是不是同族的。例如,若其中一种是叠氮化物,那么另一种不是环辛炔或炔烃。
通过选择β-消除性交联剂,该交联剂导致比切割l-e释放e的速率慢数倍的速率的m降解和溶解,可溶性m-l-e片段的形成被最小化,同时提供有效的基质溶解和清除。在本发明的一实施方式中,水凝胶通过交联多臂聚(乙二醇)制备。本发明还考虑了其它有用的基质,包括交联的右旋糖酐和透明质酸。
可以有利地将这类基质制成微球的浆料,即适合使用窄号针头注射。可以使用已知的方法制备这类浆料,例如,松散相(bulk-phase)乳化或更精确地通过预聚物混合物的微流体液滴乳化。如果需要,可以通过已知的方法对颗粒大小分布进行精制,例如通过筛选。
肽e:
通过本发明递送的肽(e)是glp-1激动剂,其指能够结合glp-1受体并将其激活的肽。glp-1激动剂的示例包括天然产生的毒蜥外泌肽(exendin),例如艾塞那肽(毒蜥外泌肽-4(exendin-4);seqidno:1)、利拉鲁肽(liraglutide)(seqidno:13)、利西拉肽(lixisenatide)(seqidno:7)、他司鲁肽(taspoglutide)(seqidno:12)和其序列变体。也考虑了结合并激活glp-1受体的合成序列,例如源自体外筛选和/或选择的序列(zhang,等,naturecommun.(2015)6:8918)。
seqidno:1
hgegtftsdlskqmeeeavrlfiewlknggpssgappps-nh2
[艾塞那肽]
seqidno:2hgegtftsdlskqmeeeavrlfiewlkqggpssgappps-nh2
[n28q]艾塞那肽
seqidno:3hgegtftsdlskqmeeeavrlfiewlkaggpssgappps-nh2
[n28a]艾塞那肽
seqidno:4hgegtftsdlskqmeeeavrlfiewlkkggpssgappps-nh2
[n28k]艾塞那肽
seqidno:5hgegtftsdlskqmeeeavrlfiewlkdggpssgappps-nh2
[n28d]艾塞那肽
seqidno:7
hgegtftsdlskqmeeeavrlfiewlknggpssgappskkkkkk-nh2
[利西拉肽]
seqidno:8
hgegtftsdlskqmeeeavrlfiewlkqggpssgappskkkkkk-nh2
[n28q]利西拉肽
seqidno:9
hgegtftsdlskqmeeeavrlfiewlkaggpssgappskkkkkk-nh2
[n28a]利西拉肽
seqidno:10
hgegtftsdlskqmeeeavrlfiewlkkggpssgappskkkkkk-nh2
[n28k]利西拉肽
seqidno:11elvdnavggdlskqmeeeavrlfiewlkqggpssgappps-nh2
seqidno:12huegtftsdvssylegqaakefiawlvkur-nh2
[他司鲁肽]u=2-胺基异丁酸
seqidno:13haegtftsdvssylegqaak*efiawlvrgrg-oh
k*=lys(y-glu-棕榈酰)
重要的是肽激动剂e在给药周期期间内在生理条件下是化学稳定的。尽管对于直接给予肽这可能并不是个问题,但是考虑到它们快速的清除以及频繁的给药,缓冲制剂对肽稳定性提出了更严格的要求。例如,在生理条件下的降解具有14天半衰期的肽可以完美的适合每天一次的给药,因为仅有5%的肽将会在1天内降解。处于30天(即,每月一次给药)缓释条件下的同样的肽将会在给药周期结束时降解80%,并且因此不合适。
如下示出降解含有序列asn-gly的肽(例如,艾塞那肽中的n28-g29二肽)的机制。若所述,形成初始l-琥珀酰亚胺,其导致天冬酰胺残基转化成天冬氨酸或异天冬氨酸。获得这些修饰的氨基酸的d和l形式。
对艾塞那肽自身序列变体的检测显示以其它氨基酸替换n28可以提供激动剂足够的稳定性,以支持经由缓释偶联物的每月一次给药,同时具有对肽结合和激活glp-1受体的效力的最小影响。因此,已经发现具有其中seqidno:1的n28分别被q、a或k替换的seqidno:2-4的激动剂以与天然艾塞那肽相当的亲和力和效力结合并激活glp-1受体,同时在一个月的周期内显示出<10%或<9%化学降解。
本发明还考虑了除了艾塞那肽以外适当稳定化的glp-1激动剂的用途。上述不稳定性预计将与具有asn-gly二肽序列的其它glp-1激动剂出现,例如利西拉肽和其它合成的肽序列。预计这些肽将进行如上所示相同的序列降解反应。能够用于本发明的这些glp-1激动剂的合适的稳定化形式包括seqidno:8-11。他司鲁肽(seqidno:13)和利拉鲁肽(seqidno:14)并不具有不稳定的asn-gly二肽,因此适合用于本发明。不稳定性的其它原因可以被纠正。对于本发明的激动剂,稳定形式在ph7.4、37℃一个月后生成少于10%的降解产物,优选在ph7.4、37℃一个月后生成少于9%的降解产物。
可切割接头l:
可切割接头将glp-1激动剂e连接至不可溶基质m,并且在生理条件下被切割以释放游离的e。接头切割的速率确定肽的有效半衰期并且根据所需的给药频率选择。更重要的是基质的降解速率和肽的释放速率与所需的给药频率调节。此前,并未试图平衡这些特征,而平衡对于本发明的组合物的成功是必需的,从而允许每月或不太频繁地给药。导致实现这样平衡的任何结构都将是符合要求的。尽管关于药物释放速率和基质降级速率之间的关系没有固定规则,一个方便的经验法则是降解速率应当约为游离肽释放速率的三倍。如果在降解发生之前肽过于迅速地释放,那么在后续给药时留给对象的是凝胶的沉淀。如果释放相对于降解速率过慢,那么肽将保持与释放到循环中的凝胶部分的结合。这两种情况都是不希望的。这种关系由reid,r.,等macromolecules(2015)48:7359-7369描述。描述各种基质降解速率的结构特征取决于交联部分,并且结构关联可以被用于为基质提供合适的降解速率。
降解和释放速率的平衡如下呈现:
由储库通过切割共价接头释放相对快速清除的药物将接头切割的半衰期赋予血浆中药物的半衰期。因为给药频率取决于药物血浆半衰期,因此接头切割速率和给药频率之间也存在关系。通常希望将暴露于患者的药物的最大(c最大)和最小(c最小)血浆浓度之间的差值最小化,从而减少由于过高药物浓度导致毒性的可能性,同时维持剂量之间功效所需的量。
例如,如果将给药频率设定为等于药物的血浆半衰期,那么c最大和c最小之间将存在2倍的差值,而如果药物以每2个血浆半衰期给药一次,那么差值将增长至4倍。因此,通常将剂量之间的药物半衰期数最小化以使c最大最小。对于缓释偶联物,这通过降低释放速率予以实现。
然而,对于缓释偶联物,来自储库的药物的稳定状态水平与释放速率成反比例。尽管通过减缓来自偶联物的药物释放速率可以任意地降低c最大/c最小比例,但是需要维持c最小的特定值并且使用可接受的剂量限制了该途径。对于单次给药,可以这样计算剂量:
其中cl=药物清除速率,f=生物利用度,k1=由偶联物储库释放药物的速率,以及t最小=到达c最小的时间。由此可以看出,维持给定t最小的c最小所需的最低剂量当k1=1/t最小时实现。或者说,当药物释放半衰期(=ln(2)/k1)=ln(2)*t最小时实现。因为,以ln(2)*(给药间隔)得到特定给药频率的优选药物释放半衰期。当释放半衰期短于优选时,由于储库在达到t最小之前被耗尽,所需剂量将增加。
一般而言,慢于优选的药物释放速率比过快的药物释放速率更耐受。因此,具有支持每月一次给药的药物释放速率的偶联物可以被用于每两周或每周一次的给药方案。此外,药物释放速率和维持c最小所需剂量之间的关系使得可以耐受与理想值的一些偏差。根据图7a和7b中所示参数对其进行描述。如图7a所示,在释放半衰期与给药频率的比例是ln(2)=0.693时,观察到优选剂量(1)。图7a对其进行描述,表明可以耐受的释放速率的范围取决于剂量水平。较高剂量水平将耐受较高释放速率(因为仍然维持高于最小所需的浓度)以及较低释放速率(因为药物以较高水平提供较长时间)。具体地,如果剂量增加高达10%,那么可以接受0.45倍-1.1倍给药频率的释放半衰期。如果剂量可以增加高达20%,那么可以接受0.4倍-1.4倍给药频率的释放半衰期。如果剂量可以增加高达50%,那么可以接受0.3倍-2倍给药频率的释放半衰期。
具体如图7b所示:对于持续一个月的单次剂量(t最小=720小时),优选药物释放速率是500小时,然而也可以使用320-800小时的任何释放速率与增长约10%的剂量、280-1000小时的任何释放速率与增长约20%的剂量或220-1440小时的任何释放速率与增长约50%的剂量。相似地,对于持续三个月的单次剂量(t最小=720小时),优选药物释放速率是1500小时,然而也可以使用320-2400小时的任何释放速率与增长约10%的剂量、840-3000小时的任何释放速率与增长约20%的剂量或660-4350小时的任何释放速率与增长约50%的剂量。对于持续2周的单次剂量(t最小=336小时),优选药物释放速率是230小时,然而也可以使用150-800小时的任何释放速率与增长约10%的剂量、130-470小时的任何释放速率与增长约20%的剂量或100-680小时的任何释放速率与增长约50%的剂量。
相似地,在重复给药情况中的稳定状态下将药物浓度维持在c最小之上所需的剂量如下所示:
在重复给药情况中,不存在上述的优选剂量,而是随着释放速率降低而降低的所需剂量,因为较大比例的药物残留来自先前的剂量,因此增加了存在的总药物储库。
然而,由于需要将由生物可降解基质中释放的含药物凝胶片段最小化,希望将患者的总储库负担最小化,并且增加实现稳定状态药物水平的时间,利用较慢的释放速率来减少剂量存在实际限制。
在一实施方式中,可切割接头l具有式(3):
其中r1和r2中至少一个或两者独立地是cn;no2;
任选被取代的芳基;
任选被取代的杂芳基;
任选被取代的烯基;
任选被取代的炔基;
cor3或sor3或so2r3,其中
r3是h或任选被取代的烷基;
芳基或芳烷基,各自任选被取代;
杂芳基或杂芳烷基,各自任选被取代;或者r3是
or9或nr92,其中r各自独立地是h或任选被取代的烷基,或两个r9基团和与其连接的氮一同形成杂环;
sr4,其中
r4是任选被取代的烷基;
芳基或芳烷基,各自任选被取代;或
杂芳基或杂芳烷基,各自任选被取代;
其中r1和r2可接合形成3-8元环;且
其中r1和r2中有且只有一个可以是h或烷基、芳烷基或杂芳烷基,各自任选被取代;且
其中r5中的一个是(ch2)yz、(ch2ch2o)xch2ch2z或(ch2)ynh-co-(ch2ch2o)xch2ch2z,其中x是1-100,y=1-6,且另一r5是h、烷基、烯基烷基、炔基烷基、芳基、芳烷基、杂芳基或杂芳烷基,各自任选被取代;并且
z是用于介导与基质偶联的功能性基团。
这类接头由β-消除切割。在本发明描述的优选实施方式中,r1是cn或r3so2,其中r3是取代的或未取代的烷基或(r9)2n,其中各r9是独立取代或未取代的烷基;r2是h;一个r5是(ch2)yz,而另一个r5是h。z是n3、sh、nh-c(=o)ch2onh2或o-nh2。在具体的优选实施方式中,r1是cn或ch3so2,和/或z是n3。
可以使用其它类型的可切割接头,例如,通过酶促或非酶促水解作用切割的接头,如通过引用纳入本文的pct公开wo2006/136586中的那些。唯一的要求是接头切割速率适合上述所需给药方案。
在本发明的一实施方式中,接头在生理条件下以合适支持每月一次给药的半衰期切割并释放e,即该接头以220-1440小时的半衰期切割并释放e。在较优选的实施方式中,接头以280-1000小时的半衰期切割并释放e,更优选320-800小时的半衰期。在本发明的其它实施方式中,接头在生理条件下以合适支持每3个月一次或每两周一次给药的半衰期切割并释放e。
在本发明的具体实施方式中,接头l具有式(5),其中r1是cn。如实施例5所示,接头从大鼠中的水凝胶以760小时的半衰期释放肽
在另一具体实施方式中,接头l具有式(5),其中r1是ch3so2。如实施例5所示,接头从大鼠中的水凝胶以350小时的半衰期释放肽
接头l通过在l的c=o基团和e的氨基基团之间形成氨基甲酸酯连接来连接肽e。氨基基团可以是赖氨酸侧链的ε-氨基基团或n-末端α-氨基基团。制备两者的方法在本领域中是公知的。在一实施方式中,l在固相合成肽期间连接e的α-氨基基团。
接头l还包括基团z,其允许使用化学物质/方法(chemistry)使接头-肽l-e与基质连接,所述化学物质/方法在肽e上存在功能性基团的情况时是相容和选择性的。z可以是叠氮化物,再这样的情况中,l-e使用这样连接基质,其使用1,3-偶极环加成反应来形成1,2,3-三唑连接或使用磷化氢介导的施陶丁格连接(staudingerligation)来形成酰胺,两种反应都在本领域充分记载。环加成反应可以是对炔烃衍生基质的铜催化加成,也可以是对环辛炔-或二环壬烷-衍生的基质的张力促进的(strain-promoted)加成z还可以是氨基氧基或氨基氧基-乙酰胺基基团,在这样的情况中,l-e使用肟化反应连接酮衍生的基质。或z自身可以是酮基团,其连接基质上的胺基氧基基团。z还可以是硫醇基团,在这样的情况中,l-e通过形成硫醚连接至卤化乙酰衍生的基质、马来酰亚胺衍生的基质或环氧衍生的基质。
因此,用于将l与基质偶联的功能性基团包括:n3、nh2、nh-co2tbu、sh、stbu、马来酰亚胺、co2h、co2tbu、1,3-二烯、环戊二烯、呋喃、炔烃、环辛炔、丙烯酸盐/酯、氨基氧基、酮基或丙烯酰胺。
偶联物的制备
偶联物通过连接肽e、可切割接头l和基质m制备。在一实施方式中,成对地生成连接,并且连接的顺序可变。因此,肽e可以首先连接至接头l,然后获得的l-e连接基质至m。或者,接头l可以连接至介质m,然后e连接至m-l。当m是通过聚合单体单元制备的基质时,m-l或m-l-e可以是通过在反应中使用可交联单体-l或单体-l-e单元的聚合过程的产物。
为了生物利用,偶联物必需满足无菌和内毒素污染的严格标准。尽管在某些情况中有可能可以使用末端灭菌工艺,一般而言,本发明的偶联物并不适用于此。例如,不可溶水凝胶不适用于灭菌过滤。因此,可能需要的是本发明的偶联物在无菌条件下制备。偶联物可以制备为可注射微珠悬浮液,或者它们可以通过共注射单体单元原位形成。
制剂:
可使用标准药学上可接受的缓冲液和赋形剂配置偶联物以改善可注射性和储存稳定性。典型的制剂包括将ph维持于4-7之间的缓冲液,优选5-6之间的ph。赋形剂可以包括针对肽药物的稳定剂,例如,抗甲缩醛和/或抗氧化剂,如间甲酚,张力调节剂,如多元醇样甘露醇,和粘度降低剂,如牛磺酸,茶氨酸,肌氨酸,瓜氨酸和甜菜碱。
使用方法:
本发明的偶联物能够用于在已知给予glp-1激动剂将有效的人和动物中治疗代谢病症和疾病,包括但不限于糖尿病、代谢综合征和肥胖症。大幅提高的有效半衰期使每月一次的给药成为可能,因此改善了患者依从性(避免漏服)并且改善了患者的生活质量。给药优选通过皮下注射,并且可以使用自动注射器进行。
以下实施例用于说明但非限制本发明。
制备a
艾塞那肽的体外降解
作为ph7.4的200mmnapi中内标的2.4mm艾塞那肽(1ml)、0.1%nan3和200umlys(dnp)oh的溶液保持于37℃。每隔一段时间,移出50ul等分并冷冻于-20℃直到试验进行。解冻各种样品并分析a)hplc,b)glp1r激动剂活性,以及c)蛋白质异天冬氨酸甲基转移酶活性。将孵育56天的样品进行hplc,并且收集位于rv9.9、10.4和10.8的样品,然后单独分析由分析性rp-hplc的纯度、glp1r激动剂和pimt活性。
(a)艾塞那肽脱酰胺基作用相对于时间的hplc概况示于图8a-8c。通过rp-hplc纯化来自第56天反应的各峰。组图a示出在0(顶部)、7,28和56(底部)天针对天然艾塞那肽获得的hplc踪迹。艾塞那肽初始的单个峰逐渐被多个降解产物的峰所取代。组图b示出源自图a数据的艾塞那肽降解的时程。艾塞那肽的减少(方块)以及主要降解产物的增加示出大约10天的t1/2。组图c示出以对应图a中那些艾塞那肽的[n28q]艾塞那肽获得的hplc踪迹。分离降解产物的分析性hplc显示,l-asp和d-异asp峰分布包含约7和12%的污染性异asp;分离的异asp显示单个峰。
(b)通过glp1rcamphuntertm生物试验(discoverx公司)分析glp-1受体活化的时间点。ec50值总结于以下表1中。
表1
glp1rcamphuntertm试验中艾塞那肽降解产物的ec50值
由a280和ε280=5,500m-1cm-1计算肽浓度;l-asp和d-异asp值未针对少量异asp杂质校正。
分离自脱酰胺基作用混合物的asp肽包含少量潜在干扰性异asp肽,但是合成的[asp28]艾塞那肽相对于艾塞那肽显示出激动剂活性。第56天,脱酰胺基反应中形成的d-异asp的量非常少(约12%),其不能对混合物的激动剂活性作出显著地贡献。
(c)为了测试异天冬氨酸的存在,使用
制备b
制备艾塞那肽类似物
通过spps制备用ala、asp、gln和lys取代艾塞那肽的asn28。所有[xaa28]艾塞那肽具有与glp-1ra试验中艾塞那肽(17pm)中相当的ec50值(17-至41pm)。在200mmpi中以ph7.4、37℃延长孵育(约3个月)这些[xaa28]艾塞那肽后,并未观察到主要的新峰,除了[asp28]艾塞那肽缓慢异构化为[异asp28]艾塞那肽。处于低肽浓度(约0.2mm)时,在a280中观测到少量损失,这与对容器表面的非特异性吸附一致。处于2mm的[gln28]艾塞那肽时,估计肽损失的t1/2为>/=30周。因此,[gln28]艾塞那肽在生理条件下非常稳定。30周的t1/2将会在一个月内导致<9%损失。
制备c
体外受体结合以及毒蜥外泌肽类似物的活性
各种艾塞那肽类似物激活glp-1受体的能力使用camp试验(glp1rcamphuntertm生物试验(discoverx公司))测试。发现n28d、n28a、n28k和n28q类似物具有与艾塞那肽相当的能力。
当降解产物的混合物(图8a,第56天)在camp试验中测试时,其具有与初始艾塞那肽(图8a,第0天)相等的ec50。此外,由混合物纯化的推定的[异asp]28-和[asp]28艾塞那肽以及合成的[asp]28艾塞那肽显示与艾塞那肽相似的ec50值。然而,当在elisa试验(peninsula实验室公司)中进行测试时,分离的脱酰胺基作用产物和合成的[n28d]-艾塞那肽显示出明显减少的亲和力(ec50艾塞那肽,0.2nm;n28a=6nm;n28q=10nm;n28d>100nm;n28k>100nm)。因此,主要降解产物具有与艾塞那肽相等的激动剂活性,但不会通过用于血清艾塞那肽的lc-ms/ms或elisa测定来测量。
制备d
可降解微球的制备
大分子单体a的制备
(a)将5ml乙腈中的1-(双-(2-甲氧基乙基)氨基磺酰基)-7-叠氮基-2-庚基琥珀酰亚胺基碳酸酯(使用wo2013/036847中所述方法制备;1.12mmol)溶液添加到10ml水和5ml乙腈中的h-lys(boc)-oh(300mg,1.22mmol)和nahco3(420mg,5.0mmol)溶液中。0.5小时后,真空浓缩溶液以去除乙腈,用1nhcl酸化,并用乙酸乙酯提取。用水和盐水洗涤提取物,然后用mgso4干燥,过滤,并且蒸发以提供粗制na-[1-(双-(2-甲氧基乙基)氨基磺酰基)-7-叠氮基-2-庚氧基)羰基]-ne-(boc)-赖氨酸(“叠氮基-接头[mod]-lys(boc)-oh”)。
根据该方法制备的是叠氮基-接头[mod]-lys(boc)-oh,其中调节剂是二(2-甲氧乙基)氨基磺酰基、二甲基氨基磺酰基、氰、甲基磺酰基、4-甲基哌啶基磺酰基、吗啉代磺酰基或笨磺酰基。
(b)将上述粗制叠氮基-接头[mod]-lys(boc)-oh溶解在25mlch2cl2中,并用n-羟基琥珀酰亚胺(138mg,1.2mmol)和二环己基碳二亚胺(二甲苯中的60wt%溶液0.5ml)处理2小时。将混合物过滤并在sio2上使用己烷中的丙酮梯度进行层析以提供琥珀酰亚胺基酯叠氮基-接头[mod]-lys(boc)-osu。
根据该方法制备的是叠氮基-接头[mod]-lys(boc)-osu,其中调节剂是二(2-甲氧乙基)氨基磺酰基、二甲基氨基磺酰基、氰、甲基磺酰基、4-甲基哌啶基磺酰基、吗啉代磺酰基或笨磺酰基。
(c)含有n,n-二异丙基乙胺(80mm,0.8mmol,2当量)的乙腈中20-kda的4臂peg-四胺溶液(10ml,200mg/ml,40mm胺,0.4mmol,1当量)接受乙腈中叠氮基-接头[mod]-lys(boc)-osu溶液(3.3ml,145.5mm,0.48mmol,1.2当量)的处理。室温保持获得的混合物1小时,然后通过tnbs试验使用peg-四胺作为标准品对0.010ml样品的胺含量进行评估;通常剩余<1%的起始的胺。然后用乙酸酐(40.8mg,0.0378ml,0.4mmol,1当量)处理反应物15分钟,之后在真空下浓缩成粘稠糖浆(约4ml),然后将其缓慢地加入mtbe(350ml)。所得悬浮液搅拌1小时,然后通过过滤收获沉淀,用mtbe(150ml)洗涤,并且在真空下干燥以产生白色固体的大分子单体a。
根据该方法制备的是大分子单体a,其中调节剂是二(2-甲氧乙基)氨基磺酰基、二甲基氨基磺酰基、氰、甲基磺酰基、4-甲基哌啶基磺酰基、吗啉代磺酰基或笨磺酰基。
大分子单体b的制备
在4ml顶部螺纹药瓶加入peg20kda-[nh2]4(sunbrightpte-200pa;150mg,7.6μmolpeg,30.2μmolnh2,1.0当量,20mm最终胺浓度)、mecn(1.5ml)和ipr2net(7μl,40μmol,1.3当量,27mm最终浓度)。添加活化的酯环辛炔(39μmol,1.3当量,27mm最终浓度),并在环境温度下搅拌反应混合物。通过由elsd的c18hplc(11分钟内20-80%b)检测反应。当完成时,将ac2o(3μl,30μmol,1当量/初始nh2)添加至反应混合物,然后搅拌混合物30分钟。然后将反应混合物浓缩成浓稠油,并在mtbe(20ml)中悬浮。剧烈搅拌所得悬浮液10分钟。通过剧烈地混合用mtbe(20ml)研磨所得固体,离心沉淀(2800rpm,4℃,10分钟),然后通过沉淀去除上清液。所得固体在真空环境温度下干燥不超过30分钟。在20mmnaoac(ph5)中以20mm的目标胺浓度制备母液。然后,环辛炔浓度通过以peg7-n3(2当量)的处理和以dbco-co2h反滴定未反应的peg7-n3进行验证。
使用该方法制备的大分子单体包括其中环辛炔基团是下述基团的那些:mfco、5-羟基环辛炔、3-羟基环辛炔、bcn、dibo、3-(羧基甲氧基)环辛炔和3-(2-羟基乙氧基)环辛炔,其使用下述物质制备:mfco五氟苯基酯、5-((4-硝基苯氧基-羧基)氧基)环辛炔、3-(4-硝基苯氧基羧基)氧基环辛炔、bcn羟基琥珀酰亚胺基碳酸酯、dibo4-硝基苯基碳酸酯、3-(羧基甲氧基)环辛炔琥珀酰亚胺酯或3-(羟基乙氧基)环辛炔4-硝基苯基碳酸酯。
制备e
制备图1a的说明性水凝胶如下制备衍生的8臂大分子单体p:大分子单体p是各臂以环辛炔封端的8臂peg。在环境温度下搅拌16小时2mldmf中的200mg的40-kda8臂peg-胺·hcl(键凯科技有限公司(jenkemtechnologies);40umolnh2)、20mg的bcn对硝基苯基碳酸酯(synaffix公司;63umol)和20ul的n,n-二异丙基乙胺(115umol)溶液。在用0.5ml的0.1mkpi中的100mm牛磺酸(ph7.5)淬火1小时后,使用12-kda膜以水、1:1甲醇/水和甲醇依次对混合物进行透析。蒸发后,使残留物溶解于2mlthf并用10ml甲基叔丁基醚沉淀。收集产物并且干燥(190mg)。通过使用适当的活化的环辛炔,可以类似地制备包括其它环辛炔的大分子单体p。
如下制备衍生的4臂大分子单体t:大分子单体t是各臂以可释放接头-叠氮化物封端的4臂peg。将1mlacna中的25umol叠氮基-接头-琥珀酰亚胺基碳酸酯(使用wo2013/036847中所述方法制备)溶液添加到这样的混合物中,所述混合物是1ml水中的5umol(100mg)的20-kda4臂peg-胺盐酸盐(季戊四醇核心,键凯科技有限公司)和40ul的1.0mnahco3(40umol)。环境温度下1小时后,先后以1l50%的甲醇和1l甲醇对该溶液进行透析(12-14kmwco)。蒸发后,使残留物(109mg)溶解于2.12ml无菌过滤的10mmnaoac(ph5.0),并在-20℃冷冻。该叠氮化物的浓度通过与dbco-酸反应测定为9.5mm。通过使用适当的叠氮化物-接头-琥珀酰亚胺基碳酸酯,可以相似地制备包括接头-叠氮化物的大分子单体t,其中所述接头-叠氮化物具有其它调节剂。
释放肽的水凝胶可以至少两种不同的方式由衍生的大分子单体制备。
(a)在一实施方式中,在形成不可溶水凝胶制剂之前,接头-肽连接大分子单体p。诸如本文实施例1所示的式(4)叠氮基-接头-肽与大分子单体p以这样的化学剂量混合,所述化学剂量使得p的臂的一些部分用接头-肽衍生化。然后使用足够的大分子单体t将所得物质交联以使p剩余的臂与t的臂反应,并因此形成不可溶基质。因此,n摩尔的式(4)叠氮基-接头-肽与n/(8f)摩尔的大分子单体p混合,其中f=适当溶剂中接头-肽与臂加载的所需分数(即,对于50%的臂加载,f=0.5),所述适当溶剂通常是缓冲水性介质。在允许叠氮基-接头-肽反应足够时间后,所得溶液与n(1/f–1)/4摩尔的大分子单体t混合以形成不可溶水凝胶基质。通常,f经选择以使得水凝胶基质中各p残基具有>3个交联臂(f<0.625)。形成不可溶水凝胶基质的交联反应可以松散料进行或者在悬浮液或乳液中进行,从而形成细分的微粒聚合物,例如本文实施例2所述的微球。
(b)或者,可以制备不可溶水凝胶基质,然后连接接头-肽。对于基质中各p大分子单体残基包括8f当量的接头-肽的最终水凝胶,不可溶水凝胶制剂通过n/(8f)摩尔大分子单体p与n(1/f–1)/4摩尔大分子单体t的反应形成。形成不可溶水凝胶基质的交联反应可以松散料进行或者在悬浮液或乳液中进行,从而形成细分的微粒聚合物,例如本文实施例2所述的微球。然后允许聚合的基质与至少n摩尔式(4)叠氮基-接头-肽的溶液反应,从而使得接头-肽共价地连接基质。从基质洗脱未反应的叠氮基-接头-肽以提供释放肽的水凝胶。
实施例1
制备式(4)的叠氮基-接头-[n28q]艾塞那肽
其中,r1=cn或meso2;r2=h;一个r5=h而其它r5=(ch2)5n3;p=nα-[n28q]艾塞那肽
使用
使用装配有peakscientific
通过改进之前所述方法(schneider,e.l.等,biocong.chem(2016)3月1日网络公开),进行树脂上肽的n末端氨甲酰化,并且通过下述进行示例。
nα-(7-叠氮基-1-氰基-2-庚氧基羰基)-[gln28]艾塞那肽。隔膜封盖的125ml锥形瓶中,nh2[n28q]艾塞那肽(无α-胺)
ms:m/z=4408。
使用o-(7-叠氮基-1-(甲基磺酰基)-2-庚基)-o’-琥珀酰亚胺基碳酸酯相似地制备nα-[1-(甲基磺酰基)-7-叠氮基-2-庚氧基羰基]-艾塞那肽。ms:m/z=4461。
实施例2
制备peg水凝胶微球
使用2试剂的(2-reagent)
在50ml的
来自含癸烷的表面活性剂中微流体运行(30ml)的微球悬浮液在室温下固化24小时。去除癸烷层,并且使微球在0.1%(w/v)水性nan3(15ml)和戊烷之间分开。搅动混合物30分钟,然后通过离心分离戊烷相。然后用水(30ml)处理微球悬浮液,并用5个连续(39ml)份的戊烷洗涤。离心后,去除过量的水相,并用等体积的50%w/vtfa处理微球浆料以灭菌。通过以1000g’s离心去除微球(注意:球体在tfa中收缩并且形成紧实的沉淀,所以应当避免过度用力)。用0.125mna2hpo4(150ml)处理沉淀以使悬浮液的ph约为6.5。膨胀18小时后,通过离心回收球体,然后用5个100ml份的水以及最终5个100ml分的70%乙醇洗涤。浆料在30分钟的3000g’s下沉淀至最终浓度。吸取上清液后,将微球浆料转移至60ml注射器(bd号309653),该注射器通过鲁尔偶联件(luer)连接至另一60ml注射器,并且通过数个来回通道均匀化以将小团块分散。含有浆料的注射器被用于通过该鲁尔偶联件加载单独的10ml注射器,使用前储存于4℃。
称量3个乙腈中的0.100ml份氨基-微球浆料以确定它们的密度(0.79±0.2g/ml),然后用0.900ml的50mmnaoh在室温下处理各部分18小时以切割交联并形成[h2n-lys(nh2)-nh]4-peg20kda单体。通过tnbs试验测试各样品的总胺浓度,所述tnbs试验通过用硼酸盐缓冲液(100mm,ph9.3)将0.030ml稀释成0.120ml,然后在微量滴定板中用0.150ml含0.04%w/v钠2,4,6-三硝基苯磺酸酯的硼酸盐缓冲液处理。在25℃酶标仪中监测3小时tnbs反应在420nm处吸光度的变化,然后记录420nm处的最终吸光度。将单独含tnbs的等价反应用作背景减除,而含40、20或10um赖氨酸的反应被用作胺浓度标准。微球消化物的总氨基浓度/2提供了凝胶的游离e-胺含量。
实施例3
制备环辛炔-微球
该反应如下所示在注射反应容器中进行。向含2μmol胺/ml的mecn中的各4ml氨基-微球填充悬浮液添加1mlmecn中的32μmoldipea(4当量),以及1mlmecn中的9.6μmol(1.2当量)的1-氟代-2-环辛炔-1-羧酸五氟苯基酯(mfco-pfp)。1小时环境温度摇动后,少量(~50ul)微球从注射器出口排除,并用0.5ml的0.1m硼酸钠中的0.04%w/vtnbs(ph~9.3)(1)处理30分钟;通过与起始氨基-微球(具有深桔色的颜色)相比微球颜色匹配tnbs溶液来指示完全反应。反应后,通过添加1mlmecn中的8μmol(1当量)ac2o持续10分钟来封端微球。去除上清液后,将约2ml微球转移至第二10ml注射器,用4x3体积mecn/填充浆料体积洗涤各浆料,并且合并浆料。
实施例4
制备释放肽的peg水凝胶微球
在(schneider,等引用如上)所述的注射反应容器中进行实施例1中制备的叠氮基-接头-[n28q]艾塞那肽的偶联。向10ml注射器中30%mecn中的2.4g实施例3的mfco衍生的微球(11.2μmolmfco)的悬浮液中添加2ml30%mecn中的46mg(10.4μmol)的nα-[1-(甲基磺酰基)-7-叠氮基-2-庚氧基羰基]-[n28q]艾塞那肽的溶液。缓慢旋转混合物直至等分的od280在约24小时为恒定值。将约50%的浆料转移至第二注射器,并用4x2ml的30%mecn然后5x5ml的10mmnapi,0.04%
通过将偶联物的样品悬浮于0.1m硼酸盐中(ph9.4),通过37℃下od280中的增溶,在体内测量由微球释放的游离[n28q]艾塞那肽(图5)。观测到一级(first-order)释放,显示ph9.4处6.7小时的半衰期。这意味着ph7.4处为670小时。类似地制备加载有nα-[1-氰基-7-叠氮基-2-庚氧基羰基]-[n28q]艾塞那肽。通过将偶联物的样品悬浮于0.1m硼酸盐(ph9.4)中,然后通过37℃下od280中的增溶,在体内测量由这些微球释放的游离[n28q]艾塞那肽。观测到一级释放,显示ph9.4处16.5小时的半衰期。这意味着ph7.4处为1650小时。
使用nα-[1-氰基-7-叠氮基-2-庚氧基羰基]-[n28q]艾塞那肽,类似地制备包括经由接头连接的[n28q]艾塞那肽的微球,其中r1=cn并且r2=h(实施例1)。最终的制备物在具有0.05%
实施例5
大鼠药代动力学
通过27号针头将含实施例4中制备的微球浆料的配衡的1ml给药注射器的内含物皮下给予插管的雄性spraguedawley大鼠(~350g)的胁腹。各注射器在1.9μmol肽g-1浆料含有0.45或0.98μmol肽。在给药前以及给药后对注射器进行称重以验证递送至各大鼠的量。采集血液样品(300μl),并且将血清冷冻于-80℃直到分析。
按照生产商的方案,通过elisa测量艾塞那肽浓度(半岛实验室有限公司(peninsulalaboratoriesinc.),#s-1311)。将冷冻的血清样品在冰上解冻,并且在提供的大鼠血清中稀释5-20倍之间。标准的艾塞那肽显示ec50=0.22nm(报道为0.19nm)。将数据重复经平均并拟合至适当的药代动力学模型。通过lc-ms/ms测量血清中的[n28q]艾塞那肽浓度。
结果见图10和11。
图10示出大鼠中以水凝胶连接后给药的艾塞那肽的药代动力学(与实施例4中的那些相同,除了使用天然形式的艾塞那肽,并且其中r1=meso2)。基于体外释放动力学(t1/2=1400小时)以及已知的艾塞那肽药代动力学参数,产生预期浓度与时间的曲线(虚线)。实验数据(方块)显示与考虑了艾塞那肽在水凝胶(实线)上降解的模型更好的拟合,其中总体t1/2=190小时。
图11示出皮下给药后大鼠中实施例4的[n28q]艾塞那肽的药代动力学。组图a示出水凝胶,其中,肽使用其中r1=meso2的l连接并且得到t1/2=350小时。组图b示出水凝胶,其中,肽使用其中r1=cn的l连接并且得到t1/2=760小时。因此,在单次剂量后,[n28q]艾塞那肽的血浆水平可以维持至少一个月,而图11中的数据显示短很多的t1/2。
实施例6
口服葡萄糖耐受测试
在小鼠中确定[n28q]艾塞那肽相对于艾塞那肽提供对口服葡萄糖丸剂耐受的能力。使总计54只雄性、8周龄c57bl/6j小鼠(法国janvier)适应2周环境,然后将其分成9组(n=6)。在第0天,将小鼠禁食4小时,然后在t=-15分钟时通过皮下给予试验物质,然后在0分钟时给予葡萄糖。在-60、-15、0、15、30、60和120分钟时测量血糖。在0和15分钟时采集用于胰岛素测量的血液样品。结果示于图12和13。艾塞那肽和[n28q]艾塞那肽在口服葡萄糖耐受测试中显示相当的活性。
图12示出艾塞那肽和[n28q]艾塞那肽在口服葡萄糖耐受测试中的比较结果。在-30分钟时以5种不同浓度的毒蜥外泌肽-4和[n28q]艾塞那肽给药的c57bl/j小鼠的口服葡萄糖耐受测试中观测到艾塞那肽和[n28q]艾塞那肽清晰且相似的剂量响应。各线表示与载剂显著的不同。双向重复测量anova与载剂比较。p<0.05邦弗朗尼事后检验(bonferroniposthoctest)。每次口服的葡萄糖丸剂为10ml中的2g/kg。
图13示出对于图7中示出的口服葡萄糖耐受测试数据的auc分析。在口服葡萄糖耐受测试(ogtt)曲线数据下方区域观测到艾塞那肽和[n28q]艾塞那肽清晰且相似的剂量响应。单向anova,邦弗朗尼事后检验(bonferroniposthoctest)对比载剂。***p<0.001。
实施例7
q4wk注射的水凝胶微球偶联的[n28q]艾塞那肽与艾塞那肽连续输注的慢性葡萄糖调节作用
将总计55只雄性、6周龄且为180-200克的zucker糖尿病肥胖大鼠(zdf-leprfa/crl)(美国的查尔斯河实验室(charlesriver))单独饲养,每两周监测其血糖和体重2-4周。根据晨间喂食的血糖,排除异常值,并且将40只糖尿病大鼠(平均体重为340g,血糖为9.7-22.5mm,平均为16.2mm)分成的n=10的4组。
在t=0:
组i接受
组ii接受艾塞那肽
组iii接受皮下水凝胶微球-[n28q]艾塞那肽,其具有实施例4中所述的缓释调节剂r1=cn,0.37mg肽),以及载剂泵;
组iv接受皮下水凝胶微球-[n28q]艾塞那肽(3.7mg肽),以及载剂泵。
在第29天,即4周ogtt后两天,将泵替换并且以相同水平将水凝胶微球-[n28q]艾塞那肽皮下再给药。在第56天,移除泵,并且允许动物恢复4周。后期患上糖尿病的6只大鼠在第28天接受渗透泵中的[n28q]艾塞那肽(30μg/kg/天,acoh中,ph4.5),在第56天停止,在此之后允许动物恢复4周。
监测从第-3天到整个研究每日的体重。食物和水摄入的监测在第-3天,以及第一次给药后的前11天每天一次,然后在研究期的剩余时间每两周一次进行。针对药代动力学研究的血液采样在第一次给药后的第2天进行,然后是每周进行一次。在第-3天以及ogtt前的第26和55天测量hbac,并且在第26天进行胃排空实验。对于ogtt,将大鼠过夜半禁食(60%),然后在t=0给予po葡萄糖(10ml中的2g/kg)。葡萄糖刺激后t=-60、-15、0、15、30、60和120分钟测量血糖和胰岛素。通过在第26天以ogtt给予乙酰氨基酚(100mg/kg)测量胃排空,并且在15、30、60和120分钟测量血液水平。
结果显示在图14a-14e中。在这些图中,载剂对照(黑色),通过使用皮下泵以30ug/kg/天连续输注递送的毒蜥外泌肽-4(粉色),以220nmol肽/kg给药的pl-cmpd(灰色),以2200nmol肽/kg给药的pl-cmpd(蓝色),和通过使用皮下泵以30ug/kg/天连续输注递送的[n28q]艾塞那肽游离肽(绿色)。
图14a显示体重。
图14b以mmol/l显示血糖。
图14c显示在第4和8周进行的口服葡萄糖耐受测试的结果。
图14d显示在第4和8周的糖基化血红蛋白hba1c的水平。
图14e显示血浆中肽的水平与时间的函数。
包括[n28q]艾塞那肽的水凝胶微球制备物的单次剂量有效控制血糖至少一个月。
实施例8
大鼠和小鼠中水凝胶-微球偶联物的药代动力学
a.用等渗醋酸盐(10mm醋酸钠,143mmnacl)ph5.0,0.05%
给药前和给药后清除针头组件的空气并称重,以确定递送至各只大鼠的浆料质量;将含0.7mg肽(170nmol)的meso2调节剂130mg浆料给予各只大鼠,并且给予含2.5mg肽(580nmol)的cn调节剂400mg浆料。
在0、1、2、4、8、24、48、72、120、168、240、336、432、504、600、672小时针对两种接头采集血液样品(300μl),并且在840、1008、1176、1344、1512、1680、1848和2016小时针对具有cn调节剂的接头获得其它样品。制备血清,并冷冻于-80℃直到分析。通过lc/ms/ms分析血清[n28q]艾塞那肽。
结果示于图15a和15b。图15a用具有药物释放调节剂r1=meso2(170nmol[n28q]艾塞那肽/大鼠或2.6mg/kg)的水凝胶-[n28q]艾塞那肽微球注射后的结果;t1/2,β为310小时。图15b用具有药物释放调节剂r1=cn(600nmol[n28q]艾塞那肽/大鼠或8.9mg/kg)的水凝胶-[n28q]艾塞那肽微球注射后的结果;t1/2,β为880小时。误差线为±sem。
b.小鼠中所需的少量微球需要进行稀释以允许精确给药。使用基于双注射器反应容器{schneider公司,2016#24},[n28q]艾塞那肽-微球浆料的缓冲液(对于药物释放调节剂r1=meso2为约1ml的,对于r1=cn为4ml)被等渗醋酸盐ph5.0(10mmnaoac,143mmnacl)、25%甘油和0.05%
对于r1=meso2,将含130ug肽(30nmol)的120mg浆料sc给予18只cd-1小鼠中的每一只的胁腹(平均体重30g)。在8、24、48、72、96、120、168、240、336、408、504、576和672小时以交错的方案(staggeredschedule)由眼窝窦采集血液样品(100μl),以在各时间点进行6次重复,并且制备各自的血清。对于r1=cn,将含605μg肽(144nmol)的200mg浆料以同样的方式sc给予24只cd-1小鼠。以上述相同的时间由眼窝窦采集血液样品(100μl),并且也在840、1008、1176、1344、1512、1680、1848和2016小时以交错的方案进行,以在各时间点进行6次重复。制备血清,并冷冻于-80℃直到分析。通过lc/ms/ms分析血清[n28q]艾塞那肽。
用3体积的can处理血清样品并且离心。将上清液干燥、重建并且用于hplems/ms系统。通过含0.1%甲酸的水/acn梯度洗脱样品。[n28q]艾塞那肽的校正曲线在0.25-100ng/ml的范围内是线性的。hplc-ms/ms分析在偶联岛津(shimadzu)hplc系统的sciex5500
结果示于图16a和16b。图16a显示用具有药物释放调节剂r1=meso2(30nmol[n28q]艾塞那肽/小鼠或4.2mg/kg)的水凝胶-[n28q]艾塞那肽微球注射后的结果。图16b显示用具有药物释放调节剂r1=cn(144nmol[n28q]艾塞那肽/小鼠或20.2mg/kg)的水凝胶-[n28q]艾塞那肽微球注射后的结果。早期的点无法计算吸收相动力学,并且未用于拟合所示的β相。误差线为±sem。
使用graphpadprism通过eqx(文本)的非线性回归以1/sd2的加权对c与t曲线(文本)进行分析;因为ka>>k1,使用最初几天之后的数据点对终末半衰期的单指数相进行建模。
表2
水凝胶-[n28q]艾塞那肽微球在小鼠和大鼠中的药代动力学特性
- 还没有人留言评论。精彩留言会获得点赞!