用于利用促蠕动蛋白2激动剂和拮抗剂来治疗昼夜节律紊乱的组合物和方法与流程
本发明是在由nih、dhhs颁发的拨款第dk91916号的政府支持下作出的。政府拥有本发明的某些权利。
本发明大体涉及神经生物学和光生物学以及依赖昼夜节律的哺乳动物行为。在替代实施方式中,提供了组合物和方法,用于:改变哺乳动物的昼夜节律或时间性、治疗由于人类昼夜调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制、或引起唤醒或觉醒反应,包括将能够改变促蠕动蛋白2(pk2)表达或活性、和/或pkr2(pk2受体)、血管加压素受体(vr)和/或褪黑素受体(mr)的表达或活性的化合物或组合物给药至哺乳动物或人。在替代实施方式中,pk2激动剂给药或增加或激活了促蠕动蛋白2(pk2)、pkr2(pk2受体)、vr活性和/或mr活性的化合物或组合物给药引起或导致由哺乳动物的唤醒或觉醒反应,并且pk2拮抗剂给药或降低或失活了促蠕动蛋白2(pk2),pkr2(pk2受体)、vr活性和/或mr活性的化合物或组合物给药引起或导致哺乳动物的活动抑制和睡眠诱导。
背景技术
大约2%的人口罹患某些形式的昼夜节律紊乱,伴有睡眠或情绪症状。昼夜节律睡眠紊乱的其他示例包括时差和轮班工人综合症,其与内部昼夜节律系统相对于外部环境的失调有关。昼夜节律睡眠紊乱的另一个示例是睡眠周期提前障碍(aspd),其特征在于晚上早睡和早晨早醒(大约2-5am)。睡眠问题在一般人群中很常见,特别是对于老年人。许多老年人报告有早晨早醒,伴随有与aspd相似的一些症状。
除睡眠症状外,昼夜节律或时间性的障碍对情绪有深远的影响。现在认识到,精神紊乱中昼夜节律异常的高患病率不仅是精神症状的结果,而且还是由于昼夜节律调控系统的改变所致。季节性情感障碍的典型治疗包括抗抑郁药物和光疗法。抗抑郁药对季节性情感障碍有效性的证据是有限的。光疗法,尤其是蓝光疗法,看上去对季节性情感障碍有效。然而,光疗法是麻烦且耗时的,并且不可能成为具有慢性或复发性疾病(例如季节性情感障碍)的大多数受试者的标准疗法。
视交叉上核(scn)已被认为容纳所有哺乳动物物种的主生物钟。对于夜间哺乳动物,例如小鼠和大鼠,支持这种主张的证据非常强烈。然而,同样声称scn容纳用来昼夜节制觉醒水平调控的主时钟的证据实际上在昼夜动物(包括人类)的情况中很有限。被充分引用的松鼠猴scn损伤导致睡眠增加的工作(edgar等人,1993),被解释为scn对昼夜动物的觉醒或唤醒促进,可能是由于视网膜-下丘脑束的并发损伤。因此,除了scn之外的其他位置可以容纳调控昼夜动物(例如灵长类动物,包括人类)的觉醒水平的关键生物钟。
技术实现要素:
在替代实施方式中,提供了用于改变哺乳动物的昼夜节律性或时间性以及利用促蠕动蛋白2激动剂和拮抗剂来治疗、改善或预防昼夜节律紊乱的组合物、制品和方法。
在替代实施方式中,提供了具有如表1所公开的结构的化合物、或所述化合物的等同物、或所述化合物的立体异构体、或所述化合物的类似物、或所述化合物的药学上可接受的盐、或所述化合物的生物电子等排体。
其中所述化合物、所述化合物的等同物、所述化合物的立体异构体、所述化合物的类似物、所述化合物的药学上可接受的盐、或所述化合物的生物电子等排体充当pk2拮抗剂,或者充当能够降低促蠕动蛋白2(pk2)的活性或失活促蠕动蛋白2(pk2)、或能够充当pk2受体拮抗剂的化合物或组合物。
在替代实施方式中,提供了包含本文提供的化合物或组合物的制剂,其中任选地,所述制剂是固体、半固体、液体、气溶胶、粉末或乳液制剂。
在替代实施方式中,提供了包含本文提供的化合物或组合物的药物组合物,其中任选地所述药物组合物配制成用于肠内或肠外给药,和任选地所述化合物配制成用于体内给药;或用于肠内或肠外给药,或配置成软膏、片剂、丸剂、胶囊、凝胶、凝胶剂、液体、洗剂、气溶胶或植入物,和任选地所述化合物配制成纳米颗粒或纳米脂质颗粒。
在替代实施例中,提供了方法,所述方法用于:
-改变哺乳动物的昼夜节律或时间性,
-治疗或改善因人类昼夜节律调控系统中的或者由人类昼夜节律调控系统中功能失调或基因缺陷导致的改变、或者非野生型的人类昼夜节律调控系统或人类昼夜节律调控系统中生物反馈机制导致的精神状况或症状,
-治疗或改善与昼夜节律调控相关的神经精神疾病,
-治疗或改善哺乳动物的睡眠问题或睡眠障碍,
-诱导睡眠或活动抑制,或引起唤醒或觉醒反应,
-治疗或改善畏光,或
-治疗或改善注意力缺陷/多动障碍(adhd),
-治疗、预防或改善急性或慢性疼痛的症状,
-治疗、预防或改善癌症,其中任选地所述癌症是胶质母细胞瘤或胰腺癌,
-治疗、预防或改善炎症疾病,其中任选地所述炎症疾病是牛皮癣或关节炎,
所述方法包括:
(a)提供化合物或组合物,所述化合物或所述组合物能够充当激动剂或拮抗剂,所述激动剂或所述拮抗剂用于:
(1)改变促蠕动蛋白2(pk2)活性,
(2)改变pkr2(pk2受体)活性,
(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或
(4)改变褪黑素受体(mr)活性;和
(b)将(a)的化合物或组合物中的一种或任一组合给药至有需要的哺乳动物或人,
其中任选地,所述组合包含pkr2和vr;pkr2和mr;pkr2和pk2;vr和pk2;mr和pk2;mr和vr;或者pkr2、vr和mr的激动剂或拮抗剂,
以及任选地,所述前动力蛋白(pk2)受体拮抗剂是如在uspn8,722,896中所公开的化合物、或具有如式1所公开的结构的化合物、或权利要求1所述的化合物;或如在美国专利申请公开第2015/0111922号、或美国专利申请公开第2014/0038968号、或uspn7,855,201(或wo2007067511,pct/us2006/046330)中所述的化合物,
以及任选地,所述褪黑素受体(mr)拮抗剂是如在uspn8,907,126或wo/2014/103998中所公开的化合物,
以及任选地,所述血管加压素受体(vr)拮抗剂是如在us2016-0221944a1、us2015-0073032a1或wo/2015/036160中所公开的化合物,
其中pk2激动剂给药或者能够增加或激活促蠕动蛋白2(pk2)或pkr2(pk2受体)的化合物或组合物给药引起或导致人或哺乳动物的唤醒或觉醒反应,
其中vr激动剂给药或者能够增加或激活vr活性的化合物或组合物给药引起或导致人或哺乳动物的唤醒或觉醒反应,
其中mr激动剂给药或者能够增加或激活mr活性的化合物或组合物给药引起或导致人或哺乳动物的唤醒或觉醒反应,
pk2拮抗剂给药或者能够降低或失活促蠕动蛋白2(pk2)或pkr2(pk2受体)的化合物或组合物给药引起或导致人或哺乳动物的活动抑制和睡眠诱导,
vr拮抗剂给药或者能够降低或失活vr活性的化合物或组合物给药引起或导致人或哺乳动物的活动抑制和睡眠诱导,
mr拮抗剂给药或者能够降低或失活mr活性的化合物或组合物给药引起或导致人或哺乳动物的活动抑制和睡眠诱导,和
拮抗剂给药或者能够降低或失活促蠕动蛋白2(pk2)、pkr2(pk2受体)、vr活性、和/或mr活性的化合物或组合物给药引起或导致:
-治疗或改善与昼夜节律调控相关的神经精神疾病,
-治疗或改善畏光,或
-治疗或改善注意力缺陷/多动障碍(adhd),
-治疗、预防或改善急性或慢性疼痛的症状,
-治疗、预防或改善癌症,其中任选地所述癌症是胶质母细胞瘤或胰腺癌,
-治疗、预防或改善炎症疾病,其中任选地,所述炎症疾病是牛皮癣或关节炎。
在替代实施方式中,与昼夜节律的调控相关的所述神经精神疾病包括:情绪障碍;抑郁;时差;轮班工人综合症;睡眠周期提前障碍(aspd);季节性情感障碍(sad);家族性睡眠周期提前综合征;延迟睡眠阶段型、不规则睡眠-觉醒型或非24小时睡眠-觉醒型昼夜节律睡眠障碍。
在替代实施方式中,所述化合物或组合物配制成药物组合物,任选地配制成用于肠内或肠外给药,任选地配制成用于体内给药或口服给药、粘膜给药或鼻内给药,任选地配制成软膏、片剂、丸剂、胶囊、凝胶、软膏、凝胶剂、糖浆、浆液、悬浮液、液体、洗剂、气溶胶或植入物,并且任选地所述化合物配制成颗粒、脂质体、纳米颗粒或纳米脂质颗粒。
在替代实施方式中,所述化合物或组合物配制成用于注射,任选地通过皮下(ic)、肌肉(im)、静脉(iv)和/或皮内注射或输注。在替代实施方式中,所述化合物或组合物配制成用于局部或粘膜给药,任选地配制成凝胶、外用药、软膏、喷雾剂、滴眼剂或软膏。在替代实施方式中,所述组合物、化合物或制剂通过口服、肠外、通过吸入喷雾、经鼻、局部、鞘内、鞘内、脑内、硬膜外、颅内或直肠给药。
在替代实施方式中,所述激动剂或拮抗剂组合物或化合物是抗体,所述抗体特异性结合促蠕动蛋白2(pk2)、pkr2(pk2受体)、血管加压素受体(vr)或褪黑素受体(mr),并且要么抑制pk2、pkr2、vr或mr活性或表达,要么增加或维持pk2、pkr2、vr或mr活性或表达。
在替代实施方式中,所述激动剂或拮抗剂组合物或化合物是核酸,所述核酸特异性结合促蠕动蛋白2(pk2)、pkr2(pk2受体)、血管加压素受体(vr)、或褪黑素受体(mr)基因或转录物;和/或要么抑制pk2、pkr2、vr或mr活性或表达,要么增加或维持pk2、pkr2、vr或mr活性或表达,并且任选地,所述拮抗剂是抑制性核酸,其中任选地,所述抑制性核酸是sirna或反义寡核苷酸。
在替代实施方式中,其中所述激动剂或拮抗剂组合物或化合物是小分子、蛋白质、肽、碳水化合物或脂质,所述小分子、所述蛋白质、所述肽、所述碳水化合物或所述脂质特异性结合促蠕动蛋白2(pk2)、pkr2(pk2受体)、血管加压素受体(vr)或褪黑素受体(mr)基因或转录物,和/或要么抑制pk2、pkr2、vr或mr活性或表达,要么增加或维持pk2、pkr2、vr或mr活动或表达。
在替代实施方式中,提供了治疗组合,用于
-改变哺乳动物的昼夜节律或时间性,
-治疗或改善因人类昼夜节律调控系统中的或者由人类昼夜节律调控系统中功能失调或基因缺陷导致的改变、或者非野生型的人类昼夜节律调控系统或人类昼夜节律调控系统中生物反馈机制导致的精神状况或症状,
-治疗或改善与昼夜节律调控相关的神经精神疾病,
-治疗或改善哺乳动物的睡眠问题或睡眠障碍,
-诱导睡眠或活动抑制,或引起觉醒或觉醒反应,
-治疗或改善畏光,或
-治疗或改善注意力缺陷/多动障碍(adhd),
-治疗、预防或改善急性或慢性疼痛的症状,
-治疗、预防或改善癌症,其中任选地所述癌症是胶质母细胞瘤或胰腺癌,
-治疗、预防或改善炎症疾病,其中任选地所述炎症疾病是牛皮癣或关节炎,
其中所述治疗组合包含两种或更多种化合物或组合物,其中所述两种或更多种化合物或组合物能够完成以下至少一种:
(1)改变促蠕动蛋白2(pk2)活性,
(2)改变pkr2(pk2受体),
(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或
(4)改变褪黑素受体(mr)活性;和
其中任选地,所述组合包含pkr2和vr;pkr2和mr;pkr2和pk2;vr和pk2;mr和pk2;或者,pkr2、vr和mr的激动剂或拮抗剂,
以及任选地,所述前动力蛋白(pk2)受体拮抗剂是如在uspn8,722,896中所公开的化合物、或具有如式1所公开的结构的化合物、或权利要求1所述的化合物;或如在美国专利申请公开第2015/0111922号、或美国专利申请公开第2014/0038968号、或uspn7,855,201(或wo2007067511,pct/us2006/046330)中所述的化合物,
以及任选地,所述褪黑素受体(mr)拮抗剂是如在uspn8,907,126或wo/2014/103998中所公开的化合物,
以及任选地,所述血管加压素受体(vr)拮抗剂是如在us2016-0221944a1、us2015-0073032a1或wo/2015/036160中所公开的化合物。
在替代实施方式中,提供了试剂盒,所述试剂盒包含:本文提供的组合物、本文提供的制剂、本文提供的药物组合物、本文提供的治疗组合、或能够完成以下至少一种的化合物或组合物:
(1)改变促蠕动蛋白2(pk2)活性,
(2)改变pkr2(pk2受体),
(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或
(4)改变褪黑素受体(mr)活性;和
其中任选地,所述组合包含pkr2和vr;pkr2和mr;pkr2和pk2;vr和pk2;mr和pk2;或者pkr2、vr和mr的激动剂或拮抗剂,
以及任选地,所述前动力蛋白(pk2)受体拮抗剂是如在uspn8,722,896中所公开的化合物、或具有如式1所公开的结构的化合物、或权利要求1所述的化合物;或如在美国专利申请公开第2015/0111922号、或美国专利申请公开第2014/0038968号、或uspn7,855,201(或wo2007067511,pct/us2006/046330)中所述的化合物,
以及任选地,所述褪黑素受体(mr)拮抗剂是如在uspn8,907,126或wo/2014/103998中所公开的化合物,
以及任选地,所述血管加压素受体(vr)拮抗剂是如在us2016-0221944a1、us2015-0073032a1或wo/2015/036160中所公开的化合物。
在替代实施方式中,提供了制品,所述制品包含:本文提供的组合物、本文提供的制剂、本文提供的药物组合物、本文提供的治疗组合、或能够完成以下至少一种的化合物或组合物:
(1)改变促蠕动蛋白2(pk2)活性,
(2)改变pkr2(pk2受体),
(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或
(4)改变褪黑素受体(mr)活性;和
其中任选地,所述组合包含pkr2和vr;pkr2和mr;pkr2和pk2;vr和pk2;mr和pk2;或者pkr2、vr和mr的激动剂或拮抗剂,
以及任选地,所述前动力蛋白(pk2)受体拮抗剂是如在uspn8,722,896中所公开的化合物、或具有如式1所公开的结构的化合物、或权利要求1所述的化合物;或如在美国专利申请公开第2015/0111922号、或美国专利申请公开第2014/0038968号、或uspn7,855,201(或wo2007067511,pct/us2006/046330)中所述的化合物,
以及任选地,所述褪黑素受体(mr)拮抗剂是如在uspn8,907,126或wo/2014/103998中所公开的化合物,
以及任选地,所述血管加压素受体(vr)拮抗剂是如在us2016-0221944a1、us2015-0073032a1或wo/2015/036160中所公开的化合物,
并且任选地,所述制品是试剂盒、泵、装置、皮下输注装置、连续皮下输注装置、输注笔、针、储液器、安瓿、小瓶、注射器、药筒、笔、一次性笔或无针注射器、预填充笔或注射器或药筒、药筒或一次性笔或无针注射器、两室或多室泵。
在替代实施方式中,提供了本文提供的组合物、本文提供的制剂、本文提供的药物组合物、本文提供的治疗组合、或能够完成以下至少一种的化合物或组合物:
1)改变促蠕动蛋白2(pk2)活性,
(2)改变pkr2(pk2受体),
(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或
(4)改变褪黑素受体(mr)活性;
在制造药剂时的用途,
并且可选地用于:
-改变哺乳动物的昼夜节律或时间性,
-治疗或改善因人类昼夜节律调控系统中的或者由人类昼夜节律调控系统中功能失调或基因缺陷导致的改变、或者非野生型的人类昼夜节律调控系统或人类昼夜节律调控系统中生物反馈机制导致的精神状况或症状,
-治疗或改善与昼夜节律调控相关的神经精神疾病,
-治疗或改善哺乳动物的睡眠问题或睡眠障碍,
-诱导睡眠或活动抑制,或引起觉醒或觉醒反应,
-治疗或改善畏光,或
-治疗或改善注意力缺陷/多动障碍(adhd),
-治疗、预防或改善急性或慢性疼痛的症状,
-治疗、预防或改善癌症,其中任选地所述癌症是胶质母细胞瘤或胰腺癌,
-治疗、预防或改善炎症疾病,其中任选地所述炎症疾病是牛皮癣或关节炎。
在替代实施方式中,用作药剂的化合物、配方、制品或组合物,
并且任选地,所述药剂用于:
-改变哺乳动物的昼夜节律时间性,
-治疗或改善因人类昼夜节律调控系统中的或者由人类昼夜节律调控系统中功能失调或基因缺陷导致的改变、或者非野生型的人类昼夜节律调控系统或人类昼夜节律调控系统中生物反馈机制导致的精神状况或症状,
-治疗或改善与昼夜节律调控相关的神经精神疾病,
-治疗或改善哺乳动物的睡眠问题或睡眠障碍,
-诱导睡眠或活动抑制,或引起觉醒或觉醒反应,
-治疗或改善畏光,或
-治疗或改善注意力缺陷/多动障碍(adhd),
-治疗、预防或改善急性或慢性疼痛的症状,
-治疗、预防或改善癌症,其中任选地所述癌症是胶质母细胞瘤或胰腺癌,
-治疗、预防或改善炎症疾病,其中任选地所述炎症疾病是牛皮癣或关节炎
和
所述化合物、配方、制品或组合物包含:本文提供的组合物、本文提供的制剂、本文提供的药物组合物、本文提供的治疗组合、或能够完成以下至少一种的化合物或组合物:
(1)改变促蠕动蛋白2(pk2)活性,
(2)改变pkr2(pk2受体),
(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或
(4)改变褪黑素受体(mr)活性;
或本文提供的试剂盒、或本文提供的制品,
在随附的附图和以下描述中公开了本发明的一个或多个示例性实施方式的细节。根据说明书和附图以及权利要求书,本发明的其他特征、目的和优点将显而易见。
为了各种目的,本文引用的所有出版物、专利、专利申请均通过引用明确并入本文。
附图说明
本文公开的附图是对本文提供的示例性实施方式的说明,并不意味着限制由权利要求书所涵盖的本发明的范围。
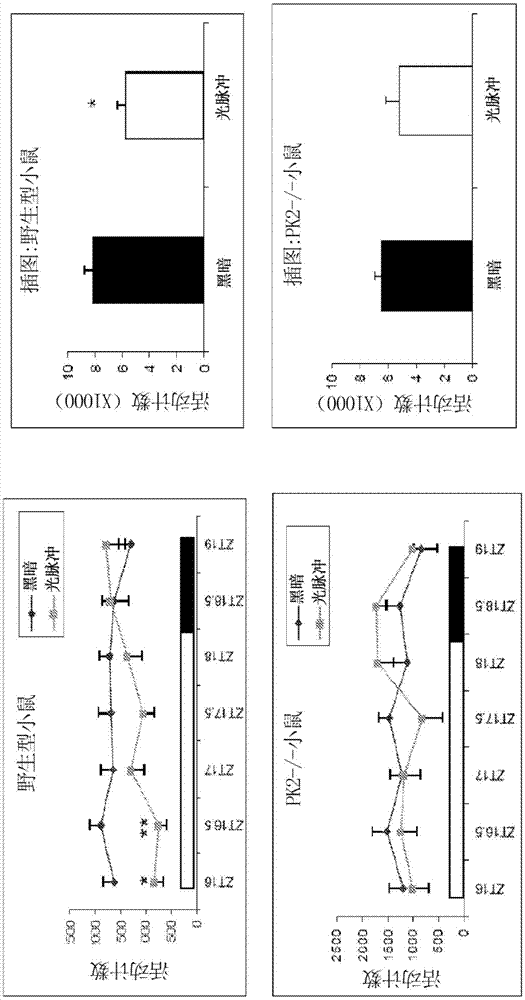
图1a-b图示说明来自研究的数据,所述研究检查了光脉冲对pk2-/-小鼠的运动活动和唤醒水平的抑制效果。图1a示出活动计数作为暴露于光或黑暗的函数,当在黑暗中期期间向野生型小鼠施加光脉冲(150lux)时(如zt16-zt18.5所示),运动活动显著;与之相反,对于pk2-/-小鼠,仅观察到光脉冲对运动活动的微不足道的抑制;图1b示出以分钟为单位的觉醒时间作为暴露于光或黑暗的函数,eeg/emg记录显示光脉冲抑制野生型小鼠或pk2-/-小鼠的觉醒,如下文实施例1中详细描述的一样。
图2a-b图示说明来自研究的数据,所述研究将作为暴露于黑暗和昏暗光的函数的活动计数和觉醒时间进行比较。对于pk2-/-小鼠,昏暗光和黑暗下的觉醒时间非常相似,表明在没有pk2信号传导的情况下,昏暗光仅会导致微不足道的唤醒抑制,如下面实施例1中详细描述的一样。对于野生型小鼠,在这四个小时的昏暗光期间活动计数和保持觉醒的时间与在黑暗中相比大幅减少,显示出昏暗光的强烈睡眠诱导效果,如下面实施例1中详细描述的一样。
图3a-d图解表达pk2的视网膜神经节细胞的图像,其中检查了iprgc中pk2的表达:图3a示出pk2在一些视网膜神经节细胞中强烈表达,并且进一步的共免疫染色研究表明所有opn4阳性视网膜神经节细胞表达pk2,(图3b);图3c示出hoeschst染色(其染色dna)的图像,并且图3d是图3a-c的合并图像,如下面实施例1中详细描述的一样。
图4a-d图解昼夜猴的视网膜神经节细胞的图像:图4a示出猴iprgc中的pk2染色;图4b示出相同视网膜神经节细胞中的opn4染色;图4c示出视网膜神经节细胞中的hoeschst染色;和图4d是图4a-c的合并图像,示出pk2在猴iprgc中与opn4共表达,如下文实施例1中详细描述的一样。
图5a-d图解小鼠脑和猴脑中pkr2表达的图像:图5a示出pkr2染色,表现出pkr2仅在背侧scn中表达,但在猴脑的腹侧scn中未检测到;图5b示出pkr2染色,表现出pkr2在整个scn中表达,覆盖小鼠脑scn的腹侧和背侧区室两者:图5c示出pkr2染色,表现出pkr2在猴脑中sc的表面层中稳健表达;图5d示出pkr2染色,表现出在小鼠脑的sc中未检测到pkr2表达,如下文实施例1中详细描述的一样。
图6a-c用图像图解来自研究的数据,所述研究检查了合成的pk2拮抗剂pkra83对小鼠和猴的唤醒水平的效果:图6a和图6b图解示出pkra83给药显著增加小鼠的运动活动(图6a)和觉醒(图6b)的数据;图6c图解示出在猴中pk2拮抗剂给药导致睡眠时间显著增加的数据,如下文实施例1中详细描述的一样。
图7a-b图解示出小鼠视网膜的视网膜神经节细胞中pk2表达的图像;图7a是两个pk2阳性视网膜神经节细胞的实例,一个未移位的和一个移位的pk2阳性视网膜神经节细胞用箭头标记;图7b是两个pk2阳性视网膜神经节细胞的实例,一个强烈染色的和一个更适度染色的,用箭头标记,如下面实施例1中详细描述的一样。
图8图解示出通过iprgc的pk2信号转导到脑靶标上的差异唤醒调控的图,如下文实施例1中详细描述的一样。
图9a-b图解示出在连续黑暗期间视网膜外核层中pk2表达被发现增加的图像,其中图像表现出与zt4(图9a)相比视网膜外核层中pk2在ct4处(图9b)的上调,示出了pk2免疫染色;框区域表示小鼠视网膜的外段;核复染示出为蓝色,如下面实施例1中详细描述的一样。
图10a-b用图像图解iprgc中pk2的时钟依赖性振荡表达:图10a图解pk2的免疫荧光强度的数据和相应图像被定量并示出为平均值±sem;图10b图解数据和相应的图像,表现出bmal1缺陷型小鼠(bmalko)的iprgc中的pk2水平始终较低,并且未显示出明显的振荡;柱上方的插图示出iprgc的pk2免疫染色(绿色)的代表性图像,并且核复染色显示为蓝色,如下文实施例1中详细描述的一样。
图11a-d图解原位杂交的图像,表现出作为pk2受体的pkr2在特定视网膜神经节细胞中表达:图11a示出视网膜神经节细胞层中的pkr2信号;图11b示出了图11a的框区域的更高放大率图像;在图11b中,pkr2阳性的个别视网膜神经节细胞是明显的;图11c和图11d示出分别对应于图11a和图11b的眼部的尼氏染色,如下面的实施例2中详细描述的一样。
图12用图像图解数据,所述数据示出在深夜期间pk2缺陷(pk2-/-)小鼠的觉醒水平增加,其表现出在深夜期间(zt20-zt24)pk2-/-小鼠的觉醒增加,如在下面的实施例2中详细地描述的一样。
图13用图像图解数据,所述数据示出pk2拮抗剂(pkra)的眼局部递送与对照小鼠(未给予拮抗剂)相比增加了pkra给药的小鼠的运动活动,如下文实施例2中详细描述的一样。
图14用图像图解数据,所述数据示出与对照小鼠(未给予拮抗剂)相比pk2拮抗剂(pkra)对小鼠唤醒水平的效果,如下文实施例2中详细描述的一样。
图15用图像图解数据,所述数据示出与对照(未给予拮抗剂)相比pk2拮抗剂(pkra83)对猴睡眠的效果,如下文实施例2中详细描述的一样。
图16图解示出iprgc的分子机制、偶联和策略位置及它们与用来控制夜间和昼夜哺乳动物的唤醒水平的关键脑中心的关系的图,如下文实施例2中详细描述的一样。
图17图解示出视网膜外核层中血管加压素(avp)在ct4上调的图像,其中左上图示出pk2染色,右上图示出avp染色,左下图示出hoeschst染色,并且右下图是其他三个图的合并图像,如下面的示例2中详细描述的一样。
图18图解血管加压素(avp)也在iprgc中表达,其中左上图示出pk2染色,右上图示出avp染色,左下图示出hoeschst染色,并且右下图是其他三个图的合并图像,如下面实施例2中详细描述的一样。
图19用图像图解pkra给药的猴与对照(无拮抗剂)的睡眠时间数据,示出pk2受体拮抗剂的鼻腔施用促进了猴的睡眠,如下文实施例2中详细描述的一样。
各附图中类似的参考符号表示类似的元件。
具体实施方式
在替代实施方式中,提供了组合物和方法,所述组合物和所述方法用于:改变哺乳动物的昼夜节律或时间性,治疗由于人类昼夜调控系统的改变引起的精神状况或症状,治疗哺乳动物的睡眠问题,或者诱导睡眠或活动抑制,或者引起唤醒或觉醒反应,包括将能够改变促蠕动蛋白2(pk2)活性的化合物或组合物给药至哺乳动物或人。虽然本发明不受任何特定作用机制的限制,但提供了组合物和方法,所述组合物和所述方法靶向和改变在内在光敏视网膜神经节细胞中表达的受体的活性或激活或者受体信号传导的抑制或激活结果,用于治疗比如某些中枢神经疾病,如渗漏、情绪障碍和其他与昼夜节律调控有关的神经精神疾病。
本文首次描述的是pk2偶联内在光敏视网膜神经节细胞(iprgc)并且还向iprgc的脑靶标发出信号以调控唤醒水平和睡眠/觉醒周期。iprgc的分子机制和策略位置使iprgc能够整合生物钟信息和环境光照/黑暗条件。iprgc投射到大脑中心,如上丘,大脑中心对于唤醒水平和睡眠觉醒周期的调控至关重要,特别是对于昼夜哺乳动物,包括人类。iprgc的药理学靶向,特别是如本文提供的iprgc中表达的受体,提供了用于治疗相关中枢神经疾病,特别是睡眠和情绪障碍(如季节性情感障碍和双相情感障碍)的途径。
本文首次描述的是这样的数据,所述数据示出内在光敏视网膜神经节细胞(iprgc)对于调控昼夜哺乳动物的昼夜节律以调控觉醒和睡眠是至关重要的,iprgc的活性可以通过调控促蠕动蛋白2(pk2)信号传导来改变,如本文所述。本文提供了用于调控iprgc的pk2信号传导以调控觉醒和睡眠的方法。
我们已经发现内在光敏视网膜神经节细胞(iprgc)在环境光照黑暗条件下容纳昼夜动物的主生物钟之一。特别地,我们已经表明,时钟输出分子促蠕动蛋白2(pk2)在小鼠(图3)和猴(图4)的iprgc中表达。iprgc是介导光掩蔽和光夹带的光通道。iprgc直接通过自身的光色素并间接通过视网膜外段的经典光感受器来感知光。来自iprgc的pk2信号传导对视交叉上核(腹侧scn)的视网膜受体区室有影响,并且还对中脑的上丘(sc)有影响。在小鼠脑中,pkr2(pk2受体)在视网膜受体scn中稳健表达,但在sc中基本上不存在,因此pk2信号传导主要通过iprgc-scn途径运送。与之相反,pkr2不在猴脑的视网膜受体腹侧scn中表达,而是在sc的视网膜受体表面层中强烈表达。因此,猴中iprgc的pk2信号传导通过iprgc-sc途径运送。总之,pk2信号传导刺激昼夜猴的唤醒水平和抑制夜间小鼠(参见下面的图8,实施例1)。
iprgc-sc途径经由投射到通过外侧后方/pulvinar丘脑传送的皮质区域或经由脑干中的网状激活系统来调控唤醒水平。iprgc-sc途径的pk2信号传导可能刺激夜间小鼠和昼夜猴两者的唤醒水平。在诸如大鼠和小鼠之类的夜间动物中,通过光对iprgc-sc途径的唤醒刺激可能相对较小(短暂但不持久)。这与小鼠脑的sc中不存在pkr2(pk2受体)表达一致。值得注意的是,与诸如小鼠之类的夜间哺乳动物相比,sc的总体大小、丘脑和相关皮质的侧向正片/pulvinar复合体在诸如灵长类动物的昼夜哺乳动物中都显著放大和扩展。scn(腹侧和背侧两者)中的pk2途径可能直接或间接地投射到诸如下丘脑的腹外侧视前核、下丘脑外侧和蓝斑之类的唤醒中心。iprgc-scn途径的pk2信号传导途径(包括pkr2(pk2受体))明显抑制夜间小鼠的唤醒水平。我们的发现表明,哺乳动物的昼夜/夜间确定是由iprgc的差异信号传导至它们的脑靶标上所介导的。已知猴scn中的pk2以与小鼠相同的相振荡(burton等人,2016)。
制品和试剂盒
提供了制品和试剂盒,所述制品和所述试剂盒包含本文提供的治疗组合,或本文提供的化合物或组合物,例如药物组合物,用于:(1)改变促蠕动蛋白2(pk2)活性,(2)改变pkr2(pk2受体),(3)改变血管加压素受体(vr)活性,其中任选地所述vr为v1a型vr或v1b型vr,或(4)改变褪黑素受体(mr)活性;并且其中任选地,所述组合包含pkr2和vr;pkr2和mr;pkr2和pk2;vr和pk2;mr和pk2;或者,pkr2、vr和mr的激动剂或拮抗剂。
在替代实施方式中,所述试剂盒还包含用于实施本文提供的方法的说明书。
将参考本文描述的实施例进一步描述本发明;然而,应该理解,本发明不限于这些实施例。
实施例
实施例1:用于哺乳动物昼夜和夜间确定的新型神经和分子机制
该实施例证明,本文提供的方法对以下方面是有效的:改变哺乳动物的昼夜节律性或时间性、治疗由于人类昼夜调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制,或引起觉醒或觉醒反应。本文首次描述了用于哺乳动物昼夜和夜间确定的新型神经和分子机制。在此,我们证明了先前显示为视交叉上生物钟的输出分子的促蠕动蛋白2(pk2)在内在光敏视网膜神经节细胞中表达,并且pk2信号传导是小鼠中光导致的活动和唤醒抑制所需的。在夜间小鼠和昼夜猴之间,pk2的信号传导受体显示为在视网膜受体视交叉上核和上丘,即内在光敏视网膜神经节细胞的脑投射靶中差异表达。用选择性拮抗剂阻断揭示了pk2信号传导分别对夜间小鼠和昼夜猴的觉醒水平具有抑制效果和刺激效果。因此,哺乳动物的昼夜性或夜间性通过pk2从内在光敏视网膜神经节细胞差异信号传导到其视网膜受体脑靶标上来确定。
在该实施例中,我们示出了pk2(先前显示为重要scn输出信号的分子)内在光敏视网膜神经节细胞(iprgc)中与黑视蛋白(opn4)共表达。我们进一步示出了pk2信号传导是小鼠持续的光诱导活动抑制和睡眠诱导所必需的。用pk2拮抗剂阻断证明了pk2信号传导对夜间小鼠和昼夜猴的觉醒水平的相反效果。结合观察到的pk2信号传导受体在夜间小鼠和昼夜猴之间的iprgc的视网膜受体脑靶标中的差异表达,哺乳动物的昼夜/夜间确定可能位于scn时钟上游的视网膜-脑输入途径中。
结果
1.pk2信号传导是小鼠持续的光诱导抑制运动活动和唤醒所必需的。
在基因中要么缺乏pk2(pk2-/-)要么缺乏其受体(pkr2)的小鼠在恒定黑暗条件下已减少了运动活动的昼夜节律29,30。我们观察到pk2-/-小鼠在光照/黑暗(ld)循环条件下也表现出增加的白天运动活动,这与先前观察到在光照时期间pk2-/-小鼠中增加的觉醒一致31。这些观察结果暗示着,在没有pk2信号传导的情况下,光抑制效果是异常的。因此,我们检查了光脉冲对pk2-/-小鼠的运动活动和唤醒水平的抑制效果。当在黑暗中期(zt16-zt18.5)期间向野生型小鼠施加光脉冲(150lux)时,运动活动被显著抑制(图1a)。与之相反,对于pk2-/-小鼠,仅观察到光脉冲对运动活动的微不足道的抑制(图1a和插图)。正如预期的那样,eeg/emg记录显示光脉冲抑制野生型小鼠的觉醒(图1b和插图)。对于pk2-/-小鼠,对觉醒的光抑制仅在前30分钟内是显著的(图1b)。因此,光仍然可以抑制pk2-/-小鼠的觉醒,但不能维持抑制效果。
我们进一步研究了昏暗光对运动活动和唤醒水平的抑制效果。就在zt12的常规约150lux照度条件结束之前,在对应于zt12-zt16的四小时期间,光强度变暗至~30lux。这种减少的光照连续地抑制了野生型小鼠的运动活动(图2a和插图)。与之相反,pk2-/-小鼠表现出非常稳健的运动活动以响应光强度降低,实现了与黑暗下相当的活动水平(图2a)。该观察结果表明,在较晚的活动的高稳态驱动下,昏暗光不再能够显著抑制pk2-/-小鼠中的运动活动。eeg/emg记录证实了这种昏暗光治疗所影响的相应唤醒水平。对于野生型小鼠,在这四小时的昏暗光下保持觉醒的时间远远少于在黑暗中,显示出昏暗光的强烈睡眠诱导效果(图2a)。对于pk2-/-小鼠,在昏暗光和黑暗条件下的觉醒时间非常相似,表明在没有pk2信号传导的情况下,昏暗光仅引起微不足道的唤醒抑制(图2b)。
2.pk2在内在光敏视网膜神经节细胞中的表达
光对pk2-/-小鼠的唤醒水平和运动活动的抑制作用减弱表明pk2信号传导可能参与iprgc-脑神经途径,因为iprgc已被证明是用于光的非视觉功能(包括运动活动抑制和睡眠诱导)的中枢传递的光通道22,23,24,25,32,33。因此我们检查了iprgc中pk2的可能表达。如图3a和图7)所示,pk2在一些视网膜神经节细胞中强烈表达。进一步的共免疫染色研究表明,所有opn4阳性视网膜神经节细胞表达pk2(28/28细胞,图3)。pk2和opn4在iprgc中约100%的共表达表明iprgc的pk2投射到scn和脑的其他非视觉光功能区域,例如上丘34,35,36。
3.pk2受体在夜间小鼠与昼夜猴之间的内在光敏视网膜神经节细胞的脑靶标中的差异表达
与夜间小鼠一样,在昼夜猴的视网膜神经节细胞中也检测到pk2表达(图4a)。也与小鼠相同,pk2在猴iprgc中与opn4共表达(图4b/d)。重要的是,对于夜间小鼠和昼夜猴,观察到pkr2(脑pk2受体)在scn区室中的差异表达。在小鼠脑中,pkr2在整个scn中表达,覆盖scn的腹侧和背侧区室两者(图5b)6,37。已示出腹侧scn是视网膜受体,即接收用于光掩蔽和生物钟夹带的视网膜输入9,38。pkr2在小鼠的视网膜受体scn中的表达表明小鼠腹侧scn可能响应来自iprgc的pk2信号。我们先前的电生理学研究已示出pk2增加表达pkr2的神经元的电活动39,40。在猴脑中,pkr2仅在背侧scn中表达,但未在腹侧scn中检测到(图5a)。与夜间动物一样,腹侧scn已被示出为scn时钟的视网膜受体区室38,41。pkr2在腹侧scn中表达的缺失表明猴scn不能响应来自iprgc的pk2信号。小鼠和猴脑之间pkr2的不同表达也在上丘(sc)中观察到,上丘是iprgc的另一个重要的非视觉脑靶标34,35,36。如图5c所示,pkr2在猴脑中sc的表面层中稳健地表达。已知sc的表面层接收来自视网膜神经节细胞(包括iprgc)的输入34,35,36。与之相反,在小鼠脑的sc中未检测到pkr2表达(图5d),表明小鼠中不存在通过iprgc-sc的pk2信号传导。
4.pk2阻断对夜间小鼠和昼夜猴的觉醒水平的相反效果
接下来我们检查了合成的pk2拮抗剂pkra83对小鼠和猴的唤醒水平的效果。如图6a和图6b所示,pkra83给药显著增加小鼠的运动活动和觉醒。这些结果与先前观察到的pk2-/-小鼠的觉醒增加一致31。因此,pk2信号对夜间小鼠的唤醒水平是整体抑制的。与之相反,在猴中pk2拮抗剂给药导致睡眠时间显著增加(>70分钟)(图6c),表明pk2信号刺激昼夜猴的唤醒水平。
结论
我们已示出pk2在集中投射的iprgc中表达。由于iprgc是用于光的非视觉功能的中心传递的唯一光通道,因此pk2-/-小鼠中持续的光诱导活动抑制和睡眠诱导的缺失表明iprgc的pk2信号传导对于传播光对夜间小鼠唤醒调控的效果至关重要。通过pk2拮抗剂给药阻断pk2信号传导证明了pk2信号对唤醒水平的相反效果:对夜间小鼠具有抑制作用而对昼夜猴具有刺激作用。总之,这些结果表明,夜间和昼夜趋异的机制在于iprgc的差异pk2信号传导至其脑靶标上(图8)。
iprgc的pk2信号传导可能通过对iprgc的脑靶标(特别是scn和sc)的影响来调控唤醒水平。然后,pk2受体(pkr2)在scn的视网膜受体区室和sc的视网膜受体表面层中的差异表达可能导致光对夜间小鼠和昼夜猴之间的唤醒水平的相反效果。在小鼠脑中,pkr2在视网膜受体scn中稳健表达,但在sc中不存在,并且iprgc的pk2信号传导因此流经夜间小鼠中抑制唤醒的iprgc-scn途径。与之相反,pkr2未在猴脑的视网膜受体腹侧scn中表达,而是在sc的视网膜受体表面层中强烈表达,因此iprgc-sc途径在昼夜猴中占主导地位。
iprgc-sc途径的pk2信号传导可能刺激唤醒水平。sc之前已被认为是光诱导的唤醒或与增加的唤醒密切相关的其他更高级的大脑功能(例如注意力)的关键核42,43,44,45。sc可经由上行投射至通过丘脑的外侧后方/pulvinar复合体传送的皮质来介导光驱动的唤醒46,47。或者,sc可以通过下行投射至中脑网状结构来促进唤醒,中脑网状结构是上行激活系统的重要组成部分42,43,44,45。在猴中,已发现sc的双侧损伤会极大地影响唤醒水平,包括对光的响应42。大鼠的损伤研究表明,sc对于eeg去同步(唤醒)以响应闪光来说很重要43。这项大鼠损伤研究暗示,为响应闪光,iprgc-sc途径可能刺激夜间动物的唤醒水平,至少短暂地。总体而言,由于抑制性iprgc-scn途径占主导地位,光抑制夜间动物的唤醒水平。众所周知,与夜间动物相比,sc的总体大小、丘脑的外侧后方/pulvinar复合体以及相关的皮质都在昼夜哺乳动物物种(例如灵长类动物)中显著放大和扩展48,49。由于哺乳动物物种被认为开始是夜间活动50,哺乳动物的昼夜性可能通过增强刺激唤醒的视网膜-sc途径和同时减弱抑制唤醒的视网膜-scn途径而进化。该模型表明夜间/昼夜确定位于scn生物钟的上游,因此可能不需要scn时钟下游的趋异信号传导。
方法
动物:pk2-/-小鼠和它们在混合遗传背景中的同窝野生型对照如所述产生29,31。小鼠以libo喂养并以常规光照/黑暗循环圈养,在早上7:00开启光(约150lux白光)(zeitgeber时间zt0,光照期zt0-zt12)并在晚上7:00关灯(zt12,黑暗期zt12-zt0)。所有动物程序均经适当的机构动物使用委员会批准。
测量和分析小鼠的运动活动:如所描述的那样实施运动活动的监测29。简而言之,将小鼠单独圈养在装有用于监测运动活动的红外线束的笼子中(accuscaninstrumentinc.columbus,oh)。将小鼠圈养在规则的12小时光照(约150lux白光):12小时黑暗的循环下。将运动活型性记录为每10分钟间隔的计数,并在30或60分钟的pin中进行分析。施加指定强度的光脉冲或昏暗光。
测量和分析小鼠的觉醒水平:如描述的那样植入用于记录脑电图(eeg)和肌电图(emg)信号的电极29,31。将小鼠连接到用于收集eeg/emg信号的系绳/换向器系统的旋转系统(plasticsone,roanoke,va)。使用grassmodel78tm(grassinstruments,westwarwick,ri)扩增eeg/emg信号并过滤(eeg:0.3-100hz,emg:30-300hz),然后以128hz的采样速率进行数字化,存储在计算机上。收集睡眠数据后,如所述,用sleepsigntm软件睡眠评分系统(kisseicomtecamerica,irvine,ca)对eeg/emg记录进行评分31。将小鼠圈养在常规的12小时(hr)光照/12小时黑暗的循环下。施加指定强度的光脉冲或昏暗光。
原位杂交:原位杂交的程序与所述类似地实施6,7。在-20℃下切割组织切片,然后用4%多聚甲醛固定,接着用0.1m磷酸盐缓冲液洗涤三次,空气干燥,并储存在-20℃直至使用。对于原位杂交,将切片在室温下干燥,然后用蛋白酶k(1μg/ml)预处理。然后将切片空气干燥并在60℃温育18小时用s35标记的核糖核酸探针杂交。杂交后,用rnase(20μg/ml)(sigma-aldrich,st.louis,mo)处理组织切片,减少盐度洗涤和高严格性(68℃)洗涤。在脱水和空气干燥后,将组织切片暴露于kodakbiomaxtm膜。用图像分析系统(mcid,imagingresearch,ontario,canada)捕获图像。
免疫组织化学:根据先前的出版物执行免疫组织化学51,52。将视网膜切片安装在涂覆的载玻片上。将切片在pbs中再水合20分钟,然后浸入含有2%bsa,0.5%tween-20和0.05%triton-x100的封闭缓冲液中1小时。将用于pk2(hamster单克隆,1:200,rocheinc.)或opn4(affinity纯化的兔多克隆,1:200,milliporeinc.)的一抗在4℃下加入切片中过夜。将载玻片用含有0.5%tween-20的pbs洗涤五次,每次5分钟。然后施用抗兔或抗仓鼠二抗(alexafluor488或5551:2000;invitrogeninc.),然后在室温下与10μg/ml的hoechst33342tm(invitrogeninc)一起温育5分钟以染色核。在nikon倒置荧光显微镜(型号te-2000utm;nikoninc,tokyo,japan)下观察切片。用spot数码相机(diagnosticinstruments,inc,sterlingheights,mi)捕获图像。对于dab(3,3’-二氨基联苯胺)免疫染色,将切片与抗pk2抗体(hamster单克隆,1∶500稀释)抗体一起温育,然后与生物素化的抗仓鼠二抗一起温育。dab免疫染色的显色用标准abc方法实施52。
检测pk2拮抗剂对小鼠和猴活动或唤醒水平效果的药理实验:
与描述类似地制备pk2拮抗剂(pkra83)53。将pkra83(40mg/kg)在zt6时腹膜内给药至小鼠。将pkra83(10mg/kg)在zt10时肌肉内给药至猴。对于药理学实验,用载体抑或拮抗剂处理动物,然后在一周后用相反的处理交叉以形成配对对照。
获得pk2拮抗剂处理或对照处理的小鼠的睡眠和活动数据,并如对pk2-/-小鼠所述一样进行分析。对于猴的睡眠研究,将年轻的成年猴(食蟹猴(macacafascicularis))圈养于标准光(白光~250lux)和黑暗的循环下。测量和分析猴的唤醒水平按如下实施。使用类似于先前针对人类受试者54,55,56,57和非人类灵长类动物58描述的可穿戴无线睡眠跟踪器。该无线系统能够长时间远程监控猴的睡眠/唤醒状态,以便进行动态设置,同时最大限度地减少对猴的干扰。通过同时的红外摄像机记录来验证从无线睡眠跟踪器获得的睡眠数据。每天用坐落在离动物笼约十米远地方的移动电话来取回睡眠跟踪器的睡眠数据,没有与猴的身体接触。先前的研究已经表明通过睡眠跟踪器获得的睡眠数据、摄像机与通过eeg/emg方法获得的经典睡眠/觉醒数据的良好一致性54,57,59。
统计:为了减少由于超节律引起的数据偏差的影响,对小鼠运动活动和eeg/emg的测量执行两次,并且这两次测量的平均值用于统计分析。通过使用graphpadprismsoftwareversion5.0tm(sandiego,ca),用单因子或双因子变异数分析进行统计学分析,然后进行适当的后检验。
图例
图1a。光脉冲对运动活动和唤醒水平的效果。白色条显示在zt16-zt18.5(2.5小时)期间施加至wt(n=6)和pk2-/-小鼠(n=7)的光脉冲(150lux)。分析箱大小为30分钟,值为平均值±sem。a.光脉冲显著抑制wt小鼠的运动活动(通过bonferroni事后检验,p<0.01,双因子变异数分析,*,p<0.05,**,p<0.01)。光脉冲对pk2-/-小鼠运动活动的效果不显著(p>0.05,双因子变异数分析)。插图显示整个2.5小时的运动活动(*,p<0.05,配对t检验)。
图1b。光脉冲显著降低wt小鼠的觉醒时间(通过bonferroni事后检验,p<0.0001,双因子变异数分析,*,p<0.05,**,p<0.01,***,p<0.001)。光脉冲对pk2-/-小鼠的唤醒水平的抑制效果仅在前30分钟显著(通过bonferroni的事后检验,p<0.05,双因子变异数分析,**,p<0.01)。插图显示整个2.5小时的觉醒分钟(***,p<0.001,配对t检验)。对于pk2-/-小鼠,光脉冲对整个2.5小时的觉醒水平的抑制效果不显著(p>0.05,配对t检验)。
图2a。昏暗光对运动活动和唤醒水平的影响。灰色条显示在zt12-zt16期间施加至wt(n=6)和pk2-/-小鼠(n=7)的4小时昏暗光(30lux)。a.与黑暗相比,昏暗光显著降低wt小鼠的运动活动(通过bonferroni的事后检验,p<0.0001,双因子变异数分析,*,p<0.05,**,p<0.01,***,p<0.001)。对于pk2-/-小鼠,昏暗光对运动活动的抑制作用不显著(p>0.05,双因子变异数分析)。插图显示整个4小时内的运动活动(**,p<0.01,配对t检验)。
图2b。与黑暗相比,昏暗光显著降低了wt小鼠的唤醒水平(通过bonferroni事后检验,p<0.0001,双因子变异数分析,*,p<0.05,**,p<0.01,***,p<0.001)。昏暗光对pk2-/-小鼠唤醒水平的抑制作用仅在前30分钟显著(通过bonferroni事后检验,p<0.05,双因子变异数分析,**,p<0.01)。
图3。pk2和opn4在小鼠视网膜的视网膜神经节细胞中的共表达。pk2免疫染色示出为绿色(a),而opn4荧光免疫标记示出为红色(b)。核复染示出为蓝色(c)。pk2和opn4在视网膜神经节细胞中的共表达是显而易见的(d)。示出了pk2和opn4强烈免疫染色的两个细胞。比例尺,40μm。
图4。pk2和opn4在猴视网膜的视网膜神经节细胞中的共表达。pk2免疫标记示出为绿色(a),而opn4荧光免疫标记示出为红色(b)。核复染示出为蓝色(c)。pk2和opn4在视网膜神经节细胞中的共表达是显而易见的(d)。插图示出代表性阳性细胞的较高放大倍数图像。比例尺,20μm。
图5。pkr2mrna在小鼠脑和猴脑的视网膜受体靶标中的差异表达。a.检测猴脑中视交叉上核(scn)背侧区室中的pkr2mrna,但不检测在腹侧scn中的pkr2mrna。b.在小鼠脑的整个scn(腹侧和背侧区室两者)中检测pkr2mrna。c.在猴脑的上丘(sc)的表面层中检测pkr2mrna。d.在小鼠脑的sc中无pkr2mrna。注意pkr2在小鼠和猴脑两者的中缝背核(dr)中的表达。比例尺,1mm。
图6。pk2拮抗剂pkra83对小鼠和猴的运动活动和唤醒水平的不同效果。a.pkra83显著增加小鼠的运动活动(通过bonferroni事后检验,n=16,p<0.05,双因子变异数分析,*,p<0.05)。b.pkra83显著增加小鼠的觉醒时间(通过bonferroni的事后检验,n=6,双因子变异数分析,*,p<0.05)。a和b的插图示出pkra83分别在6小时白天时间段内增加运动活动和觉醒分钟(**,p<0.01,配对t-检验)。c.pkra83显著增加猴的睡眠时间(n=9,*,p<0.05,配对t检验)。
图7。pk2在小鼠视网膜的视网膜神经节细胞中的表达。pk2免疫标记通过dab(3,3’-二氨基联苯胺)显色。a.用箭头标记两个pk2阳性视网膜神经节细胞的实例,一个是非移位的,一个是移位的。b.用苏木精复染剂进行pk2dab免疫染色。用箭头标记两个pk2阳性视网膜神经节细胞的实例,一个强烈染色且一个更适度染色。比例尺,20μm。
图8。示出iprgc的pk2信号传导至脑靶标上引起的差异唤醒通孔的图。pk2在iprgc中表达,iprgc是传递光的中心非视觉功能的唯一光通道。总体而言,pk2信号传导刺激昼夜猴并抑制夜间小鼠,如拮抗剂阻断和pk2缺陷所示。pkr2在视网膜受体腹侧scn和sc表面层中的差异表达分别表明iprgc的pk2信号传导对于小鼠和猴分别流经iprgc-scn和iprgc-sc。对于夜间动物,光通过iprgc-sc途径的唤醒刺激是轻微的(短暂的,不持续的),这与小鼠脑sc中pkr2的缺失一致。iprgcscn途径的pk2信号传导对于夜间小鼠是明显抑制性的,尽管尚不清楚它是否对昼夜动物具有抑制性或刺激性。事实上,尽管支持scn作为主要生物钟的证据对于夜间哺乳动物来说绝对强大,但这种主张实际上限制了昼夜动物的支持证据。被充分引用的松鼠猴scn损失导致睡眠增加的工作,被解释为scn对于昼夜动物而言促进唤醒,可以通过对视网膜下丘脑束的并发损伤来解释。我们的模型表明,哺乳动物的昼夜/夜间确定是由iprgc差异信号传导至其脑靶标所介导的,因此可能不需要scn下游的趋异信号传导机制。
实施例2:pk2作为iprgc与脑连接的信号分子起作用
该实施例描述了这样的研究,其示出pk2作为用于iprgc中生物钟的输出分子起作用以调控哺乳动物的觉醒和睡眠,并且示出pk2拮抗剂诱导或促进睡眠。
视网膜中的生物钟主要被认为调控局部生理和诸如视网膜电流图振幅和光感受器外段视盘的吞噬作用之类的功能。我们的研究结果揭示,pk2作为iprgc中生物钟的输出分子起作用以调控哺乳动物的觉醒和睡眠。
发现在连续黑暗期间pk2在视网膜外核层中的表达增加。如图9所示,pk2在视网膜外核层中的表达在ct4处比在zt4处高得多。细胞计数揭示,在zt4处,pk2阳性的光感受器的百分比约为0.1%。act4,pk2阳性光感受器的百分比增加至约2%,表明pk2阳性细胞可能是视锥细胞。图9图解与在zt4处(图a)相比,视网膜外核层中pk2在ct4处(图b)上调的图像:图9中,图解了与在zt4处(图a)相比,视网膜外核层中pk2在ct4处(图b)上调;示出了pk2免疫染色;框区域表示小鼠视网膜的外段;核复染示出为蓝色;与zt4(图a)相比,pk2在ct423处(图b)的上调是显而易见的。哺乳动物视网膜外核层中pk2的上调可能与黑暗期间光感受器的神经活动增加有关。
进一步示出iprgc中的pk2表达以在光照和黑暗条件下以bmal1依赖性方式振荡(图10)。在野生型小鼠中,iprgc中pk2水平的峰值和谷值分别在zt4和zt20附近。与之相反,bmal1缺陷小鼠的iprgc中的pk2水平持续低,并且未观察到明显的pk2振荡。iprgc中pk2水平的振荡阶段,包括分别在大约zt4和大约zt20处的峰时和谷时,与scn时钟中观察到的pk2振荡非常相似,表明由相同分子振荡器的调控。总之,这些结果表明iprgc中pk2的振荡表达是时钟依赖性过程。
原位杂交示出pk2受体pkr2在某些视网膜神经节细胞中表达(图11)。pkr2表达仅在视网膜神经节细胞中检测到,但未在双极细胞中检测到。视网膜神经节细胞层中的这些pkr2阳性细胞的丰度和直径特征表明这些pkr2阳性细胞是iprgc。图11图解示出某些视网膜神经节细胞中pkr2表达的图像;在图11中,图解了某些视网膜神经节细胞中的pkr2表达;pkr2mrna通过原位杂交被检测到;图a示出视网膜神经节细胞层中的pkr2信号;框区域的放大倍率较高的图像示出在图b中;在图b中,pkr2阳性的个别视网膜神经节细胞是显而易见的;图c和图d示出眼部的nissl染色,分别对应于图a和图b。
如图12所示,pk2缺陷的(pk2-/-)小鼠的唤醒水平在深夜增加,特别是在zt20-zt24(光照前4小时)之间。因此,pk2信号在此期间抑制小鼠的唤醒水平。图12用图像图解示出在深夜期间(zt20-zt24)pk2-/-小鼠的觉醒增加的数据。
在野生型小鼠中测试pk2拮抗剂对运动活动的效果。如图13所示,通过眼局部施用在深夜递送的pk2拮抗剂增加了运动活动,从而增加了小鼠的觉醒水平。图13用图像图解示出pk2拮抗剂的眼局部递送增加小鼠的运动活动的数据。
图14用图像图解示出pk2拮抗剂pkra对小鼠唤醒水平的效果的数据:pk2拮抗剂在白天的眼局部施用显著增加了小鼠的觉醒时间(*,p<0.05,配对t检验)。
由于与夜间哺乳动物相比,pk2信号传导对昼夜哺乳动物的觉醒水平的效果被逆转,因此pk2信号传导刺激诸如猴或人类之类的昼夜受试者的觉醒。由于pk2拮抗剂被示出增加小鼠的觉醒(图14),因此预期相同的pk2拮抗剂抑制觉醒,即促进诸如猴之类的昼夜受试者的睡眠。图14用图像图解pk2拮抗剂((3r)-1-(4-氟-3-甲氧基苄基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺,即所谓的“pkra83”)对小鼠唤醒水平的效果。pk2拮抗剂的眼局部施用显著增加了小鼠的觉醒时间(*,p<0.05,配对t检验)。
我们通过眼局部施用测试了pk2拮抗剂对猴唤醒水平的效果。如图15所示,pk2拮抗剂的局部施用促进了猴的睡眠。图15用图像图解示出pk2拮抗剂(pkra83)对猴睡眠的影响的数据。pk2拮抗剂的眼局部施用显著增加了猴的睡眠时间(*,p<0.05,配对t检验)。
由于iprgc表达pkr2并且还在深夜和整个白天时段表达pk2,pk2也可能从iprgc的树突或侧支轴突释放以激活邻近iprgc上的pkr2受体,即pk2偶联iprgc的神经活动。因此,如本文所提供的,阻断视网膜中pk2信号传导的方法将会促进睡眠,以用于诸如睡眠周期提前障碍之类的疾病状况,这些方法预期具有pk2信号的提前周期。
本文首次提供的数据证明pk2信号传导偶联iprgc的生物钟然后与iprgc的脑靶标偶联以调控唤醒水平,如图16中示意性所示。图16以图表的形式示意性地图解iprgc的战略位置。iprgc整合了光照/黑暗和时钟信息。pk2信号传导用于iprgc的偶联和将iprgc神经投射至关键脑中心,以控制夜间和昼夜哺乳动物的唤醒水平。
iprgc的分子机制和战略位置使iprgc能够整合生物钟信息和环境光照/黑暗条件。进一步地,iprgc投射到对于调控唤醒水平和睡眠觉醒循环至关重要的大脑中心,例如上丘。因此,本文提供的方法,其在药理学上靶向iprgc,并在替代实施方式中靶向在iprgc中表达的受体,可用于治疗、改善或预防iprgc调控的和相关的中枢神经疾病,包括例如畏光、睡眠和情绪障碍、季节性情感障碍和双相情感障碍。
畏光可能是由视网膜中的光感受器的过度刺激、或视神经的过度电脉冲,或大脑中的过度反应引起的。由于pk2参与将光的非视觉功能传递给大脑,通过pk2拮抗剂减弱pk2信号将阻止光信号进入大脑。因此,pk2拮抗剂给药可能有助于改善、治疗或预防畏光症状。
我们已经示出视网膜外核层中的血管加压素(avp)在连续黑暗期间也会上调,如图17的图像所示,其图解视网膜外核层中的血管加压素(avp)在ct4处的上调,与pk2一样。与pk2类似,血管加压素也在iprgc中表达,如图18的图像所示,其图解pk2与血管加压素(avp)在iprgc中的共定位。因此,看上去具有pk2和血管加压素的平行信号传导,用于偶联iprgc,然后从iprgc传导到关键的脑靶标。因此,药理学操作在iprgc中表达的血管加压素受体也可用于治疗相关的中枢神经疾病,特别是睡眠和情绪障碍(季节性情感障碍和双相情感障碍)。
我们已经示出,pk2受体拮抗剂的鼻腔施用也促进了猴的睡眠(图19)。或许,在该局部途径中递送的pk2受体拮抗剂可以穿入大脑并阻断关键细胞核中的pk2受体,例如受来自iprgc的pk2投射支配的上丘。图19用图像图解示出pk2拮抗剂(pkra)对猴睡眠的效果的数据。鼻局部施用pk2受体拮抗剂显著增加了猴的睡眠时间(*,p<0.05,配对t检验)。
实施例3:用于治疗哺乳动物昼夜和夜间疾病及相关状况以及治疗诸如疼痛、癌症、牛皮癣和关节炎之类的其他重要人类疾病的组合物
该实施例描述了可用于实践本文提供的方法和组合物的前动力蛋白拮抗剂的合成和制剂。
在替代实施方式中,用于实践本文提供的方法的化合物是具有令人感兴趣的溶解度和药理学特征的酰胺衍生物。特别地,本文提供了前动力蛋白拮抗剂或其药物前体,包括包含它们的脂质制剂和可注射的长效制剂。这些衍生物及其长效制剂适用于例如改变哺乳动物的昼夜节律时间性、治疗由于人类昼夜调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制,或引起唤醒或觉醒反应,以及任选地还治疗诸如癌症之类的某些人类疾病,并可用于实践本文提供的方法和组合物。
在替代实施方式中,用于实践本文提供的方法的化合物,特别是pk2(前动力蛋白)受体拮抗剂,是酰胺衍生物并且具有根据式1的结构的化合物(参见,例如,uspn8,722,896):
其中r1是任选地取代的芳基、任选地取代的杂芳基、或具有稠合杂环的任选地取代的芳基;x和y独立地为低级烷基;q为nh或nr6,其中r6为低级烷基;z为ch2或chr7,其中r7为低级烷基;或q和z彼此共价偶联形成杂环4-至6-元环,其中q为n且z为ch;r2是低级亚烷基;r3是h、低级烷基或烷芳基;a是n或c;w是h、或卤素,或者w是空的,其中a是n;并且r4和r5独立地为烷氧基,或彼此共价偶联以形成具有至少一个氧原子的任选地取代的杂环6-或7-元环。
在替代实施方式中,r1是任选地取代的苯基、任选地取代的吲哚基、或任选地取代的二氢吲哚基,和/或x和y是ch2。任选地,x和y彼此共价偶联以形成吡咯烷环、哌啶环、哌嗪环、硫代吗啉环或吗啉环。虽然不限制本发明的主题,但任选地r3是任选地支化的低级烷基,和/或r4、r5、w和与r4、r5和w共价偶联的苯环形成任选地卤代的苯并二氧杂卓环。最典型地,r2是ch2,和/或w是cl或f。
由于前动力蛋白拮抗剂的许多潜在临床适应症是慢性疾病,因此非常期望长时间抑制pk受体。因此,长效前动力蛋白拮抗剂可用于治疗此类人类疾病。长效药物前体或长效剂型的药剂可以是替代解决方案。长效拮抗剂或持续释放制剂可以每次在患者的系统中保持治疗水平达数天或数周。
在替代实施方式中,提供了用于改变哺乳动物的昼夜节律时间性、治疗由于人类昼夜节律调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制、或引起觉醒或唤醒反应、并任选地还治疗癌症的药物组合物,所述药物组合物包含根据下式i或表1的化合物和药学上可接受的载体。在替代实施方式中,化合物以治疗或预防与诸如肿瘤之类的癌症相关的异常的有效量存在于口服给药的剂量单位中。在替代实施方式中,根据式i的化合物在制备用于改变哺乳动物的昼夜节律时间性、治疗由于人类昼夜节律调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制、或引起觉醒或觉醒反应、以及任选地还治疗癌症的药剂中的用途。
在替代实施方式中,提供了具有长半衰期和/或增加的分布体积的酰胺衍生物,用于治疗慢性人类疾病的理想药代动力学参数。在替代实施方式中,提供了酰胺pk拮抗剂和在治疗人类疾病的有效浓度下持续一段时间递送药物的制剂。
在替代实施方式中,提供了用于长效递送前动力蛋白拮抗剂的组合物和方法。
在替代实施方式中,提供:(3r)-1-(苯并咪唑-4-基甲基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺。
在替代实施方式中,合成包括:
步骤1.1h-苯并咪唑-4-羧酸。将2,3-二氨基苯甲酸(7g)悬浮在原甲酸三乙酯(100ml)中并加热至130℃搅拌过夜。冷却至室温后,加入乙醚(300m1)并过滤得到的沉淀。干燥后得到7.3g的1h-苯并咪唑-4-羧酸固体粉末,m+1=163.1。
步骤2.(1h-苯并咪唑-4-基)甲醇。将1h-苯并咪唑-4-羧酸(7.3g)悬浮在350ml四氢呋喃中,并用干冰-丙酮浴冷却。缓慢加入氢化铝锂(4m,21ml)。搅拌反应并使其温热至室温过夜。用5ml甲醇淬灭反应,并用800ml20%甲醇和80%乙酸乙酯萃取。过滤后,弃去固体。减压蒸发滤液,得到7g的粗品(1h-苯并咪唑-4-基)甲醇(m+1=149.1),用于下一步骤。
步骤3.1h-苯并咪唑-4-甲醛。将7g的(1h-苯并咪唑-4-基)甲醇溶于350ml的二甲基亚砜中。加入36ml的二异丙基乙胺和33g的三氧化硫吡啶络合物。将反应搅拌过夜。加入800ml水并用400ml乙酸乙酯萃取混合物五次。用饱和食盐水洗涤有机层,用硫酸钠干燥并蒸发。快速色谱(100%乙酸乙酯)得到1h-苯并咪唑-4-甲醛的淡黄色粉末(m+1=147.1)。
步骤4.(3r)-1-(苯并咪唑-4-基甲基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺。如上所述制备(3r)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺。(3r)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺(3800mg,如wo/2010/077976中所述制备)、1h-苯并咪唑-4-甲醛(1550mg)、冰醋酸(4.7m1)和三乙酰氧基硼氢化钠(3.0g)在二氯甲烷(150ml)中的混合物搅拌过夜。加入k2co3水溶液(2n,1200ml)后,将混合物用100ml乙酸乙酯萃取三次。合并有机层,用饱和食盐水(500ml)洗涤,用无水硫酸钠干燥,并浓缩。残留物经硅胶快速色谱(100%乙酸乙酯的己烷溶液)纯化,并得到(3r)-1-(苯并咪唑-4-基甲基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺树脂:ms(m+1)=497.2;1hnmr(500mhz,cdcl3)0.95(m,6h),2.00(m,1h),2.09(s,1h),2.12(m,1h),2.25(m,2h),2.39(m,1h),2.45(m,1h),2.53(m,1h),2.60(m,1h),2.70(m,1h),3.14(m,1h),3.23(m,1h),3.30(m,1h),3.38(q,1h),4.20(m,2h),4.30(m,2h),4.45(m,2h),4.66(d,1h),6.6-8.0(m,6h)。
在替代实施方式中,提供:(3r)-1-(苯并咪唑-4-基甲基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺盐酸盐。
在替代实施方式中,合成包括:
步骤1.将1,77g的(3r)-1-(苯并咪唑-4-基甲基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺溶于20ml二氯甲烷中。加入在4m的氯化氢的1,4-二恶烷溶液,并在室温下搅拌4小时。减压蒸发混合物,得到(3r)-1-(苯并咪唑-4-基甲基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基吡咯烷-3-甲酰胺盐酸盐。熔点,120-122℃。
在替代实施方式中,提供:(-)-(2r)-2-甲基-3-(苯并咪唑-4-基甲基氨基)-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基丙酰胺。
利用如(wo/2010/077976)所述制备的(-)-(2r)-2-甲基-3-氨基-n-(9-氯-3,4-二氢-2h-1,5-苯并二氧杂卓-7-基甲基)-n-异丁基丙酰胺,如上所述来制备(-)-(2r)-2-甲基-3-(苯并咪唑-4-基甲基氨基)-n-(9-氯-3,4-二氢-2h-1,5)-苯并二氧杂卓-7-基甲基)-n-异丁基丙酰胺。
选定的生物实验实例
体外ca2+固定测试
使用用于钙固定的基于水母发光蛋白的发光测定法来测量细胞内ca2+的固定(bullock等人,molpharmacol65,582-588,2004)。通过该方法测试稳定表达光蛋白水母发光蛋白和重组pkr1或pkr2的中国仓鼠卵巢(cho)细胞。简而言之,将细胞装入含有8μm腔肠素cp的opti-memtm(invitrogen)中,在37℃下保持2小时。通过短暂的胰蛋白酶消化将细胞分离,并以约5×105细胞/ml保持在hank′s平衡盐溶液(hbss)加10mmhepes(ph7.5)和0.1%bsa中。使用berthold光度计进行发光测量。
将所有化合物在hbss加10mmhepes(ph7.5)和0.1%bsa中稀释。为了测试激动剂活性,将100μl的细胞与20μl的化合物一起注入管中。对于拮抗剂测定,将80μl细胞在管中与20μl不同浓度的拮抗剂在室温下温育20分钟,然后注射100μl的重组pk2。然后使用下式将从测定获得的ic50转换为ki值:ic50/(1+[pk2]/ec50pk2)。
在一些实施方式中,用于描述和要求保护本文提供的某些实施方式的表示成分的量、诸如浓度之类的性质、反应条件等的数字应理解为在某些情况下通过术语“约”进行修饰。因此,在一些实施方式中,书面描述和所附权利要求书中公开的数值参数是近似值,其可以根据特定实施方式试图获得的所需性质而变化。在一些实施方式中,数值参数应根据报告的有效数字的数量并通过应用普通的舍入技术来解释。尽管公开本文提供的一些实施方式的宽范围的数值范围和参数是近似值,但具体实施例中公开的数值尽可能精确地报告。在本文提供的一些实施方式中呈现的数值可能包含由其各自的测试测量中发现的标准偏差所不可避免引起的某些误差。
如本文的描述和贯穿随后的权利要求中所使用的,除非上下文另有明确说明,否则“一”、“一个”和“该”的含义包括复数指代。此外,如在本文的描述中所使用的,除非上下文另有明确规定,否则“在……中”的含义包括“在……中”和“在……上”。
本文中对数值范围的记载仅旨在用作单独提及落入该范围内的每个单独值的简写方法。除非本文另有说明,否则将各个单独的值并入本说明书中,如同其在本文中单独记载一样。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。关于本文的某些实施方式提供的任何和所有示例或示例性语言(例如,“诸如”)的使用仅旨在更好地说明本文提供的实施方式,而不是对要求保护的本发明的范围构成限制。说明书中的任何语言都不应被解释为表示对于本发明的实践必不可少的任何未要求保护的元件。
本文公开的替代元件或实施方式的群组不应解释为限制。每个群组成员可以单独地或与该群组中的其他成员或本文中找到的其他元件任意组合地提及和要求保护。出于方便和/或可专利性的原因,可以将一个或多个群组成员包括在群组中或从群组中删除。当发生任何这样的包含或删除时,本说明书在此被认为包含经修改的群组,从而实现所附权利要求书中使用的所有马库什组的书面描述。
如本文所使用的,并且除非上下文另有指示,否则术语“偶联到”旨在包括直接偶联(其中两个彼此偶联的元件彼此接触)和间接偶联(其中至少一个附加元件)位于两个元件之间)。因此,术语“偶联到”和“偶联”同义使用。
表1
在替代实施方式中,表1中列出的是本文提供的新化合物,其中的每一个可用于实施本文提供的方法。使用前述方法通过改变所用的起始原料、试剂或条件制备这些化合物。必需的试剂可商购或在文献中描述或由本领域技术人员容易地合成。
基于发明人对预期化合物的生物活性的发现,通常预计本文提供的化合物可以配制成用于改变哺乳动物的昼夜节律性或时间性、治疗由于人类昼夜节律调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制、或引起唤醒或觉醒反应、以及任选地治疗各种癌症。在替代实施方式中,提供了包含本文所述化合物的药物组合物,其中这些化合物可有效改变哺乳动物的昼夜节律性或时间性、治疗由于人类昼夜节律调控系统的改变引起的精神状况或症状、治疗哺乳动物的睡眠问题、或诱导睡眠或活动抑制、或引起唤醒或觉醒反应、以及任选地治疗或预防各种癌症,其中预期药物组合物包含治疗有效量的预期化合物(或其药学上可接受的盐、水合物或药物前体)和药学上可接受的载体。例如,在一个方面,组合物配制成用于治疗神经胶质瘤、胰腺癌或其他肿瘤。
在替代实施方式中,提供了用一种或多种无毒的药学上可接受的载体配制的组合物。在替代实施方式中,提供了配制成以固体、半固体或液体形式口服给药或用于肠外注射的药物组合物。在替代实施方式中,这些药物组合物可以采用各种途径,包括口服、直肠、肠外,腹膜内、阴道或局部,给药至人和其他动物。
在替代实施方式中,提供了用于注射的药物组合物,例如,其包含药学上可接受的无菌水性或非水性溶液、分散液、乳液或悬浮液,以及用于在使用前重建成无菌可注射溶液或分散液的无菌粉末。合适的水性和非水性载体、稀释剂、溶剂或载体的实例包括水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等)、及其合适的混合物;油和可注射的有机酯(例如油酸乙酯)。在替代实施方式中,提供了包含或含有各种非活性成分(包括防腐剂、润湿剂、乳化剂和/或分散剂)的组合物。无菌可以通过包含抗细菌剂和/或抗真菌剂(例如对羟基苯甲酸酯、苯酚山梨酸、氯丁醇等)来确保。适当时,可包括渗透活性剂(例如,糖、氯化钠等)。
在替代实施方式中,提供了配制成用于口服给药的固体或半固体剂型的组合物,因此可以是软膏、胶囊、片剂、丸剂、粉剂和颗粒剂。在替代实施方式中,将固体或半固体剂型、预期化合物与药学上可接受的赋形剂或载体(例如,柠檬酸钠或磷酸二钙)、填充剂或增量剂(例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇或硅酸)、粘合剂(例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖等),保湿剂(例如甘油)、崩解剂(例如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐或碳酸钠)、溶液延迟剂(例如石蜡)、吸收促进剂(例如季铵盐化合物)、润湿剂(例如鲸蜡醇和甘油单硬脂酸酯)、和吸收剂(例如高岭土或膨润土)和润滑剂(例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠)中的至少一种混合。
在替代实施方式中,相似类型的固体或半固体组合物也可用作软和硬填充明胶胶囊中的填充剂,使用诸如乳糖或奶糖以及高分子量聚乙二醇等赋形剂。片剂、糖衣丸、胶囊、丸剂和颗粒剂的固体或半固体剂型可以用包衣和外壳制备,例如肠溶包衣和药物配制领域熟知的其它包衣。在替代实施方式中,提供了配制成仅释放活性成分,抑或可选地,在肠道的某一部分中,任选地以延迟方式释放活性成分的组合物。可以使用的包埋组合物的实例包括聚合物质和蜡。在替代实施方式中,如果合适,提供具有一种或多种上述赋形剂的微囊形式的化合物。
在替代实施方式中,提供了用于口服给药的液体剂型,包括药学上可接受的乳液、溶液、悬浮液、糖浆和酏剂。除活性化合物外,液体剂型可含有本领域常用的惰性稀释剂(例如水、或其他溶剂、增溶剂)、乳化剂(例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇)。,苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺)、油(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和脱水山梨糖醇的脂肪酸酯及其混合物。除惰性稀释剂外,口服组合物还可包括佐剂、如润湿剂、乳化剂和悬浮剂,甜味剂、调味剂和芳香剂。
在替代实施方式中,提供了用于直肠或阴道给药的组合物,例如栓剂,其可通过将本文提供的化合物与合适的无刺激性赋形剂或诸如可可脂、聚乙二醇或栓剂蜡之类的载体混合来制备,所述无刺激性赋形剂或载体在室温下是固体或半固体,但在体温下是液体,因此在直肠或阴道腔内融化并释放活性化合物。
在替代实施方式中,提供了待以脂质体形式给药的化合物,其可以是单层、低聚层或多层。脂质体形式的预期组合物可以进一步含有稳定剂、防腐剂、赋形剂等。在替代实施方式中,提供了用于脂质体形成(天然和合成两者)的脂质,包括磷脂和磷脂酰胆碱(卵磷脂)。形成脂质体的方法是本领域已知的。参见,例如,prescott编,methodsincellbiology,volumexiv,academicpress,newyork,n.y.(1976),第33页等。
本文提供的药物组合物中化合物的实际剂量水平可以改变,以便获得有效实现特定患者、组合物和给药方式的所需治疗响应的预期化合物的量。因此,所选的剂量水平将取决于各种因素,包括特定化合物的活性、给药途径、所治疗病症的严重程度、以及所治疗患者的病症和既往病史。然而,在低于实现所需治疗效果所需的水平开始化合物的剂量并逐渐增加剂量直至达到所需效果在本领域技术范围内。在替代实施方式中,提供的是哺乳动物患者口服给药为每天每千克体重约0.01mg至约500mg、或约0.5mg至约50mg的预期化合物的剂量水平。如果需要,出于给药的目的,可以将有效日剂量分成多个剂量,例如每天2至4个单独的剂量。
在替代实施方式中,提供了包含另外的药学活性化合物的药物组合物。在替代实施方式中,另外的药物活性化合物可以包含在相同的药物组合物中,或者可以分开给药,并且本领域普通技术人员将容易地确定合适的另外药物活性化合物的共同给药方案和途径。在替代实施方式中,提供的组合物还可以包括预期化合物的代谢物和/或药物前体形式,并且所有化合物可以以外消旋混合物或立体化学纯(或部分纯)的形式存在。
参考文献-实施例1
1.lincoln,etal.,temporalexpressionofsevenclockgenesinthesuprachiasmaticnucleusandtheparstuberalisofthesheep:evidenceforaninternalcoincidencetimer.procnatlacadsciusa99,13890-13895(2002)
2.valenzuela.f.j.etal.clockgeneexpressioninadultprimatesuprachiasmaticnucleiandadrenal:istheadrenalaperipheralclockresponsivetomelatonin?endocrinology149,1454-1461(2008)
3.schwartzetal.,invivometabolicactivityofthesuprachiasmaticnuclei:acomparativestudy.brainres.1983274,184-7(1983)
4.smale,eta1.,mammaliandiurnality:somefactsandgaps.jbiolrhythms18,356-366(2003)
5.jin,x.etal.amolecularmechanismregulatingrhythmicoutputfromthesuprachiasmaticcircadianclock.cell96,57-68(1999)
6.cheng,m.y.etal.prokineticin2transmitsthebehaviouralcircadianrhythmofthesuprachiasmaticnucleus.nature417,405-410(2002)
7.burton,k.j.,etal.expressionofprokineticin2anditsreceptorinthemacaquemonkeybrain.chronobiologyinternationalinpressdoi:10.3109/07420528.2015.1125361
8.mistlberger,r.e.circadianregulationofsleepinmammals:roleofthesuprachiasmaticnucleus.brainresbrainresrev.49,429-454(2005)
9.moore,r.y.thesuprachiasmaticnucleusandthecircadiantimingsystem.progmolbioltranslsci.119,1-28(2013)
10.mrosovsky,n.masking:history,definitions,andmeasurement.chronobiolint.16,415-429(1999)
11.morin,l.p.neuroanatomyoftheextendedcircadianrhythmsystem.expneurol.243,4-20(2013)
12.borbély,a.a.effectsoflightonsleepandactivityrhythms.progneurobiol.10,1-31(1978)
13.gander,p.h.&moore-ede,m.c.light-darkmaskingofcircadiantemperatureandactivityrhythmsinsquirrelmonkeys.amjphysiol.245,r927-934(1983)
14.campbell,s.s.&dawson,d.enhancementofnighttimealertnessandperformancewithbrightambientlight.physiolbehav.48,317-320(1990)
15.rietveld,w.j.,minors,d.s.&waterhouse,j.m.circadianrhythmsandmasking:anoverview.chronobiolint.10,306-312(1993)
16.provencio,i.etal.anovelhumanopsinintheinnerretina.jneurosci.20,600-605(2000)
17.berson,d.m.,dunn,f.a.&takao,m.phototransductionbyretinalganglioncellsthatsetthecircadianclock.science295,1070-1073(2002)
18.mrosovsky,n.&hattar,s.impairedmaskingresponsestolightinmelanopsin-knockoutmice.chronobiolint.20,989-999(2003)
19.dacey,d.m.etal.melanopsin-expressingganglioncellsinprimateretinasignalcolourandirradianceandprojecttothelgn.nature433,749-754(2005)
20.panda,s.etal.melanopsinisrequiredfornon-image-formingphoticresponsesinblindmice.science301,525-527(2003)
21.wee,etal.,lossofphoticentrainmentandalteredfree-runningcircadianrhythmsinmath5-/-mice.jneurosci.22,10427-10433(2002)
22.altimus,c.m.etal.rods-conesandmelanopsindetectlightanddarktomodulatesleepindependentofimageformation.procnatlacadsciusa105,19998-20003(2008)
23.goz,d.etal.targeteddestructionofphotosensitiveretinalganglioncellswithasaporinconjugatealterstheeffectsoflightonmousecircadianrhythms.plosone3,e3153(2008)
24.güler,a.d.etal.melanopsincellsaretheprincipalconduitsforrod-coneinputtonon-image-formingvision.nature453,102-105(2008)
25.hatori,m.etal.inducibleablationofmelanopsin-expressingretinalganglioncellsrevealstheircentralroleinnon-imageformingvisualresponses.plosone3,e2451(2008)
26.johnson,etal.,lossofentrainmentandanatomicalplasticityafterlesionsofthehamsterretinohypothalamictract.brainres.460,297-313(1988)
27.li,etal.,disruptionofmaskingbyhypothalamiclesionsinsyrianhamsters.jcompphysiolaneuroetholsensneuralbehavphysiol.191,23-30(2005)
28.lehman,m.n.etal.circadianrhythmicityrestoredbyneuraltransplant.immunocytochemicalcharacterizationofthegraftanditsintegrationwiththehostbrain.jneurosci.7,1626-1638(1987)
29.li,j.d.etal.attenuatedcircadianrhythmsinmicelackingtheprokineticin2gene.jneurosci.26,11615-11623(2006)
30.prosser,h.m.etal.prokineticinreceptor2(prokr2)isessentialfortheregulationofcircadianbehaviorbythesuprachiasmaticnuclei.procnatlacadsciusa104,648-653(2007)
31.hu,w.p.etal.alteredcircadianandhomeostaticsleepregulationinprokineticin2-deficientmice.sleep30,247-256(2007)
32.lupi,d.,oster,h.,thompson,s.&foster,r.g.theacutelight-inductionofsleepismediatedbyopn4-basedphotoreception.natneurosci.11,1068-1073(2008).
33.tsai,j.w.etal.melanopsinasasleepmodulator:circadiangatingofthedirecteffectsoflightonsleepandalteredsleephomeostasisinopn4(-/-)mice.plosbiol.7,e1000125(2009)
34.morin,etal.,retinalganglioncellprojectionstothehamstersuprachiasmaticnucleus,intergeniculateleaflet,andvisualmidbrain:bifurcationandmelanopsinimmunoreactivity.jcompneurol.465,401-416(2003)
35.hattar,s.etal.centralprojectionsofmelanopsin-expressingretinalganglioncellsinthemouse.j.comp.neurol.497,326–349(2006)
36.hannibal,j.etal.centralprojectionsofintrinsicallyphotosensitiveretinalganglioncellsinthemacaquemonkey.jcompneurol.522,2231-2248(2014)
37.cheng,m.y.,leslie,f.m.&zhou,q.y.expressionofprokineticinsandtheirreceptorsintheadultmousebrain.jcompneurol.498,796-809(2006)
38.moore,r.y.&silver,r.suprachiasmaticnucleusorganization.chronobiolint.15,475-487(1998)
39.yuill,etal.,prokineticin2depolarizesparaventricularnucleusmagnocellularandparvocellularneurons.eurjneurosci.25,425-434(2007)
40.ren,p.etal.prokineticin2regulatestheelectricalactivityofratsuprachiasmaticnucleineurons.plosone6,e20263(2011)
41.costa,m.s.etal.retinohypothalamicprojectionsinthecommonmarmoset(callithrixjacchus):astudyusingcholeratoxinsubunitb.jcompneurol.415,393-403(1999)
42.denny-brown,d.themidbrainandmotorintegration.proc.r.sot.med.55,527-538(1962)
43.dean,etal.,visualdesynchronizationofcorticaleegimpairedbylesionsofsuperiorcolliculusinrats.jneurophysiol.52,625-637(1984)
44.dean,p.,redgrave,p.&westby,g.w.eventoremergency?tworesponsesystemsinthemammaliansuperiorcolliculus.trendsneurosci.12,137-147(1989)
45.may,p.j.themammaliansuperiorcolliculus:laminar结构andconnections.progbrainres.151,321-378(2006)
46.berman,etal.,functionalidentificationofapulvinarpathfromsuperiorcolliculustocorticalareamt.jneurosci.30,6342-6354(2010)
47.lyon,etal.,adisynapticrelayfromsuperiorcolliculustodorsalstreamvisualcortexinmacaquemonkey.neuron.65,270-279(2010)
48.hilbig,etal.,dendriticorganizationofneuronsofthesuperiorcolliculusinanimalswithdifferentvisualcapability.brainresbull.51,255-265(2000)
49.chalfin,etal.,scalingofneuronnumberandvolumeofthepulvinarcomplexinnewworldprimates:comparisonswithhumans,otherprimates,andmammals.jcompneurol.504,265-274(2007)
50.crompton,etal.,evolutionofhomeothermyinmammals.nature272,333-336(1978)
51.zhang,etal.,efferentprojectionsofprokineticin2expressingneuronsinthemousesuprachiasmaticnucleus.plosone4,e7151(2009)
52.ghosh,a.etal.anti-inflammatoryandneuroprotectiveeffectsofanorallyactiveapocyninderivativeinpre-clinicalmodelsofparkinson'sdisease.jneuroinflammation9,241(2012).
53.qiuc.y.etal.prokineticin2potentiatesacid-sensingionchannelactivityinratdorsalrootganglionneurons.jneuroinflammation.9,108(2012).
54.jones,c.r.etal.familialadvancedsleep-phasesyndrome:ashort-periodcircadianrhythmvariantinhumans.natmed.5,1062-1065(1999).
55.evansd.s.etal.commongeneticvariantsinarntlandnpas2andatchromosome12p13areassociatedwithobjectivelymeasuredsleeptraitsintheelderly.sleep36,431-46(2013).
56.rahmank,burtona,galbraiths,lloyda,vollmer-connau.sleep-wakebehaviorinchronicfatiguesyndrome.sleep34,671-8(2011).
57.mehrar.etal.interpretingwristactigraphicindicesofsleepinepidemiologicstudiesoftheelderly:thestudyofosteoporoticfractures.sleep31,1569-76(2008).
58.fletcher,r.b.,amemori,k.i.,goodwin,m.&graybiel,a.m.34thannualinternationalconferenceoftheieeeembs.4046-4049(2012).
59.balzamo,etal.,scoringofsleepandwakefulnessbybehavioralanalysisfromvideorecordingsinrhesusmonkeys:comparisonwithconventionaleeganalysis.electroencephalogrclinneurophysiol.106,206-212(1998).
edgardm,dementwc,fullerca.effectofscnlesionsonsleepinsquirrelmonkeys:evidenceforopponentprocessesinsleep-wakeregulation.jneurosci.199313:1065-79.
对于本领域技术人员显而易见的是,在不脱离本文的发明构思的情况下,除了已经描述的那些之外的更多修改是可能的。因此,除了所附权利要求的精神之外,本发明的主题不受限制。此外,在解释说明书和权利要求时,所有术语应以与上下文一致的最广泛的方式解释。术语“包括”和“包含”应被解释为以非排他性方式引用元件,组件或步骤,指示所引用的元件,组件或步骤可以与未明确引用的其他元件,组件或步骤一起存在,或利用或组合它们。当说明书权利要求涉及选自a,b,c......和n中的至少一种时,文本应解释为只需要组中的一个元件,而不是a加n,或b加n等。
已经描述了本发明的许多实施例。然而,可以理解的是,在不脱离这里描述的实施例的精神和范围的情况下,可以进行各种修改。因此,其他实施例在以下权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!