使用碳硅烷树状高分子的靶组织特异性递送型药物递送系统用胶囊的制作方法
本发明涉及能够用于药物递送系统的使用碳硅烷树状高分子的靶组织特异性递送型药物递送系统用靶向型胶囊。
背景技术:
:目前,抗体、肽适体、核酸等生物高分子作为下一代药品受到关注。这样的生物高分子在制造工序中的品质管理、制剂的保存、以及给药方法和其他方面与以往的以低分子化合物为有效成分的药品大不相同。通常,在对药物制剂进行给药时,虽然还取决于需要治疗的疾病和药剂的性质,但能够将多少量的有效成分递送到靶部位这一点会对有效率产生影响。例如,已知在以作为生物高分子的蛋白质或抗体作为有效成分的情况下,根据给药时的剂型,会生成针对它们的抗体,有效性降低,由此产生有效率(治疗效果)也下降的问题。因此,作为将这种药物制剂适当地递送到靶部位的手段,正在积极地开发各种药物递送系统(dds:药物递送系统)。作为用于dds的载体,例如可以举出脂质体、胶束、合成树脂粒子等。另外,作为使用了这种载体的制剂,例如报道了:使与定位在靶部位的分子特异性结合的配体与脂质体等结合而成的制剂(参见专利文献1和2);使n-乙酰基葡糖胺或其他糖露出到脂质体或合成树脂粒子等的表面而成的制剂(参见专利文献3和4);以及使抗体结合到胶束上而成的制剂(参见专利文献5);等等。另外,关于利用了形成胶束结构的树状高分子的载体,也正在进行开发(参见专利文献6、7和8)。树状高分子是以希腊语中的“dendra”(树木)为词源的、规则地分支的树状高分子化合物的统称。几分子树状高分子缔合时会形成球状,在其内部形成纳米级的空间。因此,能够将分子以在该空间中出现各种官能团的方式并入,并且还能够将缔合度提高到几十~几百,设计的自由度高。因此,目前在纳米
技术领域:
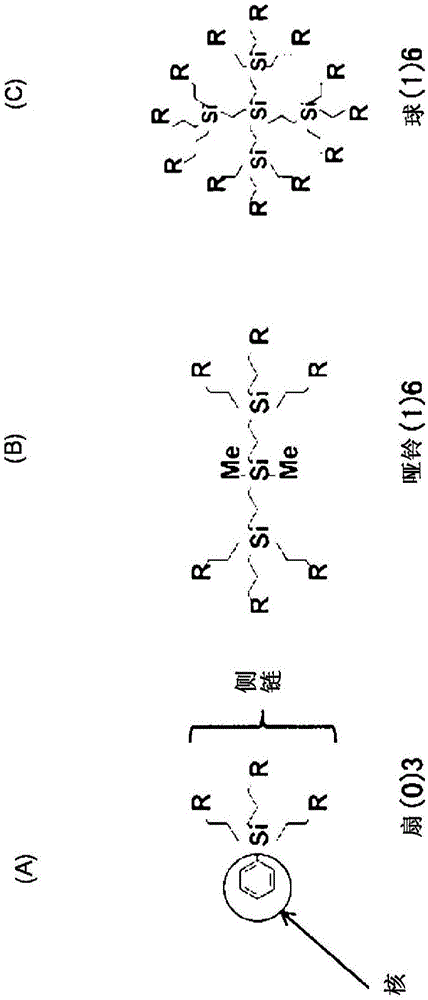
中正在积极地进行各种新型树状高分子的开发。迄今为止,为了预防和/或治疗由病毒或细菌感染引起的疾病,已进行了利用树状高分子的dds载体的开发(参见专利文献9)。另一方面,已知具有aie(聚集诱导发光;非发光性化合物相互聚集,通过照射特定波长的光而引起高效发光的现象)效应的含噻咯基的树状高分子(以下在本说明书中称为“碳硅烷树状高分子”)通常在形成胶束时等价于形成聚集体,并进行荧光发光(参见非专利文献1)。人体由约60万亿个细胞构成,所有这些细胞从细胞外摄入营养素、激素或神经递质及其他细胞外信息传递物质等以维持人体的稳态性。此时,将细胞外存在的各种物质被摄入到细胞内的现象称为胞吞作用。作为代表性的胞吞作用,可以举出胞膜窖介导的胞吞作用、脂筏介导的胞吞作用、巨胞饮作用、吞噬作用、受体依赖性胞吞作用和网格蛋白依赖性胞吞作用。已知通过胞吞作用,即使是分子量大的分子也能够被摄入到细胞内,已经报道了:将含噻咯的碳硅烷树状高分子和标记蛋白(例如绿色荧光蛋白)在水性溶剂中、或者在上述水性溶剂与有机溶剂的混合溶剂中混合,形成作为上述树状高分子与蛋白质的复合体的聚集性分子。并且还报道了:将上述荧光蛋白负载于树状高分子时,可诱导上述荧光蛋白朝向外侧的状态的脂质体(下文中有时称为“囊泡”)或者胶束形成;上述囊泡可包封例如色素、凝集素、抗体等(参照专利文献10,下文中称为“现有技术1”)。现有技术文献专利文献专利文献1:wo2005/011632专利文献2:wo2005/011633专利文献3:日本特开2007-1923专利文献4:日本特开2009-46413专利文献5:日本特开2014-73975专利文献6:日本特开2001-206885专利文献7:日本特开2005-120068专利文献8:日本特开2007-238860专利文献9:日本专利第5629888号专利文献10:wo2016/084979非专利文献非专利文献1:chemcommun(camb).2009aug7;(29):4332-53.doi:10.1039/b904665h.epub2009may13技术实现要素:发明所要解决的课题如上所述,虽然正在积极地进行dds用的载体的研究,但将以生物高分子为有效成分的药剂在不损害其特性的情况下有效地递送到靶部位是非常困难的。在口服给药的情况下,除非可防止载体被胃酸这种强酸所分解,否则作为有效成分的生物高分子就无法到达肠道,也不会被吸收。另外,在静脉给药(静脉注射、下文中有时统称为“静注”)的情况下,虽然能够将高浓度的药剂暂时给药至血流中,但还存在上述胃酸分解之外的问题,出于下述理由,难以以有效浓度递送到靶部位。即,血中的药剂浓度由于向尿中排出、在肝脏中代谢、在各种组织中蓄积等原因,随着时间推移而迅速降低;并且,有时没有靶向性而停留于血中。另外,在递送到靶部位的药剂量增加时,有时还会产生严重的副作用。例如,作为帕金森病治疗药的左旋多巴由于血脑屏障的通过量非常少,因此有效率无法提高。并且,若增加左旋多巴的给药量,由于在作为靶部位的脑以外也存在左旋多巴的分解酶,因此会出现严重的副作用,实际上发生了无法继续治疗的情况。另一方面,一天中多次给药少量药剂会引起对患者和医疗人员的负担增大的问题。对于生物高分子用的载体而言,除了能够将分子量大的有效成分摄入到其内部的特性之外,还必须是其自身与生物体的相容性高的载体。这是因为,若生物相容性低,则会在生物体侧发生各种反应,载体的给药本身会对生物体产生不良影响。此外,还必须是在被递送到靶部位之前保持稳定的结构、在被递送到靶部位时能够迅速地释放出作为有效成分的生物高分子的载体。现有技术1是在下述方面优异的发明:能够将分子量大的有效成分摄入到其内部,其自身与生物体的相容性高。但是,其具有无法将包封的模型药剂有效地递送到靶组织的问题。迄今为止,能够将包封的模型药剂特异性地递送到靶组织的安全性高的生物高分子用的载体尚未实用化,对于具有这样的特性、性质的载体有强烈的社会需求。用于解决课题的手段本发明是在上述的状况下完成的,其目的在于提供一种能够摄入各种分子量的化合物和生物高分子、在生物体内稳定性高、并且能够向靶组织特异性递送有效成分的靶组织特异性递送型药物递送系统用胶囊。本发明包括下述方式。在本发明的一个实施方式中,本发明涉及一种靶组织特异性递送型药物递送系统用胶囊,其是由聚集性分子构成的靶组织特异性递送型药物递送系统用胶囊,其中,上述聚集性分子由下式(i)表示,其具备靶向序列提呈部(tspp),该靶向序列提呈部(tspp)由具有用于向靶组织进行特异性递送的靶向识别部位的蛋白质或肽、以及荧光蛋白构成;上述聚集性分子在水性溶剂中聚集,构成能够包封选自由分子量为20万以下的蛋白质、核酸以及疏水性分子组成的组中的至少1种分子的胶囊。[化1](式中,t表示溴原子、或者下式(ii)所示的靶向序列提呈部。并且,n1和n2分别表示上述靶向序列提呈部的数量,(3-n1)和(3-n2)表示溴原子数。n1和n2为0~3的整数且它们不同时为0。)[化2]上述靶组织特异性递送型药物递送系统用胶囊优选具有50~500nm的直径。这是由于,具有该尺寸的直径的胶囊在抗癌剂的药物递送中成为对于癌细胞周边的新生血管的高渗透长滞留效应(enhancedpermiabilityandretentioneffect)而言最佳的尺寸。此处,从能够制作均匀且稳定的胶囊、能够在不会使蛋白质及其他生物高分子变性的情况下进行包封的方面出发,优选上述水性溶剂为选自由生理盐水、磷酸缓冲生理盐水(下文中有时称为“pbs”)、三羟甲基氨基甲烷-盐酸缓冲液(下文中有时称为“tris盐酸缓冲液”)、hepes缓冲液(下文中有时称为“hepes缓冲液”)、柠檬酸钠缓冲液(下文中有时称为“柠檬酸缓冲液”)以及碳酸-重碳酸缓冲液(下文中有时称为“碳酸缓冲液”)组成的组中的任一种缓冲液。另外,优选上述肽具有组织特异性递送功能和促进上述组织特异性递送的胶囊向细胞内的摄入的功能;上述肽与在上述靶组织中表达的选自由表面抗原、受体、门、转运蛋白和通道组成的组中的靶蛋白特异性地结合。具体地说,优选上述肽具有选自由序列表的序列号1~3组成的组中的任一者中记载的序列。dmpgtvlpgg(序列表的序列号1)vptdtdysgg(序列表的序列号2)dmpgtvlpgggggsegewqqqqhqwakqe(序列表的序列号3)优选上述肽具有选自由序列表的序列号4~6组成的组中的任一者中记载的序列。此处,优选上述靶组织为发生了炎症的正常组织、包含观察到不期望的基因表达的细胞的组织、由观察到不期望的基因表达的细胞构成的组织、以及由肿瘤细胞构成的组织组成的组中的任一种组织。此处,作为上述发生了炎症的正常组织,可以举出具有作为自身免疫疾病的显著特征的组织等。另外,作为含有观察到不期望的基因表达的细胞的组织,可以举出通过snp分析明确了发病与单碱基置换等基因突变的关联的组织等。作为观察到不期望的基因表达的细胞,可以举出来自上述观察到不期望的基因表达的组织的细胞等。此外,作为由肿瘤细胞构成的组织,可以举出乳腺癌组织、肺癌组织、肝癌组织、子宫颈癌组织等。作为上述的靶向识别部位,可以举出序列表的序列号1~3,作为靶向序列提呈部,可以举出序列表的序列号7~11所示的氨基酸序列。另外,优选上述式(i)所示的聚集性分子为由具有选自由下述式(iii)~(vi)组成的组中的任一种结构的分子表示的聚集性分子,下式中,tspp为具有靶向序列提呈部的荧光蛋白。[化3][化4][化5][化6]此处,优选上述荧光蛋白为选自由红色荧光蛋白、黄色荧光蛋白、蓝色荧光蛋白和绿色荧光蛋白组成的组中的任一种荧光蛋白。另外,上述向细胞内的摄入优选通过选自由胞膜窖介导的胞吞作用、脂筏介导的胞吞作用、巨胞饮作用和吞噬作用组成的组中的任一种细胞内转移途径来进行。发明的效果根据本发明,能够提供一种靶组织特异性递送型药物递送系统用胶囊,其具备能够递送药剂等的载体所需要的全部特性。并且,使上述靶组织特异性递送型药物递送系统用胶囊中包封包含生物高分子的各种药剂,能够组织特异性地递送到靶组织。附图说明图1是示出一般的碳硅烷树状高分子的基本形态的示意图。图2是示出从二甲基硅烷合成二甲基哑铃(1)6-br的合成方案的图。图3是示出所制作的胶束的粒径分布的图。图4是利用扫描型显微镜(sem)对所制作的胶束进行观察时的典型电子显微镜照片。图5是示出gfp与式(x)所示的噻咯树状高分子的复合体(下文中称为“gfp-sd复合体”)的发光特性的调查结果的图。图6是示出在药剂模型的存在下制作的胶束的粒径分布的调查结果的图。图7是示出将包封有dii的gfp-噻咯树状高分子复合体所构成的胶束在370nm进行激发时的发光特性的调查结果的图。图8是示出将gfp-sd复合体所构成的胶束在370nm进行激发时的发光特性的调查结果的图。上述胶束包封有用alexa594标记的wga。图9是改变退火温度进行反向pcr后的pcr产物的电泳图像。图10是示出对结合有靶向肽序列的荧光蛋白缔合驱动型胶束的荧光光谱进行测定的结果的图。图11是mcf-7的结合有靶向肽序列的荧光蛋白缔合驱动型胶束的粒径分布图。图12是利用低温低真空扫描型电子显微镜,为了判断所形成的粒子是胶束还是囊泡而进行观察时的电子显微镜图像。图13是示出靶向型蛋白质和包含靶向型蛋白质的胶束向mcf细胞中的摄入的图。图14是示出在a549细胞与本发明的胶束接触后,24小时后的胶束的摄入差异的facs分析结果。图15是示出在mcf7细胞与本发明的胶束接触后,24小时后的胶束的摄入差异的facs分析结果。图16是示出非靶向型胶束的浓度依赖性变化和经时变化的图。图17是示出靶向型1型胶束的浓度依赖性变化和经时变化的图。图18是示出非靶向型胶束和靶向型胶束的经时变化的图。图19是示出对构成胶囊的蛋白质进行凝胶电泳时的结果的电泳图像。图20a是示出在胶原包被培养皿中进行培养的靶细胞中的非靶向型胶束的摄入的荧光显微镜图像。图20b是示出在聚-d-赖氨酸包被培养皿或胶原包被培养皿中在无胶束情况下对细胞进行培养时的状态的光学显微镜图像。图20c是示出在胶原包被培养皿中进行培养的靶细胞中的靶向型1型胶束的摄入的荧光显微镜图像。图21是示出使用tris-hcl缓冲液(下文中有时称为“缓冲液”)制作的胶束的粒度分布图。图22是示出对使用tris-hcl缓冲液制作的胶束的荧光光谱进行测定的结果的图。图23是使用hepes缓冲液制作的胶束在制作时的粒度分布图。图24是使用hepes缓冲液制作的胶束在制作后第1天的粒度分布图。图25是示出对使用hepes缓冲液制作的胶束的荧光光谱进行测定的结果的图。图26是使用柠檬酸钠缓冲液制作的胶束在制作时的粒度分布图。图27是使用柠檬酸钠缓冲液制作的胶束在制作后第1天的粒度分布图。图28是示出对使用柠檬酸钠缓冲液制作的胶束的荧光光谱进行测定的结果的图。图29是使用碳酸-重碳酸缓冲液制作的胶束的粒度分布。图30是使用碳酸-重碳酸缓冲液制作的胶束在制作经过1天后的粒度分布图。图31是示出对使用碳酸-重碳酸缓冲液制作的胶束的荧光光谱进行测定的结果的图。图32是在含有bsa的溶剂中搅拌后测定的胶束的粒度分布图。图33是在含有bsa的溶剂中在4℃保存6天后测定的胶束的粒度分布图。图34是示出对在含有bsa的溶剂中在4℃保存时的胶束的荧光光谱进行测定的结果的图。图35是示出在对经抑制剂处理的mcf7细胞和胶束进行培养时利用facs得到的细胞内摄入率和荧光寿命的相关性的调查结果的图。图36是示出使用经胞吞作用抑制剂处理的mcf7细胞对胶束在细胞内的摄入率进行调查的结果的图。具体实施方式下面进一步详细地说明本发明。本发明为如上所述的靶组织特异性递送型药物递送系统用胶囊(下文中有时称为“靶向型胶囊”)。本发明的靶向型胶囊通过下述式(i)所示的上述聚集性分子聚集而形成,能够包封生物高分子。并且,构成上述靶向型胶囊的聚集性分子具备靶向序列提呈部(tspp),该靶向序列提呈部(tspp)由(a1)具有用于向靶组织进行特异性递送的靶向识别部位的蛋白质或肽、以及(a2)荧光蛋白构成。[化7]式中,t表示溴原子、或者下述式(ii)所示的靶向序列提呈部。并且,n1和n2分别表示上述靶向序列提呈部的数量,(3-n1)和(3-n2)表示溴原子数。n1和n2为0~3的整数且它们不同时为0。[化8]上述靶向型胶囊中包封的生物高分子为选自由分子量20万以下的蛋白质、核酸以及疏水性分子组成的组中的至少1种分子,也可以同时包封2种以上的上述蛋白质,还可以同时包封上述蛋白质与核酸和/或疏水性高分子。如上所述,本发明中使用的聚集性分子为碳硅烷树状高分子(下文中有时称为“噻咯树状高分子”),从具备聚集性和能够进行靶组织特异性递送所需的、上述式(ii)中示意性示出的靶向序列提呈部(tspp)的方面出发,优选为具有上述式(i)所示的母骨架的化合物。一般的碳硅烷树状高分子为图1的a~c中所示的结构。图1a所示的化合物被称为扇(0)3,其以苯环为核。图1b所示的化合物被称为哑铃(1)6,其是将图1a所示的2分子的扇(0)3分子的作为核的苯环置换成带有2个甲基的硅(me-si-me)、由除核以外的2分子的扇(0)3结合而成的结构。图1c所示的化合物被称为球(1)6,其中哑铃的me-si-me的甲基部分被置换成(si)5,在其上结合扇(0)3的去掉核的分子而形成球状结构(参照图2)。与之相对,如上述式(i)和(ii)所示,本发明的碳硅烷树状高分子与现有的碳硅烷树状高分子具有完全不同的结构,其藉由结合在分子末端的溴原子而具有包含蛋白质分子的靶向序列提呈部。此处,靶向序列提呈部可以由上述式(ii)示意性表示,其由具有用于向靶组织进行特异性递送的靶向识别部位的蛋白质或肽、以及荧光蛋白构成。另外,具有靶向识别部位的蛋白质或肽具有序列表的序列号1~3所示的序列时,在能够进行由上述树状高分子形成的dds用胶囊的靶组织特异性递送的方面是优选的。并且,构成上述靶向序列的蛋白质具有唯一的反应性巯基,上述巯基优选位于折叠后的蛋白质的外侧、即蛋白质表面。这是因为,巯基与存在于上述树状高分子中的卤原子发生反应,承担着使蛋白质与树状高分子结合的作用,因此即使位于折叠后的蛋白的内侧也不能参与结合。此处,“具有巯基的蛋白质”除了包含原本就具有巯基的蛋白质以外,还包含利用基因工程方法等新导入了巯基的蛋白质、以及包含半胱氨酸的蛋白质的半胱氨酸被还原而成为巯基的蛋白质等。蛋白质中的巯基的存在位置没有特别限定,有时优选在蛋白质上的特定区域存在巯基。此外,有时可以对胶囊的发光特性进行控制。需要说明的是,“包含半胱氨酸的蛋白质”中包含的半胱氨酸可以利用与现有的任意氨基酸置换的方法、插入到所期望的位置的方法或其他基因工程方法等导入到所期望的位置。本领域技术人员能够容易地使用定点诱变法或其他公知的基因工程方法来实施向蛋白质的所期望的氨基酸位置导入半胱氨酸残基。构成上述靶向序列提呈部的蛋白质只要具有缔合的性质(下文中有时称为“缔合性”)即可,没有特别限定,优选使用包括绿色荧光蛋白(下文中有时将下述发出绿色以外的荧光的荧光蛋白统称为“gfp”)及其突变体的荧光蛋白。这是因为,结合有这种荧光蛋白的上述碳硅烷树状高分子在蛋白质发生缔合时发出强烈的荧光,能够容易地检测出缔合状态。作为本发明中能够使用的gfp,例如除了序列表的序列号7所示的gfp、序列号8所示的gfp、序列表的序列号9所示的bfp(蓝色荧光蛋白)、序列表的序列号10所示的yfp等以外,还可以举出由clontech公司销售的cfp、rfp和其他gfp衍生物。除此以外,也可以使用序列表的序列号5所示的辐盘海葵来源的荧光蛋白等,出于荧光的强度和易处理性,可以优选使用序列表的序列号7所示的gfp。此外,由于结构上的特性,可以想到也可以优选使用由mbl公司销售的azami-green或其他颜色突变体。另外,这样的gfp可以使用公知的方法(例如参见biochim.biophys.acta1679(2004)222-229;biochem.biophys.res.commun.330(2005)454-460等)来产生,也可以使用委托生产这种蛋白质的企业而制作的gfp。使用包含噻咯及其他引起aie效应的官能团的分子作为树状高分子的骨架,制作由荧光蛋白等缔合性蛋白质构成靶向序列提呈部的本发明的聚集性载体,利用该聚集性载体形成胶束时,从噻咯基聚集的部分也产生荧光,在荧光蛋白-噻咯间发生荧光共振能量转移(fret:fluorescenceresonanceenergytransfer),形成强的荧光。并且,当胶束崩解时,fret消失。因此,若将使用本发明的聚集性载体和靶向序列提呈部制作的胶束用作用于药剂递送的载体,则能够以fret的变化为指标对上述载体(胶束)在生物体内的状态进行监测。进而,由于能够进行这样的监测,因而能够追踪这种载体的存在位置和存在状态。为了在荧光蛋白与噻咯树状高分子之间产生fret,构成靶向序列提呈部的荧光蛋白的哪个位置被固定到上述噻咯树状高分子上是很重要的。本领域技术人员可以通过预实验等容易地确定与树状高分子结合的上述荧光蛋白上的位置。在使用gfp作为构成上述靶向序列提呈部的荧光蛋白的情况下,优选n末端区域、c末端区域、与n末端区域或c末端区域中的任一者相邻的环区域与树状高分子结合,优选在这些区域中存在具有巯基的半胱氨酸等氨基酸。此处,在“n末端区域”的结合是指,从存在于n末端附近的10个氨基酸左右的核部分突出的部分与上述噻咯树状高分子结合的情况。与c末端区域的结合也同样地是指,从存在于c末端区域的10个氨基酸左右的核部分突出的部分与上述噻咯树状高分子结合的情况。负载于本发明的噻咯树状高分子上的卤素基的位置没有特别限定,优选存在于上述噻咯树状高分子的侧链中。更优选如上述式(i)所示存在于侧链的末端(离噻咯基最远的位置)。如上所述,本发明的方法中使用的噻咯树状高分子优选为上述式(i)所示的化合物。该化合物例如后述的方案1所示,可以从1,2-二苯乙炔经由公知的中间体18来合成噻咯核2(1,1-二芳基-2,3,4,5-四苯基噻咯)。接下来,使用h2ptcl6·6h2o作为催化剂,利用三氯硅烷进行2的硅氢化,通过使用芳基镁溴的格氏反应,可以得到噻咯核树状高分子3。利用二氯己基硼烷对所得到的树状高分子3进行处理,之后在碱溶液中用过氧化氢进行水解,得到六羟基衍生物4。接下来,进行六羟基衍生物的o-甲磺酰化,由此与溴阴离子置换,可以得到5(tetrahedronlett.,200748:4365-4368)。[化9]式中,t表示溴原子、或者上述式(ii)所示的靶向序列提呈部。并且,n1和n2分别表示上述靶向序列提呈部的数量,(3-n1)和(3-n2)表示溴原子数。n1和n2为0~3的整数且它们不同时为0。构成上述靶向序列提呈部的具有靶向识别部位的蛋白质只要具有缔合的性质即可,没有特别限定。但是,上述蛋白质优选为选自由红色荧光蛋白、黄色荧光蛋白、蓝色荧光蛋白和绿色荧光蛋白组成的组中的任一种荧光蛋白。这是因为,上述荧光蛋白容易获得,并且由于荧光蛋白本身的荧光强度大,因此通过fret产生强烈的荧光。此处,上述蓝色荧光蛋白包括呈现出蓝色或蓝绿色的荧光的荧光蛋白中的任意一种。关于本发明的聚集性分子,将具有巯基的上述蛋白质(靶向序列提呈部)与在侧链中具有卤素基的树状高分子化合物(式(i))混合并进行温育,使蛋白质的巯基与树状高分子化合物的卤素基反应,使蛋白质与树状高分子化合物结合。此时,蛋白质优选预先利用dtt等还原剂进行处理,预先形成-sh基未被氧化的状态。将通过该反应引入了1分子gfp的情况下的反应示于方案1。[化10]方案1例如,上述方案1所示的反应可以在适当的水性溶剂中进行。此处,作为上述水性溶剂,可以举出例如磷酸缓冲生理盐水(pbs)、生理盐水、三羟甲基氨基甲烷-盐酸缓冲液、hepes缓冲液、柠檬酸缓冲液、碳酸-重碳酸缓冲液及其他水溶性溶剂。进行上述反应时的温度条件根据所使用的蛋白质而不同,反应温度只要低于所使用的蛋白质的变性温度即可,例如可以为约0℃~约50℃、优选为约30℃~约45℃、更优选为约37℃左右。若使用gfp,则直到42℃都可以温度依赖性地提高反应性,因此在dds用聚集性载体材料的制作上优选使用gfp。另外,反应时间也根据反应温度而不同,例如为约1小时~约24小时、优选为约10小时~约19小时、更优选为约15小时~约18小时左右。这是因为,通过为这种程度的反应时间,所使用的具有巯基的蛋白质与上述噻咯树状高分子结合,同时形成脂质体或胶束。即,随着蛋白质-树状高分子复合体的形成,形成具有下述结构的脂质体或胶束:蛋白质(亲水性部分)处于水溶性溶剂侧,树状高分子的核的部分(疏水性部分)以疏水性部分彼此缔合。即,认为通过使上述缔合性蛋白质结合到树状高分子的侧链上,蛋白质的缔合成为驱动力,从而形成脂质体或胶束。此处,至少1个以上的蛋白质与侧链末端的卤原子置换而结合到上述噻咯树状高分子上。因此,上述反应中得到的药物递送系统用聚集性载体材料以上述化学式(iii)~(vi)所示的结合体的混合物的形式获得。在具有巯基的蛋白质为荧光蛋白的情况下,关于这种蛋白质与树状高分子的混合比例(摩尔比),将蛋白质设为1,树状高分子例如可以为1~20、优选为1:5~1:15、更优选为1:10左右。但是,该比例依赖于浓度,最佳值会发生变动。另外,在进行上述反应时,从实现后述的dds中的高效递送的方面出发,优选预先在作为靶向序列提呈部的蛋白质中引入成为靶向识别部位的氨基酸序列。这种靶向识别部位的引入优选通过反向pcr简便地进行。这是因为,只要将如此制作的编码突变体的质粒引入到大肠杆菌中进行表达,就能够容易地得到突变体蛋白,能够得到dds用聚集性分子。通过预先将上述靶向识别部位引入到作为靶向序列提呈部的蛋白质中,能够将本发明的药物递送系统用靶向型胶囊中包封的所期望的药剂在维持活性的状态下特异性地递送到上述发生了炎症的正常组织、观察到不期望的基因表达的组织、由肿瘤细胞构成的组织等中。制作具有上述结构的药物递送系统用靶向型胶囊,使其中包封所期望的药剂,由此能够在维持药剂的有效性的同时,特异性地对靶组织递送这种药剂。实施例下述实施例只不过是示例,并不限定本发明的范围。(实施例1)dds用聚集性分子和胶束的制作本实施例中,作为靶向提呈部制作用的蛋白质,使用如下所述的gfp,另外,作为树状高分子,使用噻咯树状高分子。(1)dds用聚集性分子的制作本实施例中,作为具有卤素基的树状高分子,使用下述的化学式(x)所示的化合物(下文中有时称为“二甲基哑铃(1)6-br”),作为具有巯基的蛋白质,使用gfp(绿色荧光蛋白)(序列号7)。[化11]关于此处使用的gfp(序列表的序列号7),根据发明人已经报道的方法(参见biochim.biophys.acta1679(2004)222-229;biochem.biophys.res.commun.330(2005)454-460),将序列号7所示的gfp的氨基酸序列的c末端区域的第251位氨基酸置换为半胱氨酸,并且将原本存在的半胱氨酸(第48位和第70位)分别置换为丝氨酸和缬氨酸。首先,在浓度20μm的gfp溶液(pbs中)中加入dtt,使终浓度为1mm,在室温下处理10分钟,对存在于gfp表面的半胱氨酸进行还原。在将半胱氨酸还原后的400~450μl的20μmgfp溶液(pbs中)中加入200μm的上述式(vi)所示的噻咯树状高分子溶液(dmso溶剂)10μl,使终浓度为10倍摩尔当量,利用涡旋混合器进行混合。混合后,在37℃下静置,以该状态温育过夜,使gfp与上述噻咯树状高分子结合,继而形成胶束。此时的温育时间为约16~18小时。利用动态光散射法(dls:dynamiclightscattering)测定所得到的包含胶束的溶液中的胶束粒子的特性。将结果示于表1。[表1]25℃、pbs中的原料和产物的5次测定的平均粒径[nm]另外,对于上述反应液,使用zetasizernano-s(malvern公司制造),将激光波长设为532nm,在25℃下测定粒径。将结果示于图3。图3的(a)是仅用gfp进行温育,对所得到的产物的粒径分布进行调查的结果。图3的(b)是仅用式(vi)的噻咯树状高分子进行温育,对所得到的产物的粒径分布进行调查的结果。图3的(c)是将gfp与式(vi)的噻咯树状高分子混合并进行温育,对所得到的产物的粒径分布进行调查的结果。横轴表示所得到的产物的粒径,纵轴表示横轴所示的尺寸的产物在整体中所占的百分比。在将gfp与上述噻咯树状高分子进行温育的情况下(上述表1中,表示为“仅gfp-噻咯”),所得到的胶束的粒径约为150nm。与此相对,仅对gfp进行温育时观察到的粒径约为4nm,仅用上述噻咯树状高分子进行温育时观察到的粒径约为650nm。认为在仅用上述噻咯树状高分子进行温育时观察到的粒径如此变大可能是由于噻咯树状高分子彼此聚集,形成了大的聚集体。接着,利用扫描型电子显微镜(sem:scanningelectronmicroscope)对所得到的胶束的粒子进行观察,结果确认到大量的粒径约为100~500nm的粒子和少量的粒径为500nm左右的粒子(参见图4)。由以上结果可知,使用本发明的dds用聚集性载体形成的胶束的粒径约为100~500nm,粒径约100~200nm左右的胶束多。另外,由使用sem的电子显微镜照片的图像也可以确认形成了球状的胶束结构。(2)荧光共振能量移动的确认本实施例中使用的噻咯树状高分子具有当疏水性的噻咯的核部分聚集时会发光(发挥aie效应)的性质,因此确认了在形成胶束结构的情况下也发光。于是,对于在制作由使gfp结合到噻咯树状高分子上而成的gfp-噻咯树状高分子构成的胶束的情况下,在噻咯与gfp之间是否发生荧光共振能量转移(fret:fluorescenceresonanceenergytransfer)进行了研究。发光特性的实验在从上述反应液中去除未反应的荧光蛋白和树状高分子(游离的分子)后进行(参见图5)。仅用噻咯树状高分子进行温育的产物在370nm的波长下激发(白色空心四边形:□),仅用gfp进行温育的产物在488nm的波长下激发(白色空心三角形:△),使用gfp和噻咯树状高分子进行温育的产物(本发明的胶束)在370nm的波长下激发(黑色圆:●),对各自的发光波长的特性进行调查。关于由gfp-噻咯树状高分子复合体构成的胶束(利用gfp和式(x)的噻咯树状高分子进行温育而得到的产物),在510nm附近观察到由噻咯向gfp的fret引起的发光。如图5所示,在480nm附近观察到噻咯树状高分子的发光的峰。另外,关于gfp与噻咯树状高分子的结合体的发光,未确认到尖锐的峰,在510nm附近显示出最高值。与此相对,gfp的发光在510nm附近观察到尖锐的峰,认为这是从上述噻咯树状高分子向gfp的fret所导致的。另外,在胶束崩解时,被认为是由fret引起的gfp的发光也消失。即,制作使具有aie效应的树状高分子与荧光蛋白等缔合性蛋白质结合而成的分子(gfp-噻咯树状高分子复合体),使用这种分子形成胶束时,以胶束状态在树状高分子与荧光蛋白之间产生fret,并且由于胶束的崩解,fret也消失。由以上表明,使用本发明的胶束作为dds用聚集性载体时,能够确认被递送的组织、器官。另外,即使在被递送到靶组织、器官中的胶束崩解后,也能够追踪荧光蛋白的荧光,由此也能够感知荧光蛋白被递送的细胞内的环境等。(3)药剂等在由gfp-噻咯树状高分子复合体构成的胶束中的包封实验接着,对使用本发明的胶束能否制作包封药剂等的胶束进行了确认。本实施例中,作为模型药剂,使用了dii(1,1’-双十八烷基-3,3,3’,3’-四甲基吲哚碳菁高氯酸盐、promokinepk-ca707-60010,promocellgmbh制造)、油橙ss(东京化成工业株式会社制造,t0553)、山羊抗小鼠igg(abcam公司制造,ab6708)-alexa610(molecularprobes公司制造,a30050)和wga(小麦胚芽凝集素、molecularprobes公司制造)(wga-alexafluoro(注册商标)594偶联物、w11262)。在将半胱氨酸还原后的20μm的gfp中加入200μm的上述式(x)所示的噻咯树状高分子(dmso溶剂)10μl,使终浓度为10倍摩尔当量,进而加入dii(终浓度:1μm、荧光色素)、油橙ss(终浓度:20μm、荧光色素)、山羊抗小鼠igg-alexa610(终浓度:0.1μm)和wga(终浓度:2μm)中的任一种并用涡旋混合器混合,在37℃静置,温育过夜(约16~18小时)。测定在加入有各模型药剂的试样中是否形成了包封各药剂的胶束,并且在形成了胶束的情况下利用上述动态光散射法测定这些胶束的粒径。将结果示于表2。此处,作为药剂模型,使用了dii、油橙ss和山羊抗小鼠igg-alexa610。在图6的a~c中示出使用了上述模型药剂时的粒径分布。图6的a是在dii存在下制作胶束时的粒径分布,图6的b是在油橙ss存在下制作胶束时的粒径分布,图6的c是在山羊抗小鼠igg-alexa610存在下制作胶束时的粒径分布。横轴表示所得到的胶束的粒径,纵轴表示各横轴所示的尺寸的胶束在整体中所占的百分比。加入dii时的胶束的粒径约为95nm,加入油橙ss时也约为95nm,加入igg-alexa610时约为180nm。[表2]25℃、pbs中的5次测定的粒径平均值[nm]将对包封荧光色素dii的胶束的发光特性进行调查的结果示于图7。图7的b是将图7的a的500nm附近的光谱放大的图。横轴表示波长(nm),纵轴表示相对荧光强度(a.u.)。首先,制作包封dii的胶束,分别制备将该胶束用pbs清洗3次的试样;之后用孔径0.45μm的过滤器对该反应溶液进行过滤而除去了游离色素的试样;以及代替0.45μm的过滤器而用0.22μm的过滤器进行过滤而除去了游离色素的试样,对这些试样的荧光进行测定。如图7的a和b所示,在以370nm的波长激发的情况下,在波长480nm附近确认到肩峰,认为是由噻咯的发光引起的。510nm附近的峰认为是从噻咯向gfp的fret引起的,570nm附近的峰认为是从噻咯向dii的fret引起的。由以上结果确认,dii被封入到胶束内。接着,对包封有利用alexa594标记的wga的胶束的发光特性进行了调查(参见图8的a和b)。图8的a是对添加了alexa594标记wga时的反应液直接进行测定的结果。另外,图8的b是利用超滤离心柱(millipore公司制造)从反应液中去除未反应蛋白质等(用alexa594标记的wga、噻咯树状高分子、gfp等及其他未被摄入到胶束中的物质)后进行测定的结果。图8中,实线表示将gfp-噻咯树状高分子复合体和wga进行混合处理而得到的产物的荧光特性,虚线表示将gfp和wga进行混合处理而得到的产物的荧光特性。图中,实线示出对在由gfp-噻咯树状高分子复合体构成的胶束中包封有alexa594标记wga的胶束进行测定的结果,另外,虚线示出对包封有gfp与alexa594标记wga的混合物的胶束进行测定的结果(激发波长均为370nm)。图8的a中示出对未进行超滤离心柱处理的反应液直接进行测定的结果,在该图8的a中,在480nm附近检测出来自噻咯树状高分子的荧光,在510nm附近检测出来自gfp的荧光,另外,在610nm附近检测出来自wga的荧光。与此相对,如图8的b所示,若进行超滤离心柱处理,则游离的噻咯树状高分子、gfp和wga被去除(虚线),因此几乎未检测出来自它们的发光。由以上可以确认,在所制作的胶束中包封有alexa594标记wga。(实施例2)结合有靶向肽序列的荧光蛋白的制备结合有靶向肽序列的荧光蛋白如下制备,该荧光蛋白在c末端与本发明的胶束结合,并且在n末端与靶向肽结合,该靶向肽与在癌细胞表面表达的受体结合。(1)反向pcr(1-1)肽序列的选择将所选择的引入到靶结合部位的肽的氨基酸序列记载于下述表3中。mcf7-1为包含下述表3所示的序列的人乳腺癌来源细胞mcf7(下文中有时称为“靶向型1型”),mcf-2为包含下述表3所示的序列的mcf-1的突变体(下文中有时称为“靶向型2型”)。另外,如下述表3所示,mcf7-1+αstand为具有将α螺旋结构的短肽(下文中称为“αstand”)连接到上述mcf7-1上而成的结构的mcf7-1的另一突变体(下文中有时称为“1型增强型”)。[表3](1-2)引物的制作在下述表4中记载了用于对表3中所示的上述肽序列进行反向pcr的引物。这些引物以如下方式设计:对于序列表的序列号1和3,在上述肽序列的dm和pgtvlp之间开始延伸反应,对于序列号2,在上述肽序列的vp和tdtdysgg之间开始延伸反应。这是鉴于最佳地进行反向pcr的原因。[表4](1-3)反向pcr用模板质粒的制备反向pcr用模板质粒利用下述论文中记载的方法制备。“protease-sensitivesignallingbychemicallyengineeredintramolecularfluorescentresonanceenergytransfermutantsofgreenfluorescentprotein.-mihosuzuki,etal.biochimicaetbiophysicaacta(bba)-genestructureandexpression第1679卷,第3期,2004年9月17日,222-229页”(1-3-1)gfpuv5突变体的质粒构建gfpuv5如下由pgfpgcn4得到。首先,利用i167t突变+使用了正向引物5’cattgaagatggctccgttcaa(序列号18)和反向引物5’ttgtggcgagttttgaagttag(序列号19)的反向pcr,得到产生了基因操作用的同义突变的pcr产物,接着对该pcr产物进行环化处理,由此进行制作。将如上得到的构建体命名为pgfpgcn5。之后,将gfpuv5的cdna克隆到pet21a(novagen公司制造)中,使蛋白进行表达。将此处表达的蛋白质进行纯化,命名为gfpuv5tag。对于其编码区,利用引物5’ctcgaccat[atggctagcatgactggtggacagcaaatgggt]cgcatgagtaaaggagaagaacttttca(序列号20)(与gfpuv5系列的朝向n末端的t7基因的10个蛋白质用的最初的11个氨基酸的表位标签粘着,粘着的标签用[]表示)以及对gfpuv5系列的c末端提供his标签的5’tgacgtgaattcatta[gtgatggtgatggtgatg]tttgtagagctcatccatgc(序列号21)(his标签用[]表示)进行扩增。将序列号1~3所示的碱基序列插入到pet21a中,用ndei和ecori消化。将该pgfpgcn质粒用于基因操作,将pet21a质粒用于t7启动子控制下的蛋白质表达。通过dna测序确认了gfpuv5的基因及其突变体的基因的碱基序列(abiprism3100geneticanalyser公司制造)。实验中发现了另外3个同义突变(ser-30agt突变为agc,his-78cat突变为cac,gln-183caa突变为cag)。这些突变对于荧光蛋白来说并不是有害的,因此在包含这些突变的状态下继续实验。经纯化的gfpuv5tag的荧光强度为gfpuv4tag的约1.9倍。之后,通过使用pgfpgcn5的反向pcr将48位或70位的任一半胱氨酸残基置换为随机氨基酸。将作为寡核苷酸的5’cttaaatttattnnkactggaaaac(序列号22)和5’ggtaagttttccgtatgttg(序列号23)用于半胱氨酸48的突变,将5’gtgttcaannkttttcccgttatccg(序列号24)和5’catacgtcagagtagtgacaag(序列号25)用于半胱氨酸70的突变。用所得到的质粒对大肠杆菌bl21(de3)的培养物进行转化,在日光激发下对强荧光进行筛选,在琼脂培养基上选择。在48位的情况下,得到了几个发出强荧光的突变体(ala、asp、glu、gly、ile、leu、asn、pro、ser、thr、val和tyr置换)。但是,在置换了70位的氨基酸的突变体的情况下,仅c70v半胱氨酸突变体提供了适当的荧光。为了制作具有强荧光强度的双半胱氨酸突变gfpuv5,将具有单突变的质粒用ncoi和ecori消化,再次连接到各区域。利用单突变体进行选择。uv5c0tag(c48s/c70v)在全部重组体中显示出最高的荧光强度。接着,分别通过反向pcr将半胱氨酸导入到6位和229位。该导入中,将具有c48s突变的质粒和下述引物组用于各自的突变。glu置换用:5’tgtcttttcactggagttgtccc(序列号26)和5’ttctcctttactcattttttc(序列号27)ile置换用:5’tgcacacatggcatggatgagctc(序列号28)和5’cccagcagcagttacaaactc(序列号29)包含胰蛋白酶靶向序列(gln-gly-arg)的3个蛋白酶标签具有各种间隔子序列(无间隔子、thr间隔子或gly-thr间隔子),在his-231与asp-234之间进行了必要的半胱氨酸的置换。该构建体使用puvc48stag、所得到的质粒(模板)和下述表5所示的引物获得。[表5](1-3-2)gfpuv5tag突变体的纯化用全部质粒转化大肠杆菌bl21(de3)。将培养过夜后处于静止期的大肠杆菌(12ml)接种于添加有氨苄青霉素(50μg/ml)和iptg(0.5mm)的lb培养基(38ml)中,在37℃温育8小时。以2,500xg离心20分钟,收集细胞,重悬浮于10ml的pbs中。将细胞团在包含50mmtris和8m尿素的10ml溶解缓冲液(ph8.0)中于室温下溶解15分钟,进行涡旋混合。以1,200xg离心15分钟,将上清与悬浮在pbs中的ni2+nta树脂(qiagenco.ltd.制造)混合。用pbs和20mm咪唑依次清洗该树脂后,用250mm的咪唑溶液洗脱结合的gfpuv5tag突变体。为了更换缓冲液,将洗脱物施加到用10倍稀释的pbs平衡的pd-10凝胶电泳过滤柱(amershambioscienceco.ltd.制造)上。收集洗脱的gfpuv5tag突变体蛋白,利用考马斯蛋白检测试剂(pierce公司制造)对它们的浓度进行定量。通过15%sds-page对纯化的gfpuv5tag突变体进行分析。将反向pcr用模板质粒的碱基序列示于序列号26。(1-4)pcr的条件制备下述表6所示的反应液,在下述表7的条件下进行反向pcr。[表6][表7](1-5)通过电泳进行的确认取一部分上述pcr反应液,利用0.8%page在电压100v下进行加压时间30分钟的凝胶电泳,在各样品中确认到扩增的肽。将电泳结果示于图9。(2)非依赖性a序列的去除和pcr产物的纯化制备下述表8的反应液,在120℃反应30分钟,去除通过上述pcr产生的非依赖性a序列。之后,使用qiaquick(注册商标)pcr纯化试剂盒(qiagen公司制造),按照试剂盒附带的说明书对上述pcr产物进行纯化。[表8](3)连接反应接着,制备下述表9所示的反应液,在16℃反应3小时以上,制作后述的大肠杆菌dh5α的转化用环状质粒。根据突变体,分别使用25℃、37℃等。[表9](4)大肠杆菌dh5α的转化将10μl大肠杆菌dh5α的感受态细胞(biodynamicslaboratory公司制造)在即将使用前在冰上解冻,制备感受态细胞溶液。将1μl连接反应液加入到该感受态细胞溶液中,在冰上放置30分钟。之后,在42℃温育30秒后,在冰上冷却2分钟。向其中加入soc(东洋纺株式会社制造)培养基90μl,在37℃在振荡器上反应1小时。之后,接种到含氨苄青霉素的lb选择培养基(东洋纺株式会社制造)上,在37℃静置一晩。(5)菌落pcr由通过上述转化得到的菌落进行菌落pcr,确认了假定的插入物。(5-1)pcr用反应液溶液的制备制备下述表10的菌落pcr用反应液。[表10]将上述菌落pcr用反应液装入到pcr用管中,采集在上述含氨苄青霉素的lb培养基中增殖的大肠杆菌,将其加入。pcr按照下述表11所示的程序进行。[表11](5-2)电泳对于上述pcr反应液,利用1.2%琼脂糖凝胶在施加电压100v下进行时间30分钟的电泳,将可确认到扩增的菌落移植到装有lb液体培养基(东洋纺株式会社制造)的培养瓶中,在37℃下温育。(6)质粒的纯化对于在上述lb液体培养基中培养的大肠杆菌中的上述质粒,利用wizardplussvminipreps.dna纯化系统(promega公司制造),按照产品附带的说明书进行纯化。之后,委托eurofingenomics株式会社对纯化后的质粒的序列进行分析。(7)大肠杆菌bl21(de3)的转化将大肠杆菌bl21(de3)感受态细胞(biodynamicslaboratory公司制造)10μl在即将使用前在冰上解冻,制备感受态细胞溶液。向该感受态细胞溶液中加入通过上述测序可确认到含有目标序列的质粒液1μl,在冰上放置30分钟。之后,在42℃温育30秒后,在冰上冷却2分钟。向其中加入soc(东洋纺株式会社制造)培养基90μl,在37℃下在振荡器上反应1小时。之后,接种到含氨苄青霉素的lb选择培养基中,在37℃静置一晩。第二天,采集被转化而发出绿色荧光的菌落,加入到装有含氨苄青霉素的lb液体培养基1ml的培养瓶中,在37℃静置一晩,进行预培养。(8)结合有靶向肽序列的荧光蛋白的纯化(8-1)菌落的温育向50ml管中加入含氨苄青霉素的lb液体培养基4ml,向其中加入上述预培养液290μl,以此作为试样,准备4个这样的试样,在28℃下在振荡器上培养4小时。之后,加入100mm的iptg(异丙基-β-硫代半乳糖苷)43μl,在28℃下在振荡器上培养一晩。(8-2)蛋白质的回收第二天,将上述4根管的培养液汇集到1根管中。分别用1ml的pbs(-)缓冲液(和光纯药工业株式会社制造)清洗转移内容物后的3根管,将该清洗液也加入到汇集管中。将如上汇集有培养物的管在室温下以5,000rpm(离心机名:kubota3740、转子号kubotaaf2018、久保田商事株式会社制造)离心5分钟。之后,(i)弃去上清,向沉淀的团块中加入pbs(-)缓冲液3ml,(ii)充分搅拌后,以5,000rpm离心5分钟。重复2次上述(i)和(ii)。向沉淀的团块中加入b-per裂解缓冲液(reagent公司制造)4ml,盖上盖子在室温下用振荡器搅拌一晩。(8-3)利用his标签的纯化取ni-nta琼脂糖(qlagen公司制造)2ml到15ml管中,(i)以1,000rpm离心1分钟,(ii)弃去上清,加入1ml1×pbs缓冲液并充分搅拌。重复3次上述(i)和(ii),制备ni-nta树脂。将装有上述b-per裂解缓冲液的管以12,000rpm在室温下离心10分钟后,将上清转移到15ml的falcon管中。向其中加入充分搅拌的上述ni-nta树脂400μl,并用旋转振荡器在室温下搅拌10分钟。之后,以1,000rpm在室温下离心1分钟,弃去上清。向其中(iii)加入1×pbs缓冲液4ml并充分搅拌,(iv)以1,000rpm在室温下离心1分钟,弃去上清。重复2次(iii)和(iv)。之后,(v)加入20mm的咪唑(和光纯药工业株式会社制造)4ml并充分搅拌,(vi)以1,000rpm在室温下离心1分钟,弃去上清。重复2次(v)和(vi)。向其中加入250mm的咪唑500μl,用旋转振荡器在室温下搅拌10分钟。之后以1,000rpm离心1分钟,将发出绿色荧光的上清装入新的15ml的falcon管中,作为接下来的凝胶过滤用蛋白质纯化溶液。(8-4)通过凝胶过滤进行的纯化将上述蛋白质纯化溶液中的咪唑与pbs缓冲液进行置换,纯化得到作为目标的结合有靶向肽序列的荧光蛋白。在以上操作中使用geheathcarejapan株式会社的nap5柱,按照产品附带的说明书进行纯化。(9)结合有靶向肽序列的荧光蛋白的选择根据常规方法测量通过上述纯化操作得到的结合有靶向肽序列的荧光蛋白浓度的吸光度(280nm)以及发色团浓度(形成能力)的吸光度(488nm),选择a488/a280的值超过1.5的荧光蛋白作为目标的结合有靶向肽序列的荧光蛋白。将结果示于表12。[表12](实施例3)结合有靶向肽序列的胶囊(荧光蛋白缔合驱动型胶束)的制作作为蛋白质,代替gfp而使用实施例2中制备的结合有靶向肽序列的荧光蛋白,与实施例1同样地制成结合有靶向肽序列的胶束(荧光蛋白缔合驱动型胶束)。(1)发光特性与实施例1同样地测定上述制作的结合有靶向肽序列的荧光蛋白缔合驱动型胶束的发光特性(参见图10)。在图10的例子中,反应物表示噻咯树状高分子与结合有靶向肽序列的荧光蛋白结合而成的复合体,未反应物表示它们未结合的状态,各数值表示激发光的波长(nm)。在结合有靶向肽序列的胶束的情况下,也与实施例1同样地在510nm附近观察到发光峰。(2)粒子特性与实施例1同样地利用动态光散射法测定上述结合有靶向肽序列的脂质体或胶束的粒子特性(参见图11)。图11中,横轴表示所得到的胶束的粒径,纵轴表示各横轴所示的尺寸的胶束在整体中所占的百分比。其结果,与实施例1同样地确认到具有约100nm~200nm的粒径的粒子。由以上表明,具有靶向肽序列的荧光蛋白结合胶束也形成与不具有靶向序列时同等的胶束。此外,可推测实施例1中得到的胶束和本实施例中得到的胶束均为通过荧光蛋白的缔合形成的荧光蛋白缔合驱动型胶束。(实施例4)dds胶束/脂质体(囊泡)形态判定实验(1)基本脂质体或胶束的制作如下制作脂质体或胶束。首先,利用10kamicon过滤柱(amicon公司制造),以14,000xg将含gfp溶液离心15分钟进行浓缩,加入1xpbs定容到99μl。使用20μm的含gfp溶液,为了制作50μm/50μl的胶束,浓缩了137.5μl的gfp。接下来,向该溶液中加入1μl100mm的dtt,在室温下温育10分钟。将温育的全部量的溶液加到nick柱(geheathcarejapan公司制造)上,加入365μl的1xpbs。进一步,加入380μl的1xpbs,回收几乎全部量。接下来,对于回收的溶液中包含的gfp,按照摩尔比为1:10的方式加入7.78mm的tps(2,3,4,5-四苯基-1,1-二甲基噻咯)3.53μl,在37℃使溶液中的分子聚集过夜。接下来,将聚集过夜的约380μl溶液全部加入到100kamicon过滤柱中,以14,000xg离心10分钟进行浓缩,取约30μl作为柱上液。向其中加入100μl的1xpbs,以14,000xg离心10分钟进行清洗。重复3次该清洗操作,收集清洗液约300μl。以14,000xg离心10分钟后,将柱倒置,利用台式离心机回收柱上液。向空的柱中加入适量的1xpbs,用1xpbs定容到目标体积的1.2倍。在4℃放置1天进行平衡,稀释成20倍测定粒度。另外,荧光测定使用岛津rf5300-pc,以激发波长370nm、测定波长488nm对稀释80倍的样品进行测定(范围为3x5)。另外,将加入到100kamicon过滤器中并以14,000xg离心10分钟后的溶液中的约350μl作为柱下液。与上述清洗液合并为650μl,稀释成20倍,测定粒度。另外,荧光测定中使激发波长为370nm、测定波长为488nm,对稀释25倍的样品进行测定(范围为3x5)。将此处得到的非靶向型脂质体或胶束命名为nss25和nss26。(2)利用电子显微镜得到的判定结果使用低温低真空扫描型电子显微镜(hitachihigh-technologies制造、商品目录编号s-3400n)进行脂质体或胶束的判断,结果大体上观察到的分子为脂质体(囊泡)。在液氮气氛下进行切片的观察。利用该电子显微镜,得到入射电子束的反射电子图像作为bse图像,并且得到二次电子图像作为se图像。另外,还同时进行了利用x射线的元素分析。将bse图像示于图12的(a)~(c)。图中,白色圆和白色箭头所示的结构物被认为是盐的结晶。另外,黑色圆和黑色箭头所示的结构物被认为是囊泡样物质。在低分辨率的扫描型电子显微镜图像中,主要观察到多数囊泡型样分子。对其一部分进行了元素分析,结果也有检测出硅的分子(参见图12)。(实施例5)脂质体(囊泡)或胶束的浓度依赖性稳定性试验(1)试样胶束(具有靶结合部位的胶束)的制作如下制作50μmx50μl的量的试样胶束。作为基本胶束,分别使用16.1μm和31.6μm的上述实施例4中制作的非靶向型胶束(nss25和nss26)。使用11.3μm的包含mcf7的序列作为靶向识别部位的靶向型胶束(序列表的序列号12和13)。将上述包含各脂质体或胶束的胶束溶液分别加入到amicon10k过滤器中,以14,000xg离心15分钟,分别回收上清。将各胶束溶液用1xpbs定容到99μl,加入1mm的dtt1μl,在室温下静置10分钟。接着,利用nick柱对各脂质体或胶束溶液进行处理,向所得到的各处理液中加入tps3.21μl,在37℃放置过夜。(2)脂质体(囊泡)或胶束的浓度依赖性的确认分别将如上述(1)那样得到的各胶束溶液各380μl加入到amicon100k过滤器中,以14,000xg离心10分钟。约350μl穿过过滤器而落下,因此将其作为下液,将残留于过滤器上的约30μl作为上液。原样保留上液,向其中加入100μl的1xpbs,以14,000xg离心10分钟,回收穿过过滤器的约100μl溶液。重复3次该操作,将所得到的溶液与下液合并,稀释20倍,与基本胶束同样地测定dls(粒度分布)。将包含上液的过滤器设置于台式离心机(kubota公司制造)中,离心2~3分钟并回收。接着,向变空的过滤器中加入适量的1xpbs并静置10分钟。之后,将该过滤器倒置,设置于台式离心机中离心2~3分钟,回收过滤器内的溶液,加入1xpbs定容到60μl,制成50μm/50μl的原液(1x)。将该原液用1xpbs稀释5倍、10倍和50倍,为了平衡而在室温下放置1天。之后,与基本胶束的情况下同样地进行粒度测定和荧光测定。显示出以临界胶束浓度以上制成的胶束在1个月后也可能稳定存在。(实施例6)dds胶束的构成蛋白物性确认试验(1)蛋白质的纯化为了确认上述胶束的构成蛋白的物性,利用nintasuperflow(qiagen公司制造)按照以下步骤对上述构成蛋白进行纯化。(1-1)蛋白质从聚集分子的溶出首先,取50μl基本胶束(50μm/50μl)加入到50ml的falcon管(falcon公司制造)中,用20mm的咪唑清洗,之后加入250mm的咪唑。利用旋转振荡器反应过夜,使蛋白质从胶束溶出。将该falcon管直接设置到离心机(kubota公司制造)中,以12,000rpm离心10分钟,将所得到的上清移至15ml的falcon管中。(1-2)ninta树脂浆料的制备在如上所述对falcon管进行离心的期间,进行ninta树脂(包含于nintasuperflow中)的准备。首先,取ninta琼脂糖2.5ml,去除防腐剂。接下来,将包含ninta琼脂糖凝胶的该溶液充分振荡,均匀混合,移至15ml的falcon管中。之后,利用台式离心机以1,000rpm离心1分钟,使凝胶沉淀,用移液管除去上清,加入1xpbs1ml并振荡混合,进行涡旋混合。重复3次该操作。在第3次离心后用移液管除去上清,制成浆料。除了使用的量以外,在4℃进行保存。(1-3)各蛋白质的纯化在15ml的falcon管中的上述构成蛋白溶液中滴加上述浆料400μl,注意不要使上述浆料附着到管的内壁。之后,设置于旋转振荡器中,将存储预设调整到最快,反应10分钟。接着,将管从旋转振荡器上取下,利用动物细胞用离心机(taitec公司制造)以1,000prm离心1分钟,弃去上清。向残留于管底的团块中加入1xpbs4ml,进行涡旋混合,利用上述离心机以1,000rpm离心1分钟。重复2次该操作。向所得到的团块中加入20mm的咪唑4ml并涡旋混合,利用上述离心机以1,000rpm离心1分钟。重复2次该操作。接下来,向所得到的团块中加入250mm的咪唑500μl,设置于旋转振荡器中,将存储预设调整到最快,反应10分钟。接着,将管从旋转振荡器上取下,利用上述动物细胞用离心机以1,000rpm离心1分钟,移至上述新的15ml的falcon管中。向留在旧管中的团块中再次加入250mm的咪唑,设置于旋转振荡器中,将存储预设调整到最快,反应5分钟。接着,将管从旋转振荡器上取下,利用上述动物细胞用离心机以1,000rpm离心1分钟,取上清与之前的上清合并。重复5次该操作。(1-4)凝胶电泳对于如上纯化的各蛋白质(gfp),如下进行凝胶电泳。首先,准备各约10μl的包含5μm各蛋白质的溶液,加入到1.5ml的有盖管中。作为分子量标志物(梯状标志物),取precisionprotein宽范围预染标准品(biorad公司制造)10μl,同样地加入到1.5ml管中。制备下述表13所示组成的分离胶(12%)和表14所示组成的浓缩胶(4%)。[表13]组成容量x4分离胶缓冲液2.5ml40%丙烯酰胺凝胶溶液(包含19:1的双丙烯酰胺-丙烯酰胺)3.12ml10%aps50μltemed(正式名称:四甲基乙二胺)50μl蒸馏水余量总量10ml[表14]组成容量x4浓缩胶缓冲液1.25ml40%丙烯酰胺凝胶溶液(包含19:1的双丙烯酰胺-丙烯酰胺)0.5ml10%aps25μltemed(四甲基乙二胺)6μl蒸馏水余量总量5ml施加各纯化蛋白质溶液和分子量标志物,以200v、20ma电泳60分钟,之后进一步电泳75分钟。另外,使用具有下述表15所示组成的电泳缓冲液。[表15]组成容量2.5mm三(2-氨基-3-羟甲基-1,3-丙二醇)3.03g192mm甘氨酸14.4g0.1%sds1g蒸馏水余量总量1,000ml将结果示于图19。图19的(a)是染色前的结果,图19的(b)是用考马斯亮蓝(cbb)染色后的结果。由凝胶电泳结果可知,靶向型2型(mcf7-2)由于由碳硅烷树状高分子构成的笼状结构紧密,因此荧光强度强,但靶向性低。另外可知,1型增强型(mcf7-1+αstand)的情况下,上述笼状结构松,靶向性高,但荧光弱。由以上表明,笼状结构的松紧方式和靶向识别部位的结构很重要。(实施例7)dds脂质体或胶束中的药剂包封实验作为包封的药剂,使用橙ot(orangeot)。使用80μm的含gfp溶液,将10.28μl7.78mm的tps碳化,除此以外,按照与上述基本胶束的制作工序相同的步骤制备胶束溶液。接着,按照相对于gfp以摩尔比(终浓度)计为1:1的方式加入橙ot(8mm的橙ot的原液)1μl。接下来,按照相对于gfp以摩尔比(终浓度)计为20:1的方式加入dii282(400μm的dii282的原液),在37℃使其过夜摄入。接下来,以达到目标体积的1.2倍的方式用1xpbs对柱上液进行定容,之后从pvdf过滤器(孔径0.45μm或0.22μm)中通过,除此以外,按照与基本胶束的制作相同的步骤进行处理、回收,以相同的稀释倍率进行粒度和荧光测定。对于上液,按照与基本脂质体或胶束的制作相同的步骤进行处理,以相同的稀释倍率进行粒度和荧光测定。关于药剂的包封,认为疏水性和亲水性物质均可,但认为需要分别进行胶束形成条件的优化。(实施例8)dds脂质体或胶束的细胞摄入实验(1)实验方法对于达到融合的mcs7细胞,利用0.25%的胰蛋白酶溶液剥落,制备细胞悬浮液(1x109个/ml)。将各3ml的该细胞悬浮液接种到5枚胶原包被培养皿(mattek公司制造)或聚-d-赖氨酸培养皿(mattek公司制造)中。在细胞附着于孔的底面后,利用移液管从各孔中除去培养基,加入适当量的dmem(+),以附着细胞不剥落的方式重复3次清洗操作。在3小时和24小时观察用的胶原包被培养皿的各孔中加入450μl的dmem(+)。接下来,在阴性对照的孔中加入1xpbs50μl。在7.3μl的1型增强型的原液中加入42.7μl的1xpbs,将所得到的50μl的样品1加入到2枚培养皿的各孔中。另外,向8.4μl的非靶向型的原液中加入41.6μl的1xpbs,将所得到的样品2加入到另外2枚培养皿中。在聚-d-赖氨酸培养皿的阴性对照的孔中也加入1xpbs50μl。另外,在24小时观察用的一枚培养皿中,加入向8.1μl的非靶向型(nss26)的原液中加入了41.9μl的1xpbs而成的样品2。之后立即进行照片拍摄,在37℃下在5%co2的存在下进行3小时或24小时的培养。培养结束后,加入1ml的dmem(+)对细胞进行清洗。重复3次该操作。(2)利用共聚焦显微镜fv-100(olympus公司制造fv1000d)得到的观察结果对于dapi,利用405nm的激光激发,观察460nm的发光,对树状高分子的部分进行观察。另外,对于gfp部分,观察515~520nm的发光。将观察结果示于图20a~20c。图20(a)和图20(c)的上层均是摄入实验开始后3小时的荧光显微镜图像,下层是该实验开始后24小时的荧光显微镜图像。对3小时的结果(图20c上层)和24小时的观察结果(图20c下层)进行比较,结果认为,在24小时的情况下也是具有靶向性的胶束更准确地被摄入靶细胞(参见图16~18)中。图16(a)和18(a)示出了非靶向型(nss25)的结果,另外,图16(b)和18(b)示出了非靶向型(nss26)的结果。图18(c)示出了靶向型1型胶束的结果。(3)分析方法分析软件使用imagej。将各区域的荧光强度数值化,通过胶束的荧光强度与荧光蛋白的荧光强度的比例来确认胶束的崩解、荧光蛋白的残存。关于facs的测量,使用flowjo作为分析用软件。在分析时,使用仅有细胞的数据,选择自身发出荧光的细胞群。并且,从全部数据中减去自身发出荧光的细胞群。将结果示于图13~15。图13的(a)示出hepg2靶向型1型蛋白质(-)(-)和mcf7靶向型1型蛋白质(-)(-)的摄入,另外,图13的(b)示出hepg2靶向型1型蛋白质(+)(+)和mcf7靶向型1型蛋白质(+)(+)的摄入。图13的(c)示出hepg2靶向型1型胶束(-)(-)和mcf7靶向型1型胶束(-)(-)的摄入,另外,图13的(d)示出hepg2靶向型1型蛋白质(+)(+)和mcf7靶向型1型蛋白质(+)(+)的摄入。图14的(a)示出无胶束的情况下的结果,图14的(b)和14的(c)示出使用非靶向型胶束的情况下的结果,图14的(d)和图14的(e)示出使用靶向型胶束的情况下的结果。图15的(a)~图15的(e)中使用的胶束与图14相同。图中所示的数字为减去自身荧光后剩余的细胞数/总测定细胞数。在下述表16中,对自身荧光的细胞群进行5次判定,示出其平均值。[表16]由以上表明,若细胞的状态好则可被靶向化;并且,胶束与细胞长时间接触会使非靶向胶束也通过通常的胞吞作用被大量摄入。但是,靶向型的胶束与非靶向型的胶束相比有可能更快地被摄入。另外,认为被摄入的胶束可在细胞内崩解。(实施例9)tris盐酸缓冲液中的荧光蛋白缔合驱动型胶束形成代替实施例1的胶束制作时使用的pbs而使用tris盐酸缓冲液来制作本申请的荧光蛋白缔合驱动型胶束。首先,制备含有50μm的实施例2中制备的序列号1的肽序列的结合有靶向肽序列的荧光蛋白(下文中有时称为“mcf7-1荧光蛋白”),将219.2μl该溶液使用10kamicon过滤柱(amicon公司制造)以14,000xg离心15分钟进行浓缩,加入50mmtris盐酸缓冲液(ph8.0),定容到99μl。接下来,向该溶液中加入1μl100mm的dtt,在室温下温育10分钟。将温育的全部量的溶液(100μl)施加到预先用0.05mtris盐酸缓冲液(ph8.0)清洗了5次的nick柱(gehealthcarejapan公司制造)上,用365μl0.05μm的tris盐酸缓冲液(ph8.0)洗脱。进一步加入380μl0.05m的tris盐酸缓冲液(ph8.0)进行洗脱,回收洗脱液的几乎全部量。在回收的溶液中加入10.28μl7.78mm的tps(yoyulabo株式会社制造),搅拌10分钟后,在37℃过夜,使溶液中的分子聚集,制成胶束反应液。将上述胶束反应液装入100kamicon过滤柱(merck公司制造)中,以14,000xg离心10分钟进行浓缩,之后向该过滤柱的柱上液中加入1xpbs,以14,000xg离心10分钟进行清洗。重复3次该清洗操作,进行缓冲液交换。回收约300μl的清洗液,将它们汇集,作为胶束未反应液。将100kamicon过滤柱倒置,用小型离心机离心,回收柱上液(纯化胶束液),在变空的amicon过滤柱中加入适量的1xpbs,静置10分钟。再次将amicon过滤柱倒置,离心、回收后加入1xpbs,定容到160μl,得到纯化胶束液。为了确认所形成的胶束的粒径和在溶液中的稳定性,进行以下的实验。分别制备将所得到的纯化胶束液使用1xpbs进行20倍稀释而成的测定用试样1以及进行50倍稀释而成的测定用试样2。将胶束未反应液用1xpbs稀释25倍,作为测定用试样3。为了研究在溶液中的稳定性,将这些稀释液在室温静置4天。测定用试样1中的粒子的粒径使用zetasizernano-s(malvern公司制造)进行测定。其结果表明形成了约100~200nm的均匀的胶束(图21)。测定用试样2中的粒子的荧光光谱使用rf5300-pc(株式会社岛津制作所制),以激发波长370nm、测定波长488nm进行测定。测定用试样3中包含的粒子的荧光光谱在与测定试样2同样的条件下进行测定。图22a中示出了上述测定试样1~3的制备时的测定结果,另外,图22b中示出了4天后的测定结果。另外,图中,未反应物表示mcf7-1荧光蛋白与sd呈未结合状态,反应物表示它们呈结合状态。各数值表示激发光的波长(nm)。由图22a和22b确认到形成了mcf7-1荧光蛋白与sd结合而成的胶束,并且所形成的胶束在4天后仍稳定存在。由以上确认到,本发明的sd即使在tris盐酸缓冲液中也与具有靶向提示序列的gfp结合,形成均匀稳定的胶束。(实施例10)hepes缓冲液中的荧光蛋白缔合驱动型胶束形成除了将tris盐酸缓冲液(ph8.0)替换成50mmhepes缓冲液(ph7.6)这一点以外,在与实施例9同样的条件下对缓冲液中的胶束形成、所形成的胶束的粒径和稳定性进行确认。如图23所示,形成了约100~200nm的均匀的胶束。另外,如图24所示,在胶束制作经过1天后,胶束仍稳定地存在。图25的(a)示出了在胶束制作时进行测定的结果,图25的(b)示出了在胶束制作后第1天进行测定的结果。如图25a和25b所示,由荧光测定结果确认到,形成了mcf7-1荧光蛋白与sd结合而成的胶束,并且在胶束制作1天后该胶束稳定地存在。由以上确认到,即使在代替tris盐酸缓冲液而使用hepes缓冲液的情况下也形成了均匀稳定的胶束。(实施例11)柠檬酸钠缓冲液中的荧光蛋白缔合驱动型胶束形成除了代替tris盐酸缓冲液(ph8.0)而使用50mm柠檬酸钠缓冲液(ph7.6)这一点以外,设定为与实施例9同样的条件,对缓冲液中的胶束形成、所形成的胶束的粒径和稳定性进行确认。如图26所示,在柠檬酸钠缓冲液中,也形成了约100~200nm的均匀的胶束。另外,如图27所示,在胶束制作经过1天后,粒径也几乎无变化,表明胶束在该缓冲液中稳定地存在。图28的(a)为胶束制作时的测定结果,图28的(b)为胶束制作经过1天后的测定结果,图28的(c)为胶束制作经过2天后的测定结果。如图28的(a)~图28的(c)所示,表明形成了mcf7-1荧光蛋白与sd结合而成的胶束,并且该胶束至少稳定地存在到胶束形成后第2天。由以上确认到,即使在代替tris盐酸缓冲液而使用柠檬酸钠缓冲液的情况下也形成了均匀稳定的胶束。(实施例12)碳酸-重碳酸缓冲液中的荧光蛋白缔合驱动型胶束形成除了代替tris盐酸缓冲液(ph8.0)而使用碳酸-重碳酸缓冲液(ph8.0)这一点以外,设定为与实施例9同样的条件,对缓冲液中的胶束形成、所形成的胶束的粒径和稳定性进行确认。如图29~图30所示,在碳酸-重碳酸缓冲液中也形成了约100~200nm的均匀的胶束,并且在胶束制作经过1天后粒径也几乎无变化,表明该胶束在缓冲液中稳定地存在。图31的(a)表示胶束制作时的测定结果,图31的(b)表示胶束制作经过1天后的测定结果,图31的(c)表示胶束制作经过2天后的测定结果。如图31的(a)~图31的(c)所示,确认到形成了mcf7-1荧光蛋白与sd结合而成的胶束,并且所形成的胶束至少稳定地存在到制备后第2天。(实施例13)分散介质中的蛋白质对胶束的影响为了研究在生物体内的递送时并存的蛋白质会对所形成的胶束带来怎样的影响,进行了体外试验。作为模型系统,经时地研究了分散介质中包含的蛋白质(bsa)对胶束形成的影响。出于与gfp具有同等程度的分子量、是在血中大量含有的蛋白质、以及容易获得的原因,选择了bsa。首先,将实施例3中制作的50μm的荧光蛋白驱动型胶束(具有mcf7-1作为靶向提示序列,下文中有时称为“mcf7-1胶束”)用100kamicon过滤柱浓缩,制作100μm的mcf7-1胶束液。接着,在200μl的100μmmcf7-1胶束液中加入100μl的4%bsa(shigma-aldrich公司制造),制备bsa-胶束混合液(试样)。另外,在对照中,加入100μl的pbs,制备pbs-胶束混合液(对照)。这些制备时以及在4℃保存后的试样和对照的粒径和溶液中的胶束稳定性在与实施例9同样的条件下进行测定。如图31和图33所示,形成了约50~200nm的粒径的胶束。另外,在4℃保存的情况下,即使在6天后胶束的粒径也没有变化,表明以稳定的状态存在。图34的(a)为保存开始时进行测定的图,图34的(b)为保存6天后进行测定的图。如图34a所示,即使在bsa-胶束混合液中也未观察到对胶束状态的影响。如图34b所示,确认到与370nm的pbs-胶束混合液的荧光强度相比,bsa-胶束混合液的荧光强度稍高,在保存6天后,即使在bsa存在下对胶束的状态也没有影响。由以上表明,即使在分散介质中存在蛋白质,胶束也至少稳定地存在6天。(实施例14)胶束向细胞内的摄入途径的研究使用胞吞作用抑制剂来研究本发明的胶束向细胞内的摄入途径。首先,将达到融合的mcf-7细胞用0.25%胰蛋白酶溶液剥落,制备细胞悬浮液(1x109个/ml)。将该细胞悬浮液以各1.5ml接种在35mm培养皿(使用12孔联排培养皿)中。在细胞附着于孔的底面后,利用移液管从各孔中除去培养基,加入适当量的dmem(+),以附着细胞不剥落的方式进行清洗。重复3次该操作。在各孔中加入440μl的dmem(+),将用pbs制备的1mm氯丙嗪(和光纯药工业株式会社制造)、用dmso或乙醇制备的500mm甲基-β-环糊精(和光纯药工业株式会社制造)、以及用dmso或乙醇制备的1mm细胞松弛素b(和光纯药工业株式会社制造)分别在分开的孔中加入30μl,在37℃、5%co2的温育箱中温育30分钟。之后,在各孔中加入实施例3中制作的50μmmcf7-1胶束50μl,在37℃、5%co2的温育箱中培养6小时~7.5小时。培养结束后,加入1ml的dmem(+)清洗细胞。重复3次该操作。使用facs研究胶束向细胞中的摄入率和荧光寿命的相关性。如图35所示,结果,胶束的细胞摄入率与荧光寿命具有正相关性。另外,制备表17所示的抑制剂制备中使用的溶剂和facs测定时使用的溶剂组合而成的各溶剂组,研究facs测定时所使用的溶剂的影响。[表17]如图36所示,在利用甲基-β-环糊精或细胞松弛素b处理的细胞的情况下,胶束的细胞摄入率低于100%,抑制了向细胞内的摄入。另一方面,在氯丙嗪处理细胞中,胶束向细胞中的摄入率高于100%,促进了向细胞内的摄入。由以上表明,胶束向细胞中的摄入途径为胞膜窖胞吞作用、脂筏胞吞作用、吞噬作用或巨胞饮作用。工业实用性本发明在药物制剂领域、特别是药剂递送领域中是有用的。序列号1:引入gfp中的靶向识别序列肽(mcf7-1)序列号2:引入gfp中的靶向识别序列肽(mcf7-2)序列号3:引入gfp中的靶向识别序列肽(mcf7-1+αstand)序列号4:引入了mcf7-1的gfp序列号5:引入了mcf7-2的gfp序列号6:引入了mcf7-1+αstand的gfp序列号7:gfp的氨基酸序列序列号8:gfp的氨基酸序列序列号9:bfp的氨基酸序列序列号10:yfp的氨基酸序列序列号11:辐盘海葵来源的荧光蛋白的氨基酸序列序列号12:mcf7-1的扩增用正向引物序列号13:mcf7-1的扩增用反向引物序列号14:mcf7-2扩增用正向引物序列号15:mcf7-2扩增用反向引物序列号16:mcf7-1+αstand扩增用正向引物序列号17:mcf7-1+αstand扩增用反向引物序列号18:反向pcr用正向引物序列号19:反向pcr用反向引物序列号20:反向pcr用正向引物序列号21:反向pcr用反向引物序列号22:寡核苷酸序列号23:寡核苷酸序列号24:寡核苷酸序列号25:寡核苷酸序列号26:反向pcr用正向引物序列号27:反向pcr用反向引物序列号28:反向pcr用正向引物序列号29:反向pcr用反向引物序列号30:反向pcr用正向引物序列号31:反向pcr用反向引物序列号32:反向pcr用正向引物序列号33:反向pcr用反向引物序列号34:反向pcr用正向引物序列表<110>国立大学法人埼玉大学(saitamauniversity)石匠株式会社(quarrymenco.ltd)<120>使用碳硅烷树状高分子的药物递送系统用靶向型壳(shellforddsbyusingcarbosilanedendrimer)<130>p17su002pct<160>34<170>patentinversion3.5<210>1<211>10<212>prt<213>人类(homosapiens)<220><221>肽(peptide)<222>(1)..(10)<223>mcf7-1<400>1aspmetproglythrvalleuproglygly1510<210>2<211>10<212>prt<213>人类(homosapiens)<220><221>肽(peptide)<222>(1)..(10)<223>mcf7-2<400>2valprothraspthrasptyrserglygly1510<210>3<211>29<212>prt<213>人类(homosapiens)<220><221>肽(peptide)<222>(1)..(29)<223>mcf7-1+αstand肽(mcf7-1+alphastandpeptide)<400>3aspmetproglythrvalleuproglyglyglyglyglyserglugly151015glutrpglnglnglnglnhisglntrpalalysglnglu2025<210>4<211>272<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(272)<400>4metalasermetthrglyglyglnglnmetglyargaspmetprogly151015thrvalleuproglyglymetserlysglyglugluleuphethrgly202530valvalproileleuvalgluleuaspglyaspvalasnglyhislys354045pheservalserglygluglygluglyaspalathrtyrglylysleu505560thrleulyspheileserthrthrglylysleuprovalprotrppro65707580thrleuvalthrthrleuthrtyrglyvalglncyspheserargtyr859095proasphismetlysarghisaspphephelysseralametproglu100105110glytyrvalglngluargthrileserphelysaspaspglyasntyr115120125lysthrargalagluvallysphegluglyaspthrleuvalasnarg130135140ilegluleulysglyileaspphelysgluaspglyasnileleugly145150155160hislysleuglutyrasntyrasnserhisasnvaltyrilethrala165170175asplysglnargasnglyilelysalaasnphelysthrarghisasn180185190ilegluaspglyservalglnleualaasphistyrglnglnasnthr195200205proileglyaspglyprovalleuleuproaspasnhistyrleuser210215220thrglnseralaleuleulysaspproasnglulysargasphismet225230235240valleuleugluphevalthralaalaglyserglyilethraspglu245250255valaspglythrgluleutyrlysglyglyhishishishishishis260265270<210>5<211>272<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(272)<400>5metalasermetthrglyglyglnglnmetglyargvalprothrasp151015thrasptyrserglyglymetserlysglyglugluleuphethrgly202530valvalproileleuvalgluleuaspglyaspvalasnglyhislys354045pheservalserglygluglygluglyaspalathrtyrglylysleu505560thrleulyspheileserthrthrglylysleuprovalprotrppro65707580thrleuvalthrthrleuthrtyrglyvalglncyspheserargtyr859095proasphismetlysarghisaspphephelysseralametproglu100105110glytyrvalglngluargthrileserpheasnaspaspglyasntyr115120125lysthrargalagluvallysphegluglyaspthrleuvalasnarg130135140ilegluleulysglyileaspphelysgluaspglyasnileleugly145150155160hislysleuglutyrasntyrasnserhisasnvaltyrilethrala165170175asplysglnargasnglyilelysalaasnphelysthrarghisasn180185190ilegluaspglyservalglnleualaasphistyrglnglnasnthr195200205proileglyaspglyprovalleuleuproaspasnhistyrleuser210215220thrglnseralaleuleulysaspproasnasplysargasphismet225230235240valleuleugluphevalthralaalaglyserglyilethraspglu245250255valaspglythrgluleutyrlysglyglyhishishishishishis260265270<210>6<211>292<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(292)<400>6metalasermetthrglyglyglnglnmetglyargaspmetprogly151015thrvalleuproglyglyglyglyglysergluglyglutrpglngln202530glnglnhisglntrpalalysglnglumetserlysglyglugluleu354045phethrglyvalvalproileleuvalgluleuaspglyaspvalasn505560glyhislyspheservalserglygluglygluglyaspalathrtyr65707580glylysleuthrleulyspheileserthrthrglylysleuproval859095protrpprothrleuvalthrthrleuthrtyrglyvalglncysphe100105110serargtyrproasphismetlysarghisaspphephelysserala115120125metprogluglytyrvalglngluargthrileserphelysaspasp130135140glyasntyrlysthrargalagluvallysphegluglyaspthrleu145150155160valasnargilegluleulysglyileaspphelysgluaspglyasn165170175ileleuglyhislysleuglutyrasntyrasnserhisasnvaltyr180185190ilethralaasplysglnargasnglyilelysalaasnphelysthr195200205arghisasnilegluaspglyservalglnleualaasphistyrgln210215220glnasnthrproileglyaspglyprovalleuleuproaspasnhis225230235240tyrleuserthrglnseralaleuleulysaspproasnglulysarg245250255asphismetvalleuleugluphevalthralaalaglyserglyile260265270thraspgluvalaspglythrcysgluleutyrlysglyglyhishis275280285hishishishis290<210>7<211>263<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(263)<223>gfp<400>7metalasermetthrglyglyglnglnmetglyargmetserlysgly151015glugluleuphethrglyvalvalproileleuvalgluleuaspgly202530aspvalasnglyhislyspheservalserglygluglygluglyasp354045alathrtyrglylysleuthrleulyspheileserthrthrglylys505560leuprovalprotrpprothrleuvalthrthrleuthrtyrglyval65707580glncyspheserargtyrproasphismetlysarghisaspphephe859095lysseralametprogluglytyrvalglngluargthrileserphe100105110lysaspaspglyasntyrlysthrargalagluvallyspheglugly115120125aspthrleuvalasnargilegluleulysglyileaspphelysglu130135140aspglyasnileleuglyhislysleuglutyrasntyrasnserhis145150155160asnvaltyrilethralaasplysglnlysasnglyilelysalaasn165170175phelysthrarghisasnilegluaspglyservalglnleualaasp180185190histyrglnglnasnthrproileglyaspglyprovalleuleupro195200205aspasnhistyrleuserthrglnseralaleuleulysaspproasn210215220glulysargasphismetvalleuleugluphevalthralaalagly225230235240serglyilethraspgluvalaspglythrcysgluleutyrlysgly245250255glyhishishishishishis260<210>8<211>258<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(258)<223>gfp<400>8metalasermetthrglyglyglnglnmetglyargmetserlysgly151015glugluleuphethrglyvalvalproileleuvalgluleuaspgly202530aspvalasnglyhislyspheservalserglygluglygluglyasp354045alathrtyrglylysleuthrleulyspheilecysthrthrglylys505560leuprovalprotrpprothrleuvalthrthrleuthrtyrglyval65707580glncyspheserargtyrproasphismetlysarghisaspphephe859095lysseralametprogluglytyrvalglngluargthrileserphe100105110lysaspaspglyasntyrlysthrargalagluvallyspheglugly115120125aspthrleuvalasnargilegluleulysglyileaspphelysglu130135140aspglyasnileleuglyhislysleuglutyrasntyrasnserhis145150155160asnvaltyrilethralaasplysglnlysasnglyilelysalaasn165170175phelysthrarghisasnilegluaspglyservalglnleualaasp180185190histyrglnglnasnthrproileglyaspglyprovalleuleupro195200205aspasnhistyrleuserthrglnseralaleuleulysaspproasn210215220glulysargasphismetvalleuleugluphevalthralaalagly225230235240ilethrhisglymetaspgluleutyrlysglyglyhishishishis245250255hishis<210>9<211>259<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(259)<223>gfp<400>9metalasermetthrglyglyglnglnmetglyargmetvalserlys151015glyglugluleuphethrglyvalvalproileleuvalgluleuasp202530glyaspvalasnglyhislyspheservalserglygluglyglugly354045aspalathrtyrglylysleuthrleulyspheilecysthrthrgly505560lysleuprovalprotrpprothrleuvalthrthrleuthrhisgly65707580valglncyspheserargtyrproasphismetlysglnhisaspphe859095phelysseralametprogluglytyrvalglngluargthrilephe100105110phelysaspaspglyasntyrlysthrargalagluvallyspheglu115120125glyaspthrleuvalasnargilegluleulysglyileaspphelys130135140gluaspglyasnileleuglyhislysleuglutyrasnpheasnser145150155160hisasnvaltyrilemetalaasplysglnlysasnglyilelysval165170175asnphelysilearghisasnilegluaspglyservalglnleuala180185190asphistyrglnglnasnthrproileglyaspglyprovalleuleu195200205proaspasnhistyrleuserthrglnseralaleuserlysasppro210215220asnglulysargasphismetvalleuleugluphevalthralaala225230235240glyilethrleuglymetaspgluleutyrlysglyglyhishishis245250255hishishis<210>10<211>259<212>prt<213>维多利亚多管发光水母(aequoreavictoria)<220><221>肽(peptide)<222>(1)..(259)<400>10metalasermetthrglyglyglnglnmetglyargmetvalserlys151015glyglugluleuphethrglyvalvalproileleuvalgluleuasp202530glyaspvalasnglyhislyspheservalserglygluglyglugly354045aspalathrtyrglylysleuthrleulyspheilecysthrthrgly505560lysleuprovalprotrpprothrleuvalthrthrpheglytyrgly65707580leuglncysphealaargtyrproasphismetlysglnhisaspphe859095phelysseralametprogluglytyrvalglngluargthrilephe100105110phelysaspaspglyasntyrlysthrargalagluvallyspheglu115120125glyaspthrleuvalasnargilegluleulysglyileaspphelys130135140gluaspglyasnileleuglyhislysleuglutyrasntyrasnser145150155160hisasnvaltyrilemetalaasplysglnlysasnglyilelysval165170175asnphelysilearghisasnilegluaspglyservalglnleuala180185190asphistyrglnglnasnthrproileglyaspglyprovalleuleu195200205proaspasnhistyrleusertyrglnseralaleuserlysasppro210215220asnglulysargasphismetvalleuleugluphevalthralaala225230235240glyilethrleuglymetaspgluleutyrlysglyglyhishishis245250255hishishis<210>11<211>236<212>prt<213>维多利亚多管发光水母(actiniaequina)<220><221>肽(peptide)<222>(1)..(236)<220><221>肽(peptide)<222>(1)..(236)<223>gfp<400>11metalasersergluaspvalilelysgluphemetargphelysval151015argmetgluglyservalasnglyhisgluphegluilegluglyglu202530glygluglyargprotyrgluglythrglnthralalysleulysval354045thrlysglyglyproleuprophealatrpaspileleuserprogln505560pheglntyrglyserlysvaltyrvallyshisproalaaspilepro65707580asptyrlyslysleuserpheprogluglyphelystrpgluargval859095metasnphegluaspglyglyvalvalthrvalthrglnaspserser100105110leuglnaspglycyspheiletyrlysvallyspheileglyvalasn115120125pheproseraspglyprovalmetglnlyslysthrmetglytrpglu130135140proserthrgluargleutyrproargaspglyvalleulysglyglu145150155160ilehislysalaleulysleulysaspglyglyhistyrleuvalglu165170175phelysseriletyrmetalalyslysprovalglnleuproglytyr180185190tyrtyrvalaspserlysleuaspilethrserhisasngluasptyr195200205thrilevalgluglntyrgluargthrgluglyarghishisleuphe210215220leuglythrcysglyglyhishishishishishis225230235<210>12<211>45<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(45)<400>12cctggtactgttcttcctggtggtatgagtaaaggagaagaactt45<210>13<211>27<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(27)<223>引物(primer)<400>13catatcgcgacccatttgctgtccacc27<210>14<211>45<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(45)<223>用于mcf7-1的引物(primerformcf7-1)<400>14actgatactgattatagtggaggaatgagtaaaggagaagaactt45<210>15<211>27<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(27)<223>用于mcf7-1的引物(primerformcf7-1)<400>15aggaacgcgacccatttgctgtccacc27<210>16<211>51<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(51)<223>用于mcf7-2的引物(primerformcf7-2)<400>16caacaacaacaacatcaatgggcaaaacaagaaatgagtaaaggagaagaa51<210>17<211>42<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(42)<223>用于mcf7-2的引物(primerformcf7-2)<400>17ccattcaccttcactaccaccaccaccaccaggaagaacagt42<210>18<211>22<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(22)<223>用于mcf7-1+αstand肽的引物(primerformcf7-1+alphastandpeptide)<400>18cattgaagatggctccgttcaa22<210>19<211>22<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(22)<223>用于mcf7-1+αstand肽的引物(primerformcf7-1+alphastandpeptide)<400>19ttgtggcgagttttgaagttag22<210>20<211>70<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)forinversepcr<220><221>prim_transcript<222>(1)..(70)<223>用于反向pcr的引物(primerforinversepcr)<400>20ctcgaccatatggctagcatgactggtggacagcaaatgggtcgcatgagtaaaggagaa60gaacttttca70<210>21<211>54<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(54)<223>用于反向pcr的引物(primerforinversepcr)<400>21tgacgtgaattcattagtgatggtgatggtgatgtttgtagagctcatccatgc54<210>22<211>25<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(25)<223>用于反向pcr的引物(primerforinversepcr)<220><221>misc_feature<222>(13)..(14)<223>nisa,c,g,ort<400>22cttaaatttattnnkactggaaaac25<210>23<211>20<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(20)<223>用于反向pcr的引物(primerforinversepcr)<400>23ggtaagttttccgtatgttg20<210>24<211>26<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸(oligonucleotide)<220><221>misc_binding<222>(1)..(26)<220><221>misc_feature<222>(9)..(10)<223>n为a,c,g或t<400>24gtgttcaannkttttcccgttatccg26<210>25<211>22<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸(oligonucleotide)<220><221>misc_binding<222>(1)..(22)<400>25catacgtcagagtagtgacaag22<210>26<211>23<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸(oligonucleotide)<220><221>misc_binding<222>(1)..(23)<400>26tgtcttttcactggagttgtccc23<210>27<211>21<212>dna<213>人工序列(artificialsequence)<220><223>寡核苷酸(oligonucleotide)<220><221>misc_binding<222>(1)..(21)<400>27ttctcctttactcattttttc21<210>28<211>24<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(24)<223>用于反向pcr的引物(primerforinversepcr)<400>28tgcacacatggcatggatgagctc24<210>29<211>21<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(21)<223>用于反向pcr的引物(primerforinversepcr)<400>29cccagcagcagttacaaactc21<210>30<211>33<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(33)<223>用于反向pcr的引物(primerforinversepcr)<400>30cagcgccgttgtgagctctacaaataatgaatt33<210>31<211>21<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(21)<223>用于反向pcr的引物(primerforinversepcr)<400>31tgtaatcccagcagcagttac21<210>32<211>21<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(21)<223>用于反向pcr的引物(primerforinversepcr)<400>32acatgtgagctctacaaataa21<210>33<211>18<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(18)<400>33acggccctgtgtaatccc18<210>34<211>21<212>dna<213>人工序列(artificialsequence)<220><223>引物(primer)<220><221>prim_transcript<222>(1)..(21)<223>用于反向pcr的引物(primerforinversepcr)<400>34ggaacatgtgagctctacaaa21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1