用于靶向MENA蛋白同种型激酶的抗癌疗法的方法和组合物与流程
本申请要求2016年7月8日提交的美国临时申请号62/360,190、2017年3月9日提交的美国临时申请号62/469,373、2017年4月21日提交的美国临时申请号62/488,464以及2017年5月19日提交的美国临时申请号62/508,892的权益,所述申请各自的内容以引用的方式整体并入本文。
序列表的并入
序列表特此提供为2017年7月7日创建且大小为24kb的标题为“010739-5005-wo-sequence-listing.txt”的文本文件。所述文本文件的内容以引用的方式整体并入本文。
发明领域
本发明包括用于通过调节mena激酶的活性来抑制癌症转移和纤维化疾病的组合物。
发明背景
癌症是一种复杂疾病,其特征主要在于异常细胞的不受控制的生长和扩散。癌症仍然是世界上最严重的健康问题之一,并且在美国是继心脏病之后的第二最常见的死亡原因。当在早期检测到癌症时,大多数患者具有有利预后。已进展至转移性疾病阶段的晚期癌症患者通常具有不良预后,并且此类癌症占所有癌症相关死亡的大约90%。目前的肿瘤疗法和新的治疗剂的开发集中于通过针对原发性肿瘤的抗增殖细胞毒性或靶向疗法来抑制癌细胞增殖。
通常可抑制转移进展的有效抗转移疗法的开发可显著改善患者结果和存活。由于驱动恶性细胞播散的过程在癌症中共享,因此抑制转移级联的药物将在多种癌症适应症中广泛有益。目前可用的抗转移药物分为两大类;抗血管(血管生成)和基质金属蛋白酶(mmp)抑制剂。这些药物的主要限制一直是缺乏功效和无差别的分子抑制。
所缺乏的是靶向肿瘤细胞迁移、内渗和转移,从而使原发性肿瘤停滞于进展缓慢状态的有效疗法,所述进展缓慢状态随后可用现有方法靶向。
mena蛋白及其同种型一直牵涉于转移的连续、多步骤过程中并且已经显示参与肿瘤细胞的内渗和运动。mena是ena/vasp蛋白家族的成员,其在肌动蛋白聚合中起着关键调控作用。pymt小鼠乳腺癌模型中的mena缺乏遏制内渗,消除死亡率和发病率,并且大大降低转移性播散至肺部的频率。menainv在异种移植物小鼠乳腺肿瘤中的表达促进从原位肿瘤自发性肺转移的形成增加,并且改变肿瘤细胞对表皮生长因子(egf)、肝细胞生长因子(hgf)和胰岛素样生长因子(igf)等的敏感性。
在患者中,高水平的mena表达与增加的转移风险相关,其已经在来自随后发展癌症转移的患有早期疾病的患者的肿瘤样品中观察到。高水平的mena表达与患有早期乳腺癌、肺鳞状细胞癌、宫颈癌、结肠直肠癌和胰腺癌的患者的癌症转移的风险增加相关。mena选择性剪接以产生在肿瘤进展期间差异表达的多种蛋白质同种型。两种最佳表征的同种型是仅在侵袭性肿瘤细胞中表达的menainv和mena11a(一种在原发性乳腺癌中表达且在侵袭性肿瘤细胞中下调的上皮特异性同种型)。menainv表达通过加强其对表皮生长因子(egf)的趋化反应而在乳腺癌细胞中表达时赋予有效的促转移表型,从而通过增加其与巨噬细胞的旁分泌信号传导来增强其参与有效流动运动的能力。在跨物种和不同肿瘤类型的侵袭性肿瘤细胞中mena上调的保守性表明它在转移进展中起关键作用。
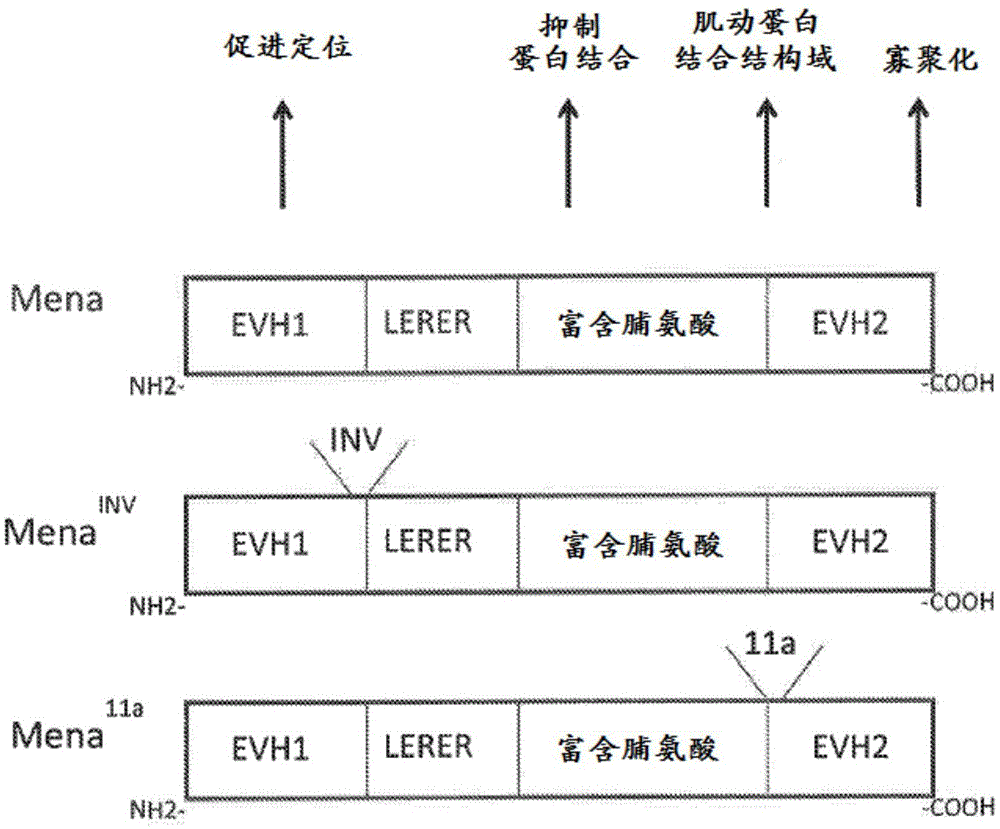
mena由至少四个公认的结构域组成,包括促进定位的evh1、lerer基序、随后是参与抑制蛋白(profilin)结合的富含脯氨酸的序列,随后是evh2结构域内的一系列肌动蛋白结合基序,其后是寡聚化基序。这些结构域的排列如图1中所示。menainv同种型是通过外显子选择性剪接至menamrna转录物中而形成,其导致刚好在蛋白质的evh1结构域之后的位置116处插入19个氨基酸的区段。mena11a同种型通过外显子选择性剪接至menamrna转录物中而产生,其在mena蛋白的evh2结构域内的位置513处插入21个氨基酸的区段。
本发明降低mena和mena同种型的活性以驱动侵袭性癌症从原发性肿瘤扩散至远处转移部位并阻断与纤维化疾病相关的过量纤维蛋白原沉积。本发明通过降低menainv同种型的存在或活性、增加mena11a同种型的存在或活性和或通过抑制来自ras-raf-mek-mapk/erk和pi3k-akt/mtor途径的激酶抑制剂调节mena或mena同种型的活性的能力而减轻与癌症转移、肿瘤细胞耐药性和纤维蛋白原沉积相关的mena依赖性表型。当与降低mena或menainv同种型的存在或活性、增加mena11a同种型的存在或活性和或抑制来自ras-raf-mek-mapk/erk和p13k-akt/mtor途径的激酶调节mena或mena同种型的活性的能力的药物组合施用时,本发明还增加抗肿瘤酪氨酸激酶抑制剂(tki)和或抗微管药物的功效。
mena蛋白经由多种过程起作用,所述过程对于肿瘤细胞侵袭和转移、肌动蛋白聚合、粘附以及egf引发的运动反应非常重要。高度迁移和侵袭性肿瘤细胞亚群产生含有mena的选择性剪接形式的menamrna。一种这样的选择性剪接形式menainv是癌症转移风险的预后,描述于美国专利申请公布号2012/0028252中,所述专利申请以引用的方式整体并入本文。另一种选择性剪接形式mena11a描述于美国专利申请公布号2010/0047240中,所述专利申请以引用的方式整体并入本文。用于鉴别各种mena同种型并将它们彼此区分开的方法和组合物描述于美国专利申请公布号2010/0033258中,所述专利申请也以引用的方式整体并入本文。
mena蛋白经由多种过程起作用,所述过程对于肿瘤细胞侵袭和转移、肌动蛋白聚合、粘附以及egf引发的运动反应非常重要。高度迁移和侵袭性肿瘤细胞亚群产生含有mena的选择性剪接形式的menamrna。一种这样的选择性剪接形式menainv是癌症转移风险的预后,描述于美国专利申请公布号2012/0028252中,所述专利申请以引用的方式整体并入本文。另一种选择性剪接形式mena11a描述于美国专利申请公布号2010/0047240中,所述专利申请以引用的方式整体并入本文。用于鉴别各种mena同种型并将它们彼此区分开的方法和组合物描述于美国专利申请公布号2010/0033258中,所述专利申请也以引用的方式整体并入本文。
mena蛋白经由多种过程起作用,所述过程对于肿瘤细胞侵袭和转移、肌动蛋白聚合、粘附以及egf引发的运动反应非常重要。高度迁移和侵袭性肿瘤细胞亚群产生含有mena的选择性剪接形式的menamrna。一种这样的选择性剪接形式menainv是癌症转移风险的预后,描述于美国专利申请公布号2012/0028252中,所述专利申请以引用的方式整体并入本文。另一种选择性剪接形式mena11a描述于美国专利申请公布号2010/0047240中,所述专利申请以引用的方式整体并入本文。用于鉴别各种mena同种型并将它们彼此区分开的方法和组合物描述于美国专利申请公布号2010/0033258中,所述专利申请也以引用的方式整体并入本文。
本发明部分地源于mena在调控磷酸酪氨酸受体信号传导中起作用的观察结果。一些癌症对包含酪氨酸激酶抑制剂(tki)的治疗完全没有反应或微弱反应。许多癌症对包含酪氨酸激酶抑制剂(tki)的治疗产生抗性,所述酪氨酸激酶抑制剂初始减少肿瘤细胞生长和增殖、但最终丧失功效。menainv通过限制内源性去磷酸化酶如ptp1b使靶受体对通过其同源配体刺激不敏感的能力而阻断至少一种tki靶受体蛋白(egfr)的去磷酸化的发现提出了menainv同种型与侵袭性癌症表型高度相关的原因的模型。在这种模型中,menainv通过破坏去磷酸化酶复合物与靶受体的缔合,通过去磷酸化破坏诱导受体的正常下调而使肿瘤细胞对生长因子刺激敏感。相比之下,mena11a同种型在侵袭性肿瘤细胞中下调,并且mena11a的表达与内聚肿瘤形态学相关。降低mena或menainv同种型的存在或活性、或者可替代地增加mena11a同种型的存在或活性的任何治疗可提供一种用于限制或根除转移性癌症和或纤维化疾病表型的发展的方法。此外,降低mena或menainv的存在或活性和或增加mena11a的存在或活性可改善并延长目前基于tki的疗法的功效。用于调节mena同种型活性的一种潜在方法是通过抑制mena激酶活性来调控mena和或mena同种型的磷酸化和去磷酸化。
本发明还部分基于以下发现:邻近mena的丝氨酸125(ser125)磷酸化位点和menainv的等效丝氨酸144(ser144)磷酸化位点的肽序列是mapkapk2/mk2激酶的有效底物。用不可磷酸化的氨基酸置换mena中的ser125和或menainv中的ser144将所述肽底物改变为mapkapk2/mk2激酶的有效肽抑制剂。hayess和benndorf发现肽序列kkkalhrqlgvaa(seqidno:30)是mapkapk2/mk2的有效抑制剂并且是基于mapkapk2/mk2底物热休克蛋白hsp25/27的共有序列结合结构域。mapkapk2/mk2依赖性磷酸化的质谱磷酸化蛋白质组学分析表明,与hsp27相比,mena/menainv是更有效的mapkapk2/mk2底物。在阿霉素处理的细胞中,menaser125磷酸化位点变得比hsp27ser82磷酸化位点(约2.5倍增加)更重地磷酸化(约8倍增加)。用不可磷酸化的甘氨酸残基置换ser125/ser144丝氨酸残基以将mena/menainv底物肽转化为有效的mena激酶抑制剂。
附图说明
图1表示mena蛋白同种型的比对,其中鉴别了单独结构域的功能。menainv所特有的19个氨基酸插入的相对位置通过“\inv/”指示,并且mena11a的23个氨基酸插入的相对位置通过“\11a/”指示。
图2示出从用对ser125处的磷酸化mena(pser125mena)、磷酸化p38(pp38)、磷酸化hsp27(phsp27)和微管蛋白的存在具有特异性的抗体探测的重组细胞系mvd7-menainv回收的蛋白质的蛋白质印迹。用tnf-α刺激实验样品并用抑制剂处理,如所指示。
图3示出从用针对mena的磷酸化ser125(pser125mena)和微管蛋白的抗体探测的mvd7-menainv的重组细胞系回收的蛋白质的蛋白质印迹。用tnf-α刺激实验样品并用抑制剂处理,如所指示。
图4表示从用针对mena的磷酸化ser125(pser125mena、微管蛋白和磷酸化hsp27(phsp27)的抗体探测的mda-mb-231menainv的重组细胞系回收的蛋白质的蛋白质印迹。用tnf-α刺激实验样品并用抑制剂处理,如所指示。
图5是用各种抑制剂处理的各种重组mvd7细胞系的细胞扩散测定的显微照片的集合。图(a)mena无效gfp对照,图(b)gfp-mena(ser144a),图(c)未处理的mvd7-menainv,图(d)用pi3k激酶抑制剂ly294002(pi3k-ly02)10um处理的mvd7-menainv,图(e)用p38mapk激酶抑制剂(ly2228820)10um处理的mvd7-menainv,图(f)用mapkapk2/mk2(pf-3644022)10um处理的mvd7-menainv,图(g)用mek1/mek2抑制剂(pd0325901)1um处理的mvd7-menainv,图(h)用mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽(100um)处理的mvd7-menainv。
图6是图5的细胞扩散测定结果的图,其中mvd7-gfp对应于图(a),mvd-ser144a对应于图(b),0对应于图(c),pi3k激酶抑制剂ly294002(pi3k-ly02)10um对应于组(d),p38mapk激酶抑制剂(p38-ly820)10um对应于图(e),mek1/mek2激酶抑制剂(erk1/2-pd)1um对应于图(f),mapkapk2/mk2激酶抑制剂pfizerpf-364402210um对应于图(g),并且h&b-100表示100um的kkkalhrqlgvaa(seqidno:30)肽抑制剂,对应于图(h)。h&b-300表示300um的kkkalhrqlgvaa(seqidno:30)肽抑制剂(图5中未示出)。
图7是用各种抑制剂处理并针对dna(dapi)和肌动蛋白丝(鬼笔环肽)以及纤连蛋白沉积染色的重组mvd7-menainv细胞系(除了如图(a)和(b)中所示)的纤连蛋白原纤维生成测定的显微照片的集合。图(a)mvd7-gfp,图(b)mvd7-menainv(ser144a),图(c)pi3k激酶抑制剂(ly294002)10um,图(d)p38mapk激酶抑制剂(ly2228820)10um,图(e)mapkapk2/mk2(pf-3644022)10um,图(f)mek1/mek2抑制剂(pd0325901)1um,以及图(g)分别100和300um的mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽。
图8是图7的纤连蛋白原纤维生成测定(相对纤连蛋白沉积)的结果的图,其中mvd7-gfp对应于图(a),mvd7-ser144a对应于图(b),0表示由未处理的mvd7-menainv细胞沉积的纤连蛋白,pi3k激酶抑制剂ly294002(pi3k-ly02)10um对应于图(c),p38激酶抑制剂ly2228820(p38-ly820)10um对应于图(d),mek1/mek2抑制剂pd0325901(erk1/2-pd)1um对应于图(e),mapkapk2/mk2激酶抑制剂(pf-3644022)10um对应于图(f),mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽(h&b-100)100um对应于图(g),并且mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽(h&b-300)300um对应于图(h)。置信水平通过以下表示:**,p=0.0022,***,p=0.0002,并且****,p<0.0001。
图9是用各种抑制剂处理的mda-mb-231-meaninv细胞的伤口测定中细胞迁移的显微照片的集合。在每个图上方示出伤口闭合的估计百分比。图(a)是处理前的细胞,图(b)在无抑制剂的培养基中18小时后的细胞,图(c)在补充有pi3k激酶抑制剂ly294002(10um)的培养基中18小时后的细胞,图(d)在补充有p38激酶抑制剂ly2228820(10um)的培养基中18小时后的细胞,图(e)在补充有mapkapk2/mk2激酶抑制剂pf-3644022(10um)的培养基中18小时后的细胞,图(f)在补充有mek1/mek2激酶抑制剂pd0325901(1um)的培养基中18小时后的细胞,图(g)在补充有mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽(h&b-100)100um的培养基中18小时后的细胞,以及h)在补充有mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽(h&b-100)300um的培养基中18小时后的细胞。
图10是细胞侵袭和趋化性基质胶测定的结果的图。在与pi3k激酶ly29400210um、p38激酶抑制剂ly2228820(p38-ly820)10um、mapkapk2/mk2激酶抑制剂(pf-3644022)10um、mek1和mek2抑制剂pd0325901(erk1/2-pd)1um以及kkkalhrqlgvaa(seqidno:30)肽抑制剂100和300um一起孵育后,mena激酶抑制剂逆转mda-md-231-menainv肿瘤细胞中的mena依赖性侵袭和趋化性表型。mda-mb-231-δmenacrisprmena无效细胞系未显示任何显著的细胞侵袭和趋化性表型,观察到少数细胞朝向egf迁移。置信水平通过以下表示:*,p<0.04。
图11是博伊登室(boydenchamber)测定内细胞迁移和趋化性的结果的图。在与pi3k激酶抑制剂ly294002(pi3k-ly02)10um、p38mapk激酶抑制剂(ly2228820)10um、mapkapk2/mk2(pf-3644022)10um、mek1/mek2抑制剂pd0325901(erk1/2-pd)1um以及mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽100um和300um一起孵育后,mena激酶抑制剂逆转mda-md-231menainv肿瘤细胞中的mena依赖性迁移和趋化性表型。mda-mb-231-δmenacrisprmena无效和不可磷酸化的mena-ser144a细胞系两者都未表现出细胞侵袭和趋化性表型,观察到少数细胞朝向egf迁移。置信水平通过以下表示:**,p<0.04,并且***,p<0.0004。
具体实施方式
提供了一种用于治疗患有实体瘤的患者的癌症的方法,所述方法包括降低受试者中的mena和或mena的menainv同种型的存在或活性,并且还可包括增加受试者中的mena11a同种型的存在或活性。所述方法涉及通过施用药物来抑制mena和或menainv蛋白同种型的磷酸化或去磷酸化,所述药物通过mena激酶抑制磷酸基团转移至mena和或menainv同种型底物中的丝氨酸、苏氨酸和/或酪氨酸残基。类似地,所述方法涉及活化mena11a同种型底物的磷酸化或去磷酸化。所述方法可涉及施用如本文所述的mena-和或menainv-和mena11a-特异性药物,以同时降低mena和或menainv的存在或活性并增加mena11a的存在或活性。如本文所用,术语“mena激酶抑制剂”是指抑制mena同种型(包括但不限于mena、menainv以及mena11a)的磷酸化或去磷酸化的任何组合物。
在本发明的一个实施方案中,所述mena激酶抑制剂是小分子、肽、蛋白质、抗体、单克隆抗体、抗体片段、rna适体、核酶或sirna。
在一个实施方案中,所述mena激酶抑制剂是atp竞争性抑制剂。在另一个实施方案中,所述mena激酶抑制剂是非atp竞争性抑制剂。
在一个实施方案中,所述mena激酶抑制剂是可逆抑制剂。在另一个实施方案中,所述mena激酶抑制剂是不可逆的共价抑制剂。
在一个实施方案中,所述mena激酶抑制剂是ras-raf-mek-erk和或pi3k-pten-atk-mtor途径的抑制剂。包括但不限于raf、p38map、mek、mapk、pkd-1、pi3k、akt和mtor抑制剂或本领域技术人员熟悉的类似蛋白激酶抑制剂。
在一个实施方案中,所述mena激酶抑制剂是mapk活化的蛋白激酶(mapk激酶)的抑制剂。如本文所用,术语“mapk激酶”共同地指若干mapk活化的蛋白激酶中的每一种和全部,包括但不限于mapk活化的蛋白激酶2(mapkapk2或mk2)抑制剂、mapk活化的蛋白激酶3(mapkapk3或mk3)抑制剂、mapk活化的蛋白激酶5(mapkapk5或mk5)抑制剂或本领域技术人员熟悉的类似mapk活化的蛋白激酶抑制剂。在一个优选的实施方案中,所述mena激酶抑制剂特异性地抑制mapkapk2(mk2)。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的磷酸化:mena(seqidno.:1)中的ser2、ser5、tyr16、ser29、thr30、ser33、tyr38、thr41、thr45、tyr70、thr74、thr76、tyr87、ser93、ser102、ser113、thr116、thr119、ser125、ser136、ser265、ser266、ser272、thr275、ser279、ser284、ser285、ser287、ser295、thr300、ser302、ser327、ser344、thr345、ser375、ser381、ser383、thr390、ser405、thr410、ser411、ser414、ser423、ser425、ser426、thr428、thr430、ser442、ser444、ser449、ser463、thr464、thr467、ser477、thr481、ser482、ser485、ser486、thr487、ser488、thr489、thr493、thr500、thr502、ser506、ser508、ser512、ser516、thr517、ser520、ser523、tyr534、ser550、ser565、ser567或thr569氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂消除mena蛋白的ser125的磷酸化。
在另一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的去磷酸化:mena(seqidno.:1)中的磷酸化ser2、ser5、tyr16、ser29、thr30、ser33、tyr38、thr41、thr45、tyr70、thr74、thr76、tyr87、ser93、ser102、ser113、thr116、thr119、ser125、ser136、ser265、ser266、ser272、thr275、ser279、ser284、ser285、ser287、ser295、thr300、ser302、ser327、ser344、thr345、ser375、ser381、ser383、thr390、ser405、thr410、ser411、ser414、ser423、ser425、ser426、thr428、thr430、ser442、ser444、ser449、ser463、thr464、thr467、ser477、thr481、ser482、ser485、ser486、thr487、ser488、thr489、thr493、thr500、thr502、ser506、ser508、ser512、ser516、thr517、ser520、ser523、tyr534、ser550、ser565、ser567或thr569氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂消除mena蛋白的磷酸化ser125的去磷酸化。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的磷酸化:menainv外显子(seqidno.:2)的ser3、thr6、thr8、ser11、thr12,或位于menainv蛋白(seqidno.:3)的位置117-135处的menainv外显子序列侧翼近侧的氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂减少或消除menainv蛋白同种型的ser144的磷酸化。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的磷酸化:meaninv(seqidno.:3)中的ser2、ser5、tyr16、ser29、thr30、ser33、tyr38、thr41、thr45、tyr70、thr74、thr76、tyr87、ser93、ser102、ser113、thr116、ser119、thr122、thr124、ser127、thr128、thr138、ser144、ser155、ser284、ser285、ser306、thr294、ser303、ser304、ser306、ser134、thr319、ser321、ser346ser363、thr364、ser394、ser400、ser402、ser409、ser424、thr429、ser430、ser433、ser442、ser444、ser445、thr447、thr449、ser461、ser468、ser482、thr483、thr486、ser496、thr500、ser501、ser504、ser505、thr506、ser507、thr508、thr512、thr519、thr521、ser525、ser527、ser531、ser535、thr536、ser539、ser542、thr548、tyr553、thr569、ser584、ser586或thr588氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂消除menainv蛋白同种型的ser144的磷酸化。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的去磷酸化:menainv外显子(seqidno.:2)的磷酸化ser3、thr6、thr8、ser11、thr12,或位于menainv蛋白(seqidno.:3)的位置117-135处的menainv外显子序列侧翼近侧的磷酸化氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂减少或消除menainv蛋白同种型的磷酸化ser144的去磷酸化。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的磷酸化:menainv(seqidno.:3)中的磷酸化ser2、ser5、tyr16、ser29、thr30、ser33、tyr38、thr41、thr45、tyr70、thr74、thr76、tyr87、ser93、ser102、ser113、thr116、ser119、thr122、thr124、ser127、thr128、thr138、ser144、ser155、ser284、ser285、ser306、thr294、ser303、ser304、ser306、ser134、thr319、ser321、ser346ser363、thr364、ser394、ser400、ser402、ser409、ser424、thr429、ser430、ser433、ser442、ser444、ser445、thr447、thr449、ser461、ser468、ser482、thr483、thr486、ser496、thr500、ser501、ser504、ser505、thr506、ser507、thr508、thr512、thr519、thr521、ser525、ser527、ser531、ser535、thr536、ser539、ser542、thr548、tyr553、thr569、ser584、ser586或thr588氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂消除menainv蛋白同种型的磷酸化ser144的去磷酸化。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的磷酸化:mena11a外显子(seqidno.:4)的ser3、ser15、tyr16、ser18,位于mena11a蛋白(seqidno.:5)的位置514-534处的mena11a外显子序列侧翼近侧的氨基酸,或seqidno.:5的ser125。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的磷酸化:mena11a(seqidno.:5)中的ser2、ser5、tyr16、ser29、thr30、ser33、tyr38、thr41、thr45、tyr70、thr74、thr76、tyr87、ser93、ser102、ser113、thr116、thr119、ser125、ser136、ser265、ser266、ser272、thr275、ser279、ser284、ser285、ser287、ser295、thr300、ser302、ser327、ser344、thr345、ser375、ser381、ser383、thr390、ser405、thr410、ser411、ser414、ser423、ser425、ser426、thr428、thr430、ser442、ser444、ser463、thr464、ser477、thr481、ser482、ser485、ser486、thr487、ser488、thr489、thr493、thr500、thr502、ser506、ser508、ser512、ser516、ser528、tyr529、ser531、ser537、thr538、ser541、ser544、thr550、tyr555、thr571、ser586、ser588或thr590氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂消除mena11a蛋白同种型的ser125的磷酸化。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的去磷酸化:mena11a外显子(seqidno.:4)的磷酸化ser3、ser15、tyr16、ser18,位于seqidno.:5的位置514-534处的mena11a外显子序列侧翼近侧的磷酸化氨基酸,或seqidno.:5的ser125。
在一个实施方案中,所述mena激酶抑制剂减少或消除以下中的一者或多者的去磷酸化:mena11a(seqidno.:5)中的磷酸化ser2、ser5、tyr16、ser29、thr30、ser33、tyr38、thr41、thr45、tyr70、thr74、thr76、tyr87、ser93、ser102、ser113、thr116、thr119、ser125、ser136、ser265、ser266、ser272、thr275、ser279、ser284、ser285、ser287、ser295、thr300、ser302、ser327、ser344、thr345、ser375、ser381、ser383、thr390、ser405、thr410、ser411、ser414、ser423、ser425、ser426、thr428、thr430、ser442、ser444、ser463、thr464、ser477、thr481、ser482、ser485、ser486、thr487、ser488、thr489、thr493、thr500、thr502、ser506、ser508、ser512、ser516、ser528、tyr529、ser531、ser537、thr538、ser541、ser544、thr550、tyr555、thr571、ser586、ser588或thr590氨基酸。在一个优选的实施方案中,所述mena激酶抑制剂消除mena11a蛋白的磷酸化ser125的去磷酸化。
在一个实施方案中,所述mena激酶抑制剂是小分子抑制剂,其特异性地抑制mena或mena同种型激酶的磷酸化或去磷酸化。
在一些实施方案中,所述小分子mena激酶抑制剂是基于支架,如氨基氰基吡啶、吡唑并嘧啶、吡咯并吡啶、咔啉、吡咯并嘧啶酮和cmpd1。在优选的实施方案中,所述小分子抑制剂通过mena激酶特异性地抑制mena和或mena同种型的磷酸化或去磷酸化。
在一个实施方案中,所述mena激酶抑制剂是肽抑制剂,其通过mena激酶特异性地抑制mena和或mena同种型的磷酸化或去磷酸化。
在本发明的一个实施方案中,所述mena激酶抑制剂包含以下中的至少一者:肽lprqngqlp(seqidno:6)、larqngqlp(seqidno:7)、kalprqngqlp(seqidno:8)以及kalarqngqlp(seqidno:9)。
在一个实施方案中,所述mena激酶抑制剂与细胞穿透肽载体序列(包括但不限于hivtat肽序列)连接以促进摄取和递送。在某些实施方案中,所述基于hivtat肽序列的细胞穿透性载体序列包含肽yaraaarqara(seqidno:10)和ygrkkrrqrrr(seqidno:11)中的至少一者。明确考虑了其他细胞穿透性载体形式。例如,kafaklaarlyr(seqidno:12)和faklaarlyr(seqisno:13)基于抗凝血酶iii肝素结合结构域。
在某些实施方案中,所述mena激酶抑制剂包含以下中的至少一者:肽yaraaarqaralprqngqlp(seqidno:14)、yaraaarqaralarqngqlp(seqidno:15)、yaraaarqarakalprqngqlp(seqidno:16)、yaraaarqarakalarqngqlp(seqidno:17)、ygrkkrrqrrrlprqngqlp(seqidno:18)、ygrkkrrqrrrlarqngqlp(seqidno:19)、ygrkkrrqrrrkalprqngqlp(seqidno:20)、ygrkkrrqrrrkalarqngqlp(seqidno:21)、kafaklaarlyrkalprqngqlp(seqidno:22)、kafaklaarlyrkalarqngqlp(seqidno:23)、kafaklaarlyrkakalprqngqlp(seqidno:24)、kafaklaarlyrkakalarqngqlp(seqidno:25)faklaarlyrkalprqngqlp(seqidno:26)、faklaarlyrkalarqngqlp(seqidno:27)、faklaarlyrkakalprqngqlp(seqidno:28)以及faklaarlyrkakalarqngqlp(seqidno:29)。
使用标准固相肽化学在树脂上用fmoc保护的氨基酸合成肽。用hbtu/hobt和diea进行氨基酸活化和偶联。使用于dmf中的20%哌啶除去fmoc基团。然后将树脂结合的序列裂解并用含有各种清除剂的80%-90%tfa脱保护,所述清除剂可包括水、茴香硫醚、乙基甲基硫醚和乙二硫醇和/或三异丙基硅烷。将肽沉淀到乙醚中且然后通过离心分离。将干燥的肽团块在水和乙腈混合物中重构并冻干,然后在c18柱上通过反相hplc纯化,所述柱用含有0.1%tfa的乙腈-水缓冲液洗脱。对每种肽进行分析并且合并纯级分并冻干。在用含有0.1%tfa的水-乙腈缓冲液洗脱的5微米c18分析柱上获得分析型hplc数据。通过maldi-tof分析确认分子量。
在一个实施方案中,将包含mena激酶抑制剂的药物预防性地施用于有需要的受试者,以预防转移性癌症的发展或纤维化疾病的进展。包含mena激酶抑制剂的药物也可治疗性地施用以减少现有转移性癌症的转移。
在其他实施方案中,mena激酶抑制剂可在施用tki治疗剂之前、同时或之后施用以改善或延长tki治疗剂的功效,所述tki治疗剂对受体酪氨酸激酶具有特异性,所述受体酪氨酸激酶靶向egf受体(egfr)、her2/neu、c-src、肝细胞生长因子受体(hgfr)、成纤维细胞生长因子受体、胰岛素样生长因子受体(igfr)、血小板源性生长因子受体、血管内皮生长因子受体和本领域技术人员已知的其他癌症相关靶标。此外,所述mena激酶抑制剂可与其他有丝分裂原活化蛋白激酶抑制剂结合施用。
在一个实施方案中,施用mena激酶抑制剂以治疗mena介导的疾病或病症,其中所述mena介导的疾病或病症是自身免疫性病症、慢性或急性炎性病症、自身炎性病症、纤维化病症、代谢病症、瘤形成或者心血管或脑血管病症。
在另一实施方案中,所述纤维化病症是选自由以下组成的组:系统性硬化症/硬皮病、狼疮性肾炎、结缔组织疾病、伤口愈合、手术瘢痕形成、脊髓损伤、cns瘢痕形成、急性肺损伤、肺纤维化、特发性肺纤维化、囊性纤维化、慢性阻塞性肺病、成人呼吸窘迫综合征、急性肺损伤、药物诱导的肺损伤、肾小球性肾炎、慢性肾病、糖尿病性肾病、高血压诱导的肾病、消化道或胃肠纤维化、肾纤维化、肝或胆纤维化、肝纤维化、非酒精性脂肪性肝炎、丙型肝炎、肝细胞癌、肝硬化、原发性胆汁性肝硬化、由于脂肪性肝病所致的肝硬化、由于酒精性脂肪性肝病所致的肝硬化、由于非酒精性脂肪变性/非酒精性脂肪性肝病所致的肝硬化、放射诱导的纤维化、头颈部纤维化、胃肠纤维化、肺纤维化、原发性硬化性胆管炎、再狭窄、心肌纤维化、心内膜心肌纤维化、心房纤维化、眼部瘢痕形成、纤维硬化、纤维化癌症、纤维瘤、纤维肌瘤、纤维腺瘤、纤维肉瘤、移植mteriopathy、瘢痕疙瘩、纵隔纤维化、骨髓纤维化、腹膜后纤维化、进行性大块纤维化以及肾源性系统性纤维化。
在另一实施方案中,所述瘤形成是选自由以下组成的组:血管生成病症、多发性骨髓瘤、白血病、急性淋巴细胞性白血病、急性和慢性骨髓性白血病、慢性淋巴细胞性白血病、急性成淋巴细胞性白血病、早幼粒细胞性白血病、淋巴瘤、b细胞淋巴瘤、t细胞淋巴瘤、套细胞淋巴瘤、毛细胞淋巴瘤、伯基特氏淋巴瘤、肥大细胞肿瘤、霍奇金氏病、非霍奇金氏病、骨髓增生异常综合征、纤维肉瘤、横纹肌肉瘤、星形细胞瘤、成神经细胞瘤、神经胶质瘤、神经鞘瘤、黑素瘤、精原细胞瘤、畸胎癌、骨肉瘤、着色性干皮病、角化棘皮瘤、甲状腺滤泡癌、卡波济氏肉瘤、黑素瘤、畸胎瘤、横纹肌肉瘤、转移性和骨骼病症、骨癌、口/咽癌、食道癌、喉癌、胃癌、肠癌、结肠癌、直肠癌、肺癌、肝癌、胰腺癌、神经癌症、脑癌、头颈癌、咽喉癌、卵巢癌、子宫癌、前列腺癌、睾丸癌、膀胱癌、肾癌、乳腺癌、胆囊癌、子宫颈癌、甲状腺癌、前列腺癌和皮肤癌、非小细胞肺癌、小细胞肺癌、神经胶质瘤以及多形性成胶质细胞瘤。
在另一实施方案中,所述心血管或脑血管病症是选自由以下组成的组:动脉粥样硬化、动脉粥样硬化性冠状动脉的再狭窄、急性冠脉综合征、心肌梗塞、心脏同种异体移植物血管病变、中风、伴有炎性或细胞凋亡组分的中枢神经系统病症、阿尔茨海默氏病、帕金森氏病、亨廷顿氏病、肌萎缩性侧索硬化、脊髓损伤、神经元缺血以及周围神经病变。
在其他实施方案中,mena激酶抑制剂可在施用抗微管药物之前、同时或之后施用,所述抗微管药物包括但不限于紫杉醇、多西他赛、紫杉醇、白蛋白结合的紫杉醇或本领域技术人员已知的任何其他抗微管相关药物。
实施例
以下实施例说明本发明的范围。所述实施例的具体要素仅出于描述目的,并且不意图限制本发明的范围。本领域技术人员可开发等效的方法并利用在本发明范围内的相当材料。
实施例1
mena同种型磷酸化以及相关试剂和测定
mena同种型是差异磷酸化的。对tmem(肿瘤转移微环境)中发现的肿瘤细胞中的menainv的分析表明所述蛋白质被活跃地磷酸化。menainv与mena之间的磷酸化差异表明磷酸化的氨基酸与menainv所特有的19个氨基酸(其在mena中不存在)相关。来自表达mena11a的非转移性肿瘤细胞的分析的类似观察结果表明,所述mena同种型所特有的21个氨基酸也可代表磷酸化的靶标。重要的是,对mena同种型插入(相对于mena)中的每种的磷酸化的作用可能不仅是由于menainv和mena11a序列内的氨基酸的磷酸化,而且可能影响靠近(在空间上或在相邻序列中)mena11a序列的mena氨基酸的磷酸化。
为了确定与menainv和mena11a插入相关或靠近的哪些潜在氨基酸残基可被磷酸化,产生了一系列重组menainv和mena11a构建体以表达修饰的mena同种型变体,其中候选残基改变为不能被磷酸化的氨基酸。在一个实施例中,丝氨酸被丙氨酸取代,所述丙氨酸具有相似的r-基团但缺少磷酰基转移所必需的羟基。在其他实施例中,酪氨酸可被苯丙氨酸取代。苏氨酸可被丙氨酸或天冬酰胺取代以阻断磷酸化。用于产生此类突变体的材料和方法是本领域技术人员熟知的(参见例如,genearttm定点诱变系统(lifetechnologiescorp.,grandisland,ny)、
在注射含有在ser125处磷酸化并与klh缀合的小鼠mena残基117-133的肽的动物(covanceresearchproducts,denver,pa)中产生了对mena/menainv中的ser125/ser144磷酸化位点具有特异性的抗磷酸-mena抗体。根据archuleta,等人(archuleta,stutzke,nixon,&browning,optimizedprotocoltomakephospho-specificantibodiesthatwork.methodsmol.biol.717:69-88,2011)的方案进行pser125mena抗体的纯化。用于纯化的肽(磷酸化肽:ac-ckkgptlprqn(ps)qlpaqvqn(seqidno:32)和去磷酸化:ckkgptlprqnsqlpaqvan(seqidno:32))分别由covanceresearchproducts(biolegend,sandiego,ca)和thermoscientific,grandisland,ny制备。根据制造商的说明书将肽与sulfolink偶联树脂柱(thermoscientific)偶联。将血清依次通过含有去磷酸化肽的柱,且然后通过含有磷酸化肽的柱。使用igg洗脱缓冲液(thermoscientific)洗脱与第二柱结合的抗体。
mena和或mena同种型的磷酸化通过来自ras-raf-mek-mapk/erk和pi3k-akt/mtor途径的mena激酶抑制剂抑制。将atp竞争性mapkapk2/mk2抑制剂pf-3644022((10r)-9,10,11,12-四氢-10-甲基-3-(6-甲基-3-吡啶基)-8h-[1,4]二氮杂卓并[5′,6′:4,5]噻吩并[3,2-f]喹啉-8-酮水合物)(tocris,bristol,uk)、非atp竞争性mapkapk2/mk2hayess和benndorfhsp25肽激酶抑制剂(kkkalnrqlgvaa(seqidno.:30))(abcam,cambridge,uk)、p38mapk激酶抑制剂ly2228820(5-[2-叔丁基-4-(4-氟苯基)-1h-咪唑-5-基]-3-(2,2-二甲基丙基)咪唑并[4,5-b]吡啶-2-胺;甲磺酸)(selleckchem,houstontx)、mek1/mek2非atp竞争性抑制剂pd0325901(n-[(2r)-2,3-二羟基丙氧基]-3,4-二氟-2-[(2-氟-4-碘苯基)氨基]-苯甲酰胺)(selleckchem,houstontx)和pi3k抑制剂ly294002(2-吗啉-4-基-8-苯基色烯-4-酮)(selleckchem,houstontx)各自在体外针对分别在突变体mvd7和mda-mb-231细胞系中阻断mena和menainv的ser125和ser144的mena激酶依赖性磷酸化的能力进行评价。使用对ser125/ser144处的mena/menainv的磷酸化具有特异性的mena抗体通过定量免疫印迹测定来测量磷酸化。刺激细胞并通过用10ng/mltnf-α处理而活化mena激酶。在这些条件下,mena在ser125处经历mena激酶依赖性磷酸化,并且menainv在ser144处经历mena激酶依赖性磷酸化。可商购的磷酸特异性hsp27抗体(cellsignalling,danvers,ma)用于监测作为内部对照的hsp27的mena激酶依赖性磷酸化。
如图2中所示,pser125特异性抗体明确地区分未磷酸化的mena/menainv与磷酸化的mena/menainv。比较标记为“培养基”的泳道和标记为“砷酸钠”的泳道中的抗体结合的程度显示在工程化以表达menainv(mvd7-menainv)的重组小鼠胚胎成纤维细胞mvd7细胞系中,pser125mena抗体在来自具有最小menainv磷酸化的细胞的蛋白质(“培养基”)中产生非常少的信号。当用砷酸钠(渗透应力诱导剂)处理以化学修饰menainv的可磷酸化位点时,相同的细胞在用pser125mena抗体探测时产生不同的信号。menainv的ser144位置等效于mena的ser125,其中位置的差异完全是由于menainv中存在inv外显子。pser125mena抗体结合menainv的ser144位置,并且它结合mena的ser125位置。此外,未刺激和未处理(培养基)与图2中刺激的未处理(0)样品的比较表明用tnf-α刺激细胞也提高了menainv的磷酸化。如图2中所示,用p38mapk激酶抑制剂ly2228820(1um,泳道“p38-ly8201um”))、mapkapk2/mk2激酶抑制剂pf-3644022(10um,泳道“pfizer10um”))和mek1/mek2抑制剂pd0325901(1um,泳道“erk1/2-pd-1um”))处理刺激的细胞显著降低磷酸化menainv的水平。
图3证实这一观察结果并将图2的抑制剂的组延伸至包括pi3k激酶抑制剂ly294002(分别1和10um,泳道“p38-ly8201um”和“p38-ly8201um”)以及50、100和300um的mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽,在所指定的抑制剂浓度下标记为“h&b”的泳道。如图4中所示,经工程化以表达menainv(mda-mb-123-menainv)的人乳腺癌mda-mb-231细胞清楚地表达升高水平的磷酸化ser144,其可使用上述抗体检测并如含有来自未刺激和未处理(0)的细胞的蛋白质的泳道中所示。标记为“p13k-ly02-10um”的泳道是来自用10um的p38mapk激酶抑制剂ly2228820处理的刺激的细胞的蛋白质。标记为“p13k-ly02-10um”和“p13k-ly02-1um”的泳道含有分别用10um和1um的pi3k激酶抑制剂ly294002处理的刺激的细胞的蛋白质。标记为“pfizer10um”的泳道含有来自用10um的mapkapk2/mk2激酶抑制剂pf-3644022处理的刺激的细胞的蛋白质。标记为erk1/2-pd-1um的泳道含有来自用1um的mek1/mek2抑制剂pd0325901处理的刺激的细胞的蛋白质,并且标记为“h&b”的泳道含有来自用所指示浓度的mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽处理的刺激的细胞的蛋白质。
mena激酶抑制剂限制mena同种型重组细胞系的细胞扩散。使用细胞扩散测定评价上述各种mena激酶抑制剂限制menainv重组mvd7(mvd7-menainv)细胞系的细胞扩散的能力。所述测定涉及用或不用图5中所示浓度的mena激酶抑制剂预处理细胞系1小时。在预处理后,使mvd7-menainv细胞在纤连蛋白上附着并扩散20分钟。在20分钟后,将细胞固定,透化并用鬼笔环肽染色以可视化肌动蛋白丝。使用imagej软件获取图像并进行分析(方差分析,n=5)。将处理组与对照mvd7-gfp细胞进行比较,并将其作为平均值与s.em.绘图,如图6中所示。
图5(c)中所示的mvd7-menainv细胞表现出mena依赖性扩散和粘附表型,所述表型对于mvd7-gfpmena无效对照和不可磷酸化mvd7-menainv(ser144a)细胞均未观察到(图5,分别图(a)和(b))。在与所指示浓度的mena激酶抑制剂一起孵育后,观察到mena依赖性扩散和粘附表型的统计学显著降低(图6)。mena依赖性扩散和粘附表型的统计学显著降低在所有mena激酶抑制剂的情况下发生(图6)。mena无效对照与menaser125a不可磷酸化突变体阴性对照之间的扩散和粘附不存在统计学上显著的差异(图6)。
mena激酶抑制剂逆转mena依赖性原纤维生成。使用mvd7-menainv细胞系在纤连蛋白原纤维生成测定中评价上述各种mena激酶抑制剂逆转mena依赖性原纤维生成的能力。将细胞用mena激酶抑制剂以图8中所示的浓度预处理细胞1小时,并在补充有标记的纤连蛋白的含有纤连蛋白耗尽的血清的培养基中培养。在4小时后,使用imagej软件通过定量免疫染色评价纤连蛋白原纤维形成以测量纤维状纤连蛋白的丰度和分布(方差分析,n=3)。相对于图8中的对照mvd7-gfp细胞绘制结果。
未处理的mvd7-menainv细胞在原纤维中组装大量纤连蛋白(图7,图(a)。然而,mvd7-gfp细胞和不可磷酸化的突变体menainv(ser144a)(分别图8和图7图(b))未能组装大量纤连蛋白。随着100和300um浓度下的mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)肽的浓度增加,观察到mena依赖性纤连蛋白原纤维生成表型的剂量依赖性减少(图7,图(g)和图8)。对于所有测试的mena激酶抑制剂,观察到mena依赖性纤连蛋白原纤维生成表型的统计学显著减少。pi3k激酶抑制剂ly294002、mek1/mek2激酶抑制剂pd0325901和mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)与mena无效对照相比显著减少mena依赖性纤连蛋白原纤维生成表型(图8)。在mena无效阴性对照与menaser144a不可磷酸化突变体之间不存在纤连蛋白沉积的统计学上显著的差异。
mena激酶抑制剂在伤口愈合测定中阻断mena依赖性细胞迁移。使用cyselect伤口愈合测定试剂盒(cellbiolabs,inc.,sandiego,ca)测定上述各种mena激酶抑制剂阻断mda-mb-231-menainv细胞的mena依赖性细胞迁移的能力。按照制造商的方案,将细胞在纤连蛋白涂覆的孔中培养,直到在伤口插入物周围形成单层。然后除去插入物,并且在完全补充的培养基中,在图9中所示浓度的抑制剂存在下培养细胞。在18小时后,将细胞固定、染色并通过荧光显微镜评价它们闭合通过插入物产生的伤口的能力。
如图9中所示,mda-mb-231-menainv细胞在完全补充的培养基中表现出mena依赖性侵袭表型(图(b))。向完全补充的培养基中生长的细胞中添加mena激酶抑制剂降低乳腺癌细胞系在伤口愈合测定中迁移的能力(图(c)-(h))。图(a)表示在治疗开始时的伤口大小。在没有药物的完全补充的培养基中培养过夜的细胞(图(b))能够闭合50%的伤口。添加pi3k激酶抑制剂ly294002(10um)产生仅15%的伤口闭合(图(c)),p38mark激酶抑制剂ly2228820(10um)产生仅20%的闭合(图(d)),mapkapk2/mk2激酶抑制剂pf-3644022(10um)使伤口闭合减少至10%(图(e)),mek1/mek2激酶抑制剂pd0325901(1um)使伤口闭合减少至15%(图(f)),并且mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)当以300um使用时使伤口闭合减少至伤口的15%(图(h))。mena激酶抑制剂抑制mena依赖性细胞侵袭和趋化性。使用biocoatmatrigel侵袭室测定法(corning,tewksbury,ma)测试上述各种mena激酶抑制剂抑制mda-mb-123-menainv肿瘤细胞侵袭的能力。按照制造商的方案,将mda-mb-123-menainv细胞用图10中所示浓度的抑制剂预处理1小时,然后接种在基质胶基质膜插入物的层上方。将插入物转移至有或无每种mena激酶抑制剂的含有基础培养基(阴性对照)和化学引诱物egf的孔中。在18小时后,将侵入膜的下部细胞表面的细胞固定、染色并使用imagej软件通过定量免疫染色进行评价。使用方差分析,n=3分析数据,并且在没有mena激酶抑制剂(0)的情况下相对于阴性对照egf刺激的细胞报告,并在图10中绘制为平均值和平均值的标准误差。
与mda-mb-231-δmena细胞系相比,mda-mb-231-menainv细胞在含有egf的基础培养基中表现出侵袭性和趋化性表型,其中使用基于crispr的技术从细胞系中缺失所有内源性mena表达(图10)。mena激酶抑制剂的添加显著减少侵入穿过matrigel插入物膜朝向egf化学引诱物的mda-mb-231-menainv细胞的相对数量。与pi3k激酶抑制剂ly294002(10um)(p<0.028)、p38mark激酶抑制剂ly2228820(10um)(p<0.019)、mapkapk2/mk2激酶抑制剂pf-3644022(10um)(p<0.040)、mek1/mek2pd0325901(1um)(p<0.040)以及mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)(100和300um)(分别p<0.019和p<0.020)一起孵育的作用在图10中示出。mena激酶抑制剂使mda-mb-231-menainv细胞中的mena依赖性侵袭表型显著逆转至与仅用基础培养基(基础培养基)处理的阴性对照mda-mb-231-menainv相似的水平。
mena激酶抑制剂在博伊登室测定中逆转mena依赖性细胞迁移和趋化性。将mda-mb-123-menainv肿瘤细胞用上述mena激酶抑制剂预处理1小时,并且负载到博伊登室(cellbiolabs,inc.)的纤连蛋白涂覆的8um孔聚碳酸酯膜插入物中。然后将纤连蛋白涂覆的上室转移至含有基础培养基(阴性对照)的孔和含有基础培养基、egf和如图11中所示浓度的mena激酶抑制剂的孔。除基础阴性对照外的所有处理条件均使用egf作为化学引诱物。在18小时后,使用如上所述的imagej软件通过定量免疫染色来评价穿过孔朝向化学引诱物迁移的细胞。使用方差分析(n=2)分析数据,并且相对于不存在任何抑制剂阳性对照(0)的egf刺激的细胞报告为图11中的平均值与平均值的误差。
mda-mb-231-menainv细胞在含有egf的基础培养基中展示迁移和趋化性mena依赖性表型。使用相似的实验条件在mda-mb-231-amena和不可磷酸化的mena-ser144a细胞系中未观察到这种表型(图11)。mena激酶抑制剂的添加显著减少穿过纤连蛋白涂覆的插入物膜朝向egf化学引诱物迁移的mda-mb-231-menainv细胞的相对数量。与pi3k激酶抑制剂ly294002(10um)(p<0.028)、p38mark激酶抑制剂ly2228820(10um)(p<0.0018)、mapkapk2/mk2激酶抑制剂pf-3644022(10um)(p<0.0018)、mek1/mek2激酶抑制剂pd0325901(1um)(p<0.0031)和mapkapk2/mk2激酶抑制剂kkkalhrqlgvaa(seqidno:30)100和300um(p<0.0004),(p<0.0004)一起孵育使mda-mb-231-menainv细胞中的mena依赖性侵袭表型显著逆转至仅用基础培养基处理的阴性对照mda-mb-231-menainv相似的水平。
实施例2
鉴别小分子mena同种型激酶抑制剂
通过使用与实施例1中所述相同(或相似)组的体外测定来鉴别小分子mena同种型激酶抑制剂。为了鉴别mena激酶的小分子抑制剂,将来自基于已知蛋白激酶抑制剂结构(支架)的化合物的商业组合化学库的单一分子或分子库,如氨基氰基吡啶、吡唑并嘧啶、吡咯并吡啶、咔啉、吡咯并嘧啶酮和cmpd1使用上述测定针对它们降低相应mena同种型底物的磷酸化的能力进行测定。此类方法是本领域技术人员所熟知的(由vonohsen和bomer,2005,wang和ma,2015综述)。潜在激酶抑制剂的文库是可商购的(参见synkinase,parkville,victoria,australia),并且筛选可在商业服务下进行(例如patricelli,等人,2011中描述的kinativtm服务)。可通过本领域熟知的方法修饰在所述测定中鉴别的抑制剂,以优化其抑制特征并改善成药性。选择表现出最有利的抑制剂概况的那些以用于如下所述的进一步体内测试。
实施例3
鉴别mena同种型激酶肽抑制剂
通过使用与实施例1中所述相同(或相似)组的体外测定来鉴别肽mena同种型激酶抑制剂。对包含seqidno.:14-29的肽进行测定并且选择具有最佳抑制剂概况的那些以用于如本文其他实施例中所述的进一步体内测试。
实施例4
mena激酶抑制剂在体内pymt小鼠模型中降低转移性癌症的发生率
通过向具有先前建立的异种移植物肿瘤的小鼠施用有效剂量的抑制剂来测定mena激酶抑制剂减少pymt小鼠乳腺癌模型(由harney,等人,2015详细描述)中的转移的能力。抑制剂的适当剂量可通过本领域熟知的方法测定。在这些实验中,建立循环肿瘤细胞和肿瘤细胞播散的基线水平,且然后将mena激酶抑制剂施用至小鼠。监测metasite的后续变化、循环肿瘤细胞数量和肺转移。metasite、循环肿瘤细胞和肺转移的数量的水平降低表明mena激酶抑制剂减少预先存在的转移性肿瘤中的癌症转移。
进行另外的实验以确定menainv激酶抑制剂抑制肿瘤转移的功效。这些另外的实验涉及在引入异种移植物肿瘤之前用menainv激酶抑制剂处理受试小鼠,并通过肿瘤发展过程确定metasite密度和循环肿瘤细胞的水平。相对于在匹配的未处理对照小鼠中建立的基线数量,metasite密度和肿瘤细胞循环的减少表明mena11a激酶抑制剂有效抑制转移表型的建立。
实施例5
mena激酶抑制剂在小鼠模型中降低转移性癌症的发生率
测定了mena激酶抑制剂减少移植有人三阴性乳腺癌(tnbc)细胞系mda-mb-231(由odin等人,2017详细描述)的nod/skid小鼠中的转移的能力。这些实验涉及在处死后针对转移性病变的存在评估器官并且针对循环肿瘤细胞(ctc)的数量增加评估血液。循环肿瘤细胞和肺转移的水平的降低表明mena激酶抑制剂减少癌症转移。
实施例6
用mena激酶抑制剂和紫杉醇组合处理恢复紫杉醇敏感性并且减少紫杉醇诱导的肿瘤细胞播散
细胞毒性化学疗法(包括紫杉烷的使用)仍然是用于治疗晚期癌症和侵袭性癌症如三阴性乳腺癌(tnbc)的护理标准。尽管与细胞毒性化学疗法应答率相关的益处可较低,并且例如tnbc可在一年治疗内变得耐药。用紫杉醇处理也可诱导肿瘤细胞播散。紫杉烷如紫杉醇通过稳定微管并抑制中期过程中的分解、从而导致有丝分裂停滞和细胞死亡而引起有丝分裂灾难。menainv表达改变紫杉醇处理的肿瘤细胞中的动态和稳定微管群体的比例。mena表达还响应于紫杉醇处理增加mapk信号传导。通过与mena激酶抑制剂共同处理来降低menainv的磷酸化可通过驱动微管稳定来恢复紫杉醇敏感性。
实施例7.
用mena同种型激酶抑制剂和吉非替尼组合处理降低对吉非替尼的自发耐药性
egfr特异性tki吉非替尼在许多癌症、特别是非小细胞肺癌的初始治疗中有效,但由于egfr或辅助受体途径中的补偿突变而常常丧失功效[在kosaka,等人,2011中综述]。适用于本发明实践的其他药物包括但不限于:
- 还没有人留言评论。精彩留言会获得点赞!