癌免疫佐剂的制作方法
[相关申请]
本申请要求基于日本专利申请2016-147657(2016年7月27日提交)和2017-079445(2017年4月13日提交)的优先权,其内容作为参考并入本说明书中。
[技术领域]
本发明涉及免疫检查点抑制剂与佐剂组合物的组合使用。更详细而言,本发明涉及一种癌症或感染性疾病的新型治疗,其特征在于,将抗pd-1抗体或抗pd-l1抗体与由双链rna和单链odn构成的核酸佐剂组合使用。
背景技术:
生物体中具备在细胞癌变时或细菌、病毒等病原体侵入到体内时将其排除的天然免疫防御系统,将控制该免疫防御系统的分子称为免疫检查点。认为癌细胞常常通过增强“免疫检查点”的表达而巧妙地逃避免疫防御系统的监视。
pd-1和pd-l1是代表性的免疫检查点分子,以该分子作为标靶的抗体已被确认在各种癌症种类中显示出显著的抗癌作用,目前已作为药物进行了开发。但是,关于pd-1/pd-l1抗体疗法,虽然报道了在50%以上的转移性黑色素瘤中观察到缓解,但另一方面,在实体癌中的缓解限于20~30%,其有效率不能称为充分。另外,存在对于pd-1抗体疗法有响应的患者和无响应的患者,要求对其进行鉴别并开发出针对无响应的患者的疗法。
近年来,抗癌免疫疫苗疗法作为对于无法通过手术、抗癌剂、放射线疗法进行治疗的癌症的第四疗法而受到特别关注。抗癌创制药多存在副作用的问题,但免疫疫苗疗法由于使用癌细胞特异性的抗原选择性地攻击癌细胞,因此具有侵袭性和副作用少的优点。在免疫疫苗疗法中,常常使用通过增强抗原性来辅助、增强疫苗的效果的佐剂。
toll样受体(toll-likereceptor,tlr)的活化使树突细胞产生天然免疫应答,诱导细胞因子的产生和细胞性免疫的活化。poly(i:c)(聚肌胞苷酸)等双链rna作为tlr3配体,显示出强抗癌效果,因此有望作为疫苗佐剂,但由于炎症、细胞因子血症等副作用,其临床应用被放弃。
本发明人发现了抑制poly(i:c)的tlr3介导的ifn-β诱导表达的含gpc二核苷酸的寡脱氧核苷酸(gpcodn),并报道了该gpcodn经tlr3介导而被摄入到细胞内(非专利文献1)。另外,已报道了麻疹病毒来源的dirna(缺陷干扰rna,defectiveinterferencerna)具有佐剂功能(专利文献1)。
进而,本发明人发现,基于上述gpcodn和dirna设计的核酸到达内体上的tlr3,具有强佐剂活性(专利文献2)。该佐剂不会诱导过剩的炎性细胞因子的产生,在小鼠移植癌模型中诱导nk/ctl依赖性的抗癌活性(专利文献3和非专利文献2),因此被期待作为副作用少的非炎症性核酸免疫佐剂应用于抗癌免疫疫苗。
现有技术文献
专利文献
专利文献1:wo2008/065752
专利文献2:wo2012/014945
专利文献3:wo2016/088784
非专利文献
非专利文献1:itohetal.,thejournalofimmunology,2008,vol.181,no.8,pp5522-5529
非专利文献2:matsumotoetal.,naturecommunications,2015,6:6280
技术实现要素:
发明所要解决的问题
本发明的课题在于提供在维持安全性的同时改善pd-1/pd-l1抗体疗法的有效率的新的癌免疫疗法。
用于解决问题的方法
为了解决上述问题,确认了:对于单独使用抗pd-l1抗体时无效的肿瘤,通过组合使用由双链rna和单链寡脱氧核苷酸(单链odn)构成的核酸佐剂,能够诱导ctl依赖性的显著的肿瘤消退。
本发明是基于上述发现而完成的,其涉及下述(1)~(17)项。
(1)一种用于治疗癌症或感染性疾病的药物,其组合含有免疫检查点抑制剂和佐剂组合物,所述药物中,所述免疫检查点抑制剂包含抗pd-1抗体或抗pd-l1抗体,所述佐剂组合物包含由双链rna和单链寡脱氧核苷酸(单链odn)构成的核酸佐剂,所述单链odn由cpgodn中cpg被置换成gpc、tpc或cpc而得到的序列或所述序列的5个碱基长度以上的部分序列构成(双链rna作为tlr3配体发挥功能,单链odn作为向内体的转运分子发挥功能);
(2)如(1)所述的药物,其特征在于,将免疫检查点抑制剂与佐剂组合物组合使用;
(3)如(2)所述的药物,其特征在于,同时或依次进行免疫检查点抑制剂和佐剂组合物的给药;
(4)一种用于治疗癌症或感染性疾病的药物,其以包含抗pd-1抗体或抗pd-l1抗体的免疫检查点抑制剂作为有效成分,其特征在于,与包含核酸佐剂的佐剂组合物组合使用,所述核酸佐剂由双链rna和单链寡脱氧核苷酸(单链odn)构成,所述单链odn由cpgodn中cpg被置换成gpc、tpc或cpc而得到的序列或所述序列的5个碱基长度以上的部分序列构成;
(5)如(1)~(4)中任一项所述的药物,其中,佐剂组合物包含选自细菌抗原、病毒抗原和癌抗原中的抗原分子;
(6)如(1)~(5)中任一项所述的药物,其中,构成核酸佐剂的核酸的末端未被磷酸化;
(7)如(1)~(6)中任一项所述的药物,其中,双链rna为具有序列号1所示的碱基序列的连续30个碱基以上、优选40个碱基以上的碱基序列且具有全长为100~160个碱基长度、优选110~150个碱基长度、更优选120~140个碱基长度的碱基序列的核酸、或者与上述序列具有80%的序列一致性且具有tlr3活化能力的核酸;
上述核酸包括双链rna将序列号1所示的碱基序列的连续30~80个碱基长度的碱基序列重复2~4次而包含的核酸、优选将序列号1所示的碱基序列的连续30~50个碱基长度的碱基序列重复3次而包含的核酸。
(8)如(1)~(7)中任一项所述的药物,其中,双链rna为具有序列号2~11中任一者所示的碱基序列的核酸、或者具有序列号2~11中任一者所示的碱基序列的连续100个碱基以上、优选110个碱基以上、更优选120个碱基以上的碱基序列的核酸、或者与上述序列具有80%的序列一致性且具有tlr3活化能力的核酸;
(9)如(1)~(8)中任一项所述的药物,其中,双链rna为具有序列号11所示的碱基序列的核酸、或者具有序列号11所示的碱基序列的连续100个碱基以上、优选110个碱基以上、更优选120个碱基以上的碱基序列的核酸、或者与上述序列具有80%的序列一致性且具有tlr3活化能力的核酸;
(10)如(1)~(9)中任一项所述的药物,其中,单链odn是由序列号19~39中任一者所示的碱基序列或所述序列的具有5个碱基以上的长度的部分序列构成的核酸;
(11)如(1)~(9)中任一项所述的药物,其中,单链odn是由序列号19~24中任一者所示的碱基序列或所述序列的具有5个碱基以上的长度的部分序列构成的核酸;
(12)如(1)~(11)中任一项所述的药物,其中,单链odn为15~28个碱基长度;
(13)如(1)~(12)中任一项所述的药物,其中,构成单链odn的核苷酸进行了磷硫酰化修饰;
(14)如(1)~(13)中任一项所述的药物,其中,核酸佐剂为包含序列号40所示的有义链和序列号41所示的反义链的核酸、包含序列号42所示的有义链和序列号43所示的反义链的核酸、或者包含与上述序列分别具有80%的序列一致性的有义链和反义链且具有佐剂活性的核酸;
(15)如(1)~(14)中任一项所述的药物,其中,核酸佐剂
1)包含序列号40所示的有义链和序列号41所示的反义链、
2)包含序列号42所示的有义链和序列号43所示的反义链、
3)包含序列号44所示的有义链和序列号45所示的反义链、或者
4)包含序列号46所示的有义链和序列号47所示的反义链。
(16)一种佐剂组合物,其包含由双链rna和单链寡脱氧核苷酸(单链odn)构成的核酸佐剂,所述单链odn由cpgodn中cpg被置换成gpc、tpc或cpc而得到的序列或所述序列的5个碱基长度以上的部分序列构成,所述佐剂组合物中,
双链rna为将序列号1所示的碱基序列的连续30~80个碱基长度的碱基序列重复2~4次而包含的核酸、优选为将序列号1所示的碱基序列的连续30~50个碱基长度的碱基序列重复3次而包含的核酸。
(17)一种用于治疗癌症或感染性疾病的药物,其包含(16)所述的佐剂组合物。
发明效果
根据本发明,能够改善pd-1/pd-l1抗体疗法的效果和有效率。本发明的佐剂被树突细胞高效地摄入,不会诱导全身性的炎性细胞因子的产生,而是特异性地活化tlr3,并且诱导nk、ctl。因此,与其他免疫复合疗法不同,不会产生细胞因子血症等副作用,可温和地提高pd-1/pd-l1抗体的效果,带来肿瘤消退。
附图说明
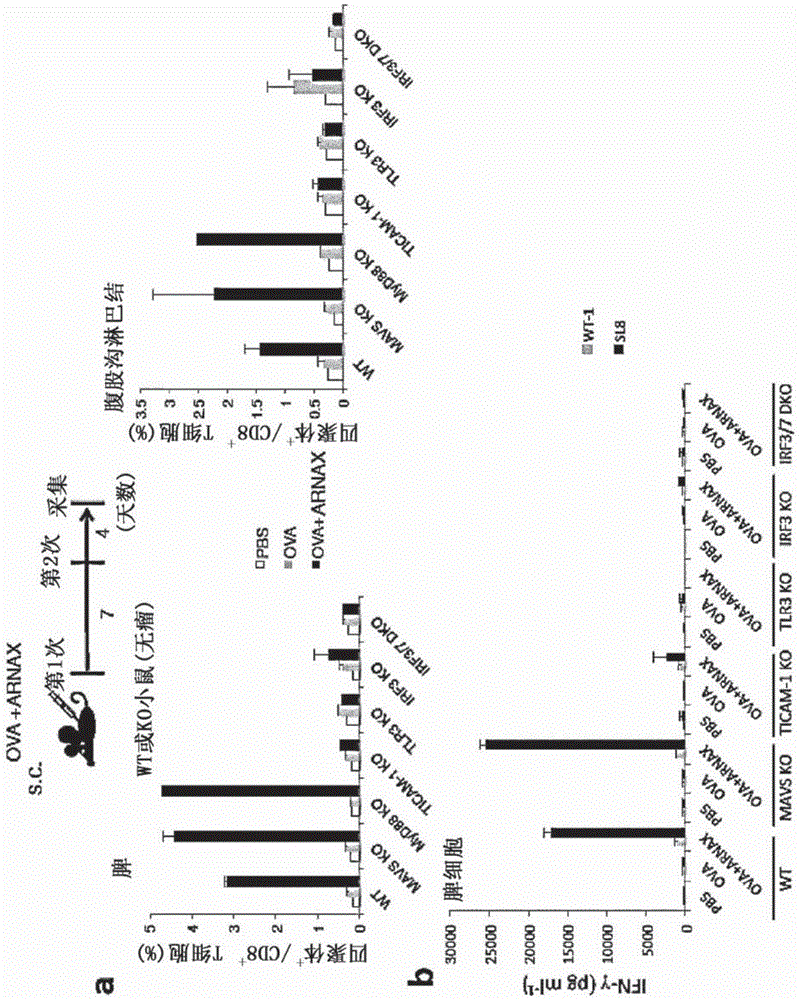
图1a示出皮下给药pbs(对照)、ova或ova+arnax的小鼠(野生型(wt)和各种敲除(ko)小鼠)的脾脏和腘窝淋巴结中的肿瘤特异性ctl的表达诱导(%)。图1b示出皮下给药pbs(对照)、ova或ova+arnax的小鼠(野生型(wt)和各种敲除(ko)小鼠)的脾细胞中的ifn-γ产生(pg/ml)。
图1c示出利用流式细胞术对皮下给药pbs(对照)、ova或ova+arnax的小鼠(野生型(wt)和各种敲除(ko)小鼠)的脾脏来源的肿瘤特异性ctl进行分析的结果。
图2示出皮下给药(a)和静脉给药(b)生理盐水(对照)、poly(i:c)或arnax时的细胞因子的诱导。
图3a示出eg7细胞株的pd-l1表达。图3b示出实施例3(由arnax和抗原的给药产生的抗肿瘤效果)的实验操作流程的概要。图3c示出在第0天时皮下移植eg7细胞的小鼠的肿瘤体积的经时变化。在第7天时,在皮下给药ova+arnax的小鼠中观察到显著的肿瘤消退(-●-),但在给药pbs的小鼠(对照)中未观察到肿瘤消退(-■-)。
图3d示出皮下给药pbs(对照)或ova+arnax的小鼠的肿瘤内的cd8阳性t细胞(左)、ova四聚体阳性/cd8阳性t细胞(中)、cd11c阳性/cd8阳性t细胞(右)的比例。图3e示出通过定量pcr得到的皮下给药pbs(对照)或ova+arnax的小鼠中的gzmb、ifng、prf1、cxcl9、cxcl10、cxcl11的表达诱导的分析结果。图3f示出皮下给药pbs(对照)或ova+arnax的小鼠的肿瘤组织中的对dapi和cd8α的免疫染色。
图4a比较地示出pd-l1高表达eg7细胞株(实线)和正常株(虚线)的pd-l1表达。图4b示出实施例4(arnax与抗αpd-l1抗体的组合使用)的实验操作流程的概要。图4c示出在第0天时皮下移植eg7细胞、在第7天时皮下给药pbs(对照)或ova+arnax后静脉给药抗小鼠pd-l1抗体或同种型抗体的小鼠的肿瘤体积的经时变化。在pd-l1抗体单独给药(-■-)时未观察到肿瘤消退,但通过将ova+arnax与pd-l1抗体联合给药(-x-),观察到显著的肿瘤消退,其效果高于仅给药ova+arnax(-▲-)。
图4d示出皮下给药pbs(对照)或ova+arnax后静脉给药抗小鼠pd-l1抗体或同种型抗体的小鼠的脾脏和肿瘤中的cd8阳性t细胞(左)、ova四聚体阳性/cd8阳性t细胞(中左)、cd11c阳性/cd8阳性t细胞(中右)、pd-1阳性/cd8阳性t细胞(右)的比例(上段为脾脏、下段为肿瘤内)。
图4e示出通过rt-pcr得到的皮下给药pbs(对照)或ova+arnax后静脉给药抗小鼠pd-l1抗体或同种型抗体的小鼠的肿瘤中的gzmb、ifng、prf1、cxcl9、cxcl10、cxcl11的表达诱导的分析结果。
图5示出本发明的佐剂核酸(arnax)和抗pd-l1抗体的作用机理。
图6a示出mo5细胞株(实线)的pd-l1表达。图6b示出实施例5(arnax与抗αpd-l1抗体的组合使用)的实验操作流程的概要。图6c示出在第0天时皮下移植mo5细胞、在第10天时皮下给药pbs(对照)或ova+arnax后静脉给药抗小鼠pd-l1抗体或同种型抗体的小鼠的肿瘤体积的经时变化。与pd-l1抗体单独给药(-■-)和ova+arnax给药(-▲-)相比,pd-l1抗体与ova+arnax联合给药(-x-)时观察到显著高的肿瘤消退。图6d示出皮下给药pbs(对照)或ova+arnax后静脉给药抗小鼠pd-l1抗体或同种型抗体的小鼠的脾脏和肿瘤中的cd8阳性t细胞(左)、ova四聚体阳性/cd8阳性t细胞(中左)、cd11c阳性/cd8阳性t细胞(中右)、pd-1阳性/cd8阳性t细胞(右)的比例(上段为脾脏、下段为肿瘤内)。图6e示出通过rt-pcr得到的皮下给药pbs(对照)或ova+arnax后静脉给药抗小鼠pd-l1抗体或同种型抗体的小鼠的肿瘤中的gzmb、ifng、prf1、cxcl9、cxcl10的表达诱导的分析结果。
图6f示出肿瘤浸润免疫细胞的比例。利用cd45阳性细胞进行设门而得到的肿瘤浸润淋巴细胞的比例(上)、利用cd45阳性细胞进行设门而得到的树突细胞(dc)亚群的比例、利用cd45阳性细胞进行设门而得到的肿瘤浸润单核细胞、cd11b阳性骨髄细胞亚群和巨噬细胞的比例。
图7示出arnax120#1、arnax#2、arnax130、arnax140的结构。
图8示出arnax120#2的tlr3介导的ifn-β启动子活化能力。
图9示出arnax120#1、arnax130的tlr3介导的ifn-β启动子活化能力。
图10示出arnax140的体内交叉致敏活性(使用量为变量)。
图11示出arnax120#2的体内交叉致敏活性(使用量为变量)。
图12示出arnax120#1的抗肿瘤效果(eg7)。
具体实施方式
本发明涉及一种用于治疗癌症或感染性疾病的药物,其组合含有免疫检查点抑制剂(抗pd-1抗体或抗pd-l1抗体)与由双链rna和单链odn构成的核酸佐剂。
1.免疫检查点抑制剂
将控制针对癌细胞、细菌或病毒等病原体的天然免疫防御系统的分子称为免疫检查点,可以列举例如表达在效应t细胞表面的pd-1、表达在肿瘤细胞表面的pd-l1或pd-l2、表达在活化t细胞或抑制性t细胞treg的表面的ctla-4、表达在树突细胞表面的cd80或cd86。这些之中,ctla-4/cd80/cd86在致敏的t细胞从初始t细胞分化为th1、th2、tfh细胞等的致敏期中发挥功能,pd-1/pd-l1/pd-l2在效应细胞对肿瘤细胞等进行攻击的效应期中发挥功能。
“免疫检查点抑制剂”是指抑制“免疫检查点”、控制天然免疫防御系统的物质或分子。例如,可以列举对上述免疫检查点具有特异性的抗体(抗pd-1抗体、抗pd-l1抗体、抗ctla-4抗体等)作为“免疫检查点抑制剂”的代表例。
本发明中使用的“免疫检查点抑制剂”是在效应期中发挥功能的免疫检查点抑制剂、即抑制pd-1/pd-l1/pd-l2的物质或分子。优选“免疫检查点抑制剂”为抗pd-1抗体或抗pd-l1抗体。
“抗pd-1抗体”
本发明中使用的“抗pd-1抗体”只要能够与pd-1结合并抑制其作为免疫检查点的功能则没有特别限定。作为抗pd-1抗体,有已经作为药物被许可销售的抗pd-1抗体和正在开发中的抗pd-1抗体,可以适当地利用这些抗pd-1抗体。作为这样的“抗pd-1抗体”,可以列举纳武单抗(nivolumab)(opdivo(gsk/小野药品))、作为人源化igg4型抗体的派姆单抗(pembrolizumab)(mk-3475(merck))、匹利珠单抗(pidilizumab)(ct-011(curetech)),但并不限定于这些。
“抗pd-l1抗体”
另外,本发明中使用的“抗pd-l1抗体”只要能够与pd-l1结合并抑制其作为免疫检查点的功能则没有特别限定。作为抗pd-l1抗体,有已经作为药物被许可(销售)的抗pd-l1抗体和正在开发中的抗pd-l1抗体,可以适当地利用这些抗pd-l1抗体。作为这样的“抗pd-l1抗体”,可以列举阿特珠单抗(atezolizumab)(mpdl3280a/rg-7446(roche/中外)、德瓦鲁单抗(durvalumab)(medi4736(阿斯利康))、阿维鲁单抗(avelumab)(msb0010718c(merck))、med10680/amp-514,但并不限定于这些。
抗体可以基于常规方法来制作。这种情况下,为了降低对人的异种抗原性,抗体优选为嵌合(chimeric)抗体、人源化(humanized)抗体、或者全人抗体。只要具有作为免疫检查点抑制剂的功能,抗体也可以为抗体片段。作为抗体片段,可以列举f(ab’)2、fab’、fab、fv、scfv。
本发明的“免疫检查点抑制剂”可以包含药理学上可接受的载体或添加物。作为这样的载体或添加物,可以列举例如表面活性剂、赋形剂、着色剂、香料、保存剂、抗氧化剂、稳定剂、缓冲剂、助悬剂、等渗剂、粘结剂、崩解剂、润滑剂、流动性促进剂、矫味剂等,但并不限定于这些,可以适当使用其他常用的载体。
具体而言,作为水性载体,包括水、乙醇、多元醇(甘油、丙二醇、聚乙二醇等)、橄榄油等植物油、以及油酸乙酯等有机酯。
作为非水性载体,可以列举轻质无水硅酸、乳糖、微晶纤维素、甘露醇、淀粉、羧甲基纤维素钙、羧甲基纤维素钠、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯醇缩乙醛二乙基氨基乙酸酯、聚乙烯吡咯烷酮、明胶、中链脂肪酸三甘油酯、聚氧乙烯氢化蓖麻油60、白糖、羧甲基纤维素、玉米淀粉、无机盐类等。
作为作为抗氧化剂,可以列举作为水溶性抗氧化剂的抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、偏亚硫酸氢钠、亚硫酸钠、作为脂溶性抗氧化剂的抗坏血酸棕榈酸酯、丁化羟基茴香醚(bha)、丁化羟基甲苯(bht)、卵磷脂、没食子酸丙酯、α-生育酚、以及作为金属螯合剂的柠檬酸、乙二胺四乙酸(edta)、山梨醇、酒石酸、磷酸。
本发明的“免疫检查点抑制剂”的给药途径没有特别限定,优选非经口给药,具体而言,可以列举注射给药、经鼻给药、经肺给药、经皮给药等。作为注射给药,可以例示静脉内注射、肌肉内注射、腹腔内注射、皮下注射。给药方法可以根据患者的年龄、症状来适当选择。
本发明的“免疫检查点抑制剂”的给药量根据其使用目的、给药途径等适当决定。以引起目标最佳应答(例如治疗应答)的方式进行调节。由于有效成分为抗体,因此给药量为约0.0001~100mg/kg、通常为0.01~5mg/kg患者体重的范围。例如,给药量为约0.3mg/kg体重、1mg/kg体重、3mg/kg体重、5mg/kg体重或10mg/kg体重或者为1~10mg/kg的范围。典型的治疗方法中,例如为每周1次给药、每2周1次给药、每3周1次给药、每4周1次给药、每月1次给药、每3个月1次给药或者每3~6个月1次给药等。例如,在静注给药的情况下,为1mg/kg体重或3mg/kg体重。给药次数根据症状适当设定,可以通过单次的推注(bolus)来给药,也可以分几次缓慢给药。例如,对于6次给药,有时每4周、接着每3周进行给药;有时每3周进行给药;有时以3mg/kg体重给药1次,接着每3周以1mg/kg体重进行给药。
2.佐剂组合物
2.1核酸佐剂
本发明的“佐剂组合物”包含由双链rna和被转运至内体的单链寡脱氧核苷酸(单链odn)构成的核酸(核酸佐剂)。
(1)“双链rna”
已知微生物来源的双链rna作为toll样受体3(toll-likereceptor3,tlr3)的配体活化天然免疫。在人工合成的双链rna的情况下也观察到同样的现象(matsumotom.,andt.seya.2008.tlr3:interferoninductionbydouble-strandedrnaincludingpoly(i:c).adv.drugdel.rev.60:805-812.)。tlr为i型膜蛋白,其识别病毒或细菌来源的成分并引发生物体防御应答。tlr3为tlr家族之一,其以细胞外的双链rna为配体,藉由ticam-1诱导多样的细胞应答。tlr3在髄系树突细胞中局部存在于内体、在一部分上皮系细胞和巨噬细胞中局部存在于细胞表面和内体,但在任意一种细胞中tlr3介导的信号均从内体进行转导,因此需要将双链rna摄入至细胞内。
由于微生物来源的双链rna对人的基因不起作用,因此也正在推进通过作为tlr3配体控制天然免疫而作为疫苗佐剂加以利用的研究。本发明中使用的“双链rna”为这样的外源性(例如病毒或细菌来源)的双链rna,不会对人的内源性基因产生影响,作为tlr3配体(具有tlr3活化能力)活化天然免疫。
本发明的“双链rna”例如可以分离出rna病毒来源的dsrna,将其作为模板来进行合成。作为对象的rna病毒没有特别限定,可以为负链单链rna病毒、正链单链rna病毒、双链rna病毒中的任意一种。具体而言,可以列举麻疹病毒、仙台病毒、rs病毒、丙型肝炎病毒、脊髓灰质炎病毒、轮状病毒等。优选为作为负链单链rna病毒的麻疹病毒、仙台病毒和rs病毒,更优选为麻疹病毒、仙台病毒和rs病毒的疫苗株。
驯化麻疹病毒株edmonston(ed)株来源的dirna(缺陷干扰rna,defectiveinterferencerna:序列号1)以往就含有在疫苗中(shingaieyal.,jimmunol.2007;179:6123-6133),已确立了对人的安全性。本发明人发现,该ed株来源的dirna具有佐剂的功能(上述itohetal.,thejournalofimmunology,2008;matsumotoetal.nat.commun.2015),并确认了:以其为基础而制作的59个碱基长度~140个碱基长度的双链rna通过与后述的单链odn连结,可被高效地转运至内体,不会使细胞内rna传感器rig-i、mda5活化而仅使tlr3活化,从而具有肿瘤消退效果(wo2012/014945和wo2016/088784)。基于该ed株来源的dirna的“双链rna”通过将5’末端加帽,不会活化其他免疫系统(例如mda5/rig-1)而仅特异性地活化tlr3,因此无需担心引起全身性的炎性细胞因子的诱导,作为疫苗佐剂是优良的。因此,作为本发明中使用的“双链rna”的优选的一个方式,可以列举基于该ed株来源的dirna的双链rna,但其他病毒或细菌来源的双链rna也可以作为tlr3配体用于本发明的核酸佐剂。
“双链rna”的长度没有特别限定,为了具有tlr3活化能力,优选为约50个碱基对以上,更优选为约60个碱基对以上,进一步优选为约90个碱基对以上、约100个碱基长度以上、约110个碱基以上,特别优选为约120个碱基长度以上。上限也没有特别限定,从合成的容易性出发,优选设定为约160个碱基对以下的长度。因此,作为本发明的“双链rna”的长度,优选为约50个~约160个碱基对,更优选为约90个~约150个碱基对、约100个~约150个碱基对、约110个~约140个碱基对,特别优选为约120个~约140个碱基对。
ed株来源的dirna具有序列号1所示的碱基序列,形成具有环结构的双链rna(dirna)(shingaietal.,jimmunol.2007nov1;179(9):6123-6133)。在基于ed株来源的dirna来设计“双链rna”的情况下,序列号1所示的ed株的dirna的任意部分均可作为“双链rna”使用,但从合成效率的方面出发,优选富含au的区域。作为这样的富含au的区域,可以列举例如作为有义链侧序列的序列号1的17位~78位、101位~164位和216位~269位等,均是从合成效率的方面出发优选的区域,作为tlr3配体的功能并不限定于这些区域。
在上述专利申请(wo2012/014945)中,制备了具有序列号1所示的ed株的dirna中的下述碱基序列的双链rna,并确认了其活性。
第1017位~第1074位的碱基序列(序列号2)
在第1077位~第1152位的5’末端附加有3个胞嘧啶的碱基序列(序列号3)
在第1017位~第1152位的5’末端附加有3个胞嘧啶的碱基序列(序列号4)
在第1077位~第1152位的3’末端附加有3个胞嘧啶的碱基序列(序列号5)
在第1017位~第1152位的3’末端附加有3个胞嘧啶的碱基序列(序列号6)
在第1057位~第1152位的3’末端附加有3个胞嘧啶的碱基序列(序列号7)
在第1046位~第1152位的3’末端附加有3个胞嘧啶的碱基序列(序列号8)
在第1037位~第1152位的3’末端附加有3个胞嘧啶的碱基序列(序列号9)
第1017位~第1089位的碱基序列(序列号10)。
另外,在专利申请(wo2016/088784)中,制备了具有序列号1所示的ed株的dirna中第1位~第140位的碱基序列(序列号11)的双链rna,并确认了其活性。若考虑到dirna形成茎环,则可以理解序列号11所示的序列为与序列号2~9所示的序列形成互补链的区域。
因此,作为本发明的“双链rna”,可以使用具有序列号1所示的碱基序列的连续30~160个碱基长度的碱基序列的核酸(双链rna)。另外,从合成效率的观点出发,优选可以使用包含序列号1所示的碱基序列的17位~78位、101位~164位和216位~269位中的连续30个碱基以上、优选40个碱基以上(也可以重复包含)且全长为100~160个碱基长度、优选为110~150个碱基长度、更优选为120~140个碱基长度的核酸(双链rna)。需要说明的是,“双链rna”也可以为包含重复了2~4次的序列号1的部分序列的核酸。例如,除了可以使用包含序列号1的17-136位的连续120个碱基长度的核酸以外(序列号42(有义)、序列号43(反义)),也可以使用包含重复了3次的序列号1的17-56位的连续40个碱基长度的核酸(序列号44(有义)、序列号45(反义))。
具有序列号2~11中任一者所示的碱基序列的核酸为其一例,其中,对于具有序列号11所示的碱基序列和其部分序列的核酸,本发明人确认了其在体内的肿瘤消退效果。
若考虑本发明的“双链rna”和ed株来源的dirna的功能和结构,则并不限定于具有序列号2~11所示的碱基序列的核酸(双链rna),也可以使用具有该序列的连续100个碱基以上、优选110个碱基以上、更优选120个碱基以上的碱基序列的双链rna。另外,只要具有tlr3活化能力,则具有与上述序列具有80%的序列一致性、优选具有85%、更优选具有90%、进一步优选具有95%的序列一致性的碱基序列的双链rna也可以用作本发明的“双链rna”。需要说明的是,在“双链rna”为包含重复了的部分序列的核酸的情况下,序列一致性为部分序列与对应于该部分序列的序列进行比较而得到的数值。
另外,只要具有tlr3活化能力,则具有在序列号2~11所示的碱基序列、其连续100个碱基以上、优选110个碱基以上、更优选120个碱基以上的碱基序列中缺失、置换、插入或添加了1~10个、优选1~6个、更优选1~3个碱基的碱基序列的双链rna也可以用作本发明的“双链rna”。
关于tlr3活化能力,如wo2012/014945的实施例2中所记载的那样,制作将人tlr3表达质粒与包含ifn-β启动子的报告质粒一起进行了转染的细胞,在其培养液中添加双链rna,观察报告基因活性的升高,由此能够容易地确认tlr3活化能力。因此,不限于序列号2~11所示的“双链rna”,本领域技术人员根据序列号1所示的病毒或细菌来源的dsrna的碱基序列、wo2012/014945和wo2016/088784的记载以及该领域的技术常识能够容易地获得本发明中使用的其他“双链rna”。
(2)单链寡脱氧核苷酸(单链odn)
tlr9识别病毒dna或细菌dna的非甲基化cpg基序。tlr9介导的信号转导由短的合成寡脱氧核苷酸(odn)高效率地进行。该odn中包含细菌或病毒的基因所特有的cpg基序,作为“cpgodn”在该领域中广为人知。已知cpgodn被转运至树突细胞的内体,作为tlr9配体发挥功能,因此作为强疫苗佐剂和抗体产生增强剂是有用的。另一方面,强力诱导myd88依赖性的细胞因子(特别是ifn-γ),引起th2应答。cpgodn分类为3个类型,a型为强力诱导ifnα的nk细胞的激活剂,b型为ifnα的诱导弱的b细胞的激活剂,c型兼具b型的作用和a型的作用。本发明的“单链odn”设定为除去了cpg的细胞因子诱导活性的gpc型,优选基于b型或c型的gpcodn的“单链odn”。
在上述专利申请(wo2012/014945)中,本发明人确认了:将上述cpgodn中的cpg变换成gpc的odn(gpcodn)、将上述gpc变换成tpc或cpc的odn也被转运至内体。本发明人进一步确认了:由具有上述odn的5个碱基以上的长度的部分序列构成的核酸也被转运至内体。
将cpg变换成gpc、tcp、cpc的odn被转运至树突细胞的内体,但由于不具有tlr9激动剂活性,因此不诱导不必要的免疫应答。即,本发明中使用的“单链odn”为不具有tlr9激动剂活性的、被转运至内体的单链odn。
cpgodn已作为tlr9激动剂销售,gpcodn已作为其对照(由于不具有tlr9激动剂活性)销售,本发明中可以适当利用这些odn。以下,记载由invivogen销售的cpgodn(b型或c型)以及该gpcodn(对照)及其序列(http://www.invivogen.com/tlr9-agonist)。
[表1]
本发明的“单链odn”可以列举具有cpgodn中的cpg二核苷酸被置换成gpc、tpc或cpc二核苷酸的碱基序列的odn、或者具有内体转运功能的该odn的部分序列。
作为这样的“单链odn”的具体例,可以列举具有序列号19~39所示的碱基序列的odn、或者由具有该序列的5个碱基以上的长度的部分序列构成的核酸。
需要说明的是,只要不具有tlr9激动剂活性且被转运至内体,则具有在序列号19~39所示的序列中具有1~3个、优选1或2个、更优选1个缺失、置换、插入或添加的碱基序列的odn也可以用作本发明的“单链odn”。
从向内体的转运功能的观点出发,本发明的“单链odn”优选为15个碱基长度以上,更优选为15~28碱基长度。
关于向内体的转运能力,如wo2012/014945的实施例5中所记载的那样,制作将人tlr3与包含ifn-β启动子的报告质粒一起进行了转染的细胞,在其培养液中添加将单链odn与双链rna连结而成的核酸,将报告基因活性与对照比较,由此能够容易地确认向内体的转运能力。因此,不仅是具有序列号19~39所示的碱基序列的单链odn,本领域技术人员根据市售的cpgodn和gpcodn(对照)的碱基序列、wo2012/014945和wo2016/088784的记载能够容易地获得本发明中使用的其他“单链odn”。
从稳定性(核酸酶耐性)的观点出发,构成本发明的“gpcodn”的单链核苷酸优选进行了修饰。作为这样的修饰,可以列举磷硫酰化修饰。通过进行磷硫酰化修饰,单链odn不会被核酸酶分解,能够高效地将核酸转运至内体。
(3)佐剂核酸的合成
本发明的佐剂核酸由上述的“双链rna”和“单链odn”构成。“双链rna”与“单链odn”的连结顺序、连结方式没有特别限定,可以在“单链odn”的3’侧结合“双链rna”的5’侧,也可以在“单链odn”的5’侧结合“双链rna”的3’侧,但优选在“单链odn”的3’侧结合有“双链rna”的5’侧,进一步优选“单链odn”的3’末端与“双链rna”的有义链的5’末端结合。
“双链rna”与“单链odn”可以直接连结,也可以经由适当的接头进行连结。接头序列的长度(碱基数)没有限定。除了接头序列以外,也可以在任意一个末端或两末端进一步连结有其他核酸,这种情况下,优选在rna的3’侧连结有其他核酸。
形成本发明的核酸的各单链核酸优选在任意一个末端均未结合磷酸基。这是因为,在5’末端残留有磷酸基时,通过生物体内的大量给药会使细胞质内rig-i途径活化,诱导大量的细胞因子产生,成为副作用的原因(robinsonra,devitavt,levyhb,barons,hubbardsp,levineas.aphasei-iitrialofmultiple-dosepolyriboinosic-polyribocytidylicacidinpatientswithleukemiaorsolidtumors.jnatlcancerinst.1976sep;57(3):599-602)。在通过体外转录而合成的rna链的5’末端会附加3磷酸,但由于本发明的核酸可以通过化学合成来制造,因此可以作为在5’末端和3’末端均未结合磷酸基的核酸来进行合成。
在“单链odn”的3’末端与“双链rna”的有义链的5’末端直接共价结合的情况下,本发明的核酸佐剂可以作为由单链核酸a(“单链odn”与“双链rna”有义链的嵌合核酸)和单链核酸b(“双链rna”反义链)构成的核酸来进行合成。
作为一例,在wo2016/088784中记载了由序列号40所示的有义链(单链核酸a)和序列号41所示的反义链(单链核酸b)构成的核酸及其合成方法。在该例中,“双链rna”与“单链odn”直接连结,但只要不对核酸的稳定性和佐剂活性产生负的影响,也可以在两者之间包含接头。本说明书中,也有时将该由序列号40所示的有义链和序列号41所示的反义链构成的核酸佐剂称为“arnax”。
本发明的核酸并不限定于上述有义链和反义链,只要其具有佐剂活性,则由与上述序列分别具有80%、优选具有85%、更优选具有90%、进一步优选具有95%的序列一致性的有义链和反义链构成的核酸也可以用作本发明的核酸。需要说明的是,如上所述,在“双链rna”包含重复了的特定部分序列的情况下,上述序列一致性设定为关于该重复部分将部分序列与对应于该部分序列的序列进行比较而得到的数值。
关于核酸的佐剂活性,可以根据wo2012/014945和wo2016/088784的实施例的记载,例如制作一次性地将人tlr3表达质粒与包含ifn-β启动子的报告质粒一起进行了转染的细胞,在其培养液中添加核酸佐剂,观察报告基因活性的升高,更严密地来说,观察在体内的肿瘤消退效果等,由此能够确认核酸的佐剂活性。
上述由有义链和反义链构成的核酸例如可以通过根据wo2016/088784记载的方法合成部分序列并依次连接来进行合成。当然并不于限定上述方法,可以根据所使用的双链rna和单链odn的长度、结构,按照常规方法适当优化合成方法。
在肿瘤的微环境中,除了肿瘤细胞以外,由浸润到肿瘤中的髄系细胞产生了免疫抑制状态。肿瘤相关巨噬细胞(tumor-associatedmacrophage:tam)强力支持肿瘤的增殖、维持、浸润,有助于形成适合肿瘤的微环境,骨髓来源抑制细胞(myeloid-derivedsuppressorcell:mdsc)抑制抗原特异性t细胞的活性。在这种抑制性巨噬细胞浸润到肿瘤内的小鼠移植癌中进行poly(i:c)治疗时,肿瘤发生消退(shimeetal.proc.natl.acad.sci.u.s.a.109(6):2066-2071.2012)。认为肿瘤消退的主要原因是由对poly(i:c)发生应答的tam产生的tlr3-ticam-1依赖性tnf-α引起的肿瘤的出血性坏死,但同时,肿瘤内的巨噬细胞由抑制型的m2型变换为效应型的m1型,通过tlr3信号诱导表观遗传性的变化。通过作为tlr3特异性佐剂的本发明的佐剂组合物的给药,将肿瘤内的癌症抑制细胞转变为癌症攻击型细胞,对肿瘤内微环境进行调控,由此能够抑制肿瘤的增殖。
本发明的核酸佐剂具有下述特征:1)被树突细胞高效地摄入;2)仅活化tlr3而不活化mda5/rig-1;3)不诱导全身性的炎性细胞因子/i型ifn产生;4)活化树突细胞,诱导nk细胞、ctl;5)显示出强抗肿瘤活性;6)通过调控肿瘤内微环境,能够抑制肿瘤的增殖;7)能够进行gmp标准的化学合成。因此,作为癌免疫疗法中的佐剂是极其有用的。
(4)制剂化
本发明的“佐剂组合物”可以包含药理学上可接受的载体或添加物。作为这样的载体或添加物,可以列举例如表面活性剂、赋形剂、着色剂、香料、保存剂、抗氧化剂、稳定剂、缓冲剂、助悬剂、等渗剂、粘结剂、崩解剂、润滑剂、流动性促进剂、矫味剂等,但并不限定于这些,可以适当使用其他常用的载体。它们的具体例如“免疫检查点抑制剂”中所记载。
本发明的“佐剂组合物”的给药途径没有特别限定,优选非经口给药,具体而言,可以列举注射给药、经鼻给药、经肺给药、经皮给药等。作为注射给药,可以例示静脉内注射、肌肉内注射、腹腔内注射、皮下注射。给药方法可以根据患者的年龄、症状来适当选择。
本发明的“佐剂组合物”的给药量根据其使用目的、给药途径等适当决定。在对人给药的情况下,例如可以在每一次给药每1kg体重为0.00001mg至10mg的范围内选择给药量。或者,例如可以在每个患者为1~100mg/个体的范围内选择给药量。但是,本发明的“佐剂组合物”的给药量并不限于上述给药量。
2.2抗原分子
本发明的佐剂组合物可以包含抗原分子。在癌症患者或细菌感染者的体内存在内源性的抗原,因此仅使用佐剂核酸也可得到免疫效果。虽然如此,在仅使用佐剂核酸无法得到充分效果的情况下,优选根据作为治疗对象的疾病,将抗原分子与佐剂一起给药。作为抗原分子,可以列举病毒抗原、细菌抗原、癌抗原和它们的抗原性成分等。
作为病毒抗原,可以列举例如腺病毒、逆转录病毒、小核糖核酸病毒、疱疹病毒、轮状病毒、汉坦病毒、冠状病毒、披膜病毒、黄病毒、弹状病毒、副粘液病毒、正粘液病毒、布尼亚病毒、沙粒病毒、呼肠孤病毒、乳头瘤病毒、细小病毒、痘病毒、嗜肝病毒、朊病毒、hiv、cmv、甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、流感病毒、麻疹病毒、骨髓灰质炎病毒、天花病毒、风疹病毒、单纯疱疹病毒、水痘带状疱疹病毒、eb病毒、日本脑炎病毒、狂犬病病毒、流感病毒等病毒抗原或它们的组合。
作为细菌抗原,可以列举例如芽孢杆菌属、埃希氏菌属、李斯特菌属、奈瑟菌属、诺卡氏菌属、沙门氏菌属、葡萄球菌属、链球菌属等的细菌抗原或它们的组合。
作为癌抗原,可以列举例如白血病、淋巴瘤、星形细胞瘤、神经胶质母细胞瘤、黑色素瘤、乳腺癌、肺癌、头颈癌、消化系统肿瘤、胃癌、结肠癌、肝癌、胰腺癌、子宫癌、卵巢癌、阴道癌、睾丸癌、前列腺癌、阴茎癌、骨肿瘤、血管肿瘤、食道癌、直肠癌、大肠癌、胰腺癌、胆囊癌、胆管癌、喉癌、支气管癌、膀胱癌、肾癌、脑肿瘤、甲状腺癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤等的癌抗原或它们的组合。
本发明的佐剂组合物单独使用即具有癌症或感染性疾病的治疗效果,本发明也提供包含佐剂组合物的用于治疗癌症或感染性疾病的药物。
3.用于治疗癌症或感染性疾病的药物
本发明提供组合包含上述免疫检查点抑制剂和佐剂组合物的、用于治疗癌症或感染性疾病的药物。
本发明的药物是指为了将佐剂组合物与包含抗pd-1抗体或抗pd-l1抗体的免疫检查点抑制剂同时、分别或依次给药而进行了组合(联合给药)的药物。
免疫检查点抑制剂和佐剂组合物可以分别提供,也可以以由免疫检查点抑制剂和佐剂组合物构成的试剂盒的形式来提供。
作为成为本发明的药物的治疗对象的疾病,是可作为免疫检查点抑制剂的对象的疾病(癌症、感染性疾病等)。作为癌症,可以列举例如骨癌、胰腺癌、皮肤癌、头颈癌、黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、急性髄性白血病、慢性髄性白血病、急性淋巴细胞性白血病、慢性白血病、急性白血病、儿童实体癌、淋巴细胞性淋巴瘤、膀胱癌、肾癌、输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、脉管肿瘤、脊椎肿瘤、脑干胶质瘤、垂体腺瘤、卡波西肉瘤、鳞状上皮癌、鳞状细胞癌、t细胞淋巴瘤、环境诱发肿瘤等。特别是可以适合应用于表达pd-l1的转移性癌。
作为感染性疾病,可以列举例如hiv感染(aids)、肝炎、疱疹、疟疾、利什曼病、流感、痢疾、肺炎、结核、败血症等。特别是可以适合应用于产生严重免疫缺陷的hiv感染。
如上所述,认为抗pd-1抗体和抗pd-l1抗体在免疫防御机制的效应期中起作用,与此相对,本发明的核酸佐剂被转运至树突细胞的内体,在活化tlr3、诱导nk细胞、ctl等的致敏期中起作用。因此,通过将本发明的佐剂核酸与抗pd-1抗体或抗pd-l1抗体组合使用,能够在致敏期和效应期这两个时期中活化免疫防御机制(参考图5)。
基于上述作用机理,本发明的药物通过将佐剂组合物与抗pd-1抗体和抗pd-l1抗体组合使用,对于抗pd-1抗体或抗pd-l1抗体单独使用时不起效的癌症也发挥出效果,并且更强力地诱导ctl依赖性的肿瘤消退。通过将佐剂组合物与抗pd-1抗体或抗pd-l1抗体组合使用,与各自单独给药时相比,抗肿瘤效果协同性地增强。
此外,通过与佐剂组合物组合使用,还发挥出单独使用抗pd-1抗体或pd-l1抗体时无法实现的、抗体产生和nk细胞活化的效果以及改善肿瘤微环境的效果。本发明的药物的安全性高,对年老者也能够安全地给药,能够扩大使用抗pd-1抗体或抗pd-l1抗体的治疗对象,能够提高其效果。
实施例
以下,利用实施例更详细地对本发明进行说明,但本发明并不限定于这些实施例。
实施例1:由arnax和抗原的给药所致的ctl的诱导
1.材料和方法
将8-11周龄的野生型(c57bl/6)和b57bl/6背景的敲除♂小鼠(mavsko、myd88ko、tlr3ko、ticam-1ko、irf3ko、irf3/7dko)用于实验。在第0天、第7天对小鼠皮下给药pbs、ova(100μg)或ova(100μg)+arnax(60μg),在第11天采集脾脏和腘窝淋巴结,使用ova四聚体(mbl公司制)测定cd8+t细胞中的ova特异性cd8+t细胞的比例。四聚体检测按照所附资料进行。具体而言,用50倍稀释的h2-kbova四聚体(pe)将脾脏和淋巴结细胞(1x107/ml)染色20分钟,清洗后,用抗cd3emab(apc)、抗cd8amab(fitc)染色,利用facsaria(bd公司)对cd8+t细胞中的ova特异性cd8+t细胞的比例进行分析。另外,将脾细胞(1x107/ml)用100nm的ova特异性肽(sl8:siinfekl)或者对照wt1肽(db126:rmfpnapyl)刺激3天,利用cytokinebeadassay(细胞因子微珠检测)(cba;bd公司)测定培养上清中的ifn-γ。
2.结果
野生型小鼠中,在脾脏和腘窝淋巴结中,在pbs或ova单独给药时未诱导出ova特异性ctl,但在ova+arnax给药时诱导出ova特异性ctl。作为rig-i样受体(rig-i-likereceptor,rlr)的下游的适配体分子的mavs的敲除小鼠、作为tlr3以外的tlr的适配体分子的myd88的敲除小鼠与野生型小鼠为同样的结果。在tlr3、tlr3的适配体分子ticam-1、i型ifn诱导所必需的转录因子irf3、irf7的敲除小鼠中,利用ova+arnax完全未诱导出ova特异性ctl(图1a、图1c)。另外,在野生型小鼠和mavs敲除小鼠的脾细胞中,在ova特异性肽刺激下产生了大量的ifn-γ,但在tlr3、ticam-1、irf3、irf3/7敲除小鼠中完全未观察到ifn-γ产生(图1b)。
3.考察
可知:单独使用抗原时未诱导出抗原特异性ctl,但通过抗原+arnax给药可诱导出抗原特异性ctl。由敲除小鼠的结果判断出,由arnax引起的抗原特异性ctl诱导依赖于tlr3-ticam-1-irf3途径,而与rlr-mavs途径或tlr3以外的tlr-myd88途径无关。arnax的致敏佐剂活性可以以tlr3-ticam-1信号来定义。
实施例2:基于给药途径的arnax的细胞因子产生效果和安全性的比较
1.材料和方法
在8周龄的野生型(c57bl/6)♀小鼠的皮下给药生理盐水、poly(i:c)(150μg)、arnax(150μg),或者在静脉中给药生理盐水、poly(i:c)(50μg)、arnax(50μg),测定3小时和6小时后的血中的细胞因子量(图2)。il-6、tnf-α、il-12p40通过cba进行测定,ifn-β、ip-10通过elisa进行测定。
2.结果
在arnax皮下给药的情况下,血中的炎性细胞因子il-6、tnf-α比poly(i:c)给药时少,ifn-γ也非常少。另一方面,作为th1型细胞因子的il-12p40比poly(i:c)时更多地被诱导产生,召集nk细胞、nkt细胞、t细胞的趋化因子ip-10与poly(i:c)时同等地被诱导。在静脉内给药的情况下,poly(i:c)强力诱导tnf-α、il-6、ifn-β,但arnax几乎未诱导出tnf-α、il-6、ifn-β。
3.考察
无论给药途径如何,arnax都几乎不诱导全身性的炎性细胞因子和i型ifn产生,因此可以称其为减轻了在poly(i:c)的情况下观察到的副作用的非炎症性佐剂。另一方面,th1型细胞因子il-12比poly(i:c)时更多地被诱导产生。在抗原特异性ctl诱导时,需要il-12、i型ifn等细胞因子作为第三信号,但也有如下报道:与由i型ifn诱导的ctl相比,由il-12诱导的ctl在肿瘤内的pd-1的表达更低、存活得更长,arnax的il-12高/ifn-β低的细胞因子谱适合于在肿瘤内的功能性的抗原特异性cd8+t细胞的诱导。
实施例3:由arnax和抗原的给药产生的抗肿瘤效果(胸腺瘤)
1.材料和方法
在c67bl/6小鼠(7周龄,♀)的腰背部皮下移植ova表达肿瘤(胸腺瘤)株eg7(2x106/200μlpbs),在第7天皮下给药pbs(n=5)或ova(100μg)+arnax(60μg)(n=5),经时测定肿瘤的增殖(图3c)。在第14天采集肿瘤,利用流式细胞术测定肿瘤内的cd8+t细胞的比例、cd8+t细胞中的ova特异性cd8+t细胞和cd11c阳性cd8+t细胞的比例(图3d)。另外,制作肿瘤组织切片,用抗cd8α抗体进行免疫染色,利用共聚焦显微镜对肿瘤内的cd8+t细胞的浸润进行pbs组20个视野、ova+arnax组16个视野的观察并进行数值化(图3f)。进一步,使用trizol从肿瘤组织中纯化rna,通过定量pcr测定gzmb、ifng、perf1、cxcl9、cxcl10、cxcl11的基因表达(图3e)。
2.结果
在ova+arnax治疗的情况下,cd8+t细胞非常多地浸润到eg7肿瘤内(图3d、图3f)。cd8+t细胞中的ova特异性ctl的比例也高,还表达活化标志物cd11c,认为诱导了效应记忆的肿瘤反应性ctl。与此相伴,诱导了肿瘤的消退(图3c)。在肿瘤内,颗粒酶(gzmb)、穿孔素(prf1)、ifn-γ(ifng)、cxcl9、cxc10、cxc11等的基因在ova+arnax的情况下表达升高(图3e)。
3.考察
认为在arnax+癌抗原给药的情况下,高效地诱导肿瘤特异性ctl并使其浸润到肿瘤内,诱导肿瘤消退。在肿瘤内,颗粒酶、穿孔素、ifn-γ等细胞杀伤相关基因和cxcl9、cxcl10、cxcl11这样的诱导ctl的趋化因子基因的表达升高,arnax是能够在肿瘤内构建th1型免疫应答的佐剂。
实施例4:arnax与pd-l1抗体的联合给药(胸腺瘤)
1.材料和方法
在c67bl/6小鼠(7周龄,♀)的腰背部皮下移植pd-l1高表达eg7(kataokaetal.,nature534:402,2016)(2x106/200μlpbs),在第7天皮下给药pbs(同种型ab(抗体)组)(n=4)、pbs(抗pd-l1ab组)(n=4)、ova(100μg)+arnax(60μg)(同种型ab组)(n=6)、ova(100μg)+arnax(60μg)(抗pd-l1ab组)(n=6),在第7天、第9天、第11天静脉内给药同种型ab或抗pd-l1ab(200μg/只),经时测定肿瘤的增殖(图4c)。在第13天采集脾脏和肿瘤,利用流式细胞术测定脾脏和肿瘤内的cd8+t细胞的比例、cd8+t细胞中的ova特异性cd8+t细胞、cd11c阳性cd8+t细胞、pd-1阳性cd8+t细胞的比例(图4d)。进一步,使用trizol从肿瘤组织中纯化rna,通过定量pcr测定gzmb、ifng、perf1、cxcl9、cxcl10、cxcl11的基因表达(图4e)。
2.结果
对于pd-l1高表达eg7,pd-l1抗体单独治疗时未抑制肿瘤增殖,但ova+arnax时诱导了肿瘤的消退。此外,通过与pd-l1抗体的组合使用,更有效地使肿瘤消退(图4c)。在ova+arnax的情况下,cd8+t细胞浸润到肿瘤内,组合使用抗pd-l1抗体时,有更多的t细胞浸润。肿瘤内的ova特异性cd8+t细胞的比例比ova+arnax、ova+arnax+抗pd-l1ab时均升高(图4d)。另一方面,在脾脏中,抗原特异性cd8+t细胞的增殖在组合使用pd-l1抗体时显著增加,活化标志物cd11c、pd-1阳性cd8+t细胞的比例也高,判断出诱导了效应记忆的肿瘤反应性ctl。另外,肿瘤内的gzmb、ifng、perf1、cxcl9的基因表达在arnax+ova与抗pd-l1抗体组合使用时也升高(图4e)。
3.考察
在对pd-l1抗体治疗具有抵抗性的pd-l1高表达的eg7肿瘤中,在ova+arnax的情况下肿瘤的增殖受到一定程度的抑制,而通过组合使用抗pd-l1抗体,能够有效地诱导肿瘤消退,因此认为,通过联合治疗能够解除pd-1/pd-l1抵抗性。
认为由于pd-1途径被阻断,因而在致敏期中诱导大量的肿瘤特异性ctl并浸润到肿瘤内,通过在效应期中解除功能抑制而有效地诱导癌症消退,与抗pd-1/pd-l1抗体的组合使用对于增强arnax的作用是有用的(参考图5)。
实施例5:arnax与pd-l1抗体的联合给药(黑色素瘤)
1.材料和方法
在c67bl/6小鼠(7周龄,♀)的腰背部皮下移植ova表达b16黑色素瘤株mo5(2x106/200μlpbs),在第10天皮下给药pbs(同种型ab组)(n=5)、pbs(抗pd-l1ab组)(n=4)、ova(100μg)+arnax(60μg)(同种型ab组)(n=4)、ova(100μg)+arnax(60μg)(抗pd-l1ab组)(n=4),在第10天、第12天、第14天、第16天静脉内给药同种型ab或抗pd-l1ab(200μg/只),经时测定肿瘤的增殖(图6c)。在第17天采集脾脏和肿瘤,利用流式细胞术测定脾脏和肿瘤内的cd8+t细胞的比例、cd8+t细胞中的ova特异性cd8+t细胞和cd11c阳性cd8+t细胞、pd-1阳性cd8+t细胞的比例(图6d)。另外,使用trizol从肿瘤组织中纯化rna,通过定量pcr测定颗粒酶(gzmb)、穿孔素(prf1)、ifn-γ(ifng)、cxcl10的基因表达(图6e)。进一步,对于淋巴细胞、树突细胞、cd11b阳性髄系细胞分别测定肿瘤浸润免疫细胞的比例(图6f)。
2.结果
对于pd-l1表达mo5,ova+arnax诱导了与pd-l1抗体单独治疗时同等程度的肿瘤消退。此外,ova+arnax通过与pd-l1抗体组合使用,更有效地使肿瘤消退(图6c)。在ova+arnax的情况下,cd8+t细胞浸润到肿瘤内,组合使用抗pd-l1抗体时,有更多的t细胞浸润。肿瘤内的ova特异性cd8+t细胞的比例比ova+arnax、ova+arnax+抗pd-l1ab时均升高(图6d)。另一方面,在脾脏中,抗原特异性cd8+t细胞的增殖在组合使用pd-l1抗体时显著增加,活化标志物cd11c、pd-1阳性cd8+t细胞的比例也高,判断出诱导了效应记忆的肿瘤反应性ctl。另外,肿瘤内的gzmb、ifng、perf1、cxcl9的基因表达在arnax+ova与抗pd-l1抗体组合使用时也升高(图6e)。
3.考察
在mo5肿瘤中,arnax+癌抗原治疗抑制肿瘤增殖,而通过与pd-l1抗体组合使用,能够更有效地诱导肿瘤消退。由此认为,对于黑色素瘤,通过与arnax+癌抗原的联合治疗,pd-1/pd-l1免疫检查点抑制剂也能够发挥高抗肿瘤效果。
实施例6:arnax的结构和tlr3介导的ifnβ活化能力
1.材料和方法
合成下述4种双链rna。
arnax140:具有序列号1的1-140位的碱基序列的双链rna
arnax120#1:具有序列号1的17-136位的碱基序列的双链rna
arnax120#2:具有将序列号1的17-56的碱基序列连结3次而得到的序列的双链rna
arnax130:具有序列号1的1-130位的碱基序列的双链rna
序列号1的17-56位为富含au的区域(图7)。
将对照质粒(pef/bos)或人tlr3表达质粒与ifn-β启动子报告质粒一起转染到hek293细胞中,24小时后以2μg/ml、5μg/ml、10μg/ml的浓度添加培养基、poly(i:c)、arnax140或arnax120#2。6小时后测定细胞中的荧光素酶活性。将在pef/bos表达细胞中添加培养基作为阴性对照时的荧光素酶活性设为1,用倍数进行表示(图8)。
以2μg/ml、5μg/ml、10μg/ml的浓度添加poly(i:c)、arnax140、arnax130或arnax120#1,实施同样的实验(图9)。
2.结果
arnax120的tlr3介导的ifn-β启动子活化能力为arnax140的7-8成,在rna序列不同的arnax120#1和arnax120#2之间未确认到tlr3活化能力的差异。确认了arnax130具有与arnax140同等的tlr3介导的ifn-β启动子活化能力。
实施例7:arnax120的ctl诱导活性
1.材料和方法
按照实施例1,使用8周龄的野生型(c57bl/6)雌性小鼠,测定通过皮下给药pbs、ova(100μg)、ova(100μg)+poly(i:c)(50μg)、ova(100μg)+arnax140(10μg)、ova(100μg)+arnax140(30μg),ova(100μg)+arnax140(60μg)产生的、脾脏和腘窝淋巴结中的ova特异性cd8+t细胞的比例。
同样地,使用8周龄的野生型(c57bl/6)雌性小鼠,测定通过皮下给药pbs、ova(100μg)、ova(100μg)+poly(i:c)(50μg)、ova(100μg)+arnax120#2(10μg)、ova(100μg)+arnax120#2(30μg)产生的、脾脏中的ova特异性cd8+t细胞的比例。另外,将脾细胞(1x107/ml)用100nm的ova特异性肽(sl8:siinfekl)或对照wt1肽(db126:rmfpnapyl)刺激3天,通过elisa测定培养上清中的ifn-γ。
2.结果
pbs或ova单独给药时未诱导ova特异性ctl,但在ova+poly(i:c)、ova+arnax140、ova+arnax120#2给药时诱导了ctl,确认了在体内的交叉致敏活性(图10、图11)。使arnax140的给药量为变量,结果判断出,在10μg/只时具有充分的ctl诱导活性(图10)。确认了:arnax120具有与arnax140同等的ctl诱导活性(交叉致敏活性),在10μg/只的给药量时显示出充分的ctl诱导活性(图11)。
实施例8:arnax120的抗肿瘤活性
1.材料和方法
按照实施例3,在c67bl/6小鼠(7周龄,♀)的腰背部皮下移植eg7(2x106/200μlpbs),在第7天皮下给药pbs(n=5)、arnax120#1(10μg)(n=4)或ova(100μg)+arnax120#1(10μg)(n=5),经时测定肿瘤的增殖。
2.结果
确认了:arnax120#110μg单独给药时观察到eg7肿瘤的增殖抑制,但与ova抗原同时给药时使肿瘤显著消退(图12)。由以上的结果确认:arnax为120个碱基长度时能够充分发挥效果;只要在其序列中包含序列号1所示的序列中的连续的至少40个碱基即可。从制造效率和成本方面出发,优选短的核酸,因此,arnax120、arnax130在实用方面可以作为有用的佐剂候选。
产业上的可利用性
根据本发明,能够改善pd-1/pd-l1抗体疗法的效果和有效率。因此,本发明在癌症、感染性疾病等利用免疫检查点抑制剂(pd-1/pd-l1抗体)的免疫疗法受到期待的医疗领域中有用。
本说明书中引用的全部发行物、专利和专利申请直接作为参考并入本说明书中。
序列表自由文本
序列号12:合成dna(odnm362)
序列号13:合成dna(odn2006)
序列号14:合成dna(odn1668)
序列号15:合成dna(odn1826)
序列号16:合成dna(odn2007)
序列号17:合成dna(odnbw006)
序列号18:合成dna(odn2395)
序列号19:合成dna(odnm362对照)
序列号20:合成dna(odnm362对照_tpc置换体)
序列号21:合成dna(odnm362对照_cpc置换体)
序列号22:合成dna(odn2006对照)
序列号23:合成dna(odn2006对照_tpc置换体)
序列号24:合成dna(odn2006对照_cpc置换体)
序列号25:合成dna(odn2007对照)
序列号26:合成dna(odn2007对照_tpc置换体)
序列号27:合成dna(odn2007对照_cpc置换体)
序列号28:合成dna(odnbw006对照)
序列号29:合成dna(odnbw006对照_tpc置换体)
序列号30:合成dna(odnbw006对照_cpc置换体)
序列号31:合成dna(odn2395对照)
序列号32:合成dna(odn2395对照_tpc置换体)
序列号33:合成dna(odn2395对照_cpc置换体)
序列号34:合成dna(odn1668对照)
序列号35:合成dna(odn1668对照_tpc置换体)
序列号36:合成dna(odn1668对照_cpc置换体)
序列号37:合成dna(odn1826对照)
序列号38:合成dna(odn1826对照_tpc置换体)
序列号39:合成dna(odn1826对照_cpc置换体)
序列号40:有义链用dna/rna嵌合分子(arnax140)
序列号41:反义链用合成rna(arnax140)
序列号42:有义链用dna/rna嵌合分子(arnax120#1)
序列号43:反义链用合成rna(arnax120#1)
序列号44:有义链用dna/rna嵌合分子(arnax120#2)
序列号45:反义链用合成rna(arnax120#2)
序列号46:有义链用dna/rna嵌合分子(arnax130)
序列号47:反义链用合成rna(arnax130)
序列表
<110>国立大学法人北海道大学(nationaluniversitycorporationhokkaidouniversity)
<120>癌免疫佐剂(adjuvantforcancerimmunotherapy)
<130>phu-9004wo
<150>jp2016-147657
<151>2016-07-27
<150>jp2017-079445
<151>2017-04-13
<160>47
<170>patentinversion3.5
<210>1
<211>1152
<212>rna
<213>麻疹病毒
<400>1
accagacaaagcugggaauagaaacuucguauuuucaaaguuuucuuuaauauauugcaa60
auaaugccuaaccaccuagggcaggauuaggguuccggaguucaaccaauuaguccuuaa120
ucagggcacuguauccgacuaacuuauaccauucuuuggucuccuugacuguuaccuuaa180
aaacccacucacguuucaaaccccccgucauaauaaucuguuucucugacuuggauagau240
ucuuaacgaagauauucugguguaagucuaguaucagauagccggacuugagauucugga300
uaaacuuauuuaucaacuuucuguucccggaguaaagaagaaugugcccccaaaauuugc360
gggugauccuagauauaaguucucguugccugcuacuuaccaauacgggguaagcgugga420
acaucccuuguugacuucuuugguugucuuugaaucuugccaacucccuguagaggauga480
guauagaauuaagcaauccaucuugcccugaggcaacaucaugguggaucaauucuuugc540
acagcuuagguccguuaauugccaacccgcaauugaucagcaccugcucuauagguguaa600
guuuuuucagaguaggauugauaucaccucuacuaacugcgucucccacaauugcuugua660
ugcagcuuaguugcuuaauggauaggaugugaccuauaaguccaggugaaguccucacag720
augauucaauuaucugcugcuuaaucuuuucaggauucauuagccgguuagccuugagau780
cugucauaaccaaauaagauucaguagauaugaaguugcuguaucuaggguauacaaggu840
ucacuucucuauaaugagacccuacauaacuuauaaaucccugaacaaaauccccgcuga900
aaggcauaagcuuaaucaccaguauugauccuauuuugcccaggagcagagccaucgaua960
agauggcugccaauuccucuagcuucucuauaguaucuuuguuaggcaaguuagucggau1020
acagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugcccuaggug1080
guuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucuauuccca1140
gcuuugucuggu1152
<210>2
<211>58
<212>rna
<213>麻疹病毒
<400>2
ggauacagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugccc58
<210>3
<211>79
<212>rna
<213>麻疹病毒
<400>3
cccggugguuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucu60
auucccagcuuugucuggu79
<210>4
<211>139
<212>rna
<213>麻疹病毒
<400>4
cccggauacagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugcc60
cuaggugguuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucu120
auucccagcuuugucuggu139
<210>5
<211>79
<212>rna
<213>麻疹病毒
<400>5
ggugguuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucuauu60
cccagcuuugucugguccc79
<210>6
<211>139
<212>rna
<213>麻疹病毒
<400>6
ggauacagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugcccua60
ggugguuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucuauu120
cccagcuuugucugguccc139
<210>7
<211>99
<212>rna
<213>麻疹病毒
<400>7
ggaacccuaauccugcccuaggugguuaggcauuauuugcaauauauuaaagaaaacuuu60
gaaaauacgaaguuucuauucccagcuuugucugguccc99
<210>8
<211>110
<212>rna
<213>麻疹病毒
<400>8
gguugaacuccggaacccuaauccugcccuaggugguuaggcauuauuugcaauauauua60
aagaaaacuuugaaaauacgaaguuucuauucccagcuuugucugguccc110
<210>9
<211>119
<212>rna
<213>麻疹病毒
<400>9
ggacuaauugguugaacuccggaacccuaauccugcccuaggugguuaggcauuauuugc60
aauauauuaaagaaaacuuugaaaauacgaaguuucuauucccagcuuugucugguccc119
<210>10
<211>73
<212>rna
<213>麻疹病毒
<400>10
ggauacagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugcccua60
ggugguuaggcau73
<210>11
<211>140
<212>rna
<213>麻疹病毒
<400>11
accagacaaagcugggaauagaaacuucguauuuucaaaguuuucuuuaauauauugcaa60
auaaugccuaaccaccuagggcaggauuaggguuccggaguucaaccaauuaguccuuaa120
ucagggcacuguauccgacu140
<210>12
<211>25
<212>dna
<213>人工序列
<220>
<223>合成dna(odnm362)
<400>12
tcgtcgtcgttcgaacgacgttgat25
<210>13
<211>24
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2006)
<400>13
tcgtcgttttgtcgttttgtcgtt24
<210>14
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1668)
<400>14
tccatgacgttcctgatgct20
<210>15
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1826)
<400>15
tccatgacgttcctgacgtt20
<210>16
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2007)
<400>16
tcgtcgttgtcgttttgtcgtt22
<210>17
<211>23
<212>dna
<213>人工序列
<220>
<223>合成dna(odnbw006)
<400>17
tcgacgttcgtcgttcgtcgttc23
<210>18
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2395)
<400>18
tcgtcgttttcggcgcgcgccg22
<210>19
<211>25
<212>dna
<213>人工序列
<220>
<223>合成dna(odnm362control)
<400>19
tgctgctgcttgcaagcagcttgat25
<210>20
<211>25
<212>dna
<213>人工序列
<220>
<223>合成dna(odnm362control_tpcsubstitute)
<400>20
ttcttcttctttcaatcatcttgat25
<210>21
<211>25
<212>dna
<213>人工序列
<220>
<223>合成dna(odnm362control_cpcsubstitute)
<400>21
tcctcctccttccaaccaccttgat25
<210>22
<211>24
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2006control)
<400>22
tgctgcttttgtgcttttgtgctt24
<210>23
<211>24
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2006control_tpcsubstitute)
<400>23
ttcttcttttgttcttttgttctt24
<210>24
<211>24
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2006control_cpcsubstitute)
<400>24
tcctccttttgtccttttgtcctt24
<210>25
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2007control)
<400>25
tgctgcttgtgcttttgtgctt22
<210>26
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2007control_tpcsubstitute)
<400>26
ttcttcttgttcttttgttctt22
<210>27
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2007control_cpcsubstitute)
<400>27
tcctccttgtccttttgtcctt22
<210>28
<211>23
<212>dna
<213>人工序列
<220>
<223>合成dna(odnbw006control)
<400>28
tgcagcttgctgcttgctgcttc23
<210>29
<211>23
<212>dna
<213>人工序列
<220>
<223>合成dna(odnbw006control_tpcsubstitute)
<400>29
ttcatctttcttctttcttcttc23
<210>30
<211>23
<212>dna
<213>人工序列
<220>
<223>合成dna(odnbw006control_cpcsubstitute)
<400>30
tccaccttcctccttcctccttc23
<210>31
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2395control)
<400>31
tgctgcttttggggggcccccc22
<210>32
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2395control_tpcsubstitute)
<400>32
ttcttcttttgggggtcccccc22
<210>33
<211>22
<212>dna
<213>人工序列
<220>
<223>合成dna(odn2395control_cpcsubstitute)
<400>33
tcctccttttgggggccccccc22
<210>34
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1668control)
<400>34
tccatgagcttcctgatgct20
<210>35
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1668control_tpcsubstitute)
<400>35
tccatgatcttcctgattct20
<210>36
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1668control_cpcsubstitute)
<400>36
tccatgaccttcctgatcct20
<210>37
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1826control)
<400>37
tccatgagcttcctgagctt20
<210>38
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1826control_tpcsubstitute)
<400>38
tccatgatcttcctgatctt20
<210>39
<211>20
<212>dna
<213>人工序列
<220>
<223>合成dna(odn1826control_cpcsubstitute)
<400>39
tccatgaccttcctgacctt20
<210>40
<211>165
<212>dna
<213>人工序列
<220>
<223>有义链用dna/rna嵌合分子
<220>
<221>misc_feature
<222>(26)..(165)
<223>rna
<400>40
tgctgctgcttgcaagcagcttgataccagacaaagcugggaauagaaacuucguauuuu60
caaaguuuucuuuaauauauugcaaauaaugccuaaccaccuagggcaggauuaggguuc120
cggaguucaaccaauuaguccuuaaucagggcacuguauccgacu165
<210>41
<211>140
<212>rna
<213>人工序列
<220>
<223>反义链用合成rna
<400>41
agucggauacagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugc60
ccuaggugguuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuuc120
uauucccagcuuugucuggu140
<210>42
<211>145
<212>dna
<213>人工序列
<220>
<223>有义链用dna/rna嵌合分子
<400>42
tgctgctgcttgcaagcagcttgataauagaaacuucguauuuucaaaguuuucuuuaau60
auauugcaaauaaugccuaaccaccuagggcaggauuaggguuccggaguucaaccaauu120
aguccuuaaucagggcacuguaucc145
<210>43
<211>120
<212>rna
<213>人工序列
<220>
<223>反义链用合成rna
<400>43
ggauacagugcccugauuaaggacuaauugguugaacuccggaacccuaauccugcccua60
ggugguuaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucuauu120
<210>44
<211>145
<212>dna
<213>人工序列
<220>
<223>有义链用dna/rna嵌合分子
<400>44
tgctgctgcttgcaagcagcttgataauagaaacuucguauuuucaaaguuuucuuuaau60
auauuaauagaaacuucguauuuucaaaguuuucuuuaauauauuaauagaaacuucgua120
uuuucaaaguuuucuuuaauauauu145
<210>45
<211>120
<212>rna
<213>人工序列
<220>
<223>反义链用合成rna
<400>45
aauauauuaaagaaaacuuugaaaauacgaaguuucuauuaauauauuaaagaaaacuuu60
gaaaauacgaaguuucuauuaauauauuaaagaaaacuuugaaaauacgaaguuucuauu120
<210>46
<211>155
<212>dna
<213>人工序列
<220>
<223>有义链用dna/rna嵌合分子
<400>46
tgctgctgcttgcaagcagcttgataccagacaaagcugggaauagaaacuucguauuuu60
caaaguuuucuuuaauauauugcaaauaaugccuaaccaccuagggcaggauuaggguuc120
cggaguucaaccaauuaguccuuaaucagggcacu155
<210>47
<211>130
<212>rna
<213>人工序列
<220>
<223>反义链用合成rna
<400>47
agugcccugauuaaggacuaauugguugaacuccggaacccuaauccugcccuagguggu60
uaggcauuauuugcaauauauuaaagaaaacuuugaaaauacgaaguuucuauucccagc120
uuugucuggu130
- 还没有人留言评论。精彩留言会获得点赞!