可卡因依赖症的治疗或防复发药的制作方法
本发明涉及以nop受体激动剂为有效成分的可卡因依赖症的治疗或防复发药。
背景技术:
根据美国的统计,2014年12岁以上成人的可卡因滥用终生患病率为14.5%(https://www.drugabuse.gov/drugs-abuse/cocaine),成为很大的社会问题,但没有有效的批准治疗药,期待新药的开发。
另一方面,作为阿片受体之一,已知有nop受体。nop(nociceptinorphaninfqpeptide,痛敏肽/孤啡肽)受体、别名orl1(opioidreceptor-like1,阿片受体样1)受体(参照非专利文献1、非专利文献2)是作为dop(δ)、kop(κ)及mop(μ)受体之后的第4个阿片受体、在1994年被发现的受体。虽然与其它阿片受体具有约60%的氨基酸序列的同源性,但在作为非选择性阿片受体拮抗剂的纳洛酮不发生结合(参照非专利文献2)的方面与其它的阿片受体明显不同。
nop受体的内源性配体是在1995年由法国和瑞士的研究团队相继鉴定的,分别被命名为痛敏肽(nociceptin)(参照非专利文献3)和孤啡肽(orphaninfq)(参照非专利文献4)(以下也称作n/ofq)。n/ofq和nop受体在中枢神经系统中广泛分布(参照非专利文献5、非专利文献6),与疼痛、学习记忆、摄取食物、奖赏等许多生理作用有关(参照非专利文献7)。
作为评价药物依赖性的强弱的方法,已知有自身给药法及条件性位置偏爱(conditionedplacepreference:cpp)法(参照非专利文献8)。目前为止,利用自身给药法及cpp法确认了n/ofq或低分子nop受体激动剂会抑制乙醇(参照非专利文献9、非专利文献10、非专利文献11、非专利文献12、专利文献13)或鸦片类药物(参照非专利文献14、非专利文献15、非专利文献17)的强化效应,即抑制想反复摄取药物的欲念(也称作奖赏效应)。
另一方面,教示nop受体激动剂对于可卡因依赖症的有效性的报告极少,特别是低分子nop受体激动剂的有效性尚未确认(参照非专利文献16、非专利文献17、非专利文献18、非专利文献19、非专利文献20)。
另外,作为在可卡因依赖症的治疗或预防复发中使用的nop受体激动剂,优选相对于mop受体、nop受体的选择性更高的分子。但是,目前报告的低分子nop受体激动剂中,相对于mop受体、nop受体的选择性最为优异的化合物sch221510(参照非专利文献21)虽然在脑内给药中会抑制大鼠的鸦片类药物自身给药,但在末梢(皮下)给药中并未产生抑制(参照非专利文献14),由此认为血脑屏障通过性较低(参照非专利文献21),作为针对可卡因依赖症模型的nop受体激动剂的有效性是不充分的。因此,期待开发出属于受体选择性高、且血脑屏障通过性优异的低分子nop受体激动剂、而且在不显示基于nop受体激动剂的中枢抑制作用的困倦等副作用(非专利文献22)的低用量下即显示有效性的化合物。但是,到目前为止并没有在临床预测性高的可卡因依赖症模型、例如灵长类的可卡因自身给药模型中显示出有效性的低分子化合物的报告(参照非专利文献21)。
作为其它的低分子nop受体激动剂,例如已知有苯并咪唑化合物(参照专利文献1),但并没有有关对可卡因依赖症的有效性的具体记载。
现有技术文献
专利文献
专利文献1:wo2008/105497号公报小册子
非专利文献
非专利文献1:febslett.347:284-288,1994.
非专利文献2:febslett.341:33-38,1994.
非专利文献3:nature377:532-535,1995.
非专利文献4:science270:792-794,1995.
非专利文献5:j.comp.neurol.412:563-605,1999.
非专利文献6:j.comp.neurol.06:503-547,1999.
非专利文献7:pharmacol.rev.53:381-415,2001.
非专利文献8:pharmacol.biochem.behav.11:231-233,1979.
非专利文献9:psychopharmacology172:170-178,2004.
非专利文献10:neuropsychopharmacology32:902-910,2007.
非专利文献11:addict.biol.20:643-651,2015.
非专利文献12:neuropsychopharmacology39,2601-2610,2014.
非专利文献13:j.phramacol.exp.ther.304:310-318,2003.
非专利文献14:eur.j.pharmacol.745:182-189,2014.
非专利文献15:neuropharmacology49,439-446,2005.
非专利文献16:neuroreport11:1939-1943,2000.
非专利文献17:psychopharmacology172:129-136,2004.
非专利文献18:behav.pharmacol.13:229-235,2002.
非专利文献19:eur.j.pharmacol.645:119-126,2010.
非专利文献20:societyforneuroscience,2013.programno.733.24
非专利文献21:j.med.chem.59:7011-7028,2016.
非专利文献22:lung188:s47-s52,2010.
技术实现要素:
发明要解决的技术问题
本发明人为了发现属于nop受体选择性高、且血脑屏障通过性优异的低分子nop受体激动剂、并且在不显示困倦等副作用的低用量下即显示有效性的化合物,进行了深入研究,使用具有下述结构的nop受体激动剂的(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺(以下也称作化合物a)或其药学上可容许的盐,并进行在猴子和大鼠的可卡因依赖模型中的有效性相关的评价,结果发现化合物a或其药学上可容许的盐具有可卡因依赖症的治疗效果及防复发效果,从而完成了本发明。
[化学式编号1]
用于解决技术问题的手段
即,本发明如下。
(1)一种可卡因依赖症的治疗或防复发用药品组合物,其含有(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐。
(2)一种可卡因依赖症的治疗方法,其包含将(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐给药至需要治疗的患者。
(3)上述(2)所述的可卡因依赖症的治疗方法,其中,(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐的给药量是每1日为0.01~30mg。
(4)一种可卡因依赖症的防复发方法,其包含将(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐给药至需要治疗的患者。
(5)上述(4)所述的可卡因依赖症的防复发方法,其中,(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐的给药量是每1日为0.01~30mg。
(6)上述(1)所述的药品组合物,其中,可卡因依赖症是选自可卡因滥用、因使用可卡因所引起的精神症状及身体症状、以及再摄取(复发)中的疾病。
(7)上述(2)或(3)所述的治疗方法,其中,可卡因依赖症是选自可卡因滥用、因使用可卡因所引起的精神症状及身体症状、以及再摄取(复发)中的疾病。
(8)上述(4)或(5)所述的防复发方法,其中,可卡因依赖症是选自可卡因滥用、因使用可卡因所引起的精神症状及身体症状、以及再摄取(复发)中的疾病。
(9)上述(1)或(6)所述的药品组合物、或者上述(2)~(5)或(7)~(8)中任一项所述的治疗方法或防复发方法,其中,可卡因依赖症是使用可卡因中止后的戒断症状。
(10)(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐的用于制造可卡因依赖症的治疗或防复发用药品组合物的用途。
(11)(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐的用于可卡因依赖症的治疗或防复发的用途。
(12)上述(10)或(11)所述的用途,其中,可卡因依赖症为选自可卡因滥用、因使用可卡因所引起的精神症状及身体症状、以及再摄取(复发)中的疾病。
(13)用于可卡因依赖症的治疗或防复发的(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐。
(14)上述(13)所述的用于治疗或防复发的(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐,其中,可卡因依赖症为选自可卡因滥用、因使用可卡因所引起的精神症状及身体症状、以及再摄取(复发)中的疾病。
(15)上述(10)~(12)中任一项所述的用途、或者上述(13)或(14)所述的用于治疗或防复发的(r)-2-{3-[1-(5-甲基-1,2,3,4-四氢萘-1-基)哌啶-4-基]-2,3-二氢-2-氧代-苯并咪唑-1-基}-n-甲基乙酰胺或其药学上可容许的盐,其中,可卡因依赖症为使用可卡因中止后的戒断症状。
发明效果
作为本发明有效成分的化合物a或其药学上可容许的盐可作为对可卡因依赖症有效的治疗药或防复发药进行使用。另外,化合物a或其药学上可容许的盐可作为可卡因滥用、因使用可卡因所引起的精神症状及身体症状(例如包含使用可卡因中止后的戒断症状)、以及再摄取(复发)的治疗药或防复发药进行使用。
附图说明
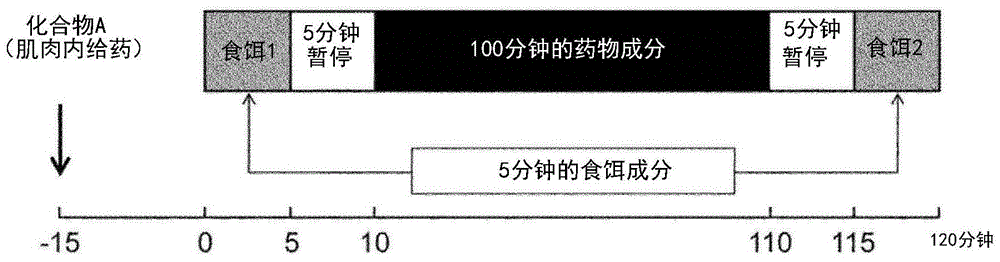
图1为表示猴子的可卡因自身给药试验的实验方案的图。在100分钟的可卡因自身给药测试(100mindrugcomponent,100分钟的药物成分)的前后插入5分钟的暂停时间(5minto,5分钟暂停;即便按压杠杆也得不到任何奖赏的时间),以评价化合物a对按压杠杆行为本身的影响为目的,实施5分钟的食饵获取测试(5minfoodcomponent,5分钟的食饵成分(食饵1,食饵2))。横轴示出了化合物a肌肉内给药(compounda(i.m.))后的时间经过。
图2为表示在使用各种用量的化合物a的条件下探讨化合物a对猴子的可卡因自身给药的作用的结果的图。左图表示可卡因自身给药测试前的食饵获取测试(食饵1)的结果、中央图表示可卡因自身给药测试(可卡因)的结果、右图表示可卡因自身给药测试后的食饵获取测试(食饵2)的结果。任何图的纵轴均表示所获取的奖赏(可卡因的自己注射或食饵丸)的次数(reinforcers,强化)、横轴均表示化合物a的用量(doseofcompounda(mg/kg,i.m.))、sal均表示作为对照的生理盐水给药组。化合物a在不影响食饵获取次数的用量下使得可卡因的奖赏次数减少。
图3为表示在使用各种用量的可卡因的条件下探讨化合物a对猴子的可卡因自身给药的作用的结果的图。纵轴表示所获取的奖赏(可卡因的自己注射或食饵丸)的次数、横轴表示每次的可卡因的用量。化合物a的用量使用图2的结果中未显示中枢抑制作用的0.1或0.32mg/kg。sal表示作为对照的生理盐水给药组。可卡因的用量与奖赏次数的关系显示出钟型反应,化合物a在可卡因的奖赏效应最强的条件(可卡因用量为0.01mg/kg/注入的条件)下使奖赏次数显著减少。
图4为表示大鼠的应激诱导的可卡因觅药行为试验的实验方案的图。纵轴表示与奖赏相关的按压杠杆次数(activeleverpresses,主动杠杆按压)、横轴表示自训练开始的时间、折线是按压杠杆次数的经日变化的图像。在可获得可卡因奖赏的训练期间(trainingphase)后,设置无法获得可卡因奖赏的期间(extinctionphase,消退期间),接着施加足底电击应激(footshockstress),之后测定按压杠杆次数(reinstatementtest,恢复测试),这时,由于因足底电击应激诱发可卡因觅药行为,按压杠杆次数增加(increase(relapsemodel,复发模型))。通过测定因化合物a的经口给药(p.o.)导致的按压杠杆次数的减少,可以评价化合物a预防由应激诱发的可卡因依赖复发的效果。
图5为表示化合物a对大鼠的应激诱导的可卡因觅药行为的作用的结果的图。纵轴表示与奖赏相关的按压杠杆次数、横轴表示化合物a的用量(doseofcompounda(mg/kg,p.o.))、veh表示作为对照的溶剂处置组。虚线表示消退期间(extinctionphase)的最终日(恢复测试前日)的各组的按压杠杆次数的平均值幅度。化合物a在3mg/kg的用量下显著性地抑制了应激诱导的可卡因觅药行为(*<0.05vs溶剂处置组)。
具体实施方式
以下对本发明详细地进行说明。
本发明的化合物a可以通过专利文献1的实施例10所记载的方法进行制造。
本发明的化合物a或其药学上可容许的盐包括用同位素(例如2h、3h、13c、14c、15n、18f、32p、35s、125i等)等标记了的化合物及氘代体。
本发明的化合物a的药学上可容许的盐包含与无机酸和有机酸形成的酸加成盐或与无机碱形成的盐。具体地说,包含与盐酸、草酸、马来酸、富马酸等无机酸和有机酸形成的酸加成盐,以及与钠、钾、钙、镁等无机碱形成的盐。
另外,本发明还包含化合物a的外消旋混合物或它们所对应的对映体。
本说明书中的用语“患者”是成为利用化合物a或其药学上可容许的盐进行治疗或防复发的对象的个体,优选是人。
本说明书中的用语“可卡因依赖症”以包含可卡因滥用、因使用可卡因引起的精神症状及身体症状(例如包含使用可卡因中止后的戒断症状)以及再摄取(复发)的广泛概念进行使用。另外,本说明书中的用语“精神症状”所含的症状并无限定,可举出四肢无力、食欲下降、不安、抑郁以及使用可卡因中止后的戒断症状等。另外,本说明书中的用语“身体症状”所含的症状并无限定,可举出瞳孔放大、血压上升、痉挛、睡眠障碍、严重的神经病、幻觉、妄想以及使用可卡因中止后的戒断症状等。
另外,本发明不仅可以治疗可卡因依赖症,还可预防在可卡因的使用中止后、各种应激成为诱因所引起的对可卡因的渴望所导致的复发。这里,所谓应激并无限定,可以举出精神应激(例如寂寞、不安感、被疏远感、疲劳、骚扰等)以及身体应激(例如噪音、疾病、疼痛、负伤、睡眠不足、过重劳动等)。
含有本发明的化合物a或其药学上可容许的盐作为有效成分的药品可以是经口给药、也可以是非经口给药。作为给药剂型,可举出片剂、胶囊剂、颗粒剂、散剂、注射剂、口腔崩解片、涂布剂、软膏及栓剂等。这些可以使用常用的技术、根据需要与药学上可容许的载体一起制成制剂。作为药学上可容许的载体,可以是本领域中常用的载体,例如可举出增量剂(乳糖、蔗糖、玉米淀粉、磷酸钾、山梨糖醇、甘氨酸、甘露醇及结晶纤维素等)、润滑剂(硬脂酸镁、滑石、聚乙二醇及二氧化硅等)、结合剂(糖浆、阿拉伯树胶、明胶、山梨糖醇、黄芪胶、聚乙烯吡咯烷酮、羟丙基纤维素、聚乙烯醇及聚乙二醇等)、崩解剂(马铃薯淀粉、低取代度羟丙基纤维素及交联羧甲基纤维素等)、包衣剂或覆膜剂(乙基纤维素及羟丙基甲基纤维素等)以及软膏基剂(凡士林及石蜡等)等。例如,当本发明的药品为片剂、胶囊剂、颗粒剂、散剂等经口剂时,可以根据需要使用增量剂、润滑剂、结合剂、崩解剂、包衣剂、覆膜剂等进行制备。当本发明的药品为软膏时,可以使用常用的基剂进行制备。本发明的化合物a由于可见良好的血脑屏障通过性,因而作为经口剂特别适合。
作为本发明有效成分的化合物a或其药学上可容许的盐的给药量(即有效量)可以根据症状、患者的年龄、体重、剂型等适当选择,若是经口剂,通常可以将每日0.01~30mg、优选0.1~3mg按1次或分数次进行给药。另外,由于已知nop受体激动剂从其作用机理的特性方面来说具有基于中枢抑制作用的困倦等副作用(非专利文献22),因此为了安全且有效地进行使用,给药量的设定是极为重要的。即,优选以在实验动物中可观察到中枢抑制作用的用量的1/3~1/30的用量进行给药。另外,作为评价中枢抑制作用的实验动物,优选对人的外推性高的灵长类,优选能够在同一个体中同时评价主要效果和中枢抑制作用的试验方案。由实施例1和猴子的药动学试验的结果可推测,人体中的化合物a的给药量为0.1~3mg,认为优选在该给药量的范围内进行使用。
接着,对可卡因依赖性的评价进行说明。
药物依赖性的强弱可以以强化效应(奖赏效应)为指标进行调查,作为在非临床上测定强化效应的方法,有自身给药法。自身给药法中,在当按压杠杆时、药物自输液泵自动地被给药至静脉内的条件下,可以以按压杠杆行为为指标来调查依赖性的强弱。自身给药法在评价药物的强化效应的方面是可靠性最高的方法,但具有自身给药的训练需要很长时间的缺点。作为克服该缺点、在较短期间内评价药物依赖性的方法,考察了条件性位置偏爱(conditionedplacepreference:cpp)法(参照非专利文献8),作为主要使用小鼠或大鼠的依赖性评价体系被广泛使用。但是,cpp法是以位置偏爱为指标来预测强化效应的方法,并非是直接评价强化效应的体系。利用cpp法,能够评价对由依赖性药物带来的位置偏爱的条件性、即cpp获得(acquisition)的作用、对位置偏爱获得后的cpp表现(expression)的作用、以及对消除暂时获得的位置偏爱后利用应激负荷等使位置偏爱恢复的复发(reinstatement,恢复)的作用。另一方面,为自身给药法时,由于训练需要较长期间,因此并未进行对获得的作用的评价,但对自身给药获得后的药物摄取行为的作用、自身给药消除后的应激负荷等导致的觅药行为的作用的评价是可以进行的。
目前,利用自身给药法及cpp法确认了n/ofq或低分子nop受体激动剂会抑制乙醇(参照非专利文献9、非专利文献10、非专利文献11、非专利文献12、专利文献13)或鸦片类药物(参照非专利文献14、非专利文献15、非专利文献17)的强化效应。表1中总结了与nop受体激动剂对于乙醇依赖症的评价体系的作用有关的到目前为止的报告。此外,表中“9)”等记载表示记载了各实验结果的非专利文献的编号(表2中也是同样的)。由多个低分子化合物的结果教示了nop受体激动剂对乙醇依赖症的有效性。
[表1]
表1nop受体激动剂对乙醇依赖症的评价体系的作用的总结
○:有效n.t.:未实施
ro64-6198:(1s,3as)-8-(2,3,3a,4,5,6-六氢-1h-非那烯-1-基)-1-苯基-1,3,8-三氮杂-螺[4.5]癸-4-酮盐酸盐
mt-7716:(r)-2-{3-[1-(苊-1-基)哌啶-4-基]-2-氧代-2,3-二氢-1h-苯并咪唑-1-基}-n-甲基乙酰胺盐酸盐一水合物
另一方面,nop受体激动剂对可卡因依赖症的作用的相关报告较少,关于自身给药法唯一地仅有n/ofq不会抑制大鼠中可卡因自身给药消除后的因应激所诱发的可卡因觅药行为的报告(参照非专利文献16)。另外,关于cpp法有下表所示化合物的相关报告。
当将n/ofq给药至小鼠的脑室内时,因可卡因导致的cpp获得(参照非专利文献17)和cpp表现(参照非专利文献18)被阻断。而低分子的nop受体激动剂ro65-6570(参照非专利文献18、非专利文献19)对于可卡因导致的cpp获得、cpp表现并未产生影响。另外,同样为低分子nop受体激动剂的at-202(参照非专利文献20)虽然不会对cpp获得造成影响,但抑制了因应激导致的cpp的复发。表2中总结了以上的nop受体激动剂对可卡因依赖症评价体系的作用的报告。
[表2]
表2nop受体激动剂对可卡因依赖症的评价体系的作用的总结
○:有效×:无效n.t.:未实施
ro65-6570:8-苊-1-基-苯基-1,3,8-三氮杂-螺[4.5]癸-4-酮盐酸盐
at-202:1-[1-(2,3,3a,4,5,6-六氢-1h-非那烯-1-基)哌啶-4-基]-吲哚啉-2-酮
另外,作为在内源性激动剂n/ofq有效的评价体系(cpp获得、cpp表现)中、目前报告的低分子nop受体激动剂不显示效果的理由,认为有这些化合物的受体选择性不充分的可能性。即,认为ro65-6570、at-202的任一个化合物并非仅对nop受体具有激动剂活性、还对mop受体具有激动剂活性,与nop受体激动剂活性的区别有可能是不充分的。因此,由nop受体激动剂活性产生的效果有可能因基于mop受体激动剂活性的依赖性的表现而减弱或消失。另外,目前报告的低分子nop受体激动剂中,相对于mop受体、nop受体的选择性最优异的化合物是sch221510(参照非专利文献21),但是,sch221510虽然通过脑内给药会抑制大鼠的鸦片类药物自身给药,但在末梢(皮下)给药中并未产生抑制(参照非专利文献14),认为血脑屏障通过性较低(参照非专利文献21)。
另一方面,显示依赖性的物质有乙醇或吗啡等中枢抑制药和可卡因或脱氧麻黄碱等精神刺激药(中枢兴奋药),但因两药剂引起的依赖症的病理机制认为是不同的,对乙醇或吗啡的依赖症有效的药剂并非就一定对可卡因依赖症也有效。为了弄清楚,有必要使用受体选择性高、且血脑屏障通过性优异的低分子nop受体激动剂来进行在临床预测性高的可卡因依赖症模型中的评价。
本发明的化合物a或其药学上可容许的盐对nop受体具有高的亲和性,且对mop受体的亲和性低,因此nop受体选择性高、且血脑屏障通过性优异,而且在不显示nop受体激动剂的中枢抑制作用的低用量下即具有高的效力。
实施例
以下举出实施例具体地说明本发明,但本发明并不受这些实施例所记载的范围的限定。此外,以下的实验按照psychopharmacology160:362-370,2002.所记载的方法来进行。
实施例1:猴子的可卡因自身给药中化合物a的作用及对中枢抑制作用的影响
(方法)
实验中使用了4只猕猴。将猴子分别放在不锈钢制的箱室(64×64×79cm)中,进行下述条件下的训练:当猴子触碰到设置在箱室前方壁上的操作面板(28×28cm)的反应键时,作为奖赏会获得1g的香蕉味食饵丸。在fr30(碰触到30次反应键,则可获得1次食饵的奖赏)的条件下,训练至猴子稳定地获得奖赏之后,进行在猴子的静脉内留置可卡因给药用的导管的手术。在猴子从手术恢复后,进行在碰触到操作面板的反应键时、作为奖赏被静脉内注入可卡因的条件下的训练,由此制作可卡因自身给药模型。
化合物a的评价按图1所示的实验方案进行。即,在开始的15分钟之前,肌肉内给药化合物a或作为对照的生理盐水,之后进行120分钟的时程。120分钟的时程如下构成:碰触到操作面板的反应键时作为奖赏静脉内注入可卡因的100分钟的药物成分(100mindrugcomponent);在其前后5分钟的即便是碰触到操作面板的反应键也无法获得任何奖赏的暂停成分(5min暂停(to));以及碰触到操作面板的反应键时可获得食饵奖赏的开始5分钟及结束5分钟的食饵成分(5minfoodcomponent(食饵1,食饵2))。食饵成分中反应键的红色led灯点亮,药物成分中反应键的绿色led灯点亮,暂停成分中反应键的黄色led灯点亮。另外,在食饵成分的期间中及药物成分的期间中分别设置获得奖赏后、未经过规定时间则无法获得下一个奖赏的条件,即暂停。暂停在食饵成分设为10秒钟、在药物成分设为60秒钟,暂停过程中反应键的黄色led灯点亮。食饵成分及药物成分均在fr30的条件下进行试验。
(结果)
其结果是,如图2的中央图所示,化合物a在0.1、0.32及0.56mg/kg的用量下,用量依赖性地减少了可卡因的自身给药的奖赏数。另外,在0.56mg/kg的用量下,食饵成分1(食饵1)的食饵获取数也减少了,因此教示了0.56mg/kg是显示中枢抑制作用的用量,但也明确了,化合物a即便是不影响食饵成分1(食饵1)的食饵获取数的用量(0.1及0.32mg/kg)下也抑制可卡因自身给药。即显示了,化合物a即便是不显示中枢抑制作用的低用量,作为可卡因依赖症治疗药也是有效的。进而,化合物a的0.56mg/kg的食饵成分1(食饵1)中的食饵获取数的减少在食饵成分2(食饵2)中并未观察到,因此教示了化合物a的中枢抑制作用是一过性的。
实施例2:猴子的可卡因自身给药中的每种可卡因用量下的化合物a的作用
(方法)
利用与实施例1相同的方法,在使用可卡因各种用量(0.001~0.1mg/kg/注入)的条件下探讨了化合物a对可卡因自身给药的作用。化合物a的用量使用的是在实施例1中不影响食饵成分1(食饵1)的食饵获取数的用量的0.1mg/kg(1例)或0.32mg/kg(3例)中的任一个。
(结果)
其结果是,如图3所示,由4例的平均数据显示了,在可卡因的0.003、0.01、0.03及0.1mg/kg/注入的用量下,通过化合物a的给药,可卡因自身给药的奖赏次数显著减少。
另外,由于可卡因依赖症患者自己可以发现能获得充分强化效应的可卡因的用量,因此使可卡因的用量反应曲线(图3的○标记的曲线图)向右偏移的药剂并不意味着是治疗药。即,这种药剂仅抑制低用量的可卡因产生的强化效应,但对高用量的可卡因的强化效应并不产生抑制,因此作为治疗药并不充分。另一方面,化合物a如图3的■标记的曲线图所示,对于低用量至高用量的任一种用量的可卡因的效应均显示了显著的抑制作用,因此示出了具有可成为优异的可卡因依赖症治疗药的药理活性。
实施例3:化合物a对大鼠的应激诱发可卡因觅药行为的作用
(方法)
实验中使用了1组12例的雄性long-evanshooded大鼠。预先进行大鼠的颈外静脉内可卡因给药用导管的留置手术后,隔5天以上的恢复期间后开始可卡因自身给药的训练。训练中使用在壁面上设有2个杠杆、在地板上设有足底电击用栅极的箱室。将大鼠每日1次(2小时/时程)放入箱室,在大鼠按压1次(fr1)主动杠杆(右杠杆)时则将可卡因溶液(0.2ml/6秒、可卡因0.5mg/kg)注入到静脉内的条件下,获得自身给药。如图4所示,在训练期间(trainingphase)内观察到稳定的按压杠杆次数之后,设置即便按压主动杠杆也无法获得可卡因奖赏的期间(extinctionphase,消退期间),使按压杠杆行为消除。对消除了按压杠杆行为的大鼠负荷15分钟的足底电击(0.63ma、0.5秒、40秒间隔),之后记录2小时/时程的按压杠杆次数(reinstatementtest,恢复测试)。化合物a或作为对照的溶剂是在恢复测试的时程开始的30分钟之前经口给药。
(结果)
其结果是,如图5所示,通过化合物a的3mg/kg的给药,显著性地抑制了因足底电击应激所诱发的可卡因觅药行为。由该结果显示了,化合物a会抑制因应激导致的可卡因摄取欲求,即具有预防因应激导致的可卡因依赖复发的效果。
由以上的结果可知,化合物a不仅成为对可卡因依赖症有效的治疗药,还可成为预防可卡因依赖症的因应激导致的复发的防复发药。
产业上的可利用性
本发明的药品可作为可卡因依赖症的治疗药或防复发药进行使用。
- 还没有人留言评论。精彩留言会获得点赞!