拉索昔芬调节膜结合雌激素信号的应用及治疗癌症的方法与流程
本发明涉及使用拉索昔芬或拉索昔芬与蛋白激酶抑制剂的组合物或其功能等效物(如吉菲特尼或/曲妥单抗),治疗雌激素受体α-36(ER-α36)表达阳性的癌症的方法。
背景技术:
绝经后妇女雌激素分泌减少导致骨质疏松和脂肪肝等症状。雌激素替代疗法已用于治疗这些症状,并增加诱发乳腺癌和子宫内膜癌的风险。三苯氧胺作为雌激素受体(ER)的拮抗剂,用于治疗ER+乳腺癌患者,它也会诱导产生先天性或获得性的三苯氧胺抗药性,从而导致了雌激素经典的核途径,膜结合雌激素受体及其信号转导途径的发现。
在此之前,流行病学数据表明,排除吸烟影响后,女性患非小细胞肺癌(NSCLC)的发病率比男性高,肺癌死亡率比接受抗雌激素治疗的乳腺癌患者低。同样,对胃癌发病率的流行病学研究表明,男性的胃癌发病率高于绝经前的女性,然而,绝经后,女性和男性之间的发病率没有显著差异。前列腺癌患者罹患胃癌的风险更高,而当这些患者接受抗雌激素药物治疗时,胃癌的风险降低。在患有ER+型乳腺癌的患者中,如果这些患者接受三苯氧胺治疗,其随后发生胃癌的风险显著增加。此外,卵巢切除术(OVX)也显著增加女性患胃癌的风险。总之,雌激素可能在非小细胞肺癌和胃癌的发生发展中起着重要作用。
编码雌激素受体的三个基因已被鉴定出来:G蛋白偶联雌激素受体1(GPER1或GPR30)、雌激素受体α(ER-α)和雌激素受体β(ER-β),ER-α和ER-β具有相似的蛋白结构和功能域,包括活化功能域1(AF-1)、DNA结合域(DBD)、二聚结构域和活化功能域2(AF-2),以及配体结合域(LBD)。ERα和ERβ均属于配体依赖性转录因子的细胞核家族蛋白,具有高度保守的DBD和LBD区域,可调节雌激素核经典途径。胰岛素(IL)与胰岛素受体(IR)结合,刺激胰岛素受体底物(IRS)的磷酸化;磷酸化的IRS与二聚体雌激素ER复合物相互作用,两个雌激素-ER复合物构成二聚体,随后转移到细胞核,并与雌激素反应元件(ERE)序列结合,通过雌激素经典核调节途径调控RNA转录。Bcl-2是抗凋亡家族蛋白的关键成员,其过度表达与人类多种癌症有关。Bcl-2基因的启动子含有一个ERE序列,E2(17β雌二醇,一种雌激素)上调Bcl-2在MCF-7细胞中的表达,三苯氧胺抑制Bcl-2在MCF-7细胞中的表达;IL调节MCF-7细胞的增殖,也影响这些细胞对三苯氧胺的敏感程度,当将IL从培养基中暂时性移除,或使用IRS特异性siRNA暂时抑制IRS的表达时,会提高三苯氧胺抑制MCF-7细胞的增殖敏感程度。
ER0和ERβ也通过其LBD中半胱氨酸的棕榈酰化作用与细胞膜结合,参入调控雌激素膜信号途径(MIES),调节细胞增殖、基质/迁移、代谢和葡萄糖稳态。通过对ER敲除小鼠的研究表明,与ERβ相比,ERα是主要的功能性雌激素受体。临床上用ER-α抗体诊断ER阳性肿瘤。已发现三种ERα66、46和36的转录变体。ERα36含有一个部分配体结合域和棕榈酰化基序(445-453),并具有一个独特的C端27氨基酸序列,取代了ERα66中的140氨基酸(456-595)。利用ER-α36特异性抗体发现ERα36主要位于质膜上。由于ER-α36缺乏AF-1和AF-2结构域,并且仍然具有与膜结合的能力,而且发现它在三苯氧胺抵抗的乳腺癌细胞和子宫内膜上皮癌细胞中唯一表达,因此认为膜结合的ERα36调控MIES是导致三苯氧胺耐药性的主要原因。以往基因表达研究表明,ERα36的表达可能是影响胃癌患者肿瘤发生的因素之一。此外,由于以前已知的ER-α抗体不能有效识别ER-α36,研究人员开发了一种ER-α36特异性抗体。参见例如Wang Z.Y.等人,PNAS。美国2006,103(24):9063-8。使用ER-α36特异性抗体,研究者发现,ER-α36在三阴性乳腺癌和获得性或先天性的抗三苯氧胺ER阳性乳腺癌中过度表达。参见Shi,et al.,J.Clin.Oncol。2009年,27(31),3423-9。
GPER1主要存在于内质网。与同样在内质网中合成的E2结合,形成E2-GPER1复合物,释放敏感型G蛋白α亚单位(GαS),GαS激活磷酸酯酶C(PLC)产生肌醇三磷酸(IP3),IP3与肌醇1,4,5-三磷酸受体(InsP3R)结合,释放内质网中的Ca2+,增强细胞生物能量学和细胞凋亡抵抗。据报道,GPER1基因敲除小鼠表现出糖耐量受损、骨骼生长减少、血压升高和消除雌二醇刺激的胰岛素释放到心血管,对生育无明显影响。因此,GPER1参与调节雌激素介导的代谢信号。
为预防绝经后妇女骨质疏松症,研制了雷洛昔芬、拉索昔芬、巴多昔芬或功能等效选择性雌激素受体调节剂(SERM)。随机对照试验的meta分析结果表明,与芳香化酶抑制剂和三苯氧胺相比,这些SERM具有更好的获益风险比(Mocellin等人,J.Natl,2016,108(2):DJV318)。
仍然需要安全有效的癌症治疗方法,特别是三苯氧胺抗药性的癌症。
发明概要
本发明提供一种治疗ER明提供阳性癌症的个体癌症治疗方法,包括拉索昔芬(或其药学上可接受的盐)有效个体给药量。
该方法用于治疗任何ER-α36表达阳性肿瘤,如任何ER-α36表达阳性的实体瘤,包括但不限于乳腺癌、子宫内膜癌、肺癌、胃癌、结肠癌、胰腺癌、甲状腺癌和肝癌;或任何ER-α36表达阳性的液体瘤,如慢性淋巴细胞白血病(CLL)。
在一些实施例中,癌症是乳腺癌。在另一些实施例中,癌症是一种对三苯氧胺耐药的乳腺癌,其中,对三苯氧胺的耐药可为先天性或获得性。在一些实施例中,ER-α36阳性乳腺癌是三阴性乳腺癌。
在某些实例中,癌症是肺癌。(比如非小细胞肺癌)在某些情况下,癌症是一种子宫内膜癌。在某些情况下,癌症是胃癌。某些情况下,癌症是一种结肠癌。还某些情况下,癌症是一种胰腺癌。有些情况下,癌症是一种肝癌。有些情况下,癌症是甲状腺癌。而某些情况下,是慢性淋巴细胞白血病。
在一些实施例中,ER-α36阳性癌也是EGFR阳性癌,例如,EGFR阳性乳腺癌或EGFR阳性肺癌。如果ER-α36阳性癌也呈EGFR阳性,则该方法可进一步包括向个体施用EGFR激酶抑制剂。在一些实施例中,同时施用拉索昔芬或其药学上可接受的盐和EGFR激酶抑制剂。在一些实施例中,按顺序施用拉索昔芬或其药学上可接受的盐和EGFR磷酸化激酶抑制剂。任何EGFR磷酸化激酶抑制剂可与拉索昔芬或其药学上可接受的盐共同施用,例如,包括但不限于,吉非替尼、厄洛替尼、伊克替尼、阿法替尼、奈拉汀尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐。
在一些实施例中,ER-α36阳性癌也是HER2阳性癌,例如,HER2阳性乳腺癌或HER2阳性胃癌。如果ER-α36阳性癌症也是HER2阳性,则该方法可进一步包括向个体施用HER2抑制剂。在一些实施例中,同时施用拉索昔芬或其药学上可接受的盐和HER2抑制剂。在一些实施例中,依次施用拉索昔芬或其药学上可接受的盐和HER2抑制剂。任何HER2抑制剂可与拉索昔芬或其药学上可接受的盐(例如,包括但不限于曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1))共同施用。在一些实施例中,HER2抑制剂是一种抗HER2抗体。
还提供一种治疗个体ER-α36阳性癌症的方法,其包括向该个体施用:a)有效量的拉索昔芬或其药学上可接受的盐:b)任选有效量的至少一种其他药物,所述药物选自表面生长因子受体的磷酸化激酶抑制剂组成的组,例如EGFR磷酸化抑制剂(例如吉非替尼)或其功能等效物,以及表面生长因子受体的抑制剂,例如曲妥珠单抗(例如,)或其功能等效物。
在一些实施例中,癌症选自乳腺癌、子宫内膜癌、肺癌、胰腺癌、胃癌、结肠癌、肝癌、甲状腺癌和CLL等,其癌细胞的ER-实施例表达是阳性。在一些实施例中,ER-α36阳性乳腺癌对三苯氧胺治疗具有抗药性。在一些实施例中,ER-α36阳性子宫内膜癌对三苯氧胺治疗具有抗药性。
在治疗ER-α36阳性癌症的方法方面,包括可进一步通过检测ER-步通过蛋白的量(和/或)ER-α36mRNA的量,来测定肿瘤的ER-α36表达。在一些实施例中,ER-α36在肿瘤中的表达由ER-α36蛋白的表达量决定,例如,通过免疫杂交方法(例如,Western blotting、免疫组织学或荧光染色)测量ER-α36蛋白在肿瘤中的阳性表达。在一些实施例中,ER-α36在癌症中的表达由ER-α36mRNA的表达量决定,例如,通过定量聚合酶链反应(q-PCR)测量ER-例如,通过定量聚的量来确定肿瘤中ER-α36的阳性表达。
在一些实例中,这种个体是人类。
本发明进一步提供了一种药物组合物,其包含有效量的拉索昔芬或其药学上可接受的盐,以及至少一种从EGFR激酶抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、奈拉汀尼、达克米替尼、奥西莫替尼、罗基替尼或奥莫替尼,或其医药上可接受的盐)组中选择的药物或其功能等效物,以及HER2抑制剂(例如,曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。
药物组合物可以单位剂量配方存在,例如口服单位剂量配方,例如胶囊、片剂、药丸、胶囊、凝胶、液体(例如悬浮液、溶液、乳剂)、粉末或其他微粒等。在一些实施例中,拉索昔芬的剂量约为0.25–50mg/天。
在另一方面,本发明提供了一种试剂盒,其包含(i)一种包含拉索昔芬或其药学上可接受的盐的组合物;和(i i)一种用于测定ER-α36蛋白或ER-α36mRNA表达量的试剂。在一些实施例中,试剂盒包含用于确定ER-α36蛋白表达量的试剂,例如识别ER-α36多肽的抗体。在一些实施例中,试剂盒包含用于确定ER-α36mRNA表达量的试剂,例如,用于定量测量ER-α36mRNA的寡核苷酸。
还提供了治疗ER-α36阳性癌症(例如本文详述的ER-α36阳性癌症)的方法中的拉索昔芬或其药学上可接受的盐。在一些实施例中,所提供的是拉索昔芬或其药学上可接受的盐与从三苯氧胺或其功能等效物组成的组中选择的另一种药剂、EGFR激酶抑制剂(例如吉非替尼)或其功能等效物组成的组中选择的另一种药剂,以及HER2抑制剂(例如曲妥珠单抗)或其功能等效物组成的组中选择的另一种药剂,用于治疗ER-α36阳性癌症,其中所述癌症还表达其它生物标记物,例如EGFR激酶或HER2。
还提供了一种在制造治疗ER-α36阳性癌症(例如ER-症(例阳性癌症)的药物中拉索昔芬或其医药上可接受的盐的使用。在一些实施例中,在制造用于治疗ER-α36阳性癌症的药物时,所提供的是将拉索昔芬或其药学上可接受的盐与从三苯氧胺或其功能等效物、EGFR激酶抑制剂(例如吉非替尼)或其功能等效物中选择的另一种药物的组合,以及HER2抑制剂(例如曲妥珠单抗)或其功能等效物中选择的另一种药物的组合,其中所述癌症还表达生物标记物,例如EGFR激酶或HER2。
从详细说明和所附的权利要求书中可以看出本发明的这些方面和其他方面以及优点。应了解,本文所述各种实施例的一个、部分或全部性质可以组合成本发明的其他实施例。
附图说明
FBS:胎牛血清;Actin:肌动蛋白,Blank/Vechile:空白/溶剂对照
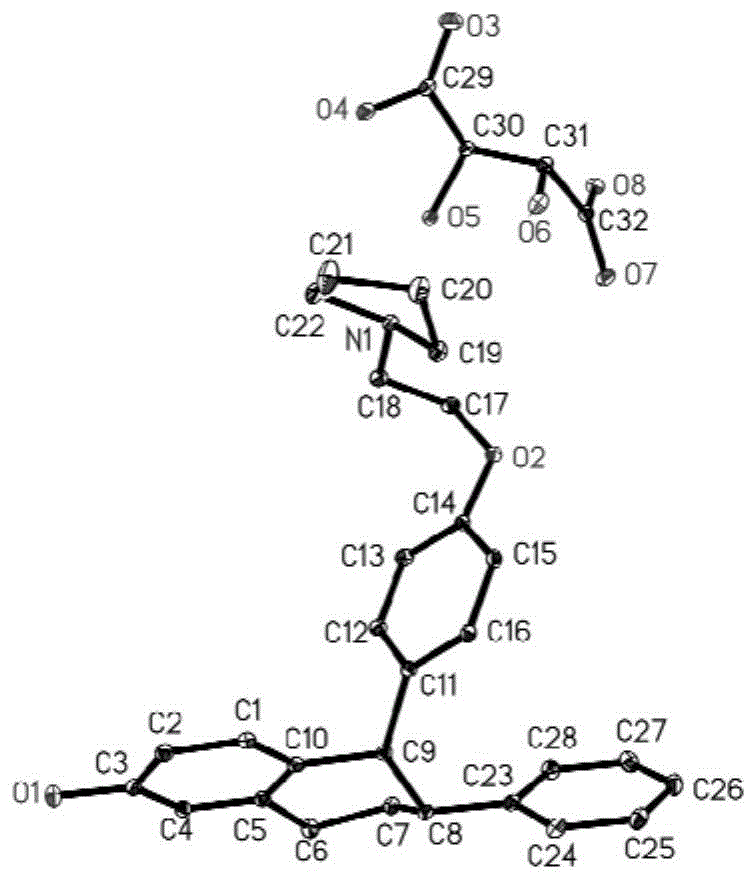
图1:拉索昔芬与(2s,3s)-2,3-二羟基丁二酸酯(D-酒石酸盐)共晶结构。
图2:比较三苯氧胺(TAM)和拉索昔芬(Laso或LAS)对MCF-7细胞中雌激素诱导Bcl-2表达的抑制作用。A:MCF-7细胞在含有10%FBS(正常FBS)或5%活性炭处理的FBS(CS FBS)的EMEM培养基中培养72小时。采用免疫印迹法分析Bcl-2的表达。B:MCF-7细胞在含胰岛素和EMEM培养基中含5%活性炭处理的FBS,培养72小时,然后用拉索昔芬和三苯氧胺处理48小时。采用免疫印迹法分析Bcl-2的表达。C.将MCF-7在含胰岛素和10%FBS的EMEM培养基中培养72小时,然后用拉索昔芬和三苯氧胺处理48小时。采用免疫印迹法分析Bcl-2的表达。D.拉索昔芬以剂量依赖的方式抑制Bcl-2的表达(与C部分相同的条件)E.C部分三次重复的统计分析,n=3x3。
图3:比较三苯氧胺和拉索昔芬对ER-芬7】阳性MCF-7癌细胞增殖的抑制作用。A.MCF-7细胞在ATCC细胞培养说明书介绍的正常培养基和无胰岛素(IL-)培养基中培养3个月。用Western blot检测ER-α66、ER-α36、ER-β和GPER的表达。B.MCF-7细胞在正常和无胰岛素培养基中培养后,加入三苯氧胺或拉索昔芬。图中显示了两种情况下用任一种药物抑制MCF-7细胞增殖的IC50(μm)。C.比较在无胰岛素的培养基中,三苯氧胺或拉索昔芬抑制MCF-7细胞增殖的IC50(μm)。***表示p<0.001。D.图中比较了在含胰岛素培养条件下,三苯氧胺或拉索昔芬抑制MCF-7细胞增殖的IC50(μm)。*表示P<0.05。
图4:拉索昔芬抑制获得性三苯氧胺耐药MCF-7细胞增殖。A.三苯氧胺处理MCF-7细胞10个月。用Western blot检测ER-α66、ER-α46、ER-α36、GPER-1的表达。B.三苯氧胺处理MCF-7细胞10个月后,用2μM三苯氧胺或2μM拉索昔芬处理细胞。显示每种药物抑制MCF-7细胞增殖的IC50(μm)。**表示p<0.01。
图5:拉索昔芬和吉非替尼联合抑制ER-α36阳性/EGFR阳性肺癌细胞的增殖。A.培养HBE、H1299、A549和H460细胞株。用Western blot检测EGFR,ER-RFR,ER-R R,ER-R R,ER-R,GPER1的表达。B.用2μm三苯氧胺或2μm拉索昔芬处理HBE细胞和H460细胞。处理48小时后,HBE细胞和H460活细胞增殖%。C.H460细胞用DMSO或吉非替尼或拉索昔芬或吉非替尼和拉索昔芬的联合处理48小时后,计量活细胞增殖%。D.H1299仅用DMSO,或吉非替尼,或拉索昔芬,或吉非替尼和拉索昔芬联合处理48小时后,计量活细胞增殖%。n=3x3;**表示p<0.01;ns:无显著差异;las:拉索昔芬;gef:吉非替尼。
图6:用拉索昔芬和吉非替尼联合抑制ras突变体的A549肺癌细胞增殖%。n=3x3;*表示p<0.05;ns:无显著差异。
图7:用拉索昔芬(Las)和/或吉非替尼(Gef)抑制裸鼠种植ER-鼠种植吉非EGFR+肺肿瘤(H460)的生长。A.裸鼠种植H460细胞后肿瘤大小,按照每千克小鼠体重计算给药量,分别服用油脂空白剂,30mg吉非替尼,3mg拉索昔芬(3mg/kg,las3),1.5mg拉索昔芬(1.5mg/kg,las1.5),0.75mg拉索昔芬(0.75mg/kg,las0.75),或每千克小鼠服用30mg吉非替尼和1.5mg拉索昔芬的组合(gef30+las1.5)。B.两次重复实验(n≥6)肿瘤大小的统计结果。*和**分别代表P<0.05和P<0.01。
图8:拉索昔芬抑制ER-芬抑制阳性结肠癌细胞和胃癌细胞的增殖。A.ER-芬抑制在结肠癌细胞中阳性表达。B.拉索昔芬抑制结肠癌细胞增殖。NCC:正常的结肠细胞.;CCC:结肠癌细胞。C:ER-肠癌细在胃癌细胞中阳性表达。D:拉索昔芬抑制胃癌细胞增殖。NGC:正常的胃细胞GCC.胃癌细胞。n=3x3;***表示p<0.001。
图9:拉索昔芬抑制ER-芬抑制阳性/三阴性MDA-MB231乳腺癌细胞增殖。MDA-MB231细胞在含10%胎牛血清(FBS)的DMEM培养基中用拉索昔芬处理。n=3x3;*和**分别表示p<0.05和p<0.01。
图10:抑制抗胰蛋白酶BT474乳腺癌细胞的增殖。BT474乳腺癌细胞在培养基中用10μg/ml处理3个月。A.细胞ER-α36阳性表达,HER2表达水平降低。B.抗的BT474对2μm拉索昔芬敏感。与单独使用拉索昔芬和赫赛汀相比,联合使用拉索昔芬和赫赛汀可更有效地抑制抗BT474细胞的增殖。*和**分别代表p<0.01和p<0.001。
图11:拉索昔芬是GPER1激动剂,可以预防骨质疏松症。A.HEK293细胞单独用GPER1-EGFP或EGFP转染。用Western blot检测GPER1-EGFP和EGFP的表达。B.仅用GPER1-EGFP或EGFP转染的HEK293细胞,用E2、拉索昔芬(las)、raloxifene(ral)或G15(GPER1拮抗剂)刺激细胞,用Fura-red做药物诱导的Ca2+浓度指示剂([Ca2+]i),检测细胞浆质中的[Ca2+]i。***表示p<0.001。
发明的详细说明
本发明提供了包括单独使用或与第二种药物联合使用的单一和/或组合物治疗方法,其通过抑制ER-α36诱导的细胞增殖信号通路来治疗癌症,并通过激活GPER1减少骨质疏松症。
定义
本文所述方法通常可用于治疗疾病。如本文所用,“治疗”是获得有益或期望的临床结果的方法。例如,对于癌症的治疗,有益或期望的临床结果包括但不限于:减轻一个或多个症状、降低癌症程度、预防或延迟癌症在体内的扩散(例如转移,例如转移到肺或淋巴结)、预防或延迟复发,癌症发生、癌症进展的延迟或减缓、癌症状态的改善和缓解(部分或全部)。“治疗”也包括减少增生性癌症的病理后果。本发明的方法考虑“治疗”的任何一个或多个方面。
本文所用的患有“三阴性乳腺癌”的个体是指临床上对雌激素受体(ER)、孕激素受体(PR)和HER2蛋白表达呈阴性的个体。
“0ER”指膜结合雌激素受体。ER通过雌激素结合域(LBD)锚定在质膜上。ER-α36是ER-α变体。它仍然含棕榈酰化基序(445-453),在C端具有独特的27个氨基酸,而不是140个氨基酸区(456-595)。由于ER-α36具有部分的LBD,主要集中在质膜和胞质溶胶上,因此它不与雌激素结合,从而失去雌激素经典途径的调节能力。
本文所用的“mER阳性”、“EGFR阳性”、“HER2阳性”分别指临床上对膜结合雌激素受体、表皮生长因子受体(EGFR)或人表皮生长因子受体2(HER2)阳性的个体。本文所用的“ER-α36阳性”是指临床上对ER-α36变体呈阳性的个体。
当个体活检标本中肿瘤细胞中的生物标志物水平高于实验确定的个体活检标本中正常组织细胞中的生物标志物水平时,个体被认为是生物标志物的“临床阳性”。实验性检测技术例子包括qPCR、免疫组化(IHC)或免疫荧光(IF)染色和western blotting(WB,免疫印迹)。例如,在ER-α36阳性个体中,个体活检标本中肿瘤细胞中的ER-α36变异体的水平高于实验测定的个体活检标本中正常组织细胞中的ER-α36变异体的水平,例如,使用在Shi,et al.,J.Clin.Oncol.2009,27(31),3423-9中描述的方法。在一些实施例中,通过IHC、IF或WB方法测量,ER-α36阳性个体在活检标本中肿瘤细胞中的ER-α36蛋白表达水平,至少比活检标本中的正常组织细胞高25%。在一些实施例中,通过qPCR测量,ER-α36阳性个体在活检标本中的肿瘤细胞中的ER-α36mRNA水平,至少比活检标本中的正常组织细胞高50%。通过IHC、IF或WB方法测量,低水平的ER-α36阳性个体在活检标本中的肿瘤细胞中的ER-α36水平比活检标本中的正常组织细胞高约25%到100%;或者由qPCR测量,在活检标本中的肿瘤细胞中的ER-α36mRNA水平比活检标本中的正常组织细胞高约50%到100%。根据qPCR、IHC、IF或WB方法测量,高水平ER-α36阳性个体的活检标本中肿瘤细胞的ER-α36水平高于活检标本中正常组织细胞的100%或更多。
本文所用术语“有效量”系指足以治疗特定病症、病况或疾病(例如改善、缓和、减轻和/或延迟其一个或多个症状)的单一化合物或组合物的量。就癌症而言,有效量包含足以引起肿瘤收缩和/或降低肿瘤生长速率(例如抑制肿瘤生长)或防止或延迟其他不需要的细胞增殖的量。
术语“个体”是哺乳动物,包括人类。个人包括但不限于人、牛、马、猫、犬、啮齿动物或灵长类动物。在某些实施例中,个体是人类。
应该理解,本文所述的本发明的方面和实施方式包括“由其构成”和/或“基本上由其构成”的方面和实施方式。
本文中对值或参数指称的“约”,包括(并描述)了涉及该值或参数本身的变化形式。例如,指称“约X”的描述包括“X”的描述。
当在本文和权利要求书中使用时,除非另有指明,否则单数形式包括其复数指称物。应该理解,本文描述的本发明的方面和变化形式包括“由其构成”或“基本上由其构成”的方面和变化形式。
拉索昔芬
拉索昔芬,(-)-顺式(5R,6S)-6-苯基-5-[4-(2-吡咯烷-1-基乙氧基)苯基]-5,6,7,8-四氢邻苯二甲酸-2-醇,CAS 180916-16-9,具有以下化学结构:
采用酒石酸盐拆分法(与D-酒石酸盐共结晶)得到了单一手性对映体。用X射线证实拉索昔芬酒石酸盐共晶的晶体结构。拉索昔芬是一种选择性雌激素受体调节剂,与ER-α具有很高的亲和力。
在本文详细介绍了方法和组成的一些实施例中,使用了药学上可接受的拉索昔芬盐。“药学上可接受的盐”是指可用于向患者(例如哺乳动物)投与的盐(在给定剂量方案下可保证哺乳动物安全性的具有反离子的盐)。此类盐可衍生自医药上可接受的无机或有机碱以及医药上可接受的无机或有机酸。非限制性的、医药上可接受的正电离子包括钠、钾、钙、镁、铵、四烷基铵等;非限制性的、医药上可接受的负电性离子包括氯化物、溴化物、甲酸盐、酒石酸盐、苯磺酸盐、甲磺酸盐、乙酸盐、马来酸盐、草酸盐等。
原理方法
在不被已有理论约束的情况下,本发明的部分基础是发现选择性雌激素膜启动调节剂(如拉索昔芬和雷洛昔芬)的独特性质和作用机制。筛选后,我们惊奇地发现,拉索昔芬是一种抑制癌细胞分裂的ER-α36拮抗剂。另一方面,拉索昔芬和雷洛昔芬在调节骨代谢信号的GPER1通路上起着激动剂的作用。因此,拉索昔芬的有益作用包括:i)抑制由膜结合雌激素受体α(ER-R,如ER-R,如)调节的恶性肿瘤细胞生长;ii)作为GPER1激动剂,调节雌激素代谢作用,从而减少绝经后症状,如骨质疏松。
一方面,本发明提供一种治疗个体癌症的方法,包括向个体投入有效量的拉索昔芬或其药学上可接受的盐,其中所述的癌症是ER-α36阳性癌症。
该方法可用于治疗任何表达ER-α36阳性肿瘤(或ER-α36阳性癌症),例如任何表达ER-α36的实体瘤(或ER-α36阳性实体瘤),包括但不限于乳腺癌、子宫内膜癌、肺癌、胃癌、结肠癌、胰腺癌、甲状腺癌和肝癌;或任何表达ER-α36的液体瘤(或ER-α36阳性液体肿瘤),如慢性淋巴细胞白血病(CLL)。
在某些实施例中,癌症是乳腺癌。在一些实施例中,癌症是一种对三苯氧胺耐药的乳腺癌,其耐药效对三苯氧胺的耐药可以是先天性或获得性的。在一些实施例中,ER-α36阳性乳腺癌是三阴性乳腺癌。在一些实施例中,子宫内膜癌是三苯氧胺诱导的子宫内膜癌。
在某些实施例中,癌症是肺癌(例如,小细胞肺癌和非小细胞肺癌(NSCLC))。在一些实施例中,癌症是子宫内膜癌。在一些实施例中,癌症是胃癌。在一些实施例中,癌症是结肠癌。在一些实施例中,癌症是胰腺癌。在一些实施例中,癌症是肝癌。在一些实施例中,癌症是甲状腺癌。在一些实施例中,癌症是CLL。
在某些实施例中,ER-α36阳性癌也是EGFR阳性癌,例如,EGFR阳性乳腺癌或EGFR阳性肺癌。如果ER-α36阳性癌也呈EGFR阳性,则该方法可进一步包括向个体施用EGFR激酶抑制剂。在一些实施例中,同时施用拉索昔芬或其药学上可接受的盐和EGFR激酶抑制剂。在一些实施例中,按顺序施用拉索昔芬或其药学上可接受的盐和EGFR激酶抑制剂。任何EGFR激酶抑制剂(例如,包括但不限于吉非替尼、厄洛替尼、伊考替尼、阿法替尼、奈拉汀尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼)或其药学上可接受的盐)可与拉索昔芬或其药学上可接受的盐共同施用。
在某些实施例中,ER-α36阳性癌也是HER2阳性癌,例如,HER2阳性乳腺癌或HER2阳性胃癌。如果ER-α36阳性癌症也是HER2阳性,则该方法可进一步包括向个体施用HER2抑制剂。在一些实施例中,同时施用拉索昔芬或其药学上可接受的盐和HER2抑制剂。在一些实施例中,按顺序施用拉索昔芬或其药学上可接受的盐和HER2抑制剂。任何HER2抑制剂(例如,包括但不限于曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1))可与拉索昔芬或其药学上可接受的盐共同使用。在一些实施例中,HER2抑制剂是抗HER2抗体。
还提供一种治疗个体ER-α36阳性癌症的方法,其包括向该个体使用:a)有效量的拉索昔芬或其药学上可接受的盐;和b)有效量的至少一种其他药物,所述药剂选自表面生长因子受体的磷酸化激酶抑制剂组成的组,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊考替尼、阿法替尼、奈拉汀尼、达克罗替尼、奥西莫替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如曲妥珠单抗、珀图珠单抗、拉帕替尼或ADO-trasTuzumab emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,EGFR磷酸化抑制剂是吉非替尼或其药学上可接受的盐。在一些实施例中,HER2抑制剂是曲妥珠单抗(例如,)。
在某些实施例中,治疗癌症(例如,ER-α36阳性和EGFR阳性癌症)的方法包括向需要治疗个体使用有效量的拉索昔芬或其药学上可接受的盐和有效量的EGFR激酶抑制剂(例如,吉非替尼、厄洛替尼、伊克替尼、阿法替尼、尼拉替尼、达克罗替尼、奥西莫替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物。在一些实施例中,治疗癌症(例如,ER-α36阳性和EGFR阳性癌症)的方法包括向需要治疗个体使用有效量的拉索昔芬或其药学上可接受的盐和有效量的吉非替尼或其药学上可接受的盐。
在某些实施例中,治疗癌症(例如,ER-α36阳性和HER2阳性癌症)的方法包括向需要治疗个体使用有效量的拉索昔芬或其药学上可接受的盐和有效量的HER2抑制剂(例如,曲妥珠单抗、帕托珠单抗、拉帕替尼或ADO-曲妥珠单抗、依马坦苷(T-DM1)或其医药上可接受之盐)或其功能等效物。在一些实施例中,治疗癌症(例如,ER-α36阳性和HER2阳性癌症)的方法包括向需要治疗个体使用有效量的拉索昔芬或其药学上可接受的盐和有效量的曲妥珠单抗(例如,)。
在某些实施例中,依次施用拉索昔芬或其医药上可接受的盐和其他药剂(例如EGFR激酶抑制剂或功能等效物或HER2抑制剂或其功能等效物)。在一些实施例中,同时施用拉索昔芬或其药学上可接受的盐和其他药剂(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)。
在某些实施例中,同时给药拉索昔芬或其药学上可接受的盐和其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)。例如,在某些实施例中,约同时(例如,在1天、2天、3天、4天、5天、6天或7天中的任何一天内)开始使用拉索昔芬或其药学上可接受的盐和其他药剂。在一些实施例中,约同时(例如,在1天、2天、3天、4天、5天、6天或7天的任何一天内)终止施予拉索昔芬或其药学上可接受的盐和其他药剂。在某些实施例中,在终止使用拉索昔芬或其药学上可接受的盐后,在(例如,约0.5、1、2、3、4、5、6、7、8、9、10、11或12个月中的任何一个月后)继续给予其他药剂。在某些实施例中,开始使用拉索昔芬或其药学上可接受的盐之后,在(例如在0.5、1、2、3、4、5、6、7、8、9、10、11或12个月中的任何一个月后)开始使用另一种药剂。在一些实施例中,约同时开始和终止使用拉索昔芬或其药学上可接受的盐和其他药物。
在一些实施例中,大约同时开始施用拉索昔芬或其药学上可接受的盐和其他药物(例如,EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物),并且在拉索昔芬或其医药上可接受的盐的施用终止后,在(例如,在约0.5、1、2、3、4、5、6、7、8、9、10、11或12个月中的任何一个月后),继续施用其他药物。在一些实施例中,拉索昔芬或其药学上可接受的盐和另一种药剂的施用大约同时停止,并且另一种药物在开始施用拉索昔芬或其药学上可接受的盐(例如,在0.5、1、2、3、4、5、6、7、8、9、10、11或12个月中的任何一个月后)开始施用。在一些实施例中,约同时停止施用拉索昔芬或其药学上可接受的盐和另一种药物,并且在开始施用拉索昔芬或其医药上可接受的盐(例如在0.5、1、2、3、4、5、6、7、8、9、10、11或12个月中的任何一个月后),开始施用另一种药物。
本文所述的其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)可以是药物本身、其药学上可接受的盐和其药学上可接受的酯,以及立体异构体、对映体、外消旋混合物,诸如此类。所述的投与的其他药物可以包含一种或多种其他药剂以及含有所述药物的药物组合物,其中所述药物组合物包含药学上可接受的载体等。
本文所述的方法需要以施用有效量拉索昔芬或其药学上可接受的盐和其他药物(如存在)。在一些实施例中,有效量是足以延迟癌症发展的量。在一些实施例中,有效量是足以防止或延迟复发的量。有效量可以在一次或多次中投与。在一些实施例中,所述药物或组合物的有效量可以:(i)减少癌细胞的数量;(ii)减小肿瘤大小;(iii)抑制、延缓、使其被延缓到某种程度并且优选地阻止癌细胞渗入周围器官;(iv)抑制(即在某种程度上延缓并且优选地阻止)肿瘤转移;(v)抑制肿瘤生长;(vi)预防或延迟肿瘤复;发和/或(vii)在某种程度上缓解与癌症相关的一种或多种症状。
因此,在某些实施例中,提供了抑制个体细胞增殖(例如肿瘤生长)的方法,其包括向个体施用:a)有效量的拉索昔芬或其药学上可接受的盐,以及b)从上皮生长因子受体的磷酸化激酶抑制剂组中选择至少一种其他药剂的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,有效量的拉索昔芬或其药学上可接受的盐和其他药物协同抑制细胞增殖(例如肿瘤细胞生长)。在一些实施例中,至少抑制约10%(包括例如至少约20%、30%、40%、60%、70%、80%、90%或100%)的细胞增殖。在一些实施例中,个体(例如人类)是ER-α36阳性。
在某些实施例中,提供了一种在个体中抑制肿瘤转移(例如乳腺癌转移、肺转移或转移到淋巴结)的方法,包括向个体施用:a)有效量的拉索昔芬,和b)从上皮生长因子受体的磷酸化激酶抑制剂组中选择至少一种其他药物的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,有效量的拉索昔芬和其他药剂协同抑制肿瘤转移。在一些实施例中,至少约10%(包括例如至少约20%、30%、40%、60%、70%、80%、90%或100%)的转移受到抑制。在一些实施例中,提供了抑制淋巴结转移的方法。在一些实施例中,提供了抑制肺转移的方法。在一些实施例中,个体(例如人类)是ER-α36阳性。
在某些实施例中,提供了一种降低个体中先前存在的肿瘤转移(例如肺转移或转移到淋巴结)的发生率或负担的方法,其包括向个体施用:a)有效量的拉索昔芬,和b)从上皮生长因子受体的磷酸化激酶抑制剂组成中选择至少一种其他药物的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,个体(例如人类)是ER-α36阳性。
在一些实施例中,提供了一种个体中减小肿瘤大小的方法,其包括向个体施用:a)有效量的拉索昔芬,和b)从上皮生长因子受体的磷酸化激酶抑制剂组成中选择至少一种其他药物的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物,以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,肿瘤大小减小至少约10%(包括例如至少约20%、30%、40%、60%、70%、80%、90%或100%)。在一些实施例中,个体(例如人类)是ER-α36阳性。
在某些实施例中,提供了延长个体癌症疾病发展时间的方法,其包括向个体施用:a)有效量的拉索昔芬,和b)从上皮生长因子受体的磷酸化激酶抑制剂组成中选择至少一种其他药物的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,所述方法将疾病进展时间至少延长1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周或12周。在一些实施例中,个体(例如人类)是ER-α36阳性。
在某些实施例中,提供了一种延长患有增殖性疾病(例如ER-α36阳性癌症)的个体存活时间的方法,其包括向该个体施用:a)有效量的拉索昔芬,和b)从上皮生长因子受体的磷酸化激酶抑制剂组成中选择至少一种其他药物的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,所述方法将个体的生存期延长至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月或24个月。
在某些实施例中,所述方法用于治疗原发性肿瘤(例如,ER-α36阳性肿瘤)。在一些实施例中,提供治疗转移癌(即从原发肿瘤转移的癌)(例如,ER-α36阳性转移癌)的方法。在一些实施例中,所述方法用于治疗晚期疾病或减缓疾病的程度,例如降低肿瘤发展程度。在一些实施例中,提供了在晚期治疗癌症(例如,ER-α36阳性癌症)的方法。在一些实施例中,所述方法用于治疗早期乳腺癌。所述方法可在佐剂环境中实施。该方法也可在新辅助剂环境中实施,即,该方法可在初级/最终治疗之前实施。在一些实施例中,该方法还包括在完成治疗后对个体进行手术。例如,在一些实施例中,当癌症是乳腺癌(例如,ER-α36阳性乳腺癌)时,保乳手术或乳房切除术可在新辅助化疗完成后约2周、3周、4周、5周、6周、7周、8周、9周、10周、11周或12周内进行。
在某些实施例中,个体先前已被治疗。在一些实施例中,个体以前未被治疗。在一些实施例中,治疗是一线治疗。在一些实施例中,乳腺癌(例如,ER-α36阳性乳腺癌)在缓解后已再次发生。
在某些实施例中,癌症是乳腺癌。例如,这些方法可用于治疗、稳定和/或延迟任何类型或阶段的乳腺癌,例如早期乳腺癌、非转移性乳腺癌、晚期乳腺癌、第四阶段乳腺癌、局部晚期乳腺癌、转移性乳腺癌、缓解期乳腺癌、辅助性乳腺癌,或新辅助治疗环境中的乳腺癌。在一些实施例中,该方法可用于术前系统治疗(PST)。在一些实施例中,乳腺癌是ER-α36阳性乳腺癌。
在某些实施例中,提供治疗乳腺癌(可以是HER2阳性或HER2阴性)的方法,包括例如晚期乳腺癌、第四阶段乳腺癌、局部晚期乳腺癌和转移性乳腺癌。在一些实施例中,乳腺癌是腔型B型乳腺癌。在一些实施例中,乳腺癌是基底细胞乳腺癌。在一些实施例中,个体被诊断为t2、t3或t4损伤,或N,M0or T1c,N1-3和M0阶段。在一些实施例中,个体的ECOG性能状态为0-1。在一些实施例中,个体具有向同侧乳房的皮肤转移的症状。在一些实施例中,个体已接受先前的治疗(例如激素治疗)。在一些实施例中,个体没有接受先前的治疗(例如激素治疗)。在一些实施例中,个体正在等待确定的手术。在一些实施例中,乳腺癌是已经切除的乳腺癌。在一些实施例中,乳腺癌是未经切除的乳腺癌,例如未切除的II或III期乳腺癌。在一些实施例中,乳腺癌是ER-α36阳性乳腺癌。
在某些实施例中,所述方法用于治疗具有一个或多个这些危险因素的个体,所述个体比不具有这些危险因素的个体更容易患乳腺癌。这些危险因素包括但不限于年龄、性别、种族、饮食、既往疾病史、前体疾病的存在、遗传(即遗传)因素和环境暴露。在一些实施例中,个体可以是在遗传上或以其他方式易患乳腺癌的人,其已经或尚未被诊断为乳腺癌。有患乳腺癌风险的个体包括,例如,那些有经历过这种疾病的亲属的人,以及那些通过基因或生化标记分析已确定有风险的人。例如,个体可能是具有与乳腺癌相关的基因、基因突变或多拷贝(例如,BRCA1、BRCA2、ATM、CHEK2、RAD51、AR、DIRAS3、ERBB2和/或TP53)的人类,或者具有与乳腺癌相关的一个或多个基因拷贝(例如,一个或多个HER2基因拷贝)的人。在某些实施例中,乳腺癌是HER2阴性。在一些实施例中,乳腺癌是ER阴性。在一些实施例中,乳腺癌为PR阴性。在一些实施例中,乳腺癌是ER阴性和HER2阴性。在一些实施例中,乳腺癌为PR阴性和HER2阴性。在一些实施例中,乳腺癌是ER阴性和PR阴性。在一些实施例中,乳腺癌是ER阴性、PR阴性和HER2阴性。
本文所述方法也可用于治疗其他实体瘤(例如晚期实体瘤)。在一些实施例中,提供治疗肺癌的方法,包括例如,非小细胞肺癌(NSCLC,例如,晚期NSCLC)、小细胞肺癌(SCLC,例如,晚期SCLC)和晚期肺癌中的实体瘤恶性肿瘤。在一些实施例中,提供了治疗任何卵巢癌、子宫内膜癌、头颈部癌、胃癌、黑色素瘤(包括转移性黑色素瘤和恶性黑色素瘤)、卵巢癌、结直肠癌和胰腺癌的方法。在一些实施例中,上述癌症是ER-α36阳性。
在某些实施例中,所述方法可用于治疗以下一种或多种疾病:皮肤T细胞淋巴瘤(CTCL)、白血病、滤泡性淋巴瘤、霍奇金淋巴瘤和急性髓性白血病。在一些实施例中,上述癌症是ER-α36阳性。
在一些实施例中,癌症是以下任一种:基底细胞癌、髓母细胞瘤、胶质母细胞瘤、多发性骨髓瘤、慢性髓细胞白血病(CML)、急性髓细胞白血病、胰腺癌、肺癌(小细胞肺癌和非小细胞肺癌)、食管癌、胃癌、胆道癌、前列腺癌。R、肝癌、肝细胞癌、胃肠道癌、胃癌、甲状腺癌、子宫内膜癌、卵巢和膀胱癌。在一些实施例中,癌症选自胰腺导管腺癌、结肠腺癌、子宫内膜癌和卵巢囊腺癌。在一些实施例中,癌症是胰腺导管腺癌。在一些实施例中,癌症是灌注不良和/或血管化不良的肿瘤。在一些实施例中,上述癌症是ER-α36阳性。
在某些实施例中,癌症是胰腺癌,包括例如胰腺腺癌、胰腺腺鳞癌、胰腺鳞癌和胰腺巨细胞癌。在一些实施例中,胰腺癌是外分泌胰腺癌。在一些实施例中,胰腺癌是内分泌胰腺癌(例如胰岛细胞癌)。在一些实施例中,胰腺癌是晚期转移性胰腺癌。在一些实施例中,上述胰腺癌是ER-α36阳性胰腺癌。
可由本发明的方法治疗的癌症的其他实例包括但不限于:腺皮质癌、不可知性髓样化生、艾滋病相关癌症(例如,艾滋病相关淋巴瘤)、肛门癌、阑尾癌、星形细胞瘤(例如,小脑及脑)、基底细胞癌、胆管癌(例如,肝外癌)IC)、膀胱癌、骨癌(骨肉瘤和恶性纤维组织细胞瘤)、脑肿瘤(例如,胶质瘤、脑干胶质瘤、小脑或脑星形细胞瘤(例如,毛细胞星形细胞瘤、弥漫性星形细胞瘤、间变性(恶性)星形细胞瘤)、恶性胶质瘤、室管膜瘤、少登革热瘤、脑膜瘤、颅咽管瘤、成血细胞瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤、视觉通路和下丘脑胶质瘤、胶质母细胞瘤)、乳腺癌、支气管腺瘤/类癌、类癌肿瘤(如胃肠类癌)、不明原发性癌、中枢神经系统淋巴瘤、宫颈癌、结肠癌、大肠癌、chronIC骨髓增生性疾病、子宫内膜癌(如子宫癌)、室管膜瘤、食管癌、尤因家族肿瘤、眼癌(如眼内黑色素瘤和视网膜母细胞瘤)、胆囊癌、胃(胃)癌、胃肠类类癌、胃肠道间质瘤(GIST)、生殖细胞瘤(如颅外肿瘤)、性腺外、卵巢)、妊娠滋养层肿瘤、头颈癌、肝(肝)细胞癌(如肝癌和Heptoma)、下咽癌、胰岛细胞癌(内分泌胰腺)、喉癌、喉癌、白血病、唇癌和口腔癌、口腔癌、肝癌、肺癌(如小细胞肺癌)。NG癌、非小细胞肺癌、肺腺癌和肺鳞癌)、淋巴肿瘤(如淋巴瘤)、髓母细胞瘤、卵巢癌、间皮瘤、转移性鳞状颈癌、口腔癌、多发性内分泌肿瘤综合征、骨髓增生异常综合征、骨髓增生异常/骨髓增生性疾病、NASAl腔旁窦癌、鼻咽癌、成神经细胞瘤、神经内分泌癌、口咽癌、卵巢癌(如卵巢上皮癌、卵巢生殖细胞瘤、卵巢低恶性潜能瘤)、胰腺癌、甲状旁腺癌、阴茎癌、腹膜癌、咽癌、嗜铬细胞瘤A、成松细胞瘤和幕上原发性神经外胚层肿瘤、垂体瘤、胸膜肺母细胞瘤、淋巴瘤、原发性中枢神经系统淋巴瘤(微胶质瘤)、肺淋巴管肌瘤病、直肠癌、肾癌、肾盂输尿管癌(移行细胞癌)、横纹肌肉瘤、唾液腺癌、皮肤癌。R(例如,非黑色素瘤(例如,鳞状细胞癌)、黑色素瘤和默克尔细胞癌)、小肠癌、鳞状细胞癌、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、结节性硬化症、尿道癌、阴道癌、外阴癌、Wilms肿瘤和移植后淋巴增生性疾病(PTLD)、与超声心动过速相关的异常血管增生、水肿(如与脑肿瘤相关的水肿)和Meigs综合征。
在一些实施例中,癌症是实体瘤(例如晚期实体瘤)。实体瘤包括但不限于肉瘤和癌,如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、卡波西肉瘤、软组织肉瘤、子宫骶管无症状肉瘤、间皮瘤、尤因肿瘤、雷奥莫约。肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、子宫内膜癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管G肾癌、肾细胞癌(包括腺癌、透明细胞肾细胞癌、乳头状肾细胞癌、发色团肾细胞癌、集合管肾细胞癌、颗粒肾细胞癌、混合颗粒肾细胞癌、肾血管肌脂肪瘤或梭形肾细胞癌)、肝癌,胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、Wilm's瘤、宫颈癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质瘤、新生血管瘤,黑色素瘤、神经母细胞瘤和视网膜母细胞瘤。在一些实施例中,上述癌症是ER-α36阳性。
在某些实施例中,淋巴肿瘤(例如,淋巴瘤)是B细胞肿瘤。B细胞肿瘤的实例包括但不限于前体B细胞肿瘤(例如,前体B淋巴细胞白血病/淋巴瘤)和外周B细胞肿瘤(例如,B细胞慢性淋巴细胞白血病/前淋巴细胞白血病/小淋巴细胞淋巴瘤(小淋巴细胞(SL)NHL)、淋巴细胞浆细胞淋巴瘤/免疫细胞瘤、曼特尔细胞瘤。L淋巴瘤、滤泡中心淋巴瘤、滤泡性淋巴瘤(例如,细胞学分级:I(小细胞)、II(混合大小细胞)、III(大细胞)和/或亚型:弥漫性和以小细胞为主的类型)、低级别/滤泡性非霍奇金淋巴瘤(NHL)。中度/滤泡性NHL、边缘区B细胞淋巴瘤(例如,淋巴结外(例如,麦芽型+/-单核细胞B细胞)和/或淋巴结(例如,+/-单核细胞B细胞))、脾边缘区淋巴瘤(例如,+/-绒毛淋巴细胞)、毛细胞白血病、浆细胞瘤/浆细胞骨髓瘤(例如,骨髓瘤和多发性骨髓瘤)、弥漫性大B细胞淋巴瘤MPHOMA(例如,原发性纵隔(胸腺)B细胞淋巴瘤)、中度弥漫性NHL、Burkitt淋巴瘤、高级B细胞淋巴瘤、Burkitt样、高级免疫母细胞NHL、高级淋巴母细胞NHL、高级小非分裂细胞NHL、大型疾病NHL、艾滋病相关淋巴瘤和Waldenstrom巨球蛋白血症)。在一些实施例中,上述淋巴肿瘤是ER-α36阳性。
在某些实施例中,淋巴肿瘤(例如,淋巴瘤)是T细胞和/或假定的NK细胞肿瘤。T细胞和/或假定的NK细胞肿瘤的实例包括但不限于前体T细胞肿瘤(前体T淋巴细胞淋巴瘤/白血病)和外周T细胞和NK细胞肿瘤(例如,T细胞慢性淋巴细胞白血病/无性系白血病和大颗粒淋巴细胞白血病(LGL)(例如,T细胞类型和/或NK细胞类型),皮肤T细胞淋巴瘤(例如,真菌病/Sezary综合征)、未明确的原发性T细胞淋巴瘤(例如,细胞学分类(例如,中型细胞、混合大细胞、大细胞)、大细胞、淋巴表细胞、肝豆状细胞γδT细胞淋巴瘤亚型和皮下泛乳样T细胞淋巴瘤)、血管免疫母细胞T细胞淋巴瘤HOMA(AILD)、血管中心性淋巴瘤、肠T细胞淋巴瘤(例如,+/-肠病相关),成人T细胞淋巴瘤/白血病(ATL)、间变性大细胞淋巴瘤(ALCL)(例如,CD30+、T和空细胞类型)、间变性大细胞淋巴瘤和霍奇金等。在一些实施例中,上述淋巴肿瘤是ER-α36阳性。
在某些实施例中,淋巴肿瘤(例如,淋巴瘤)是霍奇金病(例如,ER-α36阳性霍奇金病)。例如,霍奇金病可能是以淋巴细胞为主型、结节性硬化、混合细胞、淋巴细胞减少和/或富含淋巴细胞。
在某些实施例中,癌症是白血病(例如,ER-α36阳性白血病)。在一些实施例中,白血病是慢性白血病。慢性白血病的例子包括但不限于慢性粒细胞性I(粒细胞性)白血病、慢性粒细胞性和慢性淋巴细胞性白血病(CLL)。在一些实施例中,白血病是急性白血病。急性白血病的实例包括但不限于急性淋巴细胞性白血病(ALL)、急性髓细胞性白血病、急性淋巴细胞性白血病和急性髓细胞性白血病(例如,骨髓母细胞性白血病、早幼粒细胞性白血病、骨髓单核细胞性白血病、单核细胞性白血病和红细胞性白血病)。
在一些实施例中,癌症是液体肿瘤或浆细胞瘤。浆细胞瘤包括但不限于骨髓瘤。骨髓瘤包括但不限于髓外浆细胞瘤、孤立性骨髓瘤和多发性骨髓瘤。在一些实施例中,浆细胞瘤是多发性骨髓瘤。
在一些实施例中,癌症是多发性骨髓瘤(例如,ER-α36阳性多发性骨髓瘤)。多发性骨髓瘤的实例包括但不限于IgG多发性骨髓瘤、IgA多发性骨髓瘤、IgD多发性骨髓瘤、IgE多发性骨髓瘤和非分泌性多发性骨髓瘤。在一些实施例中,多发性骨髓瘤是IgG多发性骨髓瘤。在一些实施例中,多发性骨髓瘤是IgA多发性骨髓瘤。在一些实施例中,多发性骨髓瘤是一种闷烧的或惰性的多发性骨髓瘤。在一些实施例中,多发性骨髓瘤是进行性多发性骨髓瘤。在一些实施例中,多发性骨髓瘤可对诸如(但不限于)硼替佐米、地塞米松(dex-)、阿霉素(dox-)和美尔法仑(lr)等药物产生耐药性。
在某些实施例中,提供了通过拉索昔芬或其药学上可接受的盐减少至少一种其他药剂副作用的方法,包括向个体施用有效量的拉索昔芬或其药学上可接受的盐与其他药剂组合,其中,其他药剂从三苯氧胺、雷洛昔芬或其功能等效物和芳香化酶抑制剂中选择。在一些实施例中,个体是ER-α36阳性。在一些实施例中,个体为EGFR阳性。在一些实施例中,个体为HER2阳性。
在某些实施例中,癌症选自乳腺癌、子宫内膜癌、肺癌、胰腺癌、胃癌、结肠癌、肝癌、甲状腺癌、CLL等,其细胞正表达ER-α36。在一些实施例中,ER-α36阳性乳腺癌对三苯氧胺治疗具有抗药性。
在治疗ER-α36阳性癌症的方法的某些方面,可进一步包括通过检测ER-ER-蛋白和/或ER-α36mRNA的量来测定癌症中的ER-α36表达。在一些实施例中,例如,通过免疫杂交方法(例如,Western blotting、免疫组织学或荧光染色)测量的ER-α36多肽的量,来确定ER-α36在癌症中的表达。在一些实施例中,例如,通过定量聚合酶链反应(qPCR)测量的ER-α36mRNA的量,来确定癌症中ER-α36的表达。
在某些实施例中,ER-α36状态用作选择癌症治疗个体(或减少癌症治疗中其他药剂的副作用)的基础。例如,ER-α36的表达水平可用于确定(和辅助评估)以下任何一种或多种情况:a)个体可能或更可能适合最初接受治疗;b)个体可能或更可能不适合最初接受治疗;c)对治疗的反应性;d)个体可能或更可能继续接受治疗的适宜性;e)个体可能或更可能不适合接受治疗;f)调整剂量;g)预测临床益处的可能性。本应用程序包含这些方法中的任何一种。
例如,在某些实施例中,提供一种治疗个体(例如人类个体)癌症的方法,其包括向该个体投入:a)有效量的拉索昔芬或其药学上可接受的盐;和b)从上皮生长因子受体的磷酸化激酶抑制剂组成中选择至少一种其他药剂的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物,以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。其中,个体为ER-α36阳性个体(例如,该个体有很高的ER-α36水平)在一些实施例中,提供了一种治疗个体(例如人类个体)癌症的方法,其包含向该个体投入:a)有效量的拉索昔芬或其药学上可接受的盐;b)从上皮生长因子受体的磷酸化激酶抑制剂组成中选择至少一种其他药剂的有效量,例如EGFR磷酸化抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉替尼、达克罗替尼、奥西美替尼、罗基替尼或奥莫替尼,或其药学上可接受的盐)或其功能等效物,以及HER2抑制剂(例如曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。在一些实施例中,如果个体高表达ER-上可接,则选择该个体进行治疗。在一些实施例中,ER-α36的水平通过免疫组化方法测定。在一些实施例中,ER-α36的水平基于蛋白质表达水平。在一些实施例中,ER-α36的水平基于mRNA水平。在一些实施例中,ER-α36的水平基于响应雌激素刺激的Ca2+信号。在一些实施例中,所述方法进一步包括在处理之前测定ER-α36的水平。在一些实施例中,所述方法还包括基于ER-α36水平选择用于治疗的个体。
与对照样品相比,ER-α36的表达量可能高或低。在一些实施例中,将个体中ER-α36的表达量与对照样品中ER-α36的表达量进行比较。在一些实施例中,将个体中ER-α36的表达量与多个对照样品中ER-α36的表达量进行比较。在一些实施例中,多个对照样品用于生成将癌症个体中ER-α36表达量分类的统计数据。
ER-94】表达量(即高或低)的分类或等级可根据统计分布确定。在一些实施例中,分类或排序是相对于从个体中获得的控制样本。在一些实施例中,ER-α36的表达量是相对于控制水平的统计分布进行分类或排序的。在一些实施例中,ER-α36的表达量相对于从个体获得的对照样品的水平进行分类或排序。
对照样品的来源和方法与非对照样品相同。在一些实施例中,从不同个体(例如没有癌症的个体和/或具有相似种族、年龄和性别身份的个体)获得对照样品。在一些实施例中,当样品是肿瘤组织样本时,对照样品可以是来自同一个体的非癌性部分。在一些实施例中,使用多个对照样品(例如来自不同个体)来确定特定组织、器官或细胞群中ER-α36的表达量范围。在一些实施例中,对照样品是已被确定为适当的对照样品的培养组织或细胞。在一些实施例中,对照样品是不表达ER-α36的细胞。在一些实施例中,标准化试验中临床上接受的正常表达量被用作确定ER-α36表达量的对照。在一些实施例中,根据评分系统(例如基于免疫组化的评分系统),个体中ER-α36的参考表达量被分类为高、中或低。
在某些实施例中,ER-α36表达量通过测量个体中ER-α36的表达量并与对照或参照物(例如,给定患者群体的中位表达量或第二个体的表达量)进行比较来确定。例如,如果确定单个个体的ER-α36表达量高于患者人群的中位数,则确定该个体具有较高的ER-α36表达。相反,如果确定单个个体的ER-α36表达量低于患者人群的中位数,则确定该个体的ER-α36表达较低。在一些实施例中,将个体与对治疗有反应的第二个体和/或患者群体进行比较。在一些实施例中,将个体与对治疗无反应的第二个体和/或患者群体进行比较。在本文的任何实施例中,表达量都是通过测量ER-α36的表达量来确定的。例如,如果确定单个个体的编码ER-α36的mRNA水平高于患者群体的中位数,则确定该个体高表达ER-定该个的mRNA。相反,如果确定单个个体编码ER-α36的mRNA表达量低于患者群体的中位数,则确定该个体编码ER-α36的mRNA表达量较低。
在某些实施例中,通过获得ER-α36表达表达量的统计分布来确定ER-α36的参考表达量。
在某些实施例中,生物信息学方法用于ER-例中,表达量的确定和分类。许多替代的生物信息学方法已经开发出来,用基因表达谱数据评估基因集表达谱。方法包括但不限于Segal、E.等人Nat.Genet 34:66-176(2003);Segal,E.等人Nat.Genet 36:1090-1098(2004);Barry,W.T.等人生物信息学21:1943-1949(2005);Tian,L.等人PNAS 102:13544-13549(2005);Novak B A和Jain A N.生物信息学22:233-41(2006);Maglietta R等人生物信息学23:2063-72(2007);Bussemaker H J,BMC生物信息学8,增刊6:S6(2007)。
在某些实施例中,确定了mRNA水平,并且低水平是小于被视为临床正常表达量或从对照样品中获得表达量的2倍、1.9倍、1.8倍、1.7倍、1.6倍或1.5倍。在一些实施例中,高表达量是大于被视为临床正常表达量或从对照样品中获得表达量约2、2.2、2.5、2.7、3、5、7、10、20、50、70、100、200、500、1000倍或大于1000倍。
在某些实施例中,蛋白质表达量是通过例如免疫组化来确定的。例如,低或高表达量的标准可根据染色阳性细胞的数量和/或染色强度制定,例如,通过使用特异识别ER-α36蛋白的抗体。在一些实施例中,如果小于约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的细胞具有阳性染色,则该表达量较低。在一些实施例中,如果染色强度比阳性对照染色强度低1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,则表达量较低。在一些实施例中,肿瘤细胞的阳性对照染色强度约为正常细胞的两倍。
在某些实施例中,如果超过约40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%的细胞具有阳性染色强度,则该表达量高。在一些实施例中,如果染色强度与阳性对照染色相同,则表达量高。在一些实施例中,如果染色强度为阳性对照染色强度的80%、85%或90%,则表达量高。在一些实施例中,肿瘤细胞的阳性对照染色强度约为正常细胞的两倍。
在某些实施例中,强染色、中等染色和弱染色是校准的染色水平,其中建立了一个范围,并且染色强度在该范围内结合。在一些实施例中,强染色是在强度范围的75%以上进行染色,中等染色是在强度范围的25%到75%之间进行染色,低染色是在强度范围的25%以内进行染色。在某些方面,本领域技术人员熟悉特定的染色技术,调整染色槽大小并定义染色类别。
在某些实施例中,雌激素敏感性通过例如Ca2+振荡或电生理膜片钳确定。例如,低或高敏感的标准可以根据Ca2+浓度的变化或阳性细胞的反应信号制定,例如使用雌激素。在一些实施例中,如果小于约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的细胞具有正灵敏度,则该灵敏性较低。在一些实施例中,如果Ca2+浓度或响应信号的变化小于正控制灵敏度的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,则该灵敏性较低。在一些实施例中,肿瘤细胞中的阳性对照敏感性约为正常细胞的两倍。
在某些实施例中,如果超过约40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%的细胞具有正变化,则该水平高。在一些实施例中,如果敏感度与阳性对照敏感度相同,则灵敏性高。在一些实施例中,如果变化为阳性对照强度的80%、85%或90%,则水平高。在一些实施例中,肿瘤细胞中的阳性对照敏感度约为正常细胞的两倍。
在某些实施例中,强灵敏度、中等灵敏度和弱灵敏度是细胞中Ca2+信号的校准水平,其中建立了一个范围并且Ca2+信号的强度在该范围内结合。在一些实施例中,强灵敏度是Ca2+信号在强度范围的75%以上的变化,中等灵敏度是Ca2+信号从强度范围的25%到75%的变化,低灵敏度是Ca2+信号在强度范围的25%以内的变化。在某些方面,本领域技术人员熟悉特定的灌注技术,调整样品槽大小并定义信号记录类别。
在某些实施中还提供了拉索昔芬或其药学上可接受的盐用于治疗ER-α36阳性癌症(例如ER-α36阳性癌症)的方法。例如,将拉索昔芬或其药学上可接受的盐与三苯氧胺或其功能等效物中选择一种药剂、EGFR激酶抑制剂(例如吉非替尼)或其功能等效物以及HER2抑制剂(例如曲妥珠单抗)或功能等效物中选择一种药剂,用于治疗ER-α36阳性癌症,其中所述癌症还表达生物标记物,例如EGFR激酶或HER2。
本发明进一步提供了在制造治疗ER-α36阳性癌症(例如ER-α36阳性癌症)的药物中使用拉索昔芬或其医药上可接受的盐,并从三苯氧胺或其功能等效物中选择一种药剂,EGFR激酶抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、纳拉汀尼、达克罗替尼、奥西梅替尼、罗基替尼、奥洛替尼或其医药上可接受的盐)或其功能等效物中选择一种药物,以及HER2抑制剂(例如,曲妥珠单抗、帕托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物中中选择一种药物。这种药物组合用于制造治疗ER-α36阳性癌症药物,其癌症也表达这些生物标记物,如EGFR激酶或HER2。
本发明治疗ER-α36阳性癌症的某些实施例中,所述方法包括向个体施用有效量的拉索昔芬。在一些实施例中,个体是人(例如,ER-α36阳性的肿瘤病人)。
给药模式
在某些组合治疗的方案中,可同时(即,同时施用)和/或顺序(即按照顺序)给药,药物包含拉索昔芬或其药学上可接受的盐和其他药物(例如EGFR激酶抑制剂或功能等效物或HER2抑制剂或功能等效物)的组合物。在一些实施例中,同时施用拉索昔芬或其医药上可接受的盐和其他药剂(包括本文所述的特定药剂)。本文所用术语“同时投入”指以不超过约15分钟(例如不超过10分钟、5分钟或1分钟)的时间间隔投与拉索昔芬或其医药上可接受的盐和其他药剂。当同时投入该药物时,拉索昔芬或其医药上可接受的盐及该其他药物可包含于同一药物组合中(例如包含拉索昔芬或其药学上可接受的盐和其他药物的组合,例如,本文所包含的药学组成)也可以在单独的组分中(例如,拉索昔芬或其医药上可接受的盐和其他药物包含在单独的药物组分中)。
在某些实施例中,按顺序施用拉索昔芬或其医药上可接受的盐和其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)。本文所用术语“连续给药”意指以超过约15分钟的时间间隔(例如超过20分钟、30分钟、40分钟、50分钟、60分钟或更多)施入拉索昔芬或其医药上可接受的盐和其他药物。可首先施用拉索昔芬或其药学上可接受的盐或其他药剂。拉索昔芬或其医药上可接受的盐和其他药剂包含在单独的组分中,这些成分可以包含在相同或不同的包装中。
在某些实施例中,同时施用拉索昔芬或其药学上可接受的盐和其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物),即,拉索昔芬或药学上可接受的其中的盐分别与另一种药物同时给药。在一些实施例中,在施用另一种药物之前,将拉索昔芬或其医药上可接受的盐至少施用一个周期(例如,至少施用2、3或4个周期)。在一些实施例中,对另一种药物施用至少一周、二周、三周或四周。在一些实施例中,约同时(例如,在1天、2天、3天、4天、5天、6天或7天之内)施用拉索昔芬或其药学上可接受的盐和其他药物。在一些实施例中,约同时(例如,在1天、2天、3天、4天、5天、6天或7天之内)终止拉索昔芬或其药学上可接受的盐和其他药物的给药。在一些实施例中,在终止施予拉索昔芬或其药学上可接受的盐后,继续施予其他药物(例如,继续施予约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月)。在一些实施例中,在开始施用拉索昔芬或其药学上可接受的盐(例如,在1、2、3、4、5、6、7、8、9、10、11或12个月后),开始施用另一种药物。在一些实施例中,约同时开始和终止施用拉索昔芬或其药学上可接受的盐和其他药物。在一些实施例中,大约同时开始施用拉索昔芬或其药学上可接受的盐和其他药物,并且在终止施用拉索昔芬和其药学上可接受的盐后继续施用其他药物(例如,继续施用约1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月)。在一些实施例中,拉索昔芬或其医药上可接受的盐和另一种药剂的施用大约同时停止,并且在开始施用拉索昔芬或其药学上可接受的盐(例如,在1、2、3、4、5、6、7、8、9、10、11或12个月后)开始施用其他药物。
根据给药医师的判断,可在治疗过程中调整拉索昔芬或其医药上可接受的盐和/或其他药物(例如EGFR激酶抑制剂或功能等效物或HER2抑制剂或功能等效物)的给药频率。当单独给药时,可以以不同的给药频率或间隔施与拉索昔芬或其药学上可接受的盐和其他药剂。例如,拉索昔芬或其医药上可接受的盐可每周施用,而另一种药剂以更高或更低的频率地施用。本领域已知用于实现持续释放的各种配方和装置。在此进一步提供示例性给药频率。
可以使用相同的给药途径或不同的给药途径施与拉索昔芬或其药学上可接受的盐和其他药剂(例如,本文详述的EGFR激酶抑制剂或功能等效物或本文详述的HER2抑制剂或功能等效物)。本文还提供了示例性的给药途径。在一些实施例(同时和连续给药)中,以预定的比例施与拉索昔芬或其药学上可接受的盐和其他药物。例如,在一些实施例中,拉索昔芬或其药学上可接受的盐和其他药物的重量比约为1比1。在一些实施例中,重量比可在大约0.001到1和大约1000到1之间,或在大约0.01到1和大约100到1之间。在一些实施例中,拉索昔芬或其药学上可接受的盐与其他药物的重量比小于100:1、50:1、30:1、10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1和1:1中的任意一个,在一些实施例中,拉索昔芬或其药学上可接受的盐与其他药物的重量比为1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、30:1、50:1、100:1中的任何一个。其他比率也可以考虑。
拉索昔芬或其药学上可接受的盐和/或其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)所需的剂量可能(但不一定)低于单独施用每种药剂时通常所需的剂量。因此,在一些实施例中,投入拉索昔芬或其药学上可接受的盐和/或其他药剂的亚治疗量。亚治疗量”或“亚治疗水平”是指小于治疗量的量,即小于当单独使用拉索昔芬或其药学上可接受的盐和/或其他药物时通常使用的量。减少可反映在给定的给药量和/或给定的给药时间段内的给药时间或频率减少。
在某些实施例中,在保证治疗水平不变的情况下,施用足够的其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物),以允许正常剂量的拉索昔芬或其药学上可接受的盐减少至少5%、10%、20%、30%、50%、60%、70%、80%、90%或更多。在一些实施例中,在保证治疗水平不变的情况下,施用足够的拉索昔芬或其药学上可接受的盐,以允许正常剂量的其他药物减少至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多。
在某些实施例中,当单独给药时,与每种药物相应的正常剂量相比,拉索昔芬或其药学上可接受的盐和其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)的剂量都减少。在一些实施例中,拉索昔芬或其药学上可接受的盐和其他药物均在亚治疗(即降低)水平下给予。在一些实施例中,拉索昔芬或其药学上可接受的盐和/或其他药物的剂量实质上小于确定的最大毒性剂量(MTD)。例如,拉索昔芬或其医药上可接受的盐和/或其他药物的剂量小于MTD的约50%、40%、30%、20%或10%。
在某些实施例中,拉索昔芬或其药学上可接受的盐的剂量和/或其他药物的剂量(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)高于单独施用每种药剂时通常需要的剂量。例如,在一些实施例中,拉索昔芬或其药学上可接受的盐和/或其他药剂的剂量实质上高于MTD。例如,当单独给药时,拉索昔芬或其药学上可接受的盐和/或其他药物的剂量超过药剂的MTD的50%、40%、30%、20%或10%。
在某些实施例中,拉索昔芬或其药学上可接受的盐(单独或与其他药物(例如,本文详述的EGFR激酶抑制剂或其功能等效物或本文详述的HER2抑制剂或其功能等效物)组合)的量包括在以下任一范围内:约0.1至0.5mg,约0.5至5mg,约5至10mg,约10至15mg,约15至20mg,约20至25mg,约20至50mg,约25至50mg,约50至75mg,约50至100mg,约75至100mg,约100至125mg,约125至150mg,约150至175mg,约175至200mg,约200至225mg,约225至250mg,约250至300mg,约300至350mg,约350至400mg,约400至450mg,或约450至500mg。在一些实施例中,拉索昔芬或其医药上可接受的盐(例如,单位剂型)的量在约5mg到500mg的范围内,例如约30mg到300mg或约50mg到200mg。
在某些实施例中,拉索昔芬或其药学上可接受的盐(单独或与其他药物(例如,本文详述的EGFR激酶抑制剂或其功能等效物或本文详述的HER2抑制剂或其功能等效物)的组合)的量包括至少约0.01mg/kg、0.05mg/kg、0.1mg/kg、0.25mg/kg、0.5mg/kg、1mg/kg、2.5mg/kg、3.5mg/kg、5mg/kg、6.5mg/kg、7.5mg/kg、10mg/kg、15mg/kg或20mg/kg中的任何一种。在一些实施例中,拉索昔芬或其医药上可接受的盐(单独或与另一种药物组合)的量包括至少约0.01mg/kg/天、0.05mg/kg/天、0.1mg/kg/天、0.25mg/kg/天、0.5mg/kg/天、1mg/kg/天、2.5mg/kg/天、3.5mg/kg/天、5mg/kg/天、6.5mg/kg/天、7.5mg/kg/天、10mg/kg/天、15mg/kg/天或20mg/kg/天中的任何一种。
在某些实施例中,其他药物(例如,本文详述的EGFR激酶抑制剂或其功能等效物或本文详述的HER2抑制剂或其功能等效物)的量至少包括约0.01mg/kg、0.05mg/kg、0.1mg/kg、0.25mg/kg、0.5mg/kg、1mg/kg、2.5mg/kg、3.5mg/kg、5mg/kg、6.5mg/kg、7.5mg/kg、10mg/kg、15mg/kg或20mg/kg中的任何一种。在一些实施例中,拉索昔芬或其医药上可接受的盐(单独或与其他药剂组合)的量包括至少约0.01mg/kg/天、0.05mg/kg/天、0.1mg/kg/天、0.25mg/kg/天、0.5mg/kg/天、1mg/kg/天、2.5mg/kg/天、3.5mg/kg/天、5mg/kg/天、6.5mg/kg/天、7.5mg/kg/天、10mg/kg/天、15mg/kg/天或20mg/kg/天中的任何一种。
拉索昔芬或其医药上可接受之盐(及其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物)的实例性给药频率包括但不限于每2周一次、每3周一次、每4周一次、每6周一次或每8周一次。在一些实施例中,至少约1X、2X、3X、4X、5X、6X或7X(即每天)每周或每天三次、每天两次,施用所述组合物。在一些实施例中,每次给药之间的时间间隔小于约6个月、3个月、1个月、20天、15天、12天、10天、9天、8天、7天、6天、5天、4天、3天、2天或1天。在一些实施例中,每次给药之间的时间间隔超过约1个月、2个月、3个月、4个月、5个月、6个月、8个月或12个月。在一些实施例中,给药计划没有中断。在一些实施例中,每次给药之间的间隔不超过约一周。
拉索昔芬或其医药上可接受的盐(以及其他药物(例如EGFR激酶抑制剂或其功能等效物或HER2抑制剂或其功能等效物))的投与可延长一段时间,例如从约一个月延长至约七年。在一些实施例中,施用该组合物的时间至少约2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月、24个月、30个月、36个月、48个月、60个月、72个月或84个月。
在某些实施例中,个体至少进行了大约一个、两个、三个、四个、五个、六个、七个、八个、九个或十个治疗周期的治疗。
另一种药物的给药频率可与拉索昔芬或其药学上可接受的盐相同或不同。上面的内容提供了示例频率。
可以通过各种途径(例如,口服、静脉注射、动脉内、腹膜内、肺内、吸入、膀胱内、肌肉内、气管内、皮下、眼内、鞘内、透粘膜和透皮)向个体(例如,人类)施用拉索昔芬或其医药上可接受的盐(以及本文所述的其他药物)。在一些实施例中,可使用该组合物的持续连续释放配方。
可以使用本发明所述的给药配方组合。本发明所述的组合治疗方法可单独实施或与其他治疗(例如手术、辐射、化疗、免疫治疗、基因治疗等)结合实施。此外,有更大风险患有增殖性疾病的人可能接受抑制和/或延迟疾病发展的治疗。
如所属领域的普通技术人员所理解的,其他药物的适当剂量应当和已在其他药剂单独或与另一种药物组合使用的临床治疗中施用的剂量大致相同。根据所治疗的情况,剂量可能会发生变化。如上文所述,在一些实施例中,其他药物可能以降低的水平施用。
组合物、试剂盒和药品
本发明还提供用于本文所述方法的组合物(例如药物组合物)、药物、试剂盒和单位剂量,还提供本文所述的任何用途,无论是用作药物和/或用于制造药物。
本发明提供了一种药物组合物,其包含有效量的拉索昔芬或其药学上可接受的盐,以及从三苯氧胺或其功能等效物中选择的至少一种附加的药物,一种EGFR激酶抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、那拉替尼、达克罗替尼,奥西莫替尼、洛昔替尼或奥洛替尼,或其药学上可接受的盐)或其功能等效物,以及HER2抑制剂(例如,曲妥珠单抗、培妥珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物。
在某些实施例中,提供了一种药物组合物,其包含有效量的拉索昔芬或其药学上可接受的盐,以及至少一种从EGFR激酶抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、那拉替尼、达克罗替尼,奥西莫替尼、洛昔替尼或奥洛替尼,或其药学上可接受的盐)或其功能等效物;以及HER2抑制剂(例如,曲妥珠单抗、培妥珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物中选择的附加药物。
某些实施例中的组合物可以单位剂型(例如口服单位剂型)存在。合适的单位剂型包括但不限于胶囊、片剂、药丸、胶囊、凝胶、液体(例如悬浮液、溶液、乳剂)、粉末或其他微粒等。
在某些实施例中,拉索昔芬或其医药上可接受的盐的剂量为每天约0.25–50mg。
在某些方面,提供的试剂盒中的拉索昔芬或其药学上可接受的盐和其他药物(例如,本文详述的EGFR激酶抑制剂或其功能等效物或本文详述的HER2抑制剂或其功能等效物)可以在单独的容器中,也可以在同一容器中。本发明的试剂盒包括一个或多个容器,该容器包含拉索昔芬或其药学上可接受的盐(单位剂型和/或制造品型)和/或至少一种其他药物,并且在一些实施例中,还包括根据本文所述的任何方法使用的说明。所述试剂盒还包括对适合个体的选择或治疗的描述。本发明的药剂盒中提供的说明通常是标签或包装插入物上的书面说明(例如药剂盒中包含的纸页),但也可接受机器可读的说明(例如磁盘或光盘上携带的说明)。
在某些实施例中,试剂盒包含a)有效量的拉索昔芬或其药学上可接受的盐,和b)从EGFR激酶抑制剂(例如吉非替尼、厄洛替尼、伊克替尼、阿法替尼、那拉替尼、达克罗替尼,奥西莫替尼、洛昔替尼或奥洛替尼,或其药学上可接受的盐)或其功能等效物,中选择至少一种其他药物的有效量;和c)从HER2抑制剂(例如,曲妥珠单抗、珀托珠单抗、拉帕替尼或阿多曲妥珠单抗-emtansine(T-DM1)或其医药上可接受的盐)或其功能等效物,中选择至少一种其他药物的有效量。在一些实施例中,试剂盒还包含用于同时或按顺序施用拉索昔芬或其药学上可接受的盐和其他药物以治疗癌症(例如,ER-α36阳性癌症)(或本文所述的其他用途)的说明。
拉索昔芬或其药学上可接受的盐及其他药物可存在于单独的容器或同一个容器中。应理解,试剂盒可包含多种不同的药物成分,一种是拉索昔芬或其药学上可接受的盐,另外是一种或两种或两种以上的,成分包含其它种类药物的药物组合。
本发明的试剂盒有合适的包装。此合适的包装包括但不限于,药水瓶,瓶子,罐子,软包装(如密封聚酯薄膜或塑料袋)等。工具包可以选择性地提供其他组件,如缓冲液和解释性信息。因此,本申请还提供了制品,其中包括小瓶(如密封小瓶)、瓶子、罐子、软包装等。
关于使用拉索昔芬或其药学上可接受的盐的说明通常包括有关剂量、给药时间表和预期治疗的给药途径的信息。容器可以是单位剂量、散装包装(例如,多剂量包装)或亚单位剂量。例如,可以提供含有足够剂量的拉索昔芬或其药学上可接受的盐(如本文所公开)的试剂盒,以为个体提供延长时期的有效治疗,例如一周、2周、3周、4周、6周、8周、3个月、4个月、5个月、7个月、8个月、9个月、或更长时间。试剂盒还可包括多单位剂量的拉索昔芬或其药学上可接受的盐、药物成分和使用说明,并以足够的数量包装以供药房(例如,医院药房和配制药房)储存和使用。
一方面,本发明提供了一种试剂盒,该试剂盒包含(i)一种包含拉索昔芬或其药学上可接受的盐的组合物;和(ii)一种用于确定ER-α36蛋白或ER-α36mRNA表达量试剂。在一些实施例中,试剂盒包含用于确定ER-α36蛋白表达量试剂,例如识别ER-α36蛋白的抗体。在一些实施例中,试剂盒包含用于确定ER-α36mRNA表达量试剂,例如,用于定量测量ER-α36mRNA的寡核苷酸。
具体实施例
虽然本发明的描述和说明具有一定的特殊性,但应当理解,本发明仅以实例的方式进行阐述,并且本领域的技术人员可以在不脱离发明的精神和应用范围的情况下,按照阐述所定义的,去进行部分的组合安排的诸多改动。
实施例1拉索昔芬的化学合成
(5,6,7,8-tetrahydro-6-phenyl-5-[4-[2-(1-pyrrolidinyl)ethoxy]phenyl]-2-naphthalenol)(5,6,7,8-四氢-6-苯基-5-[4-[2-(1-吡咯烷基)乙氧基]苯基]-2-萘酚)
如在PCT/CZ2008/000058、WO2008/145075A2中所描述的那样,可以参考或使用下面详细的步骤来制备拉索昔芬。
步骤a
格氏试剂的制备:将镁(5.83g,240mmol)和50ml干燥的THF加入500ml三颈烧瓶中,在氮气气氛下搅拌过夜。逐滴添加THF中的部分4-[2-吡咯烷二甲氧基]苯基溴化物2,在热引发反应后,在20至30℃之间缓慢添加2(62.1g,230mmol)和四氢呋喃(THF)(350ml)的剩余部分,得到灰色的格氏试剂溶液。
在30min内,在干燥THF(120ml)中加入6-(苄氧基)-3,4-二氢-1(2H)-萘酮1(34.2g,136mmol)的回流溶液。将所得混合物进一步回流30min,然后冷却到室温,用含水饱和氯化铵(400ml)冷却。该混合物用乙酸乙酯(160ml x2)提取,组合提取物用水(20ml x2)洗涤,用无水Na2SO4干燥,最后蒸发。残渣在2.0M的HCl水溶液中溶解,并用异丙基醚(120ml x2)萃取。水相用2M的NaOH水溶液(21ml)组合并调整为pH值11-12,然后用乙酸乙酯(160ml×2)提取。有机层用饱和盐水(200ml)洗涤,在无水Na2SO4上干燥,蒸发为6-苄氧基-1-{4-[2-(吡咯烷-1-基)乙氧基]苯基}-3,4–二氢萘3的油状液体。
步骤b
在0-5℃条件下,将5(30.6g,72mmol)的二氯甲烷(100mL)溶液中,加入m-CPBA(18.6g,108mmol)的二氯甲烷(186ml),并恒温1h,搅拌1.5h。反应用Na2SO3的水溶液(5.12克,40.6mmol)终止,并用2M NaOH水溶液碱化至pH 10-11.两层分离,有机层用饱和盐水(50ml x 2)洗涤,在无水Na2SO4(12.1g)上干燥,蒸发为6-苄氧基-1-[4-(2pyrrolidin-1-基)苯基]-3,4-二甲基-2(1H)-1-4(29.0g,90.0%)。
步骤c
在0℃,通入氮气保护条件下,向THF(80ml)中的氯化铈(12.3g,33.0mmol)悬浮液中加入化合物4(12.8g,30.1mmol)的THF(45ml)溶液。在该温度下将所得混合物搅拌1.5h,并进一步冷却至-10至-5℃。在干燥的THF中加入苯基溴化镁溶液。[格氏试剂是由溴苯(5.21g,33.2mmol)和镁屑(0.820g,33.7mmol)在THF(40ml)中新鲜制备的],将混合物进一步搅拌2h并用NH4Cl(80mL)淬灭。过滤分离氯化铈,滤液用二氯甲烷(120ml×2)萃取,合并的有机层用饱和盐水洗涤。将萃取物蒸发到残留液体成淡黄色油状物,用D-酒石酸的甲醇溶液处理淡黄色油状物,得到6-苄氧基-2-苯基-1-4-[2-(吡咯啉-1-基)乙氧基)]苯基-3,4-二氢萘的酒石酸盐固体(化合物6)。
步骤d
1.5克的化合物6,5%PD/c(0.32g)和乙醇甲醇混合物被密封在一个密闭高压釜中,密封容器,然后将混合物在50℃下在氢气(10atm压力)下搅拌10h。反应完成后,将反应混合物冷却至室温,并通过硅藻土过滤,然后用甲醇(20ml)洗涤。在低压下浓缩滤液以提供所需产物1-2-[4-(6-苄氧基-2-苯基-1,2,3,4-四氢萘-1-基)-苯氧基]乙基吡咯烷。产量:0.736g(85%)。粗产物在乙醇中再结晶得到所需产物(拉索昔芬)。
步骤e
将步骤D中纯化的拉索昔芬(2g)溶于20ml 95%乙醇中,并与0.78g D-酒石酸混合,后者溶于7.8ml 95%乙醇中。小心地将混合溶液加热至轻微回流5分钟,然后冷却至室温。得到约1.4g的拉索昔芬的D-酒石酸盐沉淀(产率50%)。
将拉索昔芬D-酒石酸盐溶解于DMSO-d6(50mg/ml)中进行核磁共振分析。1H NMR(600MHz,DMSO-d6)δ1.71~1.85(m,5h),2.08(s,1h),2.90~2.99(m,6h),3.17(br,2h),3.295(m,1h),4.02~4.06(m,4h),4.17(d,j=3.6Hz,lh),4.43(br,2h),6.6(m,5h),6.81(d,j=6.4Hz,2h),7.11(s,1h),7.13(s,2h)。13C核磁共振(150兆赫,DMSO-D6)δ174.26,155.74,155.36,144.12,137.08,135.37,131.09,130.97,130.04,127.83,127.61,125.87,114.35,113.58,112.91,71.90,64.07,53.59,53.100,49.40,44.41,29.244,22.56,22。41。
步骤f
将20mg拉索昔芬D-酒石酸盐悬浮液置于5ml 95%乙醇水溶液中,在60℃下在单颈烧瓶中加热,直到混合物变清澈。在60℃下小心过滤溶液。将滤液置于黑暗中2天。收集形成的细晶体进行X射线分析。
实施例2生物学实验的一般材料和方法
ER-49】、ER-β和GPER1抗体购自CST和santa cluz。胎牛血清(FBS)、中、L-谷氨酰胺、Anti-anti均购自Biotech公司。三苯氧胺(MPG USP级)由Okahata(上海)贸易有限公司提供,所有化合物均从Sigma或Aladdin购买。鼠食由中国南通市营养动物饲料高科技有限公司生产。裸鼠购自上海BK实验动物公司。
雌激素受体ER-αR-抗体和质粒的制备
GL物化学公司(中国)合成了ER-α36的最后27个氨基酸,并与牛血清白蛋白交联。百奇生物(中国)制备兔抗血清。医用文献中介绍了pEGFP-GPER1质粒的构建。
细胞培养、细胞裂解物提取及免疫印迹试验
HEK-293、MCF-7、MDA-MB-231、HBE、H1299和H460细胞均在ATCC推荐的细胞培养条件下生长。用免疫印迹法测定雌激素结合受体的表达水平。简要地说,80-90%的融合细胞在RIPA缓冲液或含有1%triton-x-100和蛋白酶抑制剂的混合物的1xPBS中溶解。用Bio-rad蛋白染色法测定总蛋白浓度。采用硝酸纤维素膜(millipore)和Bio-rad半干转移系统,遵循标准方案,进行蛋白免疫印迹。从细胞裂解液中提取等量的总蛋白,加到SDS-PAGE上,通过电泳分离蛋白质,转移到硝酸纤维素膜上,用特异蛋白质抗体杂交目标蛋白印迹。用抗体检测ER-α36和66、ER-β和GPER1的表达水平。
细胞内钙离子浓度的测定
细胞内钙离子浓度的测定分析描述如下。简单地说,细胞生长在一个玻璃底灌注室,该灌注室安装在倒置共聚焦显微镜(andor)的台上,然后在37°C的正常培养基中用2μM Fura-red AM(分子探针,Eugene,OR,USA)培养60分钟。然后用含1.8mM CaCl2和0.8mM MgCl2,pH7.4的Hanks平衡盐溶液(Sigma)连续灌注细胞。当数据显示Ca2+浓度发生变化时,记录荧光密度。用不含酚红的完全培养基灌注细胞,并在572nm处激发Fura-red。然后使用基于CCD成像系统运行的软件(Andor)收集和记录在657nm波长的发射荧光。
抑制细胞分裂的药物活性测定
用培养基将细胞接种到24孔板中,并使用设定浓度的药物进行处理。采用细胞计数器计数细胞数量(count star)进行计数,利用实时细胞监测系统测量细胞总数和运动等生物行为。简单地说,在5分钟的时间间隔内捕捉66小时的图像。按照制造商的指示计算细胞形态参数和每个细胞的运动。
诱导三苯氧胺耐药的MCF-7细胞
MCF-7细胞在含有10%FBS、抗生素和0.1μm三苯氧胺的EMEM培养基中培养3个月。然后再将三苯氧胺浓度增加到0.5μm,持续3个月,最后在含1μm三苯氧胺的EMEM培养基中培养MCF-7细胞,持续4个月。以高浓度三苯氧胺为培养基,计算细胞增殖率,检测MCF-7细胞对三苯氧胺的耐药性。
裸鼠移植瘤的制备及药物抑制试验
H460细胞在含10%胎牛血清的RPMI-1640培养基中生长。当细胞为70%至80%融合并准备进行实验时,用新鲜培养基替换3小时的培养基。去除介质,用不含FBS的培养液冲洗细胞三次。细胞被胰蛋白酶处理,并悬浮在中等大小的小室中,每次注射的凝胶混合达到200微升。细胞被皮下注射到4-6周龄的裸鼠内。每个裸鼠皮下注射1.0~2.0×106个H460细胞。当肿瘤平均体积为50~60时,每天灌胃给药。肿瘤大小由公式计算:体积=(宽度)^2×长度/2。
动物
裸鼠购自中国上海BK动物模型有限公司。根据2011年中国政府颁布的第588号《动物实验规程》,动物实验方案获得了上海计划生育研究所动物伦理委员会的批准。所有动物实验均在SIPPR动物伦理委员会的审核下进行。统计分析
在表格和图表中,结果显示为平均值±标准差。星号表示使用双尾的student-t统计计算模式,显著性差异表示p>0.05,至少重复三次,N,p。
实施例3:与三苯氧胺相比,拉索昔芬对雌激素经典核途径的抑制较弱。
雌激素和ER复合物与染色体中的雌激素反应元件(ERE)结合,调节RNA转录。Bcl-2是抗凋亡家族蛋白的重要成员。它的过度表达与人类多种癌症有关。Bcl-2启动子包含一个ERE序列,并且发现Bcl-2在MCF-7细胞中的表达被E2正向调节并被三苯氧胺抑制(Gennari L.Drugs Today(Barc).2006Jun;42(6):355-67.)。拉索昔芬选择性地结合两种雌激素受体亚型(ER-α或ER-β),其亲和力至少是雷洛昔芬和三苯氧胺的10倍(Gennari L.Drugs Today(Barc).2006Jun;42(6):355-67.)。我们首先评估了与三苯氧胺相比,拉索昔芬是否能更有效地抑制Bcl-2的表达。MCF-7细胞在含有胰岛素和10%FBS或5%活性炭处理FBS的DMEM培养基中培养72小时,然后用拉索昔芬和三苯氧胺处理48小时,我们证实了先前的研究,与含有活性炭处理FBS培养基相比,含有雌激素的培养基可以增强Bcl-2蛋白的表达(图E2A和B,空白)。令人惊讶的是,与三苯氧胺相比,拉索昔芬抑制Bcl-2表达的活性较弱(图2C,2.5μm TAM:2.5μm LAS)。重要的是,与无雌激素培养基中的空白相比,三苯氧胺和拉索昔芬均不影响Bcl-2的表达(活性炭处理(CS)FBS在无酚红EMEM培养基中;Figure 2B CS FBS图片)。这些结果表明,拉索昔芬阻断雌激素经典核途径的药物活性弱于三苯氧胺,而拉索昔芬抗乳腺癌发病和活性高于三苯氧胺,说明拉索昔芬可能通过不同的雌激素调控途径抑制MCF-7细胞的增殖。
实施例4:当比较三苯氧胺和拉索昔芬抑制ER-α36阳性表达细胞增殖时,拉索昔芬有更高活性,抑制ER-α36阳性MCF-7细胞的增殖。
ER-59是ER-5的转录变种,缺少AF-1和AF2结构域。它包含一个部分配体结合域和一个棕榈酰化域(445-453),并具有一个独特的C端27氨基酸序列,取代了全长ER-α的典型140氨基酸(456-595)。它位于质膜和胞质溶胶中(Boonyaratanakornkit,V.Steroids.2011Aug;76(9):877-84)。由于ER-5-4仅限于调节MIES,并且被发现在抗三苯氧胺的癌细胞(如MDA-MB-231)中特异性表达,ER-α36被认为与三苯氧胺抗性有关。(Kang L,et al.Mol Endocrinol.2010Apr;24(4):709-21;Rao J,et al.J Steroid Biochem Mol Biol.2011Nov;127(3-5):231-7.)。此外,胰岛素(IL)与胰岛素受体(IR)结合,刺激胰岛素受体底物(IRS)的磷酸化。磷酸化的IRS与二聚体雌激素ER复合物相互作用,二聚体雌激素ER复合物随后可转移到细胞核并与ERE序列结合,通过雌激素经典核途径调节RNA转录。MCF-7细胞的增殖受白细胞介素的调节,这些细胞对三苯氧胺的敏感性在暂时从培养基中去除白细胞介素后增加(Butler-WB等。癌症研究,1981年1月;41(1):82-8.)或当IRS表达被IRS特异性siRNA短暂抑制时增加(Cesarone G等人,细胞生物化学。2006年5月15日;98(2):440-50。)综上所述,胰岛素可以调节MCF-7细胞的三苯氧胺敏感性。我们在无胰岛素培养基中培养MCF-7细胞3个月,发现在无胰岛素培养基中ER-α36的转录变异体上调。相反,其他雌激素受体的表达水平没有受到影响(图3A)。用拉索昔芬或三苯氧胺处理含有或不含有胰岛素的培养基中培养的MCF-7细胞,拉索昔芬或三苯氧胺抑制MCF-7细胞增殖的IC50(μm)显示的拉索昔芬或三苯氧胺治疗有不同的药物活性。(图3B-D)拉索昔芬更有效地抑制了正向表达ER-α36的MCF-7细胞的增殖(图3B,右图)。另一方面,三苯氧胺抑制该模型细胞增殖显示相反的效果(图3B,左图)。当MCF-7细胞阳性表达ER-α36(MCF-7)时,与三苯氧胺相比,拉索昔芬更有效地抑制ER-α36+MCF-7细胞的增殖(图3C);另一方面,当MCF-7细胞不表达ER-α36(MCF-7/IL)时,与三苯氧胺相比,拉索昔芬抑制MCF-7细胞增殖的活性较低,表明过量的ER-36变异体可能会导致获得性或新生性的三苯氧胺耐药性。
MCF-7细胞在无胰岛素培养基中培养3个月。用免疫印迹法测定雌激素受体的表达水平。简单地说,收集80-90%的细胞,在含有1%Triton-X-100和蛋白酶抑制剂混合物的RIPA缓冲液或1xPBS溶液中将细胞溶解,离心取上清溶液。用Bio-Rad蛋白染色法测定总蛋白浓度。采用硝酸纤维素膜(millipore)和Bio-Rad半干转移系统,按照标准方案进行细胞裂解液的蛋白质印迹检测。用从CST和Santa Cruz购买的抗体检测ER-α36、ER-α66、ER-β和GPER1的表达水平。
实施例5:拉索昔芬对获得性三苯氧胺耐药的MCF-7细胞增殖的抑制作用
为了验证我们的假设,过度表达的ER-α36变异体可能导致获得性的三苯氧胺抗药性,我们用三苯氧胺诱导MCF-7细胞10个月。我们发现ER-α66的表达降低(图3A,top panel)。相反,ER-α36的表达水平有所提高(图4A,middle panel)。GPER1的表达水平没有受到影响(图4A bottom panel)。2μm三苯氧胺不抑制三苯氧胺诱导出的三苯氧胺抗药的MCF-7细胞增殖。相比之下,在相同的测试条件下,2μm的拉索昔芬显示出超过50%的抑制活性(图4B)。结果表明,拉索昔芬是ER-芬是明拮抗剂,能抑制三苯氧胺耐药的ER-α36+乳腺癌的增殖。
实施例6:拉索昔芬抑制表达ER-α36的肿瘤细胞的增殖(诱导或获得性三苯氧胺耐药肿瘤细胞)
流行病学数据表明,与接受抗雌激素治疗的乳腺癌患者和排除吸烟影响的男性相比,女性患非小细胞肺癌的风险更高,肺癌死亡风险更低(Ramchandran K et等人,Semin Oncol 2009,36:516-523;Kiyohara C等人,Gender Medicine 2010,7:381-401;Bouchardy C et al.Cancer 2011,117:1288-1295)这表明ER-α36可能在某些肺癌细胞中过度表达。因此,我们检测了肺癌细胞中ER-α36的表达。在筛选了ER-α66、ER-α36、GPER1和EGFR的表达后,我们发现HBE细胞不表达ER-α36。H1299细胞表达高水平的ER-α36,但不表达EGFR。H460细胞表达高水平的ER-α36和EGFR(图5-A)。在2μM拉索昔芬的治疗下,H460和H1299细胞的增殖受到抑制(图5-B和D)。相比之下,三苯氧胺表现出相反的效果(图5-B)。三苯氧胺和拉索昔芬都不影响HBE细胞的增殖(图5-B)。与H460细胞相比,H1299细胞弱表达EGFR(图5A),EGFR激酶抑制剂吉非替尼没有抑制H1299细胞增殖(图5D)。相比之下,它抑制了H460的增殖,H460正向表达EGFR(图5C)。此外,H460细胞对拉索昔芬和吉非替尼的联合治疗更为敏感(图4C)。在H1299细胞中联合使用拉索昔芬和吉非替尼的治疗效果与单独使用拉索昔芬的治疗效果相似(图4D)。此外,当它用于治疗包括结肠癌(图8-B),胃癌(图8-D)和三阴性乳腺癌(图9)等ER-当它用于癌症时,也发现了相同的拉索昔芬活性。结果表明拉索昔芬可以抑制获得性和新生性的三苯氧胺耐药或ER-α36+癌症的生长。
实施例7:拉索昔芬抑制异种移植裸鼠中ER-α36阳性癌症的生长
为了验证体外实验结果,我们在裸鼠体内构建了异种移植H460肿瘤。用数字游标卡尺测量肿瘤大小。当肿瘤生长到60-70mm3时,每天给小鼠施用吉非替尼或拉索昔芬,或吉非替尼和拉索昔芬的组合物,持续2-3周。我们发现,拉索昔芬抑制了异种移植体H460肿瘤的生长。此外,E2和EGF都能激活ERK/MAPK和AKT/PI3K信号转导通路。当小鼠同时施用拉索昔芬和吉非替尼时,其抑制作用比单独使用拉索昔芬或吉非替尼更为显著(图7-A,B)。因此,拉索昔芬抑制ER-芬抑制索癌的生长。拉索昔芬和吉非替尼联合施用可增强对ER-α36+癌生长的抑制作用。
实施例8:拉索昔芬是GPER1激动剂,能够防止骨质疏松症
雷洛昔芬和拉索昔芬作为选择性雌激素受体调节剂药物,用于治疗绝经后妇女骨质疏松症。因为我们已经证明,拉索昔芬是ER-芬是经和经典雌激素核途径的抑制剂,并且E2与GPER1结合并调节GαS信号,从而通过InsP3R提高细胞溶质Ca2+浓度。我们假设拉索昔芬是GPER1激动剂,用GPER1-EGFP和EGFP短暂表达质粒,通过转染GPER-EGFP和EGFP质粒到HEK293细胞中,过度表达GPER1-EGFP和EGFP蛋白(图11A)。用GPER1拮抗剂(G15)做为拉索昔芬的参比药物,比较GPER1-EGFP和EGFP分别过度表达的HEK293细胞中细胞溶质[Ca2+]i。结果显示,用G15分别刺激GPER1-EGFP和EGFP过度表达的HEK293细胞,二者的细胞溶质[Ca2+]i没有显著改变(图7B);拉索昔芬和雷洛昔芬显著提高了过度表达GPER1-EGFP的HEK293细胞中细胞溶质[Ca2+]i浓度(图11B)。因为细胞溶质[Ca2+]i信号被认为是MIES的激动剂,并且因为拉索昔芬和雷洛昔芬升高了细胞[Ca2+]i信号,所以拉索昔芬和雷洛昔芬被认为是GPER 1的激动剂。因此,通过激活骨内GPER 1信号转导途径,拉索昔芬和雷洛昔芬可以预防骨质疏松症。
讨论
拉索昔芬作为一种选择性雌激素受体调节剂被开发,用于预防更年期后妇女的骨质疏松症。据报道,它可以比三苯氧胺更有效的预防乳腺癌。然而,这种机制从未被报道过。目前的研究表明,与三苯氧胺相比,拉索昔芬是通过雌激素经典核途径阻断Bcl-2表达的较弱抑制剂。有趣的是,拉索昔芬被报道对ER-αLBD亲和力是1.5nM,高于三苯氧胺,表明拉索昔芬可能在抑制膜雌激素受体的生物学功能上比三苯氧胺相比效率更高。目前的研究表明,拉索昔芬是一种ER-芬是一拮抗剂,能阻断ER-断ER阳性肿瘤细胞的增殖,说明ER-α36高表达也会导致乳腺癌。
三苯氧胺作为雌激素受体的拮抗剂,被用于治疗高度表达雌激素受体的乳腺癌患者。它还诱导耐药性和子宫内膜癌,导致了膜结合雌激素受体,ER-α36和GPER1的发现。此外,MIES还被报道有ERK/MAPK和AKT/PI3K信号转导通路的活性,这表明MIES诱发的癌症应该被列入考虑范围。然而,对所涉及的分子调节机制缺乏全面的了解,并且具有不同膜结合雌激素受体的选择性调节剂及其信号转导途径之间的相互干扰,使得很难明确ER-α36和GPER1之间的生理功能,并设计和开发药物,来治疗MIES阳性癌症。目前的研究表明,拉索昔芬抑制ER-芬抑制阳性肿瘤的生长,这表明是ER-瘤的生而不是GPER1诱发MIES癌症并导致获得性或新生性三苯氧胺抗(耐)药。
为了预防绝经后妇女骨质疏松症,拉索昔芬被开发为一种SERM。目前的研究表明,拉索昔芬是GPER1激动剂,通过激活E2-GPER1途径增强肌醇三磷酸受体(InsP3R)的Ca2+通道门控。GPER1主要定位在内质网,雌激素也是在内质网中合成。先前的报告是关于GPER1和IL-IR复合体之间的相互干扰。据报道InsP3R的活性增强可以改善葡萄糖摄取。据报道,雌激素与GPER1结合,激活Gα激信号通路,导致InsP3R-Ca2+通道活性增强。线粒体-内质网膜复合体(MAM)是细胞代谢的主要调控细胞器复合体,内质网膜的Ca2+通过E2/GPER1-GαG-InsP3R-Ca2+通道转移到线粒体,促进线粒体活性,增强糖代谢和ATP合成。因此,E2与GPER1结合可以调节细胞代谢信号。此外,GPER1基因敲除小鼠证明GPER1是雌性小鼠正常骨骼生长、葡萄糖稳态和血压所必需的。因此,GPER1是研究绝经后女性雌激素相关代谢疾病新疗法的一个有趣的治疗靶点。综上所述,拉索昔芬可以预防绝经后妇女的骨质疏松症,因为它是GPER1激动剂。
总之,雌激素是调节正常哺乳动物生理、衰老和许多疾病状态的关键激素。尽管综述中雌激素核受体被描述为介导激素调节组织和疾病基因组效应的配体激活转录因子,但雌激素也介导与膜结合的雌激素受体(ER-α36)和GPER1(G蛋白偶联雌激素受体1,以前为GPR30)的信号传导,调节组织和器官生理功能与疾病。在许多情况下,SERM用以治疗雌激素介导的疾病,这是我们正在临床开发ER-α36或GPER1靶向治疗药物的新机遇。我们的数据表明,拉索昔芬是MIES诱导的癌症的ER-α36拮抗剂,但与三苯氧胺相比,雌激素经典核途径的拮抗剂较弱。此外,它也是预防绝经后妇女骨质疏松症的GPER1激动剂。
引用文献:
1)Revankar CM,Cimino DF,Sklar LA,Arterburn JB,Prossnitz ER.A transmembrane intracellular estrogen receptor mediates rapid cell signaling.Science.2005Mar 11;307(5715):1625-30.
2)Wang Z,Zhang X,Shen P,Loggie BW,Chang Y,Deuel TF.Identification,cloning,and expression of human estrogen receptor-α36,a novel variant of human estrogen receptor-α66.Biochem Biophys Res Commun 2005,336:1023–1027.
3)Boonyaratanakornkit,V.Scaffolding proteins mediating membrane-initiated extra-nuclear actions of estrogen receptor.Steroids.2011Aug;76(9):877-84.
4)Ramchandran K,Patel JD:Sex Differences in Susceptibility to Carcinogens.Semin Oncol 2009,36:516–523.
5)Kiyohara C,Ohno Y:Sex differences in lung cancer susceptibility:a review.Gender Medicine 2010,7:381–401.
6)Bouchardy C,Benhamou S,Schaffar R,Verkooijen HM,Fioretta G,Schubert H,Vinh-Hung V,Soria J-C,Vlastos G,Rapiti E:Lung cancer mortality risk among breast cancer patients treated with anti-estrogens.Cancer 2011,117:1288–1295.
7)Sipponen P and Correa P:Delayed rise in incidence of gastric cancer in females results in unique sex ratio(M/F)pattern:etiologic hypothesis.Gastric Cancer 5:213-219,2002.
8)Fernandez E,Gallus S,Bosetti C,et al:Hormone replacement therapy and cancer risk:a systematic analysis from a network of case-control studies.Int J Cancer 105:408-412,2003.
9)Frise S,Kreiger N,Gallinger S,et al:Menstrual and reproductive risk factors and risk for gastric adenocarcinoma in women:findings from the canadian national enhanced cancer surveillance system.Ann Epidemiol 16:908-916,2006.
10)Kaneko S,Tamakoshi A,Ohno Y,et al:Menstrual and reproductive factors and the mortality risk of gastric cancer in Japanese menopausal females.Cancer Causes Control 14:53-59,2003.
11)Lindblad M,García Rodríguez LA,Chandanos E and Lagergren J:Hormone replacement therapy and risks of oesophagea and gastric adenocarcinomas.Br J Cancer 94:136-141,2006.
12)Lindblad M,Ye W,Rubio C and Lagergren J:Estrogen and risk of gastric cancer:a protective effect in a nationwide cohort study of patients with prostate cancer in Sweden.Cancer Epidemiol Biomarkers Prev 13:2203-2207,2004.
13)Chandanos E,Lindblad M,Jia C,et al:Tamoxifen exposure and risk of oesophageal and gastric adenocarcinoma:a population-based cohort study of breast cancer patients in Sweden.Br J Cancer 95:118-122,2006.
14)Matsuyama Y,Tominaga T,Nomura Y,et al:Second cancers after adjuvant tamoxifen therapy for breast cancer in Japan.Ann Oncol 11:1537-1543,2000.
15)Duell EJ,Travier N,Lujan-Barroso L,et al:Menstrual and reproductive factors,exogenous hormone use,and gastric cancer risk in a cohort of women from the European Prospective Investigation Into Cancer and Nutrition.Am J Epidemiol 172:1384-1393,2010.
16)Cesarone G,Garofalo C,Abrams MT,Igoucheva O,Alexeev V,Yoon K,Surmacz E,Wickstrom E.RNAi-mediated silencing of insulin receptor substrate 1(IRS-1)enhances tamoxifen-induced cell death in MCF-7 breast cancer cells.J Cell Biochem.2006 May 15;
98(2):440-50.
17)Butler WB,Kelsey WH,Goran N.Effects of serum and insulin on the sensitivity of the human breast cancer cell line MCF-7 to estrogen and antiestrogens.Cancer Res.1981 Jan;41(1):82-8.
18)Mauvais-Jarvis F,Clegg DJ,Hevener AL.The role of estrogens in control of energy balance and glucose homeostasis.Endocr Rev.2013Jun;34(3):309-38.
19)Kang L,Zhang X,Xie Y,Tu Y,Wang D,Liu Z,Wang ZY.Involvement of estrogen receptor variant ER-alpha36,not GPR30,in nongenomic estrogen signaling.Mol Endocrinol.2010 Apr;24(4):709-21.
20)Rao J,Jiang X,Wang Y,Chen B.Advances in the understanding of the structure and function of ER-α36,a novel variant of human estrogen receptor-alpha.J Steroid Biochem Mol Biol.2011 Nov;
127(3-5):231-7.
21)Wang J,Li J,Fang R,Xie S,Wang L,Xu C.Expression of ER-α36in gastric cancer samples and in their matched normal tissues.Oncol Lett.2012 Jan;3(1):172-175.
22)White C,Li C,Yang J,Petrenko NB,Madesh M,Thompson CB,Foskett JK.The endoplasmic reticulum gateway to apoptosis by Bcl-X(L)modulation of the InsP3R.Nat Cell Biol.2005 Oct;7(10):1021-8.).
23)Nilsson BO,Olde B,Leeb-Lundberg LM.G protein-coupled oestrogen receptor 1(GPER1)/GPR30:a new player in cardiovascular and metabolic oestrogenic signalling.Br J Pharmacol.2011 Jul;
163(6):1131-9.
24)UE,Salehi SA,Windahl S,Gomez MF,K,Daszkiewicz-Nilsson J,Wendt A,Andersson N,Hellstrand P,PO,Owman C,Rosen CJ,Adamo ML,Lundquist I,Rorsman P,Nilsson BO,Ohlsson C,Olde B,Leeb-Lundberg LM.Deletion of the G protein-coupled receptor 30 impairs glucose tolerance,reduces bone growth,increases bloodpressure,and eliminates estradiol-stimulated insulin release in female mice.Endocrinology.2009 Feb;150(2):687-98.
25)Mocellin S,Pilati P,Briarava M,Nitti D.
Breast Cancer Chemoprevention:
A Network Meta-Analysis of Randomized Controlled Trials.J Natl Cancer Inst.2015 Nov 18;108(2).pii:djv318.
26)Lin Shi,Lingyan Wang,Beibei Wang,Sanda Maria Cretoiu,Qun Wang,Xiangdong Wang and Chengshui Chen.Regulatory mechanisms of betacellulin in CXCL8 production from lung cancer cells.Journal of Translational Medicine 2014,12:70.
27)Nehra R,Riggins RB,Shajahan AN,Zwart A,Crawford AC,Clarke R.BCL2 and CASP8 regulation by NF-kappaB differentially affect mitochondrial function and cell fate in antiestrogen-sensitive and -resistant breast cancer cells.FASEB J.2010 Jun;24(6):2040-55.
28)Gennari L.Lasofoxifene:a new type of selective estrogen receptor modulator for the treatment of osteoporosis.Drugs Today(Barc).2006Jun;42(6):355-67.
29)Ke HZ,Paralkar VM,Grasser WA,Crawford DT,Qi H,Simmons HA,Pirie CM,Chidsey-Frink KL,Owen TA,Smock SL,Chen HK,Jee WS,Cameron KO,Rosati RL,Brown TA,Dasilva-Jardine P,Thompson DD.
Effects of CP-336,156,a new,nonsteroidal estrogen agonist/antagonist,on bone,serum cholesterol,uterus and body composition in rat models.Endocrinology.1998Apr;139(4):2068-76.
30)Kelly MJ,Levin ER.Rapid actions of plasma membrane estrogen receptors.Trends Endocrinol Metab.2001May-Jun;12(4):152-6.
31)Shibata Y,Voeltz GK,Rapoport TA.Rough sheets and smooth tubules.Cell.2006 Aug 11;126(3):435-9.
32)Bravo R,Vicencio JM,Parra V,Troncoso R,Munoz JP,Bui M,Quiroga C,Rodriguez AE,Verdejo HE,Ferreira J,Iglewski M,Chiong M,Simmen T,Zorzano A,Hill JA,Rothermel BA,Szabadkai G,Lavandero S.Increased ER-mitochondrial coupling promotes mitochondrial respiration and bioenergetics during early phases of ER stress.J Cell Sci.2011Jul 1;124(13):2143-52.
33)Prossnitz ER,Barton M.Estrogen biology:new insights into GPER function and clinical opportunities.Mol Cell Endocrinol.2014May 25;389(1-2):71-83.
所有参考文献,如出版物、专利、专利申请和已发表的专利申请,均以引用方式并入本文中。
为了清楚地理解上述发明,已经通过图解和示例方式对其进行了一些详细描述,但对于本领域技术人员来说,很显然未来会实施某些细微更改和调整。因此,说明书和实施例不应被解释为限制本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!