用于联合治疗的药物组合物的制作方法
本发明涉及包含特索芬辛(tesofensine)和美托洛尔(metoprolol)的治疗有效组合的药物组合物用于防止特索芬辛的心血管副作用、同时维持对食物摄取的强烈的抑制效力和不受影响的体重减轻的应用。
背景技术
在过去的几十年中,在几乎所有民族、种族和社会经济群体中,在两种性别和所有年龄组中肥胖的发病率已经上升。肥胖与关于2型糖尿病、冠心病、高血压以及多种其他主要疾病和来自所有起因的全部致命性的显著升高的风险有关。因此,减重对于肥胖患者至关重要。因此,存在对于创造新的和改进的用于管理肥胖的治疗的动力。
在wo97/30997中首次描述的特索芬辛,即(1r,2r,3s,5s)-3-(3,4-二氯苯基)-2-(乙氧基甲基)-8-甲基-8-氮杂双环[3.2.1]辛烷](1r,2r,3s,5s)-3-(3,4-dichlorophenyl)-2-(ethoxymethyl)-8-methyl-8-azabicyclo[3.2.1]octane)是研发中的用于治疗肥胖的三单胺摄取抑制剂。
wo2005/070427描述了使用某种单胺神经递质再摄取抑制剂用于获得体重的持续降低。wo2009/065845描述了使用某种单胺神经递质再摄取抑制剂用于治疗过食症。wo2009/080691描述了以与另外的抗肥胖剂联合使用某种单胺神经递质再摄取抑制剂,用于治疗肥胖。
特索芬辛有效地产生用目前市售的抗肥胖药物所见的约两倍的肥胖个体中的重量减轻。来自用特索芬辛的临床研究的结果还示出化合物具有良好的安全性曲线并且具有很好的耐受性。然而,尽管没有看见临床相关心血管不良事件或血压或脉搏的变化,测量到一些心血管影响,其中心率和血压中趋向轻微增加。尽管这种小影响对于患者不具有即时风险,根据观察研究,已经提出了一些医疗和监管关注,即使心血管参数中的小变化也可以对患者利益/风险评估具有长期暗示。
临床前和临床数据提示食欲抑制剂是特索芬辛通过其发挥它的强的体重减少效应的重要机制。值得注意的是,对于特索芬辛治疗的强烈降低食欲反应(hypophagicresponse)(即,较低的食欲,减少的进食)证明与去甲肾上腺素能和多巴胺能神经传递的中枢性刺激相关。然而,特索芬辛的拟交感的作用方式还可以与临床环境中观察到的升高的心率和血压有关。
wo2009/080693描述了包含某种单胺神经递质再摄取抑制剂与某种β阻滞剂组合的药物组合物,并且wo2011/100659描述了通过给予抗高血压药用于改善药物诱导的血压升高或心跳增加的方法。
由于这种联合治疗似乎吸引人,已经研究特索芬辛与代表不同作用机理的抗高血压剂的药物组合。基于这些实验,发现一些抗高血压剂实际上恰好干扰特索芬辛的抗肥胖效应,并且因此不适合用于这种联合治疗。此外,其他抗高血压剂实际上不适合逆转由特索芬辛诱导的收缩压和心率的增加。
在不同商标名称下标记的美托洛尔,即1-(异丙基氨基)-3-[4-(2-甲氧基乙基)-苯氧基]-丙-2-醇,是通常用于治疗心血管系统的各种病症,并且尤其是高血压中的选择性的β1(肾上腺素能)受体阻滞剂。
技术实现要素:
目前已经令人惊讶地发现:在与特索芬辛的特定的联合治疗中使用美托洛尔用于治疗肥胖,在预防特索芬辛诱导的心血管影响方面示出了满意结果,同时维持特索芬辛对食物摄取的强烈的抑制效力和不受影响的体重减轻。
因此,在一个方面,本发明提供了在包括人的活的动物中治疗、预防或减轻肥胖或与肥胖相关的病症以及用于治疗、预防或减轻特索芬辛的心血管副作用的方法,所述方法包括将治疗有效量的特索芬辛或其药学上可接受的盐在与美托洛尔或其药学上可接受的盐的联合治疗中给予至需要其的这些活的动物体的步骤。
在另一个方面,本发明提供了特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合,治疗、预防或减轻肥胖或与肥胖相关的病症以及用于治疗、预防或减轻特索芬辛的心血管副作用。
在第三个方面,本发明提供了特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合,用于用作药物。
在第四个方面,本发明提供了特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合;在包括人的哺乳动物中用于治疗、预防或减轻肥胖或与肥胖相关的病症以及用于治疗、预防或减轻特索芬辛的心血管副作用。
在第五个方面,本发明涉及特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合在制备在包括人的哺乳动物中用于治疗、预防或减轻的肥胖或与肥胖相关的病症以及用于治疗、预防或减轻特索芬辛的心血管副作用的药物中的应用。
在第六个方面,本发明提供了包含特索芬辛或其药学上可接受的盐的药物组合物,用于在与包含美托洛尔或其药学上可接受的盐的药物组合物一起的联合治疗中使用,用于治疗、预防或减轻肥胖或与肥胖相关的病症以及用于治疗、预防或减轻特索芬辛的心血管副作用。
在第八个方面,本发明提供了包含治疗有效量的特索芬辛或其药学上可接受的盐和治疗有效量的美托洛尔或其药学上可接受的盐,连同一种或多种佐剂、赋形剂、载体和/或稀释剂的药物组合物。
在第九个方面,本发明提供了包含至少两个单独的单位剂量形式(a)和(b)的试剂盒(kitofparts),其中,(a)包含特索芬辛或其药学上可接受的盐;并且(b)包含美托洛尔或其药学上可接受的盐;并且可选的(c)用于同时地、连续地(顺序地)或分开地将(a)的特索芬辛和(b)的美托洛尔给予至需要其的患者的说明书。
从以下具体实施方式和实施例,对于本领域技术人员而言,本发明的其他目的将是明显的。
具体实施方式
特索芬辛是具有对去甲肾上腺素、血清素和多巴胺转运蛋白功能的固有抑制活性的中枢性作用的三单胺再摄取抑制剂(mri)。当对于安慰剂效应和饮食效应校正时,长期的特索芬辛治疗在肥胖患者中产生约10%的体重减轻,这是由目前市售的抗肥胖药所达到的两倍。
特索芬辛的抗肥胖效果很可能通过归因于刺激饱腹感的剂量依赖性食欲降低(hypophagia)来解释,提示特索芬辛作为食欲抑制剂以产生负能量平衡。此外,还证明特索芬辛增加人类受试者的夜间能量消耗。近来,这些发现已经被证实并扩展在临床前设置中,表明特索芬辛在饮食诱导的肥胖(dio)的大鼠模型中诱导了强烈并持久的体重减轻,在该模型中体重的长效下降是由伴随能量消耗的逐渐增加的食欲抑制引起的。值得注意的是,特索芬辛在dio大鼠中的降低食欲效应关键取决于受刺激的α1肾上腺素受体活性并且较少扩展至多巴胺d1受体功能,表明增强的中枢去甲肾上腺素能和多巴胺能神经传递构成特索芬辛的强烈的抑制食欲效果下的重要机制。
总体而言,慢性特索芬辛治疗与轻微不良事件相关,并且与最小心血管影响相关,提示特索芬辛可以是用于肥胖的耐受良好的长期治疗。然而,在这方面,已经报导了在肥胖个体中在测试的最高剂量下,心率的剂量依赖性升高和血压的显著增加。因此,我们推测特索芬辛的拟交感神经药效应是否还可以与所报导的对心血管功能的影响相关。
为了解决该假设,在给予单独的特索芬辛,或给予特索芬辛与代表不同作用机制的抗高血压剂药物即美托洛尔(即,β1受体拮抗剂)和替米沙坦(即,血管紧张素at1受体拮抗剂)的药物组合之后,我们同时监测在遥测的(telemetrized)(即,自发性高血压,spontaneouslyhypertensive)大鼠中对于食物摄取和体重调节连同心血管参数的影响。
目前已经令人惊讶地发现:在与特索芬辛的具体的联合治疗中,使用美托洛尔用于治疗肥胖或与肥胖相关的病症,在预防特索芬辛诱导的心血管影响方面示出了满意结果,同时维持特索芬辛对食物摄取的强烈的抑制效力和不受影响的体重减轻。
因此,在一个方面,本发明涉及使用特索芬辛和美托洛尔用于治疗、预防或减轻患有肥胖或与肥胖相关的病症的受试者的这些病症的联合治疗。
在另一个方面,本发明涉及特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合在制备在包括人的哺乳动物中用于治疗、预防或减轻肥胖或与肥胖相关的病症以及用于治疗、预防或减轻特索芬辛的心血管副作用的药物中的应用。
肥胖和与肥胖相关的病症
肥胖是其中过多的体脂已经累积到一定程度以致对健康可能具有不良影响,导致降低的预期寿命和/或增加的健康问题的医疗病况。体重指数(bmi)是将体重和身高相比较的测量,如果人的bmi在25kg/m2和30kg/m2之间则将其定义为超重(肥胖前期),而如果bmi值大于30kg/m2时则将其定义为肥胖。
在一个优选的实施方式中,根据本发明的联合治疗预期可用于肥胖前期受试者,即具有25kg/m2和30kg/m2之间的bmi的肥胖前期受试者的治疗。
在另一个优选的实施方式中,根据本发明的联合治疗预期可用于肥胖受试者,即具有超过30kg/m2的bmi的肥胖受试者的治疗。
在第三个优选的实施方式中,根据本发明的联合治疗预期可用于病态肥胖受试者,即具有超过35kg/m2的bmi的病态肥胖受试者的治疗。
在本发明的背景中,与肥胖相关的病症是选自由以下组成的组的病症或病况:过食症(over-eatingdisorder)、神经性贪食、暴食症(bingeeatingdisorder)、强迫性过食、受损的食欲调节、代谢综合征、2型糖尿病、血脂异常、动脉粥样硬化以及药物诱导的肥胖,例如用抗抑郁或抗精神病药物治疗后的肥胖。
药学上可接受的盐
可以以适合用于预期给予的任何形式提供根据本发明使用的化合物。适合的形式包括本发明化合物的药学上(即,生理学上)可接受的盐以及前药(predrug)或前体药物(prodrug)形式。
药学上可接受的加成盐的实例包括但不限于,无毒性无机和有机酸加成盐,如盐酸盐、氢溴酸盐、硝酸盐、高氯酸盐、磷酸盐、硫酸盐、甲酸盐、乙酸盐、阿康酸盐、抗坏血酸盐、苯磺酸盐、苯甲酸盐、肉桂酸盐、柠檬酸盐、恩波酸盐(embonate)、庚酸盐、富马酸盐、谷氨酸盐、羟乙酸盐、乳酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、萘-2-磺酸盐、邻苯二甲酸盐、水杨酸盐、山梨酸盐、硬脂酸盐、琥珀酸盐、酒石酸盐、对甲苯磺酸盐等。这类盐可以通过本领域众所周知和描述的方法形成。
本发明化合物的药学上可接受的阳离子盐的实例包括但不限于,包含阴离子基团的本发明化合物的钠、钾、钙、镁、锌、铝、锂、胆碱、赖氨酸鎓(lysinium)和铵盐等。这类阳离子盐可以通过本领域众所周知和描述的方法形成。
在该发明的背景中,含n化合物的“鎓盐”也被认为是药学上可接受的盐。优选的“鎓盐”包括烷基-鎓盐、环烷基-鎓盐、以及环烷基烷基鎓盐。
根据本发明使用的化合物的前药或前体药物形式的实例包括根据本发明使用的物质的合适的前体药物的实例,包括在母体化合物的一个或多个反应性或可衍生基团上被修饰的化合物。特别关注的是在羧基、羟基或氨基上被修饰的化合物。合适的衍生物的实例是酯或酰胺。
可以以可溶性或不可溶性形式连同药学上可接受的溶剂如水、乙醇等一起提供用于根据本发明使用的化合物。可溶性形式还可以包括水合形式,如一水合物、二水合物、半水合物、三水合物、四水合物等。一般而言,对于本发明的目的,可溶性形式被视为与不可溶性形式等效。
药物组合物
在另一个方面,本发明涉及特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合,用于用作药物。
在进一步的方面,本发明提供了包含特索芬辛或其药学上可接受的盐的药物组合物用于在与包含美托洛尔或其药学上可接受的盐的药物组合物一起的联合治疗中,用于治疗、预防或减轻肥胖、或与肥胖相关的病症,以及用于治疗、预防或减轻特索芬辛的心血管副作用。
在又进一步的方面,本发明提供了包含治疗有效量的特索芬辛或其药学上可接受的盐和治疗有效量的美托洛尔或其药学上可接受的盐,连同一种或多种佐剂、赋形剂、载体和/或稀释剂的药物组合物。
尽管根据本发明使用的化合物可以以原料化合物的形式给予,但优选的是将活性成分、可选地以生理学上可接受的盐的形式,连同一种或多种佐剂、赋形剂、载体、缓冲剂、稀释剂、和/或其他常规药物助剂一起引入药物组合物中。
在一个优选的实施方式中,本发明提供了包含活性化合物或其药学上可接受的盐或衍生物、连同一种或多种其药学上可接受的载体,以及可选地,本领域中已知并使用的其他治疗性和/或预防性成分的药物组合物。从与制剂中的其他成分相容并且对其接受者没有害处的意义上说,一种或多种载体必须是“可接受的”。
可以通过适合期望疗效的任何方便的途径给予本发明的药物组合物。给予的优选途径包括口服给予,尤其是以片剂、胶囊、糖衣丸、粉末、或液体形式;以及肠胃外给予,尤其是皮肤、皮下、肌肉或静脉内注射。通过使用标准方法和适合于期望制剂的常规技术,技术人员可以制备本发明的药物组合物。当期望时,可以采用用适合产生活性成分的缓释的成分。
可以在最新版remington’spharmaceuticalsciences(maackpublishingco.,easton,pa)中找到关于用于制剂和给予技术的进一步的细节。
将式i的化合物的用量确定为api(活性药物成分),即,计算作为游离碱。每种活性成分的实际用量取决于所治疗的疾病的性质和严重程度、给予的确切方式、给予形式并且在医师的判断之内,并且可以根据本发明具体情况通过滴定用量而改变以产生期望的治疗效果。
目前认为约0.1mg至约1mg活性成分,优选地,约0.1mg至约0.5mg活性成分的范围内的特索芬辛的日剂量适合用于治疗性治疗。可以以一种或几种剂量,如两次/天给予特索芬辛的日剂量。在一个实施方式中,以一次剂量给予日剂量。
目前认为美托洛尔的日剂量在约25mg至约200mg的活性成分,优选地,约25mg至约100mg的活性成分的范围内。可以以一种或几种剂量,如两次/天给予美托洛尔的日剂量。在一个实施方式中,以一次剂量给予日剂量。
药物试剂盒
根据本发明,还提供了包含至少两个单独的单位剂型(a)和(b)的试剂盒,其中:
(a)包含特索芬辛或其药学上可接受的盐;并且
(b)包含美托洛尔或其药学上可接受的盐;并且可选的,
(c)用于同时地、连续地或分开地将(a)的特索芬辛和(b)的美托洛尔给予至需要其的患者的说明书。
用于根据本发明使用的特索芬辛和用于根据本发明使用的美托洛尔可以优选以适合与其他一起给予的形式提供。这就意在包括其中一种或另外两种制剂可以在用其他组分给予之前、之后、和/或与其他组分给予的同时给予(可选重复地)的实例。
同样,可以以组合形式、或分别、或分别且顺序给予用于根据本发明使用的特索芬辛和根据本发明使用的美托洛尔,其中,顺序给予在时间上接近或在时间上远离。特别地,这可以包括:在治疗相关状况过程中将两种制剂时间上充分接近地给予(任选重复地)对患者存在有益效果,该效果与在相同的治疗过程中如果在不存在其他制剂的情况下给予(可选重复地)两种制剂中的任一种时相比更好。确定关于并且在特定状况的治疗过程中组合是否提供了较好的有益效果,将取决于待治疗或预防的病况,但是可以由本领域技术人员常规地实现。
当用在该背景中时,术语“同时给予”和“与...在同一时间给予”包括单独剂量的特索芬辛并且在彼此的48小时内,例如24小时给予。
使两种组分彼此相关包括:可以以单独制剂(即,彼此独立地)提供组分(a)和(b),其随后被带到一起,用于在联合治疗中彼此结合使用;或以“组合包”的单独组分一起包装和出现,用于在联合治疗中彼此结合使用。
治疗方法
在另一个方面,本发明提供了治疗、预防或减轻包括人的活的动物体的肥胖或与肥胖相关的疾病的方法,所述方法包括将治疗有效量的特索芬辛或其药学上可接受的盐和美托洛尔或其药学上可接受的盐的组合给予给需要其的这种活的动物体的步骤。
在一个优选的实施方式中,与肥胖相关的病症是选自由以下组成的组的病症或病况:过食症、神经性贪食、暴食症、强迫性过食、受损的食欲调节、代谢综合征、2型糖尿病、血脂异常、动脉粥样硬化、以及药物诱导的肥胖。
目前认为约0.1mg至约1mg活性成分,优选地,约0.1mg至约0.5mg活性成分的范围内的特索芬辛的日剂量适合用于治疗性治疗。可以以一种或几种剂量,如两次/天给予特索芬辛的日剂量。在一个实施方式中,以一次剂量给予日剂量。
目前认为美托洛尔的日剂量在约25mg至约200mg的活性成分,优选地,约25mg至约100mg的活性成分的范围内。可以以一种或几种剂量,如两次/天给予美托洛尔的日剂量。在一个实施方式中,以一次剂量给予日剂量。
附图说明
通过参考附图进一步说明本发明,其中:
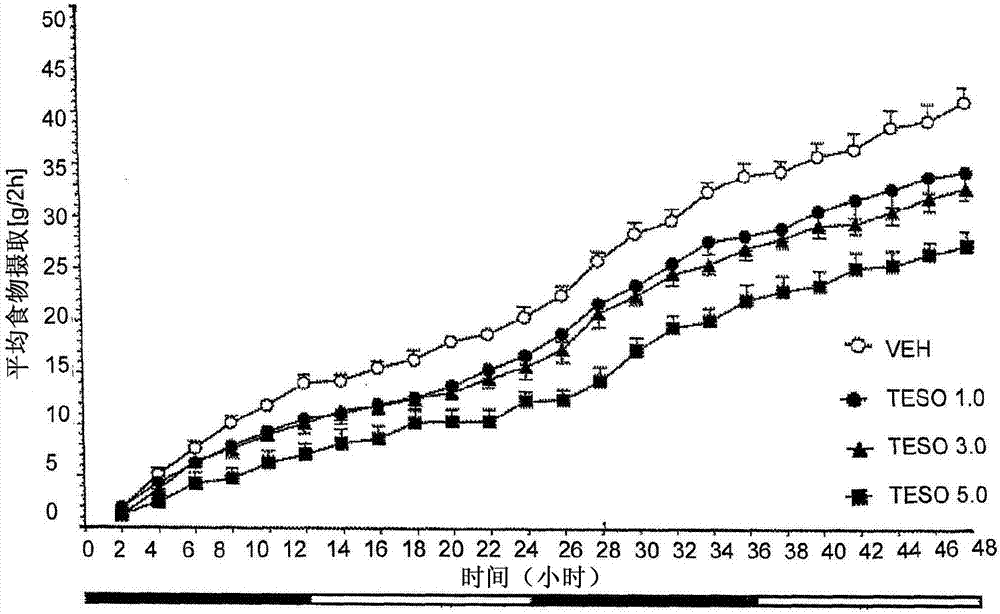
图1示出在遥测的大鼠中特索芬辛(1.0-5.0mg/kg给予,p.o.)剂量依赖性地抑制食物摄取、减少体重和刺激自发活动(运动行为,locomotoractivity)[图片a:急性给药(acutedosing)特索芬辛或盐水载体之后48小时内测量的平均累计食物摄取(2小时间隔)。图片b:在48小时内测量的、分别在12小时黑暗和光照阶段间隔内平均的平均食物摄取。图片c和d:与在第0天给药之前测量的体重相比,分别以相对值(%)和绝对值(g)给出的净体重增长。图片e:在48小时内测量的、分别在相应的12小时黑暗和光照阶段间隔平均的平均自发活动。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。缩写:veh,载体;teso,特索芬辛。*p<0.05,**p<0.01,***p<0.001(与veh相比)];
图2示出在遥测的大鼠中特索芬辛(1.0-5.0mg/kg给予,p.o.)剂量依赖性升高心率和血压[图片a:在12小时间隔中平均的平均心率±s.e.m。图片b:在12小时间隔中平均的平均舒张压。图片c:在12小时间隔中平均的平均收缩压。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。缩写:veh,载体;teso,特索芬辛;bpm,每分钟心跳次数。*p<0.05,**p<0.01,***p<0.001(与veh相比)。
图3示出美托洛尔(10mg/kg、20mg/kg给予,p.o.)与特索芬辛(3.0mg/kg,p.o.)组合的剂量响应效应,并且示出美托洛尔不影响特索芬辛的降低食欲和体重降低效果,但阻滞在遥测大鼠中的特索芬辛诱导的自发活动[图片a:在急性给予美托洛尔+特索芬辛组合物或盐水载体之后,在48小时内测量的平均累计食物摄取(2小时间隔)。图片b:在分别12小时黑暗和光照阶段间隔平均的48小时内测量的平均食物摄取。图片c和d:与在第0天给药之前测量的体重相比,以相对值(%)和绝对值(g)给出净体重增长。图片e:在48小时内测量的分别在12小时黑暗和光照阶段间隔内平均的平均自发活动。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。缩写:veh,载体,teso,特索芬辛;met,美托洛尔。**p<0.01,***p<0.001(与veh+veh相比);#p<0.05;##p<0.01(与veh+teso3.0相比)];
图4示出在遥测的大鼠中,美托洛尔剂量依赖性地阻滞特索芬辛诱导的心率和血压上升[图片a:在12小时间隔内平均的平均心率±s.e.m。图片b:在12小时间隔内平均的平均舒张压。图片c:在12小时间隔内平均的平均收缩压。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。缩写:veh,载体;teso,特索芬辛;met,美托洛尔。**p<0.01,***p<0.001(与veh+veh相比);#p<0.05,##p<0.01,###p<0.001(与veh+teso3.0相比)];
图5示出替米沙坦(1.0mg/kg、3.0mg/kg,p.o.)与特索芬辛(3.0mg/kg,p.o.)组合的剂量响应效应,并且示出替米沙坦不影响特索芬辛的降低食欲和体重降低效果,并且对遥测大鼠中特索芬辛诱导的自发活动不具有影响[图片a:在急性给予替米沙坦+特索芬辛组合或盐水载体之后,在48小时内测量的平均累计食物摄取(2小时间隔)。图片b:在48小时内测量的、分别在12小时黑暗和光照阶段间隔内平均的平均食物摄取。图片c和d:与在第0天给药之前测量的体重相比,以相对值(%)和绝对值(g)给出的净体重增长。图片e:在48小时内测量的、分别在12小时黑暗和光照阶段间隔内平均的平均自发活动。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。缩写:veh,载体;teso,特索芬辛;tel,替米沙坦。*p<0.05,**p<0.01,***p<0.001(与veh+veh相比)];以及
图6示出在遥测的大鼠中,组合的特索芬辛+替米沙坦药物治疗对心率和血压的影响[图片a:在12小时间隔内平均的平均心率±s.e.m。图片b:在12小时间隔内平均的平均舒张压。图片c:在12小时间隔内平均的平均收缩压。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。x轴以下的黑色和白色水平条分别指示12小时黑暗和光照阶段。缩写:veh,载体;teso,特索芬辛;tel,替米沙坦。*p<0.05,**p<0.01,***p<0.001(与veh+veh相比);#p<0.05(与veh+teso3.0相比)]。
实施例
参考以下实施例进一步说明本发明,以下实施例并不意在以任何方式限制所要求保护的本发明的范围。
动物护理和住处(供养,housing)
将5月龄的雄性血压正常的sprague-dawley大鼠(508±18g,荷兰,霍斯特,哈伦(harlan,horst,thenetherlands))安置在具有无尘木屑和硬纸管的固体底树脂玻璃笼中。将存贮室维持在12-h光/黑暗周期(关灯:1500h)下。室温为18.0℃至22.0℃,并且相对空气湿度为40%至60%。昏暗的红光是黑暗时期期间的照明的唯一来源。大鼠具有任意(adlibitum)标准食物(altromin1324,10%kcal来自脂肪,能量密度:2.85kcal/g,altromingmbh,lage,germany)和水。根据丹麦司法部动物实验检查员的指导方针(guidelinesoftheanimalexperimentationinspectorate,ministryofjustice,denmark)批准(许可号:2007/561-1343)并进行所有实验。
在遥测大鼠中同时实时喂养和心血管监测
遥测装置
在荷兰,霍斯特,哈伦实验室(harlanlaboratories,horst,thenetherlands),根据制造商的描述,将datascienceinternational(dsi,st.paul,usa)physiotelpa-c40发射器植入大鼠。简而言之,将大鼠用异氟烷麻醉、通气,并且在无菌条件下进行剖腹手术。用vetbond(3m,st.paul,usa)将压力导管插入并密封在分离的腹主动脉中的位置处。最后,将发射器置于肠的顶部,平行于身体长轴,并且在用可溶缝线闭合腹肌层和皮肤之后固定至腹壁。在装运之前,允许动物进行充分的手术后恢复。使用dataquesta.r.t(v.4.3)和ponemah软件(v.5.0)(dsi,st.paul,usa),使用工厂提供的针对个体发射器的校准值和以确保精确的血压测量的环境压力参考监测(dsi,st.paul,usa),以500hz的采样速率采集血压(心脏收缩和心脏舒张动脉血压)和心率(脉率)数据。数据连续采集48h并且以5s的间隔存储(bin)。
在遥测的大鼠中实时喂养监测
在手术后恢复2-3周之后,将大鼠转移到经改良以同时测定个体化的食物摄取(通过微芯片,参见以下)和心血管状况(通过遥测)的完全自动化的食物摄取监测笼(hm-2,mbrose,faaborg,denmark)。对于组合的遥测分析,将两个接收器(rpc-1,datasciencesinternational,st.paul,mn)放置在各个hm-2食物摄取监测笼的底部,从而完全覆盖笼表面区域。将改良的hm-2食物摄取监测笼放置在改良的具有类似于存贮室中的那些的用于光照-黑暗周期的箱类(cabinet-based)控制的不透光的门和灯的成套装备(kit)(scanburbk,karslunde,denmark)的通气箱中。箱温为24.0℃至26.0℃,并且相对空气湿度为40%至60%。在药物治疗过程开始之前,使动物习惯于hm-2食物摄取监测系统至少5天。在重新居住至完全自动化的食物摄取监测笼之前,用微芯片(#402575,evet,haderslev,denmark)皮下注射大鼠以同时识别,并且贯穿整个实验过程以实时方式跟踪的各个单独的动物的摄食行为。通过放置在笼之上的集成红外传感器检测自发活动。先前进一步详细报导了标准hm-2控制单元设置7。在黑暗开始之前30min,给予所有药物和盐水载体。在每个单独实验中所有大鼠接受相同处理,即,使用平行研究设计,并且在处理间使用至少5天的间歇期以确保重建食物摄取、自发活动、心率和血压的基线。在药物给予过程中将居住笼从hm-2食物摄取监测系统移开,并且在完成药物给予之后立即返回,随后继续每个单独动物的摄食行为和心血管参数的自动监测。每天测量体重。使用数据报告软件(hmview,mbrose,faaborg,denmark)进行体重和微结构食物摄取分析。
统计
将数据送入标准图形和统计分析程序(graphpadprismv.4.03)。将体重数据计算作为绝对值(g)或相对与(对照水平=100%)药物给予的第一天(第0天)的每天体重增加。将体重增加和食物摄取表示为n个单独的动物的平均±s.e.m。在获取遥测数据之后,使用microsoftexcel2007计算12小时平均。最后,使用graphpadprismv.4.03进行统计分析和数据呈现(平均±s.e.m)。使用具有应用tukey事后测试以进行治疗组之间的统计比较的重复测试单向anova评价所有数据。小于0.05的p值被认为是统计学上显著的。
药物
特索芬辛(8-氮杂双环[3.2.1]辛烷,3-[3,4-二氯苯基)-2-(乙氧基甲基)-8-甲基-[1r-(2-内,3-外)]-2-羟基-1,2,3-丙烷三羧酸酯,8-azabicyclo[3.2.1]octane,3-[3,4-dichlorophenyl)-2-(ethoxymethyl)-8-methyl-[1r-(2-endo,3-exo)]-2-hydroxy-1,2,3-propanetricarboxylate)是氮杂二环辛烷柠檬酸酯的衍生物,在neurosearcha/s的药物化学部合成。
美托洛尔和替米沙坦购自sigma(st.louis,mo)。将特索芬辛和美托洛尔溶解在0.9%的盐水溶液中,而将替米沙坦溶解在1nnaoh中并且随后用1nhcl滴定至ph7.4。
将所有药物p.o.给予(1.0ml/kg)。在药物组合实验中,将特索芬辛和抗高血压药物以单独的药物溶液同时给予(相隔<1min)。
结果
对于食物摄取和体重的影响
急性特索芬辛给予强烈地引发遥测大鼠中的食物摄取的减少(图1a和图1b)。特索芬辛治疗的大鼠的食物摄取以剂量依赖和时间依赖的方式下降,其中给药后12小时最高口服剂量(5.0mg/kg),食物摄取降低至对照水平的约50%(p<0.001)。在给予之后,特索芬辛的降低食欲效应分别持续高达12小时(所有剂量)、24小时(3.0-5.0mg/kg)以及48小时(5.0mg/kg),此后,食物摄取恢复至基线水平(图1b)。特索芬辛的降低食欲效应平行于体重的相应剂量依赖性降低(负体重增加),其中,在药物给予之后的至少48小时,明显的是最高剂量(3.0-5.0mg/kg)产生1.0-1.5%(相当于8-11g,与载体治疗的大鼠的体重相比)的显著的净体重损失(图1c和图1d)。特索芬辛还以3.0-5.0mg/kg的剂量范围,剂量依赖性地诱导显著的、尽管持续短的自发活动的增加(图1e)。
选择特索芬辛的中间剂量(3.0mg/kg)用于在分别与抗高血压剂美托洛尔(图3)和替米沙坦(图5)的急性药物组合研究中进一步表征。这些药物相互作用研究表明抗高血压药本身既不表现出对食物摄取或体重调节的效果,并且也不影响特索芬辛诱导的食物摄取(图3a、图3b、图5a、图5b)和体重(图3c、图3d、图5c、图5d)的减少。相反,美托洛尔(图3e,与单独的特索芬辛相比,p<0.05)而不是替米沙坦(图5e,与单独的特索芬辛相比,p=0.98)完全阻止特索芬辛的自发活动诱导效应。
对于心血管参数的影响
如所期望的,血压和心率的遥测监测示出清晰的昼夜变化(图2),其中在活动(夜间)期间观察到较高的血压和心率。
在所有测试的剂量下,用特索芬辛的急性治疗引起心率的剂量依赖性增加,持续最高至治疗之后48小时(图2a)。类似地,在药物给予(3.0mg/kg和5.0mg/kg)之后最高达48小时,观察到收缩压的剂量依赖性适度增加(图2c)。3.0mg/kg特索芬辛对于心率和收缩压的影响从而比3.0mg/kg的特索芬辛的降低食欲效应更耐久。尽管最高剂量没有获得统计显著性,也观察到了舒张压中剂量依赖性上升的趋向(p=0.204,图2b)。
进行两种组合药物研究以调查抗高血压治疗是否可以阻止或降低由特索芬辛引起的继发性高血压以及升高的心率。用特索芬辛(3.0mg/kg)和β1肾上腺素受体拮抗剂美托洛尔(10mg/kg和20mg/kg)的共治疗完全逆转特索芬辛诱导的心动过速(图4a)。然而,仅在给予之后的第一个24小时的过程中观察到美托洛尔的心率降低效应,而在美托洛尔+特索芬辛的组合组中,心率被标准化至对照水平(图4a)。美托洛尔的短持续效应反映大鼠的药物代谢动力学性质。在用美托洛尔(20mg/kg)共治疗高达24小时之后,还观察到标准化的收缩压(图4c)。类似地,第一光照阶段(治疗后12-24小时)过程中特索芬辛诱发的舒张压的增加通过用美托洛尔的共治疗逆转(20mg/kg,图4b)。当单独给予时,在第一个24小时中美托洛尔(20mg/kg)对舒张压不会产生任何显著影响(图4)。
在随后的药物组合研究中,研究了特索芬辛和at1-受体拮抗剂替米沙坦。对于美托洛尔研究,发现特索芬辛的类似(3.0mg/kg)剂量显著增加心率。在特索芬辛给予之后,用替米沙坦(1.0和3.0)的共治疗不会逆转心率的上升,并且与特索芬辛单独给予相比,在与特索芬辛组合的替米沙坦的最高剂量下,我们观察到心率的显著增加(图6a)。尽管发现用替米沙坦的共治疗减小了由特索芬辛产生的舒张压和收缩压的增加,但其不会使得显著防止特索芬辛诱导的高血压(与单独的特索芬辛相比,p>0.05,图6b、图6c)。单独的替米沙坦(3.0mg/kg)对心率和血压不具有影响(图6)。
讨论
体重减轻通常伴随着感知饥饿和食欲感觉的增加,其已经被确定为体重回复的重要预测因子,并且因此,认为抑制食欲功能对于维持体重减轻非常重要。
最近的临床和临床前报告已经表明:特索芬辛通过引发饱腹感和充满感,起强烈食欲抑制剂的作用,这被认为是特索芬辛的强烈的抗肥胖效应下的关键机制。因此,遥测大鼠中的关于特索芬辛诱导的食欲减退的本数据进一步支持该观点。取决于所给予的剂量,特索芬辛剂量依赖性地引发持续最高达12-48小时的快速降低食欲反应。特索芬辛的长效食欲衰退效果提示:特索芬辛的生物活性初级m1代谢物(也是三重mri)有助于大鼠的降低食欲和体重下降效应,由于m1代谢物表现出在啮齿类中显著较高的稳态浓度和较长的t1/2。
相反,与特索芬辛的那些相比,m1的人类稳态血浆浓度约低60%,暗示m1对于所有活性的贡献可能在人类中较低。此外,建议的是增加的能量代谢可以潜在地有助于由特索芬辛诱导的强烈的体重减轻。因此,近来的呼吸测热量测定(calorimetry)研究表明在超重或适度肥胖的人中,经短期特索芬辛治疗之后,脂肪氧化和夜间产热的适度上升。同样,尽管在慢性特索芬辛治疗方案中dio大鼠示出体重的长期持续降低,食欲不振在治疗的第一周期间最为显著,随后是逐渐发展的对特索芬辛的抑制食欲效应的耐性,由此间接符合临床发现。
在本研究中,在第一个12小时黑暗阶段过程中特索芬辛剂量依赖性地增加自发活动,并且其可以由此推测增强的自发活动可以有助于遥测的大鼠的体重减轻,例如,通过引起觅食行为或能量消耗方面的变化。然而,与特索芬辛诱导自发活动的能力(高达12小时)相比,特索芬辛的降低食欲效果更有效且更持久(最高达48小时)。在该方面,可能的是对于食物摄取和自发活动的不同的短时间的药效(pharmacodynamics)与特索芬辛的药物代谢动力学有关。
与特索芬辛相比,m1代谢物具有较长的t1/2(参见以上),具有对多巴胺摄取转运蛋白抑制的4倍或5倍较低的体内潜能,这支持该代谢物不会显著有助于特索芬辛诱导的自发活动。同样,美托洛尔完全阻止特索芬辛的运动刺激效应而没有影响特索芬辛对于食欲不振和体重减少的效力的证据表明:适度增加自发活动不会促进能量代谢的上升。从这些数据,我们推断自发活动效应对于特索芬辛的食欲抑制和体重减轻效果不具有影响。此外,可以推测美托洛尔通过对于纹状体(striatal)多巴胺能神经传递间接作用拮抗特索芬辛诱导的自发活动,因为报导不同的β1阻滞剂抑制大鼠纹状体多巴胺释放。
在清醒并且自由移动的大鼠中,特索芬辛的心血管影响的临床前发现与临床发现一致,也示出在比升高舒张压和收缩压所需的较低剂量水平下的心率的显著剂量依赖性升高。值得注意的是,急性给予特索芬辛之后,心血管影响比降低食欲效应耐久。由于特索芬辛和m1代谢物示出体外去甲肾上腺素重摄取的等效抑制,可能的是m1代谢物有助于特索芬辛的心血管影响。
由于通过美托洛尔共给予阻滞β1肾上腺素受体完全防止特索芬辛的心血管影响,这强烈表明特索芬辛的去甲肾上腺素能重摄取抑制组分是针对特索芬辛的心血管不良影响的最重要的标准。
在本报告中没有解决特索芬辛是否将差别地影响肥胖大鼠中的血压和心率,并且必须等待进一步的研究。还应当注意的是,本观察限于特索芬辛的急性效应,并且不排除慢性特索芬辛治疗之后遥测大鼠中的心血管参数方面的变化可能更接近模拟临床发现。同样良好的符合临床和临床前报告,在遥测的大鼠中,特索芬辛产生强烈的降低食欲响应伴随着相应的体重减轻。使用用食物喂养的正常体重的大鼠,本研究中观察到的特索芬辛诱导的食欲不振和体重降低的效力和时间模式是根据dio大鼠中的类似的发现,表明特索芬辛的急性抗肥胖效应还可以在遥测的非肥胖大鼠中研究。
总体而言,用于本研究中的体内试验设置允许以实时模式先进地同步监测心血管和食物摄取参数,代表针对同时研究抗肥胖药物的临床相关抗肥胖和生命体征效应的合理且有效的方法学。
有趣地是,目前的结果提示特索芬辛+β1阻滞剂组合治疗与西布曲明(5-羟色胺和去甲肾上腺素重摄取双重抑制剂)相比的不同的药效曲线。西布曲明表现出肥胖患者中的相当温和的体重减轻,并且显著升高肥胖患者的心率和血压,这构成了西布曲明的临床应用中的主要关注。
肥胖高血压患者的临床研究表明,西布曲明治疗分别与组合的ca2+通道拮抗剂+ace抑制剂或美托洛尔+氢氯噻嗪(hydrochlorothiazide)治疗,显著减弱了西布曲明的抗肥胖效果。后者组合最负面地影响了西布曲明的体重降低效力,这可以通过β-阻滞剂可以诱导本身体重增加的常见观察解释。
相反,在关于血压正常肥胖患者的研究中美托洛尔治疗不会显著地干扰西布曲明的抗肥胖和代谢效应,迄今为止遗留的尚未解决的是组合的β1阻滞剂治疗是否可行以减少肥胖患者中的西布曲明的心血管不利影响。在该背景中,应当注意的是,据信西布曲明的降低食欲效应与受刺激的α1-和β1-肾上腺素受体功能紧密相关,由于西布曲明诱导的食欲降低分别被哌唑嗪和美托洛尔拮抗。
来自这些研究的暗示可能是,当与β阻滞剂组合以改善任何交感神经的心血管影响时,具有去甲肾上腺素能活性的抗肥胖药物将潜在地具有较小的抗肥胖效力。然而,本研究提示由于与美托洛尔的组合治疗不影响特索芬辛的抗肥胖效果,这可能不适合特索芬辛的情况。因此,该观察表明特索芬辛的两个不同且重要的作用机理之间的清晰的药效学分离,即与β1肾上腺素受体刺激相关的抗肥胖效应和与增强的β1肾上腺素受体功能相联系的心血管影响。建议特索芬辛的β1肾上腺素受体效应次要于导致抑制下丘脑内食欲信号环路以唤起饱腹感反应的下丘脑突触性(hypothalamicsynaptic)去甲肾上腺素再摄取的阻塞。
相反,最可能的是通过增加的外周去甲肾上腺素能紧张(tonus)介导特索芬辛的心血管影响。同样与西布曲明相反的是,特索芬辛的抑制食欲效应需要刺激β1肾上腺素受体和多巴胺d1受体功能以在dio大鼠中获得完全的食欲抑制活性,因此,间接指向特索芬辛治疗使得招募多巴胺能神经传递的可能性。由于肥胖人类受试者具有被认为鼓励(instigate)过食行为以补偿降低的快乐驱动(hedonicdrive)的受损的中枢性多巴胺能活性的参数,这是相关的。
在健康的人类志愿者中,特索芬辛以引起肥胖个体的重量减轻的剂量阻断神经元多巴胺摄取转运蛋白(dat)。该发现表明特索芬辛的多巴胺增强效应与介导重量减少效应有关(beinvolvedin)。
总之,我们证明组合的特索芬辛和美托洛尔治疗保留了大鼠中的特索芬辛的抗肥胖效力同时还防止心率和血压的升高。这些发现引起这样的可能性:与特索芬辛组合的抗高血压治疗也将在肥胖患者中有效。
- 还没有人留言评论。精彩留言会获得点赞!