一种化合物制备治疗神经源性炎症药物中的应用的制作方法
本发明属于化学医药领域。具体地说是涉及左旋紫堇达明在治疗神经源性炎症等领域的应用,特别是左旋紫堇达明在抑制外周神经源性炎症治疗神经系统疾病中的应用。
背景技术
神经源性炎症是包含一系列血管和非血管炎症反应的复杂炎症反应,导致感觉神经元激活,释放多种炎性介质,诱发炎症反应[1]。损伤、病原体、有害刺激物可导致炎症细胞聚集促进多种细胞释放大量炎症介质,作用于初级感觉神经元,激活胞外调节激酶(erk)、c-jun氨基末端激酶(jnk)、蛋白激酶a、蛋白激酶c等多种信号通路,促进神经元释放p物质(sp)、降钙素基因相关肽(cgrp)、谷氨酸等神经递质,诱发炎症反应,称为神经源性炎症[2]。持续的外周伤害性刺激会导致神经源性炎症的持续激活,其典型特征如肿胀、发红和水肿,感觉神经元释放的sp、cgrp等神经递质可促进感觉神经元部位的神经炎症。急性神经源性炎症有助于机体清除有害刺激物,促进损伤修复,但严重或长时间的有害刺激可导致慢性神经源性炎症反应的发生,与多种慢性疾病如哮喘、心肌缺血、银屑病等密切相关。
神经生长因子(nervegrowthfactor,ngf)是最早发现的神经营养因子之一,广泛分布于外周施旺细胞、中枢神经细胞、骨骼肌以及腺体中,在胚胎发育、免疫调节中具有重要作用。在胚胎和幼年动物体内,ngf主要由靶组织(包括皮肤、肌肉和血管组织)内神经合成分泌,促进神经纤维生长、分化和损伤修复;成年机体神经系统内ngf水平极低,而炎症条件下多种免疫细胞可产生ngf,包括巨噬细胞、t细胞、肥大细胞、中性粒细胞等,il-1β、tnfα、干扰素γ、前列腺素pgd2等均可促进神经细胞、炎性细胞、气道结构细胞表达分泌ngf,发挥重要的生理功能[3,4]。
大量研究表明,炎症部位ngf含量显著增加。例如在多发性硬化症患者脑脊液、类风湿关节炎患者滑膜液体及系统性红斑狼疮患者的血清中ngf含量显著增加[5-7];在弗氏佐剂和角叉菜胶诱发的关节炎动物模型,nzb/w小鼠(一种人类sle的自发模型)实验性自身免疫性脑脊髓炎模型中,ngfmrna表达和蛋白水平升高;在间质性膀胱炎、变应性哮喘、春季角膜结膜炎、克罗恩病和结肠炎、银屑病等炎症性疾病中ngf水平显著上调。ngf高亲和力受体trka主要表达于外周drg伤害性初级神经元、交感神经和免疫细胞膜表面[4,8,9]。组织损伤或炎症导致外周组织释放大量炎症因子如il-1、tnfα促进ngf产生和释放。一方面,ngf能够直接作用于机体免疫细胞,造成免疫功能紊乱,另一方面,ngf被神经突触转运到脊髓背根节细胞中储存,刺激神经节细胞合成神经肽p物质等神经肽类物质增多,增强伤害感受性神经元兴奋性,导致神经源性炎症。另外,ngf还可作用于气道效应细胞(上皮细胞、平滑肌细胞等)触发气道神经源性炎症反应,而炎症反应又可以进一步上调机体ngf的水平,从而形成正反馈循环[10]。因此抑制ngf水平减弱神经源性炎症对于治疗神经-免疫系统疾病如哮喘、心肌缺血等疾病具有重要意义。
技术实现要素:
本发明的目的在于提供左旋紫堇达明在抑制神经源性炎症中的应用。
具体的,本发明涉及以下技术方案:
左旋紫堇达明在制备治疗神经源性炎症药物中的应用。
左旋紫堇达明制备治疗神经源性炎症引起的哮喘药物中的应用。
有益效果
左旋紫堇达明可通过下调外周ngf转录和蛋白水平,及下调巨噬细胞和施旺细胞分泌的ngf,抑制jnk、erk及p65磷酸化表达,下调炎症因子tnf-α、il-1β水平等途径实现的缓解神经源性炎症,如缓解坐骨神经压迫损伤及完全弗氏佐剂诱导诱导的神经源性炎症。此外左旋紫堇达明可通过下调ngf水平抑制气道神经源性炎症引起的哮喘。
附图说明
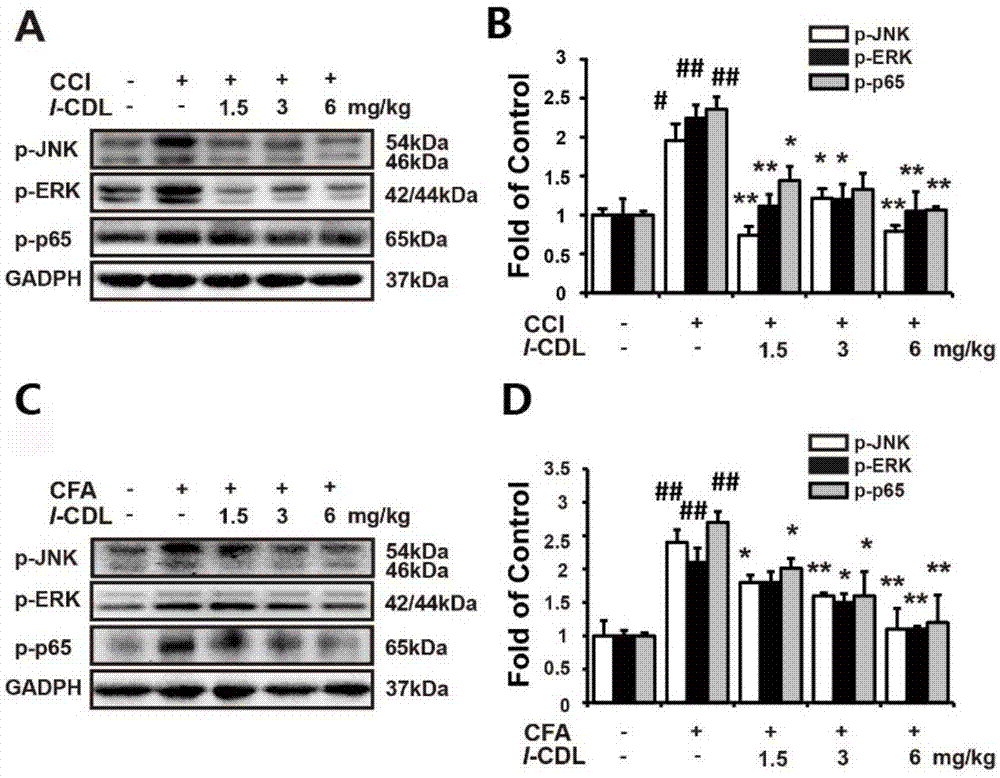
图1为局部坐骨神经周肌肉给药模式下,l-cdl对慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的p-jnk、p-erk、p-p65影响的示意图;其中a为l-cdl对慢性坐骨神经压迫损伤的westernblotting结果,b为l-cdl对慢性坐骨神经压迫损伤的wb灰度值;c为完全弗氏佐剂炎性模型诱导的westernblotting结果;d为完全弗氏佐剂炎性模型诱导的wb的灰度值
图2为局部坐骨神经周肌肉给药模式下,l-cdl对慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的il-1β、tnfα影响的示意图。
图3为局部坐骨神经周肌肉给药模式下,l-cdl对慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的ngf作用的示意图。
图4为体外细胞水平,l-cdl对lps诱导rsc96和raw264.7细胞分泌的ngf作用的示意图。
图5为在动物在体水平,足底给予ngf对l-cdl下调慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的p-jnk、p-erk、p-p65影响示意图;其中足底给予ngf对l-cdl下调慢性坐骨神经压迫损伤的wb结果,b为足底给予ngf对l-cdl下调慢性坐骨神经压迫损伤的结果;c为足底给予ngf对l-cdl下调完全弗氏佐剂炎性模型诱导的wb结果,d为足底给予ngf对l-cdl下调完全弗氏佐剂炎性模型诱导的灰度值结果;
图6为在动物在体水平,足底给予ngf对l-cdl下调慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的il-1β、tnfα影响的示意图。
图7为在动物在体水平,灌胃给予l-cdl对ova致敏诱导的豚鼠哮喘影响的示意图。
图8为在动物在体水平,灌胃给予l-cdl对ova致敏哮喘模型诱导的肺泡灌洗液中上调的ngf影响的示意图。
具体实施方式
以下实施例中l-cdl为左旋紫堇达明,购自sigma;
实施例1、l-cdl能够下调慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的ngf
1.试验动物:
健康雄性sd大鼠,清洁级,体重为180-220g,由扬州大学动物中心提供。实验动物饲养于12h-12h昼夜交替的独立环境中,室温维持在24±2℃,自由饮水和摄食,在适应环境1周后进行实验。
2.试验药品及试剂:
tris、temed、β-mercaptoethanol、甘氨酸、吐温-20sds、30%acrylamide/bis、ammoniumpersulfate、gapdh购自sigma;marker购自thermo;溴酚蓝、甘油、bovineserumalbumin购于sunshine;甲醇、氯化钠、丙三醇购于南京化学试剂有限公司;免疫印迹抗体p-jnk、p-erk、p-p65购自cellsignaling;anti-rabbit、anti-mouse购于cellsignaling;ripa裂解液购自beyotimebiotechnology;ecl发光液购自pierce;ngfelisa试剂盒购自r&d公司;三氯甲烷、异丙醇、无水乙醇购于南京化学试剂有限公司;trizol、depc、ripa裂解液购自beyotimebiotechnology。
3.试验方法
3.1l-cdl给药剂量及方法:l-cdl研磨成粉末,药用玉米油研磨制成混悬液,剂量分别为1.5、3、6mg/kg;手术侧坐骨神经周肌肉注射。
3.2坐骨神经慢性压迫损伤模型(cci):成年健康sd大鼠适应环境3-5天后,10%水合氯醛麻醉。大鼠翻正反射消失后于大鼠左后肢剪毛,消毒,在股骨外侧剪开皮肤,钝性分离肌肉组织,暴露坐骨神经,沿坐骨神经主干方向游离约4cm,羊肠线结扎坐骨神经4道间距约1mm正反结;逐层缝合肌肉、皮肤。14天后造模成功。sd大鼠随机分为5组,分别为空白对照组、cci组、cci-l-cdl低剂量给药组、cci-l-cdl中剂量给药组和cci-l-cdl高剂量给药组,给药组大鼠在造模14天后坐骨神经周注射l-cdl1.5、3、6mg/kg2小时后取材制备样品。
3.3完全弗氏佐剂(cfa)炎性模型:成年健康sd大鼠适应环境3-5天后,10%水合氯醛麻醉。左后肢足底皮下注射完全弗氏佐剂(freund’sadjuvantcomplete,cfa)100μl,3-5天后cfa炎性模型建立成功。空白对照组大鼠左后肢足底注射相同体积生理盐水作为模型组对照。sd大鼠随机分为5组,分别为空白对照组、cfa组、cfa-cdl低剂量给药组、cfa-cdl中剂量给药组和cfa-cdl高剂量给药组,给药组大鼠在造模5天后坐骨神经周注射cdl1.5、3、6mg/kg2小时后取材制备样品。
3.4elisa检测组织样品ngf含量:大鼠给药2h后麻醉,取左侧l4-l6drg,加入适量裂解液,三次匀浆处理,12000g×15min离心,取上清,按照试剂盒说明书进行检测。
3.5qpcr检测drg内ngf蛋白和mrna表达水平
组织rna提取:大鼠给药2h后麻醉,取左侧l4-l6drg,加入1mltrizol吹打数次,室温放置10min,每管加入200μl氯仿,室温5min,12000rpm×15min4℃离心。离心后,取400μl的水相于新的离心管中。加入400μl的异丙醇,温和颠倒混匀,静置15min后,12000rpm/min4℃离心15min。弃上清,加入1ml75%乙醇,温和上下颠倒混匀20s,7500rpm/min4℃离心10min。弃上清,将装有rna沉淀的离心管置于通风橱中自然干燥10min,用depc水20μl溶解rna,保存于-20℃。用nanodrop微量分光光度计测定rna浓度并通过260/280值鉴定质量。
逆转录:采用20μl的oligo(dt)逆转录酶体系将mrna反转录成cdna:10μlr-mix,1μle-mix,1μloligo(dt),6μlrnasefreeh2o,2μlrna样本。通过pcr仪进行逆转录,条件设定为50℃15min,85℃2min。
qpcr:采用20μl体系进行qpcr:2×sybrgreenfastmastermix10μl,h2o6.6μl,forward1μl,reverse1μl,roxreferencedye0.4μl,dna模板1μl。95℃预变性5min+40个pcr循环(95℃变性3s,60℃退火15s)+meltcurve(95℃15s,60℃60s,95℃15s)。扩增完毕后进行熔解曲线和扩增曲线分析,并将其转换为ct值。各样本ct值均减去样本内参gapdh的ct值校准,利用公式2-δδct进行相对定量分析。各目的基因引物序列见表1。
表1引物序列
4.实验结果描述:
图3a、b和c、d分别为elisa和qpcr检测drg内ngf蛋白和mrna表达水平。cci和cfa造模后,drg内ngf转录和蛋白表达显著上升,坐骨神经周给予不同剂量l-cdl能够不同程度下调ngf蛋白和mrna表达水平,呈剂量依赖性,其中高剂量的紫堇达明(6mg/kg)效果最好。(n=6,与空白组相比,##p<0.01,###p<0.001;与模型组相比,*p<0.05,**p<0.01,***p<0.001)。
实施例2l-cdl能够抑制慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的p-jnk,p-erk,p-p65
1.实施例1给药后的模型大鼠,进行免疫印迹(westernblotting)检测:大鼠给药2h后,取大鼠l4-l6脊髓节段drg加入裂解液,三次匀浆处理,12000rpm×15min4℃离心,取上清,加入5×loadingbuffer,沸水浴6min,降至室温后放入-20℃保存。取50μg蛋白样品,上样于10%sds-page进行凝胶电泳,4℃110v电转60min。5%bsa-tbs封闭2小时后,分别加入一抗(1:1000)室温孵育3h,4℃过夜,tbst洗涤10min×3,加入二抗,室温下孵育2h,tbst洗涤10min×3,加入ecl发光底物显色。用分子显影仪(geldoctmxr,170-8170)联合quantityone-4.6.5(bio-radlaboratories)软件分析数据。用目的蛋白灰度值与胞浆蛋白内参gapdh灰度值之比进行半定量分析。
2.实验结果描述
如图1所示,图a-d为westernblotting检测cci和cfa炎性模型drg内p-jnk、p-erk、p-p65蛋白表达水平。结果显示,cci和cfa炎性模型中,p-jnk、p-erk、p-p65表达升高(与空白组相比,#p<0.05,##p<0.01),而l-cdl能够显著抑制cci和cfa炎性模型drg中上调的p-jnk、p-erk、p-p65蛋白表达水平(与模型组相比,*p<0.05,**p<0.01),其中,l-cdl高剂量组蛋白水平接近空白组水平。
实施例3、l-cdl能够抑制慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导的外周drg内上调的il-1β、tnfα
1试验药品及试剂:
ripa裂解液购自beyotimebiotechnology;il-1β、tnfαelisa试剂盒购自r&d公司。
2.试验方法
实施例1给药后的模型大鼠,进行elisa检测各组大鼠drg内il-1β、tnfα蛋白水平变化:大鼠给药2h后麻醉,取左侧l4-l6脊髓节段drg,加入适量裂解液,三次匀浆处理,12000g×15min离心,取上清,按照试剂盒说明书进行检测。
4.实验结果描述
图2为elisa检测cci和cfa炎性模型drg内il-1β、tnfα蛋白表达水平。结果显示,cci和cfa炎性模型中,il-1β、tnfα表达升高(与空白组相比,##p<0.01,###p<0.001),而l-cdl能够显著抑制cci和cfa炎性模型drg中上调的il-1β、tnfα蛋白表达水平(与模型组相比,*p<0.05,**p<0.01),其中,l-cdl高剂量组蛋白水平接近空白组水平。
实施例4、l-cdl能够下调lps诱导的rsc96和raw264.7细胞分泌ngf
1.细胞株:
rsc96施旺细胞:购自齐氏生物科技公司。
raw264.7巨噬细胞:购自齐氏生物科技公司。
2.试验药品及试剂:
ngfelisa试剂盒购自r&d公司;trypsin-edta购自sigma;dmem,胎牛血清购自gibco;ripa裂解液购自beyotimebiotechnology。
3.试验方法
给药剂量:称取cdl34.1mg,溶于100μldmso中,此时浓度为终浓度10μm的100000倍,以dmem等比稀释至1、3、10μm浓度,现配现用。lps,溶于dmso溶液,配制为10mg/ml(终浓度10μg/ml的1000倍)。
elisa检测细胞上清中ngf蛋白含量:细胞接种于24孔板,分为5组,空白组、lps组、lps-l-cdl低剂量给药组、lps-l-cdl中剂量给药组和lps-l-cdl高剂量给药组,给药前30min换成无血清培养基,加入相应浓度l-cdl后15min,加入lps。孵育24小时后收集细胞上清,离心取上清,按照elisa试剂盒说明书检测ngf。
4.实验结果描述
如图4所示,rsc96施旺细胞和raw264.7巨噬细胞在lps刺激下,ngf含量显著上调(与空白组相比,###p<0.001),而l-cdl能够显著抑制lps诱导rsc96和raw264.7上调的ngf蛋白水平(与lps组相比,*p<0.05,**p<0.01)。
实施例5、足底给予ngf可取消l-cdl下调慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导外周drg内上调的p-jnk、p-erk、p-p65
1.试验动物:
健康雄性sd大鼠,清洁级,体重为180-220g,由扬州大学动物中心提供。实验动物饲养于12h-12h昼夜交替的独立环境中,室温维持在24±2℃,自由饮水和摄食,在适应环境1周后进行实验。
2.试验药品及试剂:
ngf购自r&d公司;tris、temed、β-mercaptoethanol、甘氨酸、吐温-20sds、30%acrylamide/bis、ammoniumpersulfate、gapdh购自sigma;marker购自thermo;溴酚蓝、甘油、bovineserumalbumin购于sunshine;甲醇、氯化钠、丙三醇购于南京化学试剂有限公司;免疫印迹抗体p-jnk、p-erk、p-p65购自cellsignaling;anti-rabbit、anti-mouse购于cellsignaling;ripa裂解液购自beyotimebiotechnology;ecl发光液购自pierce。
3.试验方法
l-cdl给药剂量及方法:l-cdl研磨成粉末,药用玉米油研磨制成混悬液,剂量分别为1.5、3、6mg/kg;手术侧坐骨神经周肌肉注射。ngf粉末以pbs溶解配制成母液10μg/ml,以pbs稀释到终浓度(0.1μg/30μl),造模侧后肢足底皮下注射;
sd大鼠随机分为4组,分别为空白对照组、模型组、模型-l-cdl高剂量给药组、ngf-l-cdl高剂量给药组,造模成功后ngf-l-cdl高剂量给药组大鼠在足底注射ngf(0.1μg/30μl/只)15min后坐骨神经周给予l-cdl,2h后麻醉取材制备免疫印迹样品,进行sds-page电泳,转膜,封闭2h,孵育一抗过夜,洗涤3次,孵育二抗2h,显影拍照,统计结果。
4.实验结果描述:
如图5中a-d所示,cci和cfa炎性模型drg内p-jnk、p-erk、p-p65表达升高,而l-cdl能够显著抑制cci和cfa炎性模型drg中上调的p-jnk、p-erk、p-p65蛋白表达水平,ngf可取消l-cdl下调cci和cfa炎性模型drg中上调的p-jnk、p-erk、p-p65作用。(n=6,与模型组相比,*p<0.05,**p<0.01;与l-cdl组相比,&p<0.05)。
实施例6、足底给予ngf可取消l-cdl下调慢性坐骨神经压迫损伤和完全弗氏佐剂炎性模型诱导外周drg内上调的il-1β、tnfα
1.试验动物:
健康雄性sd大鼠,清洁级,体重为180-220g,由扬州大学动物中心提供。实验动物饲养于12h-12h昼夜交替的独立环境中,室温维持在24±2℃,自由饮水和摄食,在适应环境1周后进行实验。
2.试验药品及试剂:
l-cdl,实验室自制,纯度99.9%;ngf购自r&d公司;ripa裂解液购自beyotimebiotechnology;il-1β、tnfαelisa试剂盒购自r&d公司。
3.试验方法
sd大鼠随机分为5组,分别为模型组、模型-l-cdl高剂量给药组,ngf-l-cdl高剂量给药组,造模成功后ngfl-cdl高剂量给药组大鼠在足底注射ngf(0.1μg/30μl/只)15min后坐骨神经周给予l-cdl,2h后麻醉取材制备elisa样品,按照elisa说明书检测蛋白水平。
4.实验结果描述:
如图6所示,cci和cfa炎性模型drg内il-1β、tnfα表达升高,而l-cdl能够显著抑制cci和cfa炎性模型drg中上调的il-1β、tnfα蛋白表达水平,ngf可取消l-cdl对il-1β、tnfα的抑制作用。(n=6,与模型组相比,*p<0.05,**p<0.01;与l-cdl组相比,&p<0.05,&&p<0.01)。
实施例7、灌胃给予l-cdl可缓解ova致敏诱导的豚鼠哮喘
1.试验动物:
健康雄性豚鼠,清洁级,体重为180-220g,由扬州大学动物中心提供。实验动物饲养于12h-12h昼夜交替的独立环境中,室温维持在24±2℃,自由饮水和摄食,在适应环境1周后进行实验。
2.试验药品及试剂:
10%卵蛋白溶液购自上海君瑞生物技术公司;ova购自美国sigma公司。
3.试验方法
实验第1天腹腔注射10%卵蛋白溶液,注射量为1ml/100g,第5天加强致敏一次。第14天将豚鼠依次置于自制的雾化箱中,用超声波雾化器以1ml/min,持续喷入1%ova溶液雾化激发2min,观察豚鼠行为变化(引喘成功的判定标准为:致敏豚鼠出现呼吸频率加快,点头呼吸、咳嗽等症状),并记录豚鼠引喘潜伏期(引喘潜伏期测定:激发后,豚鼠出现喘息急促、腹部明显收缩,则为出现哮喘症状,以激发后第一次出现该症状的时间作为引喘潜伏期),筛选出符合标准的豚鼠,随机分为5组,分别为模型组(ova)(灌胃等剂量的生理盐水)、ova-l-cdl低剂量(7.5mg/kg)给药组、ova-l-cdl中剂量(15mg/kg)给药组和ova-l-cdl高剂量(30mg/kg)给药组、阳性药地塞米松(5mg/kg)。第15天起开始灌胃给药,连续7天,每天给药2h后,以1ml/min持续喷入1%ova溶液1min,记录给药第7天各组豚鼠的哮喘潜伏期。
4.实验结果描述:
如图7所示,与模型组比较,给药7天后低、中、高剂量l-cdl组豚鼠的引喘潜伏期明显延长,差异显著,呈剂量依赖性;高剂量l-cdl组引喘潜伏期接近于阳性药地塞米松组,无显著差异。以上数据表明l-cdl可显著缓解ova致敏诱导的豚鼠哮喘(n=6,与模型组相比,*p<0.05,**p<0.01)。
实施例8、灌胃给予l-cdl可下调ova致敏哮喘模型诱导的肺泡灌洗液中上调的ngf
健康雄性豚鼠,清洁级,体重为180-220g,由扬州大学动物中心提供。实验动物饲养于12h-12h昼夜交替的独立环境中,室温维持在24±2℃,自由饮水和摄食,在适应环境1周后进行实验。
2.试验药品及试剂:
l-cdl,实验室自制,纯度99.9%;10%卵蛋白溶液,;ova,美国sigma公司;ngfelisa试剂盒购自r&d公司。
3.试验方法
豚鼠随机分为5组,分别为空白对照组(灌胃等剂量的生理盐水)、模型组(ova)(腹腔注射等剂量的生理盐水)、ova-l-cdl低剂量(7.5mg/kg)给药组、ova-l-cdl中剂量(15mg/kg)给药组和ova-l-cdl高剂量(30mg/kg)给药组。豚鼠按照实施例7试验方法进行造模,并从第15天起开始灌胃给药,连续7天,每天给药2h后,先将大鼠禁食24h,10%水合氯醛麻醉,开胸取右中肺组织,迅速将右主支气管结扎。左肺行支气管肺泡罐洗术,分两次进行,分别灌入0.9%nacl4、3ml,共计7ml。每次灌注完毕,轻揉肺叶1~2min,再回收balf,将两次收集的balf均匀混合,回收液以1500r/min离心5min,取上清液,-20℃贮存待检测。elisa试剂盒检测ngf含量。
4.实验结果描述:
如图8所示,与空白组相比,ova致敏哮喘模型豚鼠肺泡中ngf表达升高,而l-cdl可剂量依赖性地下调ngf水平(n=6,与空白对照组相比,###p<0.001;与模型组相比,*p<0.05,**p<0.01,***p<0.001)。
参考文献
[1]geppettip,nassinir,materazzis,etal.theconceptofneurogenicinflammation[j].bjuint,2008,101suppl3:2-6.
[2]richardsonjd,vaskomr.cellularmechanismsofneurogenicinflammation[j].jpharmacolexpther,2002,302(3):839-45.
[3]skapersd.nervegrowthfactor:aneuroimmunecrosstalkmediatorforallseasons[j].immunology,2017,151(1):1-15.
[4]boninis,rasig,bracci-laudieroml,etal.nervegrowthfactor:neurotrophinorcytokine?[j].intarchallergyimmunol,2003,131(2):80-4.
[5]aloel,tuverima,carcassiu,etal.nervegrowthfactorinthesynovialfluidofpatientswithchronicarthritis[j].arthritisrheum,1992,35(3):351-5.
[6]bracci-laudierol,aloel,levi-montalcinir,etal.increasedlevelsofngfinseraofsystemiclupuserythematosuspatients[j].neuroreport,1993,4(5):563-5.
[7]laudierob,aloel,levi-montalcinir,etal.multiplesclerosispatientsexpressincreasedlevelsofβ-nervegrowthfactorincerebrospinalfluid[m].1992.
[8]aokiy,ohtoris,takahashik,etal.innervationofthelumbarintervertebraldiscbynervegrowthfactor-dependentneuronsrelatedtoinflammatorypain[j].spine(philapa1976),2004,29(10):1077-81.
[9]millerfd,speelmana,mathewtc,etal.nervegrowthfactorderivedfromterminalsselectivelyincreasestheratioofp75totrkangfreceptorsonmaturesympatheticneurons[j].devbiol,1994,161(1):206-17.
[10]钟雪莺,龙发,张永昶.神经生长因子与哮喘气道炎症[j].国际呼吸杂志,2006,26(5):329-32.
- 还没有人留言评论。精彩留言会获得点赞!