一种基于天然色素的无载体纳米药物的制备方法及应用与流程
本发明涉及生物医药技术领域,特别涉及一种基于天然色素的无载体纳米药物的制备方法及应用。
背景技术
癌症(cancer)通常又称为恶性肿瘤,在发达国家和发展中国家都是导致人类死亡的主要原因,并且随着全球人口不断增长和老龄化的日益严重,以及人们过度肥胖、缺乏锻炼、抽烟、经济发展等因素都将会导致癌症患者人数的不断增加。目前肿瘤的治疗方法主要有:化疗、手术切除、放疗、光动力治疗、基因治疗等。
灵菌红素(prodigiosin,pg)是由细菌、放线菌(actinomycetes)等产生的一种典型的生物碱类次级代谢产物,是一类具有三砒咯环结构的天然红色素的总称。灵菌红素具有多样的生物活性,包括抗菌、抗真菌、抗疟疾、抗细胞毒性、抗癌、抗肿瘤转移、免疫抑制活性等。近年来,研究者发现灵菌红素在癌症治疗方面具有一定的功效,一直用于体外多种抗肿瘤细胞系的试验,并且在抑制肺癌转移方面也取得了一定的进展。因此灵菌红素在医药领域具有广泛的应用前景,市场价值极高。尽管灵菌红素的药物活性得到了广泛的认同,但其疏水性强,在水中几乎不溶解,导致其体内生物利用度低,严重影响了其在临床上的广泛使用。
为了解决化疗药物水溶性不好,没有靶向性,且生物利用度低等限制因素,纳米载体如脂质体,胶束,介孔二氧化硅,金纳米粒子等被用于提高癌症的治疗。然而,纳米载体的制备极其复杂,纳米载体的降解,代谢和排泄可引起显着的毒性问题。因此,开发“绿色”方法以获得没有“有毒”溶剂或纳米载体的纳米药物制剂是非常重要的。
本专利基于疏水性药物灵菌红素,在水中自组装形成具有肿瘤靶向性的无载体纳米粒,从而达到抗肿瘤作用,更重要的是解决了纳米载体带来的诸多临床安全性问题。
技术实现要素:
基于天然色素的无载体纳米药物是由一种天然抗癌药物灵菌红素通过一种绿色、简单的自组装方法自组装而成。利用高通透性和滞留效应(epr效应)可以准确的到达肿瘤组织,从而将药物选择性地运送到肿瘤部位,把药物效应尽量限定在肿瘤细胞上,而不对正常组织产生损害,达到抗肿瘤效果。
本发明的目的在于提供一种基于天然色素的无载体纳米药物的制备方法,另一目的是提供无载体纳米药物在制备防治肿瘤药物中的应用。
为实现上述目的,本发明采用的技术方案如下:
所述的基于天然色素的无载体纳米药物是通过自组装技术由疏水性天然色素自组装而成。
所述的疏水性天然色素为灵菌红素。
所述的制备方法包括如下具体步骤:
(1)将灵菌红素溶于良性溶剂a中,得到溶液a,所述溶液a中的灵菌红素浓度范围为1000μm-10000μm,所述良性溶剂a为二氯甲烷、氯仿、乙酸乙酯、乙酸甲酯、丙酮、正丙醇、甲醇、吡啶、乙酸、二甲基亚砜中的一种或多种;
(2)将溶液a缓慢滴入到不良溶剂水中,超声一定的时间后得溶液b,吹干里面的有机溶剂,即得到pg纳米粒。
所述步骤(2)中的超声时间为5-60min。
所述步骤(2)的溶液b中药物灵菌红素的浓度范围为10μm-640μm。
所述制得的pg纳米药物的粒径为100-200nm。
所述任意一项所制备的无载体纳米药物在制备防治肿瘤药物中的应用。
上述所述的pg的结构式如图式ⅰ所示
式ⅰ
本发明的优点在于:
1、本发明所制备的纳米药物中是由天然抗癌药物灵菌红素自组装而成,对正常细胞毒副作用小,水溶性效果好,又具有良好的抗肿瘤效果;
2、本发明所制备的一种基于天然色素的无载体纳米药物制备过程简单,方便,可以解决传统纳米载体在体内代谢不明确,体系复杂等问题,消除了人工合成载体带来的临床安全性问题,并能为以后新药研发和制备提供新的思路。
3、本发明所制备的一种基于天然色素的无载体纳米药物中的灵菌红素在水中可以通过溶剂交换法自组装成为纳米粒,有效地解决了抗癌药物灵菌红素的水溶性和生物利用度的问题;
4、本发明所制备的一种基于天然色素的无载体纳米药物通过epr效应提高纳米药物在肿瘤部位的集聚作用。
5、本发明的无载体纳米药物在ph7.4生理环境下具有良好的稳定性。
附图说明
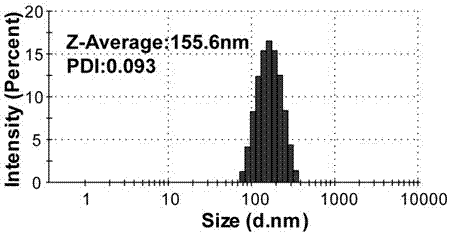
图1为实施例2中pg纳米粒径分布图。
图2为实施例2中pg纳米电势图。
图3为实施例3中pg纳米的紫外吸收。
图4为实施例4中pg纳米的荧光检测图。
图5为实施例5中pg纳米的ph响应结果。
图6为实施例6中pg纳米在不同ph溶液中粒径测定结果。
图7为实施例7中pg纳米对lo2细胞的毒性结果。
图8为实施例8中pg纳米对a549细胞的毒性实验结果。
图9为实施例9中pg纳米对hela细胞的毒性实验结果。
图10为实施10中a549细胞和hela细胞对pg纳米的摄取结果。
具体实施方式
根据下述实施例,可以更好地理解本发明,下面结合具体实施方式对本发明所述的技术方案作进一步的说明,但是本发明不仅限于此。
实施例1灵菌红素纳米的制备方法准确称取0.00324gpg粉末,溶于1ml甲醇中,超声溶解,配置成10mm的溶液;取不同体积的上述溶液溶解在100μl甲醇中,在搅拌过程中逐滴滴加到含有1ml二次水(重蒸水)中(注:滴加过程中进行涡旋),此时pg在溶液中的浓度为10μm-640μm,超声10min后,吹干甲醇,即得pg纳米;并用沉淀的方法测定纳米药物中pg分子的载药量(drugloadingcapacity)。本实施例制备的不同浓度的pg纳米平均粒径、pdi、电势及载药量如表1所示。
表1不同浓度的pg纳米平均粒径、pdi、电势及载药量
实施例2
准确称取0.00324gpg粉末,溶于1ml甲醇中,超声溶解,配置成10mm的溶液;取不同体积的甲醇溶液,在搅拌过程中逐滴滴加到含有1ml二次水(重蒸水)中(注:滴加过程中进行涡旋),此时pg在溶液中的浓度为160μm,超声10min后,吹干甲醇,即得pg纳米;
本实施例制备的pg纳米粒径155.6及电势50.2mv如图1和图2所示。
实施例3
将实施例2制备的pg纳米药物以及相同浓度的pg甲醇溶液通过紫外可见分光光度计进行紫外检测,结果显示本发明制备的纳米抗癌药物仍具有pg特征吸收峰,如图3所示,证明本发明pg自组装形成了pgnps抗癌纳米药物。
实施例4
将实施例2制备的pg纳米药物以及相同浓度的pg甲醇溶液通过荧光检测器进行荧光检测,结果显示本发明制备的纳米药物荧光强度低于相同浓度pg的荧光强度如图4所示,证明了pg自组装形成了pgnps抗癌纳米药物。
实施例5
将实施例2制备的pg纳米粒各取250µl两份于透明玻璃瓶中,然后分别加入ph为5.5和7.4的pbs溶液1750µl,静置6小时,然后用激光笔照射,观察现象,如图5所示。
本案例结果如图5所示,ph5.5的环境中溶液有微弱的丁达尔效应,在ph7.4的情况下纳米药物能够均一的存在,有很强的丁达尔效应,表明pg纳米粒在ph7.4的生理环境下可以稳定存在。
实施例6
将实施例2制备的pg纳米粒各取250µl两份于透明玻璃瓶中,然后分别加入ph为5.5和7.4的pbs溶液1750µl,静置6小时,通过紫外分光光光度计检测其现象,如图6所示。
本案例结果如图6所示,ph5.5的环境中溶液pgnps不稳定,在ph7.4的情况下纳米药物能够均一的存在,表明pg纳米粒在ph7.4的生理环境下可以稳定存在。
实施例7
pg纳米药物的抗癌活性,采用标准mtt法测定freepg和pgnps对lo2细胞的增殖抑制活性,具体步骤为:
(1)取处于对数生长期状态良好的lo2细胞,经胰蛋白酶消化后,计数并调整细胞密度为0.8×个/ml,配成细胞悬液。于每孔100µl接种到96孔板中,周围用nacl封板,置于37℃,5%co2培养箱中培养24h。
(2)弃去旧的培养液,设置不同浓度的药物组和阴性空白细胞对照组,每组设置5个复孔,于培养箱中继续孵育24h。
(3)取出96孔板,在避光条件下,移除培养基,于每孔中加入100µlmtt溶液(无血清、无酚红的rmpi1640培养基:mtt母液=9:1,v:v),继续孵育4h。
(4)取出96孔板终止培养,用移液枪轻轻吸去96孔板中的上清液,每孔加入dmso溶液100µl,振荡摇匀10min,使蓝紫色结晶全部溶解。
(5)用酶标仪于490nm波长处测定每孔的od值,使用graphpadprism5处理实验结果如图7所示。
结果显示,freepg对正常细胞lo2也具有很强的细胞毒性,而pgnps纳米药物减弱了其对正常细胞的毒性。
实施例8
pgnps纳米药物的抗癌活性,通过细胞毒性来实现,采用标准mtt法测定freepg和pgnps对a549细胞的增殖抑制活性,具体步骤见实施例6,其结果显示本发明制备的纳米抗癌药物对hela细胞具有显著的杀伤作用,如图8所示,表明本研究,与freepg相比,在相同浓度下pgnps仍对细胞具有较强的抗肿瘤活性。
实施例9
pgnps纳米药物的抗癌活性,通过细胞毒性来实现,采用标准mtt法测定freepg和pgnps对hela细胞的增殖抑制活性,具体步骤见实施例6,其结果显示本发明制备的纳米抗癌药物对hela细胞具有显著的杀伤作用,如图9所示,表明本研究,与freepg相比,在相同浓度下pgnps仍对细胞具有较强的抗肿瘤活性。
实施例10
观察细胞生长至铺满整个培养瓶底部时消化a549,hela细胞并重悬细胞团为单细胞悬浮液,a549和hela细胞接种在六孔板上,摇晃均匀后置于37℃的二氧化碳培养箱中,孵育24h后,将配制好的freepg和pgnps与细胞共孵育,继续培养2h,吸取培养液,pbs洗两次,用4%的多聚甲醛固定20min,然后用dapi染色20min,最后在激光共聚焦下根据pg的荧光检测摄取情况。结果如图10所示。
结果表明,与freepg相比,pgnps更容易被a549和hela细胞摄取,更容易进入细胞。pgnps通过渗透压进入肿瘤细胞,因此在短时间内能够进入肿瘤细胞,会表现出更强的荧光强度。
- 还没有人留言评论。精彩留言会获得点赞!