一种智能调节血糖的微针贴片及其制备方法与流程
本发明涉及生物医学领域,具体涉及一种智能调节血糖的微针贴片及其制备方法。
背景技术
糖尿病是一种由于体内胰岛素分泌不足或胰岛素生物作用受损,导致体内高葡萄糖的代谢性疾病。其中,1型糖尿病是由于自身免疫性破坏胰腺β细胞导致胰岛素分泌不足,2型糖尿病则是胰岛素抵抗和胰岛素分泌受损的组合。近年来糖尿病日益严重地危害世界公共健康安全。据统计,2017年,全球共有1型和2型糖尿病成年患者约有4.25亿,而中国以1.144亿成人患者成为全球患糖尿病人口最多的国家。
对于1型糖尿病患者和中晚期2型糖尿病患者,传统的治疗方式是采用手指采血、检测血糖,并进行皮下胰岛素注射来治疗。然而,传统的血糖检测需要在手指处扎针取血,反复的刺针采血。这种血糖检测和药物注射的方式不仅给患者带来不便且痛苦,并且患者需要有长期的依从性。更重要的是,葡萄糖传感和药物治疗不直接耦合的常规治疗,无法实现严格调节患者的葡萄糖水平。缺乏严格控制血糖水平的患者常会引发相关包括肢体截肢、失明、肾功能衰竭和致命性低血糖等病症。因此,一种可以减轻患者生理与心理痛苦、可以根据血液中葡萄糖浓度而智能响应递释胰岛素的无痛诊疗方式亟待研究。
技术实现要素:
本发明的目的在于解决现有技术存在的问题,提供一种智能调节血糖的微针贴片及其制备方法。本发明的微针贴片是一种智能的、可实时响应体内血糖浓度释放胰岛素、调节体内血糖达到正常水平的微创式微针阵列贴片。
本发明的目的通过下述技术方案实现:
一种智能调节血糖的微针贴片,其微针部分含有智能调节血糖的药物,所述智能调节血糖的药物包括载体材料、葡萄糖响应的敏感开关因子、药物分子,其载体材料表面接枝葡萄糖响应的敏感开关因子、葡萄糖响应的敏感开关因子表面接枝药物分子。其中,载体材料为金纳米簇颗粒或bsa(牛血清白蛋白)包被的金纳米簇颗粒,葡萄糖响应的敏感开关因子为苯硼酸或其衍生物,药物分子为胰岛素。
所述的智能调节血糖的微针贴片的制备方法,包括以下步骤:
(1)配制生物相容性水凝胶溶液。优选的,所述的生物相容性水凝胶包括明胶/淀粉水凝胶、海藻酸钠水凝胶、透明质酸水凝胶、聚乙烯醇水凝胶等。
(2)往水凝胶溶液中加入上述智能调节血糖的药物得到含药物的水凝胶溶液。
(3)将含药物的水凝胶溶液填充到微针模板的微针中。优选的,该步骤可以通过将含药物的水凝胶溶液加到微针模板表面上使其直接沉积在微针模板表面,再通过离心使含药物的水凝胶溶液填充到微针中。含药物的水凝胶溶液加到微针模板表面后,为了避免溶液中气泡的影响可进一步去除气泡。
(4)将不含药物的水凝胶溶液加到微针模板表面上制备微针贴片的基底部分。优选的,通过离心的方法制备微针贴片的基底部分。水凝胶溶液加到微针模板表面后,为了避免溶液中气泡的影响可进一步去除气泡。
(5)根据水凝胶材料的不同通过合适的方法使水凝胶固化。优选的,水凝胶材料为明胶/淀粉通过干燥进行固化;水凝胶材料为海藻酸钠通过加入钙离子(ca2+)进行固化;水凝胶材料为透明质酸通过紫外照射进行固化;水凝胶材料为聚乙烯醇通过循环冷冻解冻进行固化。
(6)水凝胶固化后进行干燥,干燥完成后,将微针贴片从微针模板上剥离下来,得到智能调节血糖的微针贴片。
本发明的微针贴片采用生物相容性水凝胶材料整合以金纳米簇颗粒为载体的智能调节血糖的药物,使贴片的微针阵列的机械强度明显增加,能够穿刺皮肤,根据体内血糖水平响应释放胰岛素、智能调节血糖水平,实现微创检测与给药。本发明实现了无痛的、智能响应型的血糖调节,有望指导糖尿病的诊疗一体化。
本发明实现了微创的经皮给药方式,并实现了响应型的血糖调节。本发明具有以下优点和有益效果:
(1)利于微机电系统(mems)技术制备微针贴片,有利于实现对皮肤的无痛微创穿刺。微针阵列贴片由生物相容性水凝胶材料组成,应用体内无毒无害;微针贴片内含以金纳米簇颗粒为载体的智能调节血糖的药物,一方面可大幅度提高微针贴片的机械强度,促进其具有更好的皮肤刺穿效果,另一方面该药物载药量高,且能智能响应葡萄糖浓度释放胰岛素、智能调节血糖。
(2)该微针贴片体系能可控调节糖尿病中高血糖的效果,以其特有的载药能力与微创特性,极大地提高了糖尿病的诊疗治疗效果,减轻患者的痛苦。
(3)制备方法简单,反应条件十分温和(常温、常压、水相),极大地保护了药物的活性。
附图说明
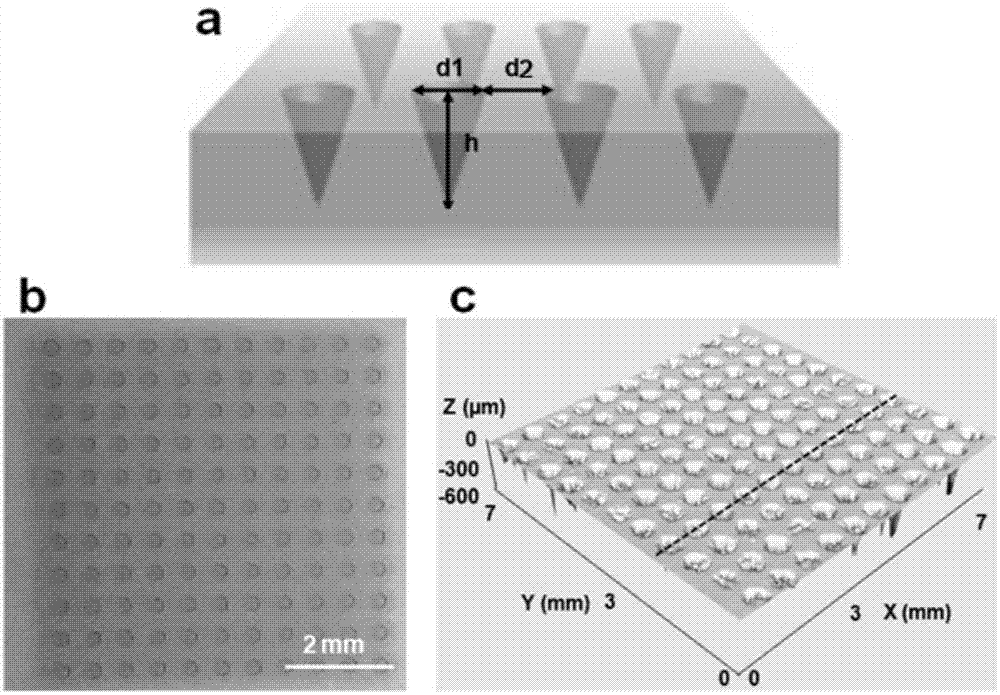
图1是微针模板的结构图。(a)微针模板的设计及参数,模板含11×11阵列的圆锥形的孔洞结构,其中每个圆锥孔的上底面直径d1为300-400μm,高h为600-800μm,相邻圆锥孔之间的距离d2为600μm;(b)微针模板的光镜图;(c)微针模板的3d轮廓扫描图。
图2是微针贴片的制备过程示意图。利用抽真空和离心的方法,将含药物的水凝胶溶液填充到微针模板的微针中;并通过再次离心的方法,用不含药物的水凝胶溶液制备微针贴片的基底,通过合适的方法进行水凝胶材料的固化,干燥后,将微针贴片从模板中剥离。
图3是不同水凝胶材料和固化方法对药物的胰岛素活性的影响结果图。(a)模拟不同温度下明胶固化成胶时对胰岛素活性影响;(b)模拟海藻酸钠交联时对胰岛素活性影响;(c)模拟紫外光固化透明质酸时对胰岛素活性影响;(d)模拟聚乙烯醇交联时对胰岛素活性影响;图中虚线表示对照组的葡萄糖溶液中的葡萄糖初始浓度(7.4mm)。
图4是制备的微针贴片图。(a)微针阵列的实物照片;(b-d)微针阵列贴片的扫描电子显微镜(sem)照片,(b)11×11微针阵列,(c)4×4微针阵列,(d)单根微针。
图5是微针贴片的力学性能图。
图6是微针贴片对皮肤的穿刺实验示意及结果图。(a)皮肤穿刺实验示意图,(b)皮肤穿刺后的光镜图,(c)皮肤穿刺后台盼蓝染色效果图。
图7是微针贴片对皮肤的穿刺效果及皮肤恢复效果测试结果图。(a-d)微针贴片移除后不同时间皮肤恢复效果的光镜图片,(e)微针贴片应用于皮肤1小时后皮肤的h&e染色图片,(f)微针贴片移除30分钟后皮肤的h&e染色图片,(g)微针贴片穿刺皮肤的深度及皮肤恢复后的穿刺深度的统计结果。
图8是不同处理对对1型糖尿病小鼠的体内血糖调节能力的比较结果图。
具体实施方式
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1智能调节血糖的药物的制备
(1)根据申请人的在先专利申请《一种智能释放胰岛素调节血糖的金纳米簇颗粒及其制备方法》(申请号201810075085.8、公开号cn108079282a)中记载的方法制备智能释放胰岛素调节血糖的金纳米簇颗粒(gnc-fpba-insulin或gnc-pba-insulin)。
(2)响应型血糖调节的金纳米簇颗粒(bsa-gnc-pba-insulin)的制备
1)制备bsa包被的金纳米簇颗粒(bsa-gncs)
含haucl4、bsa混合溶液在ph≥12的条件下35-40℃反应10-18h得到bsa包被的金纳米簇颗粒(bsa-gncs)。
2)将bsa表面的氨基转换为羧基
先在bsa-gncs溶液中加入戊二醛,24-26℃反应3-5h,使bsa表面的氨基与戊二醛上的一个醛基反应;再加入ph=8的甘氨酸,24-26℃反应20-40min,使甘氨酸上的氨基与戊二醛上的另一个醛基反应,得到表面不含氨基、仅含羧基的金纳米簇颗粒(bsa-gncs)。
3)活化bsa-gncs表面的羧基
将bsa-gncs加入到含edc、nhs和mes的溶液中,24-26℃反应15min-30min,活化bsa-gncs上的羧基。
4)将4-氨基苯硼酸(pba)接枝到羧基活化后的bsa-gncs
往羧基活化后的bsa-gncs溶液中加入4-氨基苯硼酸,24-26℃反应12-18h,得到pba修饰的金纳米簇颗粒(bsa-gnc-pba)。
5)bsa-gnc-pba上接枝糖基化胰岛素
将糖基化胰岛素(insulin)加入到bsa-gnc-pba溶液中,24-26℃反应18-30h,得到响应型血糖调节的金纳米簇颗粒(bsa-gnc-pba-insulin)。在相同的条件下,bsa-gnc-pba-insulin相对于gnc-fpba-insulin和gnc-pba-insulin降糖效果更好。
上述智能调节血糖的药物gnc-fpba-insulin、gnc-pba-insulin、bsa-gnc-pba-insulin均能根据血糖水平响应释放胰岛素、智能调节血糖水平。gnc-fpba-insulin、gnc-pba-insulin、bsa-gnc-pba-insulin均由载体材料、葡萄糖响应的敏感开关因子、药物分子组成,其载体材料表面接枝修饰葡萄糖响应的敏感开关因子、葡萄糖响应的敏感开关因子表面接枝药物分子。其中,gnc-fpba-insulin、gnc-pba-insulin的载体材料为金纳米簇颗粒,葡萄糖响应的敏感开关因子为4-羧基3-氟苯硼酸(fpba)或4-羧基苯硼酸(pba),药物分子为糖基化胰岛素;bsa-gnc-pba-insulin的载体材料为bsa(牛血清白蛋白)包被的金纳米簇颗粒(bsa-gncs),葡萄糖响应的敏感开关因子为4-氨基苯硼酸(pba),药物分子为糖基化胰岛素。
实施例2智能调节血糖的微针贴片的制备
(1)微针模板
微针模板购自爱尔兰blueacretechnology公司,微针模板由硅树脂材料组成,其设计及尺寸如图1所示:模板含有11×11阵列的圆锥形的孔洞结构,其中每个圆锥孔的上底面直径为300-400μm,高为600-800μm,相邻圆锥孔之间的距离为600μm。
(2)微针贴片的制备
微针贴片的制备包括以下步骤:
1)配制生物相容性水凝胶溶液。如生物相容性水凝胶包括明胶/淀粉水凝胶、海藻酸钠水凝胶、透明质酸水凝胶、聚乙烯醇水凝胶等。
2)往水凝胶溶液中加入智能调节血糖的药物(实施例1中的gnc-fpba-insulin、gnc-pba-insulin或bsa-gnc-pba-insulin)得到含药物的水凝胶溶液。
3)将含药物的水凝胶溶液填充到微针模板的微针中。如可以通过将含药物的水凝胶溶液加到微针模板表面上使其直接沉积在微针模板表面,再通过离心使含药物的水凝胶溶填充到微针中(图2a-c);含药物的水凝胶溶液加到微针模板表面后,为了避免溶液中气泡的影响可进一步去除气泡。
4)将不含药物的水凝胶溶液加到微针模板表面上制备微针贴片的基底部分。如可以通过离心的方法制备微针贴片的基底部分(图2c-e)。水凝胶溶液加到微针模板表面后,为了避免溶液中气泡的影响可进一步去除气泡。
5)根据水凝胶材料的不同通过不同的方法使水凝胶固化(图2f)。如:水凝胶材料为明胶/淀粉通过干燥进行固化;水凝胶材料为海藻酸钠通过加入钙离子(ca2+)进行固化;水凝胶材料为透明质酸通过紫外照射进行固化;水凝胶材料为聚乙烯醇通过循环冷冻解冻进行固化。
6)水凝胶固化后进行干燥,干燥完成后,将微针贴片从微针模板上剥离下来,得到智能调节血糖的微针贴片(图2g-h)。
实施例3使用不同的水凝胶材料制备智能调节血糖的微针贴片
根据实施例2中的方法使用不同的水凝胶材料制备智能调节血糖。
(1)以明胶/淀粉作为水凝胶材料
将质量比为1:1的淀粉和明胶分别溶于去离子水,加热至60℃,搅拌30分钟充分溶解,制备得到明胶、淀粉浓度均为5%(w/v)(明胶+淀粉总浓度10%)的明胶/淀粉溶液。
将适量的智能调节血糖的药物加入到明胶/淀粉溶液中,得到含药物的明胶/淀粉溶液。
用移液枪取50μl含药物的明胶/淀粉溶液直接沉积在微针模板表面上,置于真空(400mmhg)下15分钟,去除明胶/淀粉溶液中的气泡。然后将模板转移到离心机中,在4000rpm下离心20分钟以将含药物的明胶/淀粉溶液分散到微针的腔室中。重复该过程(溶液沉积在模板表面、真空放置去气泡、再离心)2~3次,使得微针部分被含药物的明胶/淀粉溶液完全填满。
填充满微针部分后,在微针模板周围各施加一块玻璃挡板制备微型储槽。用移液枪取200μl不含药物的明胶/淀粉溶液加到微型储槽中,然后利用抽真空去气泡,并以4000rpm离心20分钟,制备微针贴片的基底部分。
制备好基底部分后,将模板放入37℃的烘箱中,经过一天后,明胶固化,从模板上将微针贴片剥离下来,得到基于明胶/淀粉水凝胶材料的微针贴片。
(2)以海藻酸钠作为水凝胶材料
制备浓度为1%-3%(w/v)(优选2%)的海藻酸钠水溶液,利用水浴超声震荡的方法加速海藻酸钠的溶解,制备得到海藻酸钠溶液。
将适量的智能调节血糖的药物加入到海藻酸钠水溶液中,得到含药物的海藻酸钠水溶液。
用移液枪取50μl含药物的海藻酸钠溶液直接沉积在微针模板表面上,置于真空(400mmhg)下15分钟,去除海藻酸钠溶液中的气泡。然后将模板转移到离心机中,在4000rpm下离心20分钟以将含药物的海藻酸钠溶液分散到微针的腔室中。重复该过程2~3次,使得微针部分被含药物的海藻酸钠溶液完全填满。
填充满微针部分后,在微针模板周围各施加一块玻璃挡板制备微型储槽。将200μl不含药物的海藻酸钠溶液加到微型储槽中,然后利用抽真空去气泡,并以4000rpm离心20分钟,制备微针贴片的基底部分。
制备好基底部分后,将150μl的10%(w/v)钙盐溶液(caso4或cacl2)加入到微型储槽中,ca2+离子作用于海藻酸钠使之发生固化反应。然后在常温下干燥24小时,干燥完成后,从模板上将微针贴片剥离下来,得到基于海藻酸钠水凝胶材料的微针贴片。
(3)以透明质酸作为水凝胶材料
称量0.3g透明质酸溶于10ml去离子水中,制备3%(w/v)的透明质酸溶液。
将适量的智能调节血糖的药物加入到透明质酸溶液中,得到含药物的透明质酸溶液。
用移液枪取50μl含药物的透明质酸溶液直接沉积在微针模板表面上,置于真空(400mmhg)下15分钟,去除透明质酸溶液中的气泡。然后将模板转移到离心机中,在4000rpm下离心20分钟以将含药物的透明质酸溶液分散到微针的腔室中。重复该过程2~3次,使得微针部分被含药物的透明质酸溶液完全填满。
填充满微针部分后,在微针模板周围各施加一块玻璃挡板制备微型储槽。用移液枪取200μl不含药物的透明质酸溶液加到微型储槽中,然后利用抽真空去气泡,并以4000rpm离心20分钟,制备微针贴片的基底部分。
制备好基底部分后,将模板置于365nm的紫外灯下辐照5min,使透明质酸发生固化。然后在常温下干燥24小时,干燥完成后,从模板上将微针贴片剥离下来,得到基于透明质酸水凝胶材料的微针贴片。
(4)以聚乙烯醇作为水凝胶材料
将聚乙烯醇加入到去离子水中,加热至90℃溶解30分钟,制备3%(w/v)的聚乙烯醇溶液。
将适量的智能调节血糖的药物加入到聚乙烯醇溶液中,得到含药物的聚乙烯醇溶液。
用移液枪取50μl含药物的聚乙烯醇溶液直接沉积在微针模板表面上,置于真空(400mmhg)下15分钟,去除聚乙烯醇溶液中的气泡。然后将模板转移到离心机中,在4000rpm下离心20分钟以将含药物的聚乙烯醇溶液分散到微针的腔室中。重复该过程2~3次,使得微针部分被含药物的聚乙烯醇溶液完全填满。
填充满微针部分后,在微针模板周围各施加一块玻璃挡板制备微型储槽。用移液枪取200μl不含药物的聚乙烯醇溶液加到微型储槽中,然后利用抽真空去气泡,并以4000rpm离心20分钟,制备微针贴片的基底部分。
制备好基底部分后,模板通过5次冷冻解冻循环(-20℃冰箱冷冻1h,常温25℃解冻0.5h,如此循环5次),使得聚乙烯醇溶液固化。然后在常温下干燥24小时,干燥完成后,从模板上将微针贴片剥离下来,得到基于聚乙烯醇水凝胶材料的微针贴片。
评价微针的不同材料和固化方法对药物的胰岛素活性的影响,具体实验过程如下:常温下,将葡萄糖的水溶液(11.11mm)和gnc-fpba-insulin(糖基化胰岛素浓度为1.5mm)以1ml:0.5ml体积混合,作为对照组(其中葡萄糖溶液浓度为7.4mm)。(a)模拟不同温度下明胶固化成胶时对胰岛素活性影响:将葡萄糖溶于10%(w/v)明胶/淀粉溶液(得到的葡萄糖浓度为11.11mm),各取1ml葡萄糖溶液中,在不同温度下,各加入0.5ml1.5mmgnc-fpba-insulin溶液,混合均匀。利用血糖仪检测葡萄糖浓度,评价明胶固化时的不同温度处理对药物中胰岛素活性的影响;(b)模拟海藻酸钠交联时对胰岛素活性影响:将葡萄糖溶于2%(w/v)海藻酸钠水溶液(得到的葡萄糖浓度为11.11mm),将1ml该溶液与0.5mlgnc-fpba-insulin混合,添加少量ca2+溶液(50μl)使得海藻酸钠溶液交联固化形成海藻酸钠水凝胶。利用血糖仪测量葡萄糖浓度,评价海藻酸钠固化过程对药物中胰岛素活性的影响;(c)模拟紫外光固化透明质酸时对胰岛素活性影响:将葡萄糖溶于3%(w/v)的透明质酸溶液(得到的葡萄糖浓度为11.11mm),将1ml该溶液与0.5mlgnc-fpba-insulin混合,用365nm的紫外灯下辐照不同时间,使透明质酸发生固化形成透明质酸水凝胶。利用血糖仪测量葡萄糖浓度,评价紫外光辐照固化透明质酸的过程对药物中胰岛素活性的影响;(d)模拟聚乙烯醇交联时对胰岛素活性影响:将葡萄糖溶于3%(w/v)的聚乙烯醇溶液(得到的葡萄糖浓度为11.11mm),将1ml该溶液与0.5mlgnc-fpba-insulin混合,通过5次冷冻解冻循环使得聚乙烯醇溶液固化形成聚乙烯醇水凝胶。利用血糖仪测量葡萄糖浓度,评价聚乙烯醇固化形成水凝胶的过程对药物中胰岛素活性的影响。结果见图3,表明上述各水凝胶材料通过固化后,不会影响药物的胰岛素活性,具体如下:采用明胶/淀粉水凝胶作为微针的载体材料,在水凝胶溶解和固化的过程中,不影响药物的葡萄糖调节能力(图3a);采用海藻酸钠水凝胶作为微针的载体材料、并进行固化的过程,不影响药物的葡萄糖调节能力(图3b);采用透明质酸水凝胶作为微针的载体材料、并用紫外光进行固化的过程,不影响药物的葡萄糖调节能力(图3c);采用聚乙烯醇水凝胶作为微针的载体材料、并用循环冷冻解冻进行固化的过程,不影响药物的葡萄糖调节能力(图3d)。
实施例4智能调节血糖的微针贴片的应用
以实施例3制备的基于明胶/淀粉水凝胶材料的微针贴片为例。
(1)微针贴片的形貌
相机拍摄基于明胶/淀粉水凝胶材料的微针贴片的外貌见图4a,扫描电子显微镜(sem)观察微针贴片的形貌见图4b-d。结果表明微针贴片外形完整,含有11×11根圆锥形微针,微针的外貌光滑,结构完整。
(2)微针贴片的机械强度测试
用纳米压痕测试法测量微针的机械强度,结果见图5,相对于不含药物的空白微针(制备过程中以不含药物的明胶/淀粉溶液填充微针)阵列,含药物(智能调节血糖的药物)的微针阵列的机械性能明显提高。
(3)皮肤穿刺及皮肤恢复性能测试
1)将基于明胶/淀粉水凝胶材料的微针贴片按压并贴在小鼠背部皮肤上(图6a)。微针贴片应用于皮肤1小时后,将微针贴片揭掉,用相机记录微针贴片处理过后的皮肤形貌(图6b)。随后用0.4%的台盼蓝溶液对皮肤进行台盼蓝染色30分钟,用光学显微镜观察皮肤样品的台盼蓝染色效果(图6c)。从图6b-c结果可以看出,微针贴片能有效刺穿皮肤,刺穿的皮肤部位被台盼蓝染成蓝色。
2)皮肤表面应用明胶/淀粉微针贴片后,揭掉微针贴片,并用相机记录不同时间点皮肤的恢复情况。结果显示,揭掉微针之后,随着时间的推移,穿刺后的皮肤可以逐渐恢复,大约30分钟后,微针穿刺的痕迹几乎可以完全消失(图7a-d)。
用h&e染色方法对应用过微针贴片的皮肤进行染色(图7e)。皮肤上应用微针贴片1小时候后,微针刺入皮肤的平均深度为305±31μm(图7e、g)。揭除微针贴片,皮肤恢复30min后,微针刺入皮肤的深度恢复至仅有31±8μm(图7g),微针穿刺的痕迹几乎消失,皮肤能恢复原貌(图7f)。
(4)微针贴片的体内血糖调节效果测试
糖尿病小鼠建模:c57雄性小鼠,四周龄,腹腔注射1%(w/v)链脲佐菌素-柠檬酸缓冲液,注射剂量为50mg/kg,每日1次,连续5日注射。一周后测血糖,小鼠平均血糖在15mm以上(15-25mm),1型糖尿病小鼠模型构建成功。
准备不同的实验组,前三组微针贴片组,分别为微针(空白组)、微针(含游离胰岛素组)、微针(含gnc-fpba-insulin组),即制备微针贴片的过程中,填充微针的溶液分别为明胶/淀粉溶液、含胰岛素的明胶/淀粉溶液、含gnc-fpba-insulin的明胶/淀粉溶液,第四组为注射胰岛素组。前三组实验组将微针贴片应用于小鼠皮肤的表面,第四组将胰岛素药物进行皮下注射,各实验组中用于小鼠的胰岛素剂量均为10μmol/kg。在不同的时间点,对小鼠进行断尾取血,用葡萄糖测试仪测试记录小鼠体内的血糖浓度。
结果见图8:应用微针(含gnc-fpba-insulin组),小鼠体内血糖在0.75小时内迅速降低至11.35mm,并且在4小时内一直保持在正常血糖水平(低于12mm),随后血糖水平逐渐上升。应用微针(含游离胰岛素组)和皮下注射胰岛素组,小鼠体内血糖在0.5小时内迅速下降,之后逐步回升至高血糖水平。微针(空白组)应用于小鼠的皮肤后,微针贴片不能降低小鼠体内的血糖水平,小鼠的血糖浓度一直处于最高水平(图8)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!