沙蚕胞外血红蛋白在制备愈伤药物中的应用的制作方法
本发明涉及生物技术领域,特别涉及沙蚕胞外血红蛋白及其在制备愈伤药物中的应用。
背景技术
伤口的愈合是一个非常复杂的生理生化过程,随着医学科学的发展,特别是现代生物技术在医学领域的应用,使人类对愈伤的理念和过程有了更加深入地了解。概括地讲,创伤愈合可分为炎症、增生和重建三个阶段:1、机体对伤口的免疫反应和调整过程的炎性阶段;2、机体所在环境及愈伤组织再生的增生阶段;3、修复变硬及疤痕组织的变异阶段。其中,增生阶段发生的包括上皮新生、血管形成、纤维组织形成以及损伤部位的收缩直接影响伤口愈合的快慢。这个阶段,在巨噬细胞和血小板的刺激下成纤维细胞大量形成,同时快速合成愈伤的重要物质——胶原蛋白。而胶原蛋白的形成及其所形成基质的强度都依赖脯氨酸和赖氨酸的氧化,因此表明胶原蛋白的合成不仅需要适量的维生素c和铁,也需要充足的氧气。有研究表明,氧直接参与了愈伤过程,增加供氧可明显加快伤口愈合,尤其对褥疮和慢性溃疡患者甚为有效。同时,高浓度氧还能抑制微生物生长,从而有效控制了慢性伤口愈合时的并发感染。如何提高伤口周围的氧分压已经成为决定伤口愈合速度的关键之一。
基于上述的愈伤理念,人们试图采用各种方法来提高伤口周围的氧分压。其中有效果的是直接给人体输纯氧,旨在通过提高人体血红蛋白的携氧量,进而改善伤口组织周围氧的状况。但这种方法受到设备及环境条件的局限,另外过高浓度氧气的吸入会造成严重的人体氧中毒。还有人通过设计一些仪器装置对伤口进行光、电和磁等物理刺激,希望通过改善伤口周围的血液微循环来达到提高氧分压的目的,但效果不理想。目前临床效果最好、最为实用的方法是将可逆携带氧气的携氧物质直接喷洒在伤口的表面,局部直接供氧。到目前为止,所采用的携氧物质主要是一些哺乳动物的血红蛋白。由于这类血红蛋白其自身的免疫原性和携氧能力等方面的欠缺,导致其愈伤效果不尽人意。另外,也可以通过人工修饰等办法制备人造携氧物质,但它们容易通过自氧化,而逐渐丧失生物活性,形成高铁蛋白,失去载氧能力。因此寻找和开发高效的携氧物质已经成为这一疗伤技术能否成功的关键。
在研究高效携氧物质的过程中发现,部分节肢动物的胞外血红蛋白,因其不同于人血红蛋白的特殊结构而具有超强的携氧能力,并且蛋白分子未经糖化修饰,所以其免疫原性较低,更适合用于人体。在这类节肢动物中沙蚕的资源最为丰富。沙蚕胞外血红蛋白分子是由近196个肽链组成的超大分子,可携带156个氧分子,而人类血红蛋白只能携带4个氧分子,因此是人血红蛋白携氧能力的39倍。此外,人血红蛋白在红细胞内,而沙蚕血红蛋白是胞外蛋白,可以直接与细胞进行气体交换,同时更便于储存和运输。在这个方面法国的研究最为出色,他们成功地分离纯化出沙蚕胞外血红蛋白分子,并对其结构进行了详细地分析,同时测定了理化性质以及生物功能,因此成功地开发出沙蚕胞外血红蛋白在生物领域的应用价值。例如:在骨髓干细胞的培养液中加入沙蚕胞外血红蛋白,可以提高干细胞的增长率,同时延长细胞的分化能力。另外,还可以用于促进蛋白表达细胞的蛋白表达。目前该公司又将其应用于器官移植领域,充足的氧供大大提高了待植器官的保存状态和运输,为确保器官移植成功提供了先决条件。2003年,deloffre等首先发现沙蚕血红蛋白具有一定的抑菌活性。正是由于沙蚕胞外血红蛋白的这些生物学功能,使其成为非常难得的具有促进伤口愈合的超能携氧物质。本发明通过大量的试验证明沙蚕胞外血红蛋白,具有非常显著地促进伤口愈合的能力。
目前对沙蚕胞外血红蛋白的分离提取,大多采用层析或化学萃取等方法。这些方法过程复杂,操作时间较长,蛋白容易失活,并容易造成产品化学污染,很难产业化。虽然已有一些方法成功地应用在从哺乳动物血液中分离纯化出血红蛋白,但都不适合沙蚕胞外血红蛋白的分离提取。主要是由于沙蚕血红蛋白是胞外蛋白,分子巨大,结构复杂,血红蛋白分子的肽链之间并不完全是由共价键构成。可见,化学分离的方法往往会破坏其天然结构,导致生物功能的丧失。
因此,提供一种提取率高的沙蚕胞外血红蛋白的制备方法具有重要的显示意义。
技术实现要素:
有鉴于此,本发明提供一种沙蚕胞外血红蛋白在制备愈伤药物中的应用。本发明基于提供的组合物以及超滤膜错流过滤技术,以纯物理的方法实现对沙蚕胞外血红蛋白的分离纯化,显著提高了提取率,同时最大限度地保存了细胞活性。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种组合物作为沙蚕胞外血红蛋白的保护剂,包括氯化钠、还原型谷胱甘肽、抗坏血酸、牛血清白蛋白、乳糖和peg8000。
在本发明的一些具体实施方案中,还包括氯化亚铁。
在本发明的一些具体实施方案中,以质量份计,包括如下组分:
在本发明的一些具体实施方案中,以质量份计,包括如下组分:
本发明还提供了所述的组合物在制备蛋白保护剂中的应用。
此外,本发明还提供了一种蛋白保护剂,包括所述的组合物。
在此基础上,本发明还提供了沙蚕胞外血红蛋白的制备方法为:获得沙蚕组织,与缓冲液混合后,通入co获得co饱和型血红蛋白溶液,离心收集上清液,错流超滤,与本发明提供的组合物或蛋白保护剂混合,冷冻干燥;所述冷冻干燥之前的步骤,ph值为7.0~7.4,温度为0~4℃。
在本发明的一些具体实施方案中,以g/l计,本发明提供的组合物或蛋白保护剂与所述沙蚕胞外血红蛋白的质量比为(11.41~17.03):100。
在本发明的一些具体实施方案中,缓冲液为:8gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4。
在本发明的一些具体实施方案中,沙蚕组织与缓冲液的体积比为1:10,混合时间为10min。
在本发明的一些具体实施方案中,co的通入时间20~30min,气体流速为20~30lh-1。
在本发明的一些具体实施方案中,取所述co饱和型血红蛋白溶液于3000~4000rpm离心5~10min,收集上清液,再于7000~10000rpm离心10~15min,收集上清液。
在本发明的一些具体实施方案中,所述错流超滤采用al2o5陶瓷超滤膜,所述al2o5陶瓷超滤膜的截留分子量大于3mda或大于0.01nm;所述错流超滤的压力为0.3~0.5mpa,流速为1~2m/s。
在本发明的一些具体实施方案中,所述冷冻干燥包括如下步骤:
步骤1:预冻,所述预冻的温度为-40℃~-60℃,所述预冻的时间为4~10h;
步骤2:退火,所述退火的温度为-20℃~-30℃,所述退火的时间为0.5~1h;
步骤3:初次干燥,所述初次干燥的温度为-60℃~-65℃,所述初次干燥的真空度为10pa~30pa,所述初次干燥的时间为4~12h;
步骤4:二次干燥,所述二次干燥的温度为-70℃~-80℃,所述二次干燥的真空度为30~33pa,所述二次干燥的时间为4~6h。
本发明还提供了所述的制备方法制得的沙蚕胞外血红蛋白。
本发明还提供了上述蛋白保护剂制得的沙蚕胞外血红蛋白在制备促进细胞生长和/或细胞迁移、治疗开放性创伤的药物和/或制剂中的应用。
在本发明的一些具体实施方案中,所述开放性创伤包括擦伤、撕裂伤、切伤、砍伤或刺伤。
在本发明的一些具体实施方案中,所述开放性创伤为皮肤伤口、皮肤划痕或慢性伤口溃疡的药物和/或制剂中的应用。
在本发明的一些具体实施方案中,所述沙蚕胞外血红蛋白的制备方法为:获得沙蚕组织,与缓冲液混合后,通入co获得co饱和型血红蛋白溶液,离心收集上清液,错流超滤,与本发明提供的组合物混合,冷冻干燥;所述冷冻干燥之前的步骤,ph值为7.0~7.4,温度为0~4℃。
在本发明的一些具体实施方案中,以g/l计,本发明提供的组合物与所述沙蚕胞外血红蛋白的质量比为(11.41~17.03):100。
在本发明的一些具体实施方案中,缓冲液为:8gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4。
在本发明的一些具体实施方案中,沙蚕组织与缓冲液的体积比为1:10,混合时间为10min。
在本发明的一些具体实施方案中,co的通入时间20~30min,气体流速为20~30lh-1。
在本发明的一些具体实施方案中,取所述co饱和型血红蛋白溶液于3000~4000rpm离心5~10min,收集上清液,再于7000~10000rpm离心10~15min,收集上清液。
在本发明的一些具体实施方案中,所述错流超滤采用al2o5陶瓷超滤膜,所述al2o5陶瓷超滤膜的截留分子量大于3mda或大于0.01nm;所述错流超滤的压力为0.3~0.5mpa,流速为1~2m/s。
在本发明的一些具体实施方案中,所述冷冻干燥包括如下步骤:
步骤1:预冻,所述预冻的温度为-40℃~-60℃,所述预冻的时间为4~10h;
步骤2:退火,所述退火的温度为-20℃~-30℃,所述退火的时间为0.5~1h;
步骤3:初次干燥,所述初次干燥的温度为-60℃~-65℃,所述初次干燥的真空度为10pa~30pa,所述初次干燥的时间为4~12h;
步骤4:二次干燥,所述二次干燥的温度为-70℃~-80℃,所述二次干燥的真空度为30~33pa,所述二次干燥的时间为4~6h。
本发明还提供了所述的制备方法制得的沙蚕胞外血红蛋白。
本发明还提供了所述沙蚕血红蛋白在制备促进伤口愈合的药物中的应用。
在本发明的一些具体实施方案中,所述沙蚕血红蛋白的有效浓度为0.05~1%(w/w)。
本发明提供了一种组合物,包括氯化钠、还原型谷胱甘肽、抗坏血酸、牛血清白蛋白、乳糖、peg8000和氯化亚铁。基于此组合物此组合物很好地稳定了沙蚕胞外血红蛋白,同时也展示了良好的愈伤效果。本发明采用超滤膜错流过滤技术,以纯物理的方法实现对沙蚕胞外血红蛋白的分离纯化,显著提高了提取率,同时最大限度地保存了细胞活性。本发明还提供了沙蚕胞外血红蛋白在愈伤领域的应用,具体为沙蚕胞外血红蛋白在制备促进细胞生长和/或细胞迁移、皮肤伤口和/或皮肤划痕愈合的药物和/或制剂中的应用。随着对沙蚕血红蛋白的研究不断深入,相信其潜在的应用价值会不断的涌现出来,由此必将带来巨大的社会效益和经济效益。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示实施例4中蛋白电泳结果;
图2示实施例4中沙蚕胞外血红蛋白促进鼠肾脏内皮细胞增殖及迁移结果;
图3示实施例4细胞划痕实验中不同种类的蛋白促进细胞生长和迁移的能力;
图4示实施例4细胞划痕实验中不同浓度的沙蚕胞外血红蛋白对划痕愈合面积的影响;
图5示实施例5皮肤伤口愈合实验中不同种类的沙蚕胞外蛋白不同种类,不同来源的蛋白促进细胞生长和迁移的能力;
图6示实施例5皮肤伤口愈合实验中不同浓度的沙蚕胞外血红蛋白对皮肤伤口愈合速度的影响。
具体实施方式
本发明公开了一种沙蚕胞外血红蛋白及其在制备愈伤药物中的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
分离工艺流程:
整个分离提取过程始终ph为7.0~7.4;温度为0-4℃。
沙蚕取血:将新鲜沙蚕用清水洗净,冷冻过夜,用切碎机将沙蚕切成1厘米厚的切片。然后将切片迅速加入缓冲液中(8gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4,ph值7.0~7.4,温度为0~4℃),切片与缓冲液的体积比为1:10。轻轻搅拌浸泡10分钟,使沙蚕血液充分溶解。
一氧化碳饱和血红蛋白:将一氧化碳通入溶解有沙蚕胞外血红蛋白溶液中,使其成为一氧化碳饱和型血红蛋白。通一氧化碳时间为20~30min,气体流速为20~30lh-1。
固液分离:通过两次离心除去混合液中的固形物。混合液在3000~4000rpm离心5-10min后,收集上清液,丢弃沙蚕碎片。然后对所得的上清液进行第二次离心,7000~10000rpm离心10~15min,由于沙蚕胞外血红蛋白具有良好的水溶性,所以存在上清液中。
蛋白分离:对两次离心所获得的上清液采用错流超滤技术进行沙蚕胞外血红蛋白的分离、漂洗、脱盐和浓缩。整个过程一次性完成。超滤膜材质为al2o5陶瓷超滤膜,孔径为能截留分子量大于3mda或大于0.01nm。将所述滤液在操作压力为0.3~0.5mpa、流速控制在1~2m/s,ph值为7.0~7.4、温度为0~4℃。具体操作如下:将两次离心所获得的上清液,加入到陶瓷膜错流过滤机的储料罐中进行过滤,当截留液体积为原溶液体积1/5时,补给新鲜缓冲液直至原来体积,继续过滤。此步骤重复一次,达到蛋白漂洗的目的。然后用纯水替代缓冲掖,再重复上述步骤2次,同时达到脱盐及浓缩的目的。
血红素的分离、纯化及其测定方法如下:上述分离所得到的沙蚕胞外血红蛋白溶液中加入等体积的0.15%亚硫酸氢钠溶液,使其溶解,然后加入血红蛋白体积5倍的丙酮,搅拌均匀,用0.1mol/l盐酸溶液调节ph为3,使球蛋白与血红素充分分离,抽提时间为10min以上,然后5000r/min离心10min,弃沉淀,上清液即为血红素丙酮溶液。血红素丙酮溶液采用真空浓缩并回收丙酮,浓缩物用0.1mol/lnaoh溶解,3000r/min离心10min,收集上清液。用0.1mol/l盐酸调ph至4~5,沉淀血红素,收集沉淀,用水洗沉淀至中性,50℃真空干燥至恒重,得血红素。测定血红素的重量,再以0.1mol/lnaoh分别溶解血红素标准品和提取得到的血红素制品,调整至适宜浓度,于385nm处测定吸光度,计算样品中血红素的准确含量。血红素分子量为616.487,从而可以计算出样品中血红素的摩尔数为0.1294。
沙蚕胞外血红蛋白的含量=26,260g×血红素的摩尔数。蛋白保护及复配:在脱盐后的沙蚕胞外血红蛋白溶液中加入保护剂,充分搅拌混匀。保护剂与沙蚕胞外血红蛋白的质量比为(11.41~17.03):100。所述保护剂包括:氯化钠0.5~4份,还原型谷胱甘肽0.01~0.3份,抗坏血酸0.5~2份,牛血清白蛋白1~5份,乳糖3~9份,peg800001~3份,氯化亚铁0.01~0.03份。。
冷冻干燥:将加入保护剂的沙蚕胞外血红蛋白放到安培瓶中,在冷冻干燥机将蛋白冷冻干燥,烧封瓶口,避光2~8℃保存。冷冻干燥工艺:1、预冻,预冻温度为-40℃~-60℃、预冻时间4~10h。装瓶厚度一般不超过10mm。的固体含量一般为5%~10%。2、退火,温度升到-20℃~-30℃,时间为0.5~1h。3、初次干燥,干燥阶段冷凝器温度为-60℃~-65℃,初次干燥阶段的真空度在10~30pa,时间为4~12h。4、二次干燥,干燥阶段冷凝器温度为-70~-80℃,这一过程需4~6h,真空度在30~33pa。
本发明还提供了所述沙蚕血红蛋白在制备促进伤口愈合的药物中的应用。所述沙蚕血红蛋白的有效浓度为0.05~1%(w/w)。
本发明提供了一种组合物,包括氯化钠、还原型谷胱甘肽、抗坏血酸、牛血清白蛋白、乳糖和peg8000,氯化亚铁。基于此组合物,本发明采用超滤膜错流过滤技术,以纯物理的方法实现对沙蚕胞外血红蛋白的分离纯化,显著提高了提取率,同时最大限度地保存了细胞活性。随着对沙蚕血红蛋白的研究不断深入,相信其潜在的应用价值会不断的涌现出来,由此必将带来巨大的社会效益和经济效益。
本发明提供的沙蚕胞外血红蛋白及其在制备愈伤药物中的应用中所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
保护剂
整个分离提取过程始终ph为7.0;温度为2℃。
沙蚕取血:将200只(每只含血量为0.5毫升左右)新鲜沙蚕用清水洗净,冷冻过夜,用切碎机将沙蚕切成1厘米厚的切片。然后将切片迅速加入缓冲液中(8gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4,ph值7.0,温度为2℃),切片与缓冲液的体积比为1:10。轻轻搅拌浸泡10分钟,使沙蚕血液充分溶解。
一氧化碳饱和血红蛋白:将一氧化碳通入溶解有沙蚕胞外血红蛋白溶液中,使其成为一氧化碳饱和型血红蛋白。通一氧化碳时间为25min,气体流速为25lh-1。
固液分离:通过两次离心除去混合液中的固形物。混合液在3500rpm离心8min后,收集上清液,丢弃沙蚕碎片。然后对所得的上清液进行第二次离心,10000rpm离心10min,由于沙蚕胞外血红蛋白具有良好的水溶性,所以存在上清液中。
蛋白分离:对两次离心所获得的上清液采用错流超滤技术进行沙蚕胞外血红蛋白的分离、漂洗、脱盐和浓缩。整个过程一次性完成。超滤膜材质为al2o5陶瓷超滤膜,孔径为能截留分子量大于3mda或大于0.01nm。将所述滤液在操作压力为0.3mpa、流速控制在1.5m/s,ph值为7.0、温度为2℃。具体操作如下:将两次离心所获得的上清液,加入到陶瓷膜错流过滤机的储料罐中进行过滤,当截留液体积为原溶液体积1/5时,补给新鲜缓冲液直至原来体积,继续过滤。此步骤重复一次,达到蛋白漂洗的目的。然后用纯水替代缓冲掖,再重复上述步骤2次,同时达到脱盐及浓缩的目的。
血红素的分离、纯化及其测定方法如下:上述分离所得到的沙蚕胞外血红蛋白溶液中加入等体积的0.15%亚硫酸氢钠溶液,使其溶解,然后加入血红蛋白体积5倍的丙酮,搅拌均匀,用0.1mol/l盐酸溶液调节ph为3,使球蛋白与血红素充分分离,抽提时间为10min以上,然后5000r/min离心10min,弃沉淀,上清液即为血红素丙酮溶液。血红素丙酮溶液采用真空浓缩并回收丙酮,浓缩物用0.1mol/lnaoh溶解,3000r/min离心10min,收集上清液。用0.1mol/l盐酸调ph至4~5,沉淀血红素,收集沉淀,用水洗沉淀至中性,50℃真空干燥至恒重,得血红素。测定血红素的重量,再以0.1mol/lnaoh分别溶解血红素标准品和提取得到的血红素制品,调整至适宜浓度,于385nm处测定吸光度,计算样品中血红素的准确含量。血红素分子量为616.487,从而可以计算出样品中血红素的摩尔数为1.294×10-4。
沙蚕胞外血红蛋白的含量=26260g×血红素的摩尔数。
沙蚕胞外血红蛋白的含量=26260g×1.295×10-4=3.4g
蛋白保护及复配:在脱盐后的沙蚕胞外血红蛋白溶液中加入本发明提供的保护剂,充分搅拌混匀。保护剂与沙蚕胞外血红蛋白的质量比为11.41:100。
冷冻干燥:将加入保护剂的沙蚕胞外血红蛋白放到安培瓶中,在冷冻干燥机将蛋白冷冻干燥,烧封瓶口,避光2~8℃保存。冷冻干燥工艺:1、预冻,预冻最低温度-50℃、预冻时间4h。装瓶厚度一般不超过10mm。的固体含量一般为5%~10%。2、退火,温度升到-30℃,时间为0.51h。3、初次干燥,干燥阶段冷凝器温度为-60℃,初次干燥阶段的真空度在10pa,初次干燥的时间为12h。4、二次干燥,干燥阶段冷凝器温度为-80℃,这一过程需5h,真空度在30pa。
实施例2
整个分离提取过程始终ph为7.2;温度为4℃。
沙蚕取血:将200只(每只含血量为0.5毫升左右)新鲜沙蚕用清水洗净,冷冻过夜,用切碎机将沙蚕切成1厘米厚的切片。然后将切片迅速加入缓冲液中(8gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4,ph值7.2,温度为4℃),切片与缓冲液的体积比为1:10。轻轻搅拌浸泡10分钟,使沙蚕血液充分溶解。
一氧化碳饱和血红蛋白:将一氧化碳通入溶解有沙蚕胞外血红蛋白溶液中,使其成为一氧化碳饱和型血红蛋白。通一氧化碳时间为30min,气体流速为20lh-1。
固液分离:通过两次离心除去混合液中的固形物。混合液在4000rpm离心5min后,收集上清液,丢弃沙蚕碎片。然后对所得的上清液进行第二次离心,7000rpm离心15min,由于沙蚕胞外血红蛋白具有良好的水溶性,所以存在上清液中。
蛋白分离:对两次离心所获得的上清液采用错流超滤技术进行沙蚕胞外血红蛋白的分离、漂洗、脱盐和浓缩。整个过程一次性完成。超滤膜材质为al2o5陶瓷超滤膜,孔径为能截留分子量大于3mda或大于0.01nm。将所述滤液在操作压力为0.4mpa、流速控制在2m/s,ph值为7.2、温度为4℃。具体操作如下:将两次离心所获得的上清液,加入到陶瓷膜错流过滤机的储料罐中进行过滤,当截留液体积为原溶液体积1/5时,补给新鲜缓冲液直至原来体积,继续过滤。此步骤重复一次,达到蛋白漂洗的目的。然后用纯水替代缓冲掖,再重复上述步骤2次,同时达到脱盐及浓缩的目的。
血红素的分离、纯化及其测定方法如下:上述分离所得到的沙蚕胞外血红蛋白溶液白中加入等体积的0.15%亚硫酸氢钠溶液,使其溶解,然后加入血红蛋白体积5倍的丙酮,搅拌均匀,用0.1mol/l盐酸溶液调节ph为3,使球蛋白与血红素充分分离,抽提时间为10min以上,然后5000r/min离心10min,弃沉淀,上清液即为血红素丙酮溶液。血红素丙酮溶液采用真空浓缩并回收丙酮,浓缩物用0.1mol/lnaoh溶解,3000r/min离心10min,收集上清液。用0.1mol/l盐酸调ph至4~5,沉淀血红素,收集沉淀,用水洗沉淀至中性,50℃真空干燥至恒重,得血红素。测定血红素的重量,再以0.1mol/lnaoh分别溶解血红素标准品和提取得到的血红素制品,调整至适宜浓度,于385nm处测定吸光度,计算样品中血红素的准确含量。血红素分子量为616.487,从而可以计算出样品中血红素的摩尔数为1.409×10-4。
沙蚕胞外血红蛋白的含量=26260g×血红素的摩尔数。
沙蚕胞外血红蛋白的含量=26260g×1.409×10-4=3.7g
蛋白保护及复配:在脱盐后的沙蚕胞外血红蛋白溶液中加入本发明提供的保护剂,充分搅拌混匀。保护剂与沙蚕胞外血红蛋白的质量比为17.03:100。
冷冻干燥:将加入保护剂的沙蚕胞外血红蛋白放到安培瓶中,在冷冻干燥机将蛋白冷冻干燥,烧封瓶口,避光2~8℃保存。冷冻干燥工艺:1、预冻,预冻最低温度-60℃、预冻时间10h。装瓶厚度一般不超过10mm。的固体含量一般为25%~30%。2、退火,温度升到-20℃,时间为1h。3、初次干燥,干燥阶段冷凝器温度为-65℃,初次干燥阶段的真空度在20pa,初次干燥的时间为8h。4、二次干燥,干燥阶段冷凝器温度为-70℃,这一过程需4h,真空度在33pa。
实施例3
整个分离提取过程始终ph为7.4;温度为0℃。
沙蚕取血:将200只(每只含血量为0.5毫升左右)新鲜沙蚕用清水洗净,冷冻过夜,用切碎机将沙蚕切成1厘米厚的切片。然后将切片迅速加入缓冲液中(8gnacl,0.2gkcl,1.44gna2hpo4,0.24gkh2po4,ph值7.4,温度为0℃),切片与缓冲液的体积比为1:10。轻轻搅拌浸泡10分钟,使沙蚕血液充分溶解。
一氧化碳饱和血红蛋白:将一氧化碳通入溶解有沙蚕胞外血红蛋白溶液中,使其成为一氧化碳饱和型血红蛋白。通一氧化碳时间为20min,气体流速为30lh-1。
固液分离:通过两次离心除去混合液中的固形物。混合液在3000rpm离心10min后,收集上清液,丢弃沙蚕碎片。然后对所得的上清液进行第二次离心,8500rpm离心12min,由于沙蚕胞外血红蛋白具有良好的水溶性,所以存在上清液中。
蛋白分离:对两次离心所获得的上清液采用错流超滤技术进行沙蚕胞外血红蛋白的分离、漂洗、脱盐和浓缩。整个过程一次性完成。超滤膜材质为al2o5陶瓷超滤膜,孔径为能截留分子量大于3mda或大于0.01nm。将所述滤液在操作压力为0.5mpa、流速控制在1m/s,ph值为7.4、温度为0℃。具体操作如下:将两次离心所获得的上清液,加入到陶瓷膜错流过滤机的储料罐中进行过滤,当截留液体积为原溶液体积1/5时,补给新鲜缓冲液直至原来体积,继续过滤。此步骤重复一次,达到蛋白漂洗的目的。然后用纯水替代缓冲掖,再重复上述步骤2次,同时达到脱盐及浓缩的目的。
血红素的分离、纯化及其测定方法如下:上述分离所得到的沙蚕胞外血红蛋白溶液中加入等体积的0.15%亚硫酸氢钠溶液,使其溶解,然后加入血红蛋白体积5倍的丙酮,搅拌均匀,用0.1mol/l盐酸溶液调节ph为3,使球蛋白与血红素充分分离,抽提时间为10min以上,然后5000r/min离心10min,弃沉淀,上清液即为血红素丙酮溶液。血红素丙酮溶液采用真空浓缩并回收丙酮,浓缩物用0.1mol/lnaoh溶解,3000r/min离心10min,收集上清液。用0.1mol/l盐酸调ph至4~5,沉淀血红素,收集沉淀,用水洗沉淀至中性,50℃真空干燥至恒重,得血红素。测定血红素的重量,再以0.1mol/lnaoh分别溶解血红素标准品和提取得到的血红素制品,调整至适宜浓度,于385nm处测定吸光度,计算样品中血红素的准确含量。血红素分子量为616.487,从而可以计算出样品中血红素的摩尔数为1.56110-4。
沙蚕胞外血红蛋白的含量=26260g×血红素的摩尔数。
沙蚕胞外血红蛋白的含量=26260g×1.562×10-4=4.1g
蛋白保护及复配:在脱盐后的沙蚕胞外血红蛋白溶液中加入本发明提供的保护剂,充分搅拌混匀。保护剂与沙蚕胞外血红蛋白的质量比为13.13:100。
冷冻干燥:将加入保护剂的沙蚕胞外血红蛋白放到安培瓶中,在冷冻干燥机将蛋白冷冻干燥,烧封瓶口,避光2~8℃保存。冷冻干燥工艺:1、预冻,预冻最低温度-40℃、预冻时间8h。装瓶厚度一般不超过10mm。的固体含量一般为25%~30%。2、退火,温度升到-25℃,时间为0.8h。3、初次干燥,干燥阶段冷凝器温度为-63℃,初次干燥阶段的真空度在30pa,初次干燥的时间为4h。4、二次干燥,干燥阶段冷凝器温度为-75℃,这一过程需6h,真空度在31pa。
实施例4沙蚕胞外血红蛋白的定性定量分析
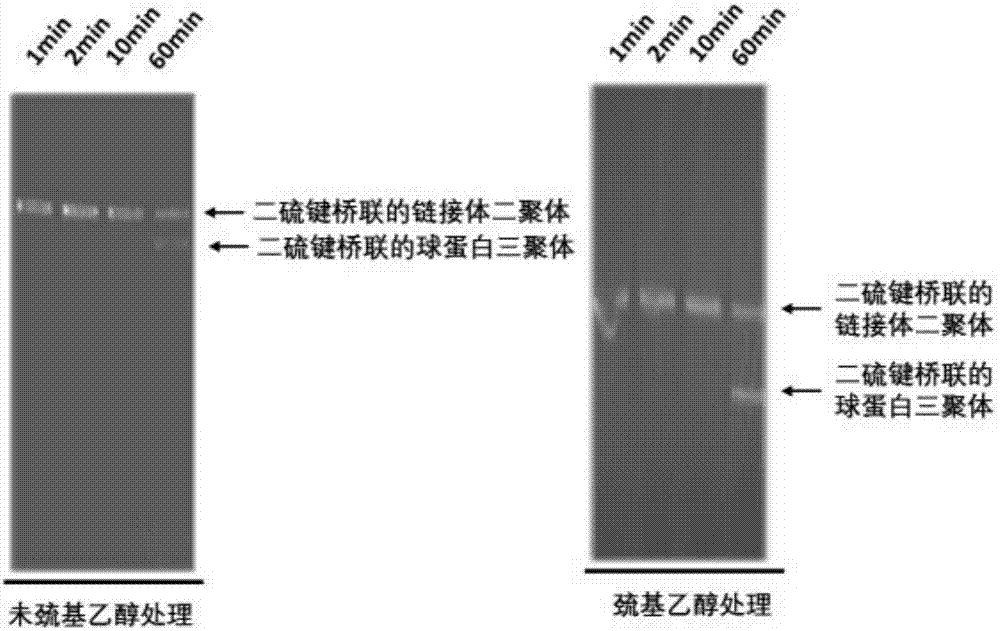
将通过上述分离纯化方法得到的沙蚕胞外血红蛋白(未加入保护剂)加入到pbs缓冲液中,在15000离心30min后取上清液,调整浓度,使蛋白的最终浓度为1mg/ml。采用fitc染色(fitc与沙蚕胞外血红蛋白的摩尔浓度比为2000:1),在室温分别染1,2,10,60min后,迅速加入十分之一反应体积的,浓度为1m的甘氨酸溶液终止反应。经过fitc染色得蛋白样品分为两组,一组加入2%的巯基乙醇,另一组不加,然后采用4~20%sds-page蛋白电泳进行蛋白组成分析。同时血气分析结果表明,所提取的沙蚕胞外血红蛋白,在ph7.2,温度为25℃的条件下,其po2为13.7mmhg,pco2为62.2mmhg,这些数据与文献报道的很接近。
沙蚕胞外血红蛋白的定量是采用测定血红素的含量进而计算出沙蚕胞外血红蛋白的含量的间接方法。lloydwaxwan等人(1974)通过吡啶血色素原方法,确定了沙蚕胞外血红蛋白重量与血红素摩尔数的关系为26260g蛋白/mol血色素。
血红素的分离、纯化及其测定方法如下:上述分离所得到的沙蚕血红蛋白中加入相等于血红蛋白体积的0.15%亚硫酸氢钠溶液,使其溶解,然后加入血红蛋白体积5倍的丙酮,搅拌均匀,用0.1mol/l盐酸溶液调节ph为3,使球蛋白与血红素充分分离,抽提时间为10min以上,然后5000r/min离心10min,弃沉淀,上清液即为血红素丙酮溶液。血红素丙酮溶液采用真空浓缩并回收丙酮,浓缩物用0.1mol/lnaoh溶解,3000r/min离心10min,收集上清液。用0.1mol/l盐酸调ph至4~5,沉淀血红素,收集沉淀,用水洗沉淀至中性,50℃真空干燥至恒重,得血红素。测定血红素的重量,再以0.1mol/lnaoh分别溶解血红素标准品和提取得到的血红素制品,调整至适宜浓度,于385nm处测定吸光度,计算样品中血红素的准确含量。血红素分子量为616.487,从而可以计算出样品中血红素的摩尔数。
沙蚕胞外血红蛋白的含量=26,260g×血红素的摩尔数。
表1
注:*表示p<0.05;***表示p<0.01。
实施例5细胞划痕实验
材料:6孔板,记号笔,直尺,20微升枪头,无血清培养基rpmi1640,pbs;流程:1.先用记号笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔0.5-1cm一道,横穿过孔。每孔至少穿过5条线。2.每孔中加入约5×105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。3.第二天用200ul枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。4.用pbs洗细胞3次,去除划下的细胞,加入5%fbsrpmi1640培养基,同时加入0.5%的不同来源的血红蛋白样品,将6孔把板放入37℃,5%co2的培养箱,培养。按0、16、24小时取样,拍照,图2显示细胞划痕愈合。采用un-scan-itgelversion6.1对成像数据化,然后用graphpadprism7.01处理数据并做出统计学分析,见表2。
采用细胞划痕实验比较了牛血清白蛋白、猪血红蛋白、牛血红蛋白和沙蚕胞外血红蛋白促进细胞生长和迁移的能力,图3、表2结果表明,分别以牛血清白蛋白,猪血红蛋白、牛血红蛋白作为对照组,沙蚕胞外血红蛋白对细胞生长和迁移都有显著的提高。同时,测定了不同浓度的沙蚕胞外血红蛋白对划痕愈合面积的影响,图4、表3结果表明划痕愈合面积得大小是与血红蛋白的剂量相关。其有效范围应为0.05~1%之间。
表2
注:与对照组相比,*表示p<0.05;***表示p<0.01。
表3
实施例6皮肤伤口愈合试验
大鼠皮肤伤口模型,选用24月龄健康wistar作为供受体,雌雄不拘,全部大鼠以戊巴比妥40mg/kg麻醉,背部去毛消毒,用取皮器切取1.5cm的皮肤,模型制备完成,对照组大鼠伤口处滴加100μl含有0.5%牛血清白蛋白的pbs,试验组大鼠伤口处分别滴加100μl含有0.5%猪血红蛋白的pbs,100μl含有0.5%牛血红蛋白的pbs,100μl含有0.5%沙蚕胞外血红蛋白(实施例1~3制得)的pbs。以上各组均外敷无菌纱布,包扎后单只分笼饲养,隔日换药。观察伤口愈合时间,以上皮覆盖为愈合。然后用graphpadprism7.01处理数据并做出统计学分析。表4采用皮肤伤口愈合试验比较了牛血清白蛋白、猪血红蛋白、牛血红蛋白和沙蚕胞外血红蛋白促进细胞生长和迁移的能力。图5、表4结果表明,分别以牛血清白蛋白,猪血红蛋白、牛血红蛋白作为对照组,沙蚕胞外血红蛋白对皮肤伤口愈合都有显著的提高。此外,观察了不同浓度的沙蚕胞外血红蛋白对皮肤伤口愈合速度的影响,图6、表5结果表明愈合速度的快慢是与血红蛋白的浓度相关。其有效范围应为0.05~1%之间。
表4
注:与对照组相比,*表示p<0.05;***表示p<0.01。
表5
实施例7慢性伤口愈合试验
大鼠皮肤伤口模型,选用24月龄健康wistar作为供受体,雌雄不拘,对照组大鼠尾静脉注射生理盐水2ml/kg,模型大鼠尾静脉注射阿霉素生理盐水溶液8mg/kg,注射后第4天后,全部大鼠以戊巴比妥40mg/kg麻醉。背部去毛消毒,用取皮器切取1.5cm的皮肤,模型制备完成。动物分组,71只大鼠分为对照组15只,模型组12只,模型+沙蚕血红蛋白,模型+hfcf组11只,模型大鼠伤口滴加100iubfgf,采用慢性伤口愈合试验比较了沙蚕胞外血红蛋白对慢伤口愈合的能力,表6结果表明,沙蚕胞外血红蛋白对皮肤伤口愈合有显著(p<0.05)的提高。
表6
注:与模型组或模型+hfgf相比,*表示p<0.05;***表示p<0.01。
取实施例2、实施例3制得的沙蚕胞外血红蛋白进行上述实验,实验结果与实施例1制得的沙蚕胞外血红蛋白的效果相近,无显著差异(p>0.05)。
可见,本发明制得的沙蚕胞外血红蛋白对皮肤伤口愈合有显著(p<0.05)的提高。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!