三叶青提取物TH-w部位对金黄色葡萄球菌的用途及其作用方法与流程
本发明涉及涉及抑菌领域,特别是三叶青提取物th-w部位对金黄色葡萄球菌的用途及其作用方法。
背景技术
细菌生物膜(biofilm)是指附着于有生命或无生命物体表面被细菌胞外大分子包裹,有组织的细菌群体,是区别于游离细菌的另一种常见生存模式。金黄色葡萄球菌(staphylococcusaureus,s.aureus)常以胞外多糖、dna和蛋白质自身分泌形成“蘑菇样”膜聚合物生物膜;金黄色葡萄球菌形成生物膜后常使患者发生慢性持续性感染,其耐药性比浮游细菌强10~100倍,给临床抗感染治疗带来很大困难。细菌生物膜形成的主要原因是抗生素滥用,长期残留在人体内的金黄色葡萄球菌不断受亚抑菌浓度抗生素的刺激,使细菌基因突变致耐药,目前传统的抗菌药物难以有效治疗金黄色葡萄球菌生物膜诱发的感染,而新抗生素的开发难以跟上细菌耐药步伐。因此,研发抵抗微生物膜的药物已成为最近微生物学领域热点话题。
三叶青是葡萄科崖爬藤属,为植物三叶崖爬藤(tetrastigmahemsleyanumdielsetgilg)的干燥块根,又名金丝吊葫芦等,是我国的特有植物,主要分布于中国东南地区民间的常用药物。三叶青的有效成分主要为含黄酮类化学成份,其性凉,味辛、苦,无毒,具有清热解毒、活血止痛、祛风化痰、活血止痛等功效,常用于高热惊厥,小儿感冒发热、喉痒肿痛、咳嗽、肺炎、肝炎、肠炎、痢疾等疾病。现代药理研究表明,三叶青提取物联合抗生素治疗细菌感染性疾病疗效明显。因此,针对三叶青中有效成分抵抗细菌微生膜的研发具有重要临床意义。
本发明观察了三叶青提取物对金黄色葡萄球菌生物膜形成和分分散作用,发现三叶青提取物能有效抑制和分散金黄色葡萄球菌生物膜的产生,发现了三叶青提取物在联合抗细菌感染中有新的医药用途,可为一些感染耐药菌患者治疗药物研发提供实验参考。再对th-t部位,th-p部位,th-a部位,th-b部位,th-w部位,th-w1部位,th-w2部位,th-w3部位,th-w4部位分别进行试验,发现了抑菌效果最好的部位。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种三叶青提取物th-w部位对金黄色葡萄球菌的用途及其作用方法,分别对th-t部位,th-p部位,th-a部位,th-b部位,th-w部位,th-w1部位,th-w2部位,th-w3部位,th-w4部位进行试验,并进行对比,找出了最优部位为th-w部位以及最优的作用方法。
为了实现上述目标,本发明采用如下的技术方案:
三叶青提取物th-w部位对金黄色葡萄球菌的用途,三叶青提取物th-w部位抑制金黄色葡萄球菌的生长。
前述的三叶青提取物th-w部位对金黄色葡萄球菌的用途,对三叶青提取物th-w部位的敏感度为:甲氧西林敏感金黄色葡萄球菌大于金黄色葡萄球菌标准株大于耐甲氧西林金黄色葡萄球菌。
三叶青提取物th-w部位对金黄色葡萄球菌的用途,三叶青提取物th-w部位抑制金黄色葡萄球菌的生物膜的形成。
三叶青提取物th-w部位对金黄色葡萄球菌的作用方法,将三叶青提取物th-w部位用lb肉汤倍比稀释到32.0mg/ml对金黄色葡萄球菌进行培养。
前述的三叶青提取物th-w部位对金黄色葡萄球菌的作用方法,三叶青提取物th-w部位用m-h肉汤倍比稀释到32.0mg/ml对甲氧西林敏感金黄色葡萄球菌进行35℃培养16-20h后,细菌抑制率为0.88。
前述的三叶青提取物th-w部位对金黄色葡萄球菌的作用方法,三叶青提取物th-w部位用m-h肉汤倍比稀释32.0mg/ml对耐甲氧西林金黄色葡萄球菌进行35℃培养16-20h后,细菌抑制率为0.34。
前述的三叶青提取物th-w部位对金黄色葡萄球菌的作用方法,三叶青提取物th-w部位用m-h肉汤倍比稀释32.0mg/ml对金黄色葡萄球菌标准株进行35℃培养16-20h后,细菌抑制率为0.7。
前述的三叶青提取物th-w部位对金黄色葡萄球菌的作用方法,三叶青提取物th-w部位用lb肉汤倍比稀释32.0mg/ml对甲氧西林敏感金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌进行37℃培养24h后,采用结晶紫染色法检测生物膜吸光度a570mm值为3.1。
本发明的有益之处在于:
本发明分别对th-t部位,th-p部位,th-a部位,th-b部位,th-w部位,th-w1部位,th-w2部位,th-w3部位,th-w4部位分别进行试验,并进行对比,找出了最优部位为th-w部位;
本发明将三叶青提取物th-w部位用不同的培养基倍比稀释浓度对金黄色葡萄球菌进行培养,再通过结晶紫染色法检测对比细菌生物膜形成能力,找出最优浓度为32mg/ml。
附图说明
图1是本发明的三叶青提取物抑制mssa-1生物膜形成能力对比图;
图2是本发明的三叶青提取物抑制mssa-2生物膜形成能力对比图;
图3是本发明的三叶青提取物抑制mssa-3生物膜形成能力对比图;
图4是本发明的三叶青提取物抑制mssa-4生物膜形成能力对比图;
图5是本发明的三叶青提取物抑制mssa-5生物膜形成能力对比图;
图6是本发明的三叶青提取物抑制mrsa-1生物膜形成能力对比图;
图7是本发明的三叶青提取物抑制mrsa-2生物膜形成能力对比图;
图8是本发明的三叶青提取物抑制mrsa-3生物膜形成能力对比图;
图9是本发明的三叶青提取物抑制mrsa-4生物膜形成能力对比图;
图10是本发明的三叶青提取物抑制mrsa-5生物膜形成能力对比图;
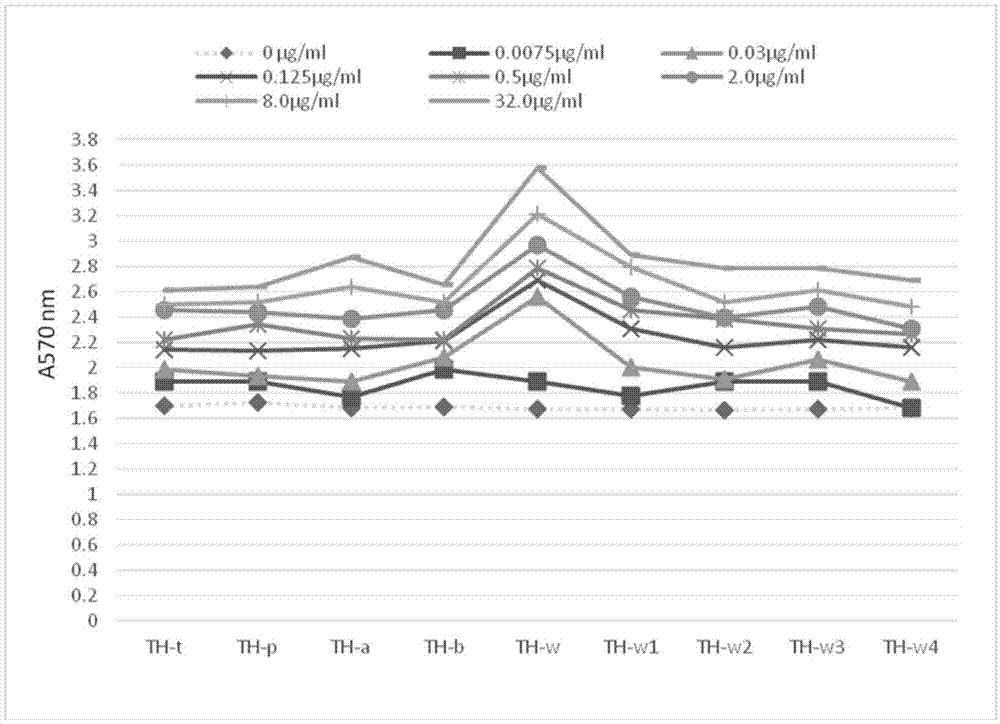
图11是本发明的三叶青提取物的各个部位在不同浓度的培养液中培养后,用结晶紫染色法检测得到的吸光度(a570mm)对比图;
图12是本发明的三叶青提取物的提取方法示意图。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
三叶青药材提取分离
三叶青提取物根据提取时所选用的制剂将提取液分为:th-t部位,th-p部位,th-a部位,th-b部位,th-w部位,th-w1部位,th-w2部位,th-w3部位,th-w4部位。
材料包括:三叶青干燥块根购于宁波市鄞州医药药材公司;80%大孔吸附树脂树色谱仪;yanaco显微熔点测定仪(温度计未校正);varianmat-212型质谱仪;bruker-speckospinac-600p型核磁共振仪。薄层色谱硅胶板与柱色谱硅胶(100~200目、200~300目)均为山东烟台江友硅胶开发公司生产;sephadexlh-20(20~80μm)为pharmacia公司生产;odsc18反相硅胶为merck公司生产;提取用乙醇;石油醚、乙酸乙酯、正丁醇为药用级,水为蒸馏水,其余试剂均为分析纯。
如图12所示,提取方法包括如下步骤:
三叶青提取物提取参照文献[张煜炯等.聚类分析和主成分分析法研究三叶青氯仿部位hplc指纹图谱[j].中成药,2016,38(3):607-612]分离纯化得到,经高效液相色谱(hplc)检测。
th-t部位、th-p部位、th-a部位、th-b部位、th-w部位的提取方法为:取三叶青干燥药材500g,加5倍体积80%乙醇水溶液浸泡24h后,加热回流提取,共3次,每次40min,合并提取液,过滤,减压回收蒸干,得总提取物th-t部位,得率11.3%;取所述总提取,加水混悬,分别采用10倍体积的石油醚(水饱和)进行分步萃取,分别得到石油醚部位th-p,得率0.08%;乙酸乙酯部位th-a,得率0.31%;丁醇部位th-b,得率1.1%;以及水部位th-w,得率8.76%。
th-w1部位的提取方法为:取所述水部位th-w进行大孔吸附树脂色谱,先使用纯水进行洗脱,除去糖分,再使用10%、30%、60%、95%乙醇水溶液分别依次洗脱;其中,10%乙醇水洗脱溶液减压回收蒸干后得到水部位脱糖流分th-w1,得率0.1%;
th-w2部位的提取方法为:取所述水部位th-w进行大孔吸附树脂色谱,先使用纯水进行洗脱,除去糖分,再使用10%、30%、60%、95%乙醇水溶液分别依次洗脱;其中,30%乙醇水洗脱溶液蒸干后得到水部位脱糖流分th-w1g,得率0.17%;
th-w3部位的提取方法为:将经80%乙醇提取(th-t)后的三叶青药材用水煮后减压回收蒸干,获得脱水物5.4克;
th-w4部位的提取方法为:将经80%乙醇提取(th-t)后的三叶青药材用水煮后减压回收蒸干,再使用10%、30%、60%、95%乙醇水溶液分别依次脱糖,其中,获得了10%乙醇水部位脱糖流分。
结果如下表所示:
表1不同提取方法提取三叶青的结果
试验1:验证三叶青提取物各部位对金黄色葡萄球菌生物膜抑制能力最强部位为th-w卒取段;
材料与方法
菌株:由本微生物室常规检测中留取的5株甲氧西林敏感金黄色葡萄球菌(methicillin-sensitivestaphylococcusaureus,mssa),5株耐甲氧西林金黄色葡萄球菌(methicillin-re.sistantstaphylococcusaureus,mrsa)。
仪器与试剂包括:vitekms全自动微生物质谱检测系统(法国生物梅里埃公司);96孔细胞培养板(美国gibco公司);多功能微孔板检测酶联仪(美国biotek公司);m-h肉汤和lb肉汤(杭州滨和公司);
实验方法包括:
金黄色葡萄球菌生物膜模型建立;挑取金黄色葡萄球菌单个菌落于4mllb培养基中,转移至35℃培养箱,于120r/min状态培养24h,取出调整菌液浓度至0.5麦氏浊度单位。用lb培养液1:100稀释上述菌悬液后,取100μl加入96孔板中,再加100μllb培养液,以不加菌液的200μllb培养液作空白对照,35℃静置培养24h、48h和72h后分别检测生物膜。所有实验重复3次,每次设3个复孔。
金黄色葡萄球菌生物膜成膜能力检测过程为:采用结晶紫染色法检测细菌生物膜形成能力,挑取哥伦比亚血琼脂平板上新鲜过夜培养单个菌落于4mllb培养基中,35℃120r/min培养18h。吸取10μl菌液至新鲜的4mllb培养基中进行传代培养。重复3次。将传代培养后获得的菌液浓度调至0.5麦氏浊度单位,取10μl菌液加入到含有190μllb培养液的96孔细胞培养板中,每株菌种做3个复孔,以不加菌液的200μllb培养液作空白对照。35℃静置培养6h。待生物膜形成之后,吸去上层浮游菌,加200μl结晶紫溶液染色15min,弃去染色液并用pbs冲洗3次洗去浮游细菌,待干后加200μl95%乙醇以溶解与细菌结合的结晶紫,用酶联仪测570nm处吸光度(a570nm)值。以空白对照孔平均吸光度值+3倍空白对照孔的标准差作为cutoff值(ac)。若实验组的a570nm≤ac,则成膜能力阴性;若a,a570nm>ac,则成膜能力阳性。
生物膜形成抑制试验包括如下步骤:挑取单个菌落置于lb肉汤中37℃200r/min培养16h,3000g离心20min后用生理盐水调整菌悬液浓度至1麦氏浊度单位。将三叶青提取物th-w段用lb肉汤倍比稀释至不同浓度(0.078~l0mg/ml),分别吸取198μl加入96孔板,以未加三叶青th-w提取物的lb肉汤作为阴性对照,再向每孔分别加入2μl备用的菌悬液。37℃培养24h后,用生理盐水漂洗3次以去除浮游菌。(1)结晶紫染色:用微量移液器吸干微孔中残余液体,各孔加入200μl(5g/l)结晶紫溶液,振荡器上摇15min,弃染液,生理盐水漂洗3次去除未结合结晶紫溶液,风干后各孔加入200μl95%乙醇溶液,以洗脱与生物膜结合的结晶紫,静置20min后于多功能酶联仪检测570nm处的吸光度(a570mm)。(2)阴性对照孔和加人不同浓度(0.078~l0mg/ml)的三叶青th-w提取物实验孔进行平板菌落稀释计数:向去除浮游菌的微孔中各加入200μl无菌生理盐水,超声振荡(频率:40khz;功率:200w)15min使粘附于孔壁和孔底的生物膜分散成浮游状态,用生理盐水倍比稀释后取10μl稀释菌悬液均匀涂布于羊血琼脂平板,于培养箱隔夜培养后选取长有5~20个菌落的平板计数菌落数量。实验重复3次,每次设3个复孔。
结果分析:
金黄色葡萄球菌成膜能力分析:5株金黄色葡萄球菌菌株和5株标准菌株均能形成生物膜。mssa培养24h时生物膜吸光度a570mm值即达峰值,为1.63±0.47;48h和72h时分别为1.18±0.83、1.56±0.44。mrsa成膜时间较长,24h时a570mm值为0.38±0.15;48h时吸光度a570mm为1.27±0.36,达峰值;72h时降为1.11±0.76。
如图1-10的结果可以得知:各个三叶青提取物都能抑制金黄色葡萄球菌的生物膜的形成,三叶青提取物th-w段对金黄色葡萄球菌生物膜形成的抑制作用最为明显。
在形成生物膜的过程中同时加入不同浓度和不同提取段的三叶青提取物;经三叶青提取物th-w段诱导24后后的mssa组和mrsa组生物膜形成明显低于对照组,提示th-w抑制明显,经比较组间有统计学差异(p<0.05);相同浓度和不同菌种作用24h时a570值与对照组比较生物膜形成能力显著性降低,各相同浓度组间较均有统计学差异(p<0.05)。相同药物浓度不同的三叶青提取段对金黄色葡萄球菌生物膜形成的抑制作用差异明显,组间均有统计学差异(p<0.05)。相同药物浓度三叶青提取物对不同金黄色葡萄球菌生物膜形成的抑制作用差异明显,组间较均有统计学差异(p<0.05)。
如图1-10所示的结果可以表明:
三叶青提取物th-t部位、th-p部位、th-a部位、th-b部位、th-w部位、th-w1部位、th-w2部位、th-w3部位、th-w4部位的各浓度(0.078-32mg/ml)对各5株甲氧西林敏感金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌生物膜均有抑制作用,对所有菌株的抑制作用均随着药物浓度的增加抑菌作用增强。有药物浓度依赖性。
对th-t部位、th-p部位、th-a部位、th-b部位、th-w部位、th-w1部位、th-w2部位、th-w3部位、th-w4部位最敏感的是甲氧西林敏感金黄色葡萄球菌,而对耐甲氧西林金黄色葡萄球菌作用较弱两对金黄色葡萄球菌的抑制差异达30%以上。
试验得知:三叶青提取物th-t部位、th-p部位、th-a部位、th-b部位、th-w部位、th-w1部位、th-w2部位、th-w3部位、th-w部位用m-h肉汤倍比稀释到32.0mg/ml对5株金黄色葡萄球菌mssa进行35℃培养16-20h后,细菌膜生成抑制作用以th-w部位最敏感。
三叶青提取物th-t部位、th-p部位、th-a部位、th-b部位、th-w部位、th-w1部位、th-w2部位、th-w3部位、th-w部位用m-h肉汤倍比稀释到32.0mg/ml对5株金黄色葡萄球菌mrsa进行35℃培养16-20h后,细菌膜生成抑制作用以th-w部位最敏感。
由此可知,不同三叶青提取物对金黄色葡萄球菌mssa和mrsa的生物膜生成的抑制用均以th-w部位敏感。
试验2:三叶青提取物抑制细菌生长试验,找出三叶青提取物th-w部位用培养基倍比稀释的最优浓度;
材料与方法
菌株包括:本微生室保存的甲氧西林敏感金黄色葡萄球菌(methicillin-sensitivestaphylococcusaureus,mssa-29213)1株、耐甲氧西林金黄色葡萄球菌(methicillin-re.sistantstaphylococcusaureus,mrsa-baa1029)1株及购买并由本微生物室保存的金黄色葡萄球菌标准株(atcc259231)1株。
仪器与试剂包括:vitekms全自动微生物质谱检测系统(法国生物梅里埃公司);96孔细胞培养板(美国gibco公司);多功能微孔板检测酶联仪(美国biotek公司);m-h肉汤和lb肉汤(杭州滨和公司);
实验方法包括:
抑制细菌生长试验的过程为:在进行三叶青提取物抑制金黄色葡萄球菌生长和对细菌生物膜抑制试验中发现,三叶青提取物各部位对金黄色葡萄球菌生物膜抑制能力最强部位为th-w卒取段。因此,本研究均选择th-w部位为本研究的试验药物。将配备好的三叶青提取物th-w部位用m-h肉汤倍比稀释(32.0、8.0、2.0、0.5、0.125、0.03、0.0075mg/ml),以未加任何药物的m.h肉汤作为空白对照。在96孔板中每孔分别加入100μl,制备微量稀释盘。将金黄色葡萄球菌mssa-29213、mrsa-baa1029和atcc259231菌株悬液调至0.5麦氏浊度单位,作1:20稀释,使其菌含量为5×106cfu/ml,取10μl上述菌悬液加入至制备好的微量稀释盘中。35℃培养16-20h,肉眼所见能完全抑制细菌生长的最低药物浓度判断为最低抑菌浓度(mic)值。实验重复3次,每次设3个复孔。
结果分析:
如图11所示的结果可以表明:
三叶青提取物th-w部位的各浓度(0.078-20mg/ml)对三株金黄色葡萄球菌生长均有抑制作用,对所有菌株的抑制作用均随着药物浓度的增加抑菌作用增强。有药物浓度依赖性。
对th-w部位最敏感的是甲氧西林敏感金黄色葡萄球菌,其次为金黄色葡萄球菌标准株,而对耐甲氧西林金黄色葡萄球菌作用最弱。
试验得知:三叶青提取物th-w部位用m-h肉汤倍比稀释到32.0mg/ml对金黄色葡萄球菌mssa-29213进行35℃培养16-20h后,细菌抑制率为0.88。
三叶青提取物th-w部位用m-h肉汤倍比稀释32.0mg/ml对金黄色葡萄球菌mrsa-baa1029进行35℃培养16-20h后,细菌抑制率为0.34。
三叶青提取物th-w部位用m-h肉汤倍比稀释32.0mg/ml对金黄色葡萄球菌atcc259231进行35℃培养16-20h后,细菌抑制率为0.7。
由此可知,三叶青提取物th-w部位用培养基倍比稀释的最优浓度为32.0mg/ml。
本发明提供一种三叶青提取物th-w对金黄色葡萄球菌的用途及其作用方法,分别对th-t部位,th-p部位,th-a部位,th-b部位,th-w部位,th-w1部位,th-w2部位,th-w3部位,th-w4部位进行试验,并进行对比,找出了最优部位为th-w部位;本发明将三叶青提取物th-w部位用不同的培养基倍比稀释浓度对金黄色葡萄球菌进行培养,再通过结晶紫染色法检测对比细菌生物膜形成能力,找出最优浓度。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!