从毛白杨叶中提取3′-O-苯甲酰基水杨苷的方法及3′-O-苯甲酰基水杨苷的应用与流程
本发明属于医药应用
技术领域:
,具体涉及从毛白杨叶中提取3′-o-苯甲酰基水杨苷的方法及3′-o-苯甲酰基水杨苷的应用。
背景技术:
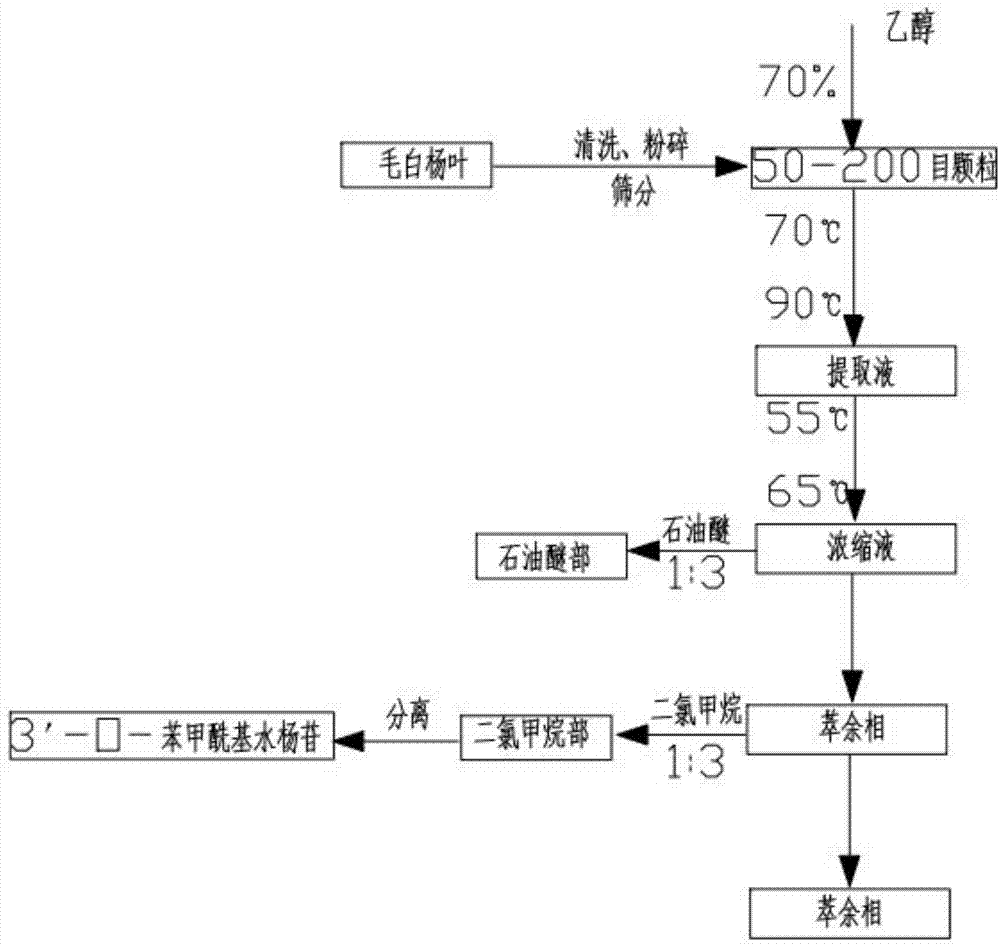
文献记载,3′-o-苯甲酰基水杨苷(chaenomeloidin)存在于杨柳树树干、树皮以及树叶中,但由于其含量较少,往往被忽略或者和其他化合物一起被制成混合提取物来研究其医药学性质。随着现代医学对水杨苷衍生物的进一步研究,水杨苷衍生物大量的工业合成,3′-o-苯甲酰基水杨苷的药学作用越来越被忽视。然而,3′-o-苯甲酰基水杨苷广泛存在与毛白杨等杨柳树中,尤其是毛白杨叶,原料来源广泛,分离提纯毛白杨叶中的有效组分并研究其药用价值将极大推进毛白杨叶在中药领域的应用。通常,学者将从毛白杨叶中提取的组合物来研究其药用价值,这导致在对3′-o-苯甲酰基水杨苷药用价值研究的缺失,不能清楚的表明3′-o-苯甲酰基水杨苷在治疗病症时的效果以及其表现出的细胞毒性。现有技术中,针对毛白杨叶有效组分的提取方法通常使用多功能提取罐提取、旋转蒸发仪蒸发浓缩,提取效率较低,目标化合物的最终得到率较低,导致中药材中本来含量不多的目标化合物不能有效析出,造成严重的浪费。在实验室中,由于提取效率低,目标化合物得到率低,常致使原料不足影响后续的实验研究。技术实现要素:有鉴于此,本发明提供一种从毛白杨叶中提取3′-o-苯甲酰基水杨苷的方法。本发明还公开了3′-o-苯甲酰基水杨苷在防治恶性肿瘤中的应用。本发明还公开了3′-o-苯甲酰基水杨苷在防治炎症中的应用。本发明解决其技术问题所采用的技术方案是:3′-o-苯甲酰基水杨苷在防治恶性肿瘤中的应用。3′-o-苯甲酰基水杨苷在防治炎症中的应用。一种从毛白杨叶中提取上述3′-o-苯甲酰基水杨苷的方法,包括以下步骤:预处理:清洗中药材毛白杨叶,并粉碎,筛选其中50目~200目的颗粒;提取:取经过预处理的毛白杨叶,投入实验室用多功能提取罐中,按预定药液比加入70%乙醇水溶液,在预定提取温度下,提取3h;浓缩:将提取产生的粗液过滤后,在预定浓缩温度下蒸发浓缩,至无醇味;萃取:对浓缩产生的浓缩液用石油醚在预定萃取比和萃取温度下进行萃取,石油醚萃取相浓缩得石油醚部,石油醚萃余相用二氯甲烷在预定萃取比和萃取温度下进行萃取,二氯甲烷萃取相浓缩得二氯甲烷部,对二氯甲烷部依次通过常压层析柱、硅胶柱、ods柱进行分离,除杂后得到3′-o-苯甲酰基水杨苷;其中,所述步骤“提取”中,预定药液比为1:10,预定提取温度为70℃~90℃;所述步骤“浓缩”中,预定浓缩温度为55℃~65℃;所述步骤“萃取”中,预定萃取温度为20℃~40℃,预定萃取比为1:3~1:5。由上述技术方案可知,本发明提供了一种从毛白杨叶中提取的3′-o-苯甲酰基水杨苷应用于预防或治疗恶性肿瘤或炎症,其有益效果是,实验发现,3′-o-苯甲酰基水杨苷在抑制肿瘤细胞生长以及抗炎的病理试验中,取得了意想不到的效果,对结肠癌肿瘤细胞抑制率达到70%以上,对胃癌肿瘤细胞的抑制率超过50%,且其抗炎活性在高剂量下尤为明显。同时,通过从毛白杨叶中提取富集3′-o-苯甲酰基水杨苷,合理利用了被废弃的毛白杨叶,原料来源广,工艺过程简单。在从毛白杨叶中提取富集3′-o-苯甲酰基水杨苷的过程中,采用恒温提取方法,选择合适的提取的温度,采用定温浓缩和萃取,最大程度提高3′-o-苯甲酰基水杨苷的提取效率以及3′-o-苯甲酰基水杨苷的收率。附图说明图1是3′-o-苯甲酰基水杨苷的基于毛白杨叶的提取制备工艺流程图。图2是毛白杨叶二氯甲烷部分离流程图。图3是3′-o-苯甲酰基水杨苷抗炎活性柱状图。图4是3′-o-苯甲酰基水杨苷抑制胃癌肿瘤细胞生长的柱状图。图5是3′-o-苯甲酰基水杨苷抑制结肠癌肿瘤细胞生长的柱状图。具体实施方式以下结合具体实施例,对本发明的技术方案做进一步说明。3′-o-苯甲酰基水杨苷存在于中药材毛白杨叶中,其结构式如下:3′-o-苯甲酰基水杨苷为白色针状结晶,溶于甲醇。请参看图3,发明人在实验中发现,3′-o-苯甲酰基水杨苷虽在毛白杨叶或是其他杨柳树叶中存在量较少,但其在抑制肿瘤细胞生长以及消炎的过程中发挥着积极且有效的作用,实验证明,3′-o-苯甲酰基水杨苷在浓度为62.5μg/ml~500μg/ml时,具有优秀的抗炎活性,在浓度为250μg/ml~500μg/ml时,具有优秀的抑制肿瘤细胞生长的活性,尤其是在作为抑制胃癌肿瘤细胞生长的药物时,其抑制率达到50%以上,在作为抑制肠癌肿瘤细胞生长的药物时,其抑制率达到70%以上,且细胞毒性较弱。3′-o-苯甲酰基水杨苷在毛白杨叶中的含量较低,在提取富集过程中,需要从各个方面,不断提高3′-o-苯甲酰基水杨苷的提取效率以及最终的3′-o-苯甲酰基水杨苷的得到率。请参看图1,在一较佳实施例中,采用恒温的提取氛围,采用定温定萃取比的萃取分离氛围,有效的提高了从毛白杨叶中提取3′-o-苯甲酰基水杨苷的提取效率,也有效的提高了3′-o-苯甲酰基水杨苷的得到率。例如,采用如下的生产工艺流程:预处理:清洗中药材毛白杨叶,并粉碎,筛选其中50目~200目的颗粒;提取:取经过预处理的毛白杨叶,投入实验室用多功能提取罐中,按预定药液比加入70%乙醇水溶液,在预定提取温度下,提取3h;浓缩:将提取产生的粗液过滤后,在预定浓缩温度下蒸发浓缩,至无醇味;萃取:对浓缩产生的浓缩液用石油醚在预定萃取比和萃取温度下进行萃取,石油醚萃取相浓缩得石油醚部,石油醚萃余相用二氯甲烷在预定萃取比和萃取温度下进行萃取,二氯甲烷萃取相浓缩得二氯甲烷部,对二氯甲烷部依次通过常压层析柱、硅胶柱、ods柱进行分离,除杂后得到3′-o-苯甲酰基水杨苷;其中,所述步骤“提取”中,预定药液比为1:10,预定提取温度为70℃~90℃;所述步骤“浓缩”中,预定浓缩温度为55℃~65℃;所述步骤“萃取”中,预定萃取温度为20℃~40℃,预定萃取比为1:3~1:5。作为优选,所述步骤“提取”中,预定药液比为1:10,预定提取温度为75℃。作为优选,所述步骤“浓缩”中,预定浓缩温度为55℃。作为优选,所述步骤“萃取”中,预定萃取温度为25℃,预定萃取比为1:3。发明人还意外的发现,一定的真空度有益于3′-o-苯甲酰基水杨苷从毛白杨叶中的分离效率,在上述实施例中,发明人选取了65kpaa~95kpaa(表压力,下同)的压力,即6kpaa~36kpaa的真空度来从毛白杨叶中分离提取3′-o-苯甲酰基水杨苷,3′-o-苯甲酰基水杨苷的最终得到量显著提高,同时,提取效率也得到了有效的提升。以下通过实验,具体说明从毛白杨叶中提取3′-o-苯甲酰基水杨苷的方法以及毛白杨叶作为抑制肿瘤细胞生长药物及作为消炎药物的应用。一、3′-o-苯甲酰基水杨苷的提取富集1、取毛白杨叶共11.5kg,清洗后进行粉碎,筛选其中50~200目的粉状颗粒,每次3kg加入实验室用多功能提取罐中,加入70%乙醇水溶液30kg(药液比1:10),在70℃提取温度下进行提取,提取时间为3h/次。将所有提取完成得到的粗液在55℃浓缩温度下进行浓缩,直至无醇味,所得到的浓缩产物为毛白杨叶的总提取物。取上述得到的总提取物部分,首先用石油醚(分析纯度)在25℃萃取温度下进行静置萃取,萃取比(萃取液:萃取剂,下同)为1:3,萃取完成后,萃取相在55℃萃取温度下浓缩得毛白杨叶的石油醚部;萃余相接着用二氯甲烷(分析纯)在相同萃取温度下进行静置萃取,萃取比为1:3,萃取完成后,萃取相在相同温度下浓缩得毛白杨叶的二氯甲烷部;萃余相接着用乙酸乙酯(分析纯)在相同温度下进行静置萃取,萃取比为1:4,萃取完成后,萃取相在相同温度下浓缩得毛白杨叶的乙酸乙酯部;萃余相接着用正丁醇(分析纯)在相同温度下进行静置萃取,萃取比为1:5,萃取完成后,萃取相在相同温度下浓缩得毛白杨叶的正丁醇部;萃余相在相同温度下浓缩得毛白杨叶的水部。将上述过程中得到的毛白杨叶总提取物、石油醚部、二氯甲烷部、乙酸乙酯部、正丁醇部和水部分别在-4℃环境下冷藏备用。本实验中,毛白杨叶提取总提取物浸膏量为2.496kg,浸膏得率为21.70%。二氯甲烷的萃取率为26.8%,乙酸乙酯萃取率为7.43%,正丁醇萃取率为44.2%。2、实验1中,取毛白杨叶共11.5kg,清洗后进行粉碎,筛选其中50~200目的粉状颗粒,每次3kg加入实验室用多功能提取罐中,加入70%乙醇水溶液30kg(药液比1:10),在80℃提取温度下进行提取,提取时间为3h/次。其他条件相同。本实验中,总提取物的浸膏量为2.412kg,总提取物的浸膏得率为20.97%。其中,二氯甲烷萃取率26.5%、乙酸乙酯萃取率7.38%、正丁醇萃取率18.03%。3、实验2中,取毛白杨叶共11.5kg,清洗后进行粉碎,筛选其中50~200目的粉状颗粒,每次3kg加入实验室用多功能提取罐中,加入70%乙醇水溶液30kg(药液比1:10),在90℃提取温度下进行提取,提取时间为3h/次。其他条件相同。本实验中,总提取物的浸膏量为2.375kg,总提取物的浸膏得率为20.65%。其中,二氯甲烷萃取率26.7%、乙酸乙酯萃取率7.46%、正丁醇萃取率17.75%。上述实验中,可以清楚的得到,恒温的提取环境提高了总提取物的浸膏得率,间接提高了目标化合物3′-o-苯甲酰基水杨苷的得到率。在实验中我们发现,恒温的提取环境虽然有助于提取溶剂和毛白杨叶料的反混效率,提高了总提取物的浸膏得率,但是,升高温度的过程中,提取溶剂气化较快,使得提取罐内产生大量泡沫,影响了实验效果。故而,我们选择70℃~90℃的提取温度,在不影响提取效率的情况下,最大程度获得目标化合物3′-o-苯甲酰基水杨苷。4、实验1中,将所有提取完成得到的粗液在65℃浓缩温度下进行浓缩,直至无醇味,所得到的浓缩产物为毛白杨叶的总提取物。其他条件不变。本实验中,总提取物的浸膏量为2.458kg,总提取物的浸膏得率为21.37%。其中,二氯甲烷萃取率26.7%、乙酸乙酯萃取率1.58%、正丁醇萃取率17.95%。5、实验1中,首先用石油醚(分析纯度)在40℃萃取温度下进行静置萃取,萃取比为1:3,萃取完成后,萃取相在55℃浓缩温度下浓缩得毛白杨叶的石油醚部;萃余相接着用二氯甲烷(分析纯)在相同萃取温度下进行静置萃取,萃取比为1:3,萃取完成后,萃取相在相同温度下浓缩得毛白杨叶的二氯甲烷部;萃余相接着用乙酸乙酯(分析纯)在相同温度下进行静置萃取,萃取比为1:4,萃取完成后,萃取相在相同温度下浓缩得毛白杨叶的乙酸乙酯部;萃余相接着用正丁醇(分析纯)在相同温度下进行静置萃取,萃取比为1:5,萃取完成后,萃取相在相同温度下浓缩得毛白杨叶的正丁醇部;萃余相在相同温度下浓缩得毛白杨叶的水部。其他条件不变。本实验中,总提取物的浸膏量为2.490kg,总提取物的浸膏得率为21.65%。其中,二氯甲烷萃取率25.2%、乙酸乙酯萃取率1.32%、正丁醇萃取率17.02%。从实验4与实验5中,可以清楚地得到,浓缩温度、萃取温度以及萃取比对目标化合物的收率都有着一定程度的影响,选择合适的浓缩温度,保证目标化合物不变质、不气化,有助于进一步提高目标化合物的收率。萃取温度和萃取比是影响萃取过程的最重要的影响因素,过高的萃取比和过高的温度都将使目标化合物溶于萃余相中的量过大而导致收率降低,过低的萃取比和过低的萃取温度不能保证目标化合物被完全萃取至萃取相中,降低了萃取的效率。7、实验2中,采取微负压的提取氛围,压力为65kpaa,其他条件不变。本实验中,总提取物的浸膏量为2.896kg,总提取物的浸膏得率为25.18%。其中,二氯甲烷萃取率26.1%、乙酸乙酯萃取率1.35%、正丁醇萃取率17.32%。8、实验2中,采取微负压的提取氛围,压力为85kpaa,其他条件不变。本实验中,总提取物的浸膏量为2.760kg,总提取物的浸膏得率为24.00%。其中,二氯甲烷萃取率25.8%、乙酸乙酯萃取率1.29%、正丁醇萃取率18.01%。9、实验2中,采取微负压的提取氛围,压力为95kpaa,其他条件不变。本实验中,总提取物的浸膏量为2.572kg,总提取物的浸膏得率为22.36%。其中,二氯甲烷萃取率26.2%、乙酸乙酯萃取率1.32%、正丁醇萃取率17.65%。实验7到实验9可以看出,随着压力的降低,真空度提高,提取反应的物质交换速率不断加强,尤其是随着压力降低,提取溶剂的沸点降低,反应扰动明显,增加了目标化合物从毛白杨叶中被提取出来的效率,目标化合物的收率也有了显著的提高。随着压力进一步降低,反应罐中出现大量的泡沫,这极大的影响了反应的提取效率。上述实验,制备了毛白杨叶的总提物、石油醚部、二氯甲烷部、乙酸乙酯部、正丁醇部以及水部。通过恒温提取,提高提取效率,使提取溶剂与毛白杨叶充分接触,反混,使提取得率有一定程度提高。而通过定温浓缩、定温萃取,最大程度提高3′-o-苯甲酰基水杨苷的提取效率以及最终3′-o-苯甲酰基水杨苷的得到率。二、对毛白杨叶的二氯甲烷部进行分离,得到目标化合物3′-o-苯甲酰基水杨苷请参看图2,对毛白杨叶的二氯甲烷部进行分离,得到6种化合物。其分离过程如下:取毛白杨叶二氯甲烷部萃取物适量,加入适量的甲醇将萃取物放在超声清洗机中溶解,待所有萃取物都溶解于甲醇中后,加入与萃取物等量的100目~200目的硅胶进行拌样,后置于干燥箱中干燥后,研磨均匀。然后按照硅胶:样品=20:1的量进行装柱,然后以二氯甲烷-甲醇系统(50:1~0:1),进行梯度洗脱。洗脱液用250ml的锥形瓶接装,根据tlc情况,将成分相似的洗脱液合并,共得到e1-e5,共5个组分。e2组分经过ods柱(洗脱梯度,20%~100%甲醇),得到e2-2,再过硅胶柱层析(洗脱梯度,二氯甲烷:甲醇系统=25:1~0:1),得到化合物2和化合物3。经现代核磁光谱鉴定,化合物2为:3′-o-苯甲酰基水杨苷(chaenomeloidin)。上述过程中,3′-o-苯甲酰基水杨苷的相对毛白杨叶二氯甲烷部的收率为0.0021%,即,每100g二氯甲烷部的提取物可分离获取2.1mg3′-o-苯甲酰基水杨苷。三、3′-o-苯甲酰基水杨苷抗炎活性实验1、实验材料2、主要仪器thermo371二氧化碳恒温培养箱上海巴玖实业有限公司超净工作台苏州金净净化设备公司sx-500高压灭菌锅上海莱睿科学仪器有限公司高速离心机hc3518北京科大创新中佳分公司-20℃低温冰箱青岛海尔公司-80℃低温冰箱sanyo公司移液器吉尔森p型移液器公司细胞培养板与细胞培养皿costa公司显微镜olympus公司rnase-free枪头,ep管axygenscientific公司酶标仪芬兰雷勃酶标仪公司电热恒温水浴锅上海森信实验仪器有限公司电子精密天平上海奥豪斯仪器有限公司3、实验方法实验用品去热源处理:加样枪头、ep管、细胞培养瓶等塑料实验用品清洗干净后,经60℃辐照(1x106gray,30分钟),去热源处理。烧杯、试管、玻璃培养瓶等玻璃实验用品,清洗干净后经300°干烘2小时,冷却后锡箔纸密封瓶口,备用。其他实验用品按照常规实验高压消毒灭菌处理。试剂配制:细胞冻存液:为含10%胎牛血清(fetalbovineserum,fbs),10%dmso的dmem(dulbecco'smodifiedeaglemedium)高糖培养液。lps(脂多糖)配制:精密称取1mglps和量取1ml含10%胎牛血清的dmem高糖培养液混合,震荡为母液。单体配制:取各单体化合物放于1.5ep管,加1mldmso配制成母液,震荡混匀。d-hanks液:称取kcl0.4g,nacl8g,na2hpo40.133g,nahco30.35g,kh2po40.06g,酚红0.02g,依次溶解在约700ml双蒸水里,将其定容于1000ml,充分混匀,分装入瓶,包扎严实,然后放入高压锅,在122℃下高压灭菌40min。raw264.7细胞复苏:将装有raw264.7的冻存管从液氮罐中取出,立即将其置于37℃温水中,迅速将其融化。然后将细胞悬液转入到预先加有适量含10%fps,青霉素100u/ml,链霉素100μg/ml的dmem高糖培养液的离心管中,盖上塞子,配平后1000rpm离心5min,去上清,加入dmem高糖培养液,重悬细胞,然后接种到培养瓶内。raw264.7细胞培养:raw264.7细胞采用贴壁方法进行培养,培养液为含有10%fps,青霉素100u/ml,链霉素100μg/ml的dmem高糖培养液,培养条件为5%co2,温度37℃,相对饱和湿度,将培养瓶放于倒置显徴镜下观察细胞的生长情况,依照细胞的生长状况,给予适当的换液,待细胞融合到80%-90%,按1:4进行传代。raw264.7细胞冻存:取生长状态良好的raw264.7,先用d-hanks液洗1次,再加入d-hanks液浸泡细胞2min后弃去液体,加入完全培养液后用滴管吹打细胞培养瓶底面,1000rpm离心5min收集细胞,加入2ml细胞冻存液,重悬细胞,移入冻存管中,拧紧管盖,标明细胞名称和冻存日期。将上述冻存管放入-20℃冰箱2h,然后转移到-80℃冰箱24h,最后转移到液氮中长期保存。4、细胞建模及分组将毛白杨叶分离得到的化合物3′-o-苯甲酰基水杨苷分别溶解于dmso中,并按照实验要求用不含fbs的dmem配制成500μg/ml的药物浓度:,然后按照倍减稀释法,取1ml的500μg/ml稀释到2ml,得250μg/ml的药物,依次稀释得到125μg/ml、62.5μg/ml、31.25μg/ml的药物,待用。取小鼠raw264.7细胞,吸去培养瓶中残余培养基,用pbs缓冲液清洗两次,加入胰蛋白酶-edta消化液放在培养箱10分钟,将贴壁的细胞消化下来,再加入适量的完全培养基,将细胞离心后,吸去废液,加入适量完全培养基,混匀细胞。计数后将细胞浓度调制1×105个/ml,然后接种于96孔板上,每孔100μl细胞。在37℃,5%co2的细胞培养箱中培养24h,24h后吸去96孔板中的残余培养基,加入100μl的2μg/ml的lps溶液(完全培养基配制)。在37℃,5%co2的细胞培养箱中培养24h即得raw264.7炎症模型。取上述lps诱导raw264.7炎症细胞,加入所要测试抗炎活性的药物,分为500μg/ml、250μg/ml、125μg/ml、62.5μg/ml、31.25μg/ml、空白对照六组,每组设四个复孔,于37℃,5%co2的细胞培养箱中培养24h后,每孔加入10μl的cck-8检测试剂,在细胞培养箱中培养2.5h后,用酶标仪,在波长450nm下检测每孔的吸光度od值,计算细胞的抑制率以及细胞生存率。上述实验中,可以清楚的得到,3′-o-苯甲酰基水杨苷有着良好的抗炎活性,尤其是在62.5μg/ml~500μg/ml的剂量下,其抗炎活性显著,且3′-o-苯甲酰基水杨苷的抗炎活性与其剂量成正比例关系,剂量越大,抗炎活性越强,且在此浓度下未发现有明显的细胞毒性,有着作为抗炎药物的潜力。四、3′-o-苯甲酰基水杨苷抑制胃癌肿瘤细胞生长取小鼠胃癌细胞,吸去培养瓶中残余培养基,用pbs缓冲液清洗两次,加入胰蛋白酶-edta消化液放在培养箱10分钟,将贴壁的细胞消化下来,再加入适量的完全培养基,将细胞离心后,吸去废液,加入适量完全培养基,混匀细胞。计数后将细胞浓度调制1×105个/ml,然后接种于96孔板上,每孔100μl细胞。在37℃,5%co2的细胞培养箱中培养24h,24h后吸去96孔板中的残余培养基加入所要测试的3′-o-苯甲酰基水杨苷,分为500μg/ml、250μg/ml、125μg/ml、62.5μg/ml、31.25μg/ml、空白对照六组,每组设四个复孔,于37℃,5%co2的细胞培养箱中培养24h后,每孔加入10μl的cck-8检测试剂,在细胞培养箱中培养2.5h后,用酶标仪,在波长450nm下检测每孔的吸光度od值,计算细胞的抑制率。上述实验中,可以清楚的得到,3′-o-苯甲酰基水杨苷有着良好的抑制胃癌肿瘤细胞生长的效用,尤其是在250μg/ml~500μg/ml的剂量下,其抑制胃癌肿瘤细胞生长活性显著,且3′-o-苯甲酰基水杨苷的抗癌活性与其剂量成正比例关系,剂量越大,抗癌活性越强,且在此浓度下未发现有明显的细胞毒性,有着优秀地作为抑制胃癌肿瘤细胞生长药物的潜力。五、3′-o-苯甲酰基水杨苷抑制肠癌肿瘤细胞生长取小鼠肠癌细胞,吸去培养瓶中残余培养基,用pbs缓冲液清洗两次,加入胰蛋白酶-edta消化液放在培养箱10分钟,将贴壁的细胞消化下来,再加入适量的完全培养基,将细胞离心后,吸去废液,加入适量完全培养基,混匀细胞。计数后将细胞浓度调制1×105个/ml,然后接种于96孔板上,每孔100μl细胞。在37℃,5%co2的细胞培养箱中培养24h,24h后吸去96孔板中的残余培养基加入所要测试的3′-o-苯甲酰基水杨苷,分为500μg/ml、250μg/ml、125μg/ml、62.5μg/ml、31.25μg/ml、空白对照六组,每组设四个复孔,于37℃,5%co2的细胞培养箱中培养24h后,每孔加入10μl的cck-8检测试剂,在细胞培养箱中培养2.5h后,用酶标仪,在波长450nm下检测每孔的吸光度od值,计算细胞的抑制率。上述实验中,可以清楚的得到,3′-o-苯甲酰基水杨苷有着良好的抑制肠癌肿瘤细胞生长的效用,尤其是在62.5μg/ml~500μg/ml的剂量下,其抗癌活性显著,且3′-o-苯甲酰基水杨苷的抗癌活性与其剂量成正比例关系,剂量越大,抗癌活性越强,且在此浓度下未发现有明显的细胞毒性,有着作为抑制肠癌肿瘤细胞生长药物的潜力。上述实验中,可以清楚的得到,3′-o-苯甲酰基水杨苷在抑制胃癌和肠癌肿瘤细胞生长中有着积极的效用,相同实验验证,3′-o-苯甲酰基水杨苷在抑制其他肿瘤细胞生长中也能发挥积极的效用,如在抑制乳腺癌、肺癌、食道癌、肝癌以及子宫癌肿瘤细胞生长中发挥积极效用。以上所揭露的仅为发明较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1