狂犬病糖蛋白病毒样颗粒(VLP)的制作方法
对相关申请的交叉引用
本申请要求2011年11月5日提交的美国临时申请no.61/410,767的权益,其公开内容在此通过提及完整并入用于所有目的。
电子提交的文本文件的描述
随本文电子提交的文本文件的内容通过提及完整并入本文:序列表的计算机可读形式拷贝(文件名:novv_047_01wo_seqlist_st25.txt,记录日期:2011年11月7日,文件大小7千字节)。
发明领域
一般而言,本发明涉及包含狂犬病病毒(rv)糖蛋白(g蛋白)的病毒样颗粒(vlp)及其生成和使用方法,包括用于治疗和/或预防狂犬病病毒感染的免疫原性组合物诸如疫苗。
发明背景
狂犬病病毒(rv)是弹状病毒科(rhabdoviridae)科的一种非分段负链rna病毒,并且在人和动物中诱导致命性神经病学疾病。每年报告超过70,000例人死亡,并且数百万其他人需要保留后治疗。虽然已经在狂犬病预防和治疗方面做出相当大的进展,但是该疾病仍然是公共健康的一项主要威胁,而且在世界范围继续引起许多人死亡。犬在亚洲、非洲和拉丁美洲仍然是最重要的贮主,在那里发生大多数人狂犬病病例。在发达国家,人狂犬病在过去50年期间主要由于宠物动物的常规疫苗接种而已经显著下降。然而,经由暴露于野生动物的狂犬病传播已经作为疾病的一种主要原因出现。在美国,已经在野生动物中报告了超过90%的动物狂犬病病例,代表不断的公共健康威胁。在过去十年中的大多数人病例已经与存在于蝙蝠,特别是银发蝙蝠(silver-hairedbat)中的rv联系起来。
狂犬病病毒具有两种主要的结构组分:螺旋核糖核蛋白核心(rnp)和围绕的包膜。狂犬病基因组编码5种蛋白质:核蛋白(n)、磷蛋白(p)、基质蛋白(m)、糖蛋白(g)和聚合酶(大蛋白)(l)。野生型狂犬病基因组中的基因次序是3’-n-p-m-g-l-5’。n、l和p蛋白与核心rnp复合物联合。rnp复合物由通过与聚合酶l和p蛋白组合的n壳体化的rna基因组构成。此复合物充当病毒转录和复制的模板。rv的病毒包膜组分由跨膜糖蛋白(g)和基质(m)蛋白组成。糖蛋白形成约400个三聚体刺突,其在病毒表面上紧密排列。m蛋白与包膜和rnp两者联合,并且可以是狂犬病病毒装配的中心蛋白。
如上文记录的,狂犬病在世界范围仍然是一种主要的公共健康威胁。控制狂犬病并且保护人类免于狂犬病需要几种控制策略,诸如宠物动物和野生动物携带者的常规疫苗接种、对有风险的人的暴露前免疫、和受到患狂犬病的动物咬伤的人的暴露后处理。虽然自细胞培养物制备的灭活狂犬病病毒(rv)疫苗是安全且耐受良好的,但是它们具有多种缺点。它们难以制造,难以贮存,具有较低的免疫原性,而且需要多次注射。此外,它们是昂贵的,并且如此是发展中国家需要疫苗的大多数人力不能及的。另外,这些灭活的疫苗通常包含可引起不想要的副作用的佐剂。如此,需要更安全的、更便宜的、且更有效的rv疫苗。
本申请通过开发用于生成包含狂犬病糖蛋白(g)的病毒样颗粒(vlp)的新颖方法来解决此需要。
发明概述
本发明涉及在用于治疗和预防狂犬病病毒感染的疫苗中使用的狂犬病病毒(rv)病毒样颗粒(vlp)。本发明的rvvlp具有在哺乳动物受试者中诱导针对狂犬病病毒的有力免疫应答的潜力。
在第一个方面,本发明提供了包含一种或多种rv糖蛋白(g蛋白)的rvvlp。rvg蛋白可以源自任何合适的rv株,包括但不限于人、犬、蝙蝠、浣熊(raccoon)、臭鼬(skunk)、和狐rv株衍生。在一个实施方案中,包含一种或多种rvg糖蛋白的rvvlp可以为胶束(micelles)形式。在一些实施方案中,rvvlp可以包含一种或多种额外的rv蛋白,其选自核蛋白(n)、磷蛋白(p)、基质蛋白(m)、和聚合酶(大蛋白)(l)。在一个具体的实施方案中,本发明的rvvlp可以包含rv基质蛋白(m)。在一个实施方案中,m蛋白源自人rv株衍生。在另一个实施方案中,m蛋白源自犬rv株衍生。在又一个实施方案中,m蛋白源自蝙蝠rv株衍生。在其它实施方案中,基质蛋白可以是来自流感病毒株的m1蛋白。在一个实施方案中,流感病毒株是禽流感病毒株。在其它实施方案中,m蛋白可以源自新城疫病毒(ndv)株衍生。
在一个实施方案中,进一步优化rvg蛋白的编码序列以增强在其合适的宿主细胞中的表达。在一个实施方案中,宿主细胞是昆虫细胞。在一个例示性的实施方案中,昆虫细胞是sf9细胞。
可以使用本发明的rvvlp来预防和/或治疗rv感染。如此,在另一个方面,本发明提供了用于引发针对rv的免疫应答的方法。该方法牵涉对受试者,诸如人或动物受试者施用免疫学有效量的含有rvvlp的组合物。
在另一个方面,本发明提供了包含一种或多种rv糖蛋白(g蛋白)的药学可接受疫苗组合物。
在一个实施方案中,本发明包括免疫原性配制剂,其包含至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。在另一个实施方案中,本发明提供了包含一个或多个容器的药用包装或试剂盒,所述容器填充有本发明的疫苗配制剂的一种或多种成分。
在另一个实施方案中,本发明提供了配制对哺乳动物诱导针对感染或其至少一种疾病症状的免疫的疫苗或抗原性组合物的方法,包括对配制剂添加有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。在一个优选的实施方案中,感染是rv感染。
本发明的rvvlp可用于制备刺激免疫应答的组合物,所述免疫应答赋予针对传染原的免疫或实质性免疫。如此,在一个实施方案中,本发明提供了在受试者中诱导针对感染或其至少一种疾病症状的免疫的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
在又一个方面,本发明提供了在受试者中诱导针对rv感染或至少一种疾病症状的实质性免疫的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
本发明的组合物在对脊椎动物施用时可以在脊椎动物(例如,人或犬)中诱导实质性免疫。如此,在一个实施方案中,本发明提供了在受试者中诱导针对rv感染或至少一种疾病症状的实质性免疫的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。在另一个实施方案中,本发明提供了针对rv接种哺乳动物的方法,包括对哺乳动物施用保护诱导量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。系统性施用防范性疫苗配制剂,例如通过使用针和注射器,或无针注射装置的皮下或肌肉内注射来进行。在一个例示性的实施方案中,肌肉内施用疫苗配制剂。
在另一个实施方案中,本发明包括在受试者中诱导对感染或其至少一种症状的保护性抗体应答的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
在另一个实施方案中,本发明包括在受试者中诱导对rv感染或至少一种疾病症状的保护性细胞应答的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
在又一个方面,本发明提供了编码狂犬病糖蛋白(g蛋白)的分离的核酸。在一个例示性的实施方案中,编码蛋白质狂犬病糖蛋白(g蛋白)的分离的核酸是seqidno:1。
在又一个方面,本发明提供了包含编码狂犬病糖蛋白(g蛋白)的核酸的分离的细胞。在一个例示性的实施方案中,编码蛋白质狂犬病糖蛋白(g蛋白)的分离的核酸是seqidno:1。
在又一个方面,本发明提供了包含编码狂犬病糖蛋白(g蛋白)的核酸的载体。在一个例示性的实施方案中,编码蛋白质狂犬病糖蛋白(g蛋白)的分离的核酸是seqidno:1。在一个实施方案中,载体是杆状病毒载体。
在又一个方面,本发明提供了生成包含一种或多种狂犬病糖蛋白(g蛋白)的rvvlp的方法,包括(a)转化宿主细胞以表达编码狂犬病糖蛋白(g蛋白)的核酸;并(b)在有助于生成所述rvvlp的条件下培养所述宿主细胞。在一个实施方案中,编码狂犬病糖蛋白(g蛋白)的核酸是seqidno:1。在另一个实施方案中,宿主细胞是昆虫细胞。在又一个实施方案中,昆虫细胞是用包含狂犬病糖蛋白(g蛋白)的杆状病毒载体转染的昆虫细胞。
附图简述
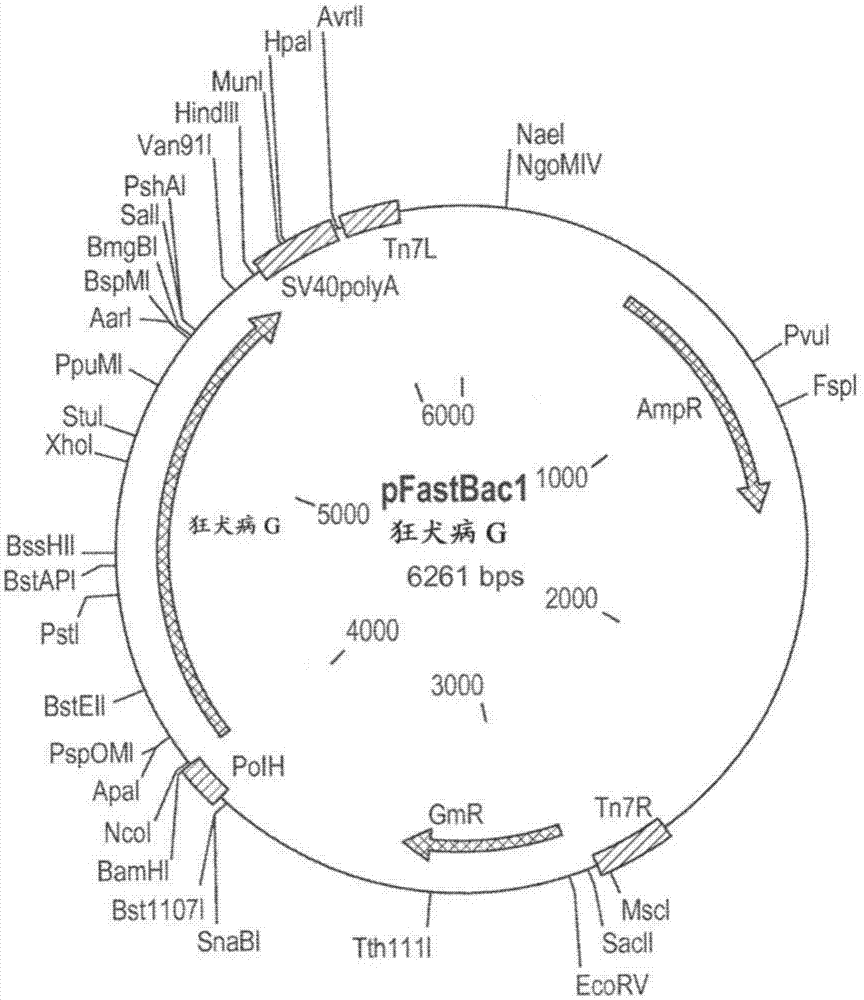
图1描绘了包含狂犬病病毒g核酸序列(seqidno:1)的pfastbac1载体的质粒图。
图2描绘了在还原性(图2a)和非还原性条件(图2b)两者下使用抗rv兔血清的针对rvg蛋白的western印迹的结果。
图3描绘了以放大率150,000x在负染电子显微术拍摄的胶束形式的纯化的重组rvg蛋白颗粒的图像。
图4描绘了施用稀释度增加的rvg颗粒的兔中的抗体诱导测定法的结果。
图5显示了包含狂犬病病毒g核酸序列(seqidno:1)(顶部)和rvg蛋白序列(seqidno:2)(底部)的pfastbac1载体的蛋白质序列。
图6的图显示了不同天数的抗狂犬病病毒抗体滴度,其以每个免疫方案的几何均值绘图(对于每个免疫组n=5)。
发明详述
如本文中所使用的,术语“佐剂”指如下的化合物,其在与特定的免疫原(例如包含一种或多种rv糖蛋白(g蛋白)的rvvlp)在配制剂中组合使用时,会提升或以其它方式改变或修饰由此所致的免疫应答。对免疫应答的修饰包括对抗体和细胞免疫应答之任一或两者的强化或使其特异性增宽。对免疫应答的修饰还可以意味着降低或抑制某些抗原特异性免疫应答。
如本文中所使用的,术语“抗原性配制剂”或“抗原性组合物”指在对脊椎动物,尤其是禽类或哺乳动物施用时会诱导免疫应答的制剂。
如本文中所使用的,术语“禽流感病毒”指主要存在于禽类中,但也可以感染人类或其它动物的流感病毒。在一些例子中,禽流感病毒可以从一个人传播或扩散到另一个。感染人的禽流感病毒具有引起流感大流行,即人发病率和/或死亡率的潜力。在出现新流感病毒株(人对其没有天然免疫的病毒)时发生大流行,扩散超出个别地区,可能在全球范围,而且一次感染许多人。
如本文中所使用的,“有效剂量”一般指足以诱导免疫、预防和/或改善感染或减轻至少一种感染或疾病症状、和/或增强另一剂包含一种或多种rv糖蛋白(g蛋白)的rvvlp的功效的包含一种或多种rv糖蛋白(g蛋白)的rvvlp量。有效剂量可以指足以延迟感染或疾病发作或使之最小化的包含一种或多种rv糖蛋白(g蛋白)的rvvlp量。有效剂量还可以指在感染或疾病的治疗或控制中提供治疗益处的包含一种或多种rv糖蛋白(g蛋白)的rvvlp量。此外,有效剂量是就单独的或与其它疗法组合在感染或疾病的治疗或控制中提供治疗益处的包含一种或多种rv糖蛋白(g蛋白)的rvvlp而言的量。有效剂量还可以是足以增强受试者(例如人)自己针对后来对传染原或疾病的暴露的免疫应答的量。免疫水平可以通过例如测量中和性分泌性和/或血清抗体的量(例如通过噬斑中和(plaqueneutralization)、补体结合(complementfixation)、酶联免疫吸附、或微中和(microneutralization)测定法来进行),或者通过测量细胞应答,诸如但不限于细胞毒性t细胞、抗原呈递细胞、辅助t细胞、树突细胞/或其它细胞应答来加以监测。在疫苗的情况中,“有效剂量”是预防疾病和/或降低症状严重性的剂量。例如,可以通过荧光流式细胞术或t细胞测定法,诸如但不限于t细胞增殖测定法、t细胞细胞毒性测定法、tetramer测定法、和/或elispot测定法通过使用特异性标志物测量例如存在的cd4+和cd8+细胞量监测t细胞应答。在疫苗的情况中,“有效剂量”是预防疾病和/或降低症状严重性的剂量。
如本文中所使用的,术语“有效量”指对于实现想要的生物学效应必需的或足够的包含一种或多种rv糖蛋白(g蛋白)的rvvlp的量。组合物的有效量将是达到选定结果的量,并且该量可以由本领域技术人员按常规确定。例如,用于预防、治疗和/或改善感染的有效量可以是引起免疫系统活化所必需的量,其导致在暴露于包含一种或多种rv糖蛋白(g蛋白)的rvvlp时形成抗原特异性免疫应答。该术语也是“足够量”的同义词。在另一个实施方案中,有效量是在期望的天数,例如7、10、14或更多天中在相关动物模型、动物或人患者中诱导血清保护的rvg胶束量(按重量计)。
如本文中所使用的,术语“表达”指多核酸转录成mrna,并翻译成肽、多肽、或蛋白质的过程。若多核酸自基因组dna衍生,则表达可以(若选择合适的真核宿主细胞或生物体)包括mrna的剪接。在本发明的上下文中,该术语还涵盖其表达后实现的rvg基因mrna和rvg蛋白的产量。
如本文中所使用的,术语“g蛋白”或“g糖蛋白”或“g蛋白多肽”指具有rvg蛋白多肽的整个或部分氨基酸序列的多肽或蛋白质。
如本文中所使用的,术语“免疫原”或“抗原”指能够引发免疫应答的物质诸如蛋白质、肽、肽、核酸。这两个术语也都涵盖表位,并且可互换使用。
如本文中所使用的,术语“免疫刺激物”指经由身体自身的化学信使(细胞因子)增强免疫应答的化合物。这些分子包括具有免疫刺激、免疫强化和促炎症活性的各种细胞因子、淋巴因子和趋化因子,诸如干扰素(ifn-y)、白介素(例如il-1,il-2,il-3,il-4,il-12,il-13);生长因子(例如粒细胞-巨噬细胞(gm)集落刺激因子(csf));及其它免疫刺激分子,诸如巨噬细胞炎性因子、flt3配体、b7.1;b7.2等。免疫刺激物分子可以在与本发明vlp相同的配制剂中施用,或者可以分开施用。可以施用蛋白质或编码该蛋白质的表达载体来产生免疫刺激效应。
如本文中所使用的,术语“免疫原性配制剂”指在对脊椎动物,例如哺乳动物施用时会诱导免疫应答的制剂。
如本文中所使用的,术语“传染原”指在脊椎动物中引起感染的微生物。通常,生物体是病毒、细菌、寄生物、原生动物和/或真菌。
如本文中所使用的,术语“多价”指具有一种或多种针对传染原或疾病的多种类型或毒株,例如,超过一种rvg蛋白类型、毒株、序列等的抗原性蛋白质/肽或免疫原的组合物。
如本文中所使用的,术语“药学可接受疫苗”指含有包含一种或多种rv糖蛋白(g蛋白)的rvvlp的配制剂,其处于能够对脊椎动物施用的形式,并且诱导足以诱导免疫以预防和/或改善感染或疾病,和/或降低感染或疾病的至少一种症状,和/或增强另一剂包含一种或多种rv糖蛋白(g蛋白)的rvvlp的功效的保护性免疫应答。通常,疫苗包含悬浮或溶解有本发明组合物的常规盐水或缓冲水性溶液介质。在此形式中,可以方便地使用本发明的组合物以预防、改善、或以其它方式处理感染。在对宿主导入后,疫苗能够激发免疫应答,包括但不限于抗体和/或细胞因子的生成和/或细胞毒性t细胞抗原呈递细胞、辅助t细胞、树突细胞的活化和/或其它细胞应答。
如本文中所使用的,短语“保护性免疫应答”或“保护性应答”指由脊椎动物(例如人)所展现出的、由针对传染原或疾病的抗体所介导的免疫应答,其预防或改善感染或减轻其至少一种疾病症状。包含一种或多种rv糖蛋白(g蛋白)的本发明的rvvlp可以刺激如下抗体的生成,所述抗体例如中和传染原、阻断传染原进入细胞、阻断所述传染原的复制、和/或保护宿主细胞免于感染和破坏。该术语还可以指由脊椎动物(例如人)所展现出的、由t淋巴细胞和/或其它白细胞介导的针对传染原或疾病的免疫应答,其预防或改善感染或疾病,或者减轻其至少一种症状。
如本文中所使用的,术语“脊椎动物”或“受试者”或“患者”指脊椎动物亚门(subphylumcordata)的任何成员,包括但不限于人和其它灵长类,包括非人灵长类,诸如黑猩猩(cgunoabzee)和其它猿类(apes)和猴物种(monkeyspecies)。家畜(farmanimal)(诸如牛、绵羊、猪、山羊和马);家养哺乳动物(domesticmammal)(诸如狗和猫);实验动物(包括啮齿动物,诸如小鼠、大鼠(包括棉鼠)和豚鼠);鸟类(包括家禽、野鸟和猎禽,诸如鸡、火鸡及其它鹑鸡类鸟类、鸭、鹅)等也是非限制性例子。该定义中包括术语“哺乳动物”和“动物”。意图涵盖成体和新生个体两者。意图涵盖成年和新生个体两者。具体地,家养哺乳动物和家畜是rv疫苗或治疗剂的合适的接受体。
如本文中所使用的,术语“病毒样颗粒”(vlp)指在至少一种属性上类似病毒但是已经证明其没有感染性的结构。依照本发明的病毒样颗粒不携带编码病毒样颗粒的蛋白质的遗传信息。一般而言,病毒样颗粒缺乏病毒基因组,因此是非感染性的。另外,病毒样颗粒通常可以通过异源表达来大量生产,而且可以容易地纯化。
如本文中所使用的,术语“嵌合vlp”指来自至少两种不同传染原(异源蛋白质)的蛋白质或其部分的vlp。通常,蛋白质之一自可以驱动自宿主细胞形成vlp的病毒衍生。出于例示性目的,例子是禽流感m蛋白和/或rvg蛋白。术语rvvlp和嵌合vlp在适当的情况下可以互换使用。
如本文中所使用的,术语“疫苗”指死的或弱化的病原体或衍生的抗原性决定簇的制剂,其用于诱导对所述病原体的抗体或免疫的形成。给予疫苗以提供对疾病,例如由流感病毒引起的流感的免疫。另外,术语“疫苗”也指对脊椎动物施用以产生保护性免疫,即预防或降低与感染有关的疾病的严重性的免疫的免疫原(例如包含一种或多种rv糖蛋白(g蛋白)的rvvlp)悬浮液或溶液。本发明提供了免疫原性的疫苗组合物,并且可以提供针对与感染有关的疾病的保护。
狂犬病病毒(rv)病毒样颗粒(vlp)
在一个方面,本发明涉及包含一种或多种rv糖蛋白(g蛋白)的rv病毒样颗粒(vlp),其可以配制成疫苗或抗原性配制剂以针对rv感染或其至少一种疾病症状保护脊椎动物(例如人和家畜)。在一些实施方案中,包含一种或多种rv糖蛋白(g蛋白)的vlp进一步包含额外的rv蛋白,诸如n、p、m、和l。在其它实施方案中,包含一种或多种rv糖蛋白(g蛋白)的vlp进一步包含来自异源病毒株的蛋白质,诸如流感病毒蛋白ha、na、和m1。在一个实施方案中,流感病毒蛋白m1自禽流感病毒株衍生(见美国申请13/280,043,其通过提及完整并入本文)。
rv疫苗
由于rv感染可以通过对脊椎动物提供中和性抗体来预防,含有包含一种或多种rv糖蛋白(g蛋白)的rvvlp的疫苗在对脊椎动物施用时可以在体内诱导中和性抗体。有利地使用包含一种或多种rv糖蛋白(g蛋白)的rvvlp以预防和/或治疗rv感染。如此,本公开内容的另一个方面关注用于引发针对rv的免疫应答的方法。该方法牵涉对受试者(诸如人或动物受试者)施用免疫学有效量的含有包含一种或多种rv糖蛋白(g蛋白)的rvvlp的组合物。施用免疫学有效量的组合物引发对rvg蛋白上存在的表位特异性的免疫应答。此类免疫应答可以包括b细胞应答(例如,生成中和性抗体)和/或t细胞应答(例如生成细胞因子)。优选地,由rvg蛋白引发的免疫应答包括对rvg蛋白上存在的至少一种构象性表位特异性的元件。在一个实施方案中,免疫应答对以胶束构象找到的rvg蛋白上存在的表位是特异性的。可以在与rv接触后在不增强病毒性疾病的情况下对受试者施用rvg蛋白和组合物。优选地,本文中公开的rvg蛋白和适当配制的免疫原性组合物引发th1偏倚的免疫应答,其降低或预防rv感染和/或降低或预防rv感染后的病理学应答。
在一个实施方案中,本发明的rvg蛋白以胶束形式(例如瓣状体(rosette))存在。参见实施例2。在一个实施方案中,在宿主细胞中表达后纯化胶束。在对受试者施用时,优选地,本发明的胶束诱导中和性抗体。在一些实施方案中,可以与佐剂一起施用胶束。在其它实施方案中,可以不与佐剂一起施用胶束。
在其它实施方案中,本发明涵盖包含rvg蛋白的rv病毒样颗粒(vlp),其可以配制成疫苗或抗原性配制剂以针对rv感染或其至少一种疾病症状保护脊椎动物(例如人)。本发明还涉及rvvlp和包含自不同rv病毒株衍生的野生型和突变型rv基因或其组合的载体,其在转染入宿主细胞中时会生成包含rv蛋白的病毒样颗粒(vlp)。
在一些实施方案中,rv病毒样颗粒可以进一步包含至少一种病毒基质蛋白(例如rvm蛋白)。在一个实施方案中,m蛋白自人rv株衍生。在另一个实施方案中,m蛋白自备选rv株,诸如犬、蝙蝠、浣熊、或臭鼬rv株衍生。在其它实施方案中,基质蛋白可以是来自流感病毒株的m1蛋白。在一个实施方案中,流感病毒株是禽流感毒株。在一个例示性的实施方案中,禽流感毒株是h5n1株甲型/印尼/5/05。在其它实施方案中,基质蛋白可以来自新城疫病毒(ndv)。
在其它实施方案中,本发明的vlp可以包含一种或多种异源免疫原,诸如流感血凝素(ha)和/或神经氨酸酶(na)。
在一些实施方案中,本发明还包括一种或多种vlp中来自相同和/或不同毒株的不同rvg、n、p、m、和l蛋白的组合。另外,vlp可以包含一种或多种额外的分子以增强免疫应答。
在本发明的另一个实施方案中,rvvlp可以携带药剂,诸如核酸、sirna、微小rna、化疗剂、成像剂、和/或需要对患者投递的其它药剂。
本发明的vlp可用于制备疫苗和免疫原性组合物。vlp的一个重要特征是表达感兴趣的表面蛋白,使得脊椎动物的免疫系统诱导针对感兴趣的蛋白质的免疫应答的能力。然而,不是所有蛋白质可以在vlp的表面上表达。某些蛋白质在vlp的表面上不表达,或较差表达可以有许多原因。一个原因在于蛋白质没有被引导至宿主细胞的膜,或者蛋白质没有跨膜域。举例而言,接近流感血凝素的羧基端的序列对于将ha掺入有包膜的成熟流感核壳的脂质双层中及对于ha三聚体与流感基质蛋白m1的相互作用的装配可以是重要的(ali等,(2000)j.virol.74,8709-19)。
如此,本发明的一个实施方案包括嵌合vlp,该嵌合vlp包含来自rv的g蛋白和至少一种免疫原,其在细胞表面上通常没有有效表达或者不是正常的rv蛋白。在一个实施方案中,可以将rvg蛋白与感兴趣的免疫原融合。在另一个实施方案中,rvg蛋白经由异源病毒表面膜蛋白,例如mmtv包膜蛋白的跨膜域和胞质尾部与免疫原联合。
本发明的其它嵌合vlp包括如下的vlp,其包含rvg蛋白和来自异源传染原的至少一种蛋白质。异源传染原的例子包括但不限于病毒、细菌、原生动物、真菌和/或寄生物。在一个实施方案中,来自另一种传染原的免疫原是异源病毒蛋白。在另一个实施方案中,来自异源传染原的蛋白质是包膜结合蛋白。在另一个实施方案中,在vlp的表面上表达来自另一种异源传染原的蛋白质。在另一个实施方案中,来自传染原的蛋白质包含会在脊椎动物中产生保护性免疫应答的表位。在一个实施方案中,与rvg蛋白共表达来自另一个传染原的蛋白质。在另一个实施方案中,将来自另一种传染原的蛋白质与rvg蛋白融合。在另一个实施方案中,仅将来自另一种传染原的蛋白质的一部分与rvg蛋白融合。在另一个实施方案中,仅将来自另一种传染原的蛋白质的一部分与rvg蛋白的一部分融合。在另一个实施方案中,在vlp表面上表达与rvg蛋白融合的来自另一种传染原的蛋白质的一部分。
本发明还涵盖本发明vlp之上或之中所表达的蛋白质变体。所述变体可含有在组成性蛋白质的氨基酸序列的变化。术语“变体”就蛋白质而言指相对于参考序列改变了一个或多个氨基酸的氨基酸序列。变体可以具有“保守的”变化,其中替代的氨基酸具有类似的结构或化学特性,例如用异亮氨酸替换亮氨酸。或者,变体可以具有“非保守的”变化,例如用色氨酸替换甘氨酸。类似的次要变化还可以包括氨基酸缺失和/或插入。使用本领域公知的计算机程序,例如dnastar软件,可以找到确定哪些氨基酸残基可供替代、插入或缺失而不消除生物学活性或免疫学活性的指导。
天然变体可由于蛋白质中的突变而发生。这些突变可能导致各组传染原(例如流感)内的抗原性变异性(antigenicvariability)。如此,感染了例如流感毒株的人形成针对该病毒的抗体,在更新的病毒株出现时,针对较旧毒株的抗体不再识别较新的病毒,而可以发生再感染。本发明涵盖用于制备vlp的来自传染原的所有抗原性变异性和遗传变异性。
描述可应用于本发明的分子生物学技术(诸如克隆、突变、细胞培养等)的通用教科书包括berger和kimmel,guidetomolecularcloningtechniques,methodsinenzymologyvolume152academicpress,inc.,sandiego,calif.(berger);sambrook等,molecularcloning--alaboratorymanual(第3版),卷1-3,coldspringharborlaboratory,coldspringharbor,n.y,2000(“sambrook”)和currentprotocolsinmolecularbiology,f.m.ausubel等编,currentprotocols,ajointventurebetweengreenepublishingassociates,inc.及johnwiley&sons,inc.,(“ausubel”)。这些教科书描述了诱变、载体的应用、启动子和许多其它相关的主题,所述主题涉及例如rvg分子的克隆和突变等。如此,本发明还涵盖使用已知的蛋白质工程和重组dna技术的方法来改进或改变在本发明vlp之上或之中表达的蛋白质的特性。可使用多种类型的诱变来产生和/或分离编码蛋白质分子的变体核酸和/或进一步修饰/突变本发明vlp之中或之上的蛋白质。它们包括但不限于定点诱变、随机点诱变、同源重组(dna改组)、使用含尿嘧啶模板进行的诱变、寡核苷酸指导的诱变、硫代磷酸修饰的dna诱变、使用缺口双链体dna的诱变等。其它合适的方法包括点错配修复(pointmismatchrepair)、使用修复缺陷的宿主株的诱变,限制选择和限制纯化、缺失诱变、通过全基因合成的诱变、双链断裂修复等。诱变(例如牵涉嵌合构建体)也包括在本发明中。在一个实施方案中,可通过天然存在分子或经过改变或突变的天然存在分子的已知信息(例如序列、序列比较、物理性质、晶体结构等)来指导诱变。
本发明进一步包括在表达于本发明vlp之上或之中时显示实质生物学活性(例如能够引发有效的抗体应答)的蛋白质变体。这样的变体包括缺失、插入、倒位、重复、和替代,根据本领域已知的一般规则来选择它们,使得其对活性具有很少的影响。
克隆蛋白质的方法是本领域已知的。例如,可以从感染了狂犬病病毒的细胞提取多聚腺苷酸化mrna,通过rt-pcr从中分离出编码特定rv蛋白的基因。所得的产物基因可以作为dna插入物克隆入载体中。术语“载体”指可用于扩增(propagate)核酸和/或在生物体、细胞、或细胞组分之间转移核酸的工具。载体包括自主复制或可整合入宿主细胞的染色体中的质粒、病毒、噬菌体、原病毒、噬菌粒、转座子、人工染色体等。载体还可以是非自主复制性的裸rna多核苷酸、裸dna多核苷酸、在同一条链内由dna和rna两者组成的多核苷酸、缀合有聚赖氨酸的dna或rna、缀合有肽的dna或rna、缀合有脂质体的dna等。在许多但不是所有的常见实施方案中,本发明的载体是质粒或杆粒(bacmid)。
如此,本发明包括这样的核苷酸,它们编码克隆入可在细胞中表达的表达载体中的蛋白质(包括嵌合蛋白),诱导本发明vlp的形成。“表达载体”是能够促进掺入其中的核酸的表达以及复制的载体,诸如质粒。通常,要表达的核酸与启动子和/或增强子“可操作连接”,并受该启动子和/或增强子的转录调节控制。在一个实施方案中,所述核苷酸编码rvg蛋白(如上文所讨论的)。在另一个实施方案中,载体进一步包含编码rvm蛋白的核苷酸。在另一个实施方案中,载体进一步包含编码m和/或nrv蛋白的核苷酸。在另一个实施方案中,载体进一步包含编码m、l和/或nrv蛋白的核苷酸。在一个例示性的实施方案中,表达载体是杆状病毒载体。
在本发明的一些实施方案中,蛋白质可以包含如下的突变,其含有产生沉默的替代、添加或缺失,但是不改变编码的蛋白质的特性或活性或者生成这些蛋白质的方式的变化。可以出于多种原因而产生核苷酸变体,例如为了针对特定宿主优化密码子表达(将人mrna中的密码子改变为昆虫细胞诸如sf9细胞优选的那些密码子)。参见美国专利公开文本2005/0118191,将其通过提述而完整收录于本文中用于所有目的。
另外,可对核苷酸测序以确保正确的编码区得到克隆,且不含有任何不想要的突变。可以将所述核苷酸亚克隆入表达载体(例如杆状病毒)中用于在任意细胞中表达。上文仅仅是可以如何克隆rv病毒蛋白质的一个例子。本发明技术人员理解,其它方法也是可用和可能的。
本发明还提供了包含rv核苷酸的构建体和/或载体,所述rv核苷酸编码rv结构基因,包括g、m、n、l、p、或其部分,和/或上文所描述的任何嵌合分子。载体可以是例如噬菌体、质粒、病毒、或逆转录病毒载体。包含rv结构基因,包括g、m、n、l、p、或其部分,和/或上文所描述的任何嵌合分子的构建体和/或载体应当与合适的启动子可操作连接,诸如acmnpv多角体蛋白启动子(或其它杆状病毒)、λ噬菌体pl启动子、大肠杆菌lac、phoa和tac启动子、sv40早期和晚期启动子、和逆转录ltr的启动子是非限制性例子。根据想要的宿主细胞和/或表达率,熟练技术人员会知道其它合适的启动子。表达构建体将进一步含有转录起始位点、终止位点、以及转录区中用于翻译的核糖体结合位点。所述构建体所表达的转录物的编码部分优选在要翻译的多肽的起始处包含翻译起始密码子,而在该多肽末尾处的合适位置上含有终止密码子。
表达载体将优选包含至少一种选择标志物。此类标志物包括用于真核细胞培养的二氢叶酸还原酶、g418或新霉素抗性,以及用于培养大肠杆菌和其它细菌的四环素、卡那霉素或氨苄青霉素抗性基因。优选的载体包括病毒载体,诸如杆状病毒、痘病毒(例如牛痘病毒、禽痘病毒(avipoxvirus)、金丝雀痘病毒、禽痘病毒(fowlpoxvirus)、浣熊痘病毒、猪痘病毒等)、腺病毒(例如犬腺病毒)、疱疹病毒和逆转录病毒。可与本发明一起使用的其它载体包括用于细菌的载体,包括pqe70,pqe60和pqe-9,pbluescriptvectors,phagescript载体,pnh8a,pnh16a,pnh18a,pnh46a,ptrc99a,pkk223-3,pkk233-3,pdr540,prit5。优选的真核载体包括pfastbac1pwineo,psv2cat,pog44,pxt1和psg,psvk3,pbpv,pmsg,及psvl。其它合适的载体会是熟练技术人员容易显而易见的。在一个实施方案中,载体是pfastbac,该载体包含编码rv基因,包括rvg基因,以及m、n、l、p、或其部分的基因,和/或上文所描述的任何嵌合分子的核苷酸。
上文所提及的重组构建体可以用来转染、感染、或转化,并且可以表达rv蛋白,包括rvg蛋白和至少一种免疫原。在一个实施方案中,重组构建体包含rvg、m、n、l、p、或其部分,和/或上文所描述的任何分子,其进入真核细胞和/或原核细胞中。如此,本发明提供了包含载体(或多个载体)的宿主细胞,所述载体含有的核酸编码rv结构基因,包括rvg;和至少一种免疫原诸如但不限于rvn、l、和p,或其部分,和/或上文所描述的任何分子,并且在容许形成vlp的条件下于所述宿主细胞中容许表达基因,包括rvg、n、l、或p或其部分,和/或上文所描述的任何分子。
真核宿主细胞包括酵母、昆虫、禽类、植物、秀丽隐杆线虫(c.elegans)(或线虫)和哺乳动物宿主细胞。昆虫细胞的非限制性例子有:草地夜蛾(spodopterafrugiperda)(sf)细胞、例如sf9、sf21,粉纹夜蛾(trichoplusiani)细胞,例如highfive细胞,和果蝇(drosophila)s2细胞。真菌(包括酵母)宿主细胞的例子有酿酒酵母(s.cerevisiae)、乳克鲁维酵母(kluyveromyceslactis;k.lactis)、假丝酵母属(candida)物种包括白色假丝酵母(c.albicans)和光滑假丝酵母(c.glabrata)、构巢曲霉(aspergillusnidulans)、粟酒裂殖酵母(schizosaccharomycespombe;s.pombe)、巴斯德毕赤酵母(pichiapastoris)、和解脂西洋蓍霉(yarrowialipolytica)。哺乳动物细胞的例子有cos细胞、幼仓鼠肾细胞、小鼠l细胞、lncap细胞、中国仓鼠卵巢(cho)细胞、人胚肾(hek)细胞和非洲绿猴细胞、cv1细胞、hela细胞、mdck细胞、vero和hep-2细胞。非洲爪蟾(xenopuslaevis)卵母细胞,或两栖动物来源的其它细胞也可以使用。原核宿主细胞的例子包括细菌细胞,例如大肠杆菌、枯草芽孢杆菌(b.subtilis)、伤寒沙门氏菌(salmonellatyphi)和分枝杆菌。
可以依照本领域中公知的方法将载体,例如包含rvg蛋白;和至少一种免疫原,包括但不限于rvn、l、p、或其部分,和/或上文所描述的任何嵌合分子的多核苷酸的载体转染入宿主细胞中。例如,例如,可通过磷酸钙共沉淀、电穿孔、显微注射、脂转染和利用多胺转染试剂的转染来将核酸导入真核细胞中。在一个实施方案中,所述载体是重组杆状病毒。在另一个实施方案中,将所述重组杆状病毒转染到真核细胞中。在一个优选的实施方案中,所述细胞是昆虫细胞。在另一个实施方案中,所述昆虫细胞是sf9细胞。
本发明还提供了会增加vlp生产效率的构建体和方法。例如,向rvg、m、n、l、p、或其部分,和/或上文所述任何嵌合或异源分子添加前导序列可以改善蛋白质在细胞内转运的效率。例如,可将异源信号序列与rvg、m、n、l、p、或其部分,和/或上文所述任何嵌合或异源分子融合。在一个实施方案中,所述信号序列可衍生自昆虫细胞的基因,并且与rvg、m、n、l、p、或其部分,和/或上文所述任何嵌合或异源分子融合。在另一个实施方案中,信号肽是几丁质酶信号序列,其在杆状病毒表达系统中高效地工作。
另一种增加vlp生产效率的方法是针对特定的细胞类型对编码rv,包括rvg蛋白、m、n、l、p、或其部分,和/或上文所述任何嵌合或异源分子的核苷酸进行密码子优化。在一个实施方案中,为在昆虫细胞中表达而对核酸进行密码子优化。在一个例示性的实施方案中,昆虫细胞是sf9昆虫细胞。
本发明还提供生产vlp的方法,所述方法包括在容许vlp形成的条件下表达包含rvg蛋白的rv基因。根据所选的表达系统和宿主细胞,在表达重组蛋白和形成vlp的条件下通过培养用表达载体转化的宿主细胞来产生vlp。在一个实施方案中,本发明包括一种生成vlp的方法,其包括将至少编码rvg蛋白的载体转染入合适的宿主细胞中,并在容许vlp形成的条件下表达rvg蛋白。在另一个实施方案中,所述真核细胞选自酵母、昆虫、两栖动物、禽类或哺乳动物细胞。合适的培养条件的选择在本领域普通技术人员的技术之内。
培养经过工程化改造而生成本发明vlp的细胞的方法包括但不限于分批、分批补料、连续和灌流(perfusion)细胞培养技术。细胞培养意思是在生物反应器(发酵室)中使细胞生长和增殖,细胞在生物反应器中增殖并表达蛋白(例如重组蛋白)以供纯化和分离用。典型地,细胞培养在生物反应器中无菌、受控的温度和大气条件下进行。生物反应器是用于培养细胞的腔室(chamber),其中可以监控环境条件诸如温度、大气、搅拌和/或ph。在一个实施方案中,所述生物反应器是不锈钢室。在另一个实施方案中,所述生物反应器是预灭菌的塑料袋(例如
然后使用保持vlp完整性的方法来分离vlp,诸如通过梯度离心,例如氯化铯、蔗糖和碘克沙醇(iodixanol)梯度离心,以及标准纯化技术,包括例如离子交换和凝胶过滤层析。
下面是如何能够制备、分离和纯化本发明vlp的一个例子。通常vlp是由重组细胞系产生的,所述细胞系经过工程化改造从而当所述细胞在细胞培养(见上文)中生长时产生vlp。本领域技术人员将会理解,可以使用其它的方法来制备和纯化本发明的vlp,如此本发明不限于所述的方法。
本发明vlp的生产可首先将sf9细胞(未感染的)接种到摇瓶中,使细胞随着生长繁殖而扩增和规模放大(例如从125ml烧瓶到50lwave袋)。培养细胞所用的培养基是为合适的细胞系配制的(优选无血清培养基,例如昆虫培养基excell-420,jrh)。接着,用重组杆状病毒以效率最高的感染复数(例如每个细胞约1个到约3个噬斑形成单位)感染所述细胞。一旦发生感染,rvg蛋白和/或上文所述的任何嵌合或异源分子即从病毒基因组表达,自装配成vlp,并在感染后大约24到72小时从细胞分泌。通常,在细胞处于生长的对数中期(mid-logphase)(4-8x106个细胞/ml)且至少约90%存活时,感染效率最高。
可以在感染后大约48到96小时,在细胞培养基中vlp水平接近最大值但在广泛的细胞溶解之前收获vlp。收获时的sf9细胞密度和生存力可以为:约0.5x106个细胞/ml至约1.5x106个细胞/ml,生存力至少为20%,如染料排除测定法所示。接着,取出培养基并将其澄清。可以向培养基添加nacl至浓度为约0.4至约1.0m,优选至约0.5m,以避免vlp聚集。可利用一次性使用的预灭菌中空纤维0.5或1.00μm筒式滤器或类似的装置,通过切向流过滤(tff)来实现从含有本发明vlp的细胞培养基中除去细胞和细胞碎片。
接着,可以使用一次性的、预灭菌的500,000分子量截留中空纤维筒通过超滤来浓缩经过澄清的培养基中的vlp。可以将经过浓缩的vlp对10倍体积的含0.5mnacl的ph7.0至8.0的磷酸盐缓冲盐水(pbs)进行渗滤来除去残余的培养基成分。
可以将经过浓缩、渗滤的vlp在含0.5mnacl的ph7.2pbs缓冲液中20%-60%不连续蔗糖梯度上,于约4℃至约10℃以6,500xg离心18小时来进一步纯化。通常,vlp将在约30%到至约40%蔗糖之间或者在界面上(在20%和60%的分步梯度中)形成显著可见的条带,可从该梯度中收集该条带并保存。可稀释该产物使其包含200mmnacl,以准备纯化过程的下一步。该产物含有vlp,并可能含有完整的杆状病毒颗粒。
可以通过阴离子交换层析或者44%等密度蔗糖垫层(cushion)离心来实现vlp的进一步纯化。在阴离子交换层析中,将来自蔗糖梯度(见上文)的样品上样入含有带阴离子的介质(例如matrixfractogelemdtmae)的柱中,并经由盐梯度(从约0.2m至约1.0mnacl)洗脱,该梯度可以将vlp与其它杂质(例如杆状病毒和dna/rna)分开。在蔗糖垫层方法中,将包含vlp的样品添加到44%蔗糖垫层,并在30,000g离心约18小时。vlp在44%蔗糖的顶部形成条带,而杆状病毒沉淀于底部,其它污染蛋白停留在顶部的0%蔗糖层中。收集vlp峰或vlp带。
若想要的话,可以将完整的杆状病毒灭活。可以通过化学方法,例如甲醛或β-丙内酯(bpl)灭活。还可以使用本领域已知的选择性沉淀和层析方法,如上文例示的,来大部分实现完整杆状病毒的除去和/或灭活。灭活方法包括将含有vlp的样品在0.2%bpl中于约25℃至约27℃温育3小时。还可以通过将含有vlp的样品在0.05%bpl于4℃温育3天,然后在37℃温育1小时,来灭活杆状病毒。
灭活/除去步骤后,可使含有vlp的产物流过另一渗滤步骤以除去任何来自灭活步骤的试剂和/或任何残余的蔗糖,并将vlp置入期望的缓冲液(例如pbs)中。包含vlp的溶液可以通过本领域已知的方法(例如无菌过滤)灭菌,并保存在冰箱或冷冻箱中。
上文的技术可以在多种规模上实施。例如,t形瓶(t-flasks)、摇瓶、转瓶(spinnerbottle)、乃至工业尺寸的生物反应器。生物反应器可包括不锈钢槽或预灭菌的塑料袋(例如,wavebiotech,bridgewater,nj出售的系统)。本领域技术人员会知道用于其目的的最佳选择。
杆状病毒表达载体的扩增和生产,以及用重组杆状病毒感染细胞以生产重组rvvlp,可以在昆虫细胞,例如前文所述的sf9昆虫细胞中实现。在一个实施方案中,所述细胞是用经工程化以生成rvvlp的重组杆状病毒感染的sf9细胞。
药物或疫苗配制剂和施用
本文中有用的药物组合物含有药学可接受载体和包含一种或多种rv糖蛋白(g蛋白)的rvvlp,所述药学可接受载体包括任何合适的稀释剂或赋形剂,包括本身不诱导产生对接受该组合物的脊椎动物有害的免疫应答、并且可以不带有异常毒性地施用的任何药剂。如本文中所使用的,术语“药学可接受的”指获得联邦或州政府监管部门批准,或者在美国药典、欧洲药典或其它公认的药典中列出的用于哺乳动物,更具体地用于人类中。这些组合物可以用作疫苗和/或抗原性组合物,用于在脊椎动物中诱导保护性免疫应答。本发明涵盖药学可接受疫苗组合物,其含有包含一种或多种rv糖蛋白(g蛋白)的rvvlp。在一个实施方案中,药学可接受疫苗组合物包含的vlp包含至少一种rvg蛋白和至少一种别的免疫原。在另一个实施方案中,药学可接受疫苗组合物包含的vlp包含至少一种rvg蛋白和至少一种rvm蛋白。在另一个实施方案中,在另一个实施方案中,药学可接受疫苗组合物包含的vlp包含至少一种rvg蛋白和至少一种流感m蛋白。在另一个实施方案中,在另一个实施方案中,药学可接受疫苗组合物包含的vlp包含至少一种rvg蛋白和至少一种禽流感m1蛋白。
本发明还涵盖用于免疫脊椎动物,诸如人受试者的试剂盒,其含有包含至少一种rvg蛋白的vlp。
在一个实施方案中,本发明包括免疫原性配制剂,其包含至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
本发明的免疫原性配制剂包含包含一种或多种rv糖蛋白(g蛋白)的rvvlp和药学可接受载体或赋形剂。药学可接受的载体包括但不限于盐水、缓冲盐水、右旋糖、水、甘油、无菌等张缓冲水溶液,和它们的组合。对药学可接受的载体、稀释剂和其它赋形剂的全面讨论呈现于remington’spharmaceuticalsciences(mackpub.co.n.j.currentedition)中。配制剂应当适合施用模式。在一个优选的实施方案中,配制剂适于给人施用,优选制剂是无菌、非颗粒性(non-particulate)和/或非热原性的。
若想要的话,组合物还可以含有小量的润湿剂或乳化剂,或ph缓冲剂。组合物可以是固体形式,诸如适于重构的冻干粉末;液体溶液;悬液;乳液;片剂;丸剂;胶囊;持续释放配制剂;或粉剂。口服配制剂可包含标准的载体,诸如药品级的甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。
本发明还提供药物包(pharmaceuticalpack)或试剂盒,其包含一个或多个容器,所述容器装有本发明疫苗配制剂的一种或多种成分。在一个优选的实施方案中,所述试剂盒包含两个容器,其一装有包含一种或多种rv糖蛋白(g蛋白)的rvvlp,另一个装有佐剂。所述容器还可以伴有通告,该通告采取由监管药品或生物制品的生产、使用或销售的政府部门规定的形式,反映该部门对于为了人体施用而生产、使用或销售的许可。
本发明还提供配制剂包装在标示组合物量的密封容器诸如安瓿或小药囊(sachette)中。在一个实施方案中,组合物作为液体提供,在另一个实施方案中,作为密封容器中的干燥无菌冻干粉末或无水浓缩物提供,并且可以用例如水或盐水重构为用于向受试者施用的合适浓度。
在一个备选的实施方案中,在标示组合物的量和浓度的密封容器中以液体形式提供组合物。优选地,在密封容器中以至少约50μg/ml、更优选至少约100μg/ml、至少约200μg/ml、至少500μg/ml、或至少1mg/ml提供液体形式的组合物。
举例而言,以足以刺激免疫应答(每种应答针对一种或多种rv株)的有效量或数量(如上文定义的)施用包含一种或多种rvg蛋白的rvvlp。包含一种或多种rv糖蛋白(g蛋白)的rvvlp的施用引发针对rv的免疫。典型地,可以根据例如年龄、身体状况(physicalcondition)、体重、性别、饮食、施用时间和其它临床因素,在该范围内调节该剂量。预防性疫苗配制剂是全身施用的,例如通过使用针头和注射器或无针头注射装置进行皮下或肌内注射来施用。在一个例示性的实施方案中,肌肉内施用疫苗配制剂。
如此,本发明还包括对哺乳动物诱导针对感染或其至少一种疾病症状的免疫的疫苗或抗原性组合物的配制方法,包括向所述配制剂添加有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。在一个实施方案中,感染是rv感染。
含有包含一种或多种rv糖蛋白(g蛋白)的rvvlp的组合物(例如,疫苗和/或抗原性配制剂)的施用方法包括,但不限于,胃肠外施用(例如皮内、肌内、静脉内和皮下)、硬膜外、和粘膜(例如鼻内和口腔或肺途径或通过栓剂)。在一个具体实施方案中,本发明的组合物通过肌内、静脉内、皮下、透皮或皮内施用。组合物可以通过任何方便的途径施用,例如通过输注或推注,通过经由上皮或粘膜皮肤衬里(例如口腔粘膜、结肠、结膜、鼻咽、口咽、阴道、尿道、膀胱和肠粘膜等)的吸收,并且可以与其它生物学活性剂一起施用。
本发明的疫苗和/或免疫原性配制剂还可以按照剂量日程表(dosageschedule)来施用,例如用疫苗组合物进行一次初次施用,随后进行多次加强施用。在具体的实施方案中,第二剂组合物在初次施用后大约两周至一年的任何时间,优选约1个月、约2个月、约3个月、约4个月、约5个月到约6个月施用。另外,可以在第二剂之后,且在距初次施用后约3个月至约两年甚至更长时间,优选约4个月、约5个月、或者约6个月、或者约7个月至约1年施用第三剂。在第二剂后在受试者的血清和/或尿或者粘膜分泌物中没有检测到或者检测到低水平的特异性免疫球蛋白时,可任选地施用第三剂。在一个优选的实施方案中,第二剂在第一次施用后约1个月施用,而第三剂在第一次施用后约6个月施用。在另一个实施方案中,第二剂在第一次施用后约6个月施用。在另一个实施方案中,所述本发明的组合物可用作为联合疗法的一部分施用。例如,本发明的组合物可以与其它免疫原性组合物、抗病毒剂和/或抗生素一起配制。
技术人员可以容易地确定药物组合物的剂量,例如通过首先鉴定可有效引发预防性或治疗性免疫应答的剂量,例如通过测量病毒特异性免疫球蛋白的血清效价或通过测量血清样品或尿样品或粘膜分泌物中抗体的抑制比。所述剂量可以由动物研究确定。用于研究疫苗功效的动物的非限制性目录包括豚鼠、仓鼠、雪貂(ferret)、小鼠和棉鼠。大多数动物不是传染原的天然宿主,但仍可用于该疾病的各个方面的研究。例如,可以对任何上文的动物定量给予疫苗候选物,例如包含一种或多种rv糖蛋白(g蛋白)的rvvlp,以部分地表征所诱发的免疫应答,和/或确定是否生成了任何中和性抗体。例如,已经在小鼠模型中进行了许多研究,因为小鼠体型小,而且它们的成本低使得研究者可以进行更大规模研究。
另外,技术人员可以进行人体临床研究来确定用于人的优选有效剂量。这样的临床研究是常规的,且为本领域公知。要使用的确切剂量还将依赖于施用途径。可以从源自体外或动物试验系统的剂量-应答曲线外推得到有效剂量。
如本领域中还公知的,可以使用免疫应答的非特异性刺激物来增强特定组合物的免疫原性,这样的刺激物称为佐剂。实验上已经使用佐剂来促进针对未知抗原的免疫的普遍增加(例如美国专利号4,877,611)。免疫规程使用佐剂来刺激应答已有多年,因此,本领域普通技术人员对佐剂是熟知的。有些佐剂影响抗原呈递的方式。例如,在蛋白抗原被明矾沉淀时,免疫应答增加。抗原的乳化也可延长抗原呈递的持续时间。本发明的范围意图涵盖vogel等,“acompendiumofvaccineadjuvantsandexcipients(第2版),”(本文通过提述收录该文献全部内容用于所有目的)中所述任何佐剂的引入。
例示性的佐剂包括完全弗氏佐剂(一种免疫应答的非特异性刺激物,含有已杀死的结核分枝杆菌(mycobacteriumtuberculosis))、不完全弗氏佐剂和氢氧化铝佐剂。其它佐剂包括gmcsp、bcg、氢氧化铝、mdp化合物诸如thur-mdp和nor-mdp、cgp(mtp-pe)、脂质a和单磷酰脂质a(mpl)。还设想使用ribi,其在2%角鲨烯/tween80乳液中含有从细菌提取的3种成分:mpl、海藻糖二霉菌酸(tdm)和细胞壁骨架(cws)。还可以使用mf-59、
在本发明的一个实施方案中,所述佐剂是少片层(paucilamellar)脂质小泡,其具有大约2到10个双层,它们排列成多个基本呈球形的壳的形式,其由水性层隔开,所述水性层围绕着不含脂质双层的无定形中心大空腔。少片层脂质小泡可以通过数种方式起作用来刺激免疫应答:作为非特异性刺激物、作为抗原载体、作为其它佐剂的载体,以及这些方式的组合。例如,在通过混合抗原与预先形成的小泡,使得抗原相对于小泡保持在胞外的方法制备疫苗时,少片层脂质小泡起非特异性免疫刺激物的作用。通过将抗原包囊在小泡的中心空腔中,小泡起到免疫刺激物和抗原载体两方面的作用。在另一个实施方案中,小泡主要由非磷脂小泡构成。在其它实施方案中,小泡是novasomes。
本发明的组合物也可以与“免疫刺激物”一起配制。这些“免疫刺激物”是身体自有的增加免疫系统应答的化学信使(细胞因子)。免疫刺激物包括但不限于具有免疫刺激性、免疫强化和促炎活性的各种细胞因子、淋巴因子和趋化因子,诸如白介素(例如il-1、il-2、il-3、il-4、il-12、il-13);生长因子(例如粒细胞-巨噬细胞(gm)集落刺激因子(csf));和其它免疫刺激性分子,诸如巨噬细胞炎性因子,flt3配体、b7.1、b7.2等。免疫刺激性分子可以与本发明的组合物在同一配制剂中施用,或者可以分开施用。可以施用蛋白质或者编码该蛋白质的表达载体来产生免疫刺激效应。如此,在一个实施方案中,本发明包括包含佐剂和/或免疫刺激物的抗原性配制剂和疫苗配制剂。刺激免疫应答的方法
包含一种或多种rv糖蛋白(g蛋白)的rvvlp可用于制备组合物,该组合物刺激赋予对传染原的免疫或实质性免疫的免疫应答。本发明涵盖在受试者中诱导针对感染或其至少一种疾病症状的免疫的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
在一个方面,本发明包括在受试者中诱导针对rv感染或其至少一种疾病症状的免疫的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。在一个实施方案中,受试者是脊椎动物。在另一个实施方案中,受试者是哺乳动物。在又一个实施方案中,受试者是人。在又一个实施方案中,哺乳动物是家畜。在另一个实施方案中,所述方法包括通过施用一剂配制剂诱导针对rv感染或至少一种疾病症状的免疫。在另一个实施方案中,所述方法包括通过施用多剂配制剂诱导针对rv感染或至少一种疾病症状的免疫。
本发明的组合物在对脊椎动物施用时可以在脊椎动物(例如人)中诱导实质性免疫。实质性免疫源自针对本发明组合物的免疫应答,其在脊椎动物中中保护或改善感染或至少减少感染的症状。在一些例子中,若脊椎动物受到感染,则感染会是无症状的。应答可以不是完全保护性应答。在此情况中,若脊椎动物受到传染原感染,则与非免疫脊椎动物相比,该脊椎动物会经历减少的症状或更短的症状持续时间。
在另一个实施方案中,本发明包括一种在受试者中诱导针对感染或其至少一种症状的保护性抗体应答的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
如本文所使用的,术语“抗体”是包含一个或多个基本上或者部分地由免疫球蛋白基因或免疫球蛋白基因片段编码的多肽的蛋白质。公认的免疫球蛋白基因包括κ、λ、α、γ、6、ε和μ恒定区基因和众多免疫球蛋白可变区基因。轻链分为κ或λ。重链分为γ、μ、α、δ或ε,它们继而分别定义了免疫球蛋白的类型:igg、igm、iga、igd和ige。典型的免疫球蛋白(抗体)结构单位包含四聚体。每个四聚体由同样的两对多肽链组成,每对具有一条“轻”(大约25kd)链和一条“重”(大约50-70kd)链。每条链的n末端定义一个约100-110个或更多氨基酸的可变区,它主要负责抗原识别。抗体作为完整的免疫球蛋白存在,或者作为若干通过各种肽酶消化而产生的、已充分表征的片段存在。
在一个实施方案中,本发明包括在受试者中诱导对rv感染或至少一种疾病症状的保护性细胞应答的方法,包括施用至少一个有效剂量的包含一种或多种rv糖蛋白(g蛋白)的rvvlp。
如上文提及的,本发明的免疫原性组合物在受试者中预防或减少至少一种rv感染症状。rv症状是本领域中公知的。它们包括发热、头痛、和全身无力或不适。随着疾病进展,出现更特异性的症状,并且可以包括失眠、焦虑、意识错乱、轻微或部分麻痹、兴奋、幻觉、激动、唾液过多(hypersalivation)(唾液增加)、吞咽困难(difficultyswallowing)、和恐水(怕水)。如此,本发明的方法包括预防或减轻与rv感染有关的至少一种症状。症状的减轻可以主观地或者客观地确定,例如通过受试者的自我评估、由内科医生评估、或通过实施合适的测定或测量(例如体温),包括例如生活质量评价、rv感染或其它症状的进展减慢、rv症状的严重程度降低或者合适的测定法(例如抗体效价和/或t细胞活化测定法)。客观评价包括动物和人的评价。
通过下面的实施例进一步例示本发明,这些实施例不应解释为限制性的。本文通过提述收录本申请中引用的所有参考文献、专利和已公开的专利申请,以及附图和序列表用于所有目的。
实施例
实施例1
纯化狂犬病g颗粒以进行动物研究
本实施例的目的是证明在sf9昆虫细胞中自杆状病毒载体表达后如何纯化rvg病毒样颗粒。
为了构建rvvlp,从图1中所显示的杆状病毒载体(pfastbacl狂犬病g)表达编码rvg蛋白的核酸序列(seqidno:2)。
感染2.5x106个细胞/ml的sf9昆虫细胞,moi为0.2。通过以4000g离心15分钟在感染后69小时时收获细胞。将细胞用1xpbs清洗,再次旋转,并于-70℃冷冻。
使用自约2l细胞培养物获得的23克细胞团粒。将细胞团粒用200ml25mmtrisclph8.0,50mmnacl,0.5%np9,4ug/ml亮抑酶肽(leupeptin)重悬。将其于室温搅拌1小时,以7000g于4℃旋转60分钟,并保存200ml上清液用于层析。
在完成从细胞团粒提取狂犬病g839后,将可溶性蛋白质加载到fractoge1emdtmaehicap(m)层析柱上。柱规格如下:柱制造商:gehealthcare;柱类型:xk50f20;树脂制造商:emdchemicals;树脂类型:fractogelemdtmaehicap(m);填充柱尺寸:约10em高度x5.0cm直径;填充柱体积:200ml;填充流速:30ml/min;填充缓冲液:25mmtrisph8.0/300mmnacl。
阴离子交换过程的详述如下:运行流速:20ml/min;柱平衡缓冲液:25mmtrisph8.0,50mmnacl,0.02%np9;洗脱液a:25mmtrisph8.0,50mmnacl,0.02%np9;洗脱液bl:25mmtrisph8.0,180mmnacl,0.02%np9;洗脱液b2:25mmtrisph8.0,500mmnacl,0.02%np9;洗脱液b3:25mmtrisph8.0,1500mmnaci,0.02%np9;柱加载:200ml狂犬病gvlp提取上清液;加载后的柱清洗:2个cv洗脱液a;柱洗脱:2个cv洗脱液bi,2个cv洗脱液b2,2个cv洗脱液b3。
主要级分收集和体积如下:流过级分:250ml;b1180mmnacl洗脱:175ml(产物);b2500mmnacl洗脱:100ml;b31500mmnacl洗脱:100ml。
将tmae柱的180mmnacl洗脱级分加载到扁豆(lentil)凝集素柱。柱的规格如下:柱制造商:gehealthcare;柱类型:xki6/20;树脂制造商:gehealthcare;树脂类型:扁豆凝集素sepharose4b;树脂产品目录编号:17-0444-01;填充柱尺寸:2.5em高度x1.6em直径;填充柱体积:约5ml;填充流速:2.5ml/min;填充缓冲液:25mmnahpo4ph6.8,50mmnaci,0.02%np9;运行流速:2ml/min;柱平衡缓冲液:25mmnahpo4ph6.8,50mmnacl,0.02%np9;洗脱液a:25mmnahpo4ph6.8,50mmnac1,0.02%np9;洗脱液b:25mmnahpo4ph6.8,50mmnacl,0.02%np9,500mm甲基-alpha-d-甘露吡喃糖苷(mannopyronoside)(fisherscientific);柱加载:175ml狂犬病g839tmae180mmnacl洗脱液;加载后的柱清洗:5个cv洗脱液a;柱洗脱:10个cv洗脱液b;
主要级分收集和体积如下:流过级分:180ml;洗脱级分:30ml(产物)。
将扁豆凝集素洗脱加载到fractogelemdso3-hicap(m)层析柱上。柱的规格如下:柱制造商:gehealthcare;柱类型:xk16/20;树脂制造商:emdchemicals;树脂类型:fractogelemdso3-hicap(m);填充柱尺寸:5em高度x1.6em直径;填充柱体积:10ml;填充流速:7.5ml/min;填充缓冲液:25mmnahpo4ph6.8,50mmnacl,0.02%np9。
阴离子交换过程的详述如下:运行流速:5ml/min;柱平衡缓冲液:25mmnahpo4ph6.8,50mmnacl,0.02%np9;洗脱液a:25mmnahpo4ph6.8,50mmnacl,0.02%np9;洗脱液b:25mmnahpo4ph6.8,300mmnacl,0.02%np9;柱加载:30ml狂犬病g839凝集素洗脱;加载后的柱清洗:3个cv洗脱液a;柱洗脱:4个cv步式洗脱洗脱液b;主要级分收集和体积:洗脱级分:9ml(终产物);用0.2μm滤器过滤9mlso3-柱300mmnacl洗脱产物:滤器制造商(0.2μm):coming;滤器类型:具有0.2微米sfca膜的28mm注射器滤器。
使用抗rvg兔血清实施western印迹(图2)。使用上述条件得到的rvg颗粒的纯度是86%。总蛋白质量是0.39mg/ml,并且rvg颗粒的浓度是0.33mg/ml,总共2.97mg来自2l细胞培养物的rvg颗粒,产率为约1.5mg/l细胞培养物。重要地,rvg颗粒于4℃持续至少一个月是稳定的(数据未显示)。
实施例2
用于分析rvg蛋白构象的电子显微术
通过负染电子显微术分析纯化的rvg蛋白(参见图3)。具有0.02%np9的rvg颗粒的平均分子量是1.04x10-6。蛋白质三聚体展现出175.5kda的分子量,并且颗粒中三聚体的平均数目是5.9。rvg蛋白以胶束(瓣状体)形式聚集。g刺突在电子显微术下展现出胶束形态学的实情提示g蛋白颗粒具有天然蛋白质的正确3维结构。
实施例3
rvg颗粒在兔中诱导高抗体水平
为了测试rvg颗粒诱导免疫应答的能力,给兔施用不同浓度的rvg颗粒。图4中显示了这些实验的结果。rvg颗粒能够在兔中诱导高水平的抗体。
实施例4
rv中和测定法和小鼠中的rv攻击研究
为了测试含有包含一种或多种g蛋白的rvvlp的疫苗在针对rv感染提供保护中的效率,在小鼠中进行中和测定法。简言之,给各组小鼠肌肉内注射rvvlp或rvvlp+佐剂,诸如铝。另外,给小鼠注射
实施例5
注射rvg颗粒或商业狂犬病疫苗
在balb/c小鼠模型中与商业狂犬病疫苗
本研究包括四个组(对于每个组,n=5):
组i:阳性对照(商业狂犬病疫苗
组ii:rvgvlp(5μg)
组iii:rvgvlp(2μg)
组iv:rvgvlp(1μg)
在第0天、第3天和第7天给小鼠施用相应的0.1ml免疫原。在第0天、第4天、第7天、第10天、第14天、第21天、第28天、第35天时从小鼠采集血清样品。通过elisa对血清测试中和性抗狂犬病抗体。
下文表1中给出了研究设计的汇总。
如上文所讨论的,在上文提供的时间点时在小鼠血清中测量抗狂犬病中和性抗体。将滴度以每次测量的几何均值绘图(图6)。如图6显示,本发明的vlp胶束在每个剂量比商品化疫苗
表2还显示了对每个免疫组的百分比血清保护(即,中和性抗体滴度为≥0.5eu/ml)。该表指示与施用
仅为了理解清楚而给予前述详细描述,且不应从中理解不必要的限制,因为修改对于本领域技术人员会是显而易见的。没有承认本文中提供的任何信息是现有技术或与目前要求保护的发明相关,或者明确或隐含引用的任何出版物是现有技术。
除非另有定义,本文中所使用的所有技术和科学术语都具有与本发明所属技术领域的普通技术人员一般理解的相同的含义。
虽然本申请已经分成各部分以指导读者注意具体的实施方案,但是此类部分不应解释为实施方案间的分隔。本文中所描述的每个部分和实施方案的教导适用于其它部分。
虽然本发明已经结合其具体实施方案进行了描述,但是应当理解,它能够进一步修改,并且本申请意图覆盖本发明的任何变化、用途、或改编,它们一般遵循本发明的原理,并且包括对本公开内容在本发明所属领域内的已知或习惯实践之内的、且可适用于上文所列出的和所附权利要求书的范围内的本质特征的偏离。
具体地,本发明涉及以下方面:
1.一种纯化的胶束,其包含一种或多种狂犬病病毒(rv)糖蛋白(g蛋白)。
2.项1的纯化的胶束,其中所述rvg蛋白源自选自下组的rv毒株:人、犬、蝙蝠、浣熊、臭鼬、和狐。
3.一种包含rvg蛋白的病毒样颗粒(vlp)。
4.项3的vlp,其中所述rvg蛋白源自选自下组的rv毒株:人、犬、蝙蝠、浣熊、臭鼬、和狐。
5.项3-4中之一的vlp,其中所述vlp包含基质(m)蛋白。
6.项5的vlp,其中所述m蛋白源自rv。
7.项5的vlp,其中所述m蛋白是来自流感病毒株的m1。
8.项5的vlp,其中所述流感病毒株是禽流感病毒株。
9.项8的vlp,其中所述禽流感病毒株是h5n1株。
10.项9的vlp,其中所述h5n1株是甲型/印尼/5/05。
11.项5的vlp,其中所述m蛋白源自新城疫病毒(ndv)株。
12.项3-11中之一的vlp,其中所述vlp在容许vlp形成的条件下在真核细胞中表达。
13.项12的vlp,其中所述真核细胞选自下组:酵母、昆虫、两栖动物、禽、哺乳动物、或植物细胞。
14.一种免疫原性组合物,其包含依照项1-2中之一的纯化的胶束。
15.一种免疫原性组合物,其包含依照项3-13中之一的vlp。
16.一种药学可接受疫苗组合物,其包含依照项1-2中之一的纯化的胶束,其中所述胶束能够在宿主中引发免疫应答。
17.一种药学可接受疫苗组合物,其包含依照项3-13中之一的vlp,其中所述vlp能够在宿主中引发免疫应答。
18.一种用于针对病毒性感染免疫人受试者的试剂盒,其包含依照项1-2中之一的纯化的胶束。
19.一种用于针对病毒性感染免疫人受试者的试剂盒,其包含依照项3-13中之一的vlp。
20.依照项18-19中之一的试剂盒,其中所述病毒性感染是rv感染。
21.一种针对病毒性感染接种哺乳动物的方法,包括对人受试者施用药学可接受配制剂中的项1-2中之一的纯化的胶束。
22.一种针对病毒性感染接种哺乳动物的方法,包括对人受试者施用药学可接受配制剂中的项3-13中之一的vlp。
23.项21-22中之一的方法,其中所述药学可接受配制剂包含佐剂。
24.依照项23的方法,其中所述佐剂是非磷脂脂质体。
25.一种产生针对病毒性感染的免疫应答的方法,包括对人受试者施用药学可接受配制剂中的项1-2中之一的纯化的胶束。
26.一种产生针对病毒性感染的免疫应答的方法,包括对人受试者施用药学可接受配制剂中的项3-13中之一的vlp。
27.一种分离的核酸,其编码seqidno:2的rvg蛋白。
28.一种分离的细胞,其包含项27的核酸。
29.一种载体,其包含项27的核酸。
30.一种生成rvg蛋白的方法,包括:
(a)转化宿主细胞以表达项27的核酸;并
(b)在有助于生成所述rvg蛋白的条件下培养所述宿主细胞。
31.一种生成rvg蛋白胶束的方法,包括:
(a)转化宿主细胞以表达项27的核酸;并
(b)在有助于生成所述rvg蛋白胶束的条件下培养所述宿主细胞。
32.依照项30-31中之一的方法,其中所述宿主细胞是昆虫细胞。
33.依照项32的方法,其中所述昆虫细胞是用包含项27的核酸的载体转染的昆虫细胞。
序列表
<110>诺瓦瓦克斯股份有限公司(novavaxinc.)
smith,gale
liu,ye
<120>狂犬病糖蛋白病毒样颗粒(vlp)
<130>novv-047/01wo
<150>us61/410,767
<151>2011-11-05
<160>2
<170>patentinversion3.5
<210>1
<211>1575
<212>dna
<213>狂犬病病毒(rabiesvirus)
<400>1
atggtgccccaggctctgctcttcgtgcctttgctggtcttcccactctgcttcggcaag60
ttccccatctacaccatccctgacaagctgggcccctggtcccctatcgacatccaccac120
ttgtcttgccctaacaacctggtggtcgaggacgaaggctgcactaacttgtccggattc180
tcttacatggagctgaaagtgggttacatctccgctatcaagatgaacggcttcacttgc240
accggagtggtcaccgaggccgaaacttacaccaacttcgtgggctacgtcaccactacc300
ttcaagaggaagcacttcagaccaactcccgacgcttgcagggctgcctacaactggaag360
atggccggagacccaagatacgaggaatccctgcacaacccttacccagactaccactgg420
ctccgtaccgtgaagactaccaaggagtccctggtcatcatctccccatctgtcgctgac480
ctcgacccctacgaccgtagcttgcactcaagagtcttcccaggtggaaactgcagcgga540
gtggccgtctcctctacttactgctcaaccaaccacgactacactatctggatgccagag600
aacccccgcctgggcatgagctgcgacatcttcaccaactcacgtggaaagcgcgcctcc660
aagggttctgagacttgcggcttcgtggacgaaaggggtttgtacaagtccctgaagggc720
gcttgcaagctcaagttgtgcggcgtgctgggactcagattgatggacggcacctgggtc780
gccatgcagactagcaacgagaccaagtggtgcccccctggacaactcgtgaacttgcac840
gacttccgttcagacgagatcgaacacctggtggtcgaggaactcgtcaagaagcgcgag900
gaatgcctggacgctctcgagagcatcatgactaccaagagcgtgtcattccgtcgcttg960
tcacacctgaggaagctcgtccccggtttcggcaaggcctacactatcttcaacaagacc1020
ctcatggaggctgacgcccactacaagtccgtgcgtacctggaacgaaatcatcccctct1080
aagggttgcctgcgtgtcggaggtagatgccaccctcacgtgaacggagtcttcttcaac1140
ggtatcatcctgggtcctgacggcaacgtgctcatcccagagatgcaaagctcactcttg1200
cagcaacacatggaactgctcgtgtcctctgtcatccctctcatgcacccattggctgac1260
cccagcaccgtcttcaagaacggcgacgaggccgaagacttcgtggaggtccacctgcca1320
gacgtgcacgaacgcatctccggagtcgacctgggtctccccaactggggaaagtacgtg1380
ttgctgtctgctggtgccctcaccgctttgatgctgatcatcttcttgatgacttgctgg1440
aggagagtcaacaggtctgagcctactcagcacaacctgaggggaaccggtagagaagtg1500
tccgtcactccacaatctggaaagatcatcagctcatgggagagctacaagtcaggcgga1560
gaaaccggtctgtaa1575
<210>2
<211>524
<212>prt
<213>狂犬病病毒(rabiesvirus)
<400>2
metvalproglnalaleuleuphevalproleuleuvalpheproleu
151015
cyspheglylyspheproiletyrthrileproasplysleuglypro
202530
trpserproileaspilehishisleusercysproasnasnleuval
354045
valgluaspgluglycysthrasnleuserglyphesertyrmetglu
505560
leulysvalglytyrileseralailelysmetasnglyphethrcys
65707580
thrglyvalvalthrglualagluthrtyrthrasnphevalglytyr
859095
valthrthrthrphelysarglyshispheargprothrproaspala
100105110
cysargalaalatyrasntrplysmetalaglyaspproargtyrglu
115120125
gluserleuhisasnprotyrproasptyrhistrpleuargthrval
130135140
lysthrthrlysgluserleuvalileileserproservalalaasp
145150155160
leuaspprotyraspargserleuhisserargvalpheproglygly
165170175
asncysserglyvalalavalserserthrtyrcysserthrasnhis
180185190
asptyrthriletrpmetprogluasnproargleuglymetsercys
195200205
aspilephethrasnserargglylysargalaserlysglyserglu
210215220
thrcysglyphevalaspgluargglyleutyrlysserleulysgly
225230235240
alacyslysleulysleucysglyvalleuglyleuargleumetasp
245250255
glythrtrpvalalametglnthrserasngluthrlystrpcyspro
260265270
proglyglnleuvalasnleuhisasppheargseraspgluileglu
275280285
hisleuvalvalglugluleuvallyslysarggluglucysleuasp
290295300
alaleugluserilemetthrthrlysservalserpheargargleu
305310315320
serhisleuarglysleuvalproglypheglylysalatyrthrile
325330335
pheasnlysthrleumetglualaaspalahistyrlysservalarg
340345350
thrtrpasngluileileproserlysglycysleuargvalglygly
355360365
argcyshisprohisvalasnglyvalphepheasnglyileileleu
370375380
glyproaspglyasnvalleuileproglumetglnserserleuleu
385390395400
glnglnhismetgluleuleuvalserservalileproleumethis
405410415
proleualaaspproserthrvalphelysasnglyaspglualaglu
420425430
aspphevalgluvalhisleuproaspvalhisgluargilesergly
435440445
valaspleuglyleuproasntrpglylystyrvalleuleuserala
450455460
glyalaleuthralaleumetleuileilepheleumetthrcystrp
465470475480
argargvalasnargsergluprothrglnhisasnleuargglythr
485490495
glyarggluvalservalthrproglnserglylysileileserser
500505510
trpglusertyrlysserglyglygluthrglyleu
515520
- 还没有人留言评论。精彩留言会获得点赞!