用于在与内源性维甲酸类缺乏相关的视觉障碍中改善视觉功能的治疗方案和方法与流程
相关申请本申请要求2012年3月1日提交的美国临时申请61/605,729、2012年5月3日提交的美国临时申请61/642,212和2012年5月8日提交的美国临时申请61/644,360的优先权,将其所公开的全部内容引入到本申请中作为参考。本申请涉及用于在患有与内源性维甲酸类(retinoid)缺乏相关的视觉障碍的受试者中改善视觉功能的治疗方案和方法,其包括向所述受试者给药合成性视黄醛衍生物。
背景技术:
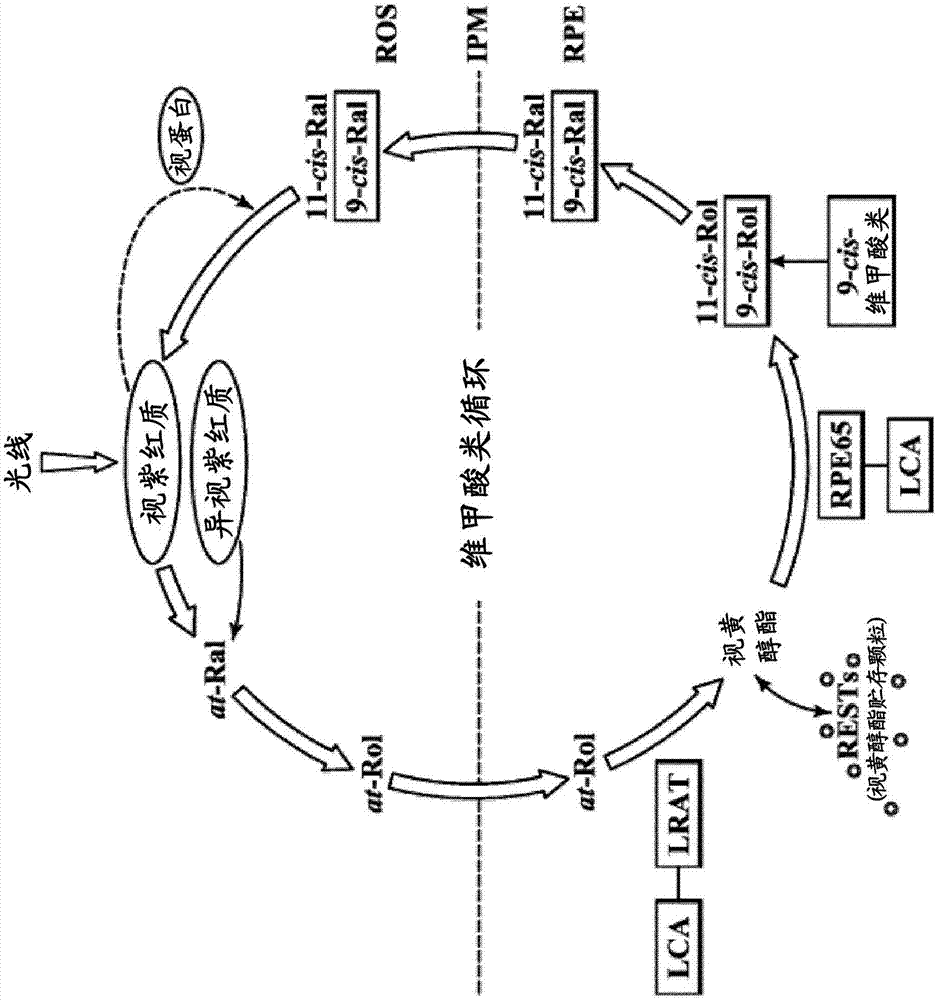
:对11-顺式-视黄醛的产生、转化和/或再生具有中断或干扰作用的基因突变所导致的遗传性视网膜疾病(ird)引起重度视力缺损和儿童期失明。11-顺式-视黄醛为在视网膜色素上皮细胞(rpe)中且由视网膜色素上皮细胞(rpe)通过对全反式-视黄醇(来自饮食的维生素a)进行异构化和氧化而产生的内源性维甲酸类。11-顺式-视黄醛作为生色团而发挥功能且与视蛋白共价连接以形成异视紫红质。当11-顺式-视黄醛捕获可见光光子而异构化成全反式-视黄醛且与视蛋白解离时,视觉被触发。视觉如下保持:通过一系列复杂的涉及维甲酸类或视觉周期中多种酶和蛋白质的生化反应使全反式-视黄醛循环回到11-顺式-视黄醛。内源性维甲酸类缺乏例如由于对视觉周期中所使用的酶和蛋白质进行编码的基因发生突变而引起的那些内源性维甲酸类缺乏对11-顺式-视黄醛的合成造成损害,这由于11-顺式-视黄醛的不足或消耗而引起视觉障碍。例如,色素性视网膜炎(retinitispigmentosa,rp)为一种遗传性视网膜疾病,其特征在于视杆细胞和视锥细胞的变性(hartong,d.t.etal.,lancet,368,1795-1809(2006))。有很多种形式的rp,所有这些rp都显示出随时间而受到各种限制的视觉功能且疾病的病因和进展在个体之间显示出很大的变异性。rp的特征通常在于最初症状为夜盲症,其发病于青春期或成年早期,发生周边视觉的丧失且随疾病的进展而发生中央视觉的丧失,这可引起失明或重度视力缺损。症状的发病年龄是高度变化的且范围为儿童期至成年中期。可通过发病年龄例如先天型rp(有时称为lca)、青少年发病型rp、少年发病型rp、成人发病型rp和迟发型rp对rp进行疾病分类。erg响应为rp中视杆细胞和视锥细胞功能丧失的早期指征且erg响应的降低可在生命的最初几年内显现,尽管症状出现得晚很多。典型的rp以视杆细胞的原发性变性及视锥细胞的继发性变性形式存在且因此被描述为视杆细胞-视锥细胞营养不良,其中与视锥细胞相比,视杆细胞受到较多的影响。光感受器发生变化的这种顺序解释了为什么一些rp受试者最初呈现夜盲症且仅在生命后期才变得在各种亮度条件下都是视力缺损的。可选择地,在约10-20%患有rp的受试者中显示出视锥细胞-视杆细胞营养不良。多种不同基因的缺陷和与其相关的疾病路径可引起rp。现在已经在100多种不同的基因中检测到200多种病因性rp突变。rp基因型是混杂的且具有相同突变的rp受试者可显示出不同的表现型。可通过遗传型例如常染色体显性型(ad)rp、常染色体隐性型(ar)rp、x相关(xl)或性相关隐性型rp、偶发型rp(单纯型rp且大多数是隐性的)或二基因型rp对rp进行分类。据估计当前在世界范围内有至少300,000人受到rp的影响,其中约20%-30%为常染色体隐性型(arrp)。近年来已经在患有arrp或adrp的rp受试者中发现lrat和rpe65基因的突变。这些具体的突变及abca4和rdh12的突变与视觉周期中维甲酸类代谢的缺陷是相关的且可引起光感受器变性。内源性维甲酸类缺乏例如由于对视觉周期中所使用的酶和蛋白质进行编码的基因发生突变而引起的那些内源性维甲酸类缺乏对11-顺式-视黄醛的合成造成损害,这由于11-顺式-视黄醛的不足或消耗而引起视觉障碍。rpe65基因所编码的蛋白质与视黄醇结合蛋白和11-顺式-视黄醇脱氢酶是生化相关的且是产生11-顺式-视黄醛所必需的(gollapalli,d.r.etal.,biochemistry.42(19):5809-5818(2003)和redmond,t.m.etal.,natgenet.20(4):344-351(1998))。11-顺式-视黄醛为在视网膜色素上皮细胞(rpe)中且由视网膜色素上皮细胞(rpe)通过对全反式-视黄醇(来自饮食的维生素a)进行异构化和氧化而产生的内源性维甲酸类。11-顺式-视黄醛作为生色团而发挥功能且与视蛋白共价连接以形成视紫红质。当11-顺式-视黄醛捕获可见光光子而异构化成全反式-视黄醛且与视蛋白解离时,视觉被触发。视觉如下保持:通过一系列复杂的涉及维甲酸类或视觉周期中多种酶和蛋白质的生化反应使全反式-视黄醛循环回到11-顺式-视黄醛。临床前和临床信息显示rpe65蛋白功能的丧失阻断了维生素a被酯化成膜脂质后的维甲酸类加工且引起视觉的丧失。rpe65突变主要与早发型重度视网膜营养不良相关,其中在生命的最初几年内出现视杆细胞-视锥细胞变性、眼球震颤和重度视觉丧失。rpe65突变所引起的疾病的严重度似乎在很大程度上与存在于rp受试者中的突变类型不相关。许多rpe65受试者都具有以在生命早期具有很差但能用的视觉功能(可测量的视锥细胞erg)为特征的共同表现型,所述视觉功能在学龄阶段显著衰退。另外,许多这样的rp受试者在30岁时尽管大幅受损,但是仍然保留了残余的孤立的周边视觉。进行性视野(vf)丧失为rp的标志之一且通常用作监测疾病进展的手段(groveretal.,ophthalmology,105:1069-1075(1998))。已经观察到大多数rp受试者在40岁前由于视杆细胞功能的丧失超过视锥细胞敏感性的降低而导致严重受限的视野且因此成为法律意义上的盲人。尽管据报道患有早发型rp的rp受试者与其它类型的rp相比具有较稳定的va,但是视敏度(va)缺损在rp过程中也可能是明显的且va缺损的水平在rp受试者之间可能有很大的变化。例如,已经报道在一些患有晚期rp且具有小的残余的孤立的中央vf的rp患者中,va可保持正常。在其他rp患者中,va的降低可能是较显著的。例如,莱伯先天性黑矇(lebercongenitalamaurosis,lca)(其作为遗传性儿童期失明的病因自出生或出生后不久就对儿童具有影响)与例如对视网膜色素上皮蛋白65(rpe65)进行编码的rpe65基因所发生的遗传性基因突变和/或对卵磷脂:视黄醇乙酰基转移酶(lrat)进行编码的lrat基因所发生的遗传性基因突变相关。lca患者不能足够量地产生11-顺式-视黄醛且因此患有出生时的重度视觉丧失、眼球震颤、很差的瞳孔响应和严重减弱的视网膜电图(erg)。lca表现的严重度具有显著的临床变异性(包括严重度的家庭内变异性)。就视觉丧失的自然过程、低亮度条件下的行为和引起表现型的遗传缺陷而言,lca显示出临床和遗传异质性。白点状视网膜炎(rpa)为另一种形式的rp,其显示出11-顺式-视黄醛在视杆细胞中的不足。lrat的纯合移码突变最近被鉴定为一些受试者中的rpa病因且已经报道lrat为参与视觉周期的第四种基因,其可引起白点状视网膜病(littinketal.,ophthalmology,119:1899-906(2012))。先天性静止性夜盲症(csnb)和白点状眼底为一组疾病,其表现为夜盲症,但是不存在如rp那样的进行性视觉丧失。一些形式的csnb是由于11-顺式-视黄醛的再循环延迟。白点状眼底直到最近才被认为是一种特殊形式的csnb,其中视网膜的形态由于数百个小白点出现在视网膜中而是不正常的。最近已经证实这也是一种进行性疾病,尽管比rp慢得多。其病因是使11-顺式-视黄醛的循环发生延迟的基因缺陷(包括rpe65的杂合突变)(schatzetal.,ophthalmology,118:888-94(2011))。合成性视黄醛衍生物及其组合物在使脊椎动物视觉系统中的光感受器功能得以恢复或稳定的方法中的使用参见国际专利申请公开文本wo2004/082622、wo2006/002097、wo2009/102418、wo2011/034551和wo2011/132084及所公开的美国申请2004/0242704、2008/0221208(授权为美国专利7,951,841)和2010/0035986(授权为美国专利8,324,270)。对9-顺式-视黄醇乙酸酯即一种合成性视黄醛衍生物在老龄小鼠中每天给药和间歇给药的作用进行评价的研究参见maeda,t.etal.,investigativeophthalmology&visualscience(2009),vol.50,no.9,pp.4368-4378。动物模型已经证实除非眼睛被遮盖,作为高光敏性化合物的合成性维甲酸类由于来自视网膜的光线而在几小时内就发生光异构化或“漂白”。这些研究所使用的动物在用合成性维甲酸类处理期间在暗处保持指定的时段直到评价时段以使合成性维甲酸类的光异构化/漂白最小化,而合成性维甲酸类的光异构化/漂白将使处理所要实现的整个目标不能实现。参见battenmletal.“pharmacologicalandraavgenetherapyrescueofviscualfunctionsinablindmousemodeloflebercongenitalamaurosis”plo-smedicinevol.2,p.333(2005);margaron,p.,castaner,l.andnarfstrom,k.“evaluationofintravitrealcis-retinoidreplacementtherapyinacaninemodelofleber’scongenitalamaurosis”investophthalmolvissci2009;50:e-abstract6280;gearhartpm,gearhartc,thompsonda,petersen-jonessm.“improvementofvisualperformancewithintravitrealadministrationof9-cis-retinalinrpe65-mutantdogs”archophthalmol2010;128(11):1442-8。任何维甲酸类为了弥补漂白作用而进行的频繁给药都涉及维甲酸类化合物的公知毒性。参见teelmann,k“retinoids:toxicityandteratogenicitytodate”pharmac.ther.,vol.40,pp29-43(1989);gerber,leetal.“changesinlipidmetabolismduringretinoidadministration”j.amer.acad.derm.,vol.6,pp664-74(1982);allenlh“estimatingthepotentialforvitatoxicityinwomenandyoungchildren”j.nutr.,vol.132,pp.2907-19(2002);silverman,ak“hypervitaminosisasyndrome:aparadigmofretinoidsideeffects”j.am.acad.derm.,vol.16,pp1027-39(1987);zechlaetal.“changesinplasmacholesterolandtriglyceridelevelsaftertreatmentwithoralisotretinoin”arch.dermatol.,vol.119,pp987-93(1983)。维甲酸类的长期给药所引起的毒性可导致脂质代谢的变化、对肝脏的损伤、恶心、呕吐、视力模糊、对骨骼的损伤、对骨骼发育的干扰和几种其它严重的不良作用。就在患有内源性维甲酸类缺乏例如rp或lca(其为需要终生治疗的慢性病症)的受试者中改善视觉功能而言,这些毒性作用可能是非常严重的。文献所充分表明的是,这些副作用在易被与其身体发育相关的副作用所影响的年轻受试者中是尤其引人关注的。对为了应对漂白而进行的重复给药和重复给药所带来的严重不良副作用的组合需要对合成性维甲酸类用于在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能提出了疑问。最近进行的研究评价了维甲酸类在治疗这些障碍中的有用性且得出维甲酸类和类似化合物不是良好治疗性候选物的结论。参见fanj.etal.“lightpreventsexogenous11-cisretinalfrommaintainingconephotoreceptorsinchromophore-deficientmice”,invest.ophthalmol.vissci.january12,2011,10-6437。技术实现要素:本申请提供合成性视黄醛衍生物的一些给药方案,所述合成性视黄醛衍生物可代替内源性产生的11-顺式-视黄醛,因此在患有内源性维甲酸类缺乏的受试者中在小于1个月的整个休止间隔例如7-28天内产生有意义的视觉改善,而同时在给药和休止的整个重复治疗周期内显示出可接受的安全性分布。在一些实施方案中,所述可接受的安全性分布可如下实现:使与合成性视黄醛衍生物在整个后续给药周期内的频繁和后续给药相关的毒性副作用的严重度最小化和/或降低与合成性视黄醛衍生物在整个后续给药周期内的频繁和后续给药相关的毒性副作用的严重度。在一些实施方案中,所述内源性维甲酸类缺乏由于例如在色素性视网膜炎(rp)或莱伯先天性黑矇(lca)受试者中对视觉周期中所使用的酶和蛋白质进行编码的基因发生突变而引起。因此,本申请提供用于在患有rp、lca或与内源性11-顺式-视黄醛缺乏相关的其它视觉障碍的受试者中改善视觉功能的治疗方案和方法,其包括向所述受试者给药合成性视黄醛衍生物。在一些实施方案中,本申请提供在患有11-顺式-视黄醛内源性产生缺乏的受试者中改善视觉功能的方法,其包括:a)向有此需要的受试者给药第一治疗剂量的合成性视黄醛衍生物;b)提供小于1个月例如约7天至约28天的休止期;和c)在所述休止期结束后向所述受试者给药第二治疗剂量的所述合成性视黄醛衍生物。在一些实施方案中,本申请提供在受试者中改善视觉功能的方法,其包括:a)向有此需要的受试者给药第一治疗剂量的9-或11-顺式-视黄酯;b)提供小于1个月例如约7天至约28天的休止期;和c)在所述休止期结束后向所述受试者给药第二治疗剂量的所述9-或11-顺式-视黄酯。在一些实施方案中,所述受试者缺乏内源性产生的11-顺式-视黄醛。在一些实施方案中,所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者患有lrat基因突变。在其它实施方案中,所述受试者患有rpe65基因突变。在一些实施方案中,所述受试者患有中度至重度rp。在其它实施方案中,所述受试者患有轻度rp。在一些实施方案中,所述受试者患有早发型或青少年型rp。在一些实施方案中,所述受试者患有先天型rp。在一些实施方案中,所述受试者患有青少年发病型rp。在其它实施方案中,所述受试者患有少年发病型rp。在其它实施方案中,所述受试者患有成人发病型rp或迟发型rp。在一些实施方案中,所述受试者患有常染色体隐性rp。在一些实施方案中,所述受试者患有常染色体显性rp。在一些实施方案中,所述受试者患有lca。在一些实施方案中,所述在受试者(包括患有rp的受试者)中改善视觉功能的方法还包括将步骤b)和c)重复进行一次或多次。在一些实施方案中,所述第一治疗剂量以分份剂量历时2-7天来给药。在一些实施方案中,所述第一治疗剂量以分份剂量历时7天来给药。在其它实施方案中,所述第一治疗剂量以分份剂量历时5天来给药。在一些实施方案中,所述休止期为约7天至约21天。在一些实施方案中,所述休止期为约21天。在其它实施方案中,所述休止期为约14天。在其它实施方案中,所述休止期为约7天。在一些实施方案中,所述第一治疗剂量为约280mg/m2至约420mg/m2。在一些实施方案中,所述第一治疗剂量为约280mg/m2。在一些实施方案中,所述第一治疗剂量为约420mg/m2。在一些实施方案中,口服给药所述治疗剂量。在一些实施方案中,所述第一治疗剂量为约5mg/m2/天或约10mg/m2/天或约20mg/m2/天或约40mg/m2/天。在其它实施方案中,所述第一治疗剂量为约60mg/m2/天。在一些实施方案中,所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。在一些实施方案中,所述视黄酯为9-顺式-视黄酯。在一些实施方案中,所述视黄酯为9-顺式-视黄醇乙酸酯。在一些实施方案中,所述视黄酯为11-顺式-视黄醇乙酸酯。在一些实施方案中,改善视觉功能包括当通过戈德曼视野(goldmannvisualfield,gvf)分析来测量时使眼睛的视野相对于基线增加至少20%。在其它实施方案中,改善视觉功能包括当使用早期治疗糖尿病性视网膜病研究(earlytreatmentdiabeticretinopathystudy,etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母。在其它实施方案中,改善视觉功能包括视网膜敏感性相对于基线的临床上显著的提高。本申请还提供在患有内源性维甲酸类缺乏例如rp的受试者中改善视觉功能的方法,其包括:a)向有此需要的受试者给药第一治疗剂量的9-顺式-视黄醇乙酸酯,其中所述第一治疗剂量以约40mg/m2/天至约60mg/m2/天历时7天来给药;b)提供约7天至约21天的休止期;和c)在所述休止期结束后向有此需要的受试者给药第二治疗剂量的9-顺式-视黄醇乙酸酯。在一些实施方案中,所述受试者缺乏内源性产生的11-顺式-视黄醛。在一些实施方案中,所述9-顺式-视黄醇乙酸酯代替内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者患有lrat基因突变。在一些实施方案中,所述受试者患有rpe65基因突变。在一些实施方案中,所述受试者患有中度至重度rp。在一些实施方案中,所述受试者患有轻度rp。在一些实施方案中,所述受试者患有早发型或青少年型rp。在一些实施方案中,所述在患有rp的受试者中改善视觉功能的方法还包括将步骤b)和c)重复进行一次或多次。在一些实施方案中,所述改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%或当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。在一些实施方案中,所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。在一些实施方案中,口服给药所述治疗剂量。在一些实施方案中,所述受试者为人类受试者。本申请还提供在患有内源性维甲酸类缺乏例如rp的受试者中改善视觉功能的方法,其包括向有此需要的受试者给药至少第一和第二治疗剂量的9-或11-顺式-视黄酯,其中所述第一剂量和所述第二剂量之间的休止期小于1个月例如约7天至约28天且其中改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%、当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。在一些实施方案中,所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者缺乏内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者患有lrat基因突变。在其它实施方案中,所述受试者患有rpe65基因突变。在一些实施方案中,所述受试者患有中度至重度rp。在一些实施方案中,所述受试者患有轻度rp。在一些实施方案中,所述受试者患有早发型或青少年型rp。在一些实施方案中,所述受试者患有lca。在一些实施方案中,所述第一治疗剂量以分份剂量历时2-7天来给药。在一些实施方案中,所述第一治疗剂量以分份剂量历时7天来给药。在一些实施方案中,所述第一治疗剂量以分份剂量历时5天来给药。在一些实施方案中,所述第一治疗剂量以分份剂量历时6天或4天或3天或2天来给药。在一些实施方案中,在此期间不给药治疗剂量的所述休止期为约2天至约21天、约2天至约25天或约2天至约28天。在一些这样的实施方案中,在此期间不给药治疗剂量的所述休止期为约7天至约21天、约7天至约25天或约7天至约28天。在一些实施方案中,所述休止期为约7天至约21天。在一些实施方案中,所述休止期为约21天。在其它实施方案中,所述休止期为约14天。在其它实施方案中,所述休止期为约7天。在一些实施方案中,所述第一治疗剂量为约280mg/m2至约420mg/m2总组合剂量。在一些实施方案中,所述第一治疗剂量为约280mg/m2总组合剂量。在一些实施方案中,所述第一治疗剂量为约420mg/m2总组合剂量在一些实施方案中,口服给药所述治疗剂量。在一些实施方案中,所述第一治疗剂量为约10mg/m2/天。在一些实施方案中,所述第一治疗剂量为约20mg/m2/天。在一些实施方案中,所述第一治疗剂量为约40mg/m2/天。在其它实施方案中,所述第一治疗剂量为约60mg/m2/天。在一些实施方案中,所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。在一些实施方案中,所述视黄酯为9-顺式-视黄酯。在一些实施方案中,所述视黄酯为9-顺式-视黄醇乙酸酯。在一些实施方案中,所述视黄酯为11-顺式-视黄醇乙酸酯。本申请还提供用于在患有内源性维甲酸类缺乏例如rp的受试者中改善视觉功能的试剂盒,所述试剂盒包含:a)至少第一治疗剂量的9-或11-顺式-视黄酯;和b)使用说明书,其提供所述第一治疗剂量和第二剂量之间的休止期,其中所述休止期小于1个月例如约7天至约28天。在一些实施方案中,所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者缺乏内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者患有lrat基因突变。在其它实施方案中,所述受试者患有rpe65基因突变。在一些实施方案中,所述受试者患有中度至重度rp。在其它实施方案中,所述受试者患有轻度rp。在一些实施方案中,所述受试者患有早发型或青少年型rp。在一些实施方案中,所述说明书指导所述第一剂量以分份剂量历时2-7天或历时2-5天来给药。在一些实施方案中,所述说明书指导所述第一剂量以分份剂量历时7天来给药。在一些实施方案中,所述说明书指导所述休止期为约2天至约21天。在一些实施方案中,所述说明书指导所述休止期为约7天至约21天。在一些实施方案中,所述说明书指导所述休止期为约21天。在一些实施方案中,所述说明书指导所述休止期为约14天。在一些实施方案中,所述说明书指导所述休止期为约7天。在一些实施方案中,所述说明书指导所述休止期为约23天、25天或28天。在一些实施方案中,所述说明书指导就所述给药方案中的每个治疗期而言,总休止期+给药期组合起来共计28天或30天。在一些实施方案中,所述第一治疗剂量为约280mg/m2至约420mg/m2。在一些实施方案中,所述第一治疗剂量为约280mg/m2。在一些实施方案中,所述第一治疗剂量为约420mg/m2。在一些实施方案中,口服给药所述治疗剂量。在一些实施方案中,所述说明书指导所述第一治疗剂量为约10mg/m2/天。在一些实施方案中,所述说明书指导所述第一治疗剂量为约20mg/m2/天。在一些实施方案中,所述说明书指导所述第一治疗剂量为约40mg/m2/天。在一些实施方案中,所述说明书指导所述第一治疗剂量为约60mg/m2/天。在一些实施方案中,所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。在一些实施方案中,所述视黄酯为9-顺式-视黄醇乙酸酯。在其它实施方案中,所述视黄酯为11-顺式-视黄醇乙酸酯。在一些实施方案中,改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%。在一些实施方案中,改善视觉功能包括当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母。在一些实施方案中,改善视觉功能包括视网膜敏感性相对于基线的临床上显著的提高。本申请还提供用于在患有rp的受试者中改善视觉功能的给药方案,其中所述给药方案至少包括第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括:a)历时约2天至约7天向有此需要的受试者给药第一剂量的9-或11-顺式-视黄酯;b)提供所述第一治疗剂量和所述第二治疗剂量之间的小于1个月例如约7天至约28天的休止期;和c)在所述休止期结束后向所述有此需要的受试者给药所述第二治疗剂量的9-或11-顺式-视黄酯。在一些实施方案中,所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者缺乏内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者患有lrat基因突变。在其它实施方案中,所述受试者患有rpe65基因突变。在一些实施方案中,所述受试者患有中度至重度rp。在一些实施方案中,所述受试者患有轻度rp。在一些实施方案中,所述受试者患有早发型或青少年型rp。在一些实施方案中,所述给药方案还包括将步骤b)和c)重复进行一次或多次。在一些实施方案中,所述第一剂量以分份剂量历时7天来给药。在一些实施方案中,所述休止期为约2天至约28天例如约7天至约28天。在一些实施方案中,所述休止期为约7天至约21天。在一些实施方案中,所述休止期为约21天。在一些实施方案中,所述休止期为约14天。在一些实施方案中,所述休止期为约7天。在一些实施方案中,所述第一治疗剂量为约280mg/m2至约420mg/m2。在一些实施方案中,所述第一治疗剂量为约280mg/m2。在一些实施方案中,口服给药所述治疗剂量。在一些实施方案中,所述第一治疗剂量为约10mg/m2/天。在一些实施方案中,所述第一治疗剂量为约20mg/m2/天。在一些实施方案中,所述第一治疗剂量为约40mg/m2/天。在其它实施方案中,所述第一治疗剂量为约60mg/m2/天。在一些实施方案中,所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。在一些实施方案中,所述视黄酯为9-顺式-视黄醇乙酸酯。在其它实施方案中,所述视黄酯为11-顺式-视黄醇乙酸酯。在一些实施方案中,改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%。在一些实施方案中,改善视觉功能包括当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母。在一些实施方案中,改善视觉功能包括视网膜敏感性相对于基线的临床上显著的提高。本申请还提供用于在患有rp的受试者中改善视觉功能的给药方案,其中所述给药方案至少包括第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括:a)给药所述第一治疗剂量的9-顺式-视黄醇乙酸酯,其中以约40mg/m2/天历时7天向有此需要的受试者给药所述第一治疗剂量;b)提供约7天至约21天的休止期;和c)在所述休止期结束后向所述受试者给药第二治疗剂量的9-顺式-视黄醇乙酸酯。在一些实施方案中,所述9-顺式-视黄醇乙酸酯代替内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者缺乏内源性产生的11-顺式-视黄醛。在一些实施方案中,所述受试者患有lrat基因突变。在一些实施方案中,所述受试者患有rpe65基因突变。在一些实施方案中,所述受试者患有中度至重度rp。在一些实施方案中,所述受试者患有轻度rp。在一些实施方案中,所述受试者患有早发型或青少年型rp。在一些实施方案中,所述给药方案还包括将步骤b)和c)重复进行一次或多次。在一些实施方案中,所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。在一些实施方案中,改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%或当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。在一些实施方案中,口服给药所述治疗剂量。在上述任何方法、给药方案和试剂盒的一些实施方案中,所述受试者为人类受试者。具体地,本发明涉及以下方面:项1:在患有11-顺式-视黄醛内源性产生缺乏的受试者中改善视觉功能的方法,其包括:a.向有此需要的受试者给药第一治疗剂量的合成性视黄醛衍生物,其中所述第一治疗剂量以分份剂量历时约2天至约7天来给药;b.提供约7天至约28天的休止期;和c.在所述休止期结束后向所述受试者给药第二治疗剂量的所述合成性视黄醛衍生物。项2:项1的方法,其中所述受试者患有色素性视网膜炎(rp)。项3:项2的方法,其中所述受试者患有中度至重度rp。项4:项2的方法,其中所述受试者患有轻度rp。项5:项2的方法,其中所述受试者患有早发型或青少年型rp。项6:项1的方法,其中所述受试者患有莱伯先天性黑矇(lca)。项7:项1的方法,其中所述受试者患有lrat基因突变。项8:项1的方法,其中所述受试者患有rpe65基因突变。项9:项1-8中任一项的方法,其中所述合成性视黄醛衍生物代替内源性产生的11-顺式-视黄醛。项10:项1-9中任一项的方法,其中所述方法还包括将步骤b和c重复进行一次或多次。项11:项1-10中任一项的方法,其中所述第一治疗剂量以分份剂量历时7天来给药。项12:项1-11中任一项的方法,其中所述休止期为约7天至约21天。项13:项12的方法,其中所述休止期为约21天。项14:项12的方法,其中所述休止期为约14天。项15:项12的方法,其中所述休止期为约7天。项16:项1-15中任一项的方法,其中所述受试者为人类受试者。项17:在患有11-顺式-视黄醛内源性产生缺乏的受试者中改善视觉功能的方法,所述方法包括:a.向有此需要的受试者给药第一治疗剂量的9-或11-顺式-视黄酯,其中所述第一治疗剂量以分份剂量历时约2天至约7天来给药;b.提供约7天至约28天的休止期;和c.在所述休止期结束后向所述受试者给药第二治疗剂量的所述9-或11-顺式-视黄酯。项18:项17的方法,其中所述受试者患有色素性视网膜炎(rp)。项19:项18的方法,其中所述受试者患有中度至重度rp。项20:项18的方法,其中所述受试者患有轻度rp。项21:项18的方法,其中所述受试者患有早发型或青少年型rp。项22:项17的方法,其中所述受试者患有莱伯先天性黑矇。项23:项17的方法,其中所述受试者患有lrat基因突变。项24:项17的方法,其中所述受试者患有rpe65基因突变。项25:项17-24中任一项的方法,其中所述方法还包括将步骤b和c重复进行一次或多次。项26:项17-25中任一项的方法,其中所述第一治疗剂量以分份剂量历时7天来给药。项27:项17-26中任一项的方法,其中所述休止期为约7天至约21天。项28:项27的方法,其中所述休止期为约21天。项29:项27的方法,其中所述休止期为约14天。项30:项27的方法,其中所述休止期为约7天。项31:项17-30中任一项的方法,其中所述第一治疗剂量为约280mg/m2至约420mg/m2。项32:项31的方法,其中所述第一治疗剂量为约280mg/m2。项33:项31的方法,其中所述第一治疗剂量为约420mg/m2。项34:项17-30中任一项的方法,其中所述第一治疗剂量为约10mg/m2/天。项35:项17-30中任一项的方法,其中所述第一治疗剂量为约20mg/m2/天。项36:项17-32中任一项的方法,其中所述第一治疗剂量为约40mg/m2/天。项37:项17-31中任一项的方法,其中所述第一治疗剂量为约60mg/m2/天。项38:项17-37中任一项的方法,其中口服给药所述治疗剂量。项39:项17-38中任一项的方法,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项40:项17-39中任一项的方法,其中所述视黄酯为9-顺式-视黄酯。项41:项40的方法,其中所述视黄酯为9-顺式-视黄醇乙酸酯。项42:项17-39中任一项的方法,其中所述视黄酯为11-顺式-视黄醇乙酸酯。项43:项17-42中任一项的方法,其中所述受试者为人类受试者。项44:用于在患有11-顺式-视黄醛内源性产生缺乏的受试者中改善视觉功能的试剂盒,所述试剂盒包含:a.至少第一治疗剂量的9-或11-顺式-视黄酯;和b.使用说明书,其指导所述第一治疗剂量以分份剂量历时约2天至约7天来给药且提供所述第一治疗剂量和第二剂量之间的休止期,其中所述休止期为约7天至约28天。项45:项44的试剂盒,其中所述受试者患有莱伯先天性黑矇(lca)。项46:项44的试剂盒,其中所述受试者患有色素性视网膜炎(rp)。项47:用于在患有11-顺式-视黄醛内源性产生缺乏的受试者中改善视觉功能的给药方案,其中所述给药方案至少包括第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括:a.历时约2天至约7天向有此需要的受试者给药第一剂量的9-或11-顺式-视黄酯;b.提供所述第一治疗剂量和所述第二治疗剂量之间的约7天至约28天的休止期;和c.在所述休止期结束后向所述有此需要的受试者给药所述第二治疗剂量的9-或11-顺式-视黄酯。项48:项47的给药方案,其中所述受试者患有莱伯先天性黑矇(lca)。项49:在患有内源性维甲酸类缺乏的受试者中改善视觉功能的方法,其包括:a.向有此需要的受试者给药第一治疗剂量的9-或11-顺式-视黄酯,其中所述第一治疗剂量以分份剂量历时约2天至约7天来给药;b.提供约7天至约28天的休止期;和c.在所述休止期结束后向所述受试者给药第二治疗剂量的所述9-或11-顺式-视黄酯。项50:项49的方法,其中所述受试者缺乏内源性产生的11-顺式-视黄醛。项51:项49或50的方法,其中所述受试者患有色素性视网膜炎(rp)。项52:项51的方法,其中所述受试者患有早发型或青少年型rp。项53:项51的方法,其中所述受试者患有中度至重度rp。项54:项51的方法,其中所述受试者患有轻度色素性视网膜炎(rp)。项55:项49或50的方法,其中所述受试者患有莱伯先天性黑矇(lca)。项56:项49-55中任一项的方法,其中所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。项57:项49或50的方法,其中所述受试者患有lrat基因突变。项58:项49或50的方法,其中所述受试者患有rpe65基因突变。项59:项49-58中任一项的方法,其中所述方法还包括将步骤b和c重复进行一次或多次。项60:项49-59中任一项的方法,其中所述第一治疗剂量以分份剂量历时7天来给药。项61:项49-60中任一项的方法,其中所述休止期为约7天至约21天。项62:项61的方法,其中所述休止期为约21天。项63:项61的方法,其中所述休止期为约14天。项64:项61的方法,其中所述休止期为约7天。项65:项49-64中任一项的方法,其中所述第一治疗剂量为约280mg/m2至约420mg/m2。项66:项65的方法,其中所述第一治疗剂量为约280mg/m2。项67:项65的方法,其中所述第一治疗剂量为约420mg/m2。项68:项49-64中任一项的方法,其中所述第一治疗剂量为约10mg/m2/天。项69:项49-64中任一项的方法,其中所述第一治疗剂量为约20mg/m2/天。项70:项49-66中任一项的方法,其中所述第一治疗剂量为约40mg/m2/天。项71:项49-65中任一项的方法,其中所述第一治疗剂量为约60mg/m2/天。项72:项49-71中任一项的方法,其中口服给药所述治疗剂量。项73:项49-72中任一项的方法,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项74:项49-73中任一项的方法,其中所述视黄酯为9-顺式-视黄酯。项75:项74的方法,其中所述视黄酯为9-顺式-视黄醇乙酸酯。项76:项49-73中任一项的方法,其中所述视黄酯为11-顺式-视黄醇乙酸酯。项77:项49-76中任一项的方法,其中改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%。项78:项49-77中任一项的方法,其中改善视觉功能包括当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母。项79:项49-78中任一项的方法,其中改善视觉功能包括视网膜敏感性相对于基线的临床上显著的提高。项80:项49-79中任一项的方法,其中所述受试者为人类受试者。项81:在患有色素性视网膜炎(rp)的受试者中改善视觉功能的方法,其包括:a.给药第一治疗剂量的9-顺式-视黄醇乙酸酯,其中以约40mg/m2至约60mg/m2/天历时7天向有此需要的受试者给药所述第一治疗剂量;b.提供约7天至约21天的休止期;和c.在所述休止期结束后向有此需要的受试者给药第二治疗剂量的所述9-顺式-视黄醇乙酸酯。项82:项81的方法,其中所述受试者缺乏内源性产生的11-顺式-视黄醛。项83:项81或82的方法,其中所述受试者患有中度至重度色素性视网膜炎(rp)。项84:项81或82的方法,其中所述受试者患有轻度色素性视网膜炎(rp)。项85:项81或82的方法,其中所述受试者患有早发型或青少年型色素性视网膜炎(rp)。项86:项81-85中任一项的方法,其中所述9-顺式-视黄醇乙酸酯代替内源性产生的11-顺式-视黄醛。项87:项81或82的方法,其中所述受试者患有lrat基因突变。项88:项81或82的方法,其中所述受试者患有rpe65基因突变。项89:项81-88中任一项的方法,其中所述方法还包括将步骤b和c重复进行一次或多次。项90:项81-89中任一项的方法,其中所述休止期为约21天。项91:项81-89中任一项的方法,其中所述休止期为约14天。项92:项81-89中任一项的方法,其中所述休止期为约7天。项93:项81-92中任一项的方法,其中所述改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%或当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。项94:项81-93中任一项的方法,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项95:项81-94中任一项的方法,其中口服给药所述治疗剂量。项96:项81-95中任一项的方法,其中所述受试者为人类受试者。项97:在患有内源性维甲酸类缺乏的受试者中改善视觉功能的方法,其包括向有此需要的受试者给药至少第一和第二治疗剂量的9-或11-顺式-视黄酯,其中所述第一治疗剂量以分份剂量历时约2天至约7天来给药,其中所述第一剂量和所述第二剂量之间的休止期为约7天至约28天且其中改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%、当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。项98:项97的方法,其中所述受试者缺乏内源性产生的11-顺式-视黄醛。项99:项97或98的方法,其中所述受试者患有色素性视网膜炎(rp)。项100:项98的方法,其中所述受试者患有中度至重度色素性视网膜炎(rp)。项101:项98的方法,其中所述受试者患有轻度色素性视网膜炎(rp)。项102:项96或97的方法,其中所述受试者患有莱伯先天性黑矇(lca)。项103:项96-102中任一项的方法,其中所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。项104:项96或97的方法,其中所述受试者患有lrat基因突变。项105:项96或97的方法,其中所述受试者患有rpe65基因突变。项106:项96-105中任一项的方法,其中所述第一剂量以分份剂量历时7天来给药。项107:项96-106中任一项的方法,其中所述休止期为约7天至约21天。项108:项107的方法,其中所述休止期为约21天。项109:项107的方法,其中所述休止期为约14天。项110:项107的方法,其中所述休止期为约7天。项111:项96-110中任一项的方法,其中所述第一治疗剂量为约280mg/m2至约420mg/m2。项112:项111的方法,其中所述第一治疗剂量为约280mg/m2。项113:项96-110中任一项的方法,其中所述第一治疗剂量为约10mg/m2/天。项114:项96-110中任一项的方法,其中所述第一治疗剂量为约20mg/m2/天。项115:项96-112中任一项的方法,其中所述第一治疗剂量为约40mg/m2/天。项116:项96-111中任一项的方法,其中所述第一治疗剂量为约60mg/m2/天。项117:项96-116中任一项的方法,其中口服给药所述治疗剂量。项118:项96-117中任一项的方法,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项119:项96-118中任一项的方法,其中所述视黄酯为9-顺式-视黄酯。项120:项119的方法,其中所述9-顺式-视黄酯为9-顺式-视黄醇乙酸酯。项121:项96-118中任一项的方法,其中所述视黄酯为11-顺式-视黄醇乙酸酯。项122:项96-121中任一项的方法,其中所述受试者为人类受试者。项123:用于在患有色素性视网膜炎(rp)的受试者中改善视觉功能的试剂盒,所述试剂盒包含:a.至少第一治疗剂量的9-或11-顺式-视黄酯;和b.使用说明书,其指导所述第一治疗剂量以分份剂量历时约2天至约7天来给药且提供所述第一治疗剂量和第二剂量之间的休止期,其中所述休止期为约7天至约28天。项124:项123的试剂盒,其中所述受试者缺乏内源性产生的11-顺式-视黄醛。项125:项123或124的方法,其中所述受试者患有早发型或青少年型rp。项126:项123或124的试剂盒,其中所述受试者患有中度至重度rp。项127:项123或124的试剂盒,其中所述受试者患有轻度rp。项128:项123-127中任一项的试剂盒,其中所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。项129:项123或124的试剂盒,其中所述受试者患有lrat基因突变。项130:项123或124的试剂盒,其中所述受试者患有rpe65基因突变。项131:项123-130中任一项的试剂盒,其中所述说明书指导所述第一剂量以分份剂量历时7天来给药。项132:项123-131中任一项的试剂盒,其中所述说明书指导所述休止期为约7天至约21天。项133:项132的试剂盒,其中所述说明书指导所述休止期为约21天。项134:项132的试剂盒,其中所述说明书指导所述休止期为约14天。项135:项132的试剂盒,其中所述说明书指导所述休止期为约7天。项136:项123-135中任一项的试剂盒,其中所述第一治疗剂量为约280mg/m2至约420mg/m2。项137:项136的试剂盒,其中所述第一治疗剂量为约280mg/m2。项138:项123-135中任一项的试剂盒,其中所述说明书指导所述第一治疗剂量为约10mg/m2/天。项139:项123-135中任一项的试剂盒,其中所述说明书指导所述第一治疗剂量为约20mg/m2/天。项140:项123-137中任一项的试剂盒,其中所述说明书指导所述第一治疗剂量为约40mg/m2/天。项141:项123-136中任一项的试剂盒,其中所述说明书指导所述第一治疗剂量为约60mg/m2/天。项142:项123-141中任一项的试剂盒,其中口服给药所述治疗剂量。项143:项123-142中任一项的试剂盒,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项144:项123-143中任一项的试剂盒,其中所述视黄酯为9-顺式-视黄醇乙酸酯。项145:项123-143中任一项的试剂盒,其中所述视黄酯为11-顺式-视黄醇乙酸酯。项146:项123-145中任一项的试剂盒,其中改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%。项147:项123-146中任一项的试剂盒,其中改善视觉功能包括当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母。项148:项123-147中任一项的试剂盒,其中改善视觉功能包括视网膜敏感性相对于基线的临床上显著的提高。项149:项123-148中任一项的试剂盒,其中所述受试者为人类受试者。项150:用于在患有色素性视网膜炎(rp)的受试者中改善视觉功能的给药方案,其中所述给药方案至少包括第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括;a.历时约2天至约7天向有此需要的受试者给药第一剂量的9-或11-顺式-视黄酯;b.提供所述第一治疗剂量和所述第二治疗剂量之间的约7天至约28天的休止期;和c.在所述休止期结束后向所述有此需要的受试者给药所述第二治疗剂量的9-或11-顺式-视黄酯。项151:项150的给药方案,其中所述受试者缺乏内源性产生的11-顺式-视黄醛。项152:项150或151的方法,其中所述受试者患有早发型或青少年型色素性视网膜炎(rp)。项153:项150或151的给药方案,其中所述受试者患有中度至重度色素性视网膜炎(rp)。项154:项150或151的给药方案,其中所述受试者患有轻度色素性视网膜炎(rp)。项155:项150-154中任一项的给药方案,其中所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。项156:项150或151的给药方案,其中所述受试者患有lrat基因突变。项157:项150或151的给药方案,其中所述受试者患有rpe65基因突变。项158:项150-157中任一项的给药方案,其中所述方法还包括将步骤b和c重复进行一次或多次。项159:项150-158中任一项的给药方案,其中所述第一剂量以分份剂量历时7天来给药。项160:项150-159中任一项的给药方案,其中所述休止期为约7天至约21天。项161:项160的给药方案,其中所述休止期为约21天。项162:项160的给药方案,其中所述休止期为约14天。项163:项160的给药方案,其中所述休止期为约7天。项164:项150-163中任一项的给药方案,其中所述第一治疗剂量为约280mg/m2至约420mg/m2。项165:项164的给药方案,其中所述第一治疗剂量为约280mg/m2。项166:项150-163中任一项的给药方案,其中所述第一治疗剂量为约10mg/m2/天。项167:项150-163中任一项的给药方案,其中所述第一治疗剂量为约20mg/m2/天。项168:项150-165中任一项的给药方案,其中所述第一治疗剂量为约40mg/m2/天。项169:项150-164中任一项的给药方案,其中所述第一治疗剂量为约60mg/m2/天。项170:项150-169中任一项的给药方案,其中口服给药所述治疗剂量。项171:项150-170中任一项的给药方案,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项172:项150-171中任一项的给药方案,其中所述视黄酯为9-顺式-视黄醇乙酸酯。项173:项150-171中任一项的给药方案,其中所述视黄酯为11-顺式-视黄醇乙酸酯。项174:项150-173中任一项的给药方案,其中所述改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%。项175:项150-174中任一项的给药方案,其中所述改善视觉功能包括当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母。项176:项150-175中任一项的给药方案,其中所述改善视觉功能包括视网膜敏感性相对于基线的临床上显著的提高。项177:项150-176中任一项的给药方案,其中所述受试者为人类受试者。项178:用于在患有色素性视网膜炎(rp)的受试者中改善视觉功能的给药方案,其中所述给药方案至少包括第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括:a.给药所述第一治疗剂量的9-顺式-视黄醇乙酸酯,其中以约40mg/m2/天历时7天向有此需要的受试者给药所述第一治疗剂量;b.提供约7天至约21天的休止期;和c.在所述休止期结束后向所述受试者给药第二治疗剂量的9-顺式-视黄醇乙酸酯。项179:项178的给药方案,其中所述受试者缺乏内源性产生的11-顺式-视黄醛。项180:项178或179的给药方案,其中所述9-顺式-视黄醇乙酸酯代替内源性产生的11-顺式-视黄醛。项181:项178或179的给药方案,其中所述受试者患有lrat基因突变。项182:项178或179的给药方案,其中所述受试者患有rpe65基因突变。项183:项178或179的给药方案,其中所述受试者患有中度至重度rp)184:项178或179的给药方案,其中所述受试者患有轻度rp。项185:项178或179的给药方案,其中所述受试者患有早发型或青少年型rp。项186:项178-185中任一项的给药方案,其中所述方法还包括将步骤b和c重复进行一次或多次。项187:项178-186中任一项的给药方案,其中所述第二治疗剂量历时与所述第一治疗剂量基本相同的时段且以与所述第一治疗剂量基本相同的量来给药。项188:项178-187中任一项的给药方案,其中改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%或当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。项189:项178-188中任一项的给药方案,其中口服给药所述治疗剂量。项190:项178-189中任一项的给药方案,其中所述受试者为人类受试者。以下更详细地描述了本申请这些方面的具体实施方案。附图说明图1提供了维甲酸类循环的示意图。图2按以下形式显示了gvf响应:在rp受试者眼睛的意向治疗(intenttotreat,itt)亚组(2a)和方案治疗(perprotocol)亚组(2b)中在第一给药日后第7、14和30天相对于基线具有改善的眼睛的比例。图3显示了基于vf严重度的gvf响应(itt;包括全部受试者)。图3a显示了gvf改善大于20%的眼睛的比例,其中基线时的起始gvf大于20度(严重度最低)且图3b显示了gvf改善大于20%的眼睛的比例,其中基线时的起始gvf仅是中央的和/或小于20度。图4显示了基于vf严重度的gvf响应(方案治疗分析;排除3名受试者)。图4a显示了gvf改善大于20%的眼睛的比例,其中基线时的起始gvf大于20度(严重度最低)且图4b显示了gvf改善大于20%的眼睛的比例,其中基线时的起始gvf仅是中央的和/或小于20度。图5提供了在对视网膜面积相对于平均基线的变化百分比进行的多水平混合作用模型分析中至第30天的gvf结果,所述平均基线针对全部受试者(itt)和可评价亚组(以所定义的主要准入/排除标准为基础由于他们的gvf测定值而排除3名受试者)来计算。图6按以下形式显示了gvf响应(itt):在两只眼睛中具有响应或在一只或多只眼睛中具有响应的gvf响应者的百分比或具有响应的眼睛的比例,其中响应者被定义为以下患者/眼睛,其中视网膜面积相对于平均基线值在1个月内的2次相连随访时增加至少20%。图7按以下形式显示了va结果:va相对于基线的平均变化(etdrs字母得分),其中全部受试者和可评价受试者(排除基线va为0个字母的眼睛)在第7天、第14天或第1个月显示出改善。图8按以下形式显示了va响应:在itt亚组(8a)和可评价亚组(8b)中眼睛相对于基线的改善程度大于或等于5个字母的va响应者的比例。图9按以下形式显示了va响应(itt):在两只眼睛中具有响应或在一只或多只眼睛中具有响应的va响应者的百分比或具有响应的眼睛的比例,其中响应者被定义为在1个月内的2次相连探访时相对于基线具有大于或等于5个etdrs字母的改善或若基线为0,则响应者被定义为在1个月内的2次相连探访时好于基线的任何情况。图10总结了在给药后第9天至第8个月视敏度(va)相对于基线的最佳变化(etdrs字母得分),其中已经基于基线va分类对数据进行了分类。图11显示了图6中的11名受试者在用40mg/m2(40mg)或10mg/m2(10mg)组合物进行治疗后的etdrs/logmar/斯内伦(snellen)等价视敏度(va)。数据所表示的是两只眼睛的平均字母得分,其中不包括受试者4和11,所述受试者4和11仅就一只眼睛而表现出可测量的字母得分。图12提供了对受试者1-9的戈德曼视野(gvf)进行的ama低视力网格分析(amalowvisiongridanalysis),其中对在第14天前和在第14天用小的i4e目标物(od)观察到的gvf进行分析。图13提供了对受试者1-9的戈德曼视野(gvf)进行的ama低视力网格分析,其中对在第14天前和在第14天用较大的v4e目标物(od)观察到的gvf进行分析。图14显示了实施例4所定义的rp受试者的va相对于基线在etdrs字母数目(按四分位数计)方面的变化。具体实施方式本申请提供用于在患有内源性维甲酸类缺乏例如由于对视觉周期中所使用的酶和蛋白质进行编码的基因发生突变而引起的那些内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的方法、给药方案和试剂盒。改善视觉功能的所述给药方案、试剂盒和后续方法可用于提供有效性,同时保持临床相关安全性分布。本申请所公开的给药方案包括:a)第一治疗剂量的合成性视黄醛衍生物例如9-或11-顺式-视黄酯,其代替内源性产生缺乏的11-顺式-视黄醛,其中所述第一治疗剂量历时所定义的时段例如约1-7天来给药;b)所述第一治疗剂量后的小于1个月例如7-28天的休止期;和c)一个或多个第二或后续治疗剂量的所述合成性视黄醛衍生物例如9-或11-顺式-视黄酯。该给药方案可在患有内源性11-顺式-视黄醛缺乏的受试者例如患有rp的受试者中提供视觉功能的临床有效改善,而不会向所述患者提供比所需时段长的所述合成性视黄醛衍生物。在一些实施方案中,该给药方案避免了与合成性视黄醛衍生物相关的已知类型的作用安全性问题(例如慢性维甲酸类毒性)。在一个方面,本申请涉及在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的方法,其包括:a)向有此需要的受试者给药第一治疗剂量的合成性维甲酸类衍生物例如9-或11-顺式-视黄酯;b)提供小于1个月例如7-28天的休止期;和c)在所述休止期结束后向所述受试者给药第二治疗剂量的所述合成性维甲酸类衍生物例如9-或11-顺式-视黄酯。所述第一剂量通常可按单一剂量历时1天或按分份剂量历时约2至约10天来口服给药。本申请分份剂量是指在给药期内以天数对总治疗剂量进行分份,其中每天给药剂量可基本相同或所述分份剂量可以是不同的。在一个实施方案中,所述治疗剂量历时约2天至约7天来给药。在另一个实施方案中,所述治疗剂量历时约2天、约3天、约4天、约5天、约6天或约7天来给药。在一个实施方案中,所述治疗剂量以分份剂量历时约7天(或1周)来给药。休止期开始于最后一次给药治疗剂量后第1天且所持续的时段小于1个月例如7-28天。本申请提供了就其中休止期小于30天的重复给药所得到的临床相关安全性分布(参见实施例5)。该安全性分布及在一些受试者中例如在一些rp受试者中在给药所述第一治疗剂量后约第7天至约第30天视觉功能的衰退表明小于1个月的休止期是合乎需要的(参见实施例2和图2-9)。在一个方面,给药第一治疗剂量后对一些受试者进行的视觉功能测试可基于对视觉功能参数进行回归或基于视觉功能参数有无响应而鉴定接受早期重复治疗的候选者。在一个方面,所述休止期为约2天至约21天、约7天至约21天或约14天至约21天。在一个方面,所述休止期为约7天至约28天例如约7天至约25天或约7天至约23天。在一些实施方案中,所述休止期为约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天或约28天。在另一个实施方案中,所述休止期为约7天(或约1周)或约14天(或约2周)或约21天(或约3周)。作为该给药方案中的一部分,在所述休止期内不向所述受试者给药治疗剂量的合成性维甲酸类衍生物。在所述休止期结束后的任何时间给药所述第二剂量或后续剂量。在一个方面,所述第二剂量或后续剂量与所述第一治疗剂量就所述合成性视黄醛衍生物例如9-或11-顺式-视黄酯的总给药量(mg/m2)或给药期的持续时间而言是相同的。在另一个方面,所述第二或后续剂量与所述第一治疗剂量就所述合成性视黄醛衍生物例如9-或11-顺式-视黄酯的总给药量(mg/m2)或给药期的持续时间而言是不同的。休止期和合成性视黄醛衍生物例如9-或11-顺式-视黄酯的第二给药可根据需要而重复进行以保持第一给药期内所实现的受试者视觉功能改善。应该理解的是,内源性维甲酸类缺乏例如rp和lca为至少由于引起内源性11-顺式-视黄醛功能丧失的基因突变所导致的慢性病症且除第一剂量外的额外给药、休止期和第二剂量是在受试者中保持视觉功能改善所需要的。治疗剂量(量和持续时间)与小于1个月例如7-28天的休止期的组合为与内源性维甲酸类相关的病症提供了视觉功能的临床相关改善,其具有临床相关安全性和有效性分布。治疗剂量(第一、第二或后续)的量可被指定为针对特定剂量的总给药量或在针对特定剂量的时段内的给药量(例如第一剂量或第二剂量)。例如,所述第一治疗剂量可被指定为280mg/m2的剂量或在7天内每天40mg/m2的给药量。因此,在一个方面,所述治疗剂量为约280mg/m2至约420mg/m2。在另一个方面,所述治疗剂量为在7天内每天约40mg/m2至约60mg/m2的给药量。在一些实施方案中,所述治疗剂量为约30-35mg/m2/天、约30-40mg/m2/天、约40-45mg/m2/天、约40-50mg/m2/天、约45-50mg/m2/天、约45-55mg/m2/天、约50-60mg/m2/天或约55-60mg/m2/天。在一些实施方案中,所述治疗剂量为约40mg/m2/天、约45mg/m2/天、约50mg/m2/天、约55mg/m2/天或约60mg/m2/天。在一些实施方案中,所述治疗剂量为约5-10mg/m2/天、约10-20mg/m2/天、约20-25mg/m2/天、约20-30mg/m2/天或约25-30mg/m2/天。在一个方面,给药于患有内源性维甲酸类缺乏例如rp或lca的受试者的合成性视黄醛衍生物例如9-或11-顺式-视黄酯为9-顺式-视黄醇乙酸酯(用于实施例1的组合物)或11-顺式-视黄醇乙酸酯。在一个实施方案中,本申请涉及在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的方法,其中所述方法包括:a)给药第一治疗剂量的9-顺式-视黄醇乙酸酯,其中以约40mg/m2/天历时7天向有此需要的受试者给药所述第一治疗剂量;b)提供约7天至约21天的休止期;和c)在所述休止期结束后向所述有此需要的受试者给药第二治疗剂量的9-顺式-视黄醇乙酸酯。在另一个实施方案中,本申请涉及在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的方法,其中所述方法包括:a)给药第一治疗剂量的9-顺式-视黄醇乙酸酯,其中以约10或约20或约40mg/m2/天历时5天向有此需要的受试者给药所述第一治疗剂量;b)提供约21天至约25天的休止期;和c)在所述休止期结束后向所述有此需要的受试者给药第二治疗剂量的9-顺式-视黄醇乙酸酯。患有内源性维甲酸类缺乏例如rp或lca且接受合成性维甲酸类衍生物例如9-或11-顺式-视黄酯的受试者可基于对视敏度和视野进行测量而被归类为具有轻度、中度或重度视力缺损。基于世界卫生组织(who)、icd-9-cm和医疗保险福利标准,正常的视觉被定义为受试者具有小于20/25的视敏度和正常的视野,所述正常的视野就每只眼睛而言在鼻侧扩展约60度(朝向鼻子或向内)、在颞侧扩展约100度(远离鼻子或向外)及在水平子午线以上约60度和在水平子午线以下约75度。轻度视觉丧失被定义为受试者具有20/30-20/65的视敏度。中度视觉丧失被定义为受试者具有20/70-20/190的视敏度和大于20度的视野。重度视觉丧失被定义为受试者具有20/200-20/490的视敏度和等于或小于20度的视野。极度视觉丧失被定义为受试者具有20/500-20/1000的视敏度和等于或小于10度的视野。接近失明被定义为受试者具有20/1100-20/2000的视敏度和等于或小于5度的视野。完全失明被定义为受试者不具有光感。在一个方面,所述受试者患有rp且已经被归类为患有中度至重度rp。在另一个方面,所述rp受试者被归类为患有轻度rp。在另一个方面,所述rp受试者被归类为患有轻度至中度rp。在一个方面,受试者视觉功能的改善被测量为相对于基线的函数。基线可针对每名受试者来确定或其可针对一组受试者来确定。在另一个方面,基线可不针对各个受试者来确定,但是来自一组类似受试者的基线可应用于各个受试者。在一个实施方案中,在给药第一治疗有效剂量的合成性视黄醛衍生物例如9-顺式-视黄酯或11-顺式-视黄酯或其药用组合物前通过对受试者的视野、视敏度、进行日常活动的能力、视网膜敏感性、动态瞳孔响应、眼球震颤、皮质视觉功能、颜色视觉或暗适应中的一项或多项进行评价来确定受试者视觉功能的基线。在另一个实施方案中,受试者视觉功能的基线通过对受试者的视野进行评价来确定。在另一个实施方案中,受试者视觉功能的基线通过对受试者的视敏度进行评价来确定。在另一个实施方案中,所述基线通过对受试者的视网膜敏感性进行评价来确定。在另一个实施方案中,所述基线通过对受试者的视野、视敏度和视网膜敏感性进行评价来确定。在另一个实施方案中,确定受试者视觉功能的基线包括确定受试者的视野、受试者的视敏度、受试者的视网膜敏感性、受试者的动态瞳孔响应、受试者的眼球震颤、受试者的皮质视觉功能、受试者进行日常活动的能力、受试者的颜色视觉和受试者的暗适应中一项或多项的基线。优选地,确定受试者视觉功能的基线包括通过已有的测试来确定受试者的视野基线、受试者的视敏度基线、受试者进行日常活动的能力基线和受试者的视网膜敏感性基线。在一个实施方案中,受试者的视觉功能在给药期内与在向受试者给药第一治疗有效量的合成性视黄醛衍生物例如9-顺式-视黄酯或11-顺式-视黄酯前所确定的受试者视觉功能基线相比发生快速改善。出于本申请目的,“快速改善”是指受试者的视觉功能在比第一给药期短的时段内与受试者视觉功能的基线相比发生临床上有意义的改善。优选地,在一个实施方案中,受试者的视觉功能在给药期开始1周内发生显著改善。在另一个实施方案中,受试者的视觉功能在给药期内与基线相比发生改善且在第一给药期结束且进入休止期后仍然保持在基线以上。在另一个实施方案中,受试者的视觉功能在第一给药期内的改善包括受试者的视野与视野基线相比发生扩展、受试者的视敏度与视敏度基线相比发生改善和/或受试者的视网膜敏感性与基线视网膜敏感性相比发生改善。在一个实施方案中,受试者视觉功能的改善包括受试者一只或多只眼睛的视野与基线相比发生扩展。在一些实施方案中,受试者的视觉功能在第一给药期内的改善包括当通过戈德曼视野(gvf)分析来测量时使受试者一只或多只眼睛的视野相对于基线增加至少30%、25%、20%或15%。在一些实施方案中,受试者视觉功能的改善包括当通过戈德曼视野分析来测量时使受试者眼睛的视野相对于基线增加至少20%。在另一个实施方案中,受试者一只或多只眼睛的视觉功能改善包括受试者的视敏度与基线相比发生改善。在一些实施方案中,受试者视觉功能的改善包括当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使受试者一只或多只眼睛的视敏度得以提高的程度相对于基线大于或等于5个字母。在另一个实施方案中,受试者一只或多只眼睛的视觉功能在第一给药期内的改善包括受试者一只或多只眼睛的视网膜敏感性与基线相比发生改善。在另一个实施方案中,受试者的视觉功能在休止期内的改善包括受试者一只或多只眼睛的视网膜敏感性与受试者在第一给药期内的视网膜敏感性相比发生改善。在另一个实施方案中,受试者视觉功能的改善包括rp受试者一只或多只眼睛的暗适应视野检查相对于基线发生改善。在一个方面,本申请涉及在患有rp或lca的受试者中改善视觉功能的方法,其包括向有此需要的受试者给药至少第一和第二治疗剂量的合成性视黄醛衍生物例如9-或11-顺式-视黄酯,其中所述第一剂量和所述第二剂量之间的休止期小于1个月例如7-28天且其中改善视觉功能包括当通过戈德曼视野(gvf)分析来测量时使眼睛的视野相对于基线增加至少20%、当使用早期治疗糖尿病性视网膜病研究(etdrs)视力表来测量时使眼睛视敏度的提高程度相对于基线大于或等于5个字母或实现上述两者。在一些实施方案中,所述休止期为约2天至约25天、约7天至约21天或约14天至约21天。在一些实施方案中,所述休止期为约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天或约28天。在一些实施方案中,本申请方法提供了给药方案,其将临床相关安全性分布与多个治疗性给药期和休止期关联起来。在一些实施方案中,在多达6个月、多达5个月、多达4个月或多达3个月内给药多达6个、多达5个、多达4个或多达3个治疗剂量。在一些实施方案中,在多达12个月、多达11个月、多达10个月、多达9个月、多达8个月、多达7个月、多达6个月、多达5个月、多达4个月或多达3个月内向受试者给药多达12个、多达11个、多达10个、多达9个、多达8个、多达7个、多达6个、多达5个、多达4个或多达3个治疗剂量。在另一个实施方案中,在约3个月内给药多达3个治疗剂量。在另一个实施方案中,在约6个月内给药多达6个治疗剂量。在上述一些情况下,每月给药不多于1个治疗剂量。在另一个实施方案中,所述第一剂量和所述第二剂量之间的休止期小于1个月例如7-28天且其中受试者眼睛的视野当通过戈德曼视野(gvf)分析来测量时保持在基线以上至少20%且其中受试者的甘油三酯水平和/或hdl水平、胆固醇水平及ldl水平尚未超过比基线多50%。在其它实施方案中,所述第一剂量和所述第二剂量之间的休止期小于1个月例如7-28天且受试者的甘油三酯水平和/或hdl水平、胆固醇水平及ldl水平尚未超过比基线多40%或30%或20%或10%。在其它实施方案中,所述休止期为以下时段,受试者的甘油三酯水平和/或hdl水平、胆固醇水平及ldl水平在所述时段后且在给药后续治疗剂量前已经返回到临床上安全和可接受的水平。在一个实施方案中,受试者的视觉丧失是由于lrat或rpe65基因突变。在一个优选的实施方案中,所述受试者具有一种或多种lrat基因突变。在另一个优选的实施方案中,所述受试者具有一种或多种rpe65基因突变。在另一个优选的实施方案中,所述受试者具有一种或多种无效或错义lrat突变。在另一个实施方案中,所述受试者具有一种或多种无效或错义rpe65突变。在一个实施方案中,所述受试者患有常染色体隐性色素性视网膜炎(arrp)。在另一个实施方案中,所述受试者患有常染色体显性色素性视网膜炎(adrp)。在另一个实施方案中,所述受试者患有中度至重度rp。在另一个实施方案中,所述受试者患有早发型rp。在另一个实施方案中,所述受试者患有青少年型rp。在另一个实施方案中,所述rp受试者为成人。在另一个实施方案中,所述rp受试者为儿科rp受试者例如婴儿、儿童或青少年。在一个实施方案中,向患有内源性维甲酸类缺乏例如rp或lca的受试者口服给药所述第一和任何后续治疗有效量。在一个实施方案中,本申请涉及用于在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的给药方案,其中所述给药方案包括至少第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括:a)历时约1天至约7天例如2-7天向有此需要的受试者给药第一剂量的9-或11-顺式-视黄酯;b)提供所述第一治疗剂量和所述第二治疗剂量之间的小于1个月例如7-28天的休止期;和c)在所述休止期结束后向所述有此需要的受试者给药所述第二治疗剂量的9-或11-顺式-视黄酯。在一个实施方案中,所述9-或11-顺式-视黄酯代替内源性产生的11-顺式-视黄醛。在另一个实施方案中,向所述受试者口服给药所述9-或11-顺式-视黄酯。在另一个实施方案中,所述给药方案还包括根据需要将步骤b)和c)重复进行一次或多次。在另一个实施方案中,所述给药方案还包括在3个月时段内将步骤b)和c)重复进行多达3次。在另一个实施方案中,所述给药方案还包括在6个月时段内将步骤b)和c)重复进行多达6次。在另一个实施方案中,所述给药方案还包括在12个月时段内将步骤b)和c)重复进行多达12次。在上述一些情况下,每月给药不多于1个治疗剂量。在另一个实施方案中,本申请提供用于在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的给药方案,其中所述给药方案包括至少第一治疗剂量、第二治疗剂量及所述第一治疗剂量和所述第二治疗剂量之间的休止期,所述方案包括:a)给药所述第一治疗剂量的9-顺式-视黄醇乙酸酯,其中以约40mg/m2/天历时7天向有此需要的受试者给药所述第一治疗剂量;b)提供约7天至约21天的休止期;和c)在所述休止期结束后向所述受试者给药第二治疗剂量的9-顺式-视黄醇乙酸酯。在另一个方面,本申请提供用于在患有内源性维甲酸类缺乏例如rp或lca的受试者中改善视觉功能的试剂盒,其中所述试剂盒至少包含:a)第一治疗剂量的合成性视黄醛衍生物例如9-或11-顺式-视黄酯;和b)使用说明书,其提供所述第一治疗剂量和第二剂量之间的休止期,其中所述休止期小于1个月例如7-28天。在一个实施方案中,所述说明书指导所述第一剂量历时约1-7天例如约2-7天来给药。在一个方面,所述说明书指导所述第一剂量历时7天来给药。在一个方面,所述说明书指导所述第一剂量历时5天来给药。在另一个实施方案中,所述说明书指导所述休止期为约2天至约21天或约7天至约21天或约7天至约25天。在另一个实施方案中,所述说明书指导所述休止期为约25天或约23天或约21天或约14天或约7天。在另一个实施方案中,所述说明书还指导在3个月时段内给药多达3个剂量。在另一个实施方案中,所述说明书还指导在6个月时段内给药多达6个剂量。在另一个实施方案中,所述说明书还指导在12个月时段内给药多达12个剂量。在上述一些情况下,每月给药不多于1个治疗剂量。在一个实施方案中,所述试剂盒中提供的治疗剂量为约280mg/m2至约420mg/m2。在一个方面,所述说明书指导所述治疗剂量以约40mg/m2/天至约60mg/m2/天来给药。在另一个方面,所述治疗剂量包含9-或11-顺式-视黄醇乙酸酯。合成性视黄醛衍生物例如9-或11-顺式-视黄酯可通过任何药物媒介物来递送,其中合成性视黄醛衍生物例如9-或11-顺式-视黄酯被稳定地递送至患有内源性维甲酸类缺乏例如rp或lca的受试者且在给药后被有效地释放。药物媒介物与维甲酸类的化学性质和药物媒介物针对维甲酸类的配制是密切相关的。这些已知的递送媒介物包括其物理性质、化学性质和释放速率适于递送合成性视黄醛衍生物的那些递送媒介物。可使用液体递送媒介物例如植物油(包括大豆油、橄榄油、菜籽油或芸苔油)。在一个实施方案中,所述合成性视黄醛衍生物为11-顺式-视黄酯且选自11-顺式-视黄醇乙酸酯、11-顺式-视黄醇琥珀酸酯、11-顺式-视黄醇枸橼酸酯、11-顺式-视黄醇酮戊二酸酯、11-顺式-视黄醇富马酸酯、11-顺式-视黄醇苹果酸酯或11-顺式-视黄醇草酰乙酸酯。优选地,所述合成性视黄醛衍生物为11-顺式-视黄醇乙酸酯。在另一个实施方案中,所述9-顺式-视黄酯选自9-顺式-视黄醇乙酸酯或9-顺式-视黄醇琥珀酸酯。在一个实施方案中,所述9-顺式-视黄酯为9-顺式-视黄醇乙酸酯。在其它实施方案中,所述合成性视黄醛衍生物为9-顺式-视黄醛、11-顺式-视黄醛、9-顺式-视黄醇或11-顺式-视黄醇。在一些实施方案中,所述药用组合物还包含液体媒介物。在一些实施方案中,所述药用组合物包含所述合成性视黄醛衍生物例如9-顺式-视黄酯和大豆油。在该方面的另一个实施方案中,所述药用组合物包含9-顺式-视黄醇乙酸酯和大豆油。在该方面的另一个实施方案中,所述药用组合物包含9-顺式-视黄醇乙酸酯和大豆油(usp级)。在一些实施方案中,所述药用组合物还包含抗氧化剂。在该方面的另一个实施方案中,所述药用组合物包含9-顺式-视黄醇乙酸酯、大豆油和丁羟茴醚(bha)。在该方面的另一个实施方案中,所述药用组合物包含9-顺式-视黄醇乙酸酯、大豆油(usp级)和丁羟茴醚(bha)。除非在说明书中另有定义,以下术语和短语应该具有以下意义:本申请使用的“视觉障碍”广泛地是指眼睛中的光感受器、组织或结构中的障碍。视觉障碍包括但不限于视网膜变性、视网膜营养不良、光感受器功能丧失、感光细胞死亡和结构异常。本申请视觉障碍通常以受试者中受损或低于正常(包括完全丧失)的视觉功能为特征,其包括例如弱的视敏度、低或缺乏的视网膜敏感性、窄或检测不到的视野等。“治疗有效量”是指化合物的以下量,所述量当给药于患有内源性维甲酸类缺乏的受试者(优选人类)时足以引起临床上有意义的治疗作用。本申请使用的术语“治疗作用”是指受试者的视觉功能在所述受试者的一只或两只眼睛中的改善,其中受试者的视觉功能在本申请治疗方案期间在一只或两只眼睛中的改善可如下证实:对受试者一只或两只眼睛的视觉功能与受试者一只或两只眼睛的视觉功能在给药本申请治疗方案前的基线测量值进行比较或对受试者一只或两只眼睛的视觉功能与没有接受所述治疗方案的对照人类视觉系统进行比较。患有维甲酸类缺乏的rp受试者中的视觉丧失通常是严重的,但是其存在程度和形式在rp受试者之间可以是变化的。受试者可丧失其周边视觉,他们可丧失其在低度至中度光线下的视敏度,他们的整体视敏度可发生衰退或可发生其它视觉丧失。该丧失可以是进行性的(尤其是在维甲酸类缺乏的成人发病型病例中),其最后导致极低视觉或完全失明。丧失的类型和程度可基本与维甲酸类缺乏的程度、受到影响的细胞类型(例如视杆细胞或视锥细胞)和/或维甲酸类缺乏在视网膜中的定位是关联的。当视网膜周边受到缺乏的最强烈影响时,可最早和最显著地观察到周边视觉丧失。当整个视网膜受到缺乏的较全面影响时,通常观察到视敏度的整体丧失。当严重或长期缺乏时,视觉丧失(无论呈什么形式)可以是较严重和较难于成功改善的。因为由于维甲酸类缺乏障碍而引起的视觉丧失的性质和程度在受试者之间是变化的,所以有意义的视觉改善的性质和程度在受试者之间也将是变化的。例如,对于一些受试者例如一些rp患者,中度光线下的视敏度恢复可以是有意义的改善。对于其他受试者例如一些rp患者,有意义的改善将为周边视觉的提高或视敏度的全面改善。在一些实施方案中,视觉的进行性丧失可被本申请所阻止或逆转。然而,在较早做出诊断且采取治疗措施的情况下,本申请给药方案的实施仅可限制或减缓视觉丧失的进展。可通过本申请所述几种已知临床测量中的任何一种(包括视敏度、视野、光敏度、进行日常活动的能力或其中一些或全部的组合)来记录临床上有意义的改善。这些和其它测量都是临床医生所公知的且常规用于临床实践。临床医生能够容易地鉴定和观察这些变化,其作为对患有与内源性维甲酸类缺乏相关的视觉障碍的受试者(包括rp和lca受试者)进行常规临床评价中的一部分。因此,临床医生还能够容易地就所给定的受试者而鉴定和观察有意义的视觉改善。与内源性维甲酸类缺乏相关的视觉障碍本申请治疗方案和方法用于在患有由于内源性维甲酸类缺乏而引起的视觉功能丧失的受试者中改善视觉功能。在一些实施方案中,所述视觉障碍为对11-顺式-视黄醛的产生、转化和/或再生具有中断或干扰作用的基因突变所导致的遗传性视网膜疾病(ird),其引起视力缺损或失明。上述缺乏的特征在于一种或多种内源性维甲酸类例如11-顺式-视黄醛的水平是缺失、不足或消耗殆尽的。因此,“内源性维甲酸类缺乏”是指内源性维甲酸类的水平与就相同物种的受试者的健康眼睛而观察到的水平相比是长期较低的。在一些情况下,受试者的健康眼睛可经历11-顺式-视黄醛的暂时不足,其引起短期失明,然后视觉恢复,而在患有内源性维甲酸类缺乏的受试者中,所述受试者缺乏使11-顺式-视黄醛的内源性水平得以可靠或快速再生的能力,这引起11-顺式-视黄醛的长期和/或显著缺乏。在一个实施方案中,本申请治疗方案和方法用于在患有遗传性视网膜障碍例如rp、lca及其亚型的受试者中改善视觉功能。在其它实施方案中,所述受试者患有白点状视网膜炎或先天性静止性夜盲症(csnb)或白点状眼底或其亚型。内源性维甲酸类缺乏可由于视觉周期中的一种或多种缺陷而引起,所述缺陷包括酶的缺乏及光感受器和视网膜色素上皮细胞(rpe)之间受损的转运过程。图1示意性地显示了脊椎动物优选人类的视觉周期(或维甲酸类循环),其在rpe和光感受器的外节之间运转。11-顺式-视黄醛通过一系列酶促反应和进出rpe的转运过程来再生,然后其在光感受器中与视蛋白结合以形成视紫红质。然后视紫红质被光所激活以形成间视紫红质,其激活光转导级联,而所结合的顺式-维甲酸类异构化成全反式-视黄醛(vonlintig,j.etal.,trendsbiochemscifeb24(2010))。已经鉴定了多于12种对以下视网膜蛋白质进行编码的基因所发生的突变,所述视网膜蛋白质参与视觉周期中的几条生化路径。例如,对卵磷脂:维甲酸类乙酰基转移酶进行编码的基因(lrat基因)和对视网膜色素上皮细胞蛋白质65kda进行编码的基因(rpe65基因)所发生的突变中断了维甲酸类的循环,这在全反式-视黄醛的再循环中导致11-顺式-视黄醛的缺乏、游离视蛋白的过量、维甲酸类废弃(例如降解)产物和/或中间体的过量等。内源性维甲酸类在受试者眼睛例如rp或lca受试者眼睛中的水平和上述水平的不足可根据例如在美国专利申请公开文本2005/0159662中公开的方法来确定(将其所公开的全部内容引入到本申请中作为参考)。确定内源性维甲酸类在脊椎动物眼睛中的水平和上述维甲酸类的缺乏的其它方法包括例如通过高压液相色谱(hplc)对来自受试者的血液样品中的维甲酸类进行分析。例如,血液样品可得自受试者且样品中维甲酸类的类型和水平可通过正相高压液相色谱(hplc)(例如使用hp1100hplc、beckmanultrasphere-si4.6mm×250mm柱和10%乙酸乙酯/90%己烷且流速为1.4ml/分钟)来分离和分析。维甲酸类可如下检测:例如在325nm使用二极管阵列检测器和hpchemstationa.03.03软件来进行检测。维甲酸类的缺乏可例如如下确定:对维甲酸类在样品中的分布与来自对照受试者(例如正常受试者)的样品进行比较。多种病症可使受试者易患或出现内源性维甲酸类缺乏。例如,患有rpe65基因突变或lrat基因突变的受试者在遗传上易患内源性维甲酸类缺乏和视力缺损,其最后导致完全视觉丧失和重度视网膜营养不良。具体地,在rp和lca受试者中发现了rpe65和lrat基因突变。rp可由于多种不同基因的缺陷而引起,其中迄今在多于100种不同的基因中检测到多于200种的病因性rp突变。rp基因型是混杂的且患有相同突变的rp受试者可显示出不同的表现型。rp可通过常染色体显性、常染色体隐性或x相关特性来遗传。近些年来已经在患有arrp或adrp的rp受试者中发现了lrat和rpe65基因的突变。这些具体的突变与视觉周期中维甲酸类代谢的缺陷相关且可引起光感受器变性。在本申请中明显的是,rpe65基因所编码的蛋白质与视黄醇结合蛋白和11-顺式-视黄醇脱氢酶是生化相关的且是产生11-顺式-视黄醛所必需的(gollapalli,d.r.etal.,biochemistry.42(19):5809-5818(2003)和redmond,t.m.etal.,natgenet.20(4):344-351(1998))。临床前和临床信息表明rpe65蛋白功能的丧失阻断了在将维生素a酯化成膜脂质后的维甲酸类加工且导致视觉的丧失。rpe65突变主要与早发型重度视网膜营养不良相关,其中在生命的最初几年内出现视杆细胞-视锥细胞变性、眼球震颤和重度视觉丧失。rpe65突变所引起的疾病的严重度似乎在很大程度上与存在于rp受试者中的突变类型不相关。许多rpe65受试者都具有以在生命早期具有很差但能用的视觉功能(可测量的视锥细胞erg)为特征的共同表现型,所述视觉功能在学龄阶段显著衰退。另外,许多这样的患者在30岁时尽管大幅受损,但是仍然保留了残余的孤立的周边视觉。进行性视野(vf)丧失为rp的标志之一且通常用作监测疾病进展的手段。已经观察到大多数rp受试者在40岁前由于视杆细胞功能的丧失超过视锥细胞敏感性的降低而导致严重受限的视野且因此成为法律意义上的盲人。尽管据报道患有早发型rp的rp受试者与其它类型的rp相比具有较稳定的va,但是视敏度(va)缺损在rp过程中也可能是明显的且va缺损的水平在rp受试者之间可能有很大的变化。例如,已经报道在一些患有晚期rp且具有小的残余的孤立的中央vf的rp患者中,va可保持正常。在其他rp患者中,va的降低可能是较显著的。受试者群体尽管患有与内源性维甲酸类缺乏相关的视觉障碍的受试者(如本申请所定义)可通过本申请治疗方案和方法来治疗,但是在一些实施方案中可存在生理学机会窗,其中所述治疗方案或方法在受试者中就减缓衰退速率或改善视觉功能而言是最有效的。在一个实施方案中,就本申请治疗方案而言在受试者中最有效的机会窗被定义为视觉功能丧失和视网膜变性之间的间隔,尤其是对于感光细胞变性。一些年龄组中的受试者可尤其受益于本申请治疗方案。更具体地,视网膜/光感受器变性程度较小的受试者易于对本申请治疗方案具有较好或较快的应答和/或可在需要后续给药期前具有较长的休止期。例如,在一些实施方案中,由于内源性视黄醛缺乏而患有视觉功能丧失例如lca或rp的较年轻受试者可保留较高百分比的休眠光感受器。上述休眠的光感受器能够响应于本申请治疗方案。具体地,当在患有遗传性儿童期失明例如lca或早发型rp例如arrp的受试者中改善视觉功能时,较年轻的受试者可预期视觉功能的较大恢复,这是因为他们的视网膜变性是较不晚期的。因此,在本申请一个实施方案中,所述受试者为人类青少年即当开始所述治疗方案时小于15岁。在本申请其它实施方案中,所述受试者为人类新生儿或人类婴儿,所述人类婴儿当开始所述治疗方案时小于1岁、小于18个月、小于24个月或小于36个月。在其它实施方案中,所述受试者为以下人类,其当开始所述治疗方案时为5岁或更大。在其它实施方案中,所述人类受试者当开始所述治疗方案时为10岁或更大。在一些情况下,rp可在10-20岁或甚至更大的人类受试者中出现。arrp在人类中的平均诊断年龄为约36岁(tsujikawam.etal.,archophthalmol126(3)337-340(2008))。因此,在其它实施方案中,所述人类rp受试者当开始所述治疗方案时为15岁或更大。在更具体的实施方案中,所述人类rp受试者当开始本申请所述方案、方法和组合物给药时为20岁或更大、30岁或更大、40岁或更大、50岁或更大、60岁或更大或70岁或更大。在其它实施方案中,所述人类rp受试者当开始本申请所述方案、方法和组合物给药时为约20岁或更小或约30岁或更小或约40岁或更小或约50岁或更小。在一个实施方案中,对于任何这些受试者,本申请治疗方案和方法应该在本申请所定义的视觉障碍被确诊后尽快开始,从而使视网膜尤其是光感受器的任何变性尚未达到以下点,其中本申请治疗方案在受试者中不能有效地改善视觉功能。合成性视黄醛衍生物本申请提供在受试者中改善视觉功能的方法。可给药合成性视黄醛衍生物以改善视觉功能和/或缓解维甲酸类水平缺乏所带来的影响。视觉功能可例如通过提供可作为11-顺式-维甲酸类代替物和/或视蛋白激动剂的合成性维甲酸类来改善。合成性维甲酸类还可缓解维甲酸类缺乏对受试者视觉系统的影响。可向受试者预防性或治疗性给药合成性维甲酸类(例如预防性给药于被诊断患有内源性维甲酸类缺乏的受试者以与没有接受合成性维甲酸类的对照受试者相比预防、减缓或延迟受试者视觉功能的恶化或进一步恶化)。合成性视黄醛衍生物为衍生自11-顺式-视黄醛或9-顺式-视黄醛的维甲酸类。在一些实施方案中,所述合成性视黄醛衍生物为合成性9-或11-顺式维甲酸类。在其它实施方案中,所述合成性维甲酸类为11-顺式-视黄醛或9-顺式-视黄醛的衍生物。在一些实施方案中,合成性视黄醛衍生物可以是例如对内源性维甲酸类的水平进行补充的维甲酸类代替物。在其它实施方案中,所述合成性视黄醛衍生物为9-或11-顺式视黄酯。在其它实施方案中,所述合成性视黄醛衍生物为9-顺式-视黄醇或11-顺式-视黄醇。在其它实施方案中,所述合成性视黄醛衍生物为9-顺式-视黄醛或11-顺式-视黄醛。抛开任何特定理论的束缚,在本申请一些实施方案中,用于本申请治疗方案的合成性视黄醛衍生物代替内源性产生的11-顺式-视黄醛,因此使视觉周期中关键的生化组分得以恢复。适于本申请治疗方案的合成性视黄醛衍生物可以是9-顺式-视黄醛或11-顺式-视黄醛的衍生物。与11-顺式-视黄醛类似的是,9-顺式-视黄醛可与视蛋白结合以形成具有光活性的异视紫红质,其当漂白时经由与11-顺式-视黄醛再生视紫红质相同的光产物而发生构象变化(yoshizawa,t.etal.,nature214,566-571(1967)和filipeks.etal.,annurevphysiol65:851-79(2003))。9-顺式-视黄醛及其衍生物与其11-顺式-视黄醛类似物相比通常是热力学上较稳定的。合成性视黄醛衍生物可直接或间接转化成视黄醛或合成性视黄醛类似物。因此,在一些方面,可将本申请化合物描述为前药,其在代谢转化后转化成9-顺式-视黄醛、11-顺式-视黄醛或其合成性视黄醛衍生物。代谢转化可例如通过酸解、酯酶活性、乙酰基转移酶活性、脱氢酶活性等而发生。例如,抛开理论的束缚,据信合成性9-顺式-视黄醛衍生物(例如9-顺式-视黄酯例如9-顺式-视黄醇乙酸酯)在消化道中转化成9-顺式-视黄醇,通过血流而转运至视网膜且在rpe中转化成9-顺式-视黄醛。在一个实施方案中,适于本申请方法的9-和11-顺式-视黄酯可以是在国际专利申请公开文本wo2006/002097和所公开的美国申请2010/0035986中描述的9-顺式-视黄酯或11-顺式-视黄酯,将所述申请完整引入到本申请中作为参考。在本申请一些实施方案中,所述合成性视黄醛衍生物可直接与视蛋白结合或经由其代谢物而与视蛋白结合且作为视蛋白激动剂而发挥功能。本申请使用的术语“激动剂”是指以下合成性视黄醛衍生物,其与视蛋白结合且有助于视蛋白/合成性视黄醛衍生物复合物对光线的响应能力。合成性视黄醛衍生物作为视蛋白激动剂而可形成受阻维甲酸类循环的药理学旁路,因此开脱对内源性维甲酸类(例如11-顺式-视黄醛)的需要。在一些实施方案中,用于本申请的9-或11-顺式-视黄酯不是天然存在且通常在眼睛中发现的视黄酯。在一些实施方案中,所述9-或11-顺式-视黄酯为经分离的视黄酯。本申请使用的“分离”是指以下分子,其远离其天然环境而存在且因此不是天然产物。经分离的分子可按经纯化的形式存在或可存在于非天然环境中。在其它实施方案中,所述合成性视黄醛衍生物为9-顺式-视黄醇、9-顺式-视黄醛、11-顺式-视黄醇或11-顺式-视黄醛。在一个方面,所述9-或11-顺式-视黄酯可以是具有式i的9-顺式-视黄酯:其中a为-oc(o)r;和r为任选取代的烷基或烯基。在一些实施方案中,r为c1-c24直链或支链烷基例如c1-c14或c1-c12直链或支链烷基。在其它实施方案中,r可以是c1-c10直链或支链烷基例如c1-c8或c1-c6直链或支链烷基。示例性烷基包括甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基和正十一烷基。在一些实施方案中,r为甲基。在一些实施方案中,r为c15烷基。在一些这样的实施方案中,式i化合物为9-顺式-视黄醇棕榈酸酯。在一些实施方案中,r为c17烷基。在一些这样的实施方案中,式i化合物为9-顺式-视黄醇硬脂酸酯。在一些实施方案中,r为c17烯基。在一些这样的实施方案中,式i化合物为9-顺式-视黄醇油酸酯。在一些实施方案中,r为取代的烷基或烯基例如取代有一个或多个羧酸的烷基或烯基。在一些实施方案中,所述取代有一个或多个羧酸的烷基或烯基还取代有一个或多个羟基。在上述一些实施方案中,a为多元羧酸基团例如二元、三元或更高级羧酸。例如,在一些实施方案中,a为c2-c22、c3-c22、c2-c10、c3-c10、c4-c10、c4-c8、c4-c6或c4多元羧酸基团。一些示例性上述实施方案包括以下实施方案,其中a为草酸(乙二酸)、缩苹果酸(丙二酸)、琥珀酸(丁二酸)、富马酸(丁烯二酸)、苹果酸(2-羟基丁烯二酸)、胶酸(戊二酸)、肥酸(己二酸)、蒲桃酸(庚二酸)、软木酸(辛二酸)、杜鹃花酸(壬二酸)、皮脂酸(癸二酸)、枸橼酸、草酰乙酸或酮戊二酸基团等。在一些实施方案中,所述多元羧酸基团不是酒石酸。术语“基团”在此是指可与式i中多烯链的末端碳共价连接的原子团。合成性9-顺式视黄酯的合适实例包括例如9-顺式-视黄醇乙酸酯、9-顺式-视黄醇琥珀酸酯、9-顺式-视黄醇枸橼酸酯、9-顺式-视黄醇酮戊二酸酯、9-顺式-视黄醇富马酸酯、9-顺式-视黄醇苹果酸酯或9-顺式-视黄醇草酰乙酸酯。在一些实施方案中,所述9-顺式-视黄酯为9-顺式-视黄醇乙酸酯:在一个相关方面,所述11-顺式-视黄酯可以是具有式ii的11-顺式-视黄酯:其中a为-oc(o)r;和r为任选取代的烷基或烯基。在一些实施方案中,r为c1-c24直链或支链烷基例如c1-c14或c1-c12直链或支链烷基。在其它实施方案中,r可以是c1-c10直链或支链烷基例如c1-c8或c1-c6直链或支链烷基。示例性烷基包括甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基和正十一烷基。在一些实施方案中,r为甲基。在一些实施方案中,r为c15烷基。在一些这样的实施方案中,式i化合物i为11-顺式-视黄醇棕榈酸酯。在一些实施方案中,r为c17烷基。在一些这样的实施方案中,式i化合物i为11-顺式-视黄醇硬脂酸酯。在一些实施方案中,r为c17烯基。在一些这样的实施方案中,式i化合物i为11-顺式-视黄醇油酸酯。在一些实施方案中,r为取代的烷基或烯基例如取代有一个或多个羧酸的烷基或烯基。在一些实施方案中,所述取代有一个或多个羧酸的烷基或烯基还取代有一个或多个羟基。在上述一些实施方案中,a为多元羧酸基团例如二元、三元或更高级羧酸。例如,在一些实施方案中,a为c2-c22、c3-c22、c2-c10、c3-c10、c4-c10、c4-c8、c4-c6或c4多元羧酸基团。一些示例性上述实施方案包括以下实施方案,其中a为草酸(乙二酸)、缩苹果酸(丙二酸)、琥珀酸(丁二酸)、富马酸(丁烯二酸)、苹果酸(2-羟基丁烯二酸)、胶酸(戊二酸)、肥酸(己二酸)、蒲桃酸(庚二酸)、软木酸(辛二酸)、杜鹃花酸(壬二酸)、皮脂酸(癸二酸)、枸橼酸、草酰乙酸或酮戊二酸基团等。在一些实施方案中,所述多元羧酸基团不是酒石酸。术语“基团”在此是指可与式ii中多烯链的末端碳共价连接的原子团。合成性11-顺式视黄酯的合适实例包括例如11-顺式-视黄醇乙酸酯、11-顺式-视黄醇琥珀酸酯、11-顺式-视黄醇枸橼酸酯、11-顺式-视黄醇酮戊二酸酯、11-顺式-视黄醇富马酸酯、11-顺式-视黄醇苹果酸酯或11-顺式-视黄醇草酰乙酸酯。在一些优选的实施方案中,所述11-顺式-视黄酯为11-顺式-视黄醇乙酸酯:术语“酰基”是本领域公知的且是指由通式“烃基c(o)-”优选“烷基c(o)-”所表示的基团。术语“酰基氨基”是本领域公知的且是指取代有酰基的氨基且可例如由式“烃基c(o)nh-”优选“烷基c(o)nh-”所表示。术语“酰基氧基”是本领域公知的且是指由通式“烃基c(o)o-”优选“烷基c(o)o-”所表示的基团。本申请使用的术语“脂族”包括直链、支链或环状烃,其是完全饱和的或含有一个或多个不饱和单元。脂族基团可以是取代或未取代的。术语“烷氧基”是指具有与其连接的烷基的氧。代表性烷氧基包括甲氧基、乙氧基、丙氧基、叔丁氧基等。“烯基”是指直链或支链烃链原子团,其仅由碳和氢原子构成且含有至少一个不饱和度(即c=c)且具有2至多达20个碳原子。在一些实施方案中,r为c12-17烯基、c1-8烯基、c1-6烯基或c1-4烯基。除非在说明书中另有具体说明,烷基可任选取代有一个或多个取代基。上述取代基可出现在一个或多个碳上,所述碳包含或不包含在一个或多个双键中。示例性取代基包括卤素(包括-f、-br、-cl和-i)、氰基(-cn)、硝基(-no2)、氧代(=o)和羟基(-oh)。在一些实施方案中,“烷基”是指饱和脂族基团的原子团,包括直链烷基和支链烷基。在一些实施方案中,烷基可包含12-17个碳原子(也称为“c12-17烷基”)。在一些实施方案中,烷基可包含12-15个碳原子(也称为“c12-15烷基”)。在一些实施方案中,烷基可包含1-8个碳原子(也称为“c1-8烷基”)。在其它实施方案中,烷基可包含1-6个碳原子(也称为“c1-6烷基”)。在其它实施方案中,烷基可包含1-4个碳原子(也称为“c1-4烷基”)。烷基为例如甲基、乙基、正丙基、1-甲基乙基(异丙基)、正丁基、正戊基、1,1-二甲基乙基(叔丁基)、3-甲基己基、2-甲基己基等。另外,在说明书、实施例和权利要求书通篇中使用的术语“烷基”(或“低级烷基”)旨在包括“未取代的烷基”和“取代的烷基”,所述取代的烷基是指烷基具有对烃骨架中一个或多个碳上的氢进行替换的取代基。上述取代基可包括例如卤素、羟基、羰基(例如羧基、烷氧基羰基、甲酰基或酰基)、硫代羰基(例如硫代酯基团、硫代乙酸酯基团或硫代甲酸酯基团)、烷氧基、烷基硫基、酰基氧基、磷酰基、磷酸酯基团、膦酸酯基团、氨基、酰氨基、脒基团、亚胺基团、氰基、硝基、叠氮基、巯基、烷基硫基、硫酸酯基团、磺酸酯基团、氨磺酰基、磺酰氨基、磺酰基、杂环基、芳烷基、芳基或杂芳基。在一些实施方案中,烷基可任选被一个或多个以下取代基所取代:卤素(包括-f、-br、-cl和-i)、氰基(-cn)、硝基(-no2)、氧代(=o)和羟基(-oh)。术语“cx-y”当与化学基团例如酰基、酰基氧基、烷基、烯基、炔基或烷氧基一起使用时旨在包括在链中含有x-y个碳的基团。例如,术语“cx-y烷基”是指取代或未取代的饱和烃基,包括直链烷基和支链烷基,其在链中含有x-y个碳,包括卤代烷基例如三氟甲基和2,2,2-三氟乙基等。c0烷基在所述基团处于末端位置的情况下表示氢且在所述基团处于内部位置的情况下表示键。术语“c2-y烯基”和“c2-y炔基”是指取代或未取代的不饱和脂族基团,其就长度和可能的取代情况而言与上述烷基是类似的,但是分别含有至少一个双键或叁键。本申请使用的术语“烷基氨基”是指取代有至少一个烷基的氨基。本申请使用的术语“烷基硫基”是指取代有烷基的巯基且可由通式“烷基s-”所表示。本申请使用的术语“炔基”是指含有至少一个叁键的脂族基团且旨在包括“未取代的炔基”和“取代的炔基”,所述取代的炔基是指以下炔基,其具有对炔基中一个或多个碳上的氢进行替换的取代基。上述取代基可出现在一个或多个碳上,所述碳包含或不包含在一个或多个叁键中。另外,上述取代基包括如上所述就烷基所涉及的所有那些取代基,除稳定性所禁止的情况外。例如,所涉及的是炔基被一个或多个烷基、碳环基、芳基、杂环基或杂芳基所取代。在优选的实施方案中,炔基在其骨架中具有1-12个碳,优选在其骨架中具有1-8个碳且更优选在其骨架中具有1-6个碳。示例性炔基包括丙炔基、丁炔基、3-甲基戊-1-炔基等。本申请使用的术语“酰胺基团”是指以下基团:其中r9和r10各自独立表示氢或烃基或r9和r10及与它们连接的n原子一起形成在环结构中具有4-8个原子的杂环。术语“胺基团”和“氨基”是本领域公知的且是指未取代和取代的胺基团及其盐例如可由下式所表示的基团:其中r9、r10和r10’各自独立表示氢或烃基或r9和r10及与它们连接的n原子一起形成在环结构中具有4-8个原子的杂环。本申请使用的术语“氨基烷基”是指取代有氨基的烷基。本申请使用的术语“芳烷基”是指取代有一个或多个芳基的烷基。本申请使用的术语“芳基”包括取代或未取代的单环芳族基团,其中每个环原子都为碳。优选地,所述环为5-7元环且更优选6元环。芳基包括苯基、苯酚基团、苯胺基团等。术语“氨基甲酸酯基团”是本领域公知的且是指以下基团:其中r9和r10独立表示氢或烃基例如烷基。本申请使用的术语“碳环”、“碳环基”和“碳环的”是指非芳族的饱和或不饱和环,其中每个环原子都为碳。优选地,碳环含有3-10个原子且更优选含有5-7个原子。本申请使用的术语“碳环基烷基”是指取代有碳环基的烷基。术语“碳酸酯基团”是本领域公知的且是指基团“-oco2-r9”,其中r9表示烃基例如烷基。本申请使用的术语“羧基”是指由式“-co2h”所表示的基团。本申请使用的术语“环烷基”是指饱和脂族环的原子团。在优选的实施方案中,环烷基在其环结构中具有3-10个碳原子且更优选在其环结构中具有5-7个碳原子。合适的环烷基包括环庚基、环己基、环戊基、环丁基和环丙基。本申请使用的术语“醚基团”是指通过氧与另一个烃基连接的烃基。因此,烃基上的醚取代基可以是烃基-o-。醚基团可以是对称或不对称的。醚基团的实例包括但不限于杂环-o-杂环和芳基-o-杂环。醚基团包括“烷氧基烷基”,其可由通式“烷基-o-烷基”所表示。本申请使用的术语“卤代”和“卤素”是指卤素且包括氯、氟、溴和碘。本申请使用的术语“杂烷基”是指包含至少一个杂原子(例如o、s或nr50,例如其中r50为h或低级烷基)的饱和或不饱和碳原子链,其中没有两个杂原子是相邻的。本申请使用的术语“杂芳烷基”是指取代有杂芳基的烷基。术语“杂芳基”包括取代或未取代的芳族单环结构,优选5-7元环且更优选5-6元环,其环结构包含至少一个杂原子(例如o、n或s),优选1-4个或1-3个杂原子且更优选1或2个杂原子。当两个或更多个杂原子存在于杂芳基环中时,它们可以是相同或不同的。术语“杂芳基”还包括具有两个或更多个环的多环环系,其中两个或更多个碳是相邻的两个环所共有的,其中至少一个环是杂芳族的,而另一个环可以是例如环烷基、环烯基、环炔基、芳基、杂芳基和/或杂环基。优选的多环环系具有两个环,其中所述两个环都是芳族的。杂芳基包括例如吡咯、呋喃、噻吩、咪唑、噁唑、噻唑、吡唑、吡啶、吡嗪、哒嗪、喹啉和嘧啶等。本申请使用的术语“杂原子”是指任何非碳或非氢元素的原子。优选的杂原子为氮、氧和硫。术语“杂环基”、“杂环”和“杂环的”是指取代或未取代的非芳族环结构,优选3-10元环且更优选3-7元环,其环结构包含至少一个杂原子,优选1-4个杂原子且更优选1或2个杂原子。杂环基包括例如哌啶、哌嗪、吡咯烷、吗啉、内酯、内酰胺等。本申请使用的术语“杂环基烷基”是指取代有杂环基的烷基。本申请使用的术语“烃基”是指以下基团,其通过不具有=o或=s取代基的碳原子来键合且通常具有至少一个碳-氢键和主要为碳的骨架,但是可任选包含杂原子。因此,甲基、乙氧基乙基、吡啶-2-基和三氟甲基等基团出于本申请目的而被认为是烃基,但是取代基例如乙酰基(其在连接碳上具有=o取代基)和乙氧基(其通过氧而非碳来连接)不被认为是烃基。烃基包括但不限于芳基、杂芳基、碳环、杂环、烷基、烯基、炔基及其组合。术语“低级”当与化学基团例如酰基、酰基氧基、烷基、烯基、炔基或烷氧基一起使用时旨在包括以下基团,其中在所述取代基中存在十个或更少个且优选六个或更少个非氢原子。例如,“低级烷基”是指含有十个或更少个且优选六个或更少个碳原子的烷基。直链或支链低级烷基的实例包括甲基、乙基、异丙基、丙基、丁基、叔丁基等。在一些实施方案中,本申请定义的酰基、酰基氧基、烷基、烯基、炔基或烷氧基取代基分别是低级酰基、低级酰基氧基、低级烷基、低级烯基、低级炔基或低级烷氧基,无论它们是单独出现还是与其它取代基一起出现[例如芳烷基(在该情况下当对烷基取代基中的碳原子进行计数时不对芳基中的原子进行计数)]。术语“多环基”、“多环”和“多环的”是指两个或更多个环(例如环烷基、环烯基、环炔基、芳基、杂芳基和/或杂环基),其中两个或更多个原子是相邻的两个环所共有的,例如所述环为“稠合的环”。优选的多环具有2-3个环。多环中的每个环都可以是取代或未取代的。在一些实施方案中,多环中的每个环都含有3-10个优选5-7个环原子。术语“取代”是指基团具有对骨架中一个或多个碳上的氢进行替换的取代基。应该理解的是,“取代情况”或“取代有”包括隐含的条件即所述取代情况符合被取代的原子和取代基所允许的化合价且所述取代情况得到稳定的化合物,例如所述稳定的化合物不会自发地例如通过重排、环化、消除等而发生转化。本申请使用的术语“取代”旨在包括所有所允许的有机化合物取代基。在一个宽泛的方面,所允许的取代基包括非环状和环状的、支化和非支化的、碳环和杂环的、芳族和非芳族的有机化合物取代基。所允许的取代基就合适的有机化合物而言可以是一个或多个且可以是相同或不同的。出于本申请目的,杂原子例如氮可具有氢取代基和/或任何所允许的有机化合物取代基,其描述在本申请中且满足所述杂原子的化合价。取代基可包括本申请描述的任何取代基例如卤素、羟基、羰基(例如羧基、烷氧基羰基、甲酰基或酰基)、硫代羰基(例如硫代酯基团、硫代乙酸酯基团或硫代甲酸酯基团)、烷氧基、烷基硫基、酰基氧基、磷酰基、磷酸酯基团、膦酸酯基团、氨基、酰氨基、脒基团、亚胺基团、氰基、硝基、叠氮基、巯基、烷基硫基、硫酸酯基团、磺酸酯基团、氨磺酰基、磺酰氨基、磺酰基、杂环基、芳烷基或芳族或杂芳族基团。除非具体描述为“未取代”,本申请提及的化学基团被理解为包括取代的变体。例如,所提及的“芳基”隐含地包括取代和未取代的变体。术语“硫酸酯基团”是本领域公知的且是指基团“-oso3h”或其药用盐或酯。术语“磺酰胺基团”是本领域公知的且是指由以下通式所表示的基团:其中r9和r10独立表示氢或烃基例如烷基。术语“亚砜基团”是本领域公知的且是指基团“-s(o)-r9”,其中r9表示烃基例如烷基、芳基或杂芳基。术语“磺酸酯基团”是本领域公知的且是指基团“-so3h”或其药用盐或酯。术语“砜基团”是本领域公知的且是指基团“-s(o)2-r9”,其中r9表示烃基例如烷基、芳基或杂芳基。本申请使用的术语“硫代酯基团”是指基团“-c(o)sr9”或“-sc(o)r9”,其中r9表示烃基例如烷基。本申请使用的术语“硫醚基团”是指其中氧用硫替换的醚基团。术语“脲基团”是本领域公知的且可由以下通式所表示:其中r9和r10独立表示氢或烃基例如烷基。在说明书各处,本申请化合物中的取代基以组群或范围的形式描述。本申请具体旨在包括上述组群和范围中各个成员的每种和所有单独亚组合。例如,术语“c1-c6烷基”具体旨在单独公开了甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基等。在一些实施方案中,9-顺式-视黄酯可被肝脏转换成代谢性前药形式即9-顺式-视黄醇脂肪酸酯,其以肝脂滴的形式贮存在肝脏中。9-顺式-视黄醇脂肪酸酯和视黄醇从肝脏中动员出来且进到循环中,其中它们移行到眼睛和rpe。它们在此转化成9-顺式-视黄醛,所述9-顺式-视黄醛最后与光感受器视蛋白结合以形成具有活性的视色素。优选的9-顺式-视黄酯为9-顺式-视黄醇乙酸酯。9-顺式-视黄醇乙酸酯(也称为“9-顺式-r-ac”)被肝脏代谢成9-顺式-视黄醇脂肪酸酯例如9-顺式-视黄醇棕榈酸酯。然后9-顺式-视黄醇脂肪酸酯和视黄醇在眼睛和rpe中转化成9-顺式-视黄醛以代替缺乏的生色团例如11-顺式-视黄醛。在一个实施方案中,9-顺式-r-ac可如下制备:最初在钯催化剂(例如钯盐或氧化钯)存在下将全反式-视黄醇乙酸酯(sigma-aldrich)转化成9-顺式-视黄醇乙酸酯和全反式-视黄醇乙酸酯的混合物。然后对9-顺式-视黄醇乙酸酯和全反式-视黄醇乙酸酯的混合物进行水解以得到9-顺式-视黄醇和全反式-视黄醇的混合物。纯的9-顺式-视黄醇可通过选择性结晶来分离且进一步酯化成纯的9-顺式-r-ac。关于9-顺式-r-ac制备和纯化方法的详细描述可参见例如gb专利1452012。在一些实施方案中,本申请描述的9-顺式-视黄酯可由9-顺式-视黄醇使用合适的酯化剂以与制备9-顺式-r-ac类似的方式来制备,所述方法在本领域技术人员的知识范围内。在一些实施方案中,9-和11-顺式-视黄酯可通过本领域已知的方法例如通过用羧酸对视黄醇进行由酸催化的酯化、通过使酰卤与视黄醇反应、通过用羧酸对视黄酯进行转酯化、通过使伯卤化物与视黄酸的羧酸盐反应、通过使酸酐与视黄醇进行由酸催化的反应等来形成。在示例性实施方案中,9-和11-顺式-视黄酯可通过用羧酸例如乙酸、丙酸、丁酸、缬草酸、羊油酸、羊脂酸、天竺葵酸、羊蜡酸、月桂酸、油酸、硬脂酸、棕榈酸、肉豆蔻酸、亚油酸、琥珀酸、富马酸等对视黄醇进行由酸催化的酯化来形成。在另一个示例性实施方案中,视黄酯可通过使酰卤与视黄醇反应来形成(参见例如vanhooseretal.,proc.natl.acad.sci.usa,97:8623-28(2000))。合适的酰卤包括例如乙酰氯、棕榈酰氯等。在一些实施方案中,反式-维甲酸类可通过暴露于uv光而异构化成顺式-维甲酸类。例如,全反式-视黄醛、全反式-视黄醇、全反式-视黄酯或全反式-视黄酸可分别异构化成9-顺式-视黄醛、9-顺式-视黄醇、9-顺式-视黄酯或9-顺式-视黄酸。反式-维甲酸类可通过例如暴露于波长为约365nm且基本不含有使顺式-维甲酸类如本申请进一步描述的那样发生降解的较短波长的uv光而异构化成9-顺式-维甲酸类。在本申请另一个实施方案中,反式-维甲酸类可通过暴露于uv光而异构化成顺式-维甲酸类。例如,全反式-视黄醛、全反式-视黄醇、全反式-视黄酯或全反式-视黄酸可通过暴露于波长为约365nm且基本不含有使顺式-维甲酸类如本申请进一步描述的那样发生降解的较短波长的uv光而分别异构化成9-顺式-视黄醛、9-顺式-视黄醇、9-顺式-视黄酯或9-顺式-视黄酸。本申请合成性视黄醛衍生物可由于其含有小于约5%或小于约1%或小于约0.1%的其它维甲酸类而是基本纯的。一种或多种合成性视黄醛衍生物可用于本申请治疗方案。本申请药用组合物本申请合成性视黄醛衍生物(包括9-和11-顺式-视黄酯)可使用药用媒介物及本领域常规使用的技术来配制成用于口服给药。在一些实施方案中,将所述合成性视黄醛衍生物配制成适于口服给药的制剂。所述合成性视黄醛衍生物中的大多数为油性物质且是亲脂性的且因此与一种或多种脂质媒介物是容易混溶的。本申请合成性视黄醛衍生物(包括9-和11-顺式-视黄酯)(例如9-顺式-视黄酯)是对光敏感和对氧气敏感的。因此,保持制剂的稳定性且使制剂的有效性和有效期最大化是合乎需要的。合适的脂质媒介物可基于其使混悬或溶解在其中的合成性视黄醛衍生物得以稳定的能力来选择。本申请使用的“脂质”或“脂质媒介物”是指一种脂肪酸酯或脂肪酸酯的共混物。在一些实施方案中,所述脂质媒介物包括一种或多种甘油三酯,当一个甘油通过三个脂肪酸来酯化时形成所述甘油三酯。甘油三酯包括植物油和动物脂肪。在一些实施方案中,所述脂质媒介物包含不多于50w/w%的多不饱和脂肪酸,所述多不饱和脂肪酸包括比例(按重量计)小于15的ω-6脂肪酸和ω-3脂肪酸。在优选的实施方案中,将所述合成性视黄醛衍生物例如9-或11-顺式-视黄酯配制成包含视黄醛衍生物例如9-或11-顺式-视黄酯和液体媒介物的口服制剂。在另一个实施方案中,所述9-或11-顺式-视黄酯为9-顺式-视黄醇乙酸酯且所述脂质媒介物为大豆油。在另一个实施方案中,所述制剂还包含抗氧化剂。在一些这样的实施方案中,所述抗氧化剂为丁羟茴醚(bha)。关于适用于本申请的其它脂质媒介物和制剂的描述可参见例如国际专利申请pct/us2009/059126(qltinc.),将其所公开的相关内容完整引入到本申请中作为参考。本申请还提供试剂盒,其含有合成性视黄醛衍生物且优选含有9-或11-顺式-视黄酯或其药用组合物。所述试剂盒还包含在本申请治疗方案和方法中使用所述合成性视黄醛衍生物的说明书。优选地,商业包装将含有所述合成性视黄醛衍生物的一个或多个单位剂量例如9-或11-顺式-视黄酯或其药用组合物在本申请治疗方案或方法中使用的一个或多个单位剂量。对于本领域技术人员将显而易见的是,对光和/或空气敏感的合成性视黄醛衍生物例如9-或11-顺式-视黄酯或其药用组合物可能需要特别的包装和/或制剂。例如,包装可用于试剂盒,其是不透光的和/或是密封的以不与环境空气接触和/或与合适的赋形剂一起配制。剂量、剂量频率和给药方式用于本申请治疗方案的合成性视黄醛衍生物和包含所述合成性视黄醛衍生物的药用组合物可呈口服剂量的形式。在一个实施方案中,将包含9-或11-顺式-视黄酯和液体媒介物的本申请药用组合物口服给药于本申请治疗方案中的受试者。在本申请另一个实施方案中,口服给药的本申请药用组合物包含9-顺式-视黄酯和大豆油。在本申请另一个实施方案中,口服给药的药用组合物包含9-顺式-视黄醇乙酸酯或9-顺式-视黄醇琥珀酸酯和大豆油(usp级)。本申请合成性视黄醛衍生物例如9-或11-顺式-视黄酯的口服给药具有潜在的几个优点,包括接受本申请治疗方案的受试者的两只眼睛中的所有光感受器都暴露于治疗、不需要手术介入和可在任何时间停止给药。在其它实施方案中,本申请治疗方案可与以下由载体介导的转基因治疗联用,所述由载体介导的转基因治疗用于代替一种或多种与受试者例如已经接受基因治疗作为针对与受试者中的内源性维甲酸类缺乏相关的视觉障碍而进行的治疗或缓解方法的受试者中的视觉周期相关的基因例如rpe65或lrat。本申请治疗方案实现有意义的视觉改善功能,同时显示出可接受的安全性分布且因此在一个实施方案中,本申请治疗方案可适于作为长期(持久)治疗方案。所述第一治疗剂量和所述第二治疗剂量之间的休止期时间长度小于1个月例如7-28天且可基于一名或多名受试者在小于1个月的休止期内视觉功能参数(如本申请所定义)的保持或提高来任选选择。可针对个体来观察和评价对受试者视觉功能的剂量依赖性作用或改善以对受试者在小于1个月的休止期内的给药需要进行个性化。可选择地,第二治疗剂量的给药可基于一名或多名受试者的视觉功能参数相对于在第一给药期和任何休止期内进行的在先有效性评价的降低。例如,可在所述第一治疗剂量后例如约3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天或21天评价对受试者的给药有效性。在任何评价点可基于对一名或多名受试者在任何休止期内的视觉功能参数进行回归而给药后续治疗剂量。在一些实施方案中,与多个治疗性给药期和休止期相关的临床相关安全性分布得以实现。在一些实施方案中,在多达6个月、多达5个月、多达4个月或多达3个月内给药多达6个、多达5个、多达4个或多达3个治疗剂量。在一些实施方案中,在多达12个月、多达11个月、多达10个月、多达9个月、多达8个月、多达7个月、多达6个月、多达5个月、多达4个月或多达3个月内向受试者给药多达12个、多达11个、多达10个、多达9个、多达8个、多达7个、多达6个、多达5个、多达4个或多达3个治疗剂量。在另一个实施方案中,在约3个月内给药多达3个治疗剂量。在另一个实施方案中,在约6个月内给药多达6个治疗剂量。在上述一些情况下,每月给药不多于1个治疗剂量。在一些实施方案中,针对rp受试者而建立的治疗方案和方法可应用于lca受试者。口服给药所述组合物后,抛开任何特定理论的束缚,据信所述药物进到肝脂滴中且从肝脏中动员出来而进到rpe(称为视黄醇酯贮存颗粒(retinosome))中。imanishiy.etal.jcellbiol166:447-53(2004)。其被与视黄醇结合蛋白4(rbp4)结合的肝脏所分泌且被递送至外周组织,而在眼睛中,其被氧化成9-顺式-视黄醛,所述9-顺式-视黄醛回流到维甲酸类循环中(图1)。moisea.r.etal.biochemistry46:4449-58(2007)。视黄醇(无论其异构形式)也贮存在脂肪细胞中且根据需要而动员到循环中。o’byrnes.m.etal.jbiolchem280:35647-57(2005)。因此,该生色团类似物的长期作用可归结为以下事实即活性药物由脂肪细胞缓慢释放到外周中。对治疗作用进行评价本申请治疗方案在患有rp或lca或患有与内源性维甲酸类缺乏相关的其它视觉障碍的受试者中改善视觉功能的有效性可基于几种视觉功能测量(包括如下所述的那些视觉功能测量)来评价。受试者在一只或两只眼睛中视觉功能的改善可基于对以下项目的测量来评价:视野、视敏度和视网膜敏感性测试及视网膜电图、动态瞳孔响应、眼球震颤、皮质视觉功能、颜色视觉、运动视觉测试和患者所报告的生活质量结果/进行日常活动的能力。视网膜和光感受器的变性程度可通过在基线时和在治疗后进行光学相干断层成像术(oct)和眼底自发荧光(faf)分析来进一步评价。可通过对受试者每只眼睛的视觉功能与受试者每只眼睛在给药本申请治疗方案前视觉功能的基线测量值进行比较或对受试者每只眼睛的视觉功能与没有接受所述治疗方案的对照人类视觉系统进行比较来证实受试者在本申请治疗方案期间在一只或两只眼睛中视觉功能的改善。1.视野进行性视野丧失是内源性维甲酸类缺乏例如rp和lca的标志之一且通常用作对所述疾病的进展进行监测的手段。例如,已经报道大多数rp受试者由于严重受限的视野而是法律意义上的盲人。视野是个体视觉的整个范围,包括每只眼睛的中央和周边(旁侧)视觉。正常的人类视野就每只眼睛而言在鼻侧扩展约60度(朝向鼻子或向内)、在颞侧扩展约100度(远离鼻子或向外)及在水平子午线以上约60度和在水平子午线以下约75度。可通过本领域公知的技术和标准例如用戈德曼视野测试(gvf)进行的视野检查、眼底受控视野检查(微视野检查-mp1)或用humphrey视野分析仪(hfa)进行的静态视野检查对视野进行测试。通常用经校正的标准戈德曼视野计对gvf进行测量。视野如下测量:将刺激物(等视力线或目标物)由不可视区移动到可视区,因此得到周边视野区域图。可基于测试过程中的平面变形而对gvf表结果进行数字化且换算成视网膜表面积以最准确地捕捉患有视网膜变性的受试者中周边vf的变化。基线测量值可用于鉴定一条随时间对vf进行评价的vf等视力线,其所提供的vflog视网膜面积与范围0.7-2.4logmm2的中点1.5logmm2最接近。所选等视力线大小所提供的log视网膜面积的变化可使用混合作用模型来评价,所述混合作用模型使用每只眼睛的log视网膜面积。在分析中考虑同一名受试者的两只眼睛之间的关联性和关联度。基于对测试-再测试变异性进行评价将大于20%的视野改善接受为临床上显著的改善(bittneretal.,iovs52:8042-8046(2011))。vf也可如下计算:测量球面度的立体角、测量体积、将两条或更多条等视力线的结果组合起来或通过发现所堆叠的等视力线的体积而得到针对先后三条或更多条等视力线的近似视觉丘(christoforidis,clin.ophthalmol.,5:535-541(2011))。通过任何方法来计算的视野的变化可通过与受试者的基线测量值进行比较来确定。患有本申请所述内源性维甲酸类缺乏的受试者可具有不同程度的缺损,其范围可包括检测不到的视野至显著收缩的视野。例如,已经定义了rp受试者中vf丧失的鉴定性特征性模式(groveretal.,ophthalmology105:1069-1075(1998))。典型的较不晚期的rp可表现出在可用v4e目标物检测到的情况下大于20度的vf。非典型的rp可表现出在v4e的情况下大于20度的大vf和降低的中央敏感性。这些rp受试者仅在黄斑中/在中心凹处检测到v4e。典型的患有晚期变性的rp受试者可表现出在v4e的情况下小于20度的小vf或在v4e的情况下小于20度的小vf和降低的中央敏感性,其中仅在黄斑中/在中心凹处检测到v4e目标物。在本申请治疗方案的一个实施方案中,与在给药期前得到的受试者视野基线相比,受试者的视野在给药期内是改善的。在一些实施方案中,与受试者的视野在给药期内的改善相比,受试者的视野在休止期内继续改善。在一些实施方案中,在最初给药期内观察到的受试者视野改善在休止期内保持在处于受试者基线视野以上的水平。在另一个实施方案中,受试者的视野在给药期和/或休止期内都是改善的,但是到休止期结束时返回到约基线。在本申请各个实施方案中,例如对于患有lrat或rpe65突变的rp受试者(包括但不限于arrp患者),受试者的视野相对于基线视网膜面积可扩展至少20度。可在对受试者的视野在最初给药期内和在休止期内的改善进行评价后开始后续给药期。例如,若受试者的视野返回到最初给药期前的水平或在最初休止期内返回到预定水平,则可开始后续给药期。在一个实施方案中,若评价是受试者的视野在最初给药期后相对于基线的改善小于20%,则开始后续给药期。2.视敏度视敏度(va)的降低在rp或与内源性维甲酸类缺乏相关的其它视觉障碍(包括lca)的过程中可能是明显的。已经证实患有早发型rp的受试者与其它类型的rp相比具有较稳定的va。甚至在患有晚期rp且具有小的残余的孤立的中央vf的个体中,va也可保持正常,尽管va的降低也可在一些rp受试者中观察到。视敏度是指视觉尤其是立体视觉的敏锐度或清晰度,其取决于眼睛中视网膜焦点的锐度和脑解读能力的敏感性。视敏度是对视觉处理系统的空间解析能力进行的测量且通常以使条件最佳化和标准化的方式来测试。logmar表特别是早期治疗糖尿病性视网膜病研究(etdrs)表已经成为在临床试验中测量对va的治疗作用的黄金标准。方案是公知的,从而使能够在4米处读到少于20个字母的受试者在1米处接受测试。该方法在高对比度和标准室内照明的情况下对视觉进行测量。史密斯-凯特尔韦尔研究所低亮度(smith-kettlewellinstitutelowluminance,skill)表被设计成用于在模拟低照明的低对比度的情况下通过在标准室内照明的情况下进行的测试来评价视觉。skill表在一侧具有高对比度近视敏度表(白色上的黑色字母)且在另一侧具有低亮度低对比度表(深色背景上的灰色字母)。卡片深色侧的低反射模拟了在昏暗环境中进行的测试。在本申请一些实施方案中,视敏度相对于基线的改善程度可取决于受试者的基线视敏度。对于患有极低视敏度(光感或挥手-0个字母)的患者,临床上有意义的改善可与1-5个etdrs字母的改善相关。在一些实施方案中,所述受试者在给药第一治疗剂量后可具有≥5个etdrs字母的va改善。在一些实施方案中,所述受试者在给药第一治疗剂量后可具有≥5至<10的va改善。在一些实施方案中,所述受试者在给药第一治疗剂量后可具有≥10至<15个字母的va改善。在一些实施方案中,所述受试者在给药第一治疗剂量后可具有≥15至<20个字母的va改善。在一些实施方案中,所述受试者在给药第一治疗剂量后可具有≥20个字母的va改善。因此,在本申请一个治疗方案中,与受试者在最初给药期治疗前的视敏度水平即受试者的视敏度基线相比,受试者的视敏度在最初给药期内是改善的。在一些实施方案中,与在最初给药期结束时观察到的受试者视敏度水平改善相比,受试者的视敏度在休止期内继续改善。在一些实施方案中,受试者视敏度的改善在休止期内保持在受试者的基线水平以上。在一个实施方案中,若就基线va>0个字母的受试者所给出的评价是受试者的视敏度在最初给药期后相对于基线的改善小于5个字母,则可开始后续给药期。3.视网膜敏感性受试者的视网膜敏感性可通过确定绝对强度阈值即产生视觉所需要的测试斑最小亮度来测量。视网膜敏感性与眼睛根据黑暗和光亮的各种水平而进行调节和检测对比度的能力相关。开发出全视野刺激测试(fst)以使用商业设备在不能注视的患者中测量暗适应敏感性(roman,a.j.etal.,physiol.meas.28(8):n51-n56(2007))。所述测试使用可在商业erg圆顶(diagnosys)中得到的全视野(ganzfeld)白色闪光刺激呈现且可得到的软件允许对绝对阈值[以log亮度(logcd/m2)表示]进行可靠有效的身心测量。fst还可使用用colordomeganzfeld刺激仪(diagnosysllc,littleton,ma)递送的光刺激来进行。在该测试方法中,在暗适应条件下用白色、红色和蓝色闪光重复测量对全视野刺激的敏感性。先前已经描述了双色阈值视野检查(lorenzetal.,investophthalvissci.49(12):5235-5242(2008))。为了评价视杆细胞和视锥细胞所介导的功能的空间分布,在暗视和明视条件下进行双色阈值视野检查。可使用经调整的humphrey视野分析仪或设备。在暗适应后对暗视阈值进行测量。就每个测试位置而言,可将敏感性丧失计算为受试者中的测量值和正常受试者中的第十百分位数之间的差异。用10cd/m2的背景照明对明视阈值进行测量。就每个测试位置而言,可将视锥细胞敏感性计算为针对长波长刺激的测量值和正常受试者中的第十百分位数之间的差异。暗适应静态视野检查对受试者在整个视野区的各个位置的暗适应(包括长达6小时或更长的延长暗适应)阈值敏感性进行测量,其尤其可用于不能注视的受试者。所述测试使用可在戈德曼视野计或商业colordome(其可提供亮度为4.5log特罗兰-秒的闪光)中得到的全视野刺激呈现。先前已经证实fst可在具有有限erg响应或不具有erg响应的rpe65缺乏性lca患者中测量视杆细胞和视锥细胞对白色、蓝色和红色刺激的敏感性(jacobson,s.g.etal.,investophthalmolvissci.50(5):2368-2375(2009))。暗适应静态视野检查方法可用于较准确地鉴定这些受试者的视野中残余的视觉。先前已经对与患有rpe65基因突变的受试者相关的视网膜敏感性评价进行了优化(cideciyan,a.v.etal.,procnatlacadsciusa.105(39):15112-15117)。因此,在本申请一个治疗方案中,与受试者在最初给药期治疗前的视网膜敏感性基线相比,受试者的视网膜敏感性在最初给药期内是改善的。在一些实施方案中,与受试者的视网膜敏感性在最初给药期结束时的改善相比,受试者的视网膜敏感性在休止期内继续改善。在一些实施方案中,受试者视网膜敏感性的改善在休止期内约保持在受试者的视网膜敏感性在最初给药期结束时的水平。在一些实施方案中,受试者视网膜敏感性的改善在休止期内保持在处于受试者基线视网膜敏感性以上的水平。4.视网膜电图(erg)erg测试为广泛接受的标准测试且常规用于对大多数遗传性视网膜疾病(ird)(包括与内源性维甲酸类缺乏相关的视觉障碍)进行诊断和监测其进展。专业为ird的医生同意erg响应的显著和可重复的改善代表了改善的视觉功能。例如,erg响应为rp中视杆细胞和视锥细胞功能丧失的早期指征且erg响应的降低可在生命的最初几年内显现,尽管症状出现得晚很多。已经报道rp患者患有降低或检测不到的视杆细胞和视锥细胞响应,通常其中与视锥细胞相比,视杆细胞具有较大的erg响应丧失。对综合视网膜响应进行评价的三种主要类型的传统总或全视野erg为暗视测试(暗适应的昏暗闪光的由视杆细胞介导的erg)、明视测试(光适应的明亮闪光的由视锥细胞介导的erg)和闪光测试(光适应的明亮闪光的31赫兹闪光的erg)。还可评价暗适应的明亮闪光的由视杆细胞/视锥细胞介导的erg。全视野erg的限制是记录结果为来自整个视网膜的集中电势。除非20%或更多的视网膜受到病症的影响,erg记录结果通常是正常的(例如患有黄斑变性、变大的盲点或其它中心暗点的法律意义上的盲人可能具有正常的总erg)。早发型rp通常被定义为显示出消失或显著降低的erg响应,其特征在于在6岁前出现视杆细胞-视锥细胞变性。在本申请治疗方案的一个实施方案中,与受试者在最初给药期治疗前的erg响应相比,受试者在最初给药期内的erg响应是改善的。在一些实施方案中,与在最初给药期结束时观察到的受试者erg响应改善相比,受试者的erg响应在休止期内继续改善。在一些实施方案中,受试者erg响应的改善在休止期内保持在受试者的基线水平以上。5.动态瞳孔响应(瞳孔测量法)瞳孔响应(瞳孔在响应亮光刺激时的收缩)在患有本申请所述视觉障碍的受试者中可能是异常的。动态瞳孔测量法为记录瞳孔响应和在对处置作出响应时监测电势变化的非介入方法。瞳孔反射在患有rpe65缺乏且接受过基因治疗的lca受试者中是改善的(maguire,a.m.etal.,newengljmed.358:2240-2248(2008))。已经建立了颜色瞳孔测量法,其中光刺激具有各种颜色、强度、刺激持续时间和刺激间隔时间(parketal.,investophthalvissci.52(9):6624-6635(2011)),其中光用colordomeganzfeld刺激仪(diagnosysllc,littleton,ma)或设备递送。在暗适应后对视杆细胞加权记录结果和内在感光视网膜神经节细胞记录结果进行检查。可将记录结果的视频信号转继至将实时瞳孔直径记录到文本文件中的处理板。对相对保持和瞬时的瞳孔收缩数据的临床显著性进行分析。因此,在本申请一个治疗方案中,与受试者在最初给药期治疗前的瞳孔响应基线水平相比,受试者的瞳孔响应在最初给药期内是改善的。在一些实施方案中,与受试者在最初给药期结束时的瞳孔响应水平相比,受试者的瞳孔响应在休止期内继续改善。在一些实施方案中,受试者瞳孔响应的改善在休止期内约保持在受试者在最初给药期结束时的瞳孔响应水平。在一些实施方案中,受试者瞳孔响应的改善在休止期内保持在处于受试者基线瞳孔响应以上的水平。6.眼球震颤眼球震颤为一种形式的不随意眼动,其通常与视力缺损(包括lca)相关。非介入性地测量眼球震颤的幅度和频率且可用于在对处置作出响应时监测电势的变化(例如通过对眼动进行录像以对受试者的振动和斜视进行定性临床分析)(maguire,a.m.etal.,newengljmed.358:2240-2248(2008))。因此,在本申请一个治疗方案中,受试者在最初给药期内显示出眼球震颤幅度和/或频率的降低。在另一个实施方案中,受试者在休止期内显示出眼球震颤幅度和/或频率的继续降低。7.视觉皮质功能本申请治疗方案的治疗有效性可使用受试者的视觉对皮质视觉功能的影响(通过功能性磁共振成像(fmri)来测量)来监测。功能性扫描包括对比度敏感性任务、运动刺激任务和较高水平的认知任务。通常将数据显示为mri信号相对于基线的变化百分比。对统计学显著性的标绘将被显示在就每名个体而重建的皮质表面上。将就激活的范围和强度而对治疗前和治疗后扫描进行直接的比较。可基于视觉和/或顶叶大脑皮质的激活来定义视觉皮质功能的改善。因此,在本申请一个治疗方案中,与受试者在最初给药期治疗前的皮质视觉功能基线水平相比,受试者的皮质视觉功能在最初给药期内是改善的。在一些实施方案中,与受试者在最初给药期结束时的皮质视觉功能水平相比,受试者的皮质视觉功能在休止期内继续改善。在一些实施方案中,受试者皮质视觉功能的改善在休止期内约保持在受试者在最初给药期结束时的皮质视觉功能水平。在一些实施方案中,受试者视觉皮质功能的改善通过视觉大脑皮质在治疗后的激活来定义。在一些实施方案中,受试者视觉皮质功能的改善通过顶叶皮质在治疗后的激活来定义。8.颜色视觉颜色视觉测试对受试者区分不同颜色的能力进行检查。石原(ishihara)测试板用于对颜色视觉的缺陷程度进行检测、分类和评价。颜色视觉测试还用于对视神经功能和遗传性视网膜疾病进行评价。颜色视觉可通过本领域已知的方法(包括石原颜色测试、哈迪-兰德-雷特(hardy-rand-rittler)测试或法恩斯沃思-芒塞尔(farnsworth-munsell)100色度测试)来评价。所述测试包括多块颜色测试板,所述颜色测试板各自含有一圈以不同颜色和大小随机出现的点,其中图案是以下点,所述点形成具有正常颜色视觉的那些受试者所能看出来的数字。因此,在本申请一个治疗方案中,与受试者在最初给药期治疗前的颜色视觉基线水平相比,受试者的颜色视觉在最初给药期内是改善的。在一些实施方案中,与受试者在最初给药期结束时的颜色视觉水平相比,受试者的颜色视觉在休止期内继续改善。在一些实施方案中,受试者颜色视觉的改善在休止期内约保持在受试者在最初给药期结束时的颜色视觉水平。9.暗适应暗适应被定义为视网膜的光敏度在暴露于亮光后在黑暗中的恢复。暗适应速率的缺损与视觉病症的范围相关且通常为rp受试者的早期症状。暗适应参数包括但不限于使由视锥细胞介导的敏感性得以恢复的时间常数、使由视杆细胞介导的敏感性得以恢复的时间常数、视锥细胞平台期、视杆细胞平台期、杆锥裂、视杆细胞截距、由视杆细胞介导的恢复中第二组分的斜率和/或时间常数、由视杆细胞介导的恢复中第三组分的斜率和/或时间常数、由视杆细胞介导的第二和第三组分之间的过渡时间及由漂白至最后阈值测量的持续时间。用于测量暗适应的方法是本领域已知的,包括us7,494,222和us7,798,646所定义的那些方法,将其内容引入到本申请中作为参考。可基于对受试者在治疗后的暗适应速率与受试者的基线速率进行比较来确定暗适应速率的改善。对暗适应的治疗作用还可使用患者所主观报告的结果来监测,所述结果记录了日常活动中与受试者的视觉当由光亮环境转换至黑暗环境时实现暗适应的速率相关的改善。在本申请治疗方案的一个实施方案中,与受试者的基线暗适应速率相比,受试者的暗适应速率在最初给药期内是改善的。在一些实施方案中,与受试者在最初给药期结束时的暗适应速率相比,受试者的暗适应速率在休止期内继续改善。在一些实施方案中,受试者暗适应速率的改善在休止期内约保持在受试者在最初给药期结束时的暗适应速率。在一些实施方案中,受试者暗适应速率的改善在休止期内保持在处于受试者基线暗适应速率以上的水平。10.运动视觉运动视觉可用于对改善的视网膜功能进行测量。运动视觉的改善可通过本领域已知的方法来确定,包括标准化障碍路线和迷宫且参见bainbridgeetal.,nengljmed.358:2231-9(2008)和maguire,a.m.etal.,newengljmed.358:2240-2248(2008)。可基于完成路线的时间或基于与所存在的障碍物总数相比受试者撞到障碍物或偏离路线的次数对受试者进行评价。还可基于患者所主观报告的结果对运动视觉进行监测。关于运动性改善的主观报告可用于通过对受试者在治疗后和在休止期内所报告的运动性与受试者所报告的基线运动性进行比较来监测治疗作用。11.视觉功能问卷可在一些研究探访时将问卷交给受试者以评价视觉功能及其对日常活动的影响。有多种已知的视觉功能问卷(vfq),其可用于评价受试者视觉功能的改善。一种这样的问卷为儿童视觉功能问卷(cvfq)(参见例如birch,e.e.etal.,j.aapos.11:473-9(2007))。该问卷为关于视觉相关生活质量的问卷,其被设计成供婴儿和年少儿童的父母所使用。低亮度问卷(llq)为已经被具体开发以评价成人在低照明(例如夜间或黑暗房间)条件下的视觉功能的问卷(参见例如owsley,c.etal.,investophthalmolvissci47:528-535(2006)。与适于下述临床研究的群体类似地,该问卷在年龄较大的rp受试者群体中被证实是有效的且与由视杆细胞介导的暗适应参数是关联的。还可使用视觉缺损影响(ivi)问卷和儿童视觉缺损影响(ivi_c)问卷。这些问卷被开发且在患有低视觉的人们中被证实可有效地测量视觉缺损对日常活动受限参与的影响。vfq的使用有助于通过对受试者在治疗后和在休止期内的问卷结果与受试者的基线问卷结果进行比较来鉴定视觉功能的主观改善,特别是就通过本申请所述治疗方案而给药本申请化合物后的日常活动而言。12.谱域-光学相干断层成像术光学相干断层成像术(oct)/自发荧光(faf)仪器例如heidelbergspectralis(heidelbergengineering,germany)可用于进行眼部断层成像术扫描。对扫描的分析可提供关于整体视网膜健康情况的信息,包括使光感受器层和外节可视化及对视网膜的厚度进行测量和评价自发荧光的有无。视网膜健康情况的改善可通过对受试者的基线oct和faf扫描与受试者在最初给药期后的oct和faf扫描进行比较来评价。受试者的基线oct和faf扫描可与受试者在最初给药期前和在最初给药期后的视觉功能是关联的。所提供的以下实施例仅用于说明本申请各个方面且不应该被理解为以任何方式来限制本申请。实施例实施例1:安全性研究在20名健康人类志愿者中进行针对口服递送的本申请药用组合物的标签公开的重复剂量递增研究以确定重复每天口服剂量的组合物的安全性和耐受性,所述组合物包含溶解在大豆油(usp)中的9-顺式-视黄醇乙酸酯(乙酸(2e,4e,6z,8e)-3,7-二甲基-9-(2,6,6-三甲基环己-1-烯-1-基)壬-2,4,6,8-四烯-1-基酯)和丁羟茴醚(bha)。对9-顺式-视黄醇乙酸酯在组合物中的浓度进行调整,从而使待给药的体积是方便的。针对研究的给药范围而制备9-顺式-视黄醇乙酸酯的浓度为1.25mg/ml、5.0mg/ml和20mg/ml的组合物,其含有0.10%w/wbha/大豆油(usp)。6个剂量组的健康受试者口服接受递增每天剂量的组合物(由1.25mg/m2至40mg/m2即1.25、2.5、5、10、20和40mg/m2)。18名受试者接受用研究组合物进行的全部7天治疗且2名受试者出现错过的剂量。受试者的平均年龄为37岁(范围为23-59岁)。发现浓度高达40mg/m2的组合物是良好耐受的且在i期试验中心在受到监测的7天治疗后没有出现严重的不良事件。所报告的最常见副作用为头痛(6名受试者/12次事件)、面红(2名受试者/7次事件)和面灼热感(2名受试者/6次事件),其主要报告自40mg/m2剂量组且总共占所报告的43次不良事件(ae)中的25次(58%)。总的来说,43次ae中41次的强度为轻度。就一些受试者而言,在所有剂量条件下都出现甘油三酯的中度可逆升高且在10-40mg/m2剂量条件下出现高密度脂蛋白(hdl)的中度可逆降低。实施例2:在rp患者中进行的研究研究方案研究被设计成用于确定实施例1的组合物当口服给药于人类rp受试者时的有效性,所述人类rp受试者患有由于lrat突变或rpe65突变而引起的rp(也称为早发型rp)。17名rp受试者历时7天口服接受每天一次剂量的组合物(40mg/m2)。对每名rp受试者的两只眼睛分别进行评价。方案所定义的视觉功能评价包括使用早期治疗糖尿病性视网膜病研究(etdrs)的最佳矫正视力测试、视野测试、全视野视网膜电图(erg)、视网膜敏感性(fst)、动态瞳孔测量法、眼球震颤测试、oct和faf及受试者问卷。在21天研究的第0天进行基线视觉功能测试(包括低亮度条件下的谱域oct)以确定在视网膜中是否存在具有活力的光感受器。每名rp受试者在第0天接受第一剂量的组合物。治疗连续进行7天(第0天至第6天且包括第0天和第6天)。在第7/8、14/15、30和60天及此后每两个月对rp受试者进行随访直到符合重复治疗标准。在第7/8天(接受最后剂量后的24/48小时)及在所有后续探访时进行所有视觉功能测试和安全性评价。对2名rp患者进行的最初和初步有效性评价在2名患有rp的人类受试者中对实施例1的组合物的有效性进行最初测试。2名受试者历时7天接受每天一次最初剂量的组合物(40mg/m2)。以门诊标准对受试者进行治疗,但是他们在研究诊所中在对每天的治疗进行医疗监督的情况下接受研究治疗。在研究期间需要受试者限制剧烈的身体活动(以避免实验室变异性)且避免过度的维生素a摄入以减小上述因素在该研究中对评价安全性变量的影响。对每名受试者的两只眼睛进行分开评价。方案所定义的视觉功能评价包括先后使用早期治疗糖尿病性视网膜病研究(etdrs)测试和低/高对比度史密斯-凯特尔韦尔研究所低亮度(skill)表的最佳矫正视力测试、使用戈德曼视野检查的视野测试、全视野视网膜电图(erg)和全视野刺激阈值测试(fst)。将基线erg、etdrs和skill测试重复进行两次。在治疗期间和在治疗后第1、7、9/10和14/15天进行视觉功能测试。受试者无需在一只或两只眼睛上佩戴眼罩。受试者id010110为在lrat基因中在c.525t>a;p.ser175arg处患有rp纯合突变的27岁男性。他的基线etdrs视力为71个字母od和60个字母os(等价于约20/40和20/62.5斯内伦)(肉眼)。受试者用40mg/m2组合物a治疗7天。观察到etdrs视力的小幅改善,其中相对于基线的最高改善为第9天的11.5个字母(od)和第1.5个月的14.5个字母os。检测到gvfod的大幅改善且被主观报告的周边视觉改善所支持。在治疗前后使用fmri对皮质视觉功能进行客观测试,其中观察到显著的改善。没有观察到视锥细胞或视杆细胞erg发生变化。受试者报告了日常活动的有意义改善。对日光和荧光灯的敏感性是明显的。暗适应时间也是改善的。在治疗期结束后历时1.5个月对患者进行监测,其中相对于基线的改善是持续的。受试者id010111为在lrat基因中在c.181t>a3;p.tyr61asp处患有纯合突变的41岁男性。他的基线etdrs视力为0个字母od和1.5个字母os。受试者用40mg/m2组合物a治疗7天。在一只眼睛中观察到etdrs视力的变化,其中相对于基线的最高改善为第14天的24.5个字母(od)和0变化(os)。对17名rp患者进行的暂时性30天安全性和有效性评价对总共17名rp受试者[年龄范围为6-55岁、平均年龄为29岁且患有rpe65突变(12名rp受试者)或lrat突变(5名rp受试者)]进行评价,其中基线va和gvf值参见表1。对每名rp受试者的两只眼睛进行独立评价。左眼的视力(va;etdrsbcva)范围为0-62个字母(os)[平均为29.5个字母(~20/250)]且右眼的视力(va;etdrsbcva)范围为0-71个字母(od)[平均为32.1个字母(~20/200)]。左眼的视野(gvf)范围为0.28-2.46[平均log视网膜面积为1.7]且右眼的视野(gvf)范围为0.48-2.53[平均log视网膜面积为1.8]。表117名rp受试者中总共13名在基线时报告了夜盲症,其中大部分rp受试者将夜盲症列为rp的第一症状:5名rp受试者在生命的第一年、3名rp受试者在2-4岁且1名rp受试者在17岁。17名rp受试者中的11名报告了视野丧失,而17名rp受试者中的12名报告了视力恶化。对两个数据组即意向治疗(itt)组和可评价(方案治疗)组进行gvf分析,所述意向治疗(itt)组包括全部17名rp受试者,所述可评价(方案治疗)组包括符合主要准入/排除标准的rp受试者。对于每名rp受试者,两个基线测量值用于鉴定一个vf目标物以对vf随时间的变化进行评价,所述vf目标物所提供的vflog视网膜面积与范围0.7-2.4logmm2的中点1.5logmm2最接近。使用混合作用模型对log视网膜面积在所选目标物大小情况下的变化进行评价,所述混合作用模型使用每只眼睛的log视网膜面积。在分析中考虑同一名rp受试者的两只眼睛之间的关联性和关联度。将gvf响应者定义为与其基线测量值相比眼睛具有改善至少20%的vf。在该研究中在17名rp受试者中观察到三种不同的视野模式。1.典型的较不晚期的rp(9名rp受试者),其表现出可用v4e目标物检测到的大于20度的vf。该模式与lca受试者的vf基线是类似的。平均年龄为20.9岁(范围为6-30岁)。2.非典型的rp(3名rp受试者,相同的rpe65突变-c,179;pleu60pro纯合):在v4e的情况下大于20度的大vf和降低的中央敏感性。这些rp受试者仅能在黄斑中/在中心凹处检测到v4e。平均年龄为34.5岁(范围为29-37岁)。3.典型的rp/晚期的变性:在v4e的情况下小于20度的小vf或在v4e的情况下小于20度的小vf和降低的中央敏感性,其中仅在黄斑中/在中心凹处检测到v4e目标物。平均年龄为39.2岁(范围为28-55岁)。图2总结了对治疗具有响应的gvf响应者在itt组和方案治疗组中的比例。基于就分析而选择的等视力线,响应者在itt组中的比例在第7天为44.1-50%、在第14天为38.2-44.1%且在第30天为35.5-41.9%。也基于就分析而选择的等视力线,响应者在可评价(方案治疗)亚组中的比例在第7天为51.7-60.7%、在第14天为44.8-53.6%且在第30天为34.6-40%。当基于vf基线严重度将这些组进一步分开时,在itt组和方案治疗组(图3包括全部受试者且图4排除3名受试者)中在严重度最低的亚组中发现较高百分比的响应者。给药7天后,可评价(方案治疗)rp受试者(n=14)中gvf相对于基线的平均面积显示出统计学上显著的改善即在第7天改善34%(p=0.005)和在第14天改善29%(p=0.02)且趋向于统计学上显著的改善即在第30天改善23%(p=0.07)。在itt组(n=17)中,gvf相对于基线的平均面积在第7天改善22%(p=0.03,统计学上显著的)、在第14天改善16%(p=0.13)和在第30天改善18%(p=0.096)(图5)。图6显示了对治疗具有响应的gvf响应者在itt组中的百分比,其中响应者被定义为以下患者/眼睛,其中视网膜面积相对于平均基线值在1个月内的2次相连随访时增加至少20%。17名rp受试者中的9名(53%)在至少一只眼睛中显示出bcva相对于基线的改善,其程度大于或等于5个etdrs字母。如表2所示,通过人口统计学将va响应进一步分开以评价对治疗可能更敏感的亚群。在第7天,27%眼睛具有≥5个etdrs字母的va改善,其中15%眼睛改善≥5至<10个字母且12%眼睛改善≥10至o<15个字母。在第14天,37%眼睛具有≥5个etdrs字母的va改善,其中28%眼睛改善≥5至<10个字母且6%眼睛改善≥10至<15个字母且3%眼睛改善≥20个字母。在第30天,34%眼睛具有≥5个etdrs字母的va改善,其中19%眼睛改善≥5至<10个字母且15%眼睛改善≥10至<15个字母。当基于基因突变对5名患有lrat突变的rp受试者进行评价时,40%眼睛在第7天改善≥5、在第14天改善60%且在第30天改善50%。对于12名患有rpe65突变的rp受试者,21%眼睛在第7天改善≥5、在第14天改善23%且在第30天改善30%。图7显示了va相对于基线的平均变化即etdrs字母得分改善。在第7天、第14天和第1个月发现全部受试者(itt组)的va平均改善分别为3+/-1个字母、3.9+/-0.9个字母和3.2+/-1.2个字母。可评价亚组[被定义为排除一名受试者的一只眼睛和另一名受试者的两只眼睛(所具有的基线va都为0个字母)]具有分别为3.5+/-1.2个字母、4.8+/-1.5个字母和3.3+/-1.3个字母的va平均改善。表2:以基线值分类的va应答**va相对于基线在第7天和第1个月之间的2次相连探访时的变化≥5个字母。图8a显示了va响应者在itt组中的比例,其中响应者被定义为相对于基线的改善大于或等于5个字母且若基线为0,则响应者被定义为好于基线的任何情况。图8b显示了当可评价亚组排除了基线为0的眼睛(即一名受试者的一只眼睛和另一名受试者的两只眼睛由于所具有的基线va=0而被排除)时va响应者的比例。图9显示了当响应者被定义为在1个月内的2次相连探访时相对于基线的改善大于或等于5个字母且在基线为0的情况下响应者被定义为在1个月内的2次相连探访时好于基线的任何情况时va响应者在itt组中的百分比。基线视觉功能显示出宽范围的与重度视网膜变性一致的严重降低的基线bcva(0-65个字母)和vf(6-75度)。在rp受试者的小亚组中测量了治疗对以下几个参数作用:暗光(夜间视觉)中的光敏度、瞳孔反射和视觉皮质对视觉刺激潜在变化的响应(功能性磁共振成像,fmri)。该研究中的fmri亚研究(n=2)显示出视觉和顶叶大脑皮质中几个先前平静的区域在治疗后的激活(例如如在第11天所测量的那样)。完成研究的几名rp受试者自发报告了夜间视觉的改善。对全部rp受试者进行安全性评价以提供基线(治疗前)和给药后的测量值。在第-1天及在治疗日给药前和给药后4小时在筛选时对生命体征进行评价。在第-1天及第3和7天在筛选时一式三份地进行ecg记录和临床实验室测试。还在第14/15天和每次后续探访(若rp受试者在前次探访时具有进行中的临床上显著的异常结果)时进行安全性评价。所进行的临床实验室测试包括血液学、血清化学(包括总胆固醇、甘油三酯、hdl和ldl)和尿分析。对安全性分布进行的分析表明所述研究治疗是良好耐受的,其中安全性结果与健康成人志愿者中的结果(参见实施例1)是一致的。观察到对脂质代谢的作用(维甲酸类的一种公知作用类型)。临床上显著的实验室结果在休止期内在很大程度上返回到基线。其它不良事件包括轻度至中度头痛(其对于大多数受试者到7天治疗期结束时消退)、恶心(其在1天内消退)和畏光。由于lrat突变和rpe65突变而患有早发型rp的rp受试者中的初步结果证实一些视觉功能参数在7天疗程后实现快速和显著的改善且安全性分布是可接受的。实施例3:在lca受试者中进行的安全性和有效性研究实施例2的研究还被设计成用于确定实施例1的组合物当口服给药于患有lca(由于lrat突变或rpe65突变而引起)的人类受试者时的有效性。受试者历时7天口服接受每天一次负荷剂量的所述组合物(40mg/m2)。以门诊标准对受试者进行治疗,但是他们在研究诊所中在对每天的治疗进行医疗监督的情况下接受研究治疗。对每名受试者的两只眼睛进行分开评价。方案所定义的视觉功能评价包括先后使用早期治疗糖尿病性视网膜病研究(etdrs)测试和低/高对比度史密斯-凯特尔韦尔研究所低亮度(skill)表的最佳矫正视力测试、使用戈德曼视野检查的视野测试、全视野视网膜电图(erg)和全视野刺激阈值测试(fst)。将基线erg、etdrs和skill测试重复进行两次。在治疗期间和在治疗后第1、7、9/10和14/15天进行视觉功能测试。对实施例2中的9名lca患者及2名rp患者的初步有效性数据进行的总结如表3所示,对总共11名受试者进行研究,其包括两种突变类型(lrat和rpe65)、两种疾病类型(lca和rp)、不同的年龄范围(6名受试者为6-15岁且5名受试者为21-41岁)和宽范围的基线视觉功能。建立四种不同范围的基线va:手部运动和光感、范围为0-20个字母的va、范围为20-50个字母的va及范围为50-70个字母的va。在具有适当水平的视网膜功能(范围为20-40个字母的va)的患者中观察到va改善中的最大响应,所述患者都用40mg/m2所述组合物进行治疗(图10)。在较年轻的患者(10-13岁)中观察到最佳响应即3行改善。在给药后长达14个月对11名受试者的视力与基线相比的相对改善进行监测,其证实临床上有意义的改善是持续的(图11)。表3对所治疗的前9名患者在第14天的gvf进行的ama低视力网格分析表明当用较小的i4e目标物(图12)或较大的v4e目标物(图13)进行检测时,9名患者中的7名显示出显著的改善。使用儿童视觉功能问卷(cvfq)或低亮度问卷(llq)而得到的初步数据已经与所主观报告的日常活动改善组合起来且支持了视觉功能的快速改善和用所述组合物进行的治疗所带来的长期治疗益处。所述研究治疗是良好耐受的。与治疗相关的不良事件在全部受试者中包括暂时性畏光和头痛、呕吐、甘油三酯水平的中度升高和hdl水平的降低趋势。如表4-7所示,发现对脂质代谢的作用(维甲酸类的一种公知作用类型)在第7给药日达到最大,但是在治疗后的4周内返回到基线。与较低剂量的10mg/m2组相比,所有不良事件(包括对脂质代谢的作用)在40mg/m2组中是较显著的。表4:甘油三酯10mg/m2(n=2)40mg/m2(n=9)总计(n=11)基线0.3±0.01.0±0.50.9±0.5第3天0.5±0.31.5±0.71.3±0.8%变化57.1%55.8%56.0%第7天0.6±0.22.0±0.81.7±1.0%变化66.1%113.4%103.9%第9天0.41.6±0.61.5±0.8%变化17.6%82.2%73.0%第14天-1.2±0.51.2±0.5%变化-12.0%12.0%表5:hdl10mg/m2(n=2)40mg/m2(n=9)总计(n=11)基线1.3±0.11.1±0.21.1±0.2第3天1.2±0.20.9±0.21.0±0.2%变化-6.3%-16.2%-13.7%第7天1.2±0.20.8±0.10.9±0.2%变化-2.5%-20.1%-16.6%第9天1.31.0±0.11.0±0.2%变化-2.9%-5.6%-5.0%第14天-1.1±0.21.1±0.2%变化-5.8%5.8%表6:胆固醇10mg/m2(n=2)40mg/m2(n=9)总计(n=11)基线4.3±0.04.0±0.74.1±0.7第3天4.3±0.23.8±0.63.9±0.6%变化-1.2%-1.3%-1.3%第7天4.5±0.34.3±0.64.3±0.6%变化3.4%11.6%9.9%第9天4.54.5±0.84.5±0.7%变化2.8%23.2%20.3%第14天-4.7±0.64.7±0.6%变化-18.1%18.1%表7:ldl实施例4:在rp和lca受试者(包括实施例2和3中的那些rp和lca受试者)中进行的最终有效性评价在所述研究中有总共32名受试者准入:14名lca受试者和18名rp受试者。所有lca和rp受试者完成7天治疗期。所有lca受试者具有至少6个月随访,其中12名lca受试者(86%)具有至少12个月随访且2名lca受试者(17%)具有至少2年随访。rp受试者的随访期趋向于比lca受试者的随访期短,这是因为rp受试者趋向于较晚地进入到所述研究中且在他们达到12个月时间点前具有进入到重复治疗研究中的选择(以下实施例6)。所有rp受试者具有至少2个月随访且13名受试者(72%)具有8个月随访。在第8个月后不再探访rp受试者。整个研究群体具有23.9岁的平均年龄(范围为6-55岁)且大部分为女性(56%)和高加索人(56%)。lca受试者[平均年龄为18岁(范围为6-38岁)]平均比rp受试者[平均年龄为28岁(范围为6-55岁)]年轻。14名lca受试者中的9名在18岁以下,而18名rp受试者中的2名在18岁以下。lca群体主要为女性(71%),而rp群体是较平衡的(44%为女性)。两个群体的种族组成是类似的,其中lca群体为50%高加索人、21%亚洲人、21%西班牙人和7%其他(叙利亚人),而rp群体为61%高加索人、33%亚洲人和6%西班牙人。在整个研究群体中,20名受试者(63%)具有缺乏的rpe65,而12名受试者(38%)具有缺乏的lrat。lca群体中患有每种基因突变的受试者是相等数目的,而rp群体具有较高发病率的rpe65缺乏(13名受试者,72%)。接受10mg/m2剂量的两名lca受试者都为患有rpe65缺乏的女性西班牙人青少年。年龄范围为6至38岁、平均年龄为17.9岁且患有rpe65突变(7名受试者)或lrat突变(7名受试者)的14名lca受试者用va和gvf基线水平进行评价。视力(va;etdrsbcva)就左眼(os)而言范围为0-68个字母且平均为30.3个字母(~20/250)且就右眼(od)而言范围为0-64个字母且平均为30.3个字母(~20/250)。针对每名受试者而选择的最佳主要等视力线所相应的视野(gvf)就左眼而言范围为0.62-2.81且平均log视网膜面积为2.0且就右眼而言范围为0.68-2.83且平均log视网膜面积为2.0。年龄范围为6至55岁、平均年龄为28.5岁且患有rpe65突变(13名rp受试者)或lrat突变(5名rp受试者)的18名rp受试者用图2所描述的va和gvf结果进行评价。对每名rp受试者的两只眼睛进行独立评价。视力(va;etdrsbcva)就左眼(os)而言范围为0-62个字母且平均为30.4个字母(~20/250)且就右眼(od)而言范围为0-71个字母且平均为30.4个字母(~20/250)。针对每名受试者而选择的最佳主要等视力线所相应的视野(gvf)就左眼而言范围为0.40-2.53且平均log视网膜面积为1.8且就右眼而言范围为0.48-2.53且平均log视网膜面积为1.8。在itt分析(包括所有lca和rp受试者)中,绝大部分lca受试者(14名中的10名,71%)在至少一只眼睛中具有增加至少20%的视网膜面积,其中响应的平均持续时间为269天(范围为5-801天)。7名lca受试者(50%)在两只眼睛中具有增加至少40%的视网膜面积,其中响应的平均持续时间为275天(范围为7-801天)。与缺乏lrat的lca受试者相比,缺乏rpe65的lca受试者较可能具有响应,但是响应的持续时间就两种突变而言是类似的。对于rp受试者,18名受试者中的8名(44%)在至少一只眼睛中具有增加至少20%的视网膜面积,其中响应的平均持续时间为72天(范围为7-253天)且2名受试者(11%)在两只眼睛中具有增加至少40%的视网膜面积,其中响应的平均持续时间为80天(范围为16-174天)。响应速率就两种基因突变而言是类似的,但是与缺乏rpe65的眼睛相比,响应的持续时间在缺乏lrat的眼睛中是基本较长的(缺乏lrat的眼睛和缺乏rpe65的眼睛分别具有123天至少20%响应和49天至少20%响应且缺乏lrat的眼睛和缺乏rpe65的眼睛分别具有104天至少40%响应和67天至少40%响应)。进行因果分析以确定在6个月的治疗中出现gvf响应的初始时间。gvf响应的中值初始时间对于至少20%响应为7天且对于至少40%响应为9天。12名rp受试者(67%)在至少一只眼睛中具有相对于基线至少5个字母的va增加且1名rp受试者(6%)在两只眼睛中具有至少10个字母的增加。通过比较可知6名lca受试者(43%)在至少一只眼睛中具有相对于基线至少5个字母的va增加且3名lca受试者(25%)在两只眼睛中具有至少10个字母的增加。va响应≥5个字母和≥10个字母的平均持续时间在lca眼睛中(对于≥5个字母和≥10个字母的响应分别为313和316天(范围为5-801天))比在rp眼睛中(分别为125天(范围为13-246天)和112天(范围为13-206天))高。va响应速率在缺乏lrat的rp受试者中比在缺乏rpe65的rp受试者中高。视力响应的中值初始时间对于至少5个字母的响应为8天且对于至少10个字母的响应为7天。接受10mg/m2qlt091001的2名lca受试者在两只眼睛中具有增加至少40%的gvf视网膜面积;然而,这些受试者都不具有va响应。相对于基线的变化均值和中值在整个研究过程中保持正性。lca受试者中va相对于基线的变化均值是随时间而高度变化的,其范围为0.5至6.6个字母。相对于基线的变化中值是较一致的,特别是在第2个月探访后当他们的范围为2-3个字母时。rp受试者中va相对于基线的变化均值在第14天探访时的范围为3-4个字母且中值的范围为1-3.5个字母;均值和中值都显示出随时间而稍微向下的趋势(图14)。可评价分析(其包括符合主要准入/排除标准的受试者)的结果通常与itt分析是类似的。对一些受试者进行其它有效性评价(包括全视野erg、全视野敏感性和颜色视觉),然而就研究群体而言没有足够的数据来得出结论。在研究期间对每天接受10mg/m2每天剂量治疗的2名lca受试者及历时7天接受40mg/m2每天剂量治疗的6名lca受试者和18名rp受试者进行选择性血浆浓度监测。药代动力学分析显示主要代谢物为9-顺式-视黄醇油酸酯或9-顺式-视黄醇棕榈酸酯和13,14-二氢-9-顺式-视黄酸。在给药后4小时,这些化合物的浓度高于9-顺式-视黄醇乙酸酯和9-顺式-视黄醇的浓度。儿童视觉相关生活质量问卷的结果没有显示出一致的治疗后改善;然而,由于响应者的数目是小的,因此对所述结果进行解释是困难的。成人所答复的llq在lca受试者的所有视觉功能亚类中都显示出均值得分的提高。rp受试者除最大照明外的视觉功能亚类是变化但无一致性趋势的,在所述最大照明中能力随研究过程而稍微降低。基线sd-oct(spectralishra+oct)参数与基线视觉功能是相应的;基线sd-oct和变化与视野对治疗的响应是相应的。用手动分节所辅助的计算机程序对外节(os)层的平均厚度(由外节/视网膜色素上皮细胞边缘测量至内节椭球带)进行计算。62只眼睛中的39只具有≥20个字母(20/400或更好)的基线va。其中36只(92%)在中心凹中具有可容易检测到的os(厚度>10μm)。28只lca眼睛中的18只(64%)和34只rp眼睛中的15只(44%)对治疗具有响应(gvf视网膜面积在2次相连的研究探访时的增加程度≥20%)。对于这些响应者,lca组中os层的平均基线厚度(中央20°)为14.22μm(与正常均值[32μm]相比减少56%)且rp组中os层的平均基线厚度(中央20°)为8.63μm(与正常值相比减少73%)。两组中的非响应者都具有小于5.72μm的os平均基线厚度(与正常值相比减少>82%)。对于lca组,os厚度在中央20°中的减小在非响应者中显著高于在响应者中(p=0.003),但是在rp组中没有显著性差异(p=0.27)。在基线时测量的中央20°中的os厚度在随访期间没有显著变化。历时7天用高达40mg/m2进行的治疗是良好耐受的。研究所准入的所有受试者都经历至少一种与治疗相关的不良事件(ae)。最常见的相关ae依次为头痛(88%受试者)、畏光(50%)和升高的血液甘油三酯(31%)。治疗在少数受试者中引起多种实验室参数相对于正常值的短期偏离。这些参数中的大多数在所有受到影响受试者中到第14天或第1个月时返回到正常值。胆固醇和tg到第2个月时返回到正常值且血细胞比容到第4个月时返回到正常值。实施例5:对多剂量给药进行的安全性研究随机的标签公开的安慰剂对照的平行设计的多剂量研究被设计成用于对实施例1的组合物当在健康人类志愿者中多剂量口服给药时的安全性、耐受性和药代动力学进行研究。35名受试者被准入。研究包括以下受试者,其接受4个(安慰剂组和20mg/m2组)或6个(40mg/m2组和60mg/m2组)连续的28天给药/清除周期(7天给药和21天清除)。最后一个周期后,受试者被随访2个月。受试者在每个周期内历时7天接受治疗剂量[包括以20mg/m2、40mg/m2或60mg/m2口服给药每天一次剂量的实施例1的组合物(9-顺式-视黄醇乙酸酯和0.1%丁羟茴醚(bha)在大豆油中)(usp))]或安慰剂,然后经历21天休止期,在此期间受试者不接受治疗。在周期内对受试者中的各种不良事件例如头痛、面红和面灼热感进行定期监测。还对受试者中与治疗相关的毒性例如甘油三酯的升高和高密度脂蛋白(hdl)的降低进行监测。所观察到的不良事件包括头痛、畏光、恶心、alt升高、甘油三酯升高和ast升高。在研究中没有观察到新的或预料不到的不良事件。多达6个重复治疗周期(实施例1的组合物以20mg/m2/天、40mg/m2/天和60mg/m2/天的剂量给药7天且然后为21天清除期)通常是安全和良好耐受的。重复治疗周期的安全性分布与一个治疗周期的安全性分布是类似的,其中整体趋势是在每个后续给药周期内不良事件的严重度是降低的。该研究的安全性结果还支持了包含9-或11-顺式视黄酯的药用组合物(包括实施例1的口服组合物)的重复给药在患有rp的受试者中用于间歇给药周期。所述研究的暂时性药代动力学结果来自在整个研究过程中在所规定的时间点测量的9-顺式-视黄醇乙酸酯及其代谢物的血浆浓度。该暂时性pk分析的范围涵盖在第1、2和3个治疗周期内得自第1组的样品,所述第1组包括安慰剂组(n=2)、40mg/m2剂量组(n=6)和60mg/m2剂量组(n=2)。血浆样品中的母体药物和潜在代谢物通过液相色谱-质谱-质谱(lc/ms/ms)来分析。非房室(nca)药代动力学(pk)参数例如auc使用winnonlin软件通过观测cmax、tmax和浓度高于基线的持续时间(td)来得到。9-顺式-视黄醇乙酸酯的血浆浓度是低和暂时的,这表明快速的首过代谢,其中进一步代谢成非极性和极性代谢物。当在所重复的7天周期内以40mg/m2给药时,9-顺式-视黄醇和视黄酯代谢物在多剂量的情况下稍微显示出适当的积累,其中根据在第1天做出的预期而在第7天具有较高的auc值。较持久的代谢物具有提高的每天cmin值,其与适当的积累是一致的且这些模式和浓度在第1、2和3个周期内是类似的,其中在各个周期之间没有观察到积累。实施例6:重复治疗在患有rpe65遗传性缺乏或lrat遗传性缺乏的受试者中对安全性和视觉结果的作用该研究被设计成用于研究重复治疗如何影响多达3个额外疗程的实施例1的组合物当历时7天每天一次口服给药于由于rpe65或lrat的遗传性缺乏而患有lca或rp的人类受试者时的安全性和有效性。所述研究还被设计成用于评价多达3个额外疗程的治疗能否在这些受试者中保持或改善视觉功能。所述研究准入多达约28名由于rpe65或lrat缺乏而患有lca或rp的受试者。患有lca的受试者为5-65岁(包括5和65岁)且患有rp的受试者为18-65岁(包括18和65岁)。所有受试者根据实施例2的研究方案而已经先前接受7天疗程且完成第30天探访。受试者在开始实施例2的7天疗程后至少1个月满足以下标准之一:a)随访gvf在至少一只眼睛中相对于基线的增加程度≤20%;或b)随访gvf在最高先前响应以下的降低程度>20%;或c)基于对其它视觉功能参数进行回归或基于其它视觉功能参数有无响应而考虑接受重复治疗的合理候选者,但是所述受试者不满足其它(gvf)标准。受试者在每个疗程内将历时7天接受每天一次口服剂量的实施例1的组合物。口服剂量对于在开始7天疗程后至少1个月针对至少一只眼睛的随访gvf没有增加(即相对于基线的增加≤20%)(先前用10mg/m2剂量进行治疗的受试者)或在最高先前响应以下的降低程度>20%(最初用10或40mg/m2进行治疗的受试者)的受试者将为40mg/m2;对于在开始7天疗程后至少1个月针对至少一只眼睛的随访gvf没有增加(即相对于基线的增加≤20%)(最初用40mg/m2进行治疗的受试者)的受试者将为60mg/m2;或对于被认为是接受重复治疗的合理候选者的受试者将为40或60mg/m2。受试者将接受多达3个疗程的研究治疗。在先前疗程的最后一天和下一个疗程的第一天之间需要最少3周。在开始第一个和第二个疗程后第30天(±3天)为了决定是否进行重复治疗而将对安全性和视觉结果数据进行评价。若没有安全性问题且在该研究中的第一个疗程后针对至少一只眼睛的随访gvf没有增加(即相对于研究基线的增加≤20%)或针对至少一只眼睛的随访gvf在最高先前响应以下的降低程度>20%或受试者没有满足gvf标准,但是基于(1)对其它视觉功能参数(例如所主观报告的颜色视觉变化或对低亮度的适应)进行回归或其它视觉功能参数(例如所主观报告的颜色视觉变化或对低亮度的适应)有无响应;或(2)gvf在gvf响应保持不变的情况下具有进一步改善的潜力而被认为是接受重复治疗的合理候选者,则受试者将接受剂量为40或60mg/m2的第二个疗程(历时7天每天一次剂量的实施例1的组合物)。若没有安全性问题且在第二个疗程后针对至少一只眼睛的随访gvf在最高先前响应以下的降低程度>20%或受试者没有满足gvf标准,但是基于(1)对其它视觉功能参数(例如所主观报告的颜色视觉变化或对低亮度的适应)进行回归或其它视觉功能参数(例如所主观报告的颜色视觉变化或对低亮度的适应)有无响应;或(2)gvf在gvf响应保持不变的情况下具有进一步改善的潜力而被认为是接受重复治疗的合理候选者,则受试者将接受剂量为40或60mg/m2的第三个疗程(历时7天每天一次剂量的实施例1的组合物)。基于在第30天(±3天)所评价的重复治疗标准而没有接受重复治疗的受试者将继续被随访。这样的受试者可在先前疗程后12个月内的任何后续随访时开始下一个疗程,条件是没有安全性问题且受试者满足就第2个疗程或第3个疗程所规定的重复治疗标准。将进行基线视觉功能测试。每名受试者在第0天将接受第一剂量的实施例1的组合物。治疗将历时7天连续进行(第0天至第6天且包括第0天和第6天)。将就第一个和最后一个剂量而收集用于研究药物和代谢物分析的血液样品(即在第0天和第6天给药后4小时及在第1天和第7天早餐前)。受试者将在第7/8、14/15和30天及第2、4、6、8、10和12个月针对每个疗程或在开始下一个疗程前被随访。方案所定义的视觉功能评价将包括使用etdrs的最佳矫正视力测试、视野测试、全视野视网膜电图(erg)、视网膜敏感性(fst)、动态瞳孔测量法、眼球震颤测试、oct、faf和受试者问卷。所提供的以上实施例用于说明而非限制权利要求书的范围。本申请其它变体对于本领域技术人员将是显而易见的且被权利要求书所涵盖。将本申请所引用的所有公开出版物、专利、专利申请和其它参考文献都引入到本申请中作为参考。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1