用于T细胞免疫疗法的组合及其用途的制作方法
本发明涉及t细胞与双特异性t细胞活化抗原结合分子的组合及在免疫疗法(例如在癌症的治疗中)中使用所述组合的方法。
背景技术:
在临床上,为治疗疾病,通常需要选择性摧毁个体内的个别细胞或特定细胞类型。以癌症疗法为例,其主要目标为特异性地摧毁肿瘤细胞,同时不使健康细胞及组织受伤害。
为实现这个目标,已开发出多种可用于t细胞介导免疫疗法的双特异性抗体。双特异性t细胞衔接子(bispecifictcellengager(bite))即为一种经充分研究且已在临床中显示其前景(holliger等人,蛋白质工程(proteng),9,299-305(1996)、kipriyanov等人,分子生物学杂志(jmolbiol),293,41-66(1999)、nagorsen及
wang及riviere(癌症基因疗法(cancergenether.),22,85-94(2015))公开t细胞可作为对抗癌症的治疗剂,其将以离体方式扩增的肿瘤特异性细胞再输注入患者中。嵌合抗原受体(chimericantigenreceptor,car)是一种针对抗原的重组受体,其具有将t细胞及其它免疫细胞重定向(redirect)的特异性及功能。其在癌症免疫疗法中使用的一般前提是迅速生成靶向肿瘤的t细胞,绕过主动免疫的障碍。一旦car在细胞中表达,所述car修饰的t细胞就成为靶向肿瘤的t细胞,并可在患者中发挥实时及长期效应。但car技术仍受限于t细胞的来源必须是患者本身,且必须先将car转导到t细胞中形成cart细胞,所述cart细胞还需长时间来增殖才能再自体移植(autologoustransplant)到病患体内。
因此在t细胞免疫疗法领域中,仍需要可改善治疗效果的技术及方法。
技术实现要素:
本发明惊人地发现双特异性t细胞活化抗原结合分子可与效应子记忆型γ9δ2t细胞(effectormemoryγ9δ2tcells)共同投予病患,并可协成性地增进免疫疗法的疗效。
因此,本发明的一目的是提供一种治疗个体中的疾病的方法,其包括投予所述个体有效量的双特异性t细胞活化抗原结合分子及有效量的效应子记忆型γ9δ2t细胞。
本发明的一另目的是提供一种组合,其包括治疗有效量的双特异性t细胞活化抗原结合分子及治疗有效量的效应子记忆型γ9δ2t细胞。
本发明的另一目的是提供一种效应子记忆型γ9δ2t细胞的用途,其用于制备与双特异性t细胞活化抗原结合分子组合治疗疾病的药剂。
本发明的另一目的是提供一种试剂盒,其包括双特异性t细胞活化抗原结合分子及效应子记忆型γ9δ2t细胞。
本文提及的所有公开案、专利申请案、专利及其它参考案均以全文引用的方式并入本文中。
本文中所公开的本发明的优点及特征将根据以下描述、附图及权利要求书变得显而易见。此外,应理解,本文所述的各种实施例的特征并不相互排斥且可以各种组合及排列存在。
附图说明
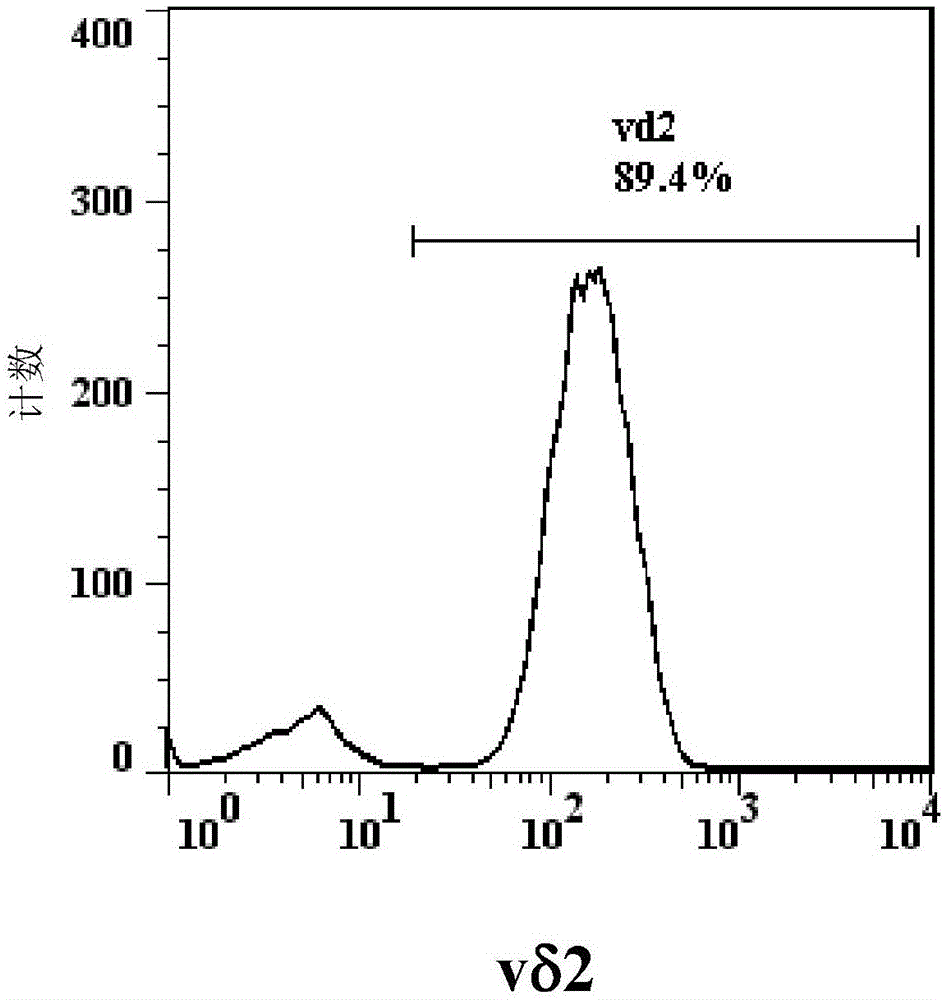
图1显示经分离且以介白素-2(il-2)和唑来膦酸刺激培养14天后δ2t细胞的比例。
图2a显示δ2细胞为一种t细胞;且图2b显示经纯化后γ9δ2细胞的比例可高达98%。
图3a显示经分离纯化的γ9δ2t细胞都是cd27(-)和cd45ra(-)的效应子记忆型γ9δ2t细胞;且图3b显示经分离纯化的γ9δ2t细胞不会表达pd-1。
图4a显示在γ9δ2t细胞或
图5a显示未经γ9δ2t细胞与
图6a显示val血癌细胞在模拟接受骨髓移植后患者发生早期复发的nog小鼠(未经pbmc移植)的存活曲线图;且图6b显示val血癌细胞在模拟接受骨髓移植后患者发生早期复发的nog小鼠(未经pbmc移植)的相对存活天数(p<0.01)。
图7a显示val血癌细胞在模拟没接受骨髓移植的患者发生早期复发的nog小鼠(经pbmc移植)的存活曲线图;且图7b显示val血癌细胞在模拟没接受骨髓移植的患者发生早期复发的nog小鼠(经pbmc移植)的相对存活天数(p<0.01)。
图8显示γ9δ2t细胞与
具体实施方式
通过参阅下列本发明的不同方面、实施例及表与其相关叙述的详细说明,可更清楚地了解本发明。除非特别定义,本文中所使用的所有用语(包含技术性及学术性用语)具有本发明所属技术领域的一般技术人员通常了解的相同意义。进一步应了解的是,例如通常使用的字典中所定义的用语应解释为与相关技艺的文章中有一致的意义,并且,除非本文中如此定义,将不会以理想化的或过度拘泥的观念加以解释。还应了解的是,本文中使用的术语仅是为了描述特定方面,并非用于限制本发明。
必须注意的是,除非上下文清楚地指出,否则,所述单数型式“一”、“一种”及“所述”包含复数对象物。因此,除非上下文认为有必要,否则,单数术语应包含复数对象物,且复数术语应包含单数对象物。
通常,本文中所述范围是以从“约”某特定数值及/或到“约”另一特定数值表示,当以这个范围表达时,所述方面包含从一特定数值及/或到另一特定数值的范围。类似地,当使用“约”字而将数值表达为近似值时,应了解,所述特定数值构成另一种方面。进一步应了解的是,各范围的端点显著地与另外的端点有关且又各自独立。本文中所述“约”字意指±20%,优选是±10%,及甚至更优选是±5%。
如本文中所用,除非另外指示,否则例如“含有(contain,containing)”、“包含(include,including)”及诸如此类的术语意指“包括”。
定义
如本文所用,术语“抗原结合分子”在其最广泛的意义上指特异性地结合抗原决定基的分子。抗原结合分子的实例为免疫球蛋白及其衍生物,例如全长或完整免疫球蛋白分子的结构及/或功能及/或是源自抗体或其片段的可变重链(vh)及/或可变轻链(vl)结构域的分子。因此,抗原结合分子能结合到其特异性标靶或抗原。抗原结合分子具有至少三个轻链cdr(即,vl区的cdr1、cdr2及cdr3)及/或三个重链cdr(即,vh区的cdr1、cdr2及cdr3)、优选所有6个cdr的存在。基于抗体的抗原结合分子包含例如单株、重组体、嵌合、人类化及人类抗体。
优选地,那些cdr包括于抗体轻链可变区(vl)及抗体重链可变区(vh)的框架中;然而,其不必同时包括所述两者。例如,fd片段具有两个vh区且通常保留完整抗原结合结构域的一定抗原结合功能。抗体片段、抗体变体或结合结构域的格式的其它实例包含(1)fab片段,其为具有vl、vh、cl及ch1结构域的单价片段;(2)f(ab')2片段,其为具有两个通过铰链区的二硫桥连接的fab片段的双价片段;(3)fd片段,其具有两个vh及ch1结构域;(4)fv片段,其为具有抗体单臂的vl及vh结构域,(5)dab片段,其具有vh结构域;(6)经分离互补决定区(cdr),及(7)单链fv(scfv)。
术语“双特异性”是指抗原结合分子能够特异性结合到至少两个不同抗原决定基。典型地,双特异性抗原结合分子包括两个抗原结合位点,其中的每一者特异性针对不同抗原决定基。在某些实施例中,双特异性抗原结合分子能够同时结合两个抗原决定基,详言之,两个不同细胞上所表达的两个抗原决定基。
如本文所用,术语“抗原结合部分”是指特异性结合抗原决定基的多肽分子。在一个实施例中,抗原结合部分能够使其所连接的物理(例如第二抗原结合部分)定向靶点,例如携带抗原决定基的特定类型肿瘤细胞或肿瘤基质。在另一个实施例中,抗原结合部分能够通过其标靶抗原(例如t细胞受体复合物抗原)活化信号传导。抗原结合部分包含抗体及其片段。特定抗原结合部分包含抗体的抗原结合域,包括抗体重链可变区及抗体轻链可变区。在某些实施例中,抗原结合部分可包括所属领域中已知的抗体恒定区。适用的重链恒定区包含五种同型中的任一者:α、δ、ε、γ或μ。适用的轻链恒定区包含两种同型中的任一者:κ及λ。
如本文所用,术语“抗原决定基”与“抗原”同义且是指多肽大分子上的位点(例如相连氨基酸区段或由非相连氨基酸的不同区域组成的构形配置),所述位点与抗原结合部分结合,从而形成抗原结合部分-抗原复合物。适用的抗原决定基可发现于例如肿瘤细胞表面上、病毒所感染细胞的表面上、其它病变细胞表面上、免疫细胞表面上、游离于血清中及/或细胞外基质中(ecm)。除非另外指明,否则本文中称为抗原的蛋白质(例如cd3)可为来自任何脊椎动物来源(包含哺乳动物,例如灵长类动物(例如人类)及啮齿动物(例如小鼠及大鼠))的蛋白质的任何原生形式。在一个特定实施例中,抗原为人类蛋白质。适用作抗原的示范性人类蛋白质为cd3,特别地,cd3的ε亚单元,或cd19,也称为b淋巴细胞抗原cd19或b淋巴细胞表面抗原b4。在某些实施例中,双特异性t细胞活化抗原结合分子结合到cd3及/或cd19的抗原决定基。
“特异性结合”意味着结合对于抗原而言具选择性且可与非所需或非特异性相互作用区分。抗原结合部分结合到特定抗原决定基的能力可通过酶联免疫吸附分析(elisa)或本领域技术人员熟悉的其它技术测量,例如表面等离子体共振(spr)技术及传统结合分析。在某些实施例中,结合到抗原的抗原结合部分或包括所述抗原结合部分的抗原结合分子具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8m或小于10-8m,例如10-8m到10-13m,例如10-9m到10-13m)的解离常数(kd)。
如本文所用,“活化t细胞抗原”是指t淋巴细胞(特别地,效应子记忆型γ9δ2t细胞)表面上所表达的抗原决定基,其与抗原结合分子相互作用时能够诱导t细胞活化。具体来说,抗原结合分子与活化t细胞抗原的相互作用可通过触发t细胞受体复合物的信号级联来诱导t细胞活化。在一个特定实施例中,活化t细胞抗原为cd3,特别地,cd3的ε亚单元。
如本文所用,“t细胞活化”是指t淋巴细胞(特别地,效应子记忆型γ9δ2t细胞)的一或多种细胞反应,选自:增殖、分化、细胞激素分泌、细胞毒性效应分子释放、细胞毒性活性及活化标记表达。在某些实施例中,双特异性t细胞活化抗原结合分子能够诱导t细胞活化。
如本文所用,“靶细胞抗原”是指靶细胞(例如肿瘤细胞,例如癌细胞或肿瘤基质细胞)表面上所呈递的抗原决定基。在一个特定实施例中,靶细胞抗原为cd19,特别地,人类cd19。
“γ9δ2t细胞”是天然存在于外周血液中的一种t细胞,其数量只占外周血液中所有t细胞的1-5%。γ9δ2t细胞它可通过辨识细胞表面的异戊烯基焦磷酸盐(isopentenylpyrophosphate(ipp))分子来区分正常与异常细胞。γ9δ2t细胞在辨识异常细胞时不需要人类白血球抗原(humanleukocyteantigen(hla)),因此它的使用与hla无关。这个特征就使得γ9δ2t细胞可使用于异体个体上而不会产生移植物抗宿主病(graftversushostdisease)。
如本文所用,“效应子记忆型γ9δ2t细胞”是指cd27(-)和cd45ra(-)的细胞。在一个特定实施例中,效应子记忆型γ9δ2t细胞不会表达编程死亡1(pd1或pd-1)免疫检查点分子(immunecheckpointmolecule)。
如本文所用的术语“并用投予”或其类似者意味着涵盖向单个患者投予所选治疗剂且打算包含以相同或不同投药途径或同时或不同时投予药剂的治疗方案。
药剂的“有效量”是指使其所投予的细胞或组织中产生生理学变化所必需的量。
药剂(例如医药组合物)的“治疗有效量”是指在必需的剂量及时间段情况下,有效实现所要治疗或预防结果的量。举例来说,治疗有效量的药剂消除、减少、延迟、最小化或预防疾病副作用。
术语“增强(enhance或enhancing)”意谓增加或延长所需作用的性能或持续时间。作为实例,“增强”治疗剂的作用是指在性能或持续时间方面增加或延长治疗剂在治疗疾病、病症或病况期间的作用的能力。如本文所用,“增强有效量”是指足以增强治疗剂治疗疾病、病症或病状的作用的量。当用于患者中时,这种用途的有效量将取决于疾病、病症或病状的严重程度及病程、先前疗法、患者的健康状况及对药物的反应以及治疗医师的判断。
“患者(patient)”或“个体(subject)”为哺乳动物。哺乳动物包含(但不限于)驯养动物(例如牛、绵羊、猫、狗及马)、灵长类动物(例如人类及非人类灵长类动物,例如猴)、兔及啮齿动物(例如小鼠及大鼠)。特别地,个体为人类。
术语“有需要个体”或“需要治疗”的那些包含已患有病症的那些以及其中欲预防病症的那些个体。
术语“医药组合物”是指所呈形式允许其中所含活性成分的生物活性有效发挥的制剂,且其不含对调配物将投予的个体具有不可接受毒性的其它组分。
“药学上可接受的载剂”是指医药组合物中的除活性成分之外的对个体无毒的成分。药学上可接受的载剂包含(但不限于)缓冲剂、赋形剂、稳定剂或防腐剂。
如本文所用,“治疗(treatment)”(及其语法变化形式,例如“治疗(treat)”或“治疗(treating)”)是指试图改变所治疗个体的疾病的自然过程的临床介入且可出于预防的或在临床病理学过程中进行。所需要治疗作用包含(但不限于)预防疾病发生或复发、缓解症状、减轻疾病的任何直接或间接病理性后果、预防转移、减缓疾病进展速率、改善或缓和疾病病况及缓解或改善预后。在一些实施例中,本发明的组合可用于延迟疾病发展或减缓疾病进展。
如本文所用,“癌症再发生”、“癌症复发”、“复发性或难治性疾病”在本文中可互换地用于指治疗后癌症的重现,且包含原发性器官中癌症的重现,以及远程复发,其中癌症在原发性器官的外部重现。
如本文中所用,术语“自体”及其语法等同物是指起源于同一者。举例来说,试样(例如,细胞、组织或器官)可被去除、处理并在稍后时间里返回到同一个体(例如,患者)。自体过程不同于其中供体及接受者为不同个体的同种异体过程。
如本文中所用,术语“异种”及其语法等同物是指起源于不同物种。举例来说,将试样(例如,细胞、组织或器官)从供体去除并处理后,再将所述试样移植到不同物种的接受者。
如本文中所用,术语“同种异体”及其语法等同物是指接受者与供体是相同物种但不同个体。举例来说,将试样(例如,细胞、组织或器官)从同一物种的供体去除并处理后,再将所述试样移植到相同物种但不同个体的接受者。
如本文中所用,短语“医药学上或药理学上可接受”是指在所用剂量及浓度下对于接受者而言一般无毒性的分子物理及组合物,即当投予动物(适当时例如人类)时,不产生有害、过敏或其它不良反应。
术语“药品说明书”用于指通常包含于治疗性产品的商业包装中的说明书,其含有关于与使用这类治疗性产品有关的适应症、用法、剂量、投药、组合疗法、禁忌症及/或警告的信息。
组合疗法及用途
本发明惊人地发现当将效应子记忆型γ9δ2t细胞与双特异性t细胞活化抗原结合分子并用投予病患时,可协同性地增进通过双特异性t细胞活化抗原结合分子所介导t细胞免疫疗法的疗效,因此本发明的实施方面之一为将有效量的双特异性t细胞活化抗原结合分子与有效量的效应子记忆型γ9δ2t细胞并用投予到需要治疗个体中的组合疗法,其可用于治疗所述需要治疗个体的例如癌症、传染性病及/或免疫病症等的疾病。在另一方面,本发明提供效应子记忆型γ9δ2t细胞在制造或制备药物中的用途,而所述药物是用于与双特异性t细胞活化抗原结合分子组合治疗疾病。
在一实施方面中,在施予双特异性t细胞活化抗原结合分子之前、之后或同时组合投予效应子记忆型γ9δ2t细胞。因此,双特异性t细胞活化抗原结合分子与效应子记忆型γ9δ2t细胞可同时、依序或间歇投予。在一实施方面中,效应子记忆型γ9δ2t细胞与双特异性t细胞活化抗原结合分子可作为单一活性成分或两种个别组合物同时投予,或作为两种个别组合物依序投予。
在一实施方面中,所述双特异性t细胞活化抗原结合分子包括:
(a)特异性结合到第一抗原的第一抗原结合部分,其中所述第一抗原为活化t细胞的cd3抗原;及
(b)特异性结合到第二抗原的第二抗原结合部分,其中所述第二抗原为选自由以下所组成的群组:肿瘤细胞新抗原、肿瘤新表位、肿瘤特异性抗原、肿瘤相关抗原、组织特异性抗原、细菌抗原、病毒抗原、酵母抗原、真菌抗原、原生动物抗原及寄生虫抗原。
在一优选实施方面中,所述第二抗原可包含,但不限定为cd19、cd20、cd22、cd31、cd32b、cd33、cd34、cd40、cd117、cd123、成纤维细胞活化蛋白质(fibroblast-activatingprotein;fap)、成纤维细胞生长因子受体1(fibroblastgrowthfactorreceptor1;fgfr1)、b细胞成熟抗原(b-cellmaturationantigen;bcma)、癌胚抗原(carcinoembryonicantigen;cea)、内皮生长因子受体(endothelialgrowthfactorreceptor)、糖蛋白a33抗原(glycoproteina33antigen;gpa33)、人类表皮生长因子受体1(humanepidermalgrowthfactorreceptor1;her1)、人类表皮生长因子受体2(her2/neu)、人类表皮生长因子受体3(her3)、人类表皮生长因子受体4(her4)、人类乳头瘤病毒(humanpapillomavirus;hpv)、粘蛋白1(mucin1;muc1)、前列腺特异性抗原(prostate-specificantigen;psa)、psma、brachyury、叶酸受体α、wt1、p53、mage-a1、mage-a2、mage-a3、mage-a4、mage-a6、mage-a10、mage-a12、bage、dam-6、dam-10、gage-1、gage-2、gage-8、gage-3、gage-4、gage-5、gage-6、gage-7b、na88-a、ny-eso-1、mart-1、mc1r、gp100、酪氨酸酶、trp-1、trp-2、art-4、camel、cyp-b、brca1、brachyury(tivs7-2,多型性)、brachyury(ivs7t/c多型性)、tbrachyury、t、htert、htrt、ice、muc1(vntr多型性)、muc1c、muc1n、muc2、prame、p15、ru1、ru2、sart-1、sart-2、sart-3、afp、β-连环蛋白/m、半胱天冬酶-8/m、cdk-4/m、elf2m、gnt-v、g250、hsp70-2m、hst-2、kiaa0205、mum-1、mum-2、mum-3、肌凝蛋白/m、rage、trp-2/int2、707-ap、膜联蛋白ii(annexinii)、cdc27/m、tpi/mbcr-abl、etv6/aml、ldlr/fut、pml/rarα及tel/aml1。所述双特异性t细胞活化抗原结合分子的实例阐述于例如以下文献中:wo00/006605a2、us7,635,472b2、wo2005/040220a1、wo2008/119567a2、wo2010/037838a2、wo2013/026837a1、wo2013/026833a1、us2014/0308285a1、wo2014/144722a2、wo2014/151910a1、wo2015/048272a1及sheridan,自然生物科技(naturebiotechnology),34:1215-1217(2016)。
在一实施方面中,效应子记忆型γ9δ2t细胞为cd27(-)和cd45ra(-)的细胞。在一特定实施方面中,所述效应子记忆型γ9δ2t细胞不会表达编程死亡1(pd1或pd-1)免疫检查点分子。在一些方面中,所述t细胞对于需要其的个体而言可为自体、同种异体或异种。在一优选实施方面中,所述t细胞对于需要其的个体而言是自体或同种异体的。
效应子记忆型γ9δ2t细胞可使用本领域技术人员已知的许多技术(例如ficolltm分离)从供体收集的血液中分离获得并离体扩增(kondo等人,细胞疗法(cytotherapy),10,842–56(2008))。
在一实施方面中,本发明的方法可用于治疗的疾病包含,但不限定为增殖性疾病(如癌症)、感染性疾病(例如细菌感染、病毒感染、酵母菌感染、真菌感染、原生动物感染及寄生虫感染)、或免疫病症(例如自体免疫疾病、过敏性及免疫缺陷)。在一些方面中,疾病为癌症。在其它方面中,癌症为实体肿瘤。在其它方面中,癌症为液体肿瘤。在一些方面中,癌症为b细胞癌症。在一些方面中,b细胞癌症为b细胞淋巴瘤或b细胞白血病。在一些方面中,b细胞癌症为非霍奇金淋巴瘤(non-hodgkinlymphoma)或急性淋巴母细胞白血病或慢性淋巴细胞性白血病。在一些方面中,急性淋巴母细胞白血病为复发性急性淋巴球性白血病。
如果必要,本发明的方法中还可包括抑制免疫系统的免疫抑制疗法。免疫抑制疗法可帮助缓解、最小化或消除接受者中的移植排斥。举例来说,免疫抑制疗法可包括免疫抑制药物。在投予效应子记忆型γ9δ2t细胞之前、期间及/或之后可使用的免疫抑制药物包含(但不限于)mmf(霉酚酸酯(mycophenolatemofetil)(山喜多(cellcept)))、atg(抗胸腺细胞球蛋白)、抗cd154(cd4ol)、抗cd40(2c10、askp1240、ccfz533x2201)、阿伦单抗(alemtuzumab)(坎帕斯(campath))、抗cd20(利妥昔单抗(rituximab))、抗il-6r抗体(托珠单抗(tocilizumab)、安挺乐(actemra))、抗il-6抗体(萨瑞鲁单抗(sarilumab)、奥洛珠单抗(olokizumab))、ctla4-ig(阿巴西普(abatacept)/orencia(奥瑞希纳))、贝拉西普(belatacept)(lea29y)、西罗莫司(sirolimus)(雷帕鸣(rapimune))、依维莫司(everolimus)、他克莫司(tacrolimus)(普乐可复(prograf))、达克珠单抗(daclizumab)(赛尼哌(ze-napax))、巴利昔单抗(basiliximab)(舒莱(simulect))、英利昔单抗(infliximab)(类克(remicade))、环孢素、去氧精胍菌素、可溶性补体受体1、眼镜蛇毒因子(cobravenomfactor、compstatin)、抗c5抗体(依库珠单抗(eculizumab)/索拉瑞斯(soliris))、甲基普赖苏浓(methylprednisolone)、fty720、依维莫司、来氟米特(leflunomide)、抗il-2r-ab、雷帕霉素、抗cxcr3抗体、抗icos抗体、抗ox40抗体及抗cd122抗体。此外,一种或多于一种免疫抑制药剂/药物可一起或依序使用。
组合
本发明进一步提供一种包括治疗有效量的双特异性t细胞活化抗原结合分子及治疗有效量的效应子记忆型γ9δ2t细胞的组合,其中所述双特异性t细胞活化抗原结合分子可在投予效应子记忆型γ9δ2t细胞之前、或与其同时或在其之后投予个体。
在一个实施例中,双特异性t细胞活化抗原结合分子及效应子记忆型γ9δ2t细胞可同时或分别溶解或分散于一或多种药学上可接受的载剂中。药学上可接受的载剂可包含任何及所有溶剂、缓冲剂、分散剂、表面活性剂、抗氧化剂、防腐剂(例如抗细菌剂、抗真菌剂)、等张剂、盐类稳定剂、聚合物、凝胶、粘合剂、崩解剂、润滑剂、调味剂及类似材料及其组合。在一些实施方面中,双特异性t细胞活化抗原结合分子及效应子记忆型γ9δ2t细胞是同时、依序或间隔投予。
在一些实施方面中,双特异性t细胞活化抗原结合分子及效应子记忆型γ9δ2t细胞可依如下所示的方式投予:静脉内、动脉内、皮下、腹膜内、病灶内、颅内、髓内、关节内、前列腺内、脾内、肾内、胸膜内、气管内、鼻内、玻璃体内、阴道内、直肠内、瘤内、肌内、结膜下、囊泡内、粘膜、心包内、脐内、眼内、经口、表面、局部、吸入(例如气溶胶吸入)、注射、输注、连续输注、局部灌注沐浴靶细胞(直接、通过导管、通过灌洗法)、于乳膏中、于脂质组合物(例如脂质体)中、于微胶囊中或通过一般技术者已知的其它方法的任何组合。在一些实施方面中,双特异性t细胞活化抗原结合分子及效应子记忆型γ9δ2t细胞通过非经肠的方式,如同时、依序或间隔注射(例如皮下、皮内、病灶内、静脉内、动脉内、肌肉内、鞘内或腹膜内注射)投予。本文中所涵盖的各种给药时程,包含(但不限于)单次投药或在不同时间点的多次投药、快速投药及脉冲式输注。
治疗疾病时,双特异性t细胞活化抗原结合分子及效应子记忆型γ9δ2t细胞的适当剂量将视以下而定:所治疗的疾病类型、投药途径、患者体重、双特异性t细胞活化抗原结合分子类型、疾病的严重程度及病程、先前或并行治疗介入、患者临床病史及主治医师判断。负责投药的从业者将在任何情况下确定组合物中活性成分的浓度及适用于单独个体的剂量。以双特异性t细胞活化抗原结合分子而言,常见的患者注射投药剂量范围为每天约0.1mg/kg到50mg/kg,优选为每天约0.5mg/kg到1mg/kg;而一般来说,对效应子记忆型γ9δ2t细胞的投药剂量范围为约1×104个与约1×1011个t细胞,优选为约1×106个与约1×109个之间的t细胞。
试剂盒
在本发明的另一方面中,提供一种含有适用于治疗前述疾病的物质的试剂盒。试剂盒包括容器及容器上或与容器相关联的药品说明书。适合的容器包含(例如)瓶子、小瓶、注射器、iv溶液袋等。容器可由多种材料(例如玻璃或塑料)形成。容器装有单独或与有效治疗疾病的另一组合物组合的组合物,且可具有无菌接取口(例如容器可为具有可由皮下注射针刺穿的塞子的静脉内溶液袋或小瓶)。组合物中的至少一种活性剂为双特异性t细胞活化抗原结合分子或效应子记忆型γ9δ2t细胞。说明书或药品说明书指示所述组合物用于治疗所选疾病。此外,试剂盒可包括(a)含有第一组合物的第一容器,其中所述第一组合物包括双特异性t细胞活化抗原结合分子;及(b)含有第二组合物的第二容器,其中所述第二组合物包括效应子记忆型γ9δ2t细胞。本发明的试剂盒可进一步包括指示组合物可用于治疗特定疾病的药品说明书。或者或另外,试剂盒可进一步包括第三容器,其包括免疫抑制药物。其可进一步包含就商业及用户观点而言所需的其它物质,包含其它缓冲剂、稀释剂、过滤器、针及注射器。
实例
通过参考以下实验实例进一步详细阐述本发明。除非另有说明,否则所述实例仅出于说明目的而提供,且并不打算具有限制性。因此,本发明决不应理解为限制以下实例,而应理解为涵盖因本文所提供的教示而变得明了的任何及所有变化形式。
实例1
γ9δ2t细胞的分离及鉴定
依据本发明的目标,首先须培养出具毒杀血癌细胞能力的效应子记忆型γ9δ2t细胞。γ9δ2t细胞可同时使用抗cd3抗体、抗γ9抗体与抗δ2抗体以流式细胞仪来做鉴定。而效应子记忆型γ9δ2t细胞的特征的一是细胞表面不具有cd27和cd45ra分子。
依据kondo等人,细胞疗法(cytotherapy),10,842–56(2008)发表的文献,将外周血液单核细胞以介白素-2(il-2,1000u/ml)和唑来膦酸(zoledronicacid)(1μm/ml)刺激培养14天后,利用抗δ2抗体以流式细胞仪分析培养细胞中δ2细胞的比例。接着以miltenyibiotec公司的试剂组(tcrγ/δ+tcellisolationkit/human)将δ2细胞纯化,纯化后的细胞以抗cd3抗体、抗γ9抗体与抗δ2抗体进行流式细胞仪分析以分析γ9δ2t细胞的比例,并以抗cd27抗体、抗cd45ra抗体和抗pd-1抗体同时分析γ9δ2t细胞上cd27、cd45ra、和pd-1分子的表达情形。
结果如图1所示,经以il-2和唑来膦酸刺激培养14天后的细胞中有大于85%的细胞是δ2细胞。经以miltenyibiotec公司的试剂组纯化后,发现这些δ2细胞均会表达cd3分子,所以是一种t细胞,且γ9δ2t细胞比例可高达98%(图2a及2b)。图3a显示这些γ9δ2t细胞都是cd27(-)和cd45ra(-)细胞,所以是效应子记忆型γ9δ2t细胞(effectormemoryγ9δ2tcells)。图3b显示这些γ9δ2t细胞不表达pd-1免疫检查点分子(immunecheckpointmolecule)。
实例2
γ9δ2t细胞与
本实验参考sheehy等人(免疫法杂志(jimmunolmethods),249,99–110(2001))所公开的方法来进行。
本实验中使用会表达cd19分子的raji、val及daudi血癌细胞作为标靶细胞,其中raji和daudi细胞系是cd19+勃奇氏淋巴瘤(burkettlymphoma)细胞,且val细胞系是cd19+all细胞。rpmi-8226细胞系则是cd19-多发性骨髓瘤(multiplemyeloma)细胞。
将raji、rpmi-8226、val及daudi血癌细胞系分别以5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(5-(and-6)-carboxyfluoresceindiacetatesuccinimidylester(cfse))染剂进行染色,染色后接种于培养平盘的各穴中(5×104个/穴)。再将获自实例1的γ9δ2t细胞(1×106个/穴)及
图4a的结果证明实例1的γ9δ2t细胞不仅本身就具有毒杀各种血癌细胞的能力,且在其与
γ9δ2t细胞与bcma-bite毒杀血癌细胞活性的体外测试
本实验参考sheehy等人(免疫法杂志(jimmunolmethods),249,99–110(2001))所公开的方法来进行。bcma-bite的製備是依據wo2013/072415a1專利。
本实验中使用会表达bcma分子的rpmi-8226血癌细胞作为标靶细胞。rpmi-8226细胞系是多发性骨髓瘤(multiplemyeloma)细胞。
将raji(bcma-)及rpmi-8226血癌细胞系分别以5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(5(6)-carboxyfluoresceindiacetatesuccinimidylester(cfse))染剂进行染色,染色后接种于培养平盘的各穴中(5×104个/穴)。再将获自实例1的γ9δ2t细胞(1×106个/穴)及bcma-bite(15μl/穴)各自独立地或共同地加入含有不同细胞的各穴中,并经6小时培养后以流式细胞仪分析cfse+的细胞以分析存活状况。
图4b的结果证明实例1的γ9δ2t细胞不仅本身就具有毒杀各种血癌细胞的能力,且在其与bcma-bite组合使用下,所述组合相较于γ9δ2t细胞或bcma-bite的单独使用,可协成性地大幅增加毒杀rpmi-8226血癌细胞系的效果。
实例3
γ9δ2t细胞与
本实验在体内没有t细胞的免疫不全nog小鼠中进行测试(参考hipp等人,白血病(leukemia),31,1-9(2017)及monjezi等人,白血病(leukemia),30,1-9(2016))。
首先使用慢病毒载体(lentiviralvector)将荧光素酶(luciferase)和绿色荧光蛋白(greenfluorescentprotein)的基因转植入val血癌细胞(acc-586)(zhou等人,血液(blood),120,4334-4342(2012))。将会表达荧光素酶和绿色荧光蛋白的val血癌细胞(5×105个)以尾部静脉注射植入nog小鼠体内。
在植入val血癌细胞后的第4天,将获自实例1的γ9δ2t细胞以尾部静脉注射的方式植入nog小鼠体内,使用的细胞数量是val细胞的20倍,每隔1天植入1次,一共植入7次;且在植入val血癌细胞后的第5天,将
实例4
γ9δ2t细胞与
在本实验中,使用体内没有t细胞的免疫不全nog小鼠来模拟接受骨髓移植后的患者发生早期复发的状况(体内t细胞数量很少或缺少功能性t细胞(如,记忆型t细胞))。
本实验中另将含有记忆型t细胞的外周血液单核细胞(peripheralbloodmononuclearcells(pbmc))植入nog小鼠来模拟没接受骨髓移植的患者发生复发的状况(体内含有记忆型t细胞)。
根据实例3所述的方法将表达荧光素酶和绿色荧光蛋白的val血癌细胞(5×105个)以静脉注射植入两组nog小鼠体内。根据实例3所述的治疗方法来进行无pbmc移植的nog小鼠的治疗。而有pbmc移植的nog小鼠是在植入val血癌细胞后的第4天,将获自外周血液的pbmc以尾部静脉注射的方式植入nog小鼠体内,使用的pbmc细胞是有经三种all化学治疗药物(cyclophosphamide、vincristine和doxorubicinhydrochloride)处理3天且其使用数量是val细胞的20倍,每隔3天植入1次。这些有pbmc移植的nog小鼠的γ9δ2t细胞及
图6a及6b提供val血癌细胞在模拟接受骨髓移植后患者发生早期复发的nog小鼠(未经pbmc移植)的存活曲线图及相对存活天数(p<0.01)的结果。所述结果显示,经γ9δ2t细胞或
由图7a及7b显示val血癌细胞在模拟没接受骨髓移植的患者发生早期复发的nog小鼠(经pbmc移植)的存活曲线图及相对存活天数(p<0.001)。所述结果显示,有pbmc移植的nog小鼠经γ9δ2t细胞单独处理后,小鼠的存活天数可较未处理的小鼠平均多活1.5天;而经
实例5
γ9δ2t细胞与
在本实验中,将具有荧光素酶和绿色荧光蛋白双基因的val血癌细胞(5×105个)以尾部静脉注射植入nog小鼠体内,在第7天开始依据实例3所述的方法将γ9δ2t细胞及
结果如图8所示。γ9δ2t细胞与
- 还没有人留言评论。精彩留言会获得点赞!